Результат интеллектуальной деятельности: Способ получения рекомбинантного антимикробного пептида UBI18-35, рекомбинантная плазмидная ДНК pET31b-2хUBI18-35 и штамм-продуцент Escherichia coli BL21 Rosetta DE3 pLysS/ pET31b-2хUBI18-35 антимикробного пептида UBI18-35
Вид РИД
Изобретение
Изобретение относится к биотехнологии, генетической и белковой инженерии, конкретно - к получению рекомбинантного антимикробного пептида UBI18-35, способного проникать в мембрану микробных клеток, накапливаться в очаге гнойного воспаления и предназначенного для дифференциальной диагностики бактериального воспаления. Для получения рекомбинантного антимикробного пептида UBI18-35 конструируют рекомбинантную плазмидную ДНК рЕТ31b-2xUBI18-35 размером 5858 п.н., кодирующую рекомбинантный пептид UBI18-35. В состав плазмидной ДНК также входит промотор транскрипции Т7 РНК-полимеразы, участок связывания рибосомы; фрагмент ДНК плазмиды ген β-лактамазы, детерминирующий устойчивость клеток Escherichia coli к ампициллину, в качестве генетического маркера, ген кетостероидизомеразы. Полученной плазмидной ДНК трансформируют клетки штамма Escherichia coli BL21 Rosetta DE3 pLysS с получением штамма-продуцента рекомбинантного антимикробного пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой. Для получения рекомбинантного пептида UBI18-35 проводят культивирование штамма-продуцента, клетки разрушают, выделяют тельца включения, тельца включения солюбилизируют в буфере, содержащем мочевину, белок слияния выделяют методом металл-аффинной хроматографии, проводят отделение рекомбинантного пептида от кетостероидизомеразы и шести гистидиновых остатков с использованием бромциана, и очищают рекомбинантный пептид методом гельфильтрационной хроматографии.
Получение векторных молекул с целью создания систем для диагностики и адресной терапии социально-значимых заболеваний крайне востребовано в современной биомедицине. В настоящее время пептиды (молекулы белковой природы размером от 3 до 50 а.к.о.) широко используются в диагностических целях. Они обеспечивают высокоспецифичное связывание с клетками-мишенями, но имеют меньшие размеры по сравнению с белками и низкую иммуногенность. Таким образом, пептиды являются перспективными объектами современной молекулярной медицины [Shadidi, М., 2003. Identification of novel carrier peptides for the specific delivery of therapeutics into cancer cells. FASEB J. 17, 256-258, Патент WO 9851794 (A1), 19.11.1998].
Антимикробные пептиды (АМП) были обнаружены в различных организмах; существуют многочисленные примеры АМП, найденных в бактериях (низин, педиоцин РА-1 и писциколин 126), растениях (дефензин и снакин-1) и в животных (магаинин, дефензин и протегрин). АМП также обнаружены в одноклеточных организмах и грибах [Ingham, А.В., 2007. Recombinant production of antimicrobial peptides in heterologous microbial systems. Biotechnol Appl Biochem. 47, 1-9].
Существуют две основные генетические группы антимикробных пептидов млекопитающих: кателицидины и дефензины [Selsted, М.Е., 2005. Mammalian defensins in the antimicrobial immune response. Nat Immunol. 6(6), 551-7]. Все они вырабатываются и функционируют как часть иммунной защиты организма.
Ключевым преимуществом антимикробных пептидов является высокая специфичность и способность связываться только с живыми бактериями [Akhtar, М.S., 2008. An imaging analysis of (99m)Tc-UBI (29-41) uptake in S. aureus infected thighs of rabbits on ciprofloxacin treatment. Eur J Nucl Med Mol Imaging 35, 1056-1064]. Благодаря способности пептидов встраиваться в мембрану микробной клетки, достигается высокоселективное накопление пептидов в очаге гнойного воспаления, тогда как накопления в стерильном воспалении не происходит [Amblard, M., 2006. Methods and protocols of modern solid phase Peptide synthesis. Molecular biotechnology 33, 239-254].
Первый антимикробный пептид убиквицидин (UBI), относящийся к классу дефензинов, был выделен из макрофагов мыши, позже идентичный пептид был обнаружен в эпителиальных клетках дыхательных путей человека. Меченные 99mTc производные (фрагменты) антимикробного пептида убиквицидина, в частности, UBI29-41, на первой стадии клинических испытаний продемонстрировал 100% общей чувствительности, 80 % специфичности и 94,4% точности среди пациентов с инфекциями мягких тканей и остеомиелитом, при этом оптимальное время формирования изображения составило 30 минут после внутривенного введения радиофармпрепарата [Akhtar, M.S., 2005. Antimicrobial Peptide 99mTc-Ubiquicidin 29-41 as Human Infection-Imaging Agent: Clinical Trial. J. Nucl. Med. 46 (4), 567-573]. Исследование специфичности детектирования стерильного воспаления и бактериальной инфекции с использованием 99mTc-меченных синтетических антимикробных производных убиквицидина (UBI 29–41, 18–35, 31–38), синтетического hLf 1–11, нейтрофильных пептидов человека (дефензинов), по сравнению с применением 99mTc-ципрофлоксацина (Infecton©), показало эффективное аккумулирование антимикробных пептидов в очаге инфекции, что указывает на преимущественное связывание этих пептидов не с активированными лейкоцитами, а с живыми микроорганизмами. При этом 99mTc-ципрофлоксацин аккумулировался как в очагах стерильного воспаления, так и бактериальной инфекции [Welling, M., 2001. 99mTc-labeled antimicrobial peptides for detection of bacterial and Candida albicans infections. J. Nucl. Med. 42, 788-794].
Группа пептидов, полученных из убиквицидина, представляет большой интерес не только для дифференциальной диагностики микробного воспаления, но также для мониторинга эффективности антимикробной терапии. Показана эффективность использования радиоактивно меченых пептидов - производных UBI, у пациентов с остеомиелитом, септическим артритом, бациллемией, медиастинитом после операции на сердце, инфекцией суставов после протезирования, вызванных различными видами патогенных микроорганизмов [Sasser, T.A., 2013. Bacterial infection probes and imaging strategies in clinical nuclear medicine and preclinical molecular imaging. Curr Top Med Chem. 13, 479-487].
Наиболее перспективными пептидами производными убиквицидина считаются фрагменты UBI29-41 и UBI18-35, которые позволяют эффективно визуализировать очаг инфекции при отсутствии неспецифического накопления [Welling, M., 2001. 99mTc-labeled antimicrobial peptides for detection of bacterial and Candida albicans infections. J. Nucl. Med. 42, 788-794]. Пептид UBI18-35 демонстрирует более высокую селективность связывания с микробными клетками Staphylococcus aureus и Candida albicans в очаге воспаления, поэтому его применение по сравнению с UBI29-41 является более перспективным. Но, несмотря на это, пептид UBI18-35 применяется реже, что обусловлено большей сложностью и стоимостью твердофазного синтеза пептида длинной 18 а.к.о. по сравнению с UBI29-41, имеющим длину 12 а.к.о. [Welling, M. M., 2000. Technetium-99m labelled antimicrobial peptides discriminate between bacterial infections and sterile inflammations. Eur J Nucl Med. 27, 292-301]. Антимикробные пептиды могут быть выделены из природных источников (Патент WO2017176041 (A1), 12.10.2017; патент WO9851794 (A1), 19.11.1998). Наиболее широко для получения пептидов используется метод химического синтеза (Патент RU 2624020 , 20.03.2016).
Пептид убиквицидин может быть получен методом твердофазного синтеза или с использованием трансгенных животных (Патент WO 1998054314 A1 Antimicrobial peptides derived from ubiquicidine 3.12.1998).
Процесс трансгенеза животных включает выделение зародышевых клеток (зиготы, эмбриональных стволовых клеток, клеток раннего эмбриона), перенос в них чужеродного фрагмента ДНК одним из стандартных способов (эндоцитоз, электропорация, микроинъекция, бомбардировка микрочастицами, нагруженными рекомбинантной ДНК, инфецирование рекомбинантными вирусами). Далее генетически модифицированные зародышевые клетки животного переносят в матку приемной матери для получения трансгенного организма. Далее пептид или его фрагменты выделяют из тканей или биологических жидкостей организма, например молока. К недостатку метода можно отнести высокую трудоемкость, длительность, высокую стоимость процедуры трансгенеза с последующим отбор (скрининг) трансгенных организмов, а также сравнительно низкие выходы пептида [Maksimenko O.G., 2013. Use of Transgenic Animals in Biotechnology: Prospects and Problems Acta Naturae, 5(1), 33-46].
Для получения синтетического пептида наиболее широко в настоящее время используется твердофазный синтез. Твердофазный синтез начинается со связывания карбоксильной группы защищенной аминокислоты пептида с соответствующей смолой, обычно через сложноэфирную или амидную связь. Проводят защиту групп боковых цепей аминокислот с помощью различных химических реагентов. Далее следуют повторяющиеся циклы наращивания аминокислотной последовательности, включающие: деблокирование аминогруппы промежуточно-образующейся N-терминально защищенной пептидной смолы, активация карбоксильной группы следующей за ней NH2-защищенной аминокислоты, сочетание аминокислот с формированием пептидной связи. В качестве сочетающего реагента применяют различные используемые в синтезе пептидов активирующие реагенты, например, карбодиимиды. Активированное аминокислотное производное обычно используется в 1,5-4-х кратном избытке. В случаях если происходит неполное сочетание, реакцию повторяют. После получения полноразмерной последовательности пептида проводят финальное деблокирование, снятие защиты с боковых групп аминокислот и отщепление готового пептида от смолы, например, с помощью трифторуксусной кислоты. Пептидный синтез широко используется для структурно-функциональных исследований, для получения аналогов биологически активных пептидов, в том числе циклических производных с заданными свойствами (например, с пролонгированным, усиленным или избирательным действием), а также аналогов с остатками небелковых аминокислот, для изучения антигенных свойств фрагментов белков и получения специфичных к отдельным участкам полипептидных цепей антител, используемых в структурно-функциональном анализе и в создании диагностических систем и вакцин [Овчинников, Ю.А., 1987. Биоорганическая химия. Просвещение. Москва]. Однако, получение необходимого количества пептида, особенно гидрофобного и/или с длинной последовательности более 15 а.к.о. методом твердофазного синтеза имеет ряд ограничений [Amblard, M., 2006. Methods and protocols of modern solid phase Peptide synthesis. Mol Biotechnol. 33, 239-254; Guzmán, F.S., 2007. Peptide synthesis: chemical or enzymatic. Electronic Journal of Biotechnology. 10, 279-314], а именно: возникновение ошибочных последовательностей, пропуск аминокислот из-за неполноты протекания стадий деблокирования и аминообразования; самоассоциация пептидных цепей за счет формирования водородных связей, вызывающая экранирование N-концевой аминогруппы; а также высокая стоимость синтеза. Дополнительным негативным фактором химического синтеза является применение в работе токсичных растворителей и реагентов. Таким образом, получение антимикробных пептидов в достаточных количествах для клинического применения методом твердофазного синтеза является высоко затратным.
Для масштабирования процесса наработки пептида с целью создания диагностических систем выгодной альтернативой является микробный синтез с использованием технологии рекомбинантных ДНК.
Экспрессия гетерологичных белков в бактериальной системе в настоящее время представляется наиболее простым и недорогим способом получения больших количеств белка. Однако при экспрессии антимикробных пептидов возникают некоторые трудности, связанные с риском протеолитической деградации пептида и его токсичностью по отношению к клетке-хозяину [Zorko, M., 2010. Production of Recombinant Antimicrobial Peptides in Bacteria // Antimicrobial Peptides. Methods in Molecular Biology. 618, 61-76]. Для преодоления этих проблем экспрессия АМП осуществляется в составе с белками-партнерами. Таким образом, за последнее десятилетие рекомбинантным путем был получен ряд АМП с различными белками-партнерами, например, морицин (moricin), который экспрессировали в составе белка-слияния с мальтозо-связывающим белком [Hara, S., 1996. Production in Escherichia coli of moricin, a novel type antibacterial peptide from the silkworm. Bombyx mori. Biochem. Biophys. Res. Commun . 220, 664-669], цекропин X (cecropin X), экспрессированный совместно с фактором некроза опухоли (TNFα) [Shen, Y., 2007. High-level expression of cecropin X in Escherichia coli. Int. J. Mol. Sci. 8, 478-491], человеческий β-дефензин 2 (human beta-defensin 2) в составе тиоредоксина (Trx) [Xu, Z.N., 2006. High-level expression of a soluble functional antimicrobial peptide, human beta-defensin 2, in Escherichia coli. Biotechnol. Progress. 22, 382-386], лактоферрицин, в составе белка-слияния с анионным пептидом [Kim, H. K., 2006. Expression of the cationic antimicrobial peptide lactoferricin fused with the anionic peptide in Escherichia coli. Appl. Microbiol. Biotechnol. 72, 330-338] и пр.
Поскольку антимикробный пептид UBI18-35 проявляет токсичность в отношении клеток E. coli, была выбрана стратегия экспрессии UBI18-35, в составе белка-слияния с кетостероидизомеразой (KSI).
Аминокислотная последовательность фермента KSI была заимствована из бактерии Pseudomonas testosteroni и в дальнейшем модифицирована - пять остатков аспарагиновой кислоты были заменены остатками глутаминовой кислоты - это обеспечило устойчивость белка к кислотному гидролизу, при этом не лишая его способности эффективно индуцировать образование телец включения [Патент US 7829311 B2; 14.07.2008]. Благодаря этому свойству получен ряд различных пептидов в составе белка слияния с KSI, в том числе противоопухолевые пептиды p53pAnt и PNC27 [Rodríguez, V., 2014. Design and implementation of a high yield production system for recombinant expression of peptides. Microb. Cell Fact. 13:65, 1-10], трансмембранный домен нейротрофин рецептора р75 [Li, Q., 2012. Expression and purification of the p75 neurotrophin receptor transmembrane domain using a ketosteroid isomerase tag. Microb. Cell Fact. 11:45, 1-8], пептидные рецепторы аденозина [Britton, Z.T., 2012. An expression and purification system for the biosynthesis of adenosine receptor peptides for biophysical and structural characterization. Protein Expr. Purif. 84(2), 224-35].
За счет гетерогенной экспрессии в составе единого белка с кетостероидизомеразой (KSI) получены два антимикробных пептида: дермцидин (dermcidin) [Cipakova, I., 2006. Expression and purification of human antimicrobial peptide, dermcidin, in Escherichia coli. Protein Expr. Purif. 45, 269-274] и лактоферрицин [Park T-J., 2009. Cloning, expression, isotope labeling, purification, and characterization of bovine antimicrobial peptide, lactophoricin in Escherichia coli // Protein Expr. Purif. 65(1), 23-29].
Известен плазмидный вектор pET31b+, который содержит ген KSI. С использованием вектора pET31b+ получены рекомбинантный пептид rP11-4 (QQRFEWEFEQQ), предназначенный для использования в тканевой инженерии [Riley, J.M., 2009. Bioproduction and characterization of a pH responsive self-assembling peptide. Biotechnol Bioeng. 103, 241-251], и четыре пептида - антагониста αvβ6 интегрина: A20fmdv2 (NAVPNLRGDLQVLAQKVART), A20lap2 (GFTTGRRGDLATIHGLNRPF), DBD1 (EKCPNLRGDLQVLAQKVCRT), TGFb3 (NEDDHQRGDLGRLKKQKDHH), предназначенные для диагностики и целевой доставки к опухолям поджелудочной железы и толстой кишки [Wagstaff, J.L., 2010. Production of recombinant isotopically labelled peptide by fusion to an insoluble partner protein: generation of integrin αvβ6 binding peptides for NMR. Mol Biosyst. 6, 2380-2385].
Технической задачей настоящего изобретения является получение рекомбинантного векторного антимикробного пептида UBI18-35, способного встраиваться в мембрану микробных клеток, предназначенного для дифференциальной диагностики бактериального воспаления. В Российской Федерации и за рубежом рекомбинантные аналоги векторного антимикробного пептида UBI18-35, способного встраиваться в мембрану микробных клеток, а также способы получения пептида UBI18-35 с использованием технологии рекомбинантных ДНК и микробных штаммов-продуцентов, отсутствуют. Применение данного способа синтеза является более приемлемым и экономически выгодным для получения векторного антимикробного пептида UBI18-35 в препаративных количествах.
Поставленная техническая задача достигается конструированием плазмиды pET31b- 2xUBI18-35 путем встраивания в плазмидный вектор pET31b+ фрагмента ДНК, кодирующего две молекулы рекомбинантного антимикробного пептида UBI18-35 разделенного последовательностью, кодирующей метионин, получением штамма-продуцента, за счет трансформации полученной плазмидой клеток Escherichia coli BL21 Rosetta DE3 pLysS, обеспечивающего синтез двух молекул рекомбинантного антимикробного пептида UBI18-35 разделенных остатком метионина в составе белка-слияния с кетостероидизомеразой (KSI) и остатком из шести гистидинов, выделением белка-слияния методом аффинной хроматографии, последующего разделения пептидов между собой, от белка-слияния и остатков из 6 гистидинов с использованием бромциана, очистки пептида UBI18-35 методом гельфильтрационной хроматографии.
Сущность изобретения заключается в следующем.
Генно-инженерными методами [Маниатис, Т.Э., 1984. Молекулярное клонирование. Мир. Москва] получают плазмиду pET31b-2xUBI18-35, содержащую последовательность, кодирующую две молекулы рекомбинантного антимикробного пептида UBI18-35, полученную методом отжига двух синтетических олигонуклеотидных последовательностей c последующей амплификацией методом полимеразной цепной реакции (ПЦР).
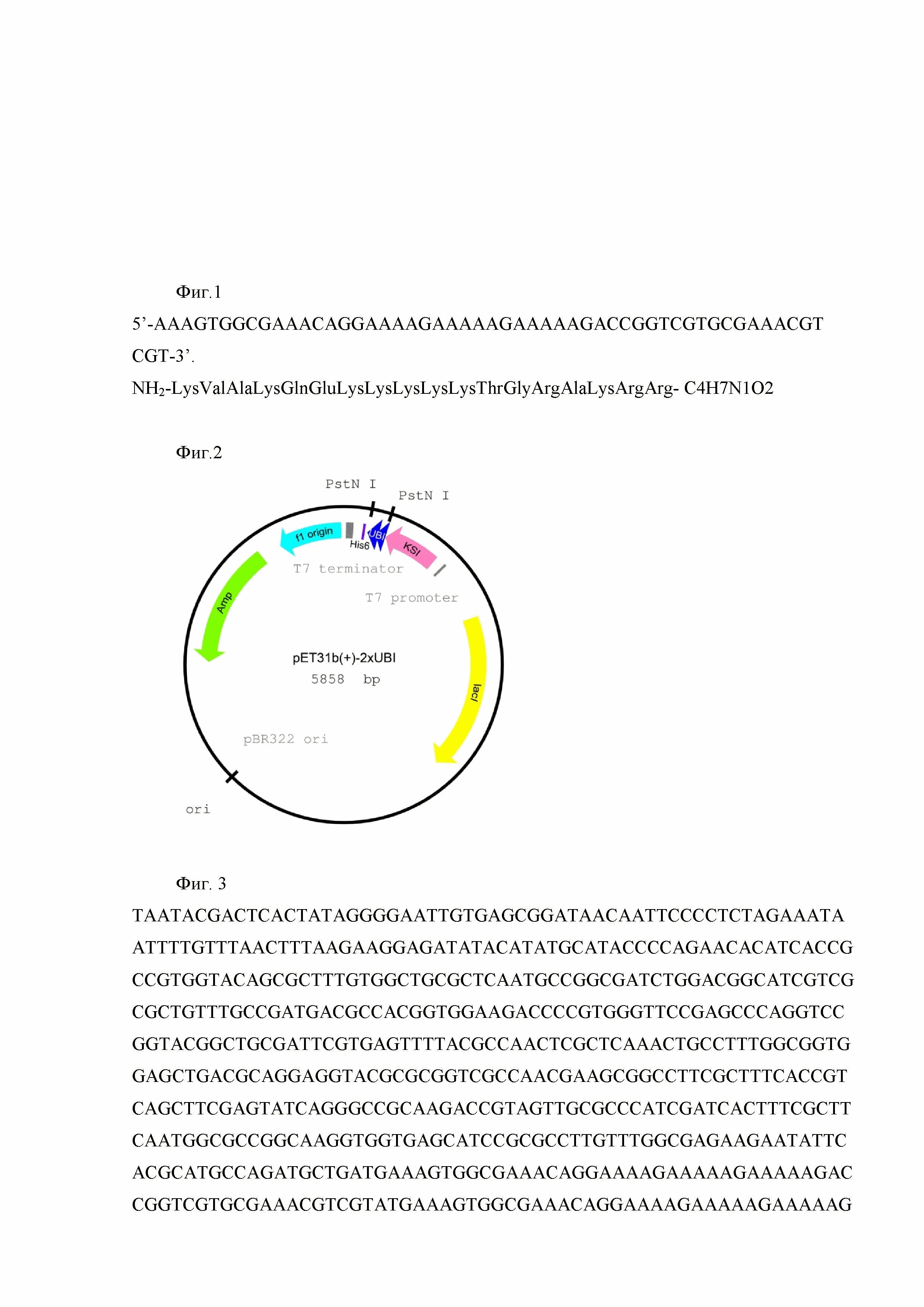
Клетки E.coli BL21 Rosetta DE3 pLysS, содержащие ген РНК-полимеразы фага Т7 под индуцибельным lacUV5 промотором, трансформируют сконструированной плазмидой pET31b-2xUBI18-35 и выращивают в течение ночи. Ночную культуру (1/100) засевают в свежую среду LB с добавлением ампициллина (50 мкг/мл). Синтез РНК-полимеразы индуцируют добавлением изопропилтиогалактазида (ИПТГ) в концентрации 0,1-0,5 мМ в тот момент, когда культура достигает среднелогарифмической фазы роста. Индуцированные клетки растят 4 часа при 28°С, после чего собирают центрифугированием при 5000 g. Индуцированные клетки E.coli BL21 Rosetta DE3 pLysS / pET31b-2xUBI18-35 используют для очистки антимикробного пептида UBI18-35, экспрессированного в составе белка слияния с кетостероидизомеразой и остатком из шести гистидинов. Для получения антимикробного пептида UBI18-35 выделенный химерный белок обрабатывают бромцианом. В результате получают 2 молекулы рекомбинантного антимикробного пептида UBI18-35, имеющего следующую аминокислотную последовательность: NH2-KVAKQEKKKKKTGRAKRR-C4H7N1O2 и молекулярную массу 2,252 кДа, кодируемого нуклеотидной последовательностью 5'- AAAGTGGCGAAACAGGAAAAGAAAAAGAAAAAGACCGGTCGTGCGAAACGTCGT-3' (Фиг. 1).
Учитывая вырожденность генетического кода, известно, что заданная аминокислотная последовательность KVAKQEKKKKKTGRAKRR может быть закодирована различными сочетаниями нуклеотидов. В тоже время, нуклеотидная последовательность кодирующая пептид играет решающую роль для успешной экспрессии и трансляции чужеродного пептида в клетке организма-продуцента, в связи с тем, что может содержать сочетания нуклеотидов распознаваемые клеткой, например, как сайты для действия ферментов гидролиза, рестрикции, модификации, остановки трансляции и проч. В связи с этим дизайн кодирующей пептид нуклеотидной последовательности является критичным для успешной экспрессии продукта и получения рекомбинантного пептида.
Исходным генетическим материалом для конструирования рекомбинантной плазмиды pET31b-2xUBI18-35 являются:
а) фрагмент плазмиды pET31b+ (Novagen), обработанный рестриктазой AlwN I (Pst I), обеспечивающий встраивание фрагмента ДНК, кодирующего две молекулы антимикробного пептида UBI18-35 и его экспрессию в составе белка-слияния с кетостероидизомеразой и остатком из шести гистидинов под контролем позднего промотора Т7 ДНК-полимеразы;
б) фрагмент ДНК, кодирующий две молекулы антимикробного пептида UBI18-35, полученный методом полимеразной цепной реакции с использованием синтетических олигонуклеотидов.
Полученная в результате плазмида pET31b-2xUBI18-35 (Фиг. 2) характеризуется следующими признаками:
- имеет размер 5858 п.н.;
- кодирует рекомбинантный антимикробный пептид UBI18-35 в составе белка слияния с кетостероидизомеразой и остатком из 6 гистидинов.
- состоит из следующих элементов:
1) фрагмент ДНК, размером 111 п.о., кодирующий 2 молекулы антимикробного пептида UBI18-35, разделенных остатком метионина.
2) фрагмент плазмиды pET31b+, обеспечивающий эффективную транскрипцию ДНК, кодирующей две молекулы антимикробного пептид UBI18-35, и их экспрессию.
- содержит:
а) сайт инициации репликации плазмиды pBR322;
б) промотор бактериофага Т7;
в) генетические маркеры: AMPr - ген β-лактамазы определяющий устойчивость E. coli к ампициллину, и lacI - репрессор лактозного оперона E. coli;
г) гены, кодирующие стартовый кодон, кетостероидизомеразу, последовательность из шести гистидиновых остатков, стоп-кадон;
д) сайт связывания с рибосомой;
е) уникальные сайты узнавания рестрикционной эндонуклеазой PstNI (прототип AlwNI);
Таким образом, впервые получена плазмидная ДНК, обеспечивающая продукцию в клетках E. coli рекомбинантного антимикробного пептида UBI18-35, способного встраиваться в мембрану микробных клеток, предназначенного для дифференциальной диагностики бактериального воспаления.
Предлагаемый штамм-продуцент E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 характеризуется следующими признаками:
Морфологические признаки. Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаризованной LB-среде - колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или LB-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки. Клетки растут при температуре от 4°C до 40°C при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к пенициллиновым антибиотикам (до 500 мкг/мл).
Штамм-продуцент E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 отличается от штамма-реципиента E. coli BL21 Rosetta DE3 pLysS только наличием рекомбинантной плазмидной ДНК pET31b-2xUBI18-35, которая придает ему устойчивость к пенициллиновым антибиотикам.
Штамм-продуцент получают путем трансформации компетентных клеток E.coli BL21 Rosetta DE3 pLysS соответствующей рекомбинантной плазмидной ДНК.
Клетки E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 являются продуцентом антимикробного пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой. При индукции изопропилтио-D-галактозидом, а также и без индукции происходит биосинтез UBI18-35 в составе белка-слияния с кетостероидизомеразой, который накапливается в нерастворимой форме в тельцах включения в клетках в количестве более 10% суммарного белка бактерий.
Пример 1. Конструирование плазмиды pET31b-2xUBI18-35.
Для получения гена UBI18-35, содержащего удвоенную последовательность, кодирующую UBI18-35 разделенную между собой и ограниченную с обоих концов остатками метионина, используют два синтетических олигонуклеотидных праймера длинной по 81 н.о.:
Прямой праймер
5'-tcaccagatgctgatgaaagtggcgaaacaggaaaagaaaaagaaaaagaccggtcgtgcgaaacgtcgtatgaaagtggc-3'
Обратный праймер
5'-gacacagcatctgcatacgacgtttcgcacgaccggtctttttctttttcttttcctgtttcgccactttcatacgacgtt-3'.
Последовательности обеспечивающих наличие в амплифицированном фрагменте сайтов рестрикции PstN1 выделены подчеркиванием, области перекрывания праймеров выделены двойным подчеркиванием, кодоны метионина выделены жирным шрифтом.
Готовят реакционную смесь содержащую: по 0,4 мкМ каждого праймера, смесь dNTP по 0,2 мМ каждого, 0,5 е.а. Encyclo полимеразы в 1× Encyclo ПЦР буфере (Евроген, Россия).
Реакцию проводят в амплификаторе (ThermoCycler, Applied Biosystems) по следующей программе: начальная денатурация 95°С - 1 мин и далее 15 циклов - денатурация 95°С - 15 сек, отжиг 60°С - 3 мин, элонгация 72°С - 30 сек, финальная элонгация 72°С - 1 мин.
Продукт ПЦР разделяют в 1,2 % агарозном геле с использованием 1× ТАЕ буфера с добавлением красителя бромистого этидия. Электрофорез проводят при постоянном электрическом токе 200 мА, напряжении 150 Вольт, мощности 1 Вт/см2.
Выделяют из геля фрагмент массой 143 п.н., соответствующий нуклеотидной последовательности:
5'- TCACCAGATGCTGATGAAAGTGGCGAAACAGGAAAAGAAAAAGAAAAAGACCGGTCGTG CGAAACGTCGTATGAAAGTGGCGAAACAGGAAAAGAAAAAGAAAAAGACCGGTCGTGCG AAACGTCGTATGCAGATGCTGTGTC-3'
с использованием набора Cleanup Standard (Евроген, Россия).
Выделенный фрагмент и плазмидный вектор pET31b+ в отдельных пробирках гидролизуют рестриктазой PstN1 (Сибэнзим, Россия). Рестрикционную смесь разделяют в 1,2 % агарозном геле и выделяют из геля линеаризованный в результате гидролиза плазмидный вектор и фрагмент массой 126 п.н., соответствующий удвоенной нуклеотидной последовательности кодирующей 2 молекулы антимикробного пептида UBI18-35, разделенных между собой и ограниченных с обоих концов остатками метионина.
Выделенный линеаризованный плазмидный вектор pET31b+ дефосфорилируют с использованием термостабильной щелочной фосфатазы (СибЭнзим, Россия). Очищают линеаризованный вектор с использованием набора Cleanup Standard (Евроген, Россия), смешивают с выделенным фрагментом в соотношении вектор : вставка равным 1:10 и лигируют с использованием Т4 ДНК-лигазы (СибЭнзим, Россия). Полученной лигазной смесью трансформируют клетки E.coli XL blue. Трансформированные колонии отбирают на селективной агаризованной среде LB с добавлением ампициллина (50 мг/мл) и выделяют плазмиду, используя набор MiniPrep (Евроген, Россия). Успешность клонирования фрагмента подтверждают методом ПЦР с праймерами на Т7 промоторную и Т7 терминирующую области плазмиды. Подтверждение соответствия клонированной последовательности ожидаемой проводят секвенированием на автоматическом секвенаторе (ABI 3130XL, Applied Biosystems) (Фиг. 3).
Пример 2. Получение штамма-продуцента продуцент E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35
Клетки E.coli BL21 Rosetta DE3 pLysS, несущие ген РНК-полимеразы фага Т7 под индуцибельным lacUV5 промотором, трансформируют [Маниатис, Т.Э., 1984. Молекулярное клонирование. Мир. Москва] сконструированной плазмидой pET31b-2xUBI18-35. Клетки E.coli BL21 Rosetta DE3 pLysS, трансформированные плазмидой pET31b-2xUBI18-35, выращивают в течение ночи. Ночную культуру (1/100) засевают в свежую среду LB с добавлением ампициллина (50 мкг/мл). Синтез РНК-полимеразы индуцируют добавлением ИПТГ в концентрации 0,1-1 мМ, предпочтительно 0,5 мМ, в тот момент, когда культура достигает среднелогарифмической фазы роста. Индуцированные клетки растят в течение 4 часов при температуре 22-37°С, предпочтительно 28°С, после чего собирают центрифугированием при 5000 g и анализируют методом электрофореза по Лэммли [Laemmli U.K., 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227, 680-685] в 16% SDS-полиакриламидном геле (ПААГ) для подтверждения успешности индукции синтеза UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом (Фиг. 4).
Результаты данного анализа, показывают наличие в индуцированной культуре клеток E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 дополнительного белка с молекулярной массой около 20 кДа (Фиг. 4, дорожки 2-9), который отсутствует в контрольном лизате клеток E.coli BL21 Rosetta DE3 pLysS/ pET31b (Фиг. 4, дорожка 1).
Пример 3. Очистка рекомбинантного антимикробного пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом из клеток E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 методом металл-аффинной хроматографии.
Клетки E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 выращивают в течение ночи. Ночную культуру (1/100) засевают в свежую среду LB с добавлением ампициллина (50 мкг/мл), экспрессию пептида индуцируют добавлением ИПТГ до конечной концентрации 0,1-0,5 мМ в тот момент, когда культура достигает среднелогарифмической фазы роста. Индуцированные клетки растят в течение 4-16 часов при 28°С, после чего собирают центрифугированием при 5000 g 4°С в течение 20 минут. Осадок замораживают -80°С для повышения эффективности лизиса клеток. Осадок растворяют в лизирующем буфере (50 mM Tris, , 100 mM NaCl, pH 8.0.) из расчета 5 мл буфера на 1 г осадка и добавляют лизоцим до конечной концентрации 1 мг/мл. Клетки ресуспендируют и обрабатывают ультразвуком, импульсами по 30 секунд с перерывом 30 сек во льду, 5 циклов. Инкубируют во льду 30 минут, центрифугируют 20 мин 10000 g при 4°С. Осадок растворяют в промывочном буфере 40 mM Tris, 500 mM NaCl, 15 mM имидазол, 8 M мочевина, pH 8.0 из расчета 10 мл на 1 г осадка и центрифугируют 20 мин 10000 g при 4°С. Отбирают супернатант, содержащий рекомбинантный белок и очищают с помощью аффинной хроматографии на Ni-NTA агарозе (Qiagen, США), согласно инструкции производителя. На хроматографическую колонку, упакованную 5 мл Ni-NTA агарозы и уравновешенную буфером 40 mM Tris, 500 mM NaCl, 15 mM имидазол, 8 M мочевина, pH 8.0, наносят 10 мл супернатанта со скоростью потока 1 мл/мин. Для удаления неспецифически сорбирующихся белков E.coli проводят предварительную элюцию 40 мл буфера, содержащего 40 mM Tris, 500 mM NaCl, 15 mM имидазол, 8 M мочевина, pH 8.0. Пептид в составе белка-слияния элюируют 5 мл буфера, содержащего 40 mM Tris, 500 mM NaCl, 300 mM имидазол, 8 M мочевина, pH 8.0.
Полученные белковые фракции, содержащие рекомбинантный UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом, диализируют против дистиллированной воды (две смены по 24 ч при комнатной температуре), анализируют электрофорезом в ПААГ с SDS по Лэммли и лиофилизируют в течение суток (Freezone Labconco). На Фиг. 5 приведены результаты электрофоретического анализа очищенного методом металл-аффиннной хроматографии пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и последовательностью из шести гистидиновых аминокислотных остатков.
Пример 4. Отделение рекомбинантного антимикробного пептида UBI18-35 от белка партнера кетостероидизомеразы и 6-гистидинового тага
Водный раствор белка-слияния KSI-2xUBI18-35 полученный после диализа, предварительно лиофилизируют. Сухой белок растворяют в минимальном количестве 75 % муравьиной кислоты и добавляют 100 молярный (в расчете на количество содержащихся в белке остатков метионина) избыток бромциана. Реакцию проводят при комнатной температуре в течение 12-24 часов в темноте. Реакцию прекращают добавлением воды в 10-кратном избытке по отношению к исходному объему. Затем пробу диализируют против 1000 кратного избытка дистиллированной воды дважды в течение 24 часов, замораживают при минус 20°С и лиофилизируют. Эффективность отщепления пептида от белка-слияния оценивают методом SDS-ПААГ-трицин [Schägger H., 2006. Tricine-SDS-PAGE. Nat Protoc. 1, 16-22] электрофореза (Фиг. 6).
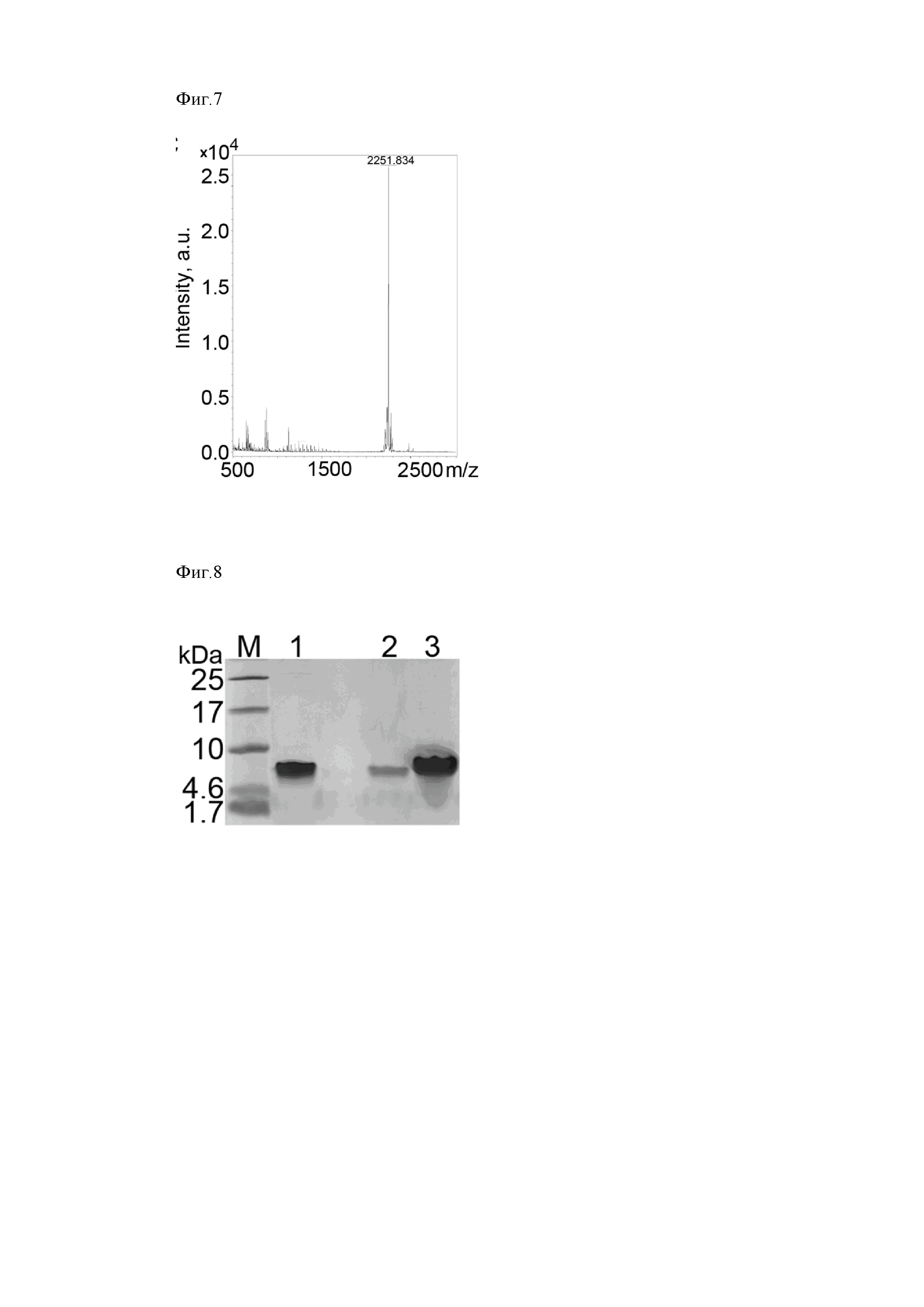
Соответствие аминокислотной последовательности рекомбинантного пептида UBI18-35 заявленной подтверждают методом MALDI-TOF-MS спектрометрии (Фиг. 7). Для проведения масс-спектрометрического анализа образца пептида в качестве матрицы используют 4-гидроксикоричную кислоту. Предварительно высушенную пробу растворяют в 0,1 % растворе трифторуксусной кислоты (ТФУ) в воде, смешивают с рабочим раствором матрицы, растворенной в 0,1 % растворе ТФУ в ацетонитриле, и наносят 2 мкл на подложку из нержавеющей стали и высушивают на воздухе. Масс-спектр получают на приборе MALDI-TOF Brucker MicroFlex mass spectrometer (Bruker, Germany).
На МАЛДИ масс-спектре наблюдается пик целевого пептида массой 2251,8 Да, что соответствует массе пептида UBI18-35 c гомосерин-лактоном на С-конце пептида, образующегося в результате реакции отщепления пептида от белка-слияния по остатку метионина под действием бромциана аминокислотной последовательностью (NH2-KVAKQEKKKKKTGRAKRR-C4H7N1O2) (Фиг. 7).
Пример 5. Получение препарата рекомбинантного антимикробного пептида UBI18-35 из клеток E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35.
Проводят очистку белка по методу, описанному в примере 3. Далее проводят отделение пептида от кетостероидизомеразы и последовательности из 6 гистидиновых аминокислотных остатков по методу, описанному в примере 4.
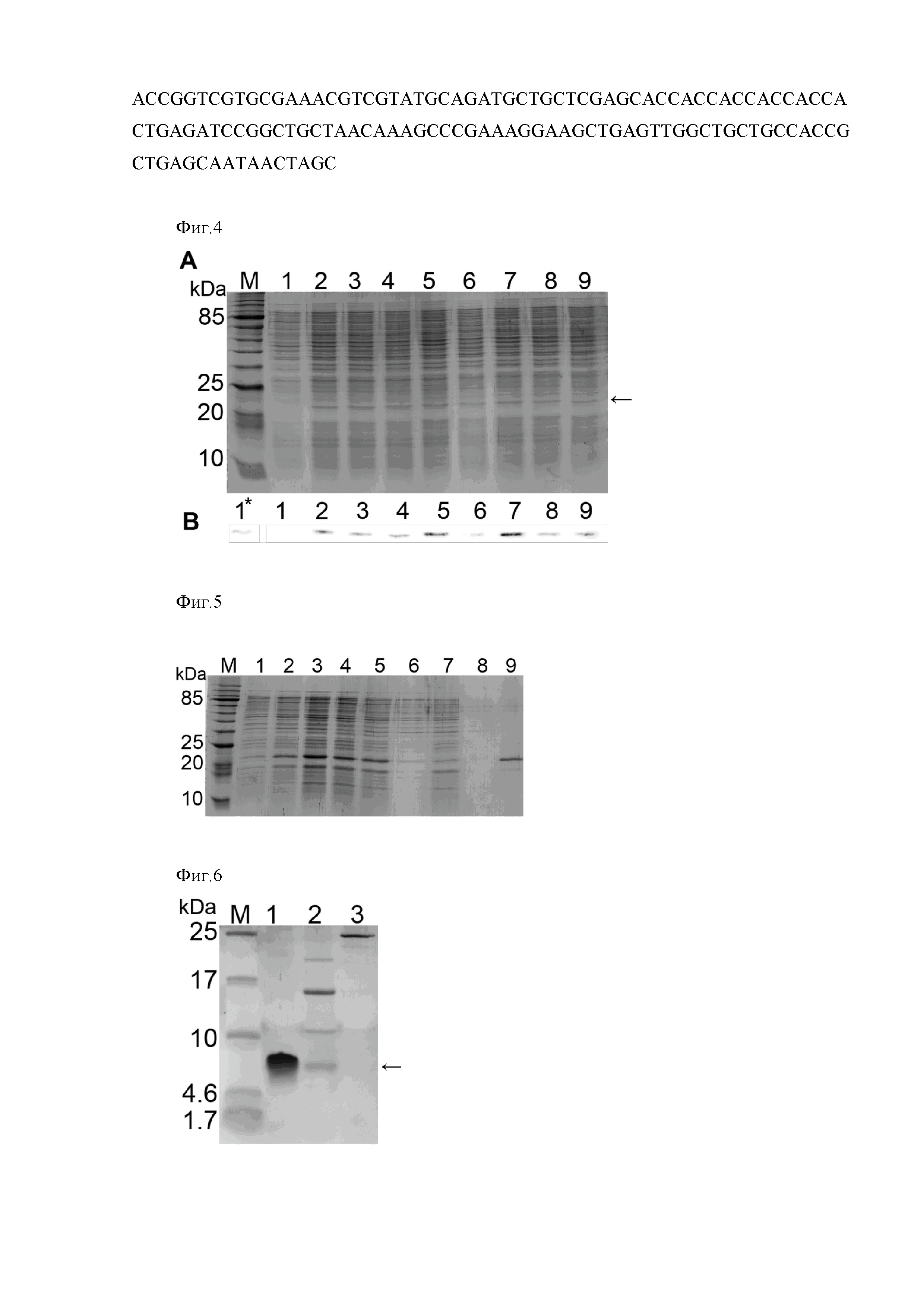
Очистку пептида UBI18-35 от прочих примесей белковой природы проводят методом гель-фильтрации на колонке с диаметром 30 мм и длиной 145 мм упакованной Bio-Gel P 2. Для этого колонку уравновешивают буфером 50 mM Tris HCl, 100 mM NaCl, 8 M мочевина (pH 8.0) и наносят смесь, содержащую пептид. Элюцию проводят в изократическом режиме при скорости потока 3 мл/мин буфером, содержащем 50 mM Tris HCl, 100 mM NaCl, 8 M мочевина (pH 8.0) в течение 25 минут с использованием хроматографической системы NGC™ Chromatography Systems (Bio-Rad). Фракцию, содержащую пептид, собирают и диализуют против воды используя Slide-A-Lyzer, 2000 MWCO (Pierce).
На Фиг. 8 приведены данные анализа методом трицин-ПААГ электрофореза фракции, собранной на 25-26 минутах хроматографирования. На электрофореграмме в пробе присутствует полоса, соответствующая пептиду UBI18-35, мигрирующего на уровне масс 7 кДа, совпадающая с миграцией синтетического пептида UBI18-35, используемого в качестве контроля.
Пример 6. Анализ способности рекомбинантного антимикробного пептида UBI18-35 полученного в E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 встраиваться в мембрану микробных клеток
Рекомбинантный антимикробный пептид UBI18-35 метят флуоресцентной меткой Cyanine5. Для этого 2 мг лиофилизированного рекомбинантного антимикробного пептида UBI18-35 растворяют в 450 мкл 0,1 M натрий-фосфатного буфера (pH 8,4) и смешивают с 5 мг Cyanine5-ester-NHS (Lumiprobe), растворенного в 50 мкл ДМСО, и инкубируют на ротаторе (Multi RS-60, BioSan) при 4 oC в течение ночи в темноте. После инкубации диализуют против натрий-фосфатного буфера, используя Slide-A-Lyzer, 2000 MWCO (Pierce).
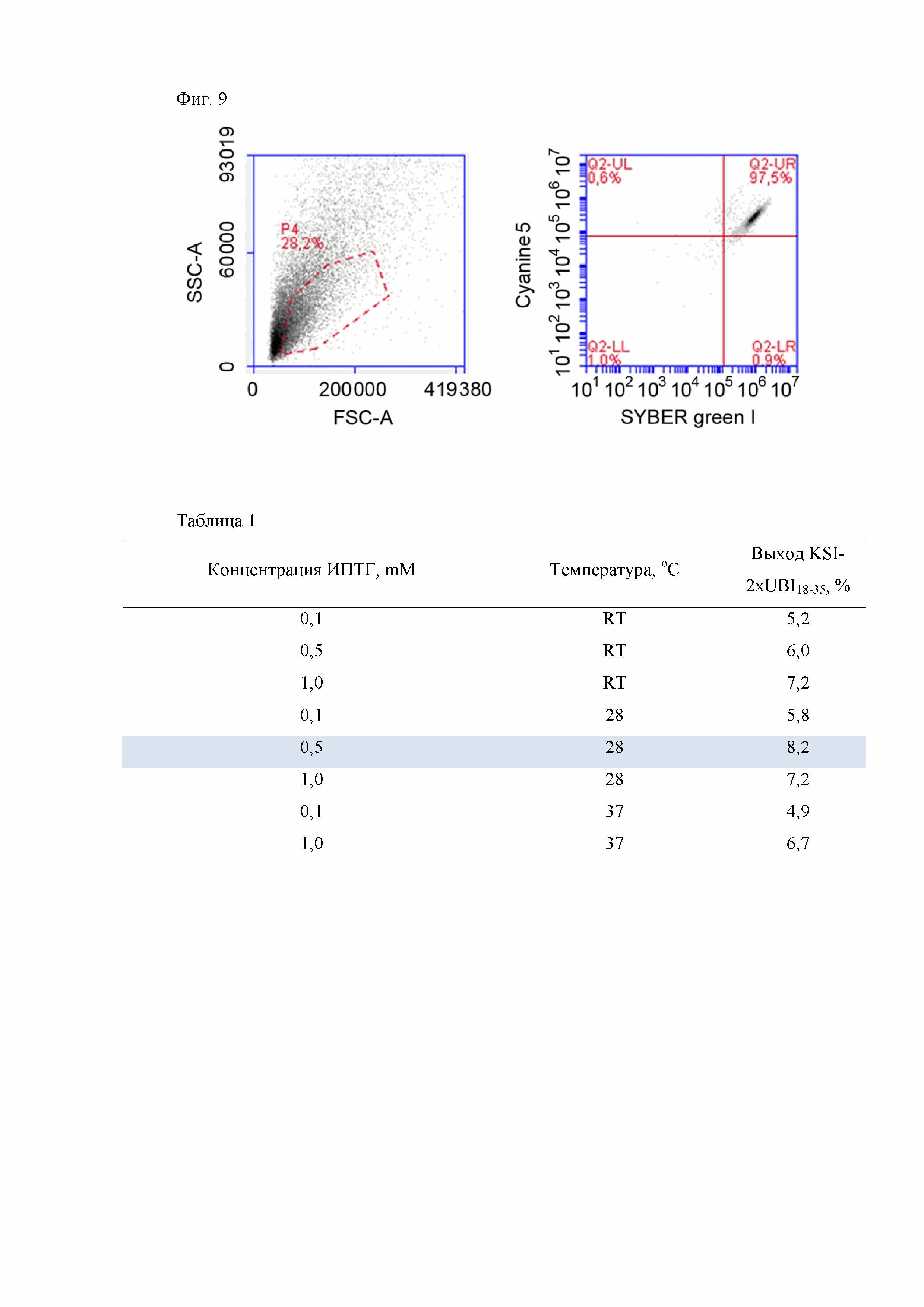
Для исследования связывание Cyanine5-UBI18-35 с микробными клетками 30 мкл Cyanine5-UBI18-35 (1 мМ) в натрий-фосфатном буфере (pH 7,4) добавляют к 420 мкл натрий-фосфатного буфера (pH 7.0), содержащего 0,01% (v/v) Tween-80, и смешивают с 50 мкл натрий-фосфатного буфера (pH 7,0) содержащего 106 микробных клеток Staphylococcus aureus. Смесь инкубируют на роторе при 4°C в течение 1 часа в темноте, центрифугируют при 3000 g 5 минут. Супернатант удаляют, дважды промывают осадок клеток, и растворяют в 200 мкл натрий-фосфатного буфера (pH 7.4). Клетки анализирую методом проточной цитомтерии (BD Accuri C6, BD Bioscience, CA). Дополнительно клетки окрашиваются с использованием флуоресцентного красителя Syber Green I. Эффективность связывания рекомбинантного антимикробного пептида UBI18-35 с клетками S. aureus по данным проточной цитофлуориметрии составляет 96,90±0,55% (Фиг. 9).
Обоснование режима экспрессии рекомбинантного антимикробного пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом в клетках E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35
Технические параметры способа основаны на результатах анализа данных экспериментальных исследований (Таблица 1), которые показали, что:
- использование для индукции экспрессии ИПТГ в конечной концентрации 0,5 мМ обеспечивает оптимальное количество синтезируемого E.coli BL21 Rosetta DE3 pLysS / pET 31b-2xUBI18-35 рекомбинантного антимикробного пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом.
- оптимальное количество рекомбинантного антимикробного пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом нарабатывается при температуре культивирования E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 - 28°С. При температуре 22°С выход целевого продукта несколько ниже, тогда как увеличение температуры до 37°С приводит к значительному снижению выхода целевого продукта.
Таким образом, впервые получена плазмидная ДНК pET31b-2xUBI18-35, кодирующая аминокислотную последовательность рекомбинантного антимикробного пептида UBI18-35, в составе белка слияния с кетостероидизомеразой на N-конце пептида и последовательность из 6 гистидиновых остатков на С-конце, штамм-продуцент рекомбинантного пептида UBI18-35 E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35, а также описан метод получения рекомбинантного антимикробного пептида UBI18-35, способного встраиваться в мембрану микробных клеток и предназначенного для дифференциальной диагностики бактериального воспаления.
Изобретение иллюстрируется следующими чертежами:
Фиг. 1. Нуклеотидная последовательность и кодируемая ею аминокислотная последовательность антимикробного пептида UBI18-35.
Фиг. 2. Общая схема структурной организации плазмиды pET31b-2х UBI18-35. UBI - ген, кодирующий две молекулы антимикробного пептида UBI18-35, KSI–ген кетостероидизомеразы, Т7 - промотор фага Т7, AMP-ген устойчивости к ампициллину, 6xHis - ген, кодирующий 6 остатков гистидина, lac I-ген, кодирующий репрессор лактозного оперона E. coli;
Фиг. 3. Секвенирование кодирующего 2xUBI18-35 фрагмента в составе рекомбинантной плазмиды pET31b-2xUBI18-35. Сиквенс фрагмента, полученного в результате ПЦР с использованием в качестве матрицы рекомбинантной плазмиды pET31b-2xUBI18-35 и праймеров на Т7 промоторную и Т7 терминирующую области плазмиды (T7 forward: 5'-taatacgactcactataggg-3', T7 reverse: 5'-gctagttattgctcagcgg-3').
Фиг. 4. Оптимизация условий экспрессии пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и остатком из 6 гистидинов в клетках E.coli BL21 Rosetta DE3 pLysS / pET31b-2xUBI18-35. (А) Электрофоретический анализ в 16% SDS-ПААГ. М - набор белковых маркеров молекулярного веса (СибЭнзим), лизаты клеток E. coli, содержащих плазмиду pET31b-2xUBI18-35: до индукции экспрессии белка KSI-2xUBI18-35 в условиях культивирования в присутствие 1% глюкозы в среде (дорожка 1) и после индукции (дорожка 2) ИПТГ в конечной концентрации 0,1 мМ, культивирование при 22°С, (дорожка 3) -0,5 мМ ИПТГ, культивирование при 22°С, (дорожка 4) - 1 мМ ИПТГ, культивирование при 22°С, (дорожка 5) -0,1 мМ ИПТГ, культивирование при 28°С, (дорожка 6) -0,5 мМ ИПТГ, культивирование при 28°С, (дорожка 7) -1 мМ ИПТГ, культивирование при 28°С, (дорожка 8) -0,1 мМ ИПТГ, культивирование при 37°С, (дорожка 9) -0,5 мМ ИПТГ, культивирование при 37°С.
(Б) Вестерн-блот анализ лизата клеток E. coli, содержащих плазмиду pET31b-2xUBI18-35 до индукции экспрессии белка KSI-2xUBI18-35 без добавления в среду глюкозы (наблюдается слабая экспрессия белка) (дорожка 1'); (дорожки 1-9) - нумерация образцов в соответствие с SDS-ПААГ электрофореграммой.
Фиг. 5. Электрофореграмма в 16 % SDS-ПААГ белковых фракций и очищенного рекомбинантного пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом. M - набор белковых маркеров молекулярного веса (СибЭнзим), (дорожка 1) - лизат клеток E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 до индукции белка KSI-2xUBI18-35, (дорожка 2) - лизат клеток E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35 после индукции белка KSI-2xUBI18-35 (дорожка 3) - общий клеточный лизат, (дорожка 4) - общий клеточный экстракт, (дорожка 5) - тельца включения KSI-2xUBI18-35, растворенные в буфере, содержащем 40 мМ трис-HCl, 500 мМ NaCl, 15мМ имидазол, 8М мочевину, pH 8.0, (дорожка 6) - осадок, после растворения телец включения KSI-2xUBI18-35, (дорожки 7, 8) - фракции, не взаимодействующие с хроматографическим сорбентом, (дорожки 9) - фракция, элюируемая буфером (40 мМ трис-HCl, 500 мМ NaCl, 300 мМ имидазол, 8 М мочевина, pH 8.0), содержащая антимикробный пептид UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом.
Фиг. 6. Анализ эффективности отщепления пептида UBI18-35, от белка-слияния KSI и 6-гистидинового тага с использованием бромциана. Электрофореграмма в 16,5 % трицин-ПААГ. M - набор низкомолекулярных белковых маркеров (Spectra Scientific Spectra Multicolor Low Range Protein Ladder, Thermo Scientific), (дорожка 1) - синтетический пептид UBI18-35 (контроль), (дорожка 2) - белковые фракции, содержащие целевой рекомбинантный пептид UBI18-35, (дорожка 3) - белок слияния KSI-2xUBI18-35 до обработки бромцианом.
Фиг. 7. МАЛДИ масс-спектр (А) рекомбинантного пептида UBI18-35 и (Б) пептида UBI18-35, полученного методом твердофазного синтеза.
Фиг. 8. Анализ хроматографических фракций, содержащих очищенный рекомбинантный пептид UBI18-35. Электрофореграмма в 16,5 % трицин-ПААГ. M - набор низкомолекулярных белковых маркеров (Spectra Scientific Spectra Multicolor Low Range Protein Ladder, Thermo Scientific), (дорожка 1) - синтетический пептид UBI18-35 (контроль), (дорожка 3) - фракция, собранная с 25 по 26 минуты хроматографирования методом гель-фильтрации на колонке упакованной Bio-Gel P 2 (рекомбинантный пептид UBI18-35).
Фиг. 9 Анализ связывания рекомбинантного антимикробного пептида UBI18-35, меченого Cyanine5, с микробными клетками S. aureus методом проточной цитометрии (клетки окрашены с использованием SYBER Green I).
ПРИЛОЖЕНИЕ
Фиг. 1. Нуклеотидная последовательность и кодируемая ею аминокислотная последовательность антимикробного пептида UBI18-35
Фиг. 2. Общая схема структурной организации плазмиды pET31b-2xUBI18-35
Фиг. 3. Секвенирование кодирующего 2xUBI18-35 фрагмента в составе рекомбинантной плазмиды pET31b-2xUBI18-35.
Фиг. 4. Оптимизация условий экспрессии пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом в клетках E.coli BL21 Rosetta DE3 pLysS / pET31b-2xUBI18-35.
Фиг. 5. Электрофореграмма в 16 % SDS-ПААГ белковых фракций и очищенного рекомбинантного пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом.
Фиг. 6. Анализ эффективности отщепления пептида UBI18-35, от белка-слияния KSI-2xUBI18-35 с использованием бромциана.
Фиг. 7. МАЛДИ масс-спектр (вверху) рекомбинантного и синтетического пептидов UBI18-35
Фиг. 8. Анализ хроматографической фракции, содержащей очищенный рекомбинантный пептид UBI18-35.
Фиг. 9. Анализ связывания рекомбинатного антимикробного пептида UBI18-35, меченого Cyanine5, с микробными клетками S. aureus методом проточной цитометрии (клетки окрашены с использованием SYBER Green I).
Таблица 1. Обоснование режима экспрессии рекомбинантного антимикробного пептида UBI18-35 в составе белка-слияния с кетостероидизомеразой и 6-гистидиновым тагом в клетках E.coli BL21 Rosetta DE3 pLysS/ pET31b-2xUBI18-35