Результат интеллектуальной деятельности: Прогнозирование преэклампсии на основе определения внеклеточной ДНК плода в материнской крови при проведении скрининга первого триместра беременности
Вид РИД
Изобретение
Изобретение относится к области медицины, в частности к акушерству, и может быть использовано для прогнозирования преэклампсии у женщин в первом триместре беременности. Сущность метода состоит в заборе материнской крови для определения содержания внеклеточной ДНК плода у женщин при проведении скрининга первого триместра беременности. Прогнозируют преэклампсию по результатам уравнения р=1/(1+e-z), где е - математическая константа, равная 2.72, a z определяют из следующего уравнения бинарной логистической регрессии: z=0.143*y1+2.138*у2-7.335, где y1 - концентрация внеклеточной ДНК плода в 11-14 недель (ГЕ/мл), у2 -средний пульсационный индекс в маточных артериях в 11-14 недель. Использование заявленного метода позволяет прогнозировать преэклампсию с чувствительностью 90.0% и специфичностью 90.9% при пороговой точке отсечки 0.51. Таким образом, при значении р≥0.51 имеется высокий риск развития преэклампсии.
Изобретение относится к области медицинской диагностики и может быть использовано для прогнозирования преэклампсии у женщин в первом триместре беременности.
Преэклампсия (далее ПЭ) клинически манифестирует после 20 недели гестации или в течение 4-6 недель после родов проявлением артериальной гипертензии и/или протеинурии, нередко сочетаясь с отеками, и остается одной из главных причин материнской и перинатальной заболеваемости и смертности [1]. Единственным эффективным способом «лечения» данного осложнения является родоразрешение. Несмотря на проведение профилактических мероприятий, частота ПЭ не снижается и составляет 2-8% [2]. Данная тенденция в том числе связана с запоздалым началом профилактики ПЭ в связи с отсутствием специфических прогностических маркеров, позволяющих выявлять женщин высокого риска на раннем сроке беременности. Тем самым, в настоящее время наиболее актуальным является возможность прогнозирования ПЭ на раннем сроке гестации для своевременного начала профилактики и тщательного мониторинга в течение беременности.
Описано большое количество факторов риска развития ПЭ, основными из которых являются: возраст женщины, ПЭ в анамнезе, хроническая артериальная гипертензия, гестационный сахарный диабет, заболевания почек, аутоиммунные заболевания, метаболические нарушения, многоплодная беременность, чрезмерная прибавка массы тела во время беременности и др. [3]. Однако процент ложноположительных результатов скрининга ПЭ на основании факторов риска составляет 64.1% [4]. В большинстве работ продемонстрировано, что увеличение сосудистого сопротивления в маточных артериях ассоциируется с развитием ПЭ. Однако в результате мета-анализа более 70 исследований продемонстрирована прогностическая значимость определения допплерометрических показателей в маточных артериях только во втором триместре беременности и при ранней манифестации или тяжелом течении ПЭ [5]. Также изменение кровотока в маточных артериях характерно для других плаценто-ассоциированных осложнений беременности.
Исследовано большое количество биохимических маркеров ПЭ. При гипоксически-ишемических изменениях в плаценте и снижении парциального давления кислорода происходит избыточное высвобождение антиангиогенных белков в материнский кровоток, ключевым из которых является растворимая fms-подобная тирозинкиназа-1 (sFlt-1). Как известно, уровень sFlt-1 повышается при ПЭ, что предшествует манифестации заболевания [6]. Концентрация плацентарного фактора роста (PLGF) при нормальном течении беременности имеет тенденцию к увеличению в первом и во втором триместрах, достигая максимума к 30 неделе гестации и впоследствии уменьшается [7]. На сроке 11-13 недель уровень PLGF в крови матери снижен при анеуплоидии плода и нарушении плацентации, вследствие чего повышается риск развития ПЭ и задержки роста плода. Аналогичное изменение концентрации PLGF наблюдаются во втором и третьем триместрах [8]. Однако определение концентрации ангиогенных факторов изолированно не имеет прогностической значимости для ПЭ с чувствительностью PLGF 32% и частотой ложноположительных результатов 5% [9]. Соотношение sFlt-1 к PLGF позволяет прогнозировать 87.5% наблюдений с ПЭ с частотой ложноположительных результатов 10% только при комбинации результатов во втором и третьем триместрах беременности, что не является оптимальным для применения профилактических мероприятий в группе повышенного риска [10]. В качестве биохимических маркеров ПЭ изучены также РАРР-А, ADAM12, cystatin С, РР-13, pentraxin-3, P-selectine, ADMA, hCG, inhibin A, activing A, sEng и др. Прогностическая ценность данных маркеров не определена ввиду имеющихся различий в результатах исследований, необходимости в комбинации с другими маркерами и отсутствии значимых изменений содержания в первом триместре беременности [11].
В 1997 г. Lo и соавторы продемонстрировали наличие последовательностей внеклеточной ДНК плода (далее пДНК) в материнской крови. Известно, что основным источником пДНК является трофобласт. Попадает пДНК в материнский кровоток вследствие апоптоза клеток трофобласта. Принимая во внимание, что одним из механизмов развития ПЭ является нарушение дифференцировки трофобласта вследствие патологии плацентации и, как следствие, усиление апоптоза клеток трофобласта, пДНК изучали в качестве диагностического маркера ПЭ. Обнаружено повышение концентрации пДНК от 2-х до 5-х раз по сравнению с неосложненным течением беременности, корреляция со степенью тяжести ПЭ, дополнительное увеличение уровня при присоединении HELLP синдрома [12-18].
Наибольший интерес представляло изучение пДНК в материнской крови на ранних сроках, а именно в первом триместре беременности, с целью прогнозирования ПЭ. По данным исследований Sifakis и соавторов (2009), Illanes и соавторов (2009), Papantoniou и соавторов (2013) в 11-14 недель гестации содержание внеклеточной пДНК в материнской крови повышено только при ранней манифестации ПЭ. Напротив, Crowley и соавторы (2007), Poon и соавторы (2013), Thurik и соавторы (2016), Kim и соавторы (2016), Silver и соавторы (2017) не отметили изменения уровня внеклеточной пДНК в первом триместре беременности у женщин с ПЭ, в то время как Rolnic и соавторы (2015) продемонстрировали снижение концентрации пДНК в 11-13 недель при развитии ранней ПЭ. Таким образом, в настоящее время результаты исследований относительно прогнозирования ПЭ на основе определения внеклеточной пДНК в материнской крови на раннем сроке беременности неоднозначные. Однако известны разные маркеры пДНК, которые обуславливают ограничения в применении данного метода, имеют различную чувствительность и специфичность. Исследование пДНК в материнской крови началось с SRY и DYS-14 генов Y-хромосомы, с помощью которых возможно определение пДНК у женщин только с мужским полом плода, что ограничивает применение данной методики. В ряде исследований обнаружение пДНК было ограничено резус-принадлежностью женщины и плода - использование RHD ген в качестве маркера пДНК. Недостатком метода, основанного на выделении пДНК по определению гена maspin (SERPINB5) является высокая степень ее деградации - более 90% ДНК. В результате поисков эпигенетических маркеров клеток плода Chan и соавторы (2006) продемонстрировали, что промотор RASSF1A гена гипометилирован в клетках крови матери, но гиперметилирован в плаценте [19]. Методика обнаружения пДНК в материнской крови при помощи гена RASSF1A позволяет определять содержание пДНК у всех беременных независимо от пола плода и резус-принадлежности.
Известен патент US №8.288.100 В2, 16.10.2012 «Methods for detecting fetal DNA in a plasma or serum sample from a pregnant woman» (Yuk Ming Dennis Lo (HK), Rossa Wai Kwun Chiu (HK), Stephen Siu Chung Chim (HK), Chunming Ding (HK), Kwan Chee Chan (HK), Hing Nam Ivy Wong (HK), Ka Chun Ryan Yuen (HK)). Авторы продемонстрировали универсальность использования гена RASSF1A в качестве маркера пДНК, а также значимое различие в концентрации пДНК у женщин с ПЭ и без.
В изученной научно-медицинской и доступной патентной литературе не обнаружено способа прогнозирования ПЭ в первом триместре беременности на основе определения внеклеточной пДНК в материнской крови в сочетании с другими предикторами развития данного осложнения беременности.
Задачей настоящего исследования является разработать систему прогнозирования ПЭ на основе определения уровня содержания внеклеточной пДНК в материнской крови.
Результат использования изобретения - выделение группы высокого риска развития ПЭ с целью своевременного начала профилактики и тщательного мониторинга в течение беременности.
Согласно поставленной задаче разработана система прогнозирования ПЭ, включающая:
- забор венозной крови при проведении пренатального скрининга в 11-14 недель беременности;
- определение содержания внеклеточной ДНК плода в материнской крови;
- проведение допплерометрического исследования кровотока в маточных артериях с определением среднего пульсационного индекса в 11-14 недель;
- прогнозирование вероятности риска развития ПЭ по результатам уравнения р=1/(1+e-z),
где е - математическая константа, равная 2.72,
z - определяют из уравнения бинарной логистической регрессии следующего вида:
z=0.143*у1+2.138*у2-7.335,
где y1 - концентрация внеклеточной ДНК плода в 11-14 недель (ГЕ/мл), у2 - средний пульсационный индекс в маточных артериях в 11-14 недель.
Новизна изобретения заключается в том, что на основании уровня содержания внеклеточной пДНК в материнской крови в 11-14 недель гестации и факторов риска развития ПЭ, наиболее значимым из которых определен средний пульсационный индекс в маточных артериях при проведении скрининга первого триместра беременности, разработана модель прогнозирования ПЭ.
Проведено обследование 580 беременных от 18 до 45 лет, европеоидной расы, с одноплодной беременностью, подписавших информированное согласие на участие в исследовании. Критериями невключения для всех пациентов явились: хромосомные аномалии и пороки развития у плода и плаценты, аномалии прикрепления и расположения плаценты, онкологические заболевания, острая фаза и обострение хронических инфекционных заболеваний, аутоиммунные заболевания, проведенные инвазивные пренатальные исследования в течение беременности, женщины с трансплантированными органами.
ПЭ диагностирована в 3.4% наблюдений (20 пациенток). Среди обследованных женщин без ПЭ (560 наблюдений) отобраны 22 здоровые пациентки с неотягощенным анамнезом, неосложненным течением беременности, у которых произошли спонтанные роды на доношенном сроке гестации живым здоровым плодом, соответствующим гестационному сроку, для определения диапазона нормативных значений внеклеточной пДНК.
Методика определения внеклеточной пДНК
Забор венозной крови для определения внеклеточной пДНК производили в 11-14 недель при прохождении скрининга первого триместра беременности. Кровь в объеме 5 мл забирали с соблюдением правил асептики в вакуумные пробирки, содержащие ЭДТА, и обрабатывали в течение часа после забора. Выделяли плазму крови центрифугированием в два этапа при 4°С: первый этап - 10 мин, 200 g, второй этап - 10 мин, 4500 g. Образцы плазмы хранили при температуре -80°С. Метод определения внеклеточной пДНК основан на различиях в метилировании промотора гена RASSF1A в геноме плода и в тканях матери - в геноме плода гиперметилирован, в то время как в тканях матери гипометилирован [19]. Общую внеклеточную ДНК выделяли из 1000 мкл плазмы с использованием магнитных частиц Sileks MagNA (Силекс, Россия) согласно рекомендациям изготовителя. Полученную ДНК переосаждали этанолом с соосадителем Satellite Red (Евроген, Россия), далее разводили в 10 мкл воды. Полученный раствор ДНК использовали для проведения метилчувствительной рестрикции с использованием фермента BstUI (NEB, England) 80 Е (единиц активности). Реакцию рестрикции проводили 10 ч при 60°С. После чего ДНК осаждали этанолом с предварительным удалением рестриктаз с помощью хлороформа. Полученную ДНК растворяли в 10 мкл воды. 2 мкл полученного раствора использовали в реакции ПЦР для контроля рестрикции с праймерами к гену АСТВ. В случае отсутствия ответа оставшийся раствор ДНК использовали в реакции ПЦР с праймерами к RASSF1 для определения концентрации внеклеточной ДНК плода в плазме крови. ПЦР-анализ проводили одновременно с пятью различными концентрациями стандарта ДНК, который изготовили из ДНК, выделенной из крови с использованием магнитных частиц (Силекс, Россия). Концентрацию стандарта ДНК определили с помощью флуориметра Qubit 4 (Thermo Fisher Scientific USA). Для проведения ПЦР использовали амплификатор CFX96 (BioRad, USA). Программа ПЦР: 95°С 3 мин, 45 циклов: 95°С 10 сек, 60°С 15 сек, 72°С 30 сек. Последовательности праймеров и зондов представлены в таблице 1.

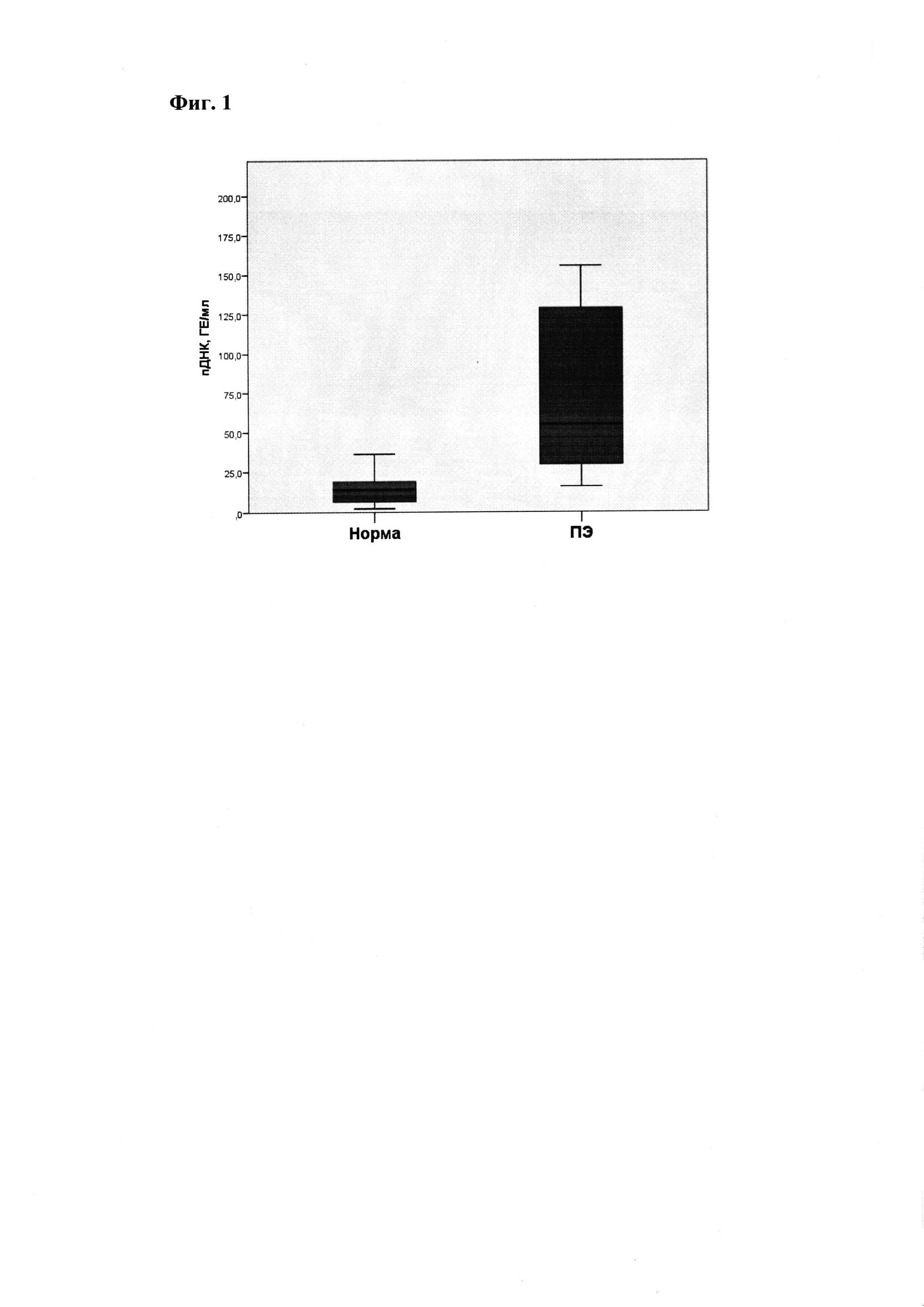
В результате полученных данных выявлено, что в 11-14 недель уровень внеклеточной пДНК достоверно выше при ПЭ по сравнению с неосложненным течением беременности. Медиана концентрации пДНК при ПЭ составляет 54.85 (29.10-131.83) ГЕ/мл, в то время как при неосложненном течении беременности - 14.15 (6.55-19.40) ГЕ/мл (р<0.001) (Фиг. 1).
Ранняя и поздняя ПЭ в изученной популяции встречались с одинаковой частотой, уровень пДНК в 11-14 недель беременности составлял 54.85 (30.33-108.09) и 51.93 (27.49-142.15) ГЕ/мл, соответственно (р>0.05).
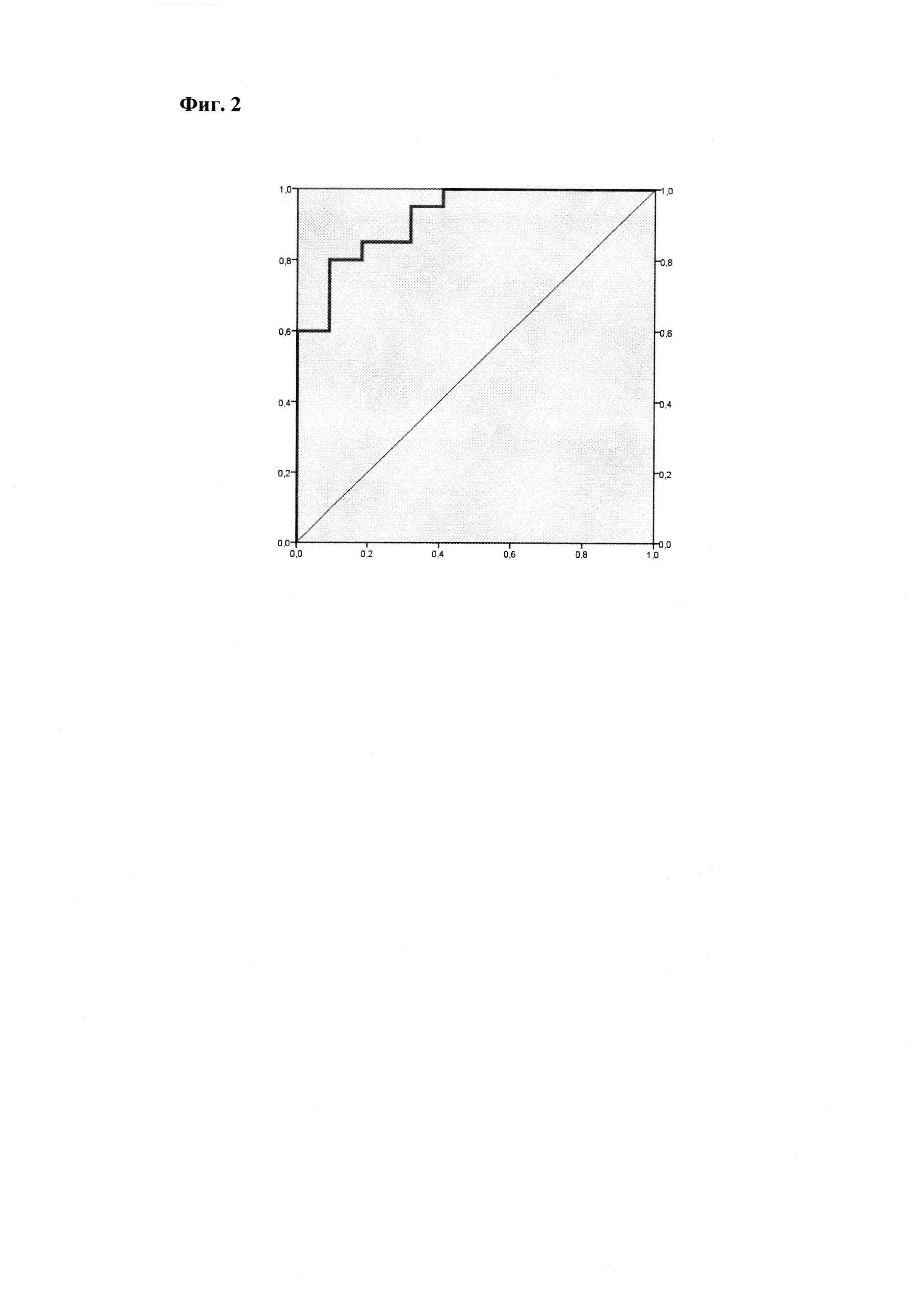
По данным ROC-анализа концентрация внеклеточной пДНК прогнозирует развитие ПЭ с чувствительностью 85.0% и специфичностью 81.8% при уровне отсечки 22.54 ГЕ/мл (площадь под кривой 0.920, р<0.001) (Фиг. 2).
При сравнительном анализе данных допплерометрии в 11-14 недель гестации выявлено более высокое значение среднего пульсационного индекса в маточных артериях у женщин с ПЭ - медиана 1.57 (1.41-1.97) против 1.37 (1.14-1.52), р=0.026).
Использование метода логистической регрессии позволило разработать прогностическую модель развития ПЭ на основе данных внеклеточной пДНК и среднего пульсационного индекса в маточных артериях в сроке 11-14 недель беременности по формуле:
р=1/(1+е-z), где
е - математическая константа, равная 2.72,
z - определяют из уравнения бинарной логистической регрессии следующего вида:
z=0.143*у1+2.138*у2-7.335, где
y1 - концентрация внеклеточной ДНК плода в 11-14 недель (ГЕ/мл),
у2 - средний пульсационный индекс в маточных артериях в 11-14 недель.
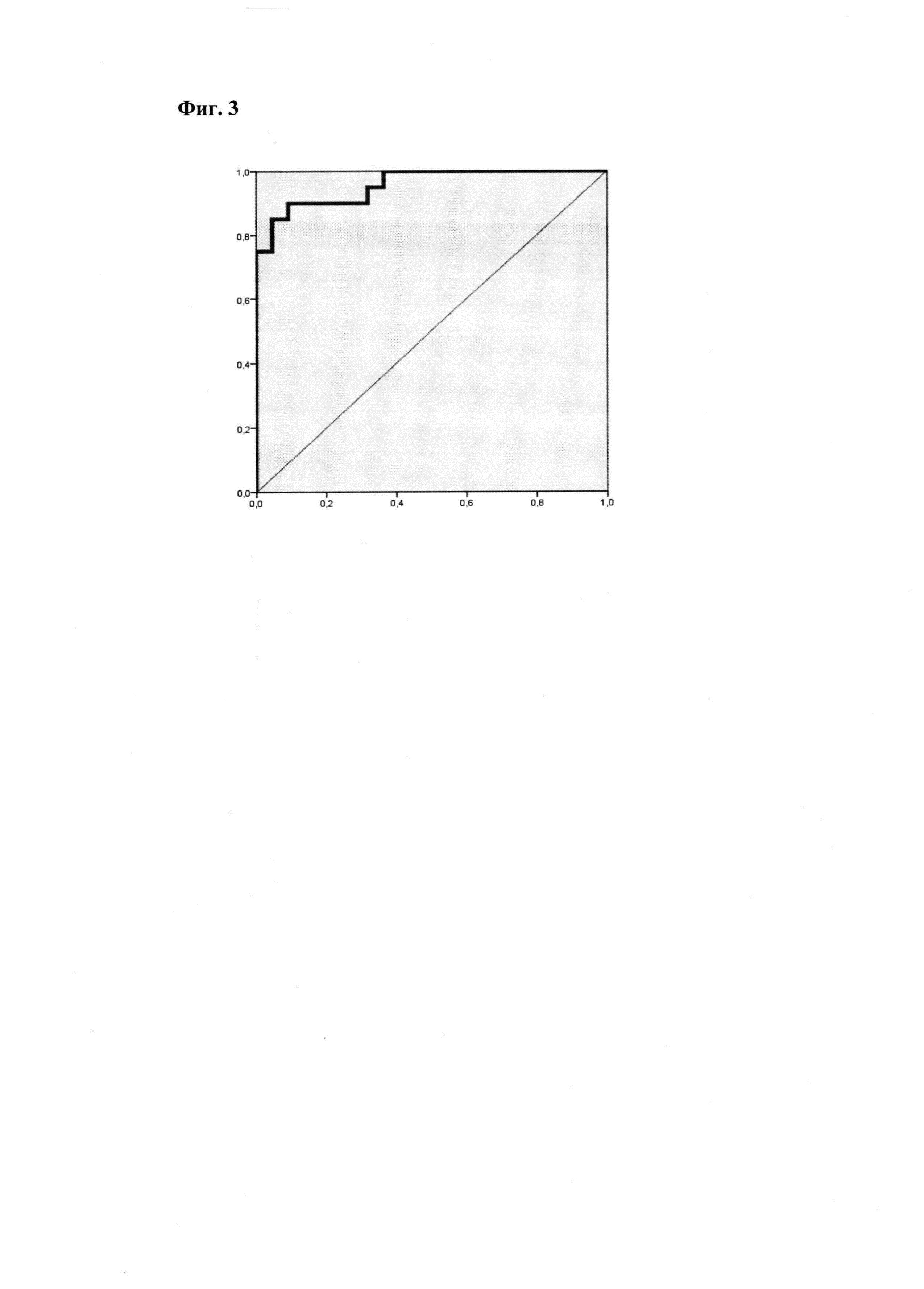
Согласно проведенному ROC-анализу, площадь под кривой составила AUC=0.957, пороговая точка отсечки - 0.51 при уровне чувствительности 90.0% и специфичности 90.9% (р<0.001) (Фиг. 3). Следовательно, при значении р≥0.51 имеется высокий риск развития преэклампсии.
Список литературы:
1. Плацентарное ложе и преэклампсия [Текст]. / З.С. Ходжаева, Е.А. Коган, А.Д. Сафонова [и др.] // Акушерство и гинекология. - 2013. - №12. - С. 10-15.
2. Are early and late preeclampsia distinct subclasses of the disease - what does the placenta reveal? [Text]. / J.L. van der Merwe, D.R. Hall, C. Wright [et al.] // Hypertens. Pregnancy. - 2010. - Vol. 29 №4. - P. 457-467.
3. Клинико-анамнестические факторы риска развития преэклампсии у беременных [Текст]. / Н.Е. Кан, Л.Е. Беднягин, Н.В. Долгушина [и др.] // Акушерство и гинекология. - 2016. - №6. - С. 39-45.
4. Combined screening for early detection of pre-eclampsia [Text]. / H.J. Park, S.S. Shim, D.H. Cha // Int. J. Mol. Sci. - 2015. - Vol. 16 №8. - P. 17952-17974.
5. Combined screening for early detection of pre-eclampsia [Text]. / H.J. Park, S.S. Shim, D.H. Cha // Int. J. Mol. Sci. - 2015. - Vol. 16 №8. - P. 17952-17974.
6. Circulating angiogenic factors and the risk of preeclampsia [Text]. / R.J. Levine, S.E. Maynard, C. Qian [et al.] // N. Engl. J. Med. - 2004. - Vol. 350 №7. - P. 672-683.
7. Serum placental growth factor in the three trimesters of pregnancy: effects of maternal characteristics and medical history [Text]. / A. Tsiakkas, N. Duvdevani, A. Wright [et al.] // Ultrasound Obstet. Gynecol. - 2015. - Vol. 45 №5. - P. 591-598.
8. Serum placental growth factor in the three trimesters of pregnancy: effects of maternal characteristics and medical history [Text]. / A. Tsiakkas, N. Duvdevani, A. Wright [et al.] // Ultrasound Obstet. Gynecol. - 2015. - Vol. 45 №5. - P. 591-598.
9. Placental growth factor and pre-eclampsia [Text]. / K. Chau, A. Hennessy, A. Makris // J. Hum. Hypertens. - 2017. - Vol. 31 №12. - P. 782-786.
10. Screening models using multiple markers for early detection of late-onset pre-eclampsia in low-risk pregnancy [Text]. / H.J. Park, S.H. Kim, Y.W. Jung [et al.] // BMC Pregnancy Childbirth. - 2014. - №14. - P. 35.
11. Pre-eclampsia: molecular events to biomarkers [Text]. / B.K. Sahai, S. Saraswathy, T.P. Yadav [et al.] // Med. J. Armed. Forces India. - 2017. - Vol. 73. №2. - P. 167-174.
12. Elevation of both maternal and fetal extracellular circulating deoxyribonucleic acid concentrations in the plasma of pregnant women with preeclampsia [Text]. / X.Y. Zhong, H.L. Laivuori, J.C. Livingston [et al.] // Am. J. Obstet. Gynecol. - 2001. - Vol. 184. №3. - P. 414-419.
13. Hemolysis, elevated liver enzymes, and low platelet count (HELLP) syndrom as a complication of pre-eclapmsia in pregnant women increases the amount of cell-free fetal and maternal DNA in maternal plasma and serum [Text]. / D.W. Swinkels, J.B. de Kok, J.C.M. Hendriks [et al.] // Clin. Chem. - 2002. - Vol. 48. №4. - P. 650-653.
14. Cell-free fetal DNA in the plasma of pregnant women with fetal growth restriction [Text]. / A. Sekizawa, M. Jimbo, H. Saito [et al.] // Am. J. Obstet. Gynecol. - 2003. - Vol. 188. №2. - P. 480-484.
15. Quantitative aberrations of hypermethylated RASSF1A gene sequences in maternal plasma in pre-eclampsia [Text]. / D.W.Y. Tsui, K.C.A. Chan, S.S.C. Chim [et al.] // Prenat. Diagn. - 2007. - №27. - P. 1212-1218.
16. Quantification of cell free fetal DNA in maternal plasma in normal pregnancies and in pregnancies with placental dysfunction [Text]. / M.S. Alberry, D.G. Maddocks, M.A. Hadi [et al.] // Am. J. Obstet. Gynecol. - 2009. - Vol. 200. №1. - P. 98.e1-98.e6.
17. Quantification and application of the placental epigenetic signature of the RASSF1A gene in maternal plasma [Text]. / F. Zhao, J. Wang, R. Liu [et al.] // Prenat. Diagn. - 2010. №30. - P. 778-782.
18. Circulating maternal total cell-free DNA, cell-free fetal DNA and soluble endoglin levels in preeclampsia: predictors of adverse fetal outcome? A cohort study [Text]. / R.M. AbdelHalim, D.I. Ramadan, R. Zeyada [et al.] // Mol. Diagn. Ther. - 2016. №20. - P. 135-149.
19. Hypermethylated RASSF1A in maternal plasma: A universal fetal DNA marker that improves the reliability of noninvasive prenatal diagnosis [Text]. / K.C. Chan, C. Ding, A. Gerovassili [et al.] // Clin. Chem. - 2006. - Vol. 52 №12. - P. 2211-2218.
Фиг. 1.
Содержание внеклеточной ДНК плода при ПЭ и неосложненном течении беременности.
Фиг. 2.
ROC-анализ внеклеточной ДНК плода в 11-14 недель беременности.
Фиг. 3.
ROC-кривая, описывающая прогнозирование ПЭ на основании построенной модели.