АНТИМЕТАНОГЕННЫЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] По настоящей заявке испрашивается приоритет на основании предварительных заявок на патент США №№ 62/036948, поданной 13 августа 2014 г.; 62/043649, поданной 29 августа 2014 г.; 62/043789, поданной 29 августа 2014 г.; и 62/141355, поданной 1 апреля 2015 г., полное содержание которых включено в данный документ посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[002] Настоящее изобретение частично относится к способам и композициям для лечения расстройств, связанных с метаногенами, таких как, например, синдром раздраженного кишечника (СРК).
УРОВЕНЬ ТЕХНИКИ
[003] Микробиом человека играет важную роль как в поддержании здоровья, так и в развитии заболевания. В то время как большинство микроорганизмов, населяющих желудочно-кишечный тракт человека и животных, оказывает благоприятное влияние, например, помогая перевариванию важных питательных веществ, известно, что меньшая часть микроорганизмов, которые ранее считались «симбиотическими» организмами, играют определенную роль в патогенезе различных заболеваний.
[004] Только в США синдром раздраженного кишечника (СРК) поражает около 30 миллионов человек. СРК является функциональным расстройством желудочно-кишечного тракта (ЖКТ), которое приводит к боли и/или ощущению дискомфорта в животе, наряду с изменениями характера дефекации. СРК подразделяется на четыре подтипа на основе консистенции стула человека: СРК, связанный с преобладанием запоров (СРК-З); СРК, связанный с преобладанием диареи (СРК-Д); смешанный (или перемежающийся) СРК (СРК-С или СРК-П); и не относящийся к какому-либо подтипу (или неопределенный) СРК (СРК-Н).
[005] Недавние исследования показали, что некоторые обитающие в кишечнике микроорганизмы, продуцирующие метан, известные как метаногены, могут являться причиной возникновения запора. В частности, исследования указывают на связь между продукцией метана (CH4) в кишечнике и запором при СРК-З, а также хроническим идиопатическим запором (ХИЗ). Продукция метана (CH4) у людей происходит вследствие наличия в кишечнике метаногенных архей. Эти организмы выполняют критически важную биологическую функцию, заключающуюся в удалении побочных продуктов бактериальной ферментации полисахаридов, в частности газообразного водорода (H2) и короткоцепочечных жирных кислот (КЦЖК). Преобладающими метаногенами, населяющим кишечник человека, являются археи Methanobrevibacter smithii (M. smithii). In vitro тестирование чувствительности продемонстрировало, что метаногены, такие как M. smithii, обладают высокой устойчивостью к большинству классов антибиотиков. Кроме того, полное уничтожение кишечных метаногенов после применения одного курса терапии с применением антибиотиков широкого спектра действия маловероятно, поскольку приводит к реколонизации метаногенами и возврату метаногенеза к патогенным уровням. Непрерывное использование антибиотиков связано с различными побочными эффектами и повышенным риском развития резистентности к антибиотикам. Кроме того, длительное применение антибиотиков может дополнительно нарушать потенциально полезный бактериальный кишечный микробиом и желудочно-кишечную флору.
[006] При лечении таких заболеваний, как СРК, все еще остается потребность в безопасных и эффективных подходах к долгосрочному подавлению кишечного метаногенеза и/или чрезмерной продукции метана.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[007] Соответственно, в настоящем изобретении предложены, среди прочего, улучшенные способы и составы для лечения различных расстройств, связанных с метаногенами. В одном аспекте настоящее изобретение относится к композициям и применению составов с модифицированным высвобождением, которые содержат по меньшей мере один антиметаногенный агент, включая, например, молекулы гидроксикислот статинов, которые, без связи с какой-либо теорией, как правило, являются эффективными ингибиторами 3-гидрокси-3-метил-глутарил-кофермента A (ГМГ-КоА)-редуктазы, и лактонов статинов, которые, без связи с какой-либо теорией, как правило, являются неэффективными ингибиторами ГМГ-КоА-редуктазы (вместе называются «антиметаногенные статины»). В различных вариантах реализации изобретения составы и способы, описанные в данном документе, уничтожают или уменьшают продукцию метана, которая является причиной или коррелирует с различными расстройствами, связанными с метаногенами, включая, например, СРК (например, СРК-З), сахарный диабет и ожирение. В различных вариантах реализации изобретения составы и способы, описанные в данном документе, оказывают целевое действие на желудочно-кишечный тракт (ЖКТ) и, таким образом, обеспечивают специфическую доставку к участку колонизации метаногенами и/или к участку продукции и/или накопления метана, одновременно предотвращая или уменьшая системное воздействие антиметаногенных статинов и сводя к минимуму их системные эффекты. Таким образом, в настоящем изобретении предложены эффективные способы лечения, предотвращающие появление побочных эффектов, связанных с продолжительным системным введением статинов (например, мышечная боль, отклонения в анализах печеночных ферментов и т. п.). Кроме того, в некоторых вариантах реализации настоящего изобретения неожиданно наблюдается лечение расстройств кишечника, несмотря на сообщения, связанные с использованием статинов при этом расстройстве, например, запоров (см., например, публикацию Fernandes et al. Possible association between statin use and bowel dysmotility. BMJ Case Reports 2012; 10.1136/bcr.10.2011.4918 and Merck Global Medical Information. Professional Information Response UK11-010274, полное содержание которой включено в данный документ посредством ссылки). Кроме того, в некоторых вариантах реализации настоящего изобретения неожиданно наблюдается лечение сахарного диабета, несмотря на сообщения, связанные с использованием статинов при этом расстройстве (см., например, публикацию Naci et al., Comparative tolerability and harms of individual statins: a study-level network meta-analysis of 246 955 participants from 135 randomized, controlled trials. Circ Cardiovasc Qual Outcomes 6 (4): 390-9, полное содержание которой включено в данный документ посредством ссылки).
[008] В некоторых вариантах реализации изобретения составы с модифицированным высвобождением высвобождают по меньшей мере 60% антиметаногенного агента, например, антиметаногенных статинов, в области ниже желудка и в одной или более областях желудочно-кишечного тракта. В некоторых вариантах реализации изобретения состав высвобождает антиметаногенный статин в тонкой кишке, включая одну или более из двенадцатиперстной кишки, тощей кишки и подвздошной кишки. В других вариантах реализации изобретения состав высвобождает антиметаногенный статин в толстой кишке (например, в одной или более из слепой кишки, восходящей, поперечной, нисходящей или сигмовидной частей ободочной кишки и прямой кишки).
[009] В различных вариантах реализации изобретения антиметаногенный статин выбран из аторвастатина, церивастатина, далвастатина, эптастатина, флуиндостатина, флувастатина, ловастатина, мевастатина, питавастатина, правастатина, розувастатина, симвастатина, велостатина и их фармацевтически приемлемых солей, стереоизомеров или их пролекарственных производных. В некоторых вариантах реализации изобретения антиметаногенный статин выбран из ловастатина, правастатина и симвастатина. В одном варианте реализации изобретения статин представляет собой правастатин и его фармацевтически приемлемые соли, стереоизомеры или его пролекарственные производные. В другом варианте реализации изобретения антиметаногенный статин представляет собой ловастатин и его фармацевтически приемлемые соли, стереоизомеры или его пролекарственные производные. В одном варианте реализации изобретения антиметаногенный статин представляет собой симвастатин и его фармацевтически приемлемые соли, стереоизомеры или его пролекарственные производные. В некоторых вариантах реализации изобретения антиметаногенный статин представляет собой лактон или ß-гидроксикислоту. В некоторых вариантах реализации изобретения антиметаногенный статин представляет собой лактон ловастатина.
[010] В различных вариантах реализации изобретения состав с модифицированным высвобождением вводят нуждающемуся в этом субъекту перорально. В одном варианте реализации изобретения состав может быть в форме капсулы или таблетки. В одном варианте реализации изобретения состав имеет оболочку с модифицированным высвобождением, которая является по существу стабильной в желудочном соке. В другом варианте реализации изобретения оболочка с модифицированным высвобождением может разлагаться микробным ферментом, присутствующим в кишечной флоре. В дополнительном варианте реализации изобретения оболочка с модифицированным высвобождением может обладать pH-зависимой растворимостью и/или стабильностью. В других вариантах реализации изобретения оболочка с модифицированным высвобождением может иметь зависимый от времени профиль разрушения.
[011] В различных вариантах реализации изобретения состав с модифицированным высвобождением содержит первую дозу по меньшей мере одного антиметаногенного статина и вторую дозу по меньшей мере одного антиметаногенного статина (например, первая и вторая дозы могут представлять собой данную дозу одного или разных антиметаногенных статинов, или первая и вторая дозы могут представлять собой одинаковые или разные дозы одного антиметаногенного статина). В различных вариантах реализации изобретения первая доза и вторая доза высвобождаются в разное время и/или при разных уровнях pH и в разных областях желудочно-кишечного тракта. В некоторых вариантах реализации изобретения первая и/или вторая доза по меньшей мере одного антиметаногенного статина инкапсулирована в частице ядра. Оболочка с модифицированным высвобождением может быть нанесена поверх частицы ядра с получением частицы с модифицированным высвобождением. В некоторых вариантах реализации изобретения состав содержит множество частиц с модифицированным высвобождением. В иллюстративном варианте реализации изобретения состав может быть в форме капсулы. В другом варианте реализации изобретения первая и вторая доза по меньшей мере одного антиметаногенного статина инкапсулированы в слое. Оболочка с модифицированным высвобождением может быть нанесена поверх слоя с получением слоя с модифицированным высвобождением. В некоторых вариантах реализации изобретения состав содержит множество слоев с модифицированным высвобождением. В иллюстративном варианте реализации изобретения состав может быть в форме многослойной таблетки.
[012] В некоторых вариантах реализации изобретения первая доза и вторая доза антиметаногенных статинов высвобождаются в разное время и/или при разных уровнях pH. В иллюстративных вариантах реализации изобретения первая доза может высвобождать антиметаногенный статин в двенадцатиперстной кишке, тогда как вторая доза может высвобождать антиметаногенный статин в подвздошной кишке. В других вариантах реализации изобретения первая доза может высвобождать антиметаногенный статин в тонкой кишке, тогда как вторая доза может высвобождать антиметаногенный статин в толстой кишке.
[013] Составы по настоящему изобретению могут дополнительно содержать фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах реализации изобретения состав может дополнительно содержать агент, который предотвращает или замедляет раскрытие лактонного кольца, такой как ингибитор эстеразы (например, грейпфрутовый сок; включая компоненты флавоноидов, такие как, например, нарингенин, кемпферол, морин, галангин, и кверцетин; вкусоароматические смеси сложных эфиров, например, из клубничного сока (например, фенилбензоат, пропилпарабен, фенэтилизобутират, бакампициллин, талампициллин, н-толилбензоат, этилпарабен, диэтилфталат, октилацетат и пивампициллин) и/или ингибитор параоксоназы (например, ингибитор PON1 или PON3). В некоторых вариантах реализации изобретения состав может дополнительно содержать ингибитор транспортера транспортного полипептида органических анионов (OATP), такой как один или более из экстракта зеленого чая, галлата эпикатехина (ECG) и галлата эпигаллокатехина (EGCG). В некоторых вариантах реализации изобретения ингибитор OATP высвобождается перед высвобождением статина. Составы по настоящему изобретению также могут дополнительно содержать дополнительный терапевтический агент, такой как, в качестве неограничивающего примера, прокинетический агент.
[014] В одном аспекте в настоящем изобретении предложены способы подавления или снижения метаногенеза и/или накопления метана посредством введения нуждающемуся в этом субъекту составов, описанных в данном документе. В некоторых вариантах реализации изобретения субъект страдает от СРК, например СРК-З. В других вариантах реализации изобретения субъект страдает от ожирения. В еще одном варианте реализации изобретения субъект страдает от сахарного диабета. В различных аспектах в настоящем изобретении предложены способы лечения или профилактики связанного с метаногенами расстройства, необязательно выбранного из одного или более из СРК, например СРК-З, сахарного диабета и ожирения, посредством введения нуждающемуся в этом субъекту составов, описанных в данном документе.
[015] В другом аспекте в настоящем изобретении также предложены способы лечения запора посредством введения нуждающемуся в этом субъекту составов, описанных в данном документе. В дополнительном аспекте изобретения предложены способы лечения (например, уменьшения или устранения) продукции метана в кишечнике посредством введения нуждающемуся в этом субъекту составов, описанных в данном документе.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
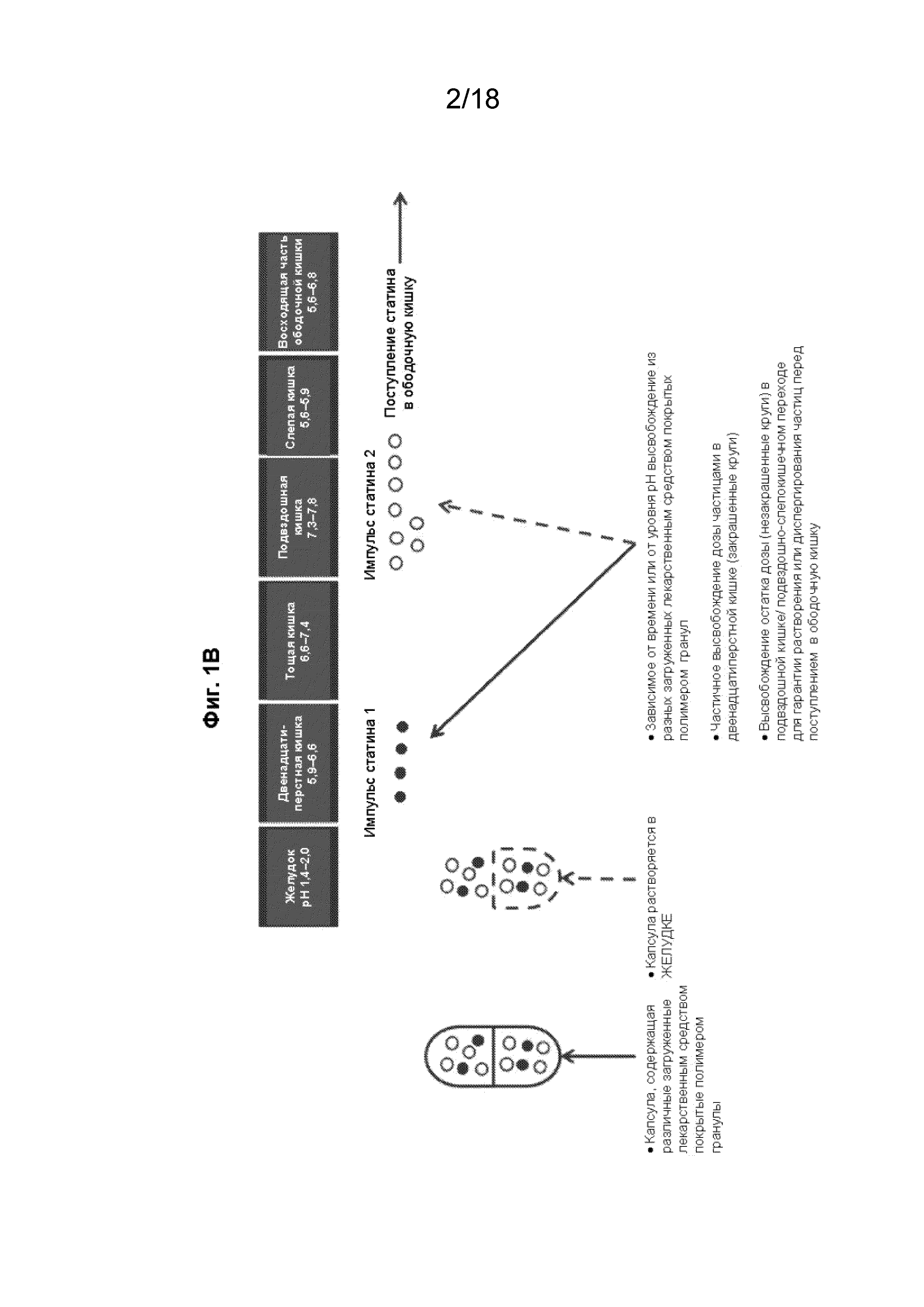
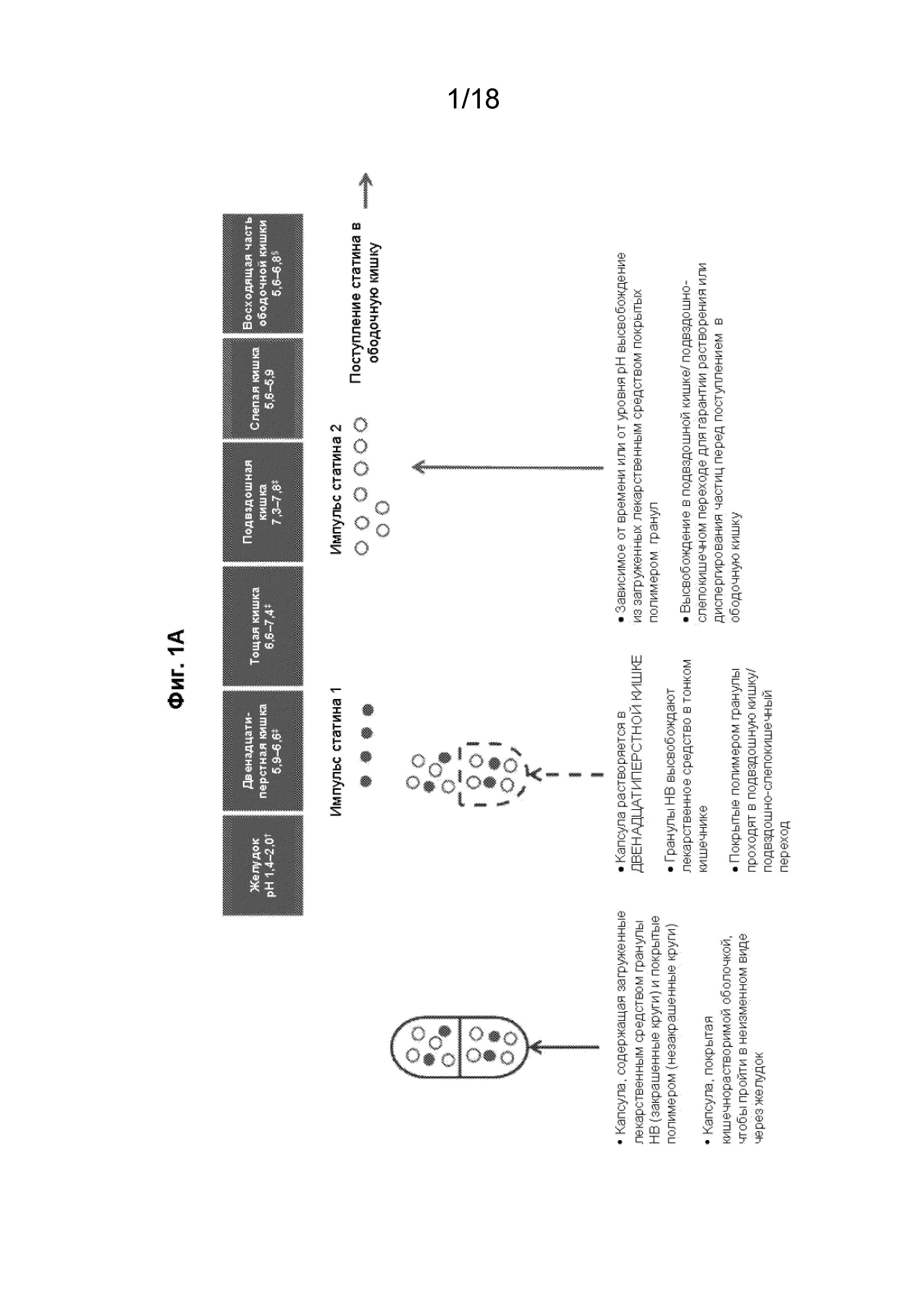
[016] На Фиг. 1, панелях A и B, проиллюстрированы некоторые варианты реализации состава с модифицированным высвобождением в форме инкапсулированных гранул, которые высвобождают первую дозу статина в двенадцатиперстной кишке, а вторую дозу статина - в подвздошной кишке.
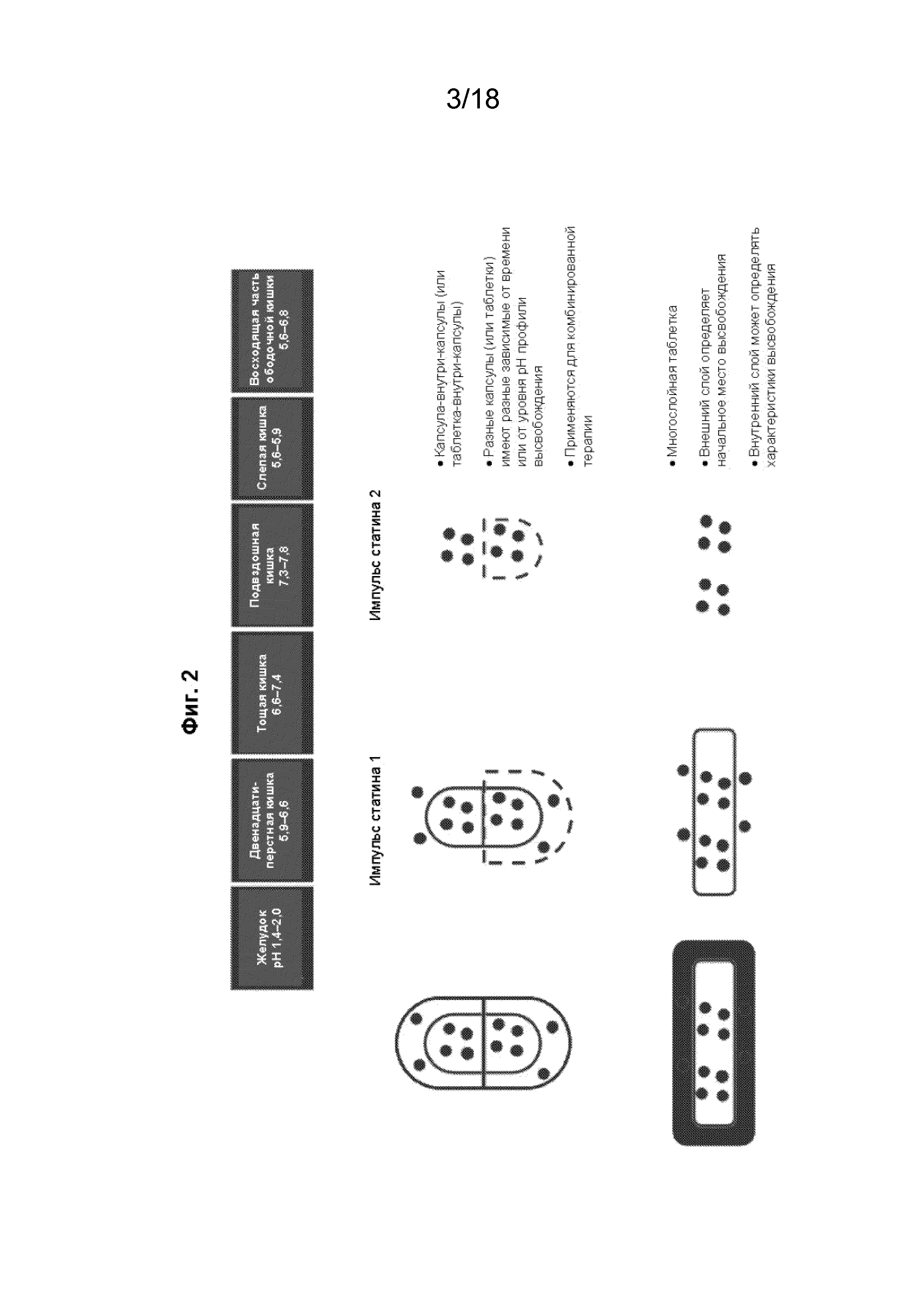
[017] На Фиг. 2 проиллюстррованы варианты реализации составов с модифицированным высвобождением в виде многослойных капсул или таблеток для доставки статинов в кишечник (показан иллюстративный коммерческий материал; в данной области техники известны родственные материалы).
[018] На Фиг. 3, панелях A и B, проиллюстрированы варианты реализации составов с модифицированным высвобождением для доставки в ободочную кишку (показан иллюстративный коммерческий материал; в данной области техники известны родственные материалы).
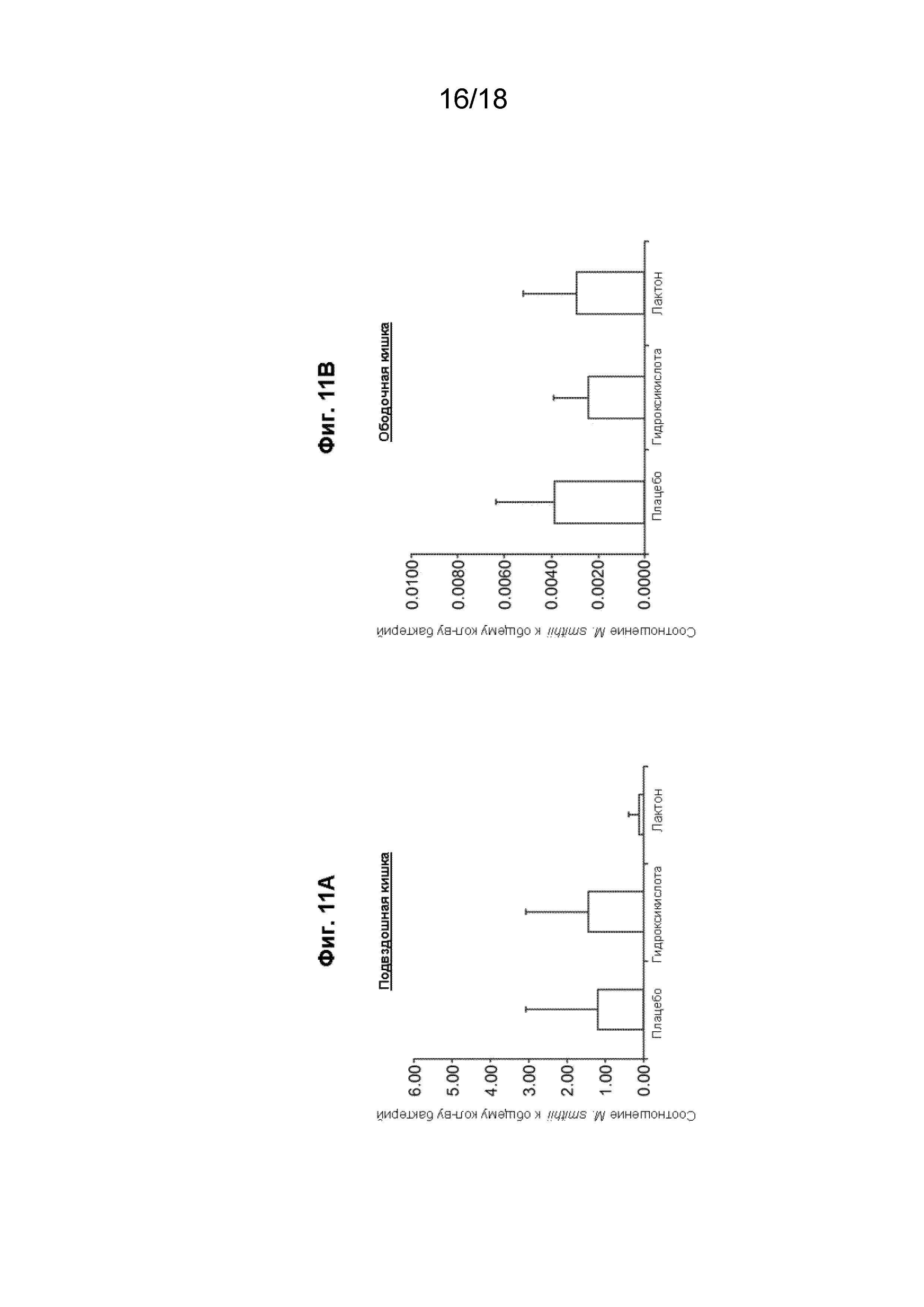
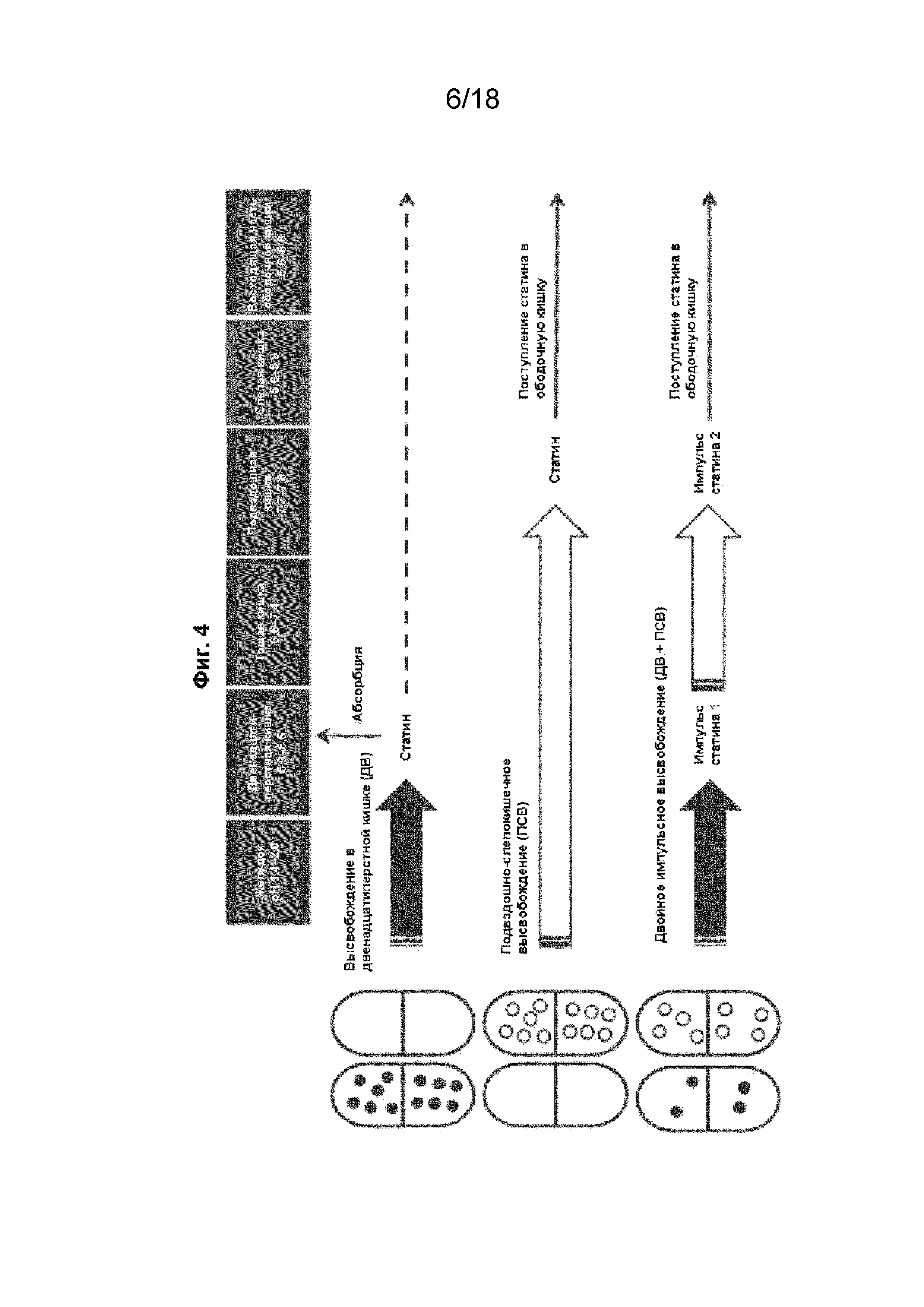
[019] На Фиг. 4 проиллюстрированы различные варианты реализации составов с модифицированным высвобождением в форме капсул, которые доставляют одну или две дозы статина в кишечник.
[020] На Фиг. 5 проиллюстрирован профиль высвобождения ловастатина из состава SYN-010 (21 мг).
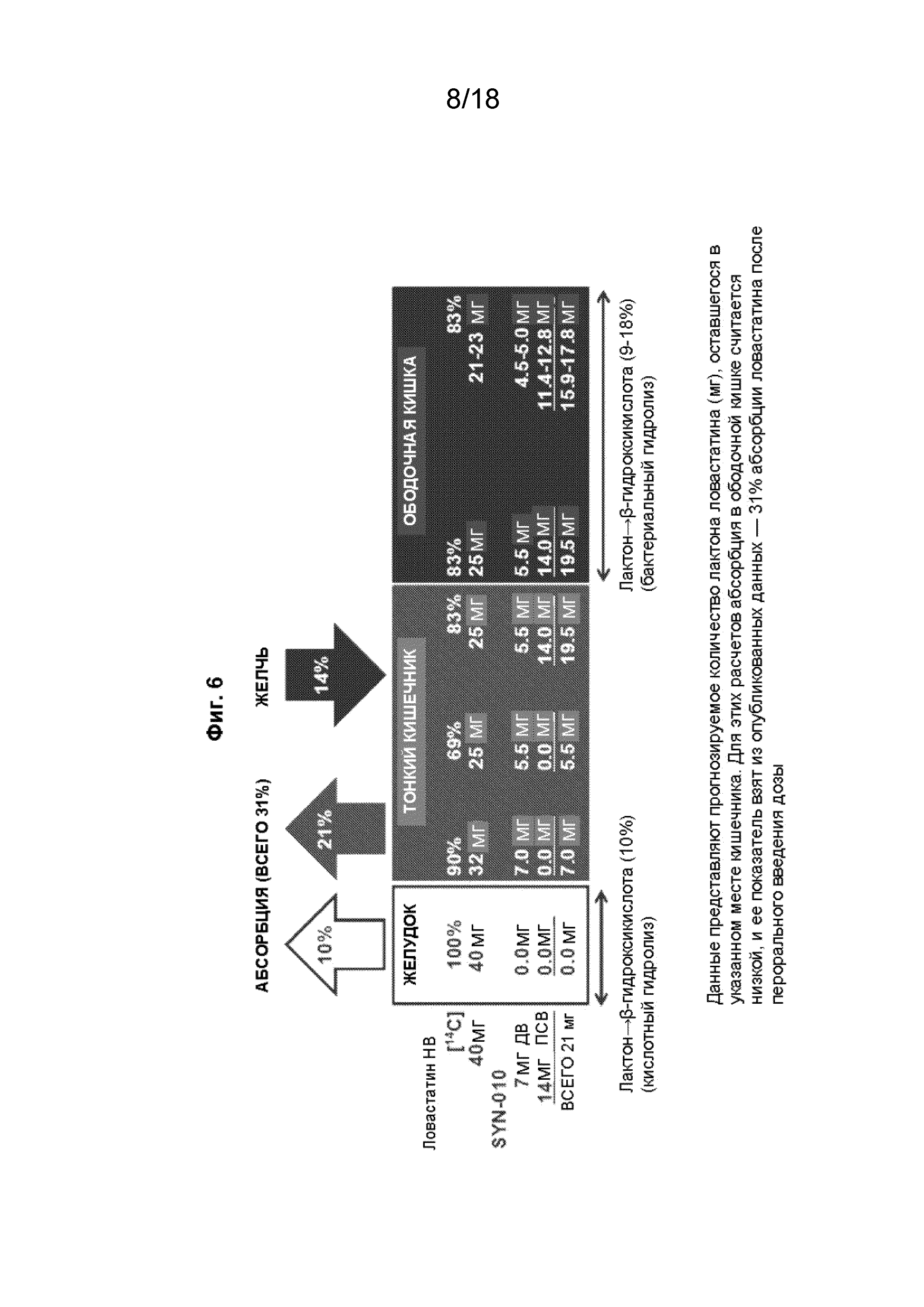
[021] На Фиг. 6 проиллюстрированы прогнозируемые уровни лактона ловастатина в желудочно-кишечном тракте после перорального введения.
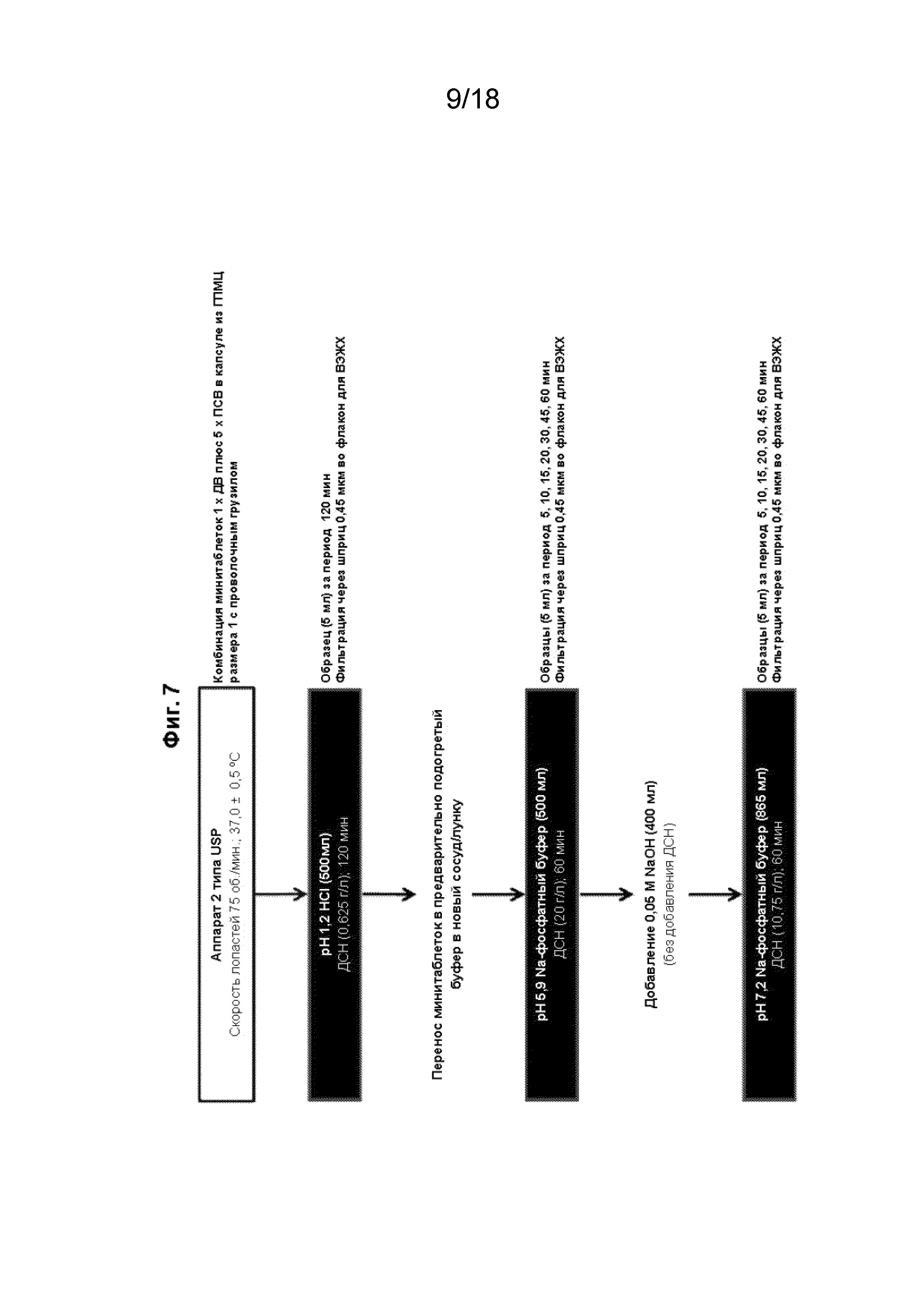
[022] На Фиг. 7 проиллюстрирована методика растворения, используемая для оценки высвобождения ловастатина из покрытых кишечнорастворимой оболочкой минитаблеток при разных значениях pH.
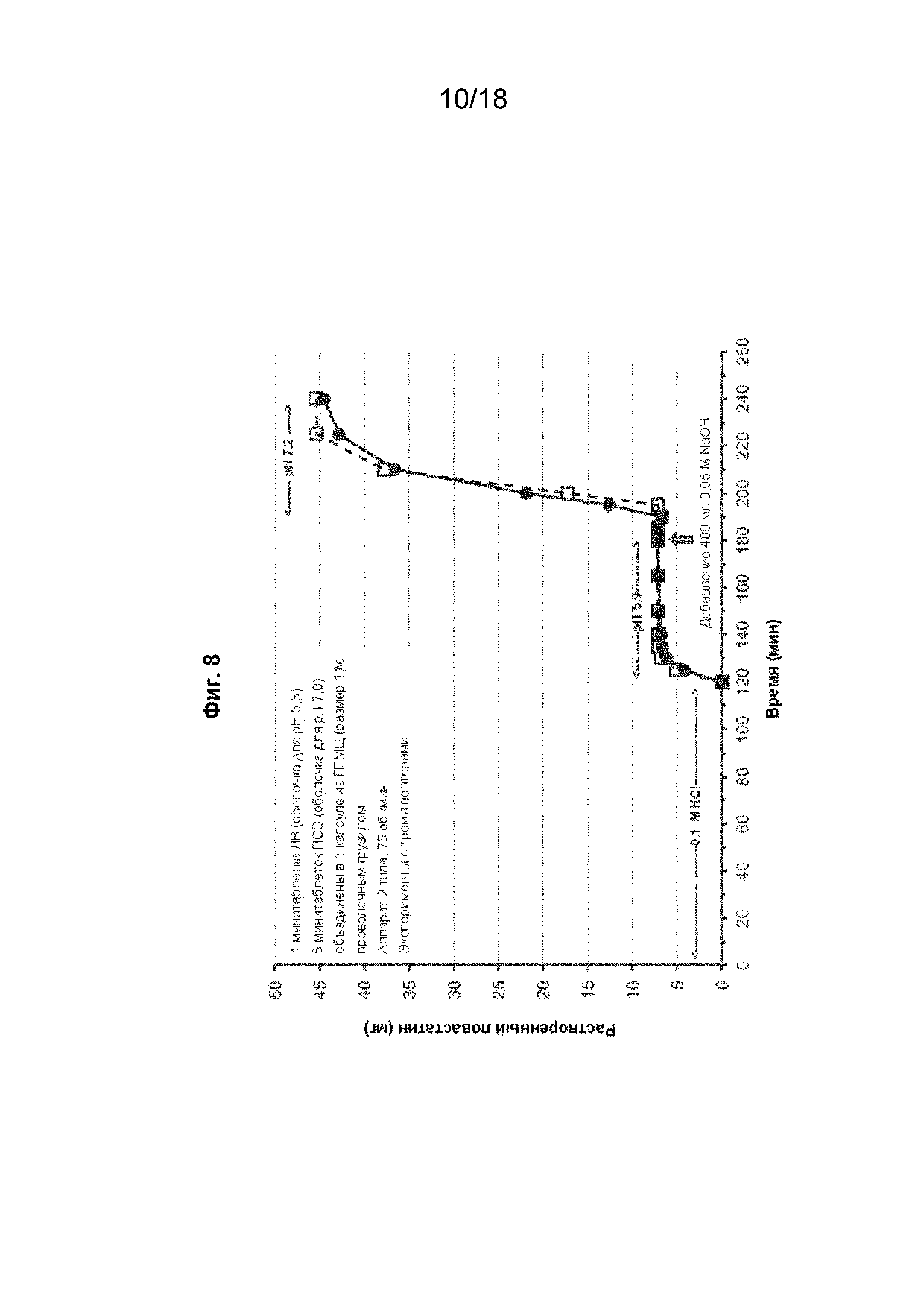
[023] На Фиг. 8 проиллюстрирован профиль растворения капсулы SYN-010 (42 мг) в аппарате 2-го типа при разных значениях pH.
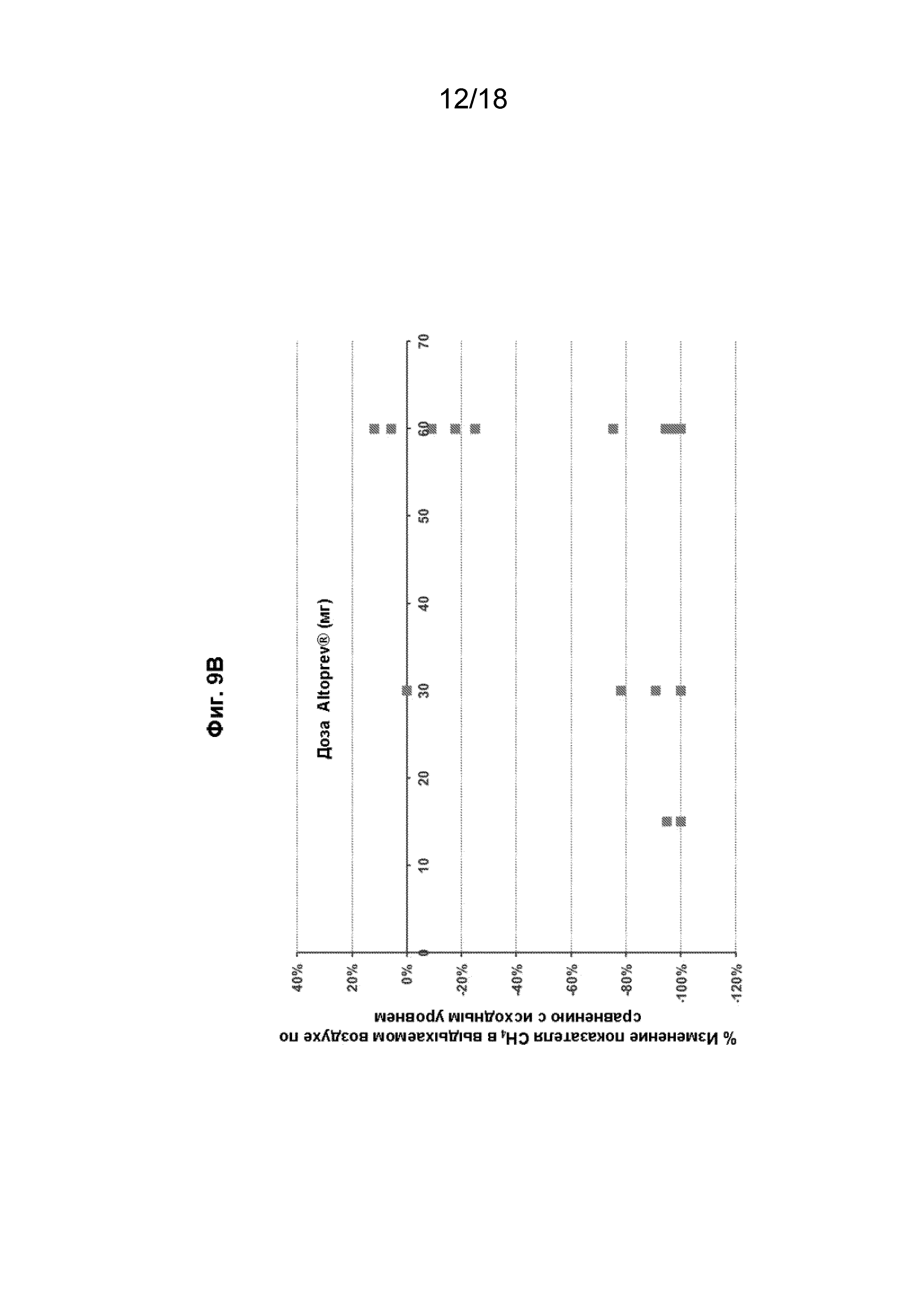
[024] На Фиг. 9 проиллюстрированы результаты обзора амбулаторных карт и историй болезни. На Фиг. 9A проиллюстрировано абсолютное изменение, а на Фиг. 9B проиллюстрировано процентное изменение уровня метана в выдыхаемом воздухе относительно исходного уровня в зависимости от дозы ALTOPREV (15, 30 или 60 мг ежедневно). На Фиг. 9C проиллюстрированоабсолютное изменение, а на Фиг. 9D проиллюстрировано процентное изменение уровня метана в выдыхаемом воздухе по сравнению с исходным уровнем метана в выдыхаемом воздухе (м.д.) у пациентов, которых лечили ALTOPREV (15, 30 или 60 мг ежедневно).
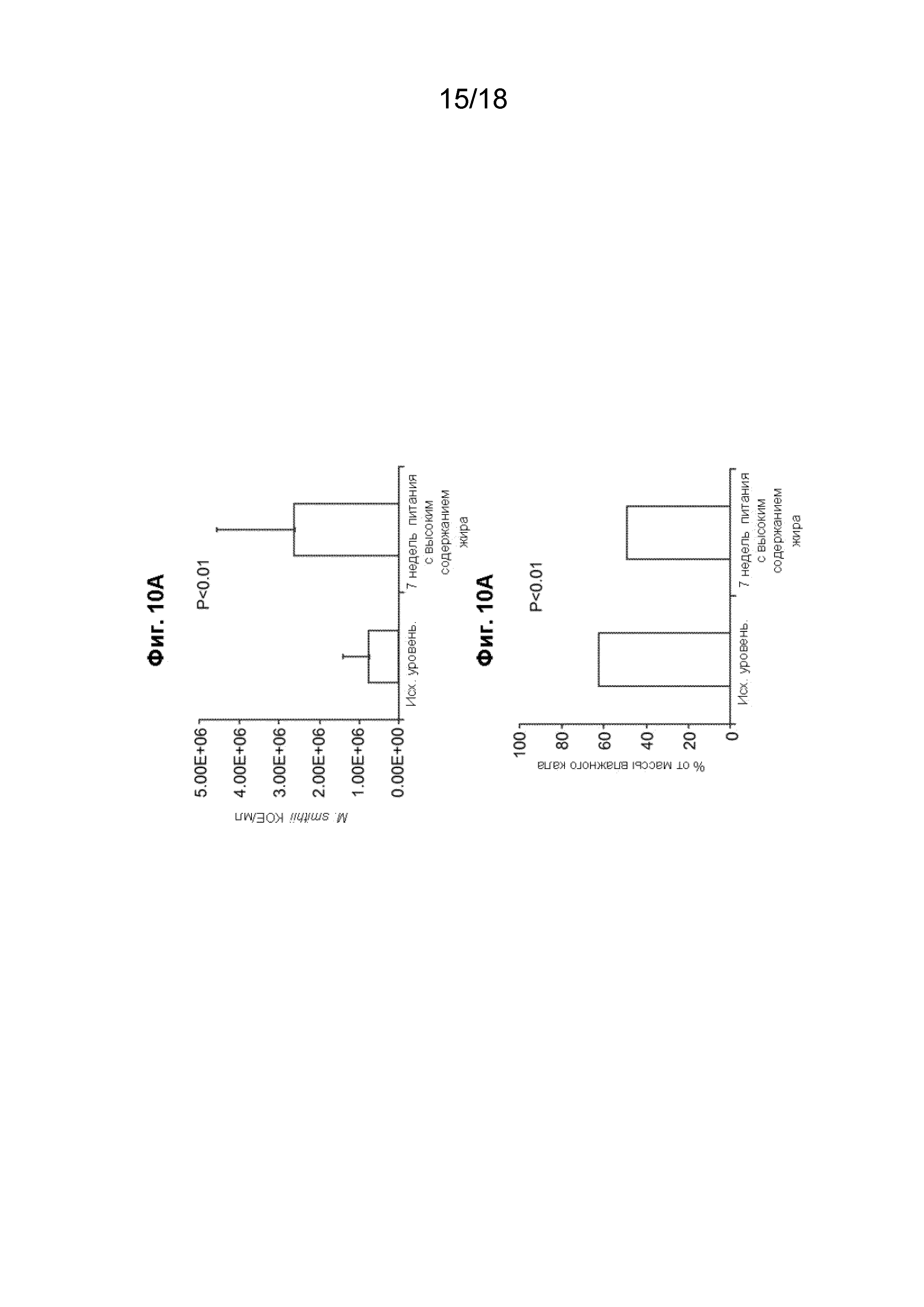
[025] На Фиг. 10A проиллюстрировано, что рацион питания с высоким содержанием жира в течение 7 недель увеличивал колонизацию кала M. smithii у крыс. На Фиг. 10B проиллюстрировано, что рацион питания с высоким содержанием жира также уменьшал массу влажного кала у крыс.
[026] На Фиг. 11 проиллюстрировано, что после введения ловастатина соотношение M. smithii и общего числа бактерий в подвздошной кишке уменьшилось.
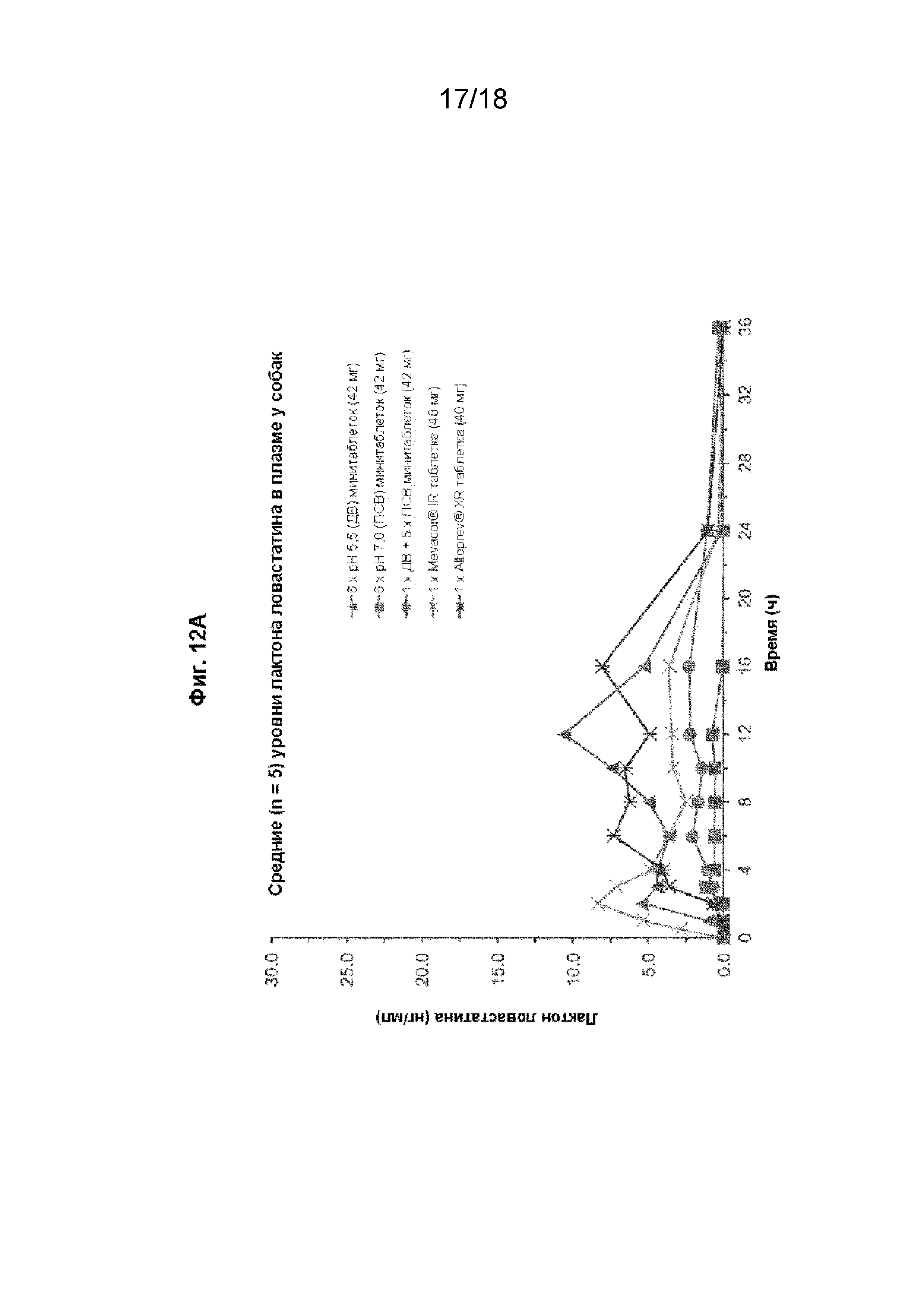
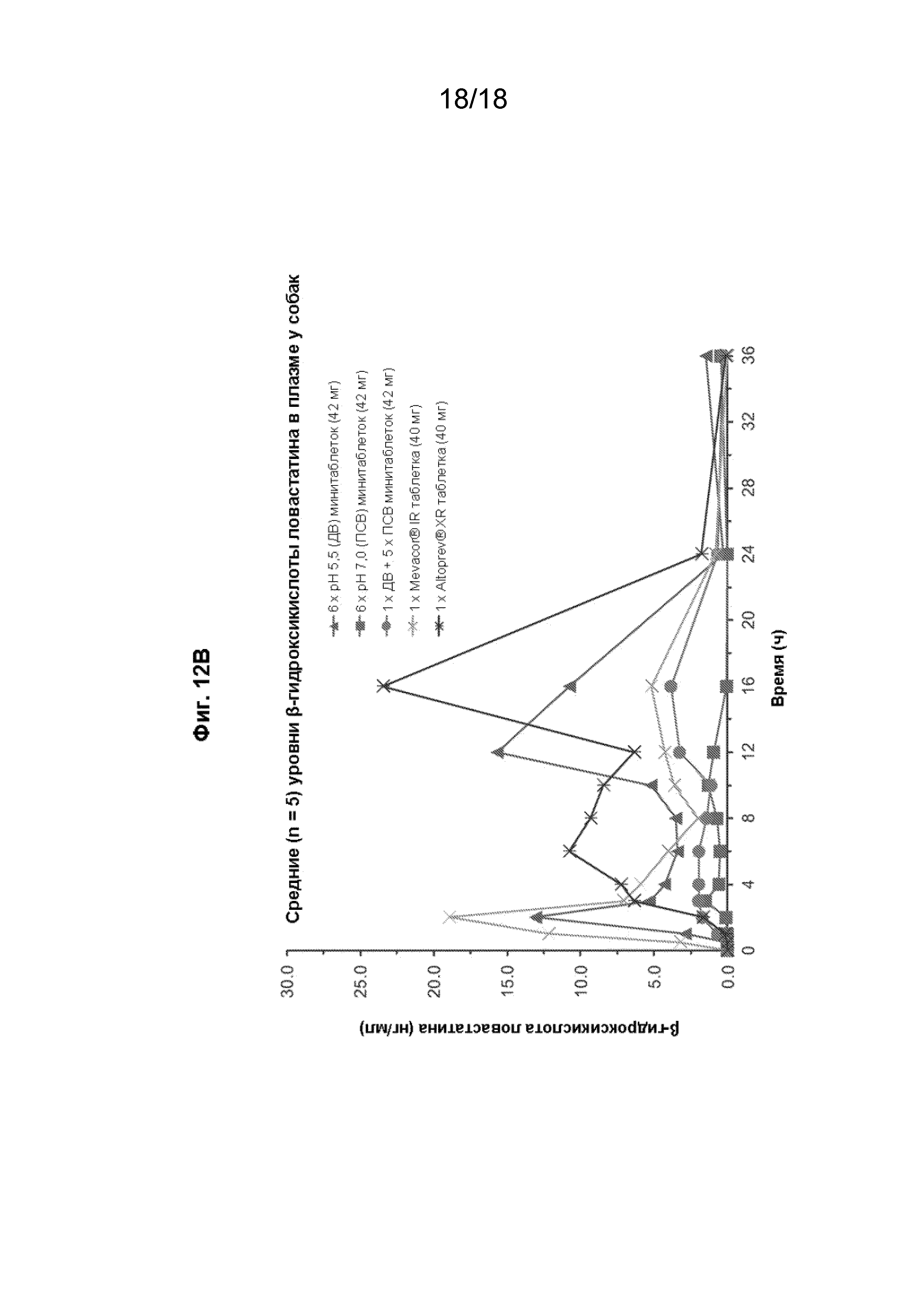
[027] На Фиг. 12 проиллюстрированы профили средней (n=5) концентрации в плазме с течением времени для лактона ловастатина (панель A) и ß-гидроксикислоты ловастатина (панель B) после перорального введения различных составов ловастатина собакам породы бигль.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[028] Настоящее изобретение основано, в частности, на неожиданном открытии составов и способов, которые полезны для эффективного лечения или профилактики расстройств, связанных с метаногенами, одновременно предотвращающих появление побочных эффектов. В настоящем изобретении предложены, среди прочего, составы с модифицированным высвобождением, содержащие один или более антиметаногенных статинов, полезных, например, для лечения расстройств, связанных с метаногенами, таких как, например, СРК (включая, например, СРК-З).
[029] В контексте данного документа «антиметаногенный статин» или «статин» относится к классу соединений, известных в данной области техники как ингибиторы ГМГ-КоА-редуктазы, используемых в качестве гиполипидемических средств. Однако существующее использование соединений статинов не обязательно подразумевает их механизм действия в лечении метаногенеза. Таким образом, в некоторых вариантах реализации изобретения статин может ингибировать фермент ГМГ-КоА-редуктазу, тогда как в других вариантах он может иметь другой способ обеспечения эффекта. Например, статин может оказывать целевое воздействие на метаногенный фермент, такой как, например, один или более из алкогольдегидрогеназы adh; формиатдегидрогеназы fdh; F420-зависимой НАДФ-оксидоредуктазы fno; формил-MF:H4MPT-формилтрансферазы ftr; формил-MF дегидрогеназы fwd; метилен-H4MPT-дегидрогеназы hmd; метенил-H4MPT-циклогидролазы mch; F420-зависимой метилен-H4MPT-дегидрогеназы mtd; F420-зависимой метилен-H4MPT-редуктазы mer; метил-H4MPT:CoM-метилтрансферазы mtr; метил-CoM-редуктазы mcr; и метанол:кобаламин метилтрансферазы (7) системы гетеродисульфид-редуктазы mtaB. В некоторых вариантах реализации изобретения статин по существу не ингибирует фермент ГМГ-КоА-редуктазу.
[030] Системное применение статинов было связано с неблагоприятными побочными эффектами, такими как повышение уровней печеночных ферментов и мышечные проблемы (например, миалгии, рабдомиолиз и тяжелая миопатия). Кроме того, системное применение статинов у некоторых пациентов было связано с расстройствами пищеварения. Составы с модифицированным высвобождением по настоящему изобретению сводят к минимуму абсорбцию введенного антиметаногенного статина из кишечника в системный кровоток и уменьшают побочные эффекты или эффекты обострения заболевания, связанные с применением статинов. Кроме того, не всем пациентам с СРК-З или ХИЗ требуется гиполипидемическая терапия, поэтому системная абсорбция статинов из составов с модифицированным высвобождением по настоящему изобретению в идеале будет недостаточной, чтобы обеспечить клинически значимое снижение уровня общего холестерина (общий-Хс), или холестерина липопротеидов низкой плотности (ЛПНП-Х), или аполипопротеина B (Апо B), или триглицеридов (ТГ), или клинически значимое повышение уровня холестерина липопротеидов высокой плотности (ЛПВП-Х) (например, снижение уровней ЛПНП-Х в сыворотке менее чем на 5% за 6 недель).
Профиль модифицированного высвобождения
[031] В одном аспекте в настоящем изобретении предложены составы с модифицированным высвобождением, содержащие по меньшей мере один антиметаногенный агент, причем состав высвобождает по меньшей мере около 60% антиметаногенного агента, такого как антиметаногенные статины, в области ниже желудка и в одной или более областях желудочно-кишечного тракта.
[032] В различных вариантах реализации изобретения антиметаногенный агент представляет собой агент, который может подавлять продукцию метана, подавлять метаногенез или подавлять рост и/или пролиферацию метаногенов. В некоторых аспектах антиметаногенный агент представляет собой молекулу гидроксикислоты статина, которая, без связи с какой-либо теорией, как правило, является эффективным ингибитором ГМГ-КоА-редуктазы, или лактона статина, который, без связи с какой-либо теорией, как правило, является неэффективным ингибитором ГМГ-КоА. В некоторых аспектах антиметаногенный агент называется «антиметаногенным статином» или «статином».
[033] В одном аспекте в настоящем изобретении предложены составы с модифицированным высвобождением, содержащие по меньшей мере один антиметаногенный статин, причем состав высвобождает по меньшей мере 60% антиметаногенного статина в области ниже желудка в одной или более областях желудочно-кишечного тракта.
[034] Иллюстративные статины, пригодные для данного изобретения, включают, но не ограничиваясь ими, аторвастатин, церивастатин, далвастатин, эптастатин, флуиндостатин, флувастатин, ловастатин, мевастатин, питавастатин, правастатин, розувастатин, симвастатин, велостатин и их фармацевтически приемлемые сложные эфиры, пролекарства, соли, сольваты, энантиомеры, стереоизомеры, активные метаболиты, сокристаллы и другие физиологически функциональные производные этих соединений. В одном варианте реализации изобретения статин представляет собой правастатин. В другом варианте реализации изобретения статин представляет собой ловастатин. В еще одном варианте реализации изобретения статин представляет собой симвастатин. В некоторых вариантах реализации изобретения статин представляет собой лактон или гидроксикислоту. В некоторых вариантах реализации изобретения антиметаногенный статин представляет собой одно или более из аторвастатина, церивастатина, далвастатина, эптастатина, флуиндостатина, флувастатина, ловастатина, мевастатина, питавастатина, правастатина, розувастатина, симвастатина, велостатина в форме лактона. В некоторых вариантах реализации изобретения антиметаногенный статин находится в форме гидроксикислоты одного или более из аторвастатина, церивастатина, далвастатина, эптастатина, флуиндостатина, флувастатина, ловастатина, мевастатина, питавастатина, правастатина, розувастатина, симвастатина, велостатина.
[035] В некоторых вариантах реализации изобретения антиметаногенный статин представляет собой одно или более из ловастатина, симвастатина и мевастатина в форме лактона. В некоторых вариантах реализации изобретения антиметаногенный статин представляет собой ловастатин в форме лактона.
[036] В различных вариантах реализации изобретения антиметаногенный статин (например, ловастатин) по существу находится в форме лактона в месте доставки составами настоящего изобретения. Например, в некоторых вариантах реализации изобретения количество доставленного в ЖКТ антиметаногенного статина (например, ловастатина), находящегося в лактонной форме, составляет более чем около 95%, или более чем около 90%, или более чем около 85%, или более чем около 80%, или более чем около 75%, или более чем около 70%, или более чем около 65%, или более чем около 60%, или более чем около 55%, или более чем около 50%, или более чем около 25%.
[037] В различных вариантах реализации изобретения составы с модифицированным высвобождением по настоящему изобретению разработаны для немедленного высвобождения (например, после приема внутрь). В различных вариантах реализации изобретения составы с модифицированным высвобождением могут иметь профили замедленного высвобождения, т. e. медленного высвобождения активного (-ых) ингредиента (-ов) в организме (например, в ЖКТ) в течение продолжительного периода времени. В различных вариантах реализации изобретения составы с модифицированным высвобождением могут иметь профиль отсроченного высвобождения, т. e. не немедленного высвобождения активного (-ых) ингредиента (-ов) после приема внутрь; а скорее отсрочку высвобождения активного (-ых) ингредиента (-ов) до того момента, пока композиция не окажется ниже в желудочно-кишечном тракте; например, для высвобождения в тонкой кишке (например, в одной или более из двенадцатиперстной кишки, тощей кишки, подвздошной кишки) или в толстой кишке (например, в одной или более из слепой кишки, восходящей, поперечной, нисходящей или сигмовидной частей ободочной кишки и прямой кишки). Например, композиция может быть покрыта кишечнорастворимой оболочкой, чтобы отсрочить высвобождение активного (-ых) ингредиента (-ов) до достижения тонкой кишки или толстой кишки. В некоторых вариантах реализации изобретения существенные количества активного (-ых) ингредиента (-ов) составов по настоящему изобретению в кале отсутствуют.
[038] В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает (необязательно в виде первого высвобождения) по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в области ниже желудка в одной или более областях кишечника. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в кишечнике.
[039] В различных вариантах реализации изобретения состав с модифицированным высвобождением высвобождает (необязательно в виде первого высвобождения) антиметаногенный статин в тонкой кишке. В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в тонкой кишке. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в тонкой кишке.
[040] В одном варианте реализации изобретения состав высвобождает (необязательно в виде первого высвобождения) антиметаногенный статин в двенадцатиперстной кишке. В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в двенадцатиперстной кишке. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в двенадцатиперстной кишке.
[041] В другом варианте реализации изобретения состав высвобождает (необязательно в виде первого высвобождения) антиметаногенный статин в тощей кишке. В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в тощей кишке. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в тощей кишке.
[042] В дополнительном варианте реализации изобретения состав высвобождает (необязательно в виде первого высвобождения) антиметаногенный статин в подвздошной кишке и/или в подвздошно-слепокишечном переходе (илеоцекальном клапане). В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в подвздошной кишке и/или в подвздошно-слепокишечном переходе. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в подвздошной кишке и/или в подвздошно-слепокишечном переходе.
[043] В других вариантах реализации изобретения состав с модифицированным высвобождением высвобождает (необязательно в виде первого высвобождения) антиметаногенный статин в толстой кишке. В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в толстой кишке. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в толстой кишке.
[044] В одном варианте реализации изобретения состав с модифицированным высвобождением высвобождает (необязательно в виде первого высвобождения) антиметаногенный статин в слепой кишке. В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в слепой кишке. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в слепой кишке.
[045] В другом варианте реализации изобретения состав с модифицированным высвобождением высвобождает (необязательно в виде первого высвобождения) антиметаногенный статин в восходящей ободочной кишке. В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в восходящей ободочной кишке. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в восходящей ободочной кишке.
[046] В еще одном варианте реализации изобретения антиметаногенный статин высвобождается (необязательно в виде первого высвобождения) в поперечной ободочной кишке. В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в поперечной ободочной кишке. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в поперечной ободочной кишке.
[047] В дополнительном варианте реализации изобретения антиметаногенный статин высвобождается (необязательно в виде первого высвобождения) в нисходящей ободочной кишке. В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в нисходящей ободочной кишке. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в нисходящей ободочной кишке.
[048] В другом варианте реализации изобретения антиметаногенный статин высвобождается (необязательно в виде первого высвобождения) в сигмовидной ободочной кишке. В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению высвобождает по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% или 60% антиметаногенного статина в сигмовидной ободочной кишке. Например, состав с модифицированным высвобождением высвобождает по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% антиметаногенного статина в сигмовидной ободочной кишке.
[049] В некоторых вариантах реализации изобретения состав с модифицированным высвобождением по существу не высвобождает антиметаногенный статин в желудке.
[050] В некоторых вариантах реализации изобретения состав с модифицированным высвобождением представляет собой капсулу из ГПМЦ, заполненную минитаблетками, покрытыми кишечнорастворимой оболочкой, из которых при разных значениях pH кишечника высвобождается ловастатин. Минитаблетки разработаны так, чтобы проходить через желудок в неизменном виде, после чего высвобождать небольшое количество ловастатина в двенадцатиперстной кишке, а основную часть дозы ловастатина - в подвздошно-слепокишечном переходе и ободочной кишке.
[051] В некоторых вариантах реализации изобретения состав с модифицированным высвобождением высвобождает антиметаногенный статин при конкретном уровне pH. Например, в некоторых вариантах реализации изобретения состав с модифицированным высвобождением является по существу стабильным в кислой среде и по существу нестабильным (например, быстро растворяется или становится физически нестабильным) в среде от близкой к нейтральной до щелочной. В некоторых вариантах реализации изобретения стабильность является показателем отсутствия существенного высвобождения, в то время как нестабильность свидетельствует о существенном высвобождении. Например, в некоторых вариантах реализации изобретения состав с модифицированным высвобождением по существу стабилен при уровне pH около 7,0 или меньше, или около 6,5 или меньше, или около 6,0 или меньше, или около 5,5 или меньше, или около 5,0 или меньше, или около 4,5 или меньше, или около 4,0 или меньше, или около 3,5 или меньше, или около 3,0 или меньше, или около 2,5 или меньше, или около 2,0 или меньше, или около 1,5 или меньше, или около 1,0 или меньше. В некоторых вариантах реализации изобретения составы по настоящему изобретению стабильны в областях с более низким уровнем pH и поэтому, например, по существу не высвобождаются в желудке. В некоторых вариантах реализации изобретения состав с модифицированным высвобождением является по существу стабильным при уровне pH от около 1 до около 4 или ниже и по существу нестабилен при более высоких значениях pH. В этих вариантах реализации изобретения состав с модифицированным высвобождением по существу не высвобождается в желудке. В этих вариантах реализации изобретения состав с модифицированным высвобождением по существу высвобождается в тонкой кишке (например, в одной или более из двенадцатиперстной кишки, тощей кишки и подвздошной кишки) и/или в толстой кишке (например, в одной или более из слепой кишки, восходящей ободочной кишки, поперечной ободочной кишки, нисходящей ободочной кишки и сигмовидной ободочной кишки). В некоторых вариантах реализации изобретения состав с модифицированным высвобождением является по существу стабильным при уровне pH от около 4 до около 5 или ниже и, следовательно, по существу нестабильным при более высоких значениях pH и, таким образом, по существу не высвобождается в желудке и/или тонкой кишке (например, в одной или более из двенадцатиперстной кишки, тощей кишки и подвздошной кишки). В этих вариантах реализации изобретения состав с модифицированным высвобождением по существу высвобождается в толстой кишке (например, в одной или более из слепой кишки, восходящей ободочной кишки, поперечной ободочной кишки, нисходящей ободочной кишки и сигмовидной ободочной кишки). В различных вариантах реализации изобретения значения pH, упомянутые в данном документе, можно регулировать так, как известно в данной области техники, с учетом состояния субъекта, например, в зависимости от состояния натощак или после приема пищи.
[052] В некоторых вариантах реализации изобретения состав с модифицированным высвобождением является по существу стабильным в желудочном соке и по существу нестабильным в кишечном соке и, соответственно, по существу высвобождается в тонкой кишке (например, в одной или более из двенадцатиперстной кишки, тощей кишки и подвздошной кишки) и/или в толстой кишке (например, в одной или более из слепой кишки, восходящей ободочной кишки, поперечной ободочной кишки, нисходящей ободочной кишки и сигмовидной ободочной кишки).
[053] В некоторых вариантах реализации изобретения состав с модифицированным высвобождением является стабильным в желудочном соке или стабильным в кислых средах. Эти составы с модифицированным высвобождением высвобождают около 30% или меньше по массе антиметаногенного статина и/или дополнительного терапевтического агента из состава с модифицированным высвобождением в желудочном соке с уровнем pH от около 4 до около 5 или меньше или в искусственном желудочном соке с уровнем pH от около 4 до около 5 или меньше в течение периода около 15, или около 30, или около 45, или около 60, или около 90 минут. Составы с модифицированным высвобождением по настоящему изобретению могут высвобождать от около 0% до около 30%, от около 0% до около 25%, от около 0% до около 20%, от около 0% до около 15%, от около 0% до около 10%, от около 5% до около 30%, от около 5% до около 25%, от около 5% до около 20%, от около 5% до около 15%, от около 5% до около 10% по массе антиметаногенного статина и/или дополнительного терапевтического агента из состава с модифицированным высвобождением в желудочном соке с уровнем pH 4-5 или меньше или в искусственном желудочном соке с уровнем pH 4-5 или меньше в течение периода, составляющкго около 15, или около 30, или около 45, или около 60, или около 90 минут. Составы с модифицированным высвобождением по настоящему изобретению могут высвобождать около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9%, или около 10% по массе от общей массы антиметаногенного статина и/или дополнительного терапевтического агента из состава с модифицированным высвобождением в желудочном соке с уровнем pH 5 или меньше или в искусственном желудочном соке с уровнем pH 5 или меньше в течение периода около 15, или около 30, или около 45, или около 60, или около 90 минут.
[054] В некоторых вариантах реализации изобретения состав с модифицированным высвобождением является нестабильным в кишечном соке. Эти составы с модифицированным высвобождением высвобождают около 70% или более по массе антиметаногенного статина и/или дополнительного терапевтического агента из состава с модифицированным высвобождением в кишечном соке или в искусственном кишечном соке в течение периода, составляющего около 15, или около 30, или около 45, или около 60, или около 90 минут. В некоторых вариантах реализации изобретения состав с модифицированным высвобождением является нестабильным в средах от близких к нейтральным до щелочных. Эти составы с модифицированным высвобождением высвобождают около 70% или более по массе антиметаногенного статина и/или дополнительного терапевтического агента из состава с модифицированным высвобождением в кишечном соке с уровнем pH около 4-5 или более или в искусственном кишечном соке с уровнем pH около 4-5 или более в течение периода около 15, или около 30, или около 45, или около 60, или около 90 минут. Состав с модифицированным высвобождением, который является нестабильным в близких к нейтральным или щелочных средах, может высвобождать 70% или более по массе антиметаногенного статина и/или дополнительного терапевтического агента из состава с модифицированным высвобождением в жидкости, имеющей уровень pH выше чем около 5 (например, в жидкости, имеющей уровень pH от около 5 до около 14, от около 6 до около 14, от около 7 до около 14, от около 8 до около 14, от около 9 до около 14, от около 10 до около 14 или от около 11 до около 14) в течение периода от около 5 минут до около 90 минут, или от около 10 минут до около 90 минут, или от около 15 минут до около 90 минут, или от около 20 минут до около 90 минут, или от около 25 минут до около 90 минут, или от около 30 минут до около 90 минут, или от около 5 минут до около 60 минут, или от около 10 минут до около 60 минут, или от около 15 минут до около 60 минут, или от около 20 минут до около 60 минут, или от около 25 минут до около 90 минут, или от около 30 минут до около 60 минут.
[055] В одном варианте реализации изобретения состав с модифицированным высвобождением может оставаться по существу неизменным или может быть по существу нерастворимым в желудочном соке. Стабильность оболочки для отсроченного высвобождения может зависеть от уровня pH. Оболочки для отсроченного высвобождения, зависимого от уровня pH, будут по существу стабильными в кислых средах (pH около 5 или меньше) и по существу нестабильными в средах от близких к нейтральным до щелочных (pH более чем около 5). Например, оболочки для отсроченного высвобождения могут по существу распадаться или растворяться в средах от близких к нейтральным до щелочных, таких как существующие в тонкой кишке (например, в одной или более из двенадцатиперстной кишки, тощей кишки и подвздошной кишки) и/или в толстой кишке (например, в одной или более из слепой кишки, восходящей ободочной кишки, поперечной ободочной кишки, нисходящей ободочной кишки и сигмовидной ободочной кишки).
[056] Примеры искусственного желудочного сока или искусственного кишечного сока включают, но не ограничиваясь ими, раскрытые в Фармакопее 2005 года 23NF/28USP в разделе «Испытуемые растворы» на странице 2858 и/или другие виды искусственного желудочного сока или искусственного кишечного сока, известные специалистам в данной области техники, например, искусственный желудочный сок и/или искусственный кишечный сок, приготовленный без ферментов.
[057] В альтернативном варианте устойчивость состава с модифицированным высвобождением может зависеть от присутствия ферментов. Оболочки для отсроченного высвобождения, зависимые от присутствия ферментов, будут по существу стабильными в жидкости, которая не содержит конкретного фермента, и практически нестабильными в жидкости, содержащей фермент. Оболочки для отсроченного высвобождения будут по существу распадаться или растворяться в жидкости, содержащей подходящий фермент. Контроль с зависимостью от ферментов обусловлен, например, посредством применения веществ, которые высвобождают активный ингредиент только при воздействии ферментов в кишечнике, таких как галактоманнаны. Стабильность состава с модифицированным высвобождением также может зависеть от стабильности фермента в присутствии микробного фермента, находящегося в кишечной флоре.
[058] В некоторых вариантах реализации изобретения предложен состав с двойным импульсным высвобождением. В различных вариантах реализации изобретения в настоящем изобретении предложены составы с модифицированным высвобождением, которые высвобождают множество доз антиметаногенного статина в разных местах по ходу кишечника, в разное время и/или при разных уровнях pH. В иллюстративном варианте реализации изобретения состав с модифицированным высвобождением содержит первую дозу антиметаногенного статина и вторую дозу антиметаногенного статина, причем первая доза и вторая доза высвобождаются в разных местах по ходу кишечника, в разное время и/или при разных уровнях pH. Например, первая доза высвобождается в двенадцатиперстной кишке, а вторая доза высвобождается в подвздошно-слепокишечном переходе и/или в ободочной кишке. В другом примере первая доза высвобождается в тощей кишке, а вторая доза высвобождается в подвздошной кишке. В других вариантах реализации изобретения первая доза высвобождается в месте по ходу тонкой кишки (например, в двенадцатиперстной кишке), тогда как вторая доза высвобождается по ходу толстой кишки (например, в восходящей ободочной кишке). В различных вариантах реализации изобретения состав с модифицированным высвобождением может высвобождать по меньшей мере одну дозу, по меньшей мере две дозы, по меньшей мере три дозы, по меньшей мере четыре дозы, по меньшей мере пять доз, по меньшей мере шесть доз, по меньшей мере семь доз или по меньшей мере восемь доз антиметаногенного статина в разных местах по ходу кишечника, в разное время и/или при разных уровнях pH. Каждая отдельная доза может содержать тот же статин или может содержать разные статины. Например, состав с модифицированным высвобождением может высвобождать множество доз, причем первая доза высвобождается в двенадцатиперстной кишке, а вторая и/или дополнительная доза высвобождается в подвздошно-слепокишечном переходе и/или в ободочной кишке.
[059] В некоторых вариантах реализации изобретения состав с двойным импульсным высвобождением представляет собой капсулу, покрытую кишечнорастворимой оболочкой, которая содержит гранулы или минитаблетки, содержащие антиметаногенный статин и, необязательно, дополнительный терапевтический агент. В некоторых вариантах реализации изобретения капсула, покрытая кишечнорастворимой оболочкой, растворяется в первой области ЖКТ с высвобождением гранул или минитаблеток, и/или первая совокупность гранул или минитаблеток высвобождается во второй области ЖКТ (которая отличается от первой области ЖКТ), а вторая совокупность гранул или минитаблеток высвобождается в третьей области ЖКТ (которая отличается от первой и второй областей ЖКТ). В некоторых вариантах реализации изобретения соотношение доза/высвобождение (например, количество агента, которое высвобождается в разных местах) можно при необходимости корректировать. В некоторых вариантах реализации изобретения капсула, покрытая кишечнорастворимой оболочкой, растворяется в двенадцатиперстной кишке с высвобождением гранул или минитаблеток, и/или первая совокупность гранул или минитаблеток высвобождается в двенадцатиперстной кишке, и/или вторая совокупность гранул или минитаблеток высвобождается в подвздошно-слепокишечном переходе (см., например, Фиг. 1-4).
[060] В альтернативных вариантах реализации изобретения состав с двойным импульсным высвобождением представляет собой водорастворимую капсулу, которая содержит покрытые кишечнорастворимой оболочкой гранулы или минитаблетки, содержащие антиметаногенный статин и, необязательно, дополнительный терапевтический агент. Иллюстративные водорастворимые капсулы включают, но не ограничиваясь ими, капсулы из желатина и гидроксипропилметилцеллюлозы (ГПМЦ). В некоторых вариантах реализации изобретения водорастворимая капсула растворяется в первой области ЖКТ с высвобождением гранул или минитаблеток, и/или первая совокупность гранул или минитаблеток высвобождается во второй области ЖКТ (которая отличается от первой области ЖКТ), а вторая совокупность гранул или минитаблеток высвобождается в третьей области ЖКТ (которая отличается от первой и второй областей ЖКТ). В некоторых вариантах реализации изобретения водорастворимая капсула растворяется в желудке с высвобождением гранул или минитаблеток, и/или первая совокупность гранул или минитаблеток высвобождается в двенадцатиперстной кишке, и/или вторая совокупность гранул или минитаблеток высвобождается в подвздошно-слепокишечном переходе и/или в ободочной кишке.
Состав и лекарственные формы с модифицированным высвобождением
[061] Состав с модифицированным высвобождением по настоящему изобретению может дополнительно содержать фармацевтически приемлемый носитель или вспомогательное вещество. Специалисту в данной области техники будет понятно, что составы могут находиться в любой приемлемой форме, подходящей для желаемого применения и пути введения. Примеры подходящих лекарственных форм включают, например, лекарственные формы для перорального и парентерального введения.
[062] Подходящие лекарственные формы для перорального применения включают, например, твердые лекарственные формы, такие как таблетки, диспергируемые порошки, гранулы и капсулы. В одном варианте реализации изобретения состав с модифицированным высвобождением находится в форме таблетки. В другом варианте реализации изобретения состав с модифицированным высвобождением находится в форме капсулы. В еще одном варианте реализации изобретения состав с модифицированным высвобождением находится в форме мягкой желатиновой капсулы. В дополнительном варианте реализации изобретения состав с модифицированным высвобождением находится в форме желатиновой капсулы. В дополнительном варианте реализации изобретения состав с модифицированным высвобождением находится в форме капсулы из гидроксипропилметилцеллюлозы (ГПМЦ).
[063] В таких лекарственных формах активное соединение смешивают с по меньшей мере одним инертным фармацевтически приемлемым вспомогательным веществом или носителем, таким как цитрат натрия, фосфат дикальция и т. п. и/или a) наполнителями, разбавителями или создающими объем агентами, такими как крахмалы, лактоза, сахароза, глюкоза, маннит, кремниевая кислота, микрокристаллическая целлюлоза (например, Avicel PH102) и специальный пекарский сахар и т. п., b) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидин, сахароза, акация, поливиниловый спирт, поливинилпирролидон, метилцеллюлоза, гидроксипропилцеллюлоза, гидроксиметилцеллюлоза и коповидоны, такие как Kollidon® VA64, Kollidon® VA64 тонкодисперсный и т. п., c) увлажняющими агентами, такими как глицерин и т. п., d) дезинтегрантами, такими как агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновая кислота, некоторые силикаты, карбонат натрия, поперечносшитые полимеры, такие как кросповидон (поперечносшитый поливинилпирролидон), кроскармеллоза натрия (поперечносшитая карбоксиметилцеллюлоза натрия), крахмалгликолят натрия и т. п., e) замедляющими растворение агентами, такими как парафин и т. п., f) ускоряющими абсорбцию агентами, такими как четвертичные соединения аммония и т. п., g) смачивающими агентами, такими как, например, цетиловый спирт и моностеарат глицерина и т. п., h) абсорбентами, такими как каолин, бентонитовая глина и т. п., i) смазывающими агентами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, глицерилбегенат и т. п., j) антиоксидантами, такими как пропилгаллат, бутилгидроксианизол (БГА), бутилгидрокситолуол (БГТ), этилендиаминтетрауксусная кислота (также известная как эдетовая кислота или ЭДТА) и т. п., k) агентами для придания вязкости и диспергаторами, такими как диоксид кремния или кремнезем, и смесями таких вспомогательных веществ. Специалисту в данной области техники будет понятно, что конкретные вспомогательные вещества могут выполнять в пероральной лекарственной форме две или более функций. В случае пероральной лекарственной формы, например, капсулы или таблетки, лекарственная форма может также содержать буферные агенты.
[064] Состав с модифицированным высвобождением может дополнительно содержать поверхностно-активное вещество. Поверхностно-активные вещества, подходящие для применения в настоящем изобретении, включают, но не ограничиваясь им, любое фармацевтически приемлемое нетоксичное поверхностно-активное вещество. Классы поверхностно-активных веществ, пригодных для использования в композициях по настоящему изобретению, включают, но не ограничиваясь ими, полиэтоксилированные жирные кислоты, сложные диэфиры ПЭГ и жирных кислот, смеси сложных моно- и диэфиров ПЭГ и жирных кислот, сложные эфиры жирных кислот с полиэтиленгликолем и глицерином, продукты переэтерификации масел со спиртами, полиглицеринизированные жирные кислоты, сложные эфиры пропиленгликоля и жирных кислот, смеси сложных эфиров пропиленгликоля и сложных эфиров глицерина, моно- и диглицериды, стерин и производные стерина, сложные эфиры полиэтиленгликоля и сорбитана с жирными кислотами, сложные алкиловые эфиры полиэтиленгликоля, сложные эфиры сахаров, эфиры полиэтиленгликоля и алкилфенолов, блок-сополимеры полиоксиэтилена и полиоксипропилена, сложные эфиры сорбитана и жирных кислот, сложные эфиры низших спиртов и жирных кислот, ионные поверхностно-активные вещества и их смеси. В некоторых вариантах реализации изобретения композиции по настоящему изобретению могут содержать одно или более поверхностно-активных веществ, включая, но не ограничиваясь ими, лаурилсульфат натрия, полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80 и триэтилцитрат.
[065] Состав с модифицированным высвобождением может также содержать фармацевтически приемлемые пластификаторы для получения желаемых механических свойств, таких как эластичность и твердость. Такие пластификаторы включают, но не ограничиваясь ими, триацетин, сложные эфиры лимонной кислоты, сложные эфиры фталевой кислоты, дибутилсебацинат, цетиловый спирт, полиэтиленгликоли, полисорбаты или другие пластификаторы.
[066] Состав с модифицированным высвобождением может также включать один или более растворителей для нанесения. Некоторые из наиболее распространенных растворителей, которые могут быть использованы для нанесения, например, композиции оболочки для отсроченного высвобождения, включают изопропиловый спирт, ацетон, метиленхлорид и т. п.
[067] Состав с модифицированным высвобождением может также включать один или более дезинтегрантов. Иллюстративные дезинтегранты, которые можно применять, включают, но не ограничиваясь ими, кросповидоны, такие как Kollidon® CL, Kollidon® CL-F, Kollidon® CL-SF или Kollidon® CL-M,
[068] Состав с модифицированным высвобождением может также включать один или более щелочных материалов. Щелочной материал, подходящий для применения в композициях по настоящему изобретению включает, но не ограничиваясь ими, натриевые, калиевые, кальциевые, магниевые и алюминиевые соли кислот, таких как фосфорная кислота, угольная кислота, лимонная кислота, и другие соединения алюминия/магния. Кроме того, щелочной материал может быть выбран из антацидных материалов, таких как гидроксиды алюминия, гидроксиды кальция, гидроксиды магния и оксид магния.
[069] Твердые пероральные лекарственные формы могут быть получены любым стандартным способом, известным в данной области техники, например гранулированием (например, влажным или сухим гранулированием) активного соединения (например, статинов) с одним или более подходящими вспомогательными веществами. В альтернативном варианте активное соединение можно наслаивать на инертное ядро (например, сферические гранулы Non Pareil/сахар или сферические гранулы двуокиси кремния) с использованием стандартных способов, таких как нанесение покрытий в псевдоожиженном слое или нанесение покрытий в барабанах, или его можно экструдировать в виде гранул, содержащих активное соединение, и придавать им сферическую форму с использованием способов, известных в данной области техники. Такие гранулы затем могут быть включены в таблетки или капсулы с использованием стандартных способов.
[070] Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, например, этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и т. п. и их смеси.
[071] Кроме инертных разбавителей композиции для перорального введения могут также содержать адъюванты, такие как подсластители, вкусовые добавки и ароматизаторы.
[072] В дополнение к активным соединениям суспензии могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтиленсорбита и сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар, трагакант и т. п. и их смеси.
[073] Составы, содержащие терапевтические агенты по настоящему изобретению, могут быть удобно представлены в виде лекарственных форм с однократной дозировкой и могут быть приготовлены любыми способами, хорошо известными специалистам в области фармацевтики. Такие способы, как правило, включают этап смешивания терапевтических агентов с носителем, который представляет собой один или более вспомогательных ингредиентов. Обычно составы получают путем однородного и тщательного объединения терапевтического агента с жидким носителем, тонко измельченным твердым носителем или и тем и другим, и затем, при необходимости, придания формы продукту в виде лекарственных форм с желательным составом (например, влажным или сухим гранулированием, смешиванием порошков и т. п., с последующим таблетированием с использованием стандартных способов, известных в данной области техники).
[074] В различных вариантах реализации изобретения в составе с модифицированным высвобождением по настоящему изобретению может использоваться одна или более оболочек с модифицированным высвобождением, таких как оболочки для отсроченного высвобождения, чтобы обеспечить эффективную, по существу отсроченную доставку антиметаногенного статина в ЖКТ, необязательно вместе с другими терапевтическими агентами.
[075] В одном варианте реализации изобретения оболочки для отсроченного высвобождения включают кишечнорастворимые агенты, которые являются по существу стабильными в кислых средах и по существу нестабильны в средах от близких к нейтральным до щелочных. В одном варианте реализации изобретения оболочка для отсроченного высвобождения содержит кишечнорастворимый агент, который является по существу стабильным в желудочном соке. Кишечнорастворимый агент может быть выбран, например, из растворов или дисперсий сополимеров метакриловой кислоты, ацетат-фталата целлюлозы, фталата гидроксипропилметилцеллюлозы, поливинилацетата-фталата, карбоксиметилцеллюлозы и полимера типа EUDRAGIT® (поли(метакриловая кислота, метилметакрилат), ацетат-сукцината гидроксипропилметилцеллюлозы, ацетат- тримеллитата целлюлозы, шеллака или другие подходящих кишечнорастворимых полимеров для покрытия. Полимеры типа EUDRAGIT® включают, например, EUDRAGIT® FS 30D, L 30 D-55, L 100-55, L 100, L 12,5, L 12,5 P, RL 30 D, RL PO, RL 100, RL 12,5, RS 30 D, RS PO, RS 100, RS 12,5, NE 30 D, NE 40 D, NM 30 D, S 100, S 12,5 и S 12,5 P. Подобные полимеры включают Kollicoat® MAE 30 DP и Kollicoat® MAE 100 P. В некоторых вариантах реализации изобретения используют один или более из EUDRAGIT® FS 30D, L 30 D-55, L 100-55, L 100, L 12,5, L 12,5 P RL 30 D, RL PO, RL 100, RL 12,5, RS 30 D, RS PO, RS 100, RS 12,5, NE 30 D, NE 40 D, NM 30 D, S 100, S 12,5 S 12,5 P, Kollicoat® MAE 30 DP и Kollicoat® MAE 100 P. В различных вариантах реализации изобретения кишечнорастворимый агент может представлять собой комбинацию из вышеуказанных растворов или дисперсий. В некоторых вариантах реализации изобретения вместе с кишечнорастворимым агентом используется одна или более добавок системы для покрытия оболочкой. Например, одну или более добавок PlasACRYLTM можно использовать в качестве добавки к покрытию против склеивания. Иллюстративные добавки PlasACRYLTM включают, но не ограничиваясь ими, PlasACRYLTM HTP20 и PlasACRYLTM T20. В одном варианте реализации изобретения PlasACRYL™ HTP20 введен в состав оболочек EUDRAGIT® L 30 D-55. В другом варианте реализации изобретения PlasACRYL™ T20 введен в состав оболочек EUDRAGIT® FS 30 D.
[076] В другом варианте реализации изобретения оболочка для отсроченного высвобождения может разлагаться в зависимости от времени при нахождении в водном растворе вне зависимости от уровня pH и/или наличия в растворе ферментов. Такая оболочка может содержать нерастворимый в воде полимер. Таким образом, ее растворимость в водном растворе не зависит от уровня pH. В контексте данного документа термин «независимый от уровня pH» означает, что водопроницаемость полимера и его способность высвобождать фармацевтические ингредиенты не зависит от уровня рН и/или зависит от уровня рН в очень слабой степени. Такие оболочки можно использовать, например, для получения составов с замедленным высвобождением. Подходящие нерастворимые в воде полимеры включают фармацевтически приемлемые нетоксичные полимеры, которые по существу нерастворимы в водных средах, например, воде, независимо от уровня pH раствора. Подходящие полимеры включают, но не ограничиваясь ими, простые эфиры целлюлозы, сложные эфиры целлюлозы или смесь сложных и простых эфиров целлюлозы т. е. производное целлюлозы, в котором некоторые из гидроксильных групп на скелете целлюлозы замещены алкильными группами, а некоторые из них модифицированы ацильными группами. Примеры включают этилцеллюлозу, ацетилцеллюлозы, нитроцеллюлозу и т. п. Другие примеры нерастворимых полимеров включают, но не ограничиваясь ими, лаки и полимеры сложных эфиров акриловой и/или метакриловой кислоты, полимеры или сополимеры акрилата или метакрилата, имеющие низкое содержание четвертичного аммония или их смесь и т. п. Другие примеры нерастворимых полимеров включают EUDRAGIT RS®, EUDRAGIT RL® и EUDRAGIT NE®. Нерастворимые полимеры, используемые в настоящем изобретении, включают в себя сложные поливиниловые эфиры, поливинилацетали, сложные эфиры полиакриловой кислоты, сополимеры бутадиена и стирола и т. п. В одном варианте реализации изобретения доставка в ободочную кишку достигается посредством использования медленно разрушающейся восковой пробки (например, различных ПЭГ, включая, например, ПЭГ 6000).
[077] В дополнительном варианте реализации изобретения оболочка для отсроченного высвобождения может разлагаться микробным ферментом, присутствующим в кишечной флоре. В одном варианте реализации изобретения оболочка для отсроченного высвобождения может разлагаться бактериями, присутствующими в тонкой кишке. В другом варианте реализации изобретения оболочка для отсроченного высвобождения может разлагаться бактериями, присутствующими в толстой кишке.
[078] В настоящем изобретении предложены составы с модифицированным высвобождением, которые высвобождают множество доз антиметаногенного статина по ходу желудочно-кишечного тракта. Общий профиль высвобождения такого состава может быть отрегулирован путем использования, например, множества типов частиц или множества слоев. В одном варианте реализации изобретения первая доза антиметаногенного статина может быть введена в состав для высвобождения, например, в двенадцатиперстной кишке, тогда как вторая доза введена в состав для отсроченного высвобождения, например, в подвздошной кишке. В другом варианте реализации изобретения первая доза антиметаногенного статина может быть введена в состав для высвобождения, например, в тонкой кишке, тогда как вторая доза введена в состав для отсроченного высвобождения, например, в толстой кишке. В альтернативном варианте множество доз высвобождаются в разных местах по ходу кишечника.
[079] В одном варианте реализации изобретения одна или более доз антиметаногенного статина могут быть инкапсулированы в частице ядра, например, в виде микрогранул или минитаблетки. Например, первая доза антиметаногенного статина может быть инкапсулирована в частице ядра, покрытой оболочкой с модифицированным высвобождением, предназначенной для высвобождения в первом месте по ходу желудочно-кишечного тракта, а вторая доза антиметаногенного статина может быть инкапсулирована в частице ядра, покрытой оболочкой с модифицированным высвобождением, предназначенной для высвобождения во втором месте по ходу желудочно-кишечного тракта. В различных вариантах реализации изобретения состав может содержать множество таких частиц с модифицированным высвобождением. Например, состав может быть в форме капсул, содержащих множество микрогранул или множество минитаблеток. Например, состав может быть в форме капсул, таких как, например, капсулы из желатина и гидроксипропилметилцеллюлозы (ГПМЦ), содержащие множество микрогранул или минитаблеток, покрытых кишечнорастворимой оболочкой. В таком варианте реализации изобретения может использоваться комбинация микрогранул или минитаблеток, в которой каждая микрогранула или минитаблетка разработана для высвобождения в определенный момент времени или в определенном месте. В альтернативном варианте реализации изобретения состав составлен как «капсула внутри капсулы», причем каждая капсула имеет различные характеристики высвобождения, зависимые от времени или уровня pH.
[080] В некоторых вариантах реализации изобретения состав может содержать множество микрогранул или множество минитаблеток в определенных соотношениях, так, чтобы высвобождать определенное количество активных ингредиентов в определенные моменты времени или в определенных местах. Например, состав может содержать определенные соотношения минитаблеток, которые высвобождаются в первом месте (например, в двенадцатиперстной кишке) или при первом уровне pH (например, при уровне pH около 5,5) и минитаблеток, которые высвобождаются во втором месте (например, в подвздошно-слепокишечном переходе или ободочной кишке) или при втором уровне pH (например, при уровне pH около 7,0). В некоторых вариантах реализации изобретения соотношение составляет от около 1:10 до около 10:1. Например, состав может содержать минитаблетки, которые высвобождаются при первом уровне pH (например, при уровне pH около 5,5) и при втором уровне pH (например, при уровне pH около 7,0) в соотношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 10:1, 9:1, 8:1, 7:1, 6:1, 5:1, 4:1, 3:1 или 2:1. В одном варианте реализации изобретения состав может содержать минитаблетки, которые высвобождаются при первом уровне pH (например, при уровне pH около 5,5) и при втором уровне pH (например, при уровне pH около 7,0) в соотношении 1:2. В другом варианте реализации изобретения состав может содержать минитаблетки, которые высвобождаются при первом уровне pH (например, при уровне pH около 5,5) и при втором уровне pH (например, при уровне pH около 7,0) в соотношении 1:5.
[081] В другом варианте реализации изобретения одна или более доз антиметаногенного статина могут быть инкапсулированы в слое. Например, первая доза антиметаногенного статина может быть инкапсулирована в слое, покрытом оболочкой с модифицированным высвобождением, предназначенном для высвобождения в первом месте по ходу желудочно-кишечного тракта, а вторая доза антиметаногенного статина может быть инкапсулирована в слое, покрытом оболочкой с модифицированным высвобождением, предназначенном для высвобождения во втором месте по ходу желудочно-кишечного тракта. Состав может содержать множество таких слоев с модифицированным высвобождением. Например, состав находится в форме многослойной таблетки или многослойной капсулы или капсул внутри капсул. Каждый слой может иметь различные характеристики высвобождения, зависимые от времени или уровня pH.
[082] В описанных выше вариантах реализации изобретения частицы или слои, покрытые оболочкой для отсроченного высвобождения, могут быть дополнительно покрыты внешним слоем. Внешний слой может быть нанесен так, как описано для других композиций оболочек. Материалы для внешнего покрытия представляют собой фармацевтически приемлемые соединения, такие как сахар, полиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, поливинилацетат, гидроксипропилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза и другие, используемые отдельно или в смесях. Материалы для внешнего покрытия могут предотвращать потенциальную агломерацию частиц, покрытых оболочкой для отсроченного высвобождения, защищать оболочку для отсроченного высвобождения от трещин во время процесса прессования или улучшать процесс таблетирования.
[083] Кроме того, в различных вариантах реализации изобретения агенты, описанные в данном документе, могут находиться в форме фармацевтически приемлемой соли, а именно тех солей, которые подходят для использования в контакте с тканями людей и других животных без чрезмерной токсичности, раздражения, аллергической реакции и т. п. и имеют разумное соотношение польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области техники. Такие соли могут быть получены in situ в ходе конечного выделения и очистки терапевтических агентов, или отдельным приведением в реакцию соединения в форме свободного основания с подходящей кислотой или свободной функциональной группой кислоты с соответствующей щелочной группой. Иллюстративные соли присоединения кислот включают ацетат, адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептонат, глицерофосфат, гемисульфат, гептонат, гексаноат, гидробромид, гидрохлорид, гидройодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, толуолсульфонат, ундеканоат, валератные соли и т. п. Иллюстративные соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и т. п., а также соли нетоксичных катионов аммония, четвертичного аммония и амина, включая, но не ограничиваясь ими, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т. п.
[084] В различных вариантах реализации изобретения состав содержит по меньшей мере одну микрогранулу или минитаблетку. В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка содержит около 5-20% по массе антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина). Например, антиметаногенный статин может присутствовать в количестве около 5%, около 6%, около 7%, около 8%, около 9%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 19% или около 20% по массе. В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 50-70% по массе разбавителя таблетки (например, около 50%, около 51%, около 52%, около 53%, около 54%, около 55%, около 56%, около 57%, около 58%, около 59%, около 60%, около 61%, около 62%, около 63%, около 64%, или около 65%, или около 66%, около 67%, или около 68%, или около 69%, или около 70%). В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 1-10% по массе связующего вещества таблетки (например, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10%). В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 0,1-3,0% по массе агента для придания вязкости и диспергатора (например, около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,1%, около 1,2%, около 1,3%, около 1,4%, около 1,5%, около 1,6%, около 1,7%, около 1,8%, около 1,9%, около 2%, около 2,1%, около 2,2%, около 2,3%, около 2,4%, около 2,5%, около 2,6%, около 2,7%, около 2,8%, около 2,9% или около 3,0%). В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 0,1-3,0% по массе смазывающего агента, например, для облегчения таблетирования (например, около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,1%, около 1,2%, около 1,3%, около 1,4%, около 1,5%, около 1,6%, около 1,7%, около 1,8%, около 1,9%, около 2%, около 2,1%, около 2,2%, около 2,3%, около 2,4%, около 2,5%, около 2,6%, около 2,7%, около 2,8%, около 2,9% или около 3,0%). В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 1-10% по массе дезинтегранта таблетки (например, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10%). В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 10-20% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 5,5 или около 7,0 (например, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 19% или около 20%).
[085] В различных вариантах реализации изобретения состав содержит один или более из, или два или более из, или три или более из, или четыре или более из, или пять или более из, или все из антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина), причем антиметаногенный статин (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина) необязательно присутствует в двух дозах; микрокристаллической целлюлозы (например, Avicel PH102); коповидона (например, Kollidon VA64 тонкодисперсный); диоксида кремния (например, Aerosil 200); стеарата магния; кросповидона (например, Kollidon CL или Kollidon CL-F); причем первая доза по меньшей мере одного антиметаногенного статина инкапсулирована кишечнорастворимым полимером, который растворяется при уровне pH около 5,5 (например, EUDRAGIT L 30 D-55+PlasACRYL HTP20); а вторая доза по меньшей мере одного антиметаногенного статина инкапсулирована кишечнорастворимым полимером который растворяется при уровне pH около 7,0 (например, EUDRAGIT FS 30 D+PlasACRYL T20 и/или EUDRAGIT® S 100).
[086] В различных вариантах реализации изобретения состав содержит по меньшей мере одну микрогранулу или минитаблетку. Каждая микрогранула или минитаблетка содержит около 5-20% по массе антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина). Например, антиметаногенный статин может присутствовать в количестве около 5%, около 6%, около 7%, около 8%, около 9%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 19% или около 20% по массе. В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 50-70% по массе микрокристаллической целлюлозы (например, Avicel PH102). Например, микрокристаллическая целлюлоза может присутствовать в количестве около 50%, около 51%, около 52%, около 53%, около 54%, около 55%, около 56%, около 57%, около 58%, около 59%, около 60%, около 61%, около 62%, около 63%, около 64%, или около 65%, или около 66%, около 67%, или около 68%, или около 69%, или около 70% по массе. В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 1-10% по массе коповидона (например, Kollidon VA64 тонкодисперсный). Например, коповидон может присутствовать в количестве около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10% по массе. В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 0,1-3,0% по массе диоксида кремния (например, Aerosil 200). Например, диоксид кремния может присутствовать в количестве около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,1%, около 1,2%, около 1,3%, около 1,4%, около 1,5%, около 1,6%, около 1,7%, около 1,8%, около 1,9%, около 2%, около 2,1%, около 2,2%, около 2,3%, около 2,4%, около 2,5%, около 2,6%, около 2,7%, около 2,8%, около 2,9%, или около 3,0% по массе. В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 0,1-3,0% по массе стеарата магния (например, около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,1%, около 1,2%, около 1,3%, около 1,4%, около 1,5%, около 1,6%, около 1,7%, около 1,8%, около 1,9%, около 2%, около 2,1%, около 2,2%, около 2,3%, около 2,4%, около 2,5%, около 2,6%, около 2,7%, около 2,8%, около 2,9% или около 3,0%). В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 1-10% по массе кросповидона (например, Kollidon CL или Kollidon CL-F). Например, кросповидон может присутствовать в количестве около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10% по массе. В некоторых вариантах реализации изобретения каждая микрогранула или минитаблетка может дополнительно содержать около 10-20% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 5,5 (например, EUDRAGIT L 30 D-55+PlasACRYL HTP20) или около 7,0 (например, EUDRAGIT FS 30 D+PlasACRYL T20 и/или EUDRAGIT® S 100). Например, кишечнорастворимый полимер может составлять около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 19% или около 20% по массе.
[087] В некоторых вариантах реализации изобретения состав содержит по меньшей мере одну микрогранулу или минитаблетку, причем каждая микрогранула или минитаблетка содержит около 12% по массе антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина); около 60% по массе микрокристаллической целлюлозы (например, Avicel PH102); около 6% по массе коповидона (например, Kollidon VA64 тонкодисперсный); около 2% по массе диоксида кремния (например, Aerosil 200); около 1% по массе стеарата магния; около 5% по массе кросповидона (например, Kollidon CL или Kollidon CL-F); и около 15% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 5,5 (например, EUDRAGIT L 30 D-55+PlasACRYL HTP20) или около 7,0 (например, EUDRAGIT FS 30 D+PlasACRYL T20 и/или EUDRAGIT® S 100).
[088] В некоторых вариантах реализации изобретения состав содержит по меньшей мере одну микрогранулу или минитаблетку, причем каждая микрогранула или минитаблетка содержит около 12,2% по массе лактона ловастатина; около 60,9% по массе микрокристаллической целлюлозы (Avicel PH102); около 6,1% по массе коповидона (Kollidon VA64 тонкодисперсный); около 1,7% по массе диоксида кремния (Aerosil 200); около 0,9% по массе стеарата магния; около 5,2% по массе кросповидона (Kollidon CL-F); и либо около 13,0% по массе покрытия EUDRAGIT L 30 D-55+PlasACRYL HTP20 (которое растворяется при уровне pH около 5,5), либо 13% по массе покрытия EUDRAGIT FS 30 D+PlasACRYL T20 (которое растворяется при уровне pH около 7,0).
[089] В различных вариантах реализации состав настоящего изобретения имеет толщину кишечнорастворимой оболочки минитаблетки, например, EUDRAGIT, например, EUDRAGIT L 30 D-55 или EUDRAGIT FS 30 D, более чем около 10%, около 13%, около 15%, или около 17%, или около 20%, или около 25%.
[090] В различных вариантах реализации изобретения состав по настоящему изобретению может содержать по меньшей мере одну минитаблетку, которая высвобождается при первом уровне pH (например, при уровне pH около 5,5), и по меньшей мере одну минитаблетку, которая высвобождается при втором уровне pH (например, при уровне pH около 7,0) в соотношении 1:2. В таких вариантах реализации изобретения состав может содержать около 5-20% по массе антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина). Например, антиметаногенный статин может присутствовать в количестве около 5%, около 6%, около 7%, около 8%, около 9%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 19%, или около 20% по массе в расчете на массу всего состава. В некоторых вариантах реализации изобретения состав может дополнительно содержать около 30-60% по массе разбавителя таблетки (например, около 30%, около 31%, около 32%, около 33%, около 34%, около 35%, около 36%, около 37%, около 38%, около 39%, около 40%, около 41%, около 42%, около 43%, около 44%, около 45%, около 46%, около 47%, около 48%, около 49%, около 50%, около 51%, около 52%, около 53%, около 54%, около 55%, около 56%, около 57%, около 58%, около 59% или около 60%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 1-10% по массе связующего вещества таблетки (например, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 0,1-3,0% по массе агента для придания вязкости и диспергатора (например, около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,1%, около 1,2%, около 1,3%, около 1,4%, около 1,5%, около 1,6%, около 1,7%, около 1,8%, около 1,9%, около 2%, около 2,1%, около 2,2%, около 2,3%, около 2,4%, около 2,5%, около 2,6%, около 2,7%, около 2,8%, около 2,9% или около 3,0%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 0,1-3,0% по массе смазывающего агента, например, для облегчения таблетирования (например, около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,1%, около 1,2%, около 1,3%, около 1,4%, около 1,5%, около 1,6%, около 1,7%, около 1,8%, около 1,9%, около 2%, около 2,1%, около 2,2%, около 2,3%, около 2,4%, около 2,5%, около 2,6%, около 2,7%, около 2,8%, около 2,9% или около 3,0%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 1-10% по массе дезинтегранта таблеток (например, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 0,5-10% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 5,5 (например, EUDRAGIT L 30 D-55+PlasACRYL HTP20). Например, кишечнорастворимый полимер, который растворяется при уровне pH около 5,5 может присутствовать в составе в количестве около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10% по массе. В некоторых вариантах реализации изобретения состав может дополнительно содержать около 1-15% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 7,0 (например, EUDRAGIT FS 30 D+PlasACRYL T20 и/или EUDRAGIT® S 100). Например, кишечнорастворимый полимер, который растворяется при уровне pH около 7,0 может присутствовать в составе в количестве около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9%, около 10%, около 11%, около 12%, около 13%, около 14% или около 15% по массе. В таких вариантах реализации изобретения антиметаногенный статин (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина) может высвобождаться в двух дозах. Первая доза антиметаногенного статина инкапсулирована кишечнорастворимым полимером, который растворяется при уровне pH около 5,5; а вторая доза антиметаногенного статина инкапсулирована кишечнорастворимым полимером, который растворяется при уровне pH около 7,0.
[091] Например, состав может содержать по меньшей мере одну минитаблетку, которая высвобождается при первом уровне pH (например, при уровне pH около 5,5), и по меньшей мере одну минитаблетку, которая высвобождается при втором уровне pH (например, при уровне pH около 7,0) в соотношении 1:2. Состав может содержать около 9% по массе антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина); около 42% по массе микрокристаллической целлюлозы (например, Avicel PH102); около 4% по массе коповидона (например, Kollidon VA64 тонкодисперсный); около 1% по массе диоксида кремния (например, Aerosil 200); около 0,5% по массе стеарата магния; около 4% по массе кросповидона (например, Kollidon CL или Kollidon CL-F); около 3% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 5,5 (например, EUDRAGIT L 30 D-55+PlasACRYL HTP20); и около 6% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 7,0 (например, EUDRAGIT FS 30 D+PlasACRYL T20 и/или EUDRAGIT® S 100).
[092] В другом примере состав может содержать по меньшей мере одну минитаблетку, которая высвобождается при первом уровне pH (например, при уровне pH около 5,5), и по меньшей мере одну минитаблетку, которая высвобождается при втором уровне pH (например, при уровне pH около 7,0), в соотношении 1:2. Состав может содержать около 8,5% по массе антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина); около 42,4% по массе микрокристаллической целлюлозы (например, Avicel PH102); около 4,2% по массе коповидона (например, Kollidon VA64 тонкодисперсный); около 1,2% по массе диоксида кремния (например, Aerosil 200); около 0,6% по массе стеарата магния; около 3,6% по массе кросповидона (например, Kollidon CL или Kollidon CL-F); около 3% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 5,5 (например, EUDRAGIT L 30 D-55+PlasACRYL HTP20); и около 6,1% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 7,0 (например, EUDRAGIT FS 30 D+PlasACRYL T20 и/или EUDRAGIT® S 100).
[093] В другом варианте реализации изобретения состав по настоящему изобретению может содержать по меньшей мере одну минитаблетку, которая высвобождается при первом уровне pH (например, при уровне pH около 5,5), и по меньшей мере одну минитаблетку, которая высвобождается при втором уровне pH (например, при уровне pH около 7,0), в соотношении 1:5. В таких вариантах реализации изобретения состав может содержать около 5-20% по массе антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина). Например, антиметаногенный статин может присутствовать в количестве около 5%, около 6%, около 7%, около 8%, около 9%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 19%, или около 20% по массе в расчете на массу всего состава. В некоторых вариантах реализации изобретения состав может дополнительно содержать около 30-60% по массе разбавителя таблетки (например, около 30%, около 31%, около 32%, около 33%, около 34%, около 35%, около 36%, около 37%, около 38%, около 39%, около 40%, около 41%, около 42%, около 43%, около 44%, около 45%, около 46%, около 47%, около 48%, около 49%, около 50%, около 51%, около 52%, около 53%, около 54%, около 55%, около 56%, около 57%, около 58%, около 59% или около 60%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 1-10% по массе связующего вещества таблетки (например, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 0,1-3,0% по массе агента для придания вязкости и диспергатора (например, около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,1%, около 1,2%, около 1,3%, около 1,4%, около 1,5%, около 1,6%, около 1,7%, около 1,8%, около 1,9%, около 2%, около 2,1%, около 2,2%, около 2,3%, около 2,4%, около 2,5%, около 2,6%, около 2,7%, около 2,8%, около 2,9% или около 3,0%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 0,1-3,0% по массе смазывающего агента, например, для облегчения таблетирования (например, около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,1%, около 1,2%, около 1,3%, около 1,4%, около 1,5%, около 1,6%, около 1,7%, около 1,8%, около 1,9%, около 2%, около 2,1%, около 2,2%, около 2,3%, около 2,4%, около 2,5%, около 2,6%, около 2,7%, около 2,8%, около 2,9% или около 3,0%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 1-10% по массе дезинтегранта таблеток (например, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10%). В некоторых вариантах реализации изобретения состав может дополнительно содержать около 0,5-10% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 5,5 (например, EUDRAGIT L 30 D-55+PlasACRYL HTP20. Например, кишечнорастворимый полимер, который растворяется при уровне pH около 5,5 может присутствовать в составе в количестве около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10% по массе. В некоторых вариантах реализации изобретения состав может дополнительно содержать около 1-15% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 7,0 (например, EUDRAGIT FS 30 D+PlasACRYL T20 и/или EUDRAGIT® S 100. Например, кишечнорастворимый полимер, который растворяется при уровне pH около 7,0 может присутствовать в составе в количестве около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9%, около 10%, около 11%, около 12%, около 13%, около 14% или около 15% по массе. В таких вариантах реализации изобретения антиметаногенный статин (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина) может высвобождаться в двух дозах. Первая доза антиметаногенного статина инкапсулирована кишечнорастворимым полимером, который растворяется при уровне pH около 5,5; а вторая доза антиметаногенного статина инкапсулирована кишечнорастворимым полимером, который растворяется при уровне pH около 7,0.
[094] Например, состав может содержать по меньшей мере одну минитаблетку, которая высвобождается при первом уровне pH (например, при уровне pH около 5,5), и по меньшей мере одну минитаблетку, которая высвобождается при втором уровне pH (например, при уровне pH около 7,0), в соотношении 1:5. Состав может содержать около 10% по массе антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина); около 50% по массе микрокристаллической целлюлозы (например, Avicel PH102); около 5% по массе коповидона (например, Kollidon VA64 тонкодисперсный); около 1% по массе диоксида кремния (например, Aerosil 200); около 0,5% по массе стеарата магния; около 4% по массе кросповидона (например, Kollidon CL или Kollidon CL-F); около 2% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 5,5 (например, EUDRAGIT L 30 D-55+PlasACRYL HTP20); и около 9% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 7,0. (например, EUDRAGIT FS 30 D+PlasACRYL T20 и/или EUDRAGIT® S 100).
[095] В другом примере состав может содержать по меньшей мере одну минитаблетку, которая высвобождается при первом уровне pH (например, при уровне pH около 5,5), и по меньшей мере одну минитаблетку, которая высвобождается при втором уровне pH (например, при уровне pH около 7,0), в соотношении 1:5. Состав может содержать около 10% по массе антиметаногенного статина (который в некоторых вариантах реализации изобретения представляет собой ловастатин, а в дополнительных вариантах реализации изобретения - лактон ловастатина); около 50% по массе микрокристаллической целлюлозы (например, Avicel PH102); около 5% по массе коповидона (например, Kollidon VA64 тонкодисперсный); около 1,4% по массе диоксида кремния (например, Aerosil 200); около 0,7% по массе стеарата магния; около 4,3% по массе кросповидона (например, Kollidon CL или Kollidon CL-F); около 1,8% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 5,5 (например, EUDRAGIT L 30 D-55+PlasACRYL HTP20); и около 8,9% по массе кишечнорастворимого полимера, который растворяется при уровне pH около 7,0. (например, EUDRAGIT FS 30 D+PlasACRYL T20 и/или EUDRAGIT® S 100).
[096] Терапевтические агенты или их фармацевтически приемлемые соли, которые используются по настоящему изобретению, могут демонстрировать стереоизомерию в силу наличия в соединениях одного или более асимметричных или хиральных центров. В настоящем изобретении предусмотрены различные стереоизомеры и смеси этих соединений. Желаемые энантиомеры могут быть получены путем хирального синтеза из коммерчески доступных хиральных исходных веществ способами, хорошо известными в данной области, или могут быть получены из смесей энантиомеров с помощью расщепления с использованием известных методик.
[097] В контексте данного документа термин «сольват» относится к фармацевтически приемлемой форме сольвата определенного терапевтического агента, которая сохраняет биологическую эффективность такого агента. Примеры сольватов включают терапевтические агенты по изобретению в комбинации с, например, водой, изопропанолом, этанолом, метанолом, ДМСО, этилацетатом, уксусной кислотой и этаноламином.
[098] В контексте данного документа термин «пролекарство» относится к терапевтическому агенту, который в физиологических условиях или путем сольволиза или метаболически (например, in vivo) превращается в определенный агент, являющийся фармацевтически активным.
[099] В контексте данного документа термин «активный метаболит» относится к фармакологически активному продукту, полученному посредством метаболизма в организме определенного терапевтического агента.
[0100] В контексте данного документа термин «сокристалл» относится к физическому соединению двух или более молекул, которое обеспечивает их стабильность за счет нековалентного взаимодействия. Один или более компонентов этого молекулярного комплекса обеспечивают стабильный каркас в кристаллической решетке. В некоторых случаях гостевые молекулы внедряются в кристаллическую решетку в виде ангидратов или сольватов.
Введение и дозы
[0101] Следует понимать, что фактическая доза антиметаногенного статина, подлежащего введению по настоящему изобретению, будет изменяться в зависимости от конкретного соединения, конкретной лекарственной формы и способа введения. Специалистом в данной области могут быть приняты во внимание многие факторы, способные изменять действие антиметаногенного статина (например, масса тела, пол, рацион питания, время введения, путь введения, скорость выведения, состояние субъекта, комбинация лекарственных средств, генетическая предрасположенность и чувствительность реакции). Введение может осуществляться непрерывно или в одной или более дискретных доз в пределах максимальной переносимой дозы. Оптимальные скорости введения для данного набора условий могут быть установлены специалистом в данной области с использованием стандартных тестов введения дозы.
[0102] Отдельные дозы антиметаногенного статина можно вводить в лекарственных формах с однократной дозировкой (например, таблетках или капсулах), содержащих, например, от около 0,01 мг до около 100 мг, от около 0,1 мг до около 100 мг, от около 0,1 мг до около 90 мг, от около 0,1 мг до около 80 мг, от около 0,1 мг до около 70 мг, от около 0,1 мг до около 60 мг, от около 0,1 мг до около 50 мг, от около 0,1 мг до около 40 мг активного ингредиента, от около 0,1 мг до около 30 мг, от около 0,1 мг до около 20 мг, от около 0,1 мг до около 10 мг, от около 0,1 мг до около 5 мг, от около 0,1 мг до около 3 мг, от около 0,1 мг до около 1 мг на лекарственную форму с однократной дозировкой или от около 5 мг до около 80 мг на лекарственную форму с однократной дозировкой. Например, лекарственная форма с однократной дозировкой может представлять дозу около 0,01 мг, около 0,02 мг, около 0,03 мг, около 0,04 мг, около 0,05 мг, около 0,06 мг, около 0,07 мг, около 0,08 мг, около 0,09 мг, около 0,1 мг, около 0,2 мг, около 0,3 мг, около 0,4 мг, около 0,5 мг, около 0,6 мг, около 0,7 мг, около 0,8 мг, около 0,9 мг, около 1 мг, около 2 мг, около 3 мг, около 4 мг, около 5 мг, около 6 мг, около 7 мг, около 8 мг, около 9 мг, около 10 мг, около 11 мг, около 12 мг, около 13 мг, около 14 мг, около 15 мг, около 16 мг, около 17 мг, около 18 мг, около 19 мг, около 20 мг, около 21 мг, около 22 мг, около 23 мг, около 24 мг, около 25 мг, около 26 мг, около 27 мг, около 28 мг, около 29 мг, около 30 мг, около 31 мг, около 32 мг, около 33 мг, около 34 мг, около 35 мг, около 36 мг, около 37 мг, около 38 мг, около 39 мг, около 40 мг, около 41 мг, около 42 мг, около 43 мг, около 44 мг, около 45 мг, около 46 мг, около 47 мг, около 48 мг, около 49 мг, около 50 мг, около 51 мг, около 52 мг, около 53 мг, около 54 мг, около 55 мг, около 56 мг, около 57 мг, около 58 мг, около 59 мг, около 60 мг, около 61 мг, около 62 мг, около 63 мг, около 64 мг, около 65 мг, около 66 мг, около 67 мг, около 68 мг, около 69 мг, около 70 мг, около 71 мг, около 72 мг, около 73 мг, около 74 мг, около 75 мг, около 76 мг, около 77 мг, около 78 мг, около 79 мг, около 80 мг, около 81 мг, около 82 мг, около 83 мг, около 84 мг, около 85 мг, около 86 мг, около 87 мг, около 88 мг, около 89 мг, около 90 мг, около 91 мг, около 92 мг, около 93 мг, около 94 мг, около 95 мг, около 96 мг, около 97 мг, около 98 мг, около 99 мг или около 100 мг, включая все значения и диапазоны между ними. В одном варианте реализации изобретения отдельную дозу антиметаногенного статина вводят в лекарственной форме с однократной дозировкой, содержащей 21 мг активного ингредиента. В другом варианте реализации изобретения отдельную дозу антиметаногенного статина вводят в лекарственной форме с однократной дозировкой, содержащей 42 мг активного ингредиента.
[0103] В одном варианте реализации изобретения антиметаногенный статин вводят в количестве от около 0,01 мг до около 100 мг в сутки, в количестве от около 0,1 мг до около 100 мг в сутки, от около 0,1 мг до около 95 мг в сутки, от около 0,1 мг до около 90 мг в сутки, от около 0,1 мг до около 85 мг в сутки, от около 0,1 мг до около 80 мг в сутки, от около 0,1 мг до около 75 мг в сутки, от около 0,1 мг до около 70 мг в сутки, от около 0,1 мг до около 65 мг в сутки, от около 0,1 мг до около 60 мг в сутки, от около 0,1 мг до около 55 мг в сутки, от около 0,1 мг до около 50 мг в сутки, от около 0,1 мг до около 45 мг в сутки, от около 0,1 мг до около 40 мг в сутки, от около 0,1 мг до около 35 мг в сутки, от около 0,1 мг до около 30 мг в сутки, от около 0,1 мг до около 25 мг в сутки, от около 0,1 мг до около 20 мг в сутки, от около 0,1 мг до около 15 мг в сутки, от около 0,1 мг до около 10 мг в сутки, от около 0,1 мг до около 5 мг в сутки, от около 0,1 мг до около 3 мг в сутки, от около 0,1 мг до около 1 мг в сутки или от около 5 мг до около 80 мг в сутки. В различных вариантах реализации изобретения антиметаногенный статин вводят в суточной дозе около 0,01 мг, около 0,02 мг, около 0,03 мг, около 0,04 мг, около 0,05 мг, около 0,06 мг, около 0,07 мг, около 0,08 мг, около 0,09 мг, около 0,1 мг, около 0,2 мг, около 0,3 мг, около 0,4 мг, около 0,5 мг, около 0,6 мг, около 0,7 мг, около 0,8 мг, около 0,9 мг, около 1 мг, около 2 мг, около 3 мг, около 4 мг, около 5 мг, около 6 мг, около 7 мг, около 8 мг, около 9 мг, около 10 мг, около 11 мг, около 12 мг, около 13 мг, около 14 мг, около 15 мг, около 16 мг, около 17 мг, около 18 мг, около 19 мг, около 20 мг, около 21 мг, около 22 мг, около 23 мг, около 24 мг, около 25 мг, около 26 мг, около 27 мг, около 28 мг, около 29 мг, около 30 мг, около 31 мг, около 32 мг, около 33 мг, около 34 мг, около 35 мг, около 36 мг, около 37 мг, около 38 мг, около 39 мг, около 40 мг, около 41 мг, около 42 мг, около 43 мг, около 44 мг, около 45 мг, около 46 мг, около 47 мг, около 48 мг, около 49 мг, около 50 мг, около 51 мг, около 52 мг, около 53 мг, около 54 мг, около 55 мг, около 56 мг, около 57 мг, около 58 мг, около 59 мг, около 60 мг, около 61 мг, около 62 мг, около 63 мг, около 64 мг, около 65 мг, около 66 мг, около 67 мг, около 68 мг, около 69 мг, около 70 мг, около 71 мг, около 72 мг, около 73 мг, около 74 мг, около 75 мг, около 76 мг, около 77 мг, около 78 мг, около 79 мг, около 80 мг, около 81 мг, около 82 мг, около 83 мг, около 84 мг, около 85 мг, около 86 мг, около 87 мг, около 88 мг, около 89 мг, около 90 мг, около 91 мг, около 92 мг, около 93 мг, около 94 мг, около 95 мг, около 96 мг, около 97 мг, около 98 мг, около 99 мг или около 100 мг, включая все значения и диапазоны между ними. В одном варианте реализации изобретения антиметаногенный статин вводят в количестве 21 мг в сутки. В другом варианте реализации изобретения антиметаногенный статин вводят в количестве 42 мг в сутки.
[0104] В некоторых вариантах реализации изобретения подходящая доза антиметаногенного статина (например, статина) находится в диапазоне от около 0,01 мг/кг до около 10 мг/кг массы тела субъекта, например, около 0,01 мг/кг, около 0,02 мг/кг, около 0,03 мг/кг, около 0,04 мг/кг, около 0,05 мг/кг, около 0,06 мг/кг, около 0,07 мг/кг, около 0,08 мг/кг, около 0,09 мг/кг, около 0,1 мг/кг, около 0,2 мг/кг, около 0,3 мг/кг, около 0,4 мг/кг, около 0,5 мг/кг, около 0,6 мг/кг, около 0,7 мг/кг, около 0,8 мг/кг, около 0,9 мг/кг, около 1 мг/кг, около 1,1 мг/кг, около 1,2 мг/кг, около 1,3 мг/кг, около 1,4 мг/кг, около 1,5 мг/кг, около 1,6 мг/кг, около 1,7 мг/кг, около 1,8 мг/кг, 1,9 мг/кг, около 2 мг/кг, около 3 мг/кг, около 4 мг/кг, около 5 мг/кг, около 6 мг/кг, около 7 мг/кг, около 8 мг/кг, около 9 мг/кг, около 10 мг/кг массы тела, включая все значения и диапазоны между ними. В других вариантах реализации изобретения подходящая доза антиметаногенного статина находится в диапазоне от около 0,01 мг/кг до около 10 мг/кг массы тела, в диапазоне от около 0,01 мг/кг до около 9 мг/кг массы тела, в диапазоне от около 0,01 мг/кг до около 8 мг/кг массы тела, в диапазоне от около 0,01 мг/кг до около 7 мг/кг массы тела, в диапазоне от 0,01 мг/кг до около 6 мг/кг массы тела, в диапазоне от около 0,05 мг/кг до около 5 мг/кг массы тела, в диапазоне от около 0,05 мг/кг до около 4 мг/кг массы тела, в диапазоне от около 0,05 мг/кг до около 3 мг/кг массы тела, в диапазоне от около 0,05 мг/кг до около 2 мг/кг массы тела, в диапазоне от около 0,05 мг/кг до около 1,5 мг/кг массы тела или в диапазоне от около 0,05 мг/кг до около 1 мг/кг массы тела.
[0105] В соответствии с некоторыми вариантами реализации изобретения антиметаногенный статин можно вводить, например, более одного раза в сутки, около одного раза в сутки, около раза через день, около раза через два дня, около одного раза в неделю, около одного раза каждые две недели, около одного раза в месяц, около одного раза в два месяца, около одного раза в три месяца, около одного раза в шесть месяцев или около одного раза в год.
[0106] В различных вариантах реализации изобретения антиметаногенный статин можно вводить пациенту натощак. В различных вариантах реализации изобретения антиметаногенный статин можно вводить пациенту с едой. В различных вариантах реализации изобретения антиметаногенный статин можно вводить пациенту после приема пищи. В различных вариантах реализации изобретения пациент питается элементными смесями. Пищевые смеси для общего энтерального питания (TEN), которые также называются «элементными смесями» коммерчески доступны, например, как VIVONEX T.E.N. (Nestle), а также доступны их варианты и т. п. Применяемые смеси для общего энтерального питания удовлетворяют все пищевые потребности субъекта, поскольку содержат свободные аминокислоты, углеводы, липиды, а также все необходимые витамины и минералы, но в такой форме, которая легко абсорбируется в верхних отделах желудочно-кишечного тракта, тем самым лишая метаногенный синтрофный микроорганизм питательных веществ, по меньшей мере, некоторых из питательных веществ, которые они используют для пролиферирации (или заставляя их «голодать»). Таким образом подавляется рост метаногенных синтрофных микроорганизмов.
Дополнительные агенты и комбинированная терапия или комбинированный состав/отбор пациентов
[0107] Введение составов по настоящему изобретению можно комбинировать с дополнительными терапевтическими агентами. Совместное введение дополнительного терапевтического агента и составов по настоящему изобретению может быть одновременным или последовательным. Кроме того, составы по настоящему изобретению могут содержать дополнительный терапевтический агент (например, в виде комбинированного состава).
[0108] В некоторых вариантах реализации изобретения составы с модифицированным высвобождением по настоящему изобретению вводят в комбинации с дополнительным терапевтическим агентом. В одном варианте реализации изобретения дополнительный терапевтический агент и антиметаногенный статин объединены в один состав с модифицированным высвобождением. В некоторых вариантах реализации изобретения способы лечения и/или профилактики включают введение составов с модифицированным высвобождением по настоящему изобретению субъекту, который проходит лечение дополнительным терапевтическим агентом.
[0109] В одном варианте реализации изобретения дополнительный агент и антиметаногенный статин вводят субъекту одновременно. В контексте данного документа термин «одновременно» означает, что дополнительный агент и антиметаногенный статин вводят с временным разделением не более чем около 60 минут, например, не более чем около 30 минут, не более чем около 20 минут, не более чем около 10 минут, не более чем около 5 минут или не более чем около 1 минуты. Введение дополнительного агента и антиметаногенного статина может представлять собой одновременное введение в едином составе (например, в составе, содержащем дополнительный агент и антиметаногенный статин) или в разных составах (например, первый состав содержит дополнительный агент, а второй состав содержит антиметаногенный статин).
[0110] Для совместного введения не требуется одновременного введения дополнительных терапевтических агентов, если время их введения таково, что фармакологическая активность дополнительного агента и антиметаногенного статина перекрывается по времени, тем самым оказывая комбинированный терапевтический эффект. Например, дополнительный агент и антиметаногенный статин можно вводить последовательно. В контексте данного документа термин «последовательно» означает, что дополнительный агент и антиметаногенный статин вводят с временным разделением более чем около 60 минут. Например, промежуток времени между последовательным введением дополнительного агента и антиметаногенного статина может составлять более чем около 60 минут, более чем около 2 часов, более чем около 5 часов, более чем около 10 часов, более чем около 1 суток, более чем около 2 суток, более чем около 3 суток или более чем около 1 недели. Время оптимального введения будет зависеть от скоростей метаболизма, экскреции, и/или фармакодинамической активности вводимого дополнительного агента и антиметаногенного статина. Первым можно вводить либо дополнительный агент, либо антиметаногенный статин.
[0111] В дополнительном варианте реализации изобретения дополнительный терапевтический агент и антиметаногенный статин вводят субъекту одновременно, но высвобождение дополнительного терапевтического агента и антиметаногенного статина из их соответствующих лекарственных форм (или, в случае комбинированного состава, из одной лекарственной формы с однократной дозировкой) в ЖКТ происходит последовательно.
[0112] Для совместного введения также не требуется вводить субъекту дополнительные терапевтические агенты тем же путем введения. Скорее, каждый терапевтический агент можно вводить любым подходящим путем, например, парентерально или непарентерально.
[0113] Составы по настоящему изобретению могут содержать фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах реализации изобретения состав может дополнительно содержать агент, который предотвращает или замедляет раскрытие лактонного кольца, такой как ингибитор эстеразы (например, грейпфрутовый сок или его компоненты, нарингенин, кемпферол) и/или ингибитор параоксоназы (например, ингибитор PON1 или PON3). В некоторых вариантах реализации изобретения ингибитор эстеразы и/или ингибитор параоксоназы представляет собой один или более из амиодарона, анастрозола, азитромицина, каннабиноидов, циметидина, кларитромицина, клотримазола, циклоспорина, даназола, делавирдина, дексаметазона диэтилдитиокарбамата, дилтиазема, диритромицина, дисульфирама, энтакапона, эритромицина, этинилэстрадиола, флуконазола, флуоксетина, флувоксамина, гестодена, грейпфрутового сока, индинавира, изониазида, кетоконазола, метронидазола, мибефрадила, миконазола, нефазодона, нелфинавира, невирапина, норфлоксацина, норфлуоксетина, омепразола, оксиконазола, пароксетина, пропоксифена, хинидина, хинина, квинупристина и дальфопристина, ранитидина, ритонавира, саквинавира, сертиндола, сертралина, троглитазона, тролеандомицина, вальпроевой кислоты и/или лактамного агента, выбранного из оксиндола, изатина, δ-валеролактама, ε-капролактама, 2-гидроксихинолина и 3,4-дигидро-2(1H)-хинолина и N-бром-ε-капролактама.
[0114] В различных вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению вводят в комбинации с ингибитором транспортера транспортного полипептида органических анионов (OATP). В одном варианте реализации изобретения ингибитор OATP и антиметаногенный статин объединены в один состав с модифицированным высвобождением. Без связи с какой-либо теорией считается, что включение ингибитора OATP минимизирует абсорбцию антиметаногенного статина из кишечника и/или уменьшает кишечно-печеночную рециркуляцию антиметаногенного статина, тем самым сводя к минимуму задержку антиметаногенного статина в кишечнике и сводя к минимуму любые потенциальные системные побочные эффекты антиметаногенного статина. Иллюстративные ингибиторы OATP включают, но не ограничиваясь ими, грейпфрутовый сок или компоненты грейпфрутового сока, такие как нарингин и гесперидин, апельсиновый сок и компоненты апельсинового сока, яблочный сок и компоненты яблочного сока, а также зеленый чай и экстракты зеленого чая, такие как галлат эпикатехина (ECG) и галлат эпигаллокатехина (EGCG). В одном варианте реализации изобретения ингибитор OATP высвобождается в кишечнике перед высвобождением антиметаногенного статина.
[0115] В одном варианте реализации изобретения дополнительный терапевтический агент представляет собой прокинетический агент, который облегчает перемещение массы по желудочно-кишечному тракту. Иллюстративные прокинетические агенты включают, но не ограничиваясь ими, прукалоприд (например, RESOLOR) или макролидный антибиотик, например, эритромицин. В другом варианте реализации изобретения дополнительный терапевтический агент является натуральным продуктом, таким как мятное масло, которое снимает боль в животе.
[0116] В настоящем изобретении также предусмотрено использование дополнительного терапевтического агента, применяемого для лечения запора, такого как, например, слабительные, агонист гуанилатциклазы C (например, линаклотид), агонист серотонина (например, прукалоприд, тегасерод), агонист хлоридного канала (например, лубипростон) и их комбинаций.
[0117] В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой агент, применяемый для лечения СРК (включая СРК-З). В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой селективный активатор хлоридного канала, включая, например, молекулы, полученные из простагландинов, такие как лубипростон (например, AMITIZA) и соединения, описанные в патентах США под номерами 5284858, 6414016 и 6583174, содержание которых полностью включено в данный документ посредством ссылки. В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой агент, включающий пептидный агент, повышающий секрецию хлорида и/или воды в кишечнике, и/или агент, размягчающий кал, и/или стимулирующий перистальтику кишечника, такой как, например, линаклотид (например, LINZESS) и соединения, описанные в патенте США № 7304036, полное содержание которого включено в данный документ посредством ссылки. В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой агент, который расслабляет ободочную кишку и/или замедляет перемещение отходов по нижнему отделу кишечника. В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой антагонист 5-HT3, включая, но не ограничиваясь им, лозетрон (например, LOTRONEX).
[0118] В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой малую молекулу, которая действует как периферический селективный агонист κ-опиоидов, такой как, например, EMD-61753 ((гидрохлорид N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)-этил]-2,2-дифенилацетамида, ASMADOLINE) и соединения, описанные в патенте США № 6344566, полное содержание которого включено в данный документ посредством ссылки. В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой антагонист холецистокинина, например, селективный в отношении подтипа CCKA и/или подавляющий моторику желудочно-кишечного тракта и уменьшающий желудочную секрецию, такой как, например, декслоксиглумид ((4R)-4-[(3,4-дихлорбензоил)амино]-5-(3-метоксипропилпентиламино)-5-оксопентановой кислоты), и соединения, описанные в патенте США № 5602179, полное содержание которого включено в данный документ посредством ссылки. В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой тапентадол (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол), как описано в патентной публикации США № 2013/0116334, полное содержание которой включено в данный документ посредством ссылки.
[0119] В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой слабительное, включая, но не ограничиваясь ими, осмотические слабительные (такие как, например, карбонат магния, гидроксид магния (например, взвесь магнезии), оксид магния, пероксид магния, сульфат магния, лактулозу, лактитол, сульфат натрия, пентаэритрит, макрогол, маннит, фосфат натрия, сорбит, цитрат магния, тартрат натрия, ламинарид и полиэтиленгликоль (например, продукты, содержащие макрогол, такие как MOVICOL и полиэтиленгликоль 3350 или SOFTLAX, MIRALAX, DULCOLAX BALANCE, CLEARLAX, OSMOLAX OR GLYCOLAX, GOLYTELY, GAVILYTE C, NULYTELY, GLYCOLAX, FORTRANS, TRILYTE, COLYTE, HALFLYTELY, SOFTLAX, LAX-A-DAY, CLEARLAX и MOVIPREP). В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой слабительное, включая, но не ограничиваясь ими, стимулирующие слабительные (такие как, например, SENOKOT). Также представлены контактные слабительные (например, оксифенизатин, бисакодил, дантрон, фенолфталеин, касторовое масло, гликозиды сенны, каскара, пикосульфат натрия и бисоксатин) и слабительные, увеличивающие объем кишечного содержимого (например, исфагула, этулоза, стеркулия, льняное семя, метилцеллюлоза, пшеница и поликарбофил кальция). В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой клизму, такую как, например, содержащую лаурилсульфат натрия, фосфат натрия, бисакодил, дантрон, глицерин, масло и сорбит. Периферические опиоидные антагонисты, такие как, например, алвимопан и метилналтрексон, а также простагланидины, такие как, например, лубипростон, в некоторых вариантах реализации изобретения также являются дополнительными терапевтическими агентами. Дополнительными терапевтическими средствами также могут быть линаклотид, прукалоприд и тегасерод.
[0120] В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой агент применяемый при длительной боли и спазмах, включая, но не ограничиваясь ими, антихолинергические средства (спазмолитики), такие как, например, дицикломин (BENTYL) и/или антидепрессанты, включая, например, дезипрамин (такой как, например, NORPRAMIN), имипрамин (TOFRANIL) или нортриптилин (PAMELOR), которые необязательно вводят в низких дозах. В низких дозах они могут облегчать боль, которая возникает при СРК.
[0121] В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой добавку в виде пищевых волокон, такую как, например, псиллиум (METAMUCIL) или метилцеллюлоза (CITRUCEL).
[0122] В некоторых вариантах реализации изобретения дополнительный терапевтический агент представляет собой агент, применяемый для лечения ожирения. Иллюстративные агенты включают, но не ограничиваясь ими, орлистат, лораказерин, фентермин-топирамат, сибутрамин, римонабант, экзенатид, прамлинтид, фентермин, бензфетамин, диэтилпропион, фендиметразин, бупропион и метформин. В различных вариантах реализации изобретения дополнительный агент представляет собой агент, который влияет на способность организма усваивать определенные питательные вещества из продуктов питания, такой как орлистат, глюкоманнан и гуаровая камедь. К числу дополнительных агентов также относятся агенты, которые подавляют аппетит, например, катехоламины и их производные (такие как фентермин и другие лекарственные средства на основе амфетамина), различные антидепрессанты и стабилизаторы настроения (например, бупропион и топирамат), анорексигенные средства (например, декседрин, дигоксин). К числу дополнительных агентов также относятся агенты, которые увеличивают обмен веществ в организме. В некоторых вариантах реализации изобретения дополнительные агенты могут быть выбраны из средств для подавления аппетита, ингибиторов обратного захвата нейротрансмиттеров, агонистов дофаминовых рецепторов, агонистов серотониновых рецепторов, модуляторов передачи сигналов через рецепторы ГАМК, противосудорожных средств, антидепрессантов, ингибиторов моноаминоксидазы, антагонистов вещества P рецепторов (NKl), агонистов и антагонистов рецепторов меланокортина, ингибиторов липазы, ингибиторов абсорбции жира, регуляторов потребления энергии или метаболизма, модуляторов каннабиноидных рецепторов, агентов для лечения зависимостей, агентов для лечения метаболического синдрома, модуляторов рецептора, активированного пролифератором пероксисом (PPAR) и антагонистов дипептидилпептидазы 4 (DPP-4). В некоторых вариантах реализации изобретения дополнительные агенты могут быть выбраны из амфетаминов, бензодиазепинов, сульфонилмочевин, меглитинидов, тиазолидиндионов, бигуанидов, бета-блокаторов, ингибиторов АПФ, диуретиков, нитратов, блокаторов кальциевых каналов, фенлермина, сибутрамина, лорказерина, цетилистата, римонабанта, таранабанта, топирамата, габапентина, вальпроата, вигабатрина, бупропиона, тиагабина, сертралина, флуоксетина, тразодона, зонисамида, метилфенидата, варениклина, налтрексона, диэтилпропиона, фендиметразина, репаглинида, натеглинида, глимепирида, пиоглитазона, розиглитазона и ситаглиптина.
[0123] В одном варианте реализации изобретения дополнительный терапевтический агент представляет собой агент для лечения предиабета, сахарного диабета, сахарного диабета II типа, резистентности к инсулину, непереносимости глюкозы или гипергликемии. Примеры лекарственных средств включают, но не ограничиваясь ими, ингибиторы альфа-глюкозидазы, аналоги амилина, ингибиторы дипептидилпептидазы-4, агонисты GLP1, меглитиниды, сульфонилмочевины, бигуаниды, тиазолидиндионы (TZD) и инсулин. Дополнительные примеры таких агентов включают бромокриптин и велхол. Примеры ингибиторов альфа-глюкозидазы включают, но не ограничиваясь ими, акарбозу и миглитол. Примером аналога амилина является прамлинтид. Примеры ингибиторов дипептидилпептидазы-4 включают, но не ограничиваясь ими, саксаглиптин, ситаглиптин, вилдаглиптин, линаглиптин и алоглиптин. Примеры агониста GLP1 включают, но не ограничиваясь ими, лираглутид, экзенатид, экзенатид с продленным высвобождением. Примеры меглитинидов включают, но не ограничиваясь ими, натеглинид и репаглинид. Примеры сульфонилмочевин включают, но не ограничиваясь ими, хлорпропамид, глимепирид, глипизид, глибурид, толазамид и толбутамид. Примеры бигуанидов включают, но не ограничиваясь ими, метформин, риомет, глюкофаж, глюкофаж XR, глуметза. Примеры тиазолидиндиона включают, но не ограничиваясь ими, розиглитазон и пиоглитазон. Примеры инсулина включают, но не ограничиваясь ими, аспарт, детемир, гларгин, глулизин и лиспро. Примеры комбинированных лекарственных средств включают, но не ограничиваясь ими, глипизид/метформин, глибурид/метформин, пиоглитазон/глимепирид, пиоглитазон/метформин, репаглинид/метформин, розиглитазон/глимепирид, розиглитазон/метформин, саксаглиптин/метформин, ситаглиптин/симвастатин, ситаглиптин/метформин, линаглиптин/метформин, алоглиптин/метформин и алоглиптин/пиоглитазон.
[0124] В другом варианте реализации изобретения дополнительный терапевтический агент представляет собой пробиотик. В некоторых вариантах реализации изобретения могут использоваться диетические смеси для энтерального питания с низким содержанием остаточного материала, такие как смеси из предварительно расщепленных или основных аминокислот, и другие способы и продукты, описанные в патенте США № 8110177 (содержание которого включено в данный документ посредством ссылки). В дополнительном варианте реализации изобретения такие диетические смеси для энтерального питания с низким содержанием остаточного материала могут быть составлены в виде смесей с низким содержанием углеводов и низким содержанием жиров со статинами немедленного или замедленного высвобождения или без них, или с красным дрожжевым рисом, который может быть особенно полезным для снижения массы тела и при сахарном диабете. В различных вариантах реализации изобретения пробиотик может содержать следующие иллюстративные клетки: E. coli штамм Nissle 1917, лактобактерии (например, ацидофильные, Lactobacillus brevis, L. bulgaricus, L. plantarum, L. rhamnosus, Rhamnosus L. fermentum, L. caucasicus, L. helveticus, L. lactis, L. reuteri и L. casei) или бифидобактерии (Bifidobacterium bifidum, B. infantis) Streptococcus thermophiles и Enterococcus faecium. Другие подходящие пробиотики и пребиотики описаны, например, в публикации R. Spiller, Aliment Pharmacol Ther 28, 385-396, полное содержание которой включено в данный документ посредством ссылки.
[0125] В некоторых вариантах реализации изобретения выбирают и/или вводят пробиотик, который необязательно подавляет рост метаногенов, например, Bifidobacterium spp. или виды или штаммы Lactobacillus, например, L. acidophilus, L. rhamnosus, L. plantarum, L. reuteri, L. paracasei подвид paracasei или L. casei Shirota, или пробиотик видов Saccharomyces, например, S. cerevisiae. Пробиотический агент, подавляющий метаногенез, можно вводить в фармацевтически приемлемом составе для приема внутрь, например, в капсуле, или для субъектов, которые употребляют пищу с введенными в нее добавками, эффективными являются, например, молоко, йогурт, сыр, мясо или другая готовая пища, способная к ферментированию. Пробиотические агенты могут подавлять рост метаногенов, например, посредством конкуренции с метаногенами за рост и, таким образом уменьшать или подавлять рост метаногенов.
Способы лечения
[0126] В одном аспекте в настоящем изобретении предложены способы лечения или профилактики расстройства, связанного с метаногенами, посредством введения субъекту, нуждающемуся в этом, состава с модифицированным высвобождением, содержащего по меньшей мере один антиметаногенный агент, такой как антиметаногенный статин, как описано в данном документе, в кишечнике (т. e. в тонкой и/или толстой кишке).
[0127] В некоторых вариантах реализации изобретения расстройство, связанное с метаногенами, представляет собой заболевание, или расстройство, или патологическое состояние, вызванное, возникшее в результате или связанное с одним или более из патологического присутствия или отсутствия метаногенов, патологических уровней метаногенов, чрезмерного роста метаногенов, повышенных уровней метаногенеза, повышенных уровней метана в кишечнике, чрезмерного поглощения водорода потребляющими водород метаногенами или колонизации метаногенами не соответствующих им мест (например, тонкого кишечника, а не толстого кишечника), либо по отдельности, либо в сочетании с неметаногенными синтрофными организмами.
[0128] Иллюстративные расстройства, связанные с метаногенами включают, но не ограничиваясь ими, колонизацию метаногенами кишечника, СРК, СРК-З, СРК-С, запоры, сахарный диабет, сахарный диабет 2 типа, метаболический синдром, резистентность к инсулину, метаболический синдром, ожирение, запоры, хронические запоры, хроническую псевдообструкцию кишечника, системный склероз, системную красную волчанку, дерматомиозит/полимиозит, узелковый периартериит, смешанные заболевания соединительной ткани, ревматоидный артрит, повреждение спинного мозга, болезнь Паркинсона, гипотиреоз/гипопаратиреоз, болезнь Гиршпрунга, болезнь Шагаса, гипоганглиоз кишечника и синдром Элерса-Данлоса.
[0129] В одном аспекте в настоящем изобретении предложены способы снижения или прекращения продукции и/или накопления метана в ЖКТ посредством введения субъекту, нуждающемуся в этом, состава с модифицированным высвобождением, содержащего по меньшей мере один антиметаногенный агент, такой как антиметаногенный статин, как описано в данном документе, в кишечнике (например, в тонкой и/или толстой кишке). В другом аспекте в настоящем изобретении предложены способы снижения уровня или устранения метана, например, продуцируемого метаногеном в ЖКТ, посредством введения субъекту, нуждающемуся в этом, состава с модифицированным высвобождением, содержащего по меньшей мере один антиметаногенный агент, такой как антиметаногенный статин, как описано в данном документе, в кишечнике (например, в тонкой и/или толстой кишке).
[0130] В различных вариантах реализации изобретения метаноген представляет собой микроорганизм, который продуцирует метан в качестве побочного продукта метаболизма. Метаногены классифицируются как археи. Примеры метаногенов включают, но не ограничиваясь ими, Methanobacterium bryantii, Methanobacterium formicum, Methanobrevibacter arboriphilicus, Methanobrevibacter gottschalkii, Methanobrevibacter ruminantium, Methanobrevibacter smithii, Methanocalculus chunghsingensis, Methanococcoides burtonii, Methanococcus aeolicus, Methanococcus deltae, Methanococcus jannaschii, Methanococcus maripaludis, Methanococcus vannielii, Methanocorpusculum labreanum, Methanoculleus bourgensis (Methanogenium olentangyi, Methanogenium bourgense), Methanoculleus marisnigri, Methanofollis liminatans, Methanogenium cariaci, Methanogenium frigidum, Methanogenium organophilum, Methanogenium wolfei, Methanomicrobium mobile, Methanopyrus kandleri, Methanoregula boonei, Methanosaeta concilii, Methanosaeta thermophile, Methanosarcina acetivorans, Methanosarcina barkeri, Methanosarcina mazei, Methanosphaera stadtmanae, Methanospirillium hungatei, Methanothermobacter defluvii (Methanobacterium defluvii), Methanothermobacter thermautotrophicus (Methanobacterium thermoautotrophicum), Methanothermobacter thermoflexus (Methanobacterium thermoflexum), Methanothermobacter wolfei (Methanobacterium wolfei), и Methanothrix sochngenii.
[0131] В одном аспекте в настоящем изобретении предложены способы снижения уровня или устранения метана, продуцируемого Methanobrevibacter smithii, в ЖКТ. В другом аспекте в настоящем изобретении предложены способы снижения уровня или устранения метана, продуцируемого Methanobrevibacter smithii в ЖКТ, посредством введения субъекту, нуждающемуся в этом, состава с модифицированным высвобождением, содержащего по меньшей мере один антиметаногенный агент, такой как антиметаногенный статин, как описано в данном документе, в кишечнике (например, в тонкой и/или толстой кишке). В некоторых вариантах реализации изобретения введение состава с модифицированным высвобождением, содержащего по меньшей мере один антиметаногенный агент, уменьшает уровень или устраняет метан, продуцируемый Methanobrevibacter smithii, в тонкой кишке (например, в одной или более из двенадцатиперстной кишки, тощей кишки, подвздошной кишки). В одном варианте реализации изобретения введение состава с модифицированным высвобождением, содержащего по меньшей мере один антиметаногенный агент, уменьшает уровень или устраняет метан, продуцируемый Methanobrevibacter smithii, в подвздошной кишке. В некоторых вариантах реализации изобретения введение состава с модифицированным высвобождением, содержащего по меньшей мере один антиметаногенный агент, уменьшает уровень или устраняет метан, продуцируемый Methanobrevibacter smithii, в толстой кишке (например, в одной или более из слепой кишки, восходящей, поперечной, нисходящей или сигмовидной частей ободочной кишки, и прямой кишки).
[0132] В одном аспекте в настоящем изобретении предложены способы снижения уровня или устранения метана, полученного из Methanobrevibacter smithii, в ЖКТ. В другом аспекте в настоящем изобретении предложены способы снижения уровня или устранения метана, продуцируемого Methanobrevibacter smithii в ЖКТ, посредством введения субъекту, нуждающемуся в этом, состава с модифицированным высвобождением, содержащего по меньшей мере один антиметаногенный агент, такой как антиметаногенный статин, как описано в данном документе, в кишечнике (т е. в тонкой и/или толстой кишке).
[0133] В различных вариантах реализации настоящее изобретение относится к существенному уменьшению уровня газа метана в ЖКТ субъекта (например, устранение метана в кишечнике). В некоторых вариантах реализации изобретения составы и способы по настоящему изобретению предотвращают повышение уровней газа метана в ЖКТ субъекта. В некоторых вариантах реализации изобретения уровни метана в ЖКТ пациента (по результатам оценки с помощью способов, описанных в данном документе, и способов, известных в данной области техники) снижаются на около 1 м.д., или около 2 м.д., или около 3 м.д., или около 4 м.д., или около 5 м.д., или около 10 м.д., или около 15 м.д., или около 20 м.д., или около 25 м.д., или около 30 м.д., или около 35 м.д., или около 40 м.д., или около 45 м.д., или около 50 м.д., или около 55 м.д., или около 60 м.д., или около 65 м.д., или около 70 м.д., или около 75 м.д., или около 80 м.д., или около 85 м.д., или около 90 м.д., или около 100 м.д. В различных вариантах реализации изобретения составы и способы по настоящему изобретению снижают уровни метана в ЖКТ пациента до меньше чем около 250 м.д., или меньше чем около 225 м.д., или меньше чем около 200 м.д., или меньше чем около 175 м.д., или меньше чем около 150 м.д., или меньше чем около 125 м.д., или меньше чем около 100 м.д., или меньше чем около 50 м.д. В различных вариантах реализации изобретения существенное уменьшение уровня газа метана не сопровождается существенным уменьшением уровня газа водорода.
[0134] В различных вариантах реализации изобретения настоящее изобретение относится к лечению СРК, включая СРК-З, как описано в МКБ-10 (Международная статистическая классификация болезней и проблем, связанных со здоровьем, издание ВОЗ). В различных вариантах реализации настоящее изобретение относится к лечению раздраженной ободочной кишки, что в классификации МКБ-10 соответствует коду [K58]. СРК может представлять собой синдром раздраженного кишечника без диареи, что в классификации МКБ-10 соответствует коду [K58.9]. Синдром раздраженного кишечника без диареи может также включать синдром раздраженного кишечника, не классифицированный в других рубриках (NOS). Кроме того, также включены заболевания, которые в классификации МКБ-10 соответствуют коду K59 (например, запор; K59.1 функциональная диарея; K59.2 неврогенная возбудимость кишечника, не классифицированная в других рубриках; K59.3 мегаколон, не классифицированный в других рубриках (включая расширение ободочной кишки, токсический мегаколон, мегаколон при болезни Шагаса (B57.3), врожденный (аганглионарный) (Q43.1) и при болезни Гиршпрунга (Q43.1)); K59.4 спазм анального сфинктера (включая преходящую прокталгию); K59.8 другие уточненные функциональные кишечные расстройства (включая атонию ободочной кишки) и K59.9 функциональное нарушение кишечника, неуточненное).
[0135] В различных вариантах реализации изобретения настоящее изобретение относится к лечению спастической ободочной кишки, нервного колита, слизистого колита, функционального колита или невроза ободочной кишки. В различных вариантах реализации изобретения настоящее изобретение относится к лечению заболеваний, которые были описаны как удлиненная и подвижная сигмовидная кишка, подвижная слепая кишка, хронический колит, висцероптоз и т. п. Типологическая классификация заболевания обычно включает спастическую толстую кишку, нервную диарею и слизистые колики; заболевание также может быть классифицировано как запор спастического типа, запор атонического типа, синдром образования кишечных газов или хроническая целиопатия.
[0136] Кроме того, СРК может также включать холангиодискинезию, гипофункцию опорожнения желудка, истерический комок в горле, неспецифические функциональные нарушения пищевода, нервную рвоту, периодические боли в животе, обычный запор, хронический идиопатический запор и т. п. В качестве диагностических критериев СРК подходят те, что описаны в NIH, Manning, Cook et al. и т. п. (см. публикацию Asakura, Clinical Digestive Internal Medicine, 8 (8): 1373-1381 (1993), полное содержание которой включено в данный документ посредством ссылки).
[0137] В различных вариантах реализации изобретения настоящее изобретение относится к лечению СРК, включая СРК-З, на разных стадиях или разной степени тяжести. В одном варианте реализации изобретения стадии или степень тяжести СРК можно оценить с помощью оценивания связанного со здоровьем качества жизни (HRQoL). В некоторых вариантах реализации изобретения стадию или степень тяжести заболевания у пациента, подлежащего лечению, оценивают посредством оценки одного или более из боли, вздутия живота, дисфункции кишечника и качества жизни/общего самочувствия пациента.
[0138] В некоторых вариантах реализации изобретения стадию или степень тяжести заболевания у пациента, подлежащего лечению, оценивают в соответствии с Римской шкалой (за последние 3 месяца с началом симптомов по меньшей мере за 6 месяцев до постановки диагноза: периодические боли или дискомфорт в животе (например, неприятные ощущения, которые не описываются как боль) по меньшей мере 3 дня в месяц за последние 3 месяца, связанные с двумя или более улучшениями дефекации, начало, связанное с изменением частоты дефекации и начало, связанное с изменением формы (внешнего вида) кала. В различных вариантах реализации изобретения композиции и способы настоящего изобретения по результатам оценки в соответствии с критериями Римской шкалы обеспечивают пациенту улучшение.
[0139] В некоторых вариантах реализации изобретения стадию или степень тяжести заболевания у пациента, подлежащего лечению, оценивают по шкале интенсивности боли в животе от 0 до 10 баллов. В различных вариантах реализации изобретения показатели ≥ 3 рассматриваются как страдание от боли, требующее лечения. В различных вариантах реализации изобретения оценка интенсивности боли в животе у пациента составляет более чем около 9, или около 8, или около 7, или около 6, или около 5, или около 4, или около 3. В различных вариантах реализации изобретения композиции и способы по настоящему изобретению уменьшают оценку интенсивности боли в животе на около 1, или около 2, или около 3, или около 4, или около 5, или около 6, или около 7, или около 8, или около 9, или около 10 баллов.
[0140] В некоторых вариантах реализации изобретения стадию или степень тяжести заболевания у пациента, подлежащего лечению, оценивают по шкале Круса (публикация Gastroenterology 87: 1-7, содержание которой включено в данный документ посредством ссылки). Эта шкала включает в себя как «основные» симптомы (боль, вздутие живота, нарушение функции кишечника), так и «тревожные» симптомы потенциального основополагающего органического заболевания, что, таким образом, исключит диагноз СРК. СРК диагностируется при сумме баллов >44.
Таблица 1. Система оценки Круса. СРК диагностируется при сумме баллов > 44.
|
[0141] В некоторых вариантах реализации изобретения оценивание пациента проводят так, как описано в публикации Francis, et al Aliment Pharmacol Ther 1997; 11: 395-402, полное содержание которой включено в данный документ посредством ссылки. Например, используется система оценки на основе ранжирования пациентом боли, вздутия, дисфункции кишечника и качества жизни/общего самочувствия пациента по шкале до 500 баллов. Легкие, средней тяжести и тяжелые случаи определяются оценками от 75 до 175, от 175 до 300 и > 300 баллов. В некоторых вариантах реализации изобретения пациент по настоящему изобретению имеет оценку от 75 до 175 баллов. В некоторых вариантах реализации изобретения пациент по настоящему изобретению имеет оценку от 175 до 300 баллов. В некоторых вариантах реализации изобретения пациент по настоящему изобретению имеет оценку > 300 баллов. В некоторых вариантах реализации изобретения шкалы описаны в публикации Wong and Drossman (Expert Rev. Gastroenterol. Hepatol. 4(3), (2010), полное содержание которой включено в данный документ посредством ссылки). Например, в некоторых вариантах реализации изобретения пациента по настоящему изобретению оценивают по таким параметрам, как дисфория, влияние на активность, представление об образе тела, беспокойство о состоянии здоровья, избегание приема пищи, социальная реакция и сексуальные отношения, причем описанная оценка необязательно составляет 0-100 баллов по шкале Патрика; и/или пациентов по настоящему изобретению оценивают по таким параметрам, как симптомы ежедневной активности, эмоционального воздействия, семейных отношений, питания, сна и усталости, социального воздействия, сексуальных отношений, причем описанная оценка необязательно составляет 0-216 баллов по шкале Гролла; пациентов по настоящему изобретению оценивают по таким параметрам, как виды деятельности, беспокойство, рацион питания, сон, ощущение дискомфорта, восприятие здоровья, преодоление болезни и стресса, причем описанная оценка необязательно составляет 0-100 баллов по шкале Чассани; пациентов по настоящему изобретению оценивают по таким параметрам, как эмоциональное здоровье, психическое здоровье, сон, энергичность, физическое функционирование, рацион питания, социальная роль, физическая роль и сексуальные отношения, причем описанная оценка необязательно составляет 0-100 баллов по шкале Хана; и/или пациентов по настоящему изобретению оценивают по таким параметрам, как симптомы со стороны кишечника, усталость, нарушение активности, эмоциональная дисфункция и, необязательно, оценивают с определением средней оценки по проблеме (рассчитывают путем деления суммарной оценки по проблеме на количество пунктов: диапазон 1-7), как описано в шкале Вонга.
[0142] В некоторых вариантах реализации изобретения пациенты могут быть стратифицированы на основе одного или более из определения метана (например, в дыхательном тесте) и определения метаногенов (например, с помощью ПЦР, например, кПЦР). В некоторых вариантах реализации изобретения дыхательный тест на метан у пациента считается положительным, если у субъекта определяют более чем около 3 м.д. метана. В некоторых вариантах реализации изобретения пациент по настоящему изобретению имеет более чем около 104, или около 105, или около 106 копий M. smithii на грамм влажного кала. В некоторых вариантах реализации изобретения пациента по настоящему изобретению определяется путем измерения вклада фракций метаногенов в общее микробное содержимое фекалий. В некоторых вариантах реализации изобретения пациент имеет более чем около 0,5%, или около 0,6%, или около 0,7%, или около 0,8%, или около 0,9%, или около 1,0%, или около 1,1%, или около 1,2%, или около 1,3%, или около 1,4%, или около 1,5%, или около 2,5% фракции M. smithii от общего микробного содержимого фекалий.
[0143] В различных вариантах реализации в настоящем изобретении предложены способы подавления или устранения метаногенеза, включая субъектов, пораженных одним или более из СРК-З, ожирения и сахарного диабета, причем субъекта оценивают как отвечающего или не отвечающего на терапию и проводят соответствующее лечение. Например, в некоторых вариантах реализации изобретения субъект может быть оценен по исходному уровню метана в кишечнике. Для такого измерения можно использовать любую из методик, описанных в данном документе, включая, без ограничений, дыхательный тест на метан. Впоследствии субъекту вводят один или более составов, описанных в данном документе, в течение начального периода лечения, который составляет менее чем около 1 недели (например, около 1 суток, или около 2 суток, или около 3 суток, или около 4 суток, или около 5 суток, или около 6 суток, или около 7 суток), после чего повторно оценивают уровень метана в кишечнике после начального лечения. Для такого измерения можно использовать любую из методик, описанных в данном документе, включая, без ограничений, дыхательный тест на метан. Это второе оценивание позволяет классифицировать субъектов как отвечающих или не отвечающих на лечение; например, отвечающие демонстрируют снижение уровня метана в кишечнике после начального лечения, в то время как у не отвечающих такое снижение не наблюдается. Соответственно, в некоторых вариантах реализации изобретения отвечающим на лечение пациентам назначают полный период введения одного или более составов, описанных в данном документе (например, введение в течение недель, месяцев, лет и даже в течение всей жизни пациента, включая долговременное введение). Кроме того, в некоторых вариантах реализации изобретения не отвечающим на лечение пациентам не назначают полный период введения одного или более составов, описанных в данном документе, а вместо этого лечат с использованием альтернативного вида терапии.
[0144] В различных вариантах реализации в настоящем изобретении предложены способы лечения запора у субъекта. В различных вариантах реализации изобретения субъекта оценивают как отвечающего или не отвечающего на терапию и проводят соответствующее лечение. Например, в некоторых вариантах реализации изобретения субъект может быть оценен по исходному уровню метана в кишечнике. Для такого измерения можно использовать любую из методик, описанных в данном документе, включая, без ограничений, дыхательный тест на метан. Впоследствии субъекту вводят один или более составов, описанных в данном документе, в течение начального периода лечения, который составляет менее, чем около 1 недели (например, около 1 суток, или около 2 суток, или около 3 суток, или около 4 суток, или около 5 суток, или около 6 суток, или около 7 суток), после чего повторно оценивают уровень метана в кишечнике после начального лечения. Для такого измерения можно использовать любую из методик, описанных в данном документе, включая, без ограничений, дыхательный тест на метан. Это второе оценивание позволяет классифицировать субъектов как отвечающих или не отвечающих на лечение; например, отвечающие демонстрируют снижение уровня метана в кишечнике после начального лечения, в то время как у не отвечающих такое снижение не наблюдается. Соответственно, в некоторых вариантах реализации изобретения отвечающим на лечение пациентам назначают полный период введения одного или более составов, описанных в данном документе (например, введение в течение недель, месяцев, лет и даже в течение всей жизни пациента, включая долговременное введение). Кроме того, в некоторых вариантах реализации изобретения не отвечающим на лечение пациентам не назначают полный период введения одного или более составов, описанных в данном документе, а вместо этого лечат с использованием альтернативного вида терапии.
[0145] В различных вариантах реализации в настоящем изобретении предложены способы лечения различных расстройств, связанных с метаногенами, включая, в качестве неограничивающего примера, СРК-З, причем субъекта оценивают как отвечающего или не отвечающего на терапию и проводят соответствующее лечение. Например, в некоторых вариантах реализации изобретения субъект может быть оценен по исходному уровню метана в кишечнике. Для такого измерения можно использовать любую из методик, описанных в данном документе, включая, без ограничений, дыхательный тест на метан. Впоследствии субъекту вводят один или более составов, описанных в данном документе, в течение начального периода лечения, который составляет менее, чем около 1 недели (например, около 1 суток, или около 2 суток, или около 3 суток, или около 4 суток, или около 5 суток, или около 6 суток, или около 7 суток), после чего повторно оценивают уровень метана в кишечнике после начального лечения. Для такого измерения можно использовать любую из методик, описанных в данном документе, включая, без ограничений, дыхательный тест на метан. Это второе оценивание позволяет классифицировать субъектов как отвечающих или не отвечающих на лечение; например, отвечающие демонстрируют снижение уровня метана в кишечнике после начального лечения, в то время как у не отвечающих такое снижение не наблюдается. Соответственно, в некоторых вариантах реализации изобретения отвечающим на лечение пациентам назначают полный период введения одного или более составов, описанных в данном документе (например, введение в течение недель, месяцев, лет и даже в течение всей жизни пациента, включая долговременное введение). Кроме того, в некоторых вариантах реализации изобретения не отвечающим на лечение пациентам не назначают полный период введения одного или более составов, описанных в данном документе, а вместо этого лечат с использованием альтернативного вида терапии.
[0146] В различных вариантах реализации в настоящем изобретении предложены способы идентификации пациента, который вероятно будет отвечать на длительное лечение (включая долгосрочное) одним или более составами, описанными в данном документе, с целью проведения одного или более видов лечения: подавление или снижение метаногенеза, включая метаногенез у субъектов, пораженных одним или более из СРК-З, ожирения и сахарного диабета; лечение запора; и лечение различных расстройств, связанных с метаногенами, включая, в качестве неограничивающего примера, СРК-З. В различных вариантах реализации изобретения способы включают этапы оценки у субъекта исходного уровня метан в кишечнике (например, с помощью любой из методик, описанных в данном документе, включая, без ограничений, дыхательный тест на метан); введения одного или более составов, описанных в данном документе, в течение начального периода лечения, который составляет менее чем около 1 недели (например, около 1 суток, или около 2 суток, или около 3 суток, или около 4 суток, или около 5 суток, или около 6 суток, или около 7 суток); и повторной оценки уровня метана в кишечнике субъекта после начального лечения (например, с помощью любой из методик, описанных в данном документе, включая, без ограничений, дыхательный тест на метан). Это повторное оценивание позволяет классифицировать субъектов как отвечающих или не отвечающих на лечение; например, отвечающие демонстрируют снижение уровня метана в кишечнике после начального лечения, в то время как у не отвечающих такое снижение не наблюдается. Отвечающими на лечение являются те пациенты, которые вероятно будут отвечать на длительное лечение (включая долгосрочное) одним или более составами, описанными в данном документе, с целью проведения одного или более видов лечения: подавление или снижение метаногенеза, включая метаногенез у субъектов, пораженных одним или более из СРК-З, ожирения и сахарного диабета; лечение запора; и лечение различных расстройств, связанных с метаногенами, включая, в качестве неограничивающего примера, СРК-З.
[0147] В некоторых вариантах реализации изобретения способы по настоящему изобретению лечат или предотвращают запор. Запор может быть связан, например, с проведением химиотерапии, применением алкалоидов барвинка, оксалиплатины, таксанов, талидомида, опиоидов, седативных средств, антихолинергических средств, желудочно-кишечных спазмолитиков, противопаркинсонических агентов, антидепрессантов, фенотиазинов, антацидов на основе кальция и алюминия, диуретиков, транквилизаторов, снотворных составов, общей анестезии, средств для блокады срамного нерва, недостаточным потреблением жидкости, чрезмерным применением слабительных и/или клизм, длительной неподвижностью, недостаточной физической активностью, повреждением или сдавлением спинного мозга, переломами, усталостью, слабостью, отсутствием активности, соблюдением постельного режима, проблемами со стороны сердца, дивертикулитом, неврологическими поражениями, опухолями мозга, повреждением спинного мозга, компрессией спинного мозга, параплегией, нарушением мозгового кровообращения с парезом, слабыми мышцами брюшного пресса, гипотиреозом, отравлением свинцом, уремией, обезвоживанием, гиперкальциемией, гипокалиемией, гипонатриемией, анорексией, неподвижностью, антидепрессантами, невозможностью увеличения внутрибрюшного давления, эмфиземой, нервно-мышечным нарушением диафрагмы, нервно-мышечным нарушением мышц живота, грыжами живота, недоеданием, кахексией, анемией, раковым заболеванием и старческим слабоумием. В некоторых вариантах реализации изобретения способы по изобретению увеличивают количество актов дефекации у субъекта, страдающего запором. Например, способы по изобретению могут увеличивать количество актов дефекации у субъекта по меньшей мере на 1, 2, 3, 4 или 5 дефекаций в неделю. В некоторых вариантах реализации изобретения способы по изобретению увеличивают массу влажного кала у субъекта, страдающего запором. Например, способы по изобретению могут увеличивать массу влажного кала по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100%.
[0148] В различных вариантах реализации изобретения запор связан с СРК, но настоящее изобретения в некоторых вариантах реализации может также относиться к хроническому функциональному запору.
[0149] В различных вариантах реализации изобретения настоящее изобретение относится к лечению повышенной висцеральной гиперчувствительности. В различных вариантах реализации изобретения настоящее изобретение относится к лечению одного или более из боли в желудке, боли, тошноты, напряжения и вздутия живота и/или газообразования. Составы и способы по настоящему изобретению также лечат одно или более из твердого кала, редкой частоты дефекации, трудности или напряжения при дефекации, ощущения неспособности полного опорожнения во время акта дефекации и ощущения желания опорожнения кишечника, но неспособности осуществления этого.
[0150] В различных вариантах реализации изобретения настоящее изобретение относится к лечению сахарного диабета (1 типа или 2 типа) и/или непереносимости глюкозы. В некоторых вариантах реализации изобретения настоящее изобретение относится к способу лечения пациента с риском развития сахарного диабета, одного или более из резистентности к инсулину, предиабета, нарушения уровня глюкозы натощак (IFG), нарушенной толерантности к глюкозе (IGT) и акантокератодермии.
[0151] В некоторых вариантах реализации изобретения предложены способы стимуляции потери массы тела или предотвращения увеличения массы тела (или лечения или профилактики ожирения, или стимуляции потери массы тела, или предотвращения увеличения массы тела у пациента, который по существу не изменяет потребление калорий), включающие введение составов по настоящему изобретению. Пациентам может быть проведена или им планируется проведение хирургической операции на органах системы пищеварения; у них может быть излишняя масса тела, составляющая 80-100 фунтов (32-40 кг); их ИМТ может превышать около 35 кг/м2; или они могут иметь проблемы со здоровьем, связанные с ожирением.
[0152] В некоторых вариантах реализации изобретения введение состава с модифицированным высвобождением по настоящему изобретению не обеспечивает связанные со снижением уровня холестерина эффекты со стороны сердечно-сосудистой системы, наблюдаемые при системном введении статинов. Например, составы и способы по настоящему изобретению могут предотвратить или уменьшить системное воздействие статина на субъекта. Например, составы и способы по настоящему изобретению после лечения могут обеспечить среднее уменьшение уровней ЛПНП-Х в сыворотке менее чем на около 20%, около 19%, около 18%, около 17%, около 16%, около 15%, около 14%, около 13%, около 12%, около 11%, около 10%, около 9%, около 8%, около 7%, около 6%, около 5%, около 4%, около 3% или около 2%.
[0153] В некоторых вариантах реализации изобретения пациент представляет собой пациента, которому не требуется терапевтическое применение статинов для лечения сердечно-сосудистых заболеваний. В некоторых вариантах реализации изобретения пациент представляет собой пациента, которому не требуется терапевтическое применение статинов для лечения сердечно-сосудистых заболеваний и у которого выявлено образование метана (например, по результатам оценки с помощью способов, описанных в данном документе, таких как дыхательный тест на метан и кПЦР).
[0154] Посредством максимального увеличения удержания антиметаногенных статинов в кишечнике, в способах настоящего изобретения также минимизируются побочные эффекты, связанные с системным высвобождением статина. Например, способ по настоящему изобретению предотвращает и/или сводит к минимуму различные неблагоприятные эффекты, связанные с применением статинов, включая связанные с мышцами неблагоприятные эффекты, такие как миозит, миалгии, рабдомиолиз, межлекарственные взаимодействия, когнитивные эффекты, повышенный риск развития рака, увеличение уровня печеночных ферментов, геморрагический инсульт, повышение уровня глюкозы в крови, нарушения сна, периферическую невропатию, половую дисфункцию, дисфункцию щитовидной железы, почечную токсичность, раздражительность, одышку, гиперкалиемию, увеличение массы тела, нейродегенеративное заболевание, панкреатит, патологию печени, митохондриальные синдромы, дерматологические патологические состояния, сухость во рту, катаракту, нарушение обоняния, неблагоприятные эффекты со стороны крови и костного мозга, гипотензию, неблагоприятные эффекты со стороны желудочно-кишечного тракта, включая язвенный колит и язву желудка, усталость и головную боль. В некоторых вариантах реализации изобретения способы по изобретению также сводят к минимуму следующие побочные эффекты, связанные с системным высвобождением статина: мышечная боль, болезненность или слабость, недостаток энергии, слабость, лихорадка, темное окрашивание мочи, желтуха, боли в желудке, в том числе в верхней правой части живота, тошнота, необычные кровотечение или гематомы, потеря аппетита, гриппоподобные симптомы, сыпь, крапивница, зуд, затрудненное дыхание или глотание и отек лица, горла, языка, губ, глаз, рук, ног, лодыжек или голеней, охриплость.
[0155] Соответственно, состав с модифицированным высвобождением по настоящему изобретению может применяться для целевого воздействия у субъектов, у которых нежелательно системное повышение уровней статина. В одном варианте реализации изобретения субъект может представлять собой женщин и детей, которые не имеют других проблем со здоровьем и не нуждаются в составе для лечения сердечно-сосудистых заболеваний (что характеризуется, например, как наличие низкого или нулевого факторов риска развития инфаркта согласно Руководству ATP III). В другом варианте реализации изобретения субъект может быть ребенком с СРК-З, у которого нет необходимости применения агента для снижения уровня холестерина. В таких вариантах реализации изобретения введение состава с модифицированным высвобождением по настоящему изобретению приводит к среднему уменьшению уровней ЛПНП-Х в сыворотке менее чем на около 20%, около 19%, около 18%, около 17%, около 16%, около 15%, около 14%, около 13%, около 12%, около 11%, около 10%, около 9%, около 8%, около 7%, около 6%, около 5%, около 4%, около 3% или около 2%.
[0156] Состав с модифицированным высвобождением по настоящему изобретению также может применяться как часть схемы лечения, в которой субъекту назначают начальную антиметаногенную терапию с последующим назначением долговременной поддерживающей антиметаногенной или снижающей уровень метана и/или устраняющей метан терапии.
[0157] Для начальной антиметаногенной терапии кроме статинов можно применять другие агенты, такие как, например, антибиотики, которые уничтожают метаногены. Например, можно применять нитроимидазолы, такие как метронидазол, сложные эфиры и/или изомеры метронидазола, или гидрофобные производные имидазола, рифаксимина или неомицина, достаточные для уничтожения, существенного уменьшения или уменьшения кишечной колонизации метаногенами. Такая начальная терапия может продолжаться 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 14, 28, 42, 56, 60, 90, 120 или 180 суток или более. Примеры антибиотиков включают, но не ограничиваясь ими, аминогликозиды (например, амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин, паромомицин), ансамицины (например, гелданамицин, гербимицин), карбацефемы (например, лоракарбеф), карбапенемы (например, эртапенем, дорипенем, имипенем, циластатин, меропенем), цефалоспорины (например, первого поколения: цефадроксил, цефазолин, цефалотин или цефалозин, цефалексин; второго поколения: цефаклор, цефамандол, цефокситин, цефпрозил, цефуроксим; третьего поколения: цефиксим, цефдинир, цефдиторен, цефоперазон, цефотаксим, цефподоксим, цефтазидим, цефтибутен, цефтизоксим, цефтриаксон; четвертого поколения: цефепим; пятого поколения: цефтобипрол), гликопептиды (например, тейкопланин, ванкомицин), макролиды (например, азитромицин, кларитромицин, диритромицин, эритромицин, рокситромицин, тролеандомицин, телитромицин, спектиномицин), монобактамы (например, азтреонам), пенициллины (например, амоксициллин, ампициллин, азлоциллин, карбенициллин, клоксациллин, диклоксациллин, флуклоксациллин, мезлоциллин, метициллин, нафциллин, оксациллин, пенициллин, пиперациллин, тикарциллин), антибиотики-полипептиды (например, бацитрацин, колистин, полимиксин B), хинолоны (например, ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, тровафлоксацин), рифамицины (например, рифампицин или рифампин, рифабутин, рифапентин, рифаксимин), сульфаниламиды (например, мафенид, пронтозил, сульфацетамид, сульфаметизол, сульфаниламид, сульфасалазин, сульфисоксазол, триметоприм, триметоприм-сульфаметоксазол (ко-тримоксазол, «tmp-smx») и тетрациклины (например, демеклоциклин, доксициклин, миноциклин, окситетрациклин, тетрациклин), а также арсфенамин, хлорамфеникол, клиндамицин, линкомицин, этамбутол, Фосфомицин, фузидиевая кислота, фуразолидон, изониазид, линезолид, метронидазол, мупироцин, нитрофурантоин, платензимицин, пиразинамид, комбинация квинупристин/дальфопристин и тинидазол.
[0158] После начальной терапии субъекту может быть назначена поддерживающая терапия с целью поддержания сниженных уровней метаногенов и/или метана. В некоторых вариантах реализации изобретения для поддерживающей терапии применяют состав с модифицированным высвобождением по настоящему изобретению. В одном варианте реализации изобретения начальная терапия включает применение антибиотика с последующим назначением долговременной поддерживающей схемы применения составов, содержащих низкую дозу статина. В различных вариантах реализации изобретения поддерживающую схему можно применять в течение по меньшей мере 1 недели, по меньшей мере 2 недель, по меньшей мере 3 недель, по меньшей мере 4 недель, по меньшей мере одного месяца, по меньшей мере двух месяцев, по меньшей мере трех месяцев, по меньшей мере четырех месяцев, по меньшей мере пяти месяцев, по меньшей мере шести месяцев, по меньшей мере семи месяцев, по меньшей мере восьми месяцев, по меньшей мере девяти месяцев, по меньшей мере десяти месяцев, по меньшей мере одиннадцати месяцев, по меньшей мере 1 года, по меньшей мере 2 лет, по меньшей мере 3 лет, по меньшей мере 4 лет, по меньшей мере 5 лет, по меньшей мере 10 лет или неопределенно долгое время.
[0159] Состав с модифицированным высвобождением по настоящему изобретению может применяться исключительно для долговременной поддерживающей терапии. В различных вариантах реализации в настоящем изобретении предложен способ лечения пациентов в возрасте от 40 до 75 лет, у которых ранее было выявлено образование метана, и которые не имеют одного или более из сердечно-сосудистого заболевания, уровня ЛПНП 190 мг/дл или выше, сахарного диабета 2 типа, возраст которых составляет от 40 до 75 лет, оценочный 10-летний риск развития сердечно-сосудистого заболевания 7,5 процента или выше, составом с модифицированным высвобождением, описанным в данном документе, для поддержания их отрицательного статуса обнаружения метана. Соответственно, в некоторых вариантах реализации изобретения состав с модифицированным высвобождением по настоящему изобретению применяется в качестве профилактического средства у пациентов с высоким уровнем риска.
[0160] В различных вариантах реализации изобретения способы по настоящему изобретению применяются для лечения субъекта-человека. В некоторых вариантах реализации изобретения человек является ребенком. В других вариантах реализации изобретения человек является взрослым. В других вариантах реализации изобретения человек является пожилым человеком. В других вариантах реализации изобретения человек может называться пациентом. В некоторых вариантах реализации изобретения человек является женщиной. В некоторых вариантах реализации изобретения человек является мужчиной.
[0161] В некоторых вариантах реализации изобретения возраст человека находится в диапазоне от около 1 до около 18 месяцев, от около 18 до около 36 месяцев, от около 1 до около 5 лет, от около 5 до около 10 лет, от около 10 до около 15 лет, от около 15 до около 20 лет, от около 20 до около 25 лет, от около 25 до около 30 лет, от около 30 до около 35 лет, от около 35 до около 40 лет, от около 40 до около 45 лет, от около 45 до около 50 лет, от около 50 до около 55 лет, от около 55 до около 60 лет, от около 60 до около 65 лет, от около 65 до около 70 лет, от около 70 до около 75 лет, от около 75 до около 80 лет, от около 80 до около 85 лет, от около 85 до около 90 лет, от около 90 до около 95 лет или от около 95 до около 100 лет. В одном варианте реализации изобретения человек является ребенком. В одном варианте реализации изобретения человек является женщиной.
Способы определения уровней метаногенов. Диагностика и отбор пациентов
[0162] Уровни метаногенов и/или метана в кишечнике можно определить с помощью дыхательных тестов, в которых измеряют уровни метана в выдыхаемом воздухе. Проведение дыхательных тестов можно использовать для определения субъектов, являющихся «метан-положительными», которые потенциально могут получить пользу от применения способов по настоящему изобретению. Кроме того, проведение дыхательных тестов можно также использовать для отслеживания эффективности лечения. Способы и оборудование для проведения дыхательных тестов известны в данной области техники (см., например, публикацию PCT/US14/27697, полное содержание которой включено в данный документ посредством ссылки). Примеры такого оборудования включают, например, газовый хроматограф (ГХ)-анализатор QuinTron BreathTracker или устройство QuinTron BreathTracker (QuinTron Instrument Company, Inc., Milwaukee, WI).
[0163] Кроме того, у субъектов с СРК обычно встречается отклонение от нормы результатов дыхательного теста с использованием лактулозы, и поэтому в настоящем изобретении при оценивании пациентов предложено использование дыхательных тестов с лактулозой. В некоторых вариантах реализации изобретения пациента оценивают с использованием дыхательного теста с лактулозой перед и/или после введения составов по настоящему изобретению.
[0164] В общем, у индивидуумов, имеющих уровень метана в выдыхаемом воздухе, составляющий по меньшей мере около 3 м.д., обычно имеется связь с расстройствами, связанными с метаногенами, и у них имеется вероятность получения пользы от способов по настоящему изобретению. В альтернативном варианте способы по настоящему изобретению могут использоваться на практике у субъектов, имеющих уровень метана в выдыхаемом воздухе, составляющий по меньшей мере 1 м.д., по меньшей мере 1,5 м.д., по меньшей мере 2 м.д., по меньшей мере 2,5 м.д., по меньшей мере 3 м.д., по меньшей мере 3,5 м.д., по меньшей мере 4 м.д., по меньшей мере 5 м.д., по меньшей мере 6 м.д., по меньшей мере 7 м.д., по меньшей мере 8 м.д., по меньшей мере 9 м.д., по меньшей мере 10 м.д.
[0165] Один из способов измерения уровней метаногенов включает расчет площади под кривой уровня метана в выдыхаемом воздухе (BM-ППК) у субъекта. Этот способ предполагает получение множество образцов выдыхаемого воздуха в среднем через интервалы времени, составляющие около 15 минут, в течение периода около 90 минут, или около 120 минут, или до 4 часов или более при потенциально менее частых интервалах. Результаты для периода времени используются для расчета BM-ППК пациента. Например, субъекту можно выполнять такой дыхательный тест с лактулозой, ксилозой, лактозой или глюкозой после голодания в течение 12 часов. Дыхательный тест может включать исходное измерение метана в выдыхаемом воздухе, после чего субъект принимает внутрь около 10 г лактулозы, ксилозы, лактозы или глюкозы. После приема внутрь лактулозы, субъекту предлагают выполнить дыхательный тест с получением образца через интервалы времени, составляющие около 15 минут, в течение периода от около 90 минут до около 120 минут для определения продукции метана. BM-ППК может быть использована для более точного определения и отслеживания, например, эффективности антиметаногенной терапии. Показатели BM-ППК также могут быть использованы для разделения «метан-положительных» субъектов от «метан-отрицательных» субъектов для улучшения принятия клинического решения. BM-ППК можно сравнивать или использовать вместе с измерением уровней метаногенов в образцах кала с помощью ПЦР, например, кПЦР. В альтернативном варианте измерение уровней метаногенов в образцах кала с помощью ПЦР, например, кПЦР, может заменить использование дыхательного теста. В более точных методиках может также использоваться измерение уровня метана в выдыхаемом воздухе с учетом и вычитанием уровня метана в окружающей среде.
[0166] Капельный анализ метана в выдыхаемом воздухе с использованием коммерчески доступного оборудования, такого как аппарат BreathTracker, можно использовать для дифференциации «метан-положительных» и «метан-отрицательных» субъектов, а также для отслеживания успеха, неудачи, титрования дозы, схемы дозирования (например, ежедневно или не ежедневно) составов с модифицированным высвобождением, таких как различные антиметаногенные статины. Например, может быть определена самая низкая минимальная эффективная доза. Дополнительные инструменты и методики для измерения уровней метана включают, но не ограничиваясь ими, методики усиленной резонатором абсорбции с применением инструмента LGR-FMR для измерения уровня метана с диапазоном измерения от 0,01 м.д. (Los Gatos Research, Inc., Mountain View, CA), спектроскопию внутрирезонаторного спада сигнала во времени со сканированием длины волны, анализ изотопов углерода (G2132-i13C, Picarro, Inc, Santa Clara, CA), газовую хроматографию, масс-спектроскопию, анализ изотопов углерода, экстрагированного из мембран (Pollock, 2012 GSA Annual Meeting, «Membrane Extracted Carbon Isotope Analysis Of Dissolved Methane»), газовую хроматографию в свободном пространстве над продуктом с использованием, например, инструмента для масс-спектрометрии изотопных соотношений (IRMS) с пламенно-ионизационным детектором (ПИД) и ГХ-сгоранием. Другие инструменты, обладающие способностью измерения уровней низкой концентрации метана в выдыхаемом воздухе с большей точностью, чем инструмент одобренный для использования в клинической практике и доступный на рынке как QuinTron BreathTracker, включают высокоточный анализ метана в выдыхаемом воздухе (HPBMA). HPBMA можно применять для проведения капельного анализа уровней метана в выдыхаемом воздухе или в виде BM-ППК.
[0167] В некоторых вариантах реализации изобретения определение количества водорода и количества метана осуществляют посредством газовой хроматографии с масс-спектрометрией и/или детектирования излучения для измерения выдыхаемого меченого изотопом диоксида углерода, метана или водорода после введения меченого изотопом субстрата, такого как лактулоза, ксилоза, маннит или мочевина, который метаболизируется желудочно-кишечными бактериями, но плохо переваривается в организме человека-хозяина (например, G. R. Swart and J. W. van den Berg, 13C breath test in gastrointestinal practice, Scand. J. Gastroenterol. [Suppl.] 225:13-18 [1998]; S. F. Dellert et al., The 13C-xylose breath test for the diagnosis of small bowel bacterial overgrowth in children, J. Pediatr. Gastroenterol. Nutr. 25(2):153-58 [1997]; C. E. King and P. P. Toskes, Breath tests in the diagnosis of small intestinal bacterial overgrowth, Crit. Rev. Lab. Sci. 21(3):269-81 [1984]). Плохо перевариваемый субстрат представляет собой субстрат, для которого существует относительное или абсолютное отсутствие возможностей его абсорбции или ферментативного разложения или катаболизма в организме человека.
[0168] Подходящие изотопные метки включают 13C или 14C. Подходящие изотопные метки для измерения метана могут также включать 2H и 3H или 17O и 18O, до тех пор, пока субстрат синтезируется с изотопной меткой, помещенной в метаболически подходящем месте в структуре субстрата, т. e. в месте, где ферментативное биоразложение кишечной микрофлорой приводит к выделению изотопной метки в газообразном продукте. Если в качестве изотопной метки выбран радиоактивный изотоп, например, 14C, 3H или 15O, образцы выдыхаемого воздуха можно проанализировать с помощью газовой хроматографии с использованием соответствующих средств обнаружения излучения (например, C. S. Chang et al., Increased accuracy of the carbon-14 D-xylose breath test in detecting small-intestinal bacterial overgrowth by correction with the gastric emptying rate, Eur. J. Nucl. Med. 22(10):1118-22 [1995]; C. E. King and P. P. Toskes, Comparison of the 1-gram [14C]xylose, 10-gram lactulose-H2, and 80-gram glucose-H2 breath tests in patients with small intestine bacterial overgrowth, Gastroenterol. 91(6):1447-51 [1986]; A. Schneider et al., Value of the 14C -D-xylose breath test in patients with intestinal bacterial overgrowth, Digestion 32(2):86-91 [1985]).
[0169] В различных вариантах реализации изобретения лечение с применением состава с модифицированным высвобождением по настоящему изобретению приводит к снижению уровня метана в выдыхаемом воздухе по меньшей мере на около 1 м.д., по меньшей мере на около 2 м.д., по меньшей мере на около 3 м.д., по меньшей мере на около 4 м.д., по меньшей мере на около 5 м.д., по меньшей мере на около 6 м.д., по меньшей мере на около 7 м.д., по меньшей мере на около 8 м.д., по меньшей мере на около 9 м.д., по меньшей мере на около 10 м.д., по меньшей мере на около 20 м.д., по меньшей мере на около 30 м.д., по меньшей мере на около 40 м.д., по меньшей мере на около 50 м.д., по меньшей мере на около 60 м.д., по меньшей мере на около 70 м.д., по меньшей мере на около 80 м.д., по меньшей мере на около 90 м.д., по меньшей мере на около 100 м.д., по меньшей мере на около 110 м.д., по меньшей мере на около 120 м.д., по меньшей мере на около 130 м.д., по меньшей мере на около 140 м.д., по меньшей мере на около 150 м.д., по меньшей мере на около 160 м.д., по меньшей мере на около 170 м.д., по меньшей мере на около 180 м.д., по меньшей мере на около 190 м.д., по меньшей мере на около 200 м.д., по меньшей мере на около 210 м.д., по меньшей мере на около 220 м.д., по меньшей мере на около 230 м.д., по меньшей мере на около 240 м.д. и по меньшей мере на около 250 м.д.
[0170] Образцы, используемые для данного изобретения, включают выдыхаемый воздух пациента. В различных вариантах реализации изобретения, например, также предложено измерение уровней метаногенов образцах кала с помощью ПЦР, например, кПЦР, или других подходов из области молекулярной биологии. Кроме того, на уровни метаногенов и/или метана могут быть проанализированы аспираты жидкости из ЖКТ. Также на уровни метаногенов и/или метана могут быть проанализированы биоптаты из области желудочно-кишечного тракта.
[0171] Специалистам в данной области хорошо известны способы «количественной» амплификации. Например, количественная ПЦР включает в себя одновременную коамплификацию известного количества контрольной последовательности с использованием тех же праймеров. Это обеспечивает внутренний стандарт, который может быть использован для калибровки ПЦР-реакции. Подробные протоколы для проведения количественной ПЦР представлены, например, в публикации Innis, et al. (1990) PCR Protocols, A Guide to Methods and Applications, Academic Press, Inc. N.Y.). Измерение числа копий ДНК в микросателлитных локусах с использованием количественного анализа ПЦР описано, например, в публикации Ginzonger, et al. (2000) Cancer Research 60:5405-5409. Известная последовательность нуклеиновых кислот генов достаточна для того, чтобы любой специалист в данной области техники мог выбрать праймеры для амплификации любой части гена. В способах по настоящему изобретению можно также использовать флуорогенную количественную ПЦР. При флуорогенной количественной ПЦР количественный анализ основан на количестве сигналов флуоресценции, например, TaqMan и SYBRGreen.
[0172] Другие подходящие способы амплификации включают, но не ограничиваясь ими, лигазную цепную реакцию (ЛЦР) (см., например, Wu and Wallace (1989) Genomics 4: 560, Landegren, et al. (1988) Science 241:1077, и Barringer et al. (1990) Gene 89: 117), транскрипционную амплификацию (Kwoh, et al. (1989) Proc. Natl. Acad. Sci. USA 86: 1173), замедленную саморепликацию последовательностей (Guatelli, et al. (1990) Proc. Nat. Acad. Sci. USA 87: 1874), дот-ПЦР и линкер-адаптер ПЦР и т. п.
[0173] В других вариантах реализации способов, предложенных в настоящем изобретении, выполняют секвенирование отдельных нуклеиновых молекул (или продуктов их амплификации). В одном варианте реализации изобретения перед секвенированием может использоваться методика высокопроизводительного параллельного секвенирования, в которой выделяют отдельные молекулы нуклеиновых кислот из популяции молекул нуклеиновых кислот. Для таких стратегий можно использовать так называемые «системы секвенирования следующего поколения», включая, без ограничений, машины и/или стратегии секвенирования, хорошо известные в данной области техники, такие как разработанные компанией Illumina/Solexa (геномный анализатор; Bennett et al. (2005) Pharmacogenomics, 6:373-20 382), компанией Applied Biosystems, Inc. (секвенсер SOLiD; solid.appliedbiosystems.com), компанией Roche (например, секвенсер 454 GS FLX sequencer; Margulies et al. (2005) Nature, 437:376-380; патенты США под номерами 6274320; 6258568; 6210891) и др. Также могут быть использованы другие стратегии секвенирования, такие как стохастическое секвенирование (например, разработанное компанией Oxford Nanopore), например, как описано в международной патентной публикации № WO/2010/004273.
[0174] В других вариантах реализации способов, предложенных в настоящем изобретении, для идентификации и количественного определения метаногенов или метаногенных синтрофных микроорганизмов может быть использовано глубокое секвенирование. Эти методики известны в данной области техники.
Наборы
[0175] Настоящее изобретение также относится к набору для лечения расстройства, связанного с метаногенами. Набор представляет собой совокупность материалов или компонентов, включая по меньшей мере один из составов с модифицированным высвобождением, описанных в данном документе. Набор может дополнительно содержать материалы и компоненты для количественного определения метаногенов. Точные характеристики компонентов, собранных в наборе, зависят от цели его использования. В одном варианте реализации изобретения набор скомпонован для лечения субъектов-людей.
[0176] В набор могут быть включены инструкции по применению. Как правило, инструкции по применению включают конкретные формулировки, описывающее методику, которую необходимо использовать при применении компонентов набора для получения желаемого результата, например, для лечения расстройства, связанного с метаногенезом. Набор также необязательно содержит другие пригодные компоненты, такие как разбавители, буферы, фармацевтически приемлемые носители, шприцы, катетеры, аппликаторы, инструменты для пипетирования или измерения, перевязочные материалы или другие пригодные атрибуты, которые будут легко определены специалистами в данной области техники.
[0177] Материалы и компоненты, собранные в наборе, могут быть предоставлены практикующему врачу, хранящимися в любых удобных и подходящих условиях, которые сохраняют их пригодность для эксплуатации и эффективность. Например, компоненты могут быть предоставлены при комнатной, прохладных температурах или в замороженном виде. Компоненты, как правило, содержатся в пригодных упаковочных материалах. В различных вариантах реализации изобретения упаковочный материал изготавливается с помощью хорошо известных способов, предпочтительно для обеспечения стерильной, неконтаминированной среды. Упаковочный материал может иметь внешнюю этикетку, которая указывает на содержание и/или цели применения набора и/или его компонентов.
[0178] В различных вариантах реализации изобретения набор содержит флакон для таблеток, содержащий влагопоглотитель для поддержания стабильности состава.
[0179] Настоящее изобретение дополнительно описано посредством ссылки на следующие неограничивающие примеры.
ПРИМЕРЫ
Пример 1. Состав с двойным импульсным высвобождением
[0180] Клиническое исследование было проведено у пациентов-людей. Пациенту вводили ALTOPREV (т. e. ловастатин с продленным высвобождением), и показатель метана в выдыхаемом воздухе составлял около 70 м.д. При смене состава на MEVACOR (т. e. ловастатин немедленного высвобождения), показатель метана в выдыхаемом воздухе повышался до 168 м.д. Неожиданно было обнаружено, что при введении комбинации ALTOPREV и MEVACOR, показатель метана в выдыхаемом воздухе снижался до 0 м.д.
[0181] Без связи с какой-либо теорией, продукт с немедленным высвобождением по существу высвобождается в ЖКТ выше, чем продукт с продленным высвобождением, который высвобождается в ЖКТ ниже. Соответственно, были созданы покрытые полимером гранулы, которые высвобождаются из капсулы, покрытой кишечнорастворимой оболочкой, как показано на Фиг. 1-3, и различные другие составы с двойным импульсным высвобождением.
Пример 2. Разработка составов с двойным импульсным высвобождением
[0182] Был приготовлен лекарственный препарат SYN-010, который представлял собой капсулу из ГПМЦ, заполненную минитаблетками, покрытыми кишечнорастворимой оболочкой, из которых при разных значениях pH кишечника высвобождается ловастатин. Минитаблетки были разработаны так, чтобы проходить через желудок в неизменном виде, после чего высвобождать небольшое количество ловастатина в двенадцатиперстной кишке, а основную часть дозы ловастатина - в подвздошно-слепокишечном переходе и ободочной кишке (Фиг. 5). Относительные количества ловастатина, которые высвобождаются в тонкой и толстой кишке отражали уровни архей, продуцирующих метан, в каждом месте.
[0183] Каждая минитаблетка в лекарственной форме SYN-010 содержит ловастатин в комбинации со вспомогательными веществами согласно Фармакопее США (USP) и покрыта кишечнорастворимым полимером EUDRAGIT®, который растворяется либо при уровне pH 5,5 (высвобождение в двенадцатиперстной кишке; ДВ), либо при уровне pH 7,0 (подвздошно-слепокишечное высвобождение; ПСВ). В частности, состав SYN-010 (21 мг) представляет собой непрозрачную белую капсулу из ГПМЦ размера 1, содержащую 1 минитаблетку (ДВ) с оболочкой, которая растворяется при pH 5,5, и 2 минитаблетки (ПСВ) с оболочкой, которая растворяется при pH 7,0. Состав SYN-010 (42 мг) представляет собой непрозрачную белую капсулу из ГПМЦ размера 1, содержащую 1 минитаблетку (ДВ) с оболочкой, которая растворяется при pH 5,5, и 5 минитаблеток (ПСВ) с оболочкой, которая растворяется при pH 7,0.
[0184] Капсулы SYN-010 принимают внутрь один раз в сутки, запивая 200 мл воды. Капсулы SYN-010 проглатывают целиком, не разжевывая. Для капсул SYN-010 не требуется растворение.
[0185] Ловастатин был получен, проанализирован и выпущен с использованием методологии, известной в данной области техники. Характеристики ловастатина представлены ниже в таблице 2.
Таблица 2
|
[0186] В лекарственном препарате SYN-010 используются различные вспомогательные вещества, и их функции перечислены в таблице 3, приведенной ниже. Вспомогательные вещества и оболочки были выбраны так, чтобы обеспечить состав ловастатина в виде соответствующих минитаблеток, покрытых кишечнорастворимой оболочкой и обеспечить желательный профиль двойного импульсного высвобождения ловастатина, подробно описанного в данном документе.
Таблица 3.
|
[0187] Совместимость лекарственного вещества ловастатина со вспомогательными веществами состава оценивали в исследованиях бинарного стресс-тестирования, в которых смеси ловастатина и каждого вспомогательного вещества в соотношении 1:1 хранили в течение 7 дней при различных условиях температуры и относительной влажности (ОВ). Образцы анализировали с помощью ВЭЖХ (на основе способов USP) на день 0 и день 7. Данные из исследования бинарного стресс-тестирования со вспомогательными веществами по настоящему изобретению представлены ниже в таблице 4.
Таблица 4.
|
a Относительное время удержания ВЭЖХ 0,46 мин=ß-гидроксикислота ловастатина.
b В монографии USP требуется, чтобы содержание отдельных примесей не превышало 0,2%.
c Высокое содержание влаги.
[0188] Бинарное стресс-тестирование выявило, что сам по себе лактон ловастатина был стабильным в широком диапазоне условий; однако ловастатин в составе состава претерпел незначительное гидролитическое разложение с образованием ß-гидроксикислоты. Этот процесс усиливался в присутствии кислотных материалов, таких как лимонная кислота. Последующее стресс-тестирование минитаблеток ловастатина, покрытых кишечнорастворимой оболочкой подтвердило чувствительность ловастатина к влаге и показало, что незначительное разложение ловастатина в лекарственной форме можно предотвратить посредством хранения в герметичном контейнере или хранением с влагопоглотителем (см. таблицу 5 ниже). В ходе разработки рецептуры выполняли оценку влагозащитных подслоев, включая SEPIFILM™ LP014, и LP030 (SEPPIC), Opadry® amb II (Colorcon) и Aquarius® MG (Ashland Aqualon Functional Ingredients). Кишечнорастворимую оболочку Acryl-EZE® (Colorcon) pH 5,5 также оценивали в начальном тестировании целостности оболочки в 0,1 M HCl. Для применения в составах SYN-010 выбрали полимеры EUDRAGIT.
Таблица 5.
|
a Перед нанесением покрытия все минитаблетки содержали одинаковое ядро (ANH-056).
b Влагозащитный подслой.
c Относительное время удержания ВЭЖХ 0,46 мин=ß-гидроксикислота ловастатина; Ограничение в соответствии с монографией USP: не более чем 0,2%.
d Бутылка из полиэтилена высокой плотности (ПЭВП).
[0189] Композиции минитаблеток, содержащих ловастатин и покрытых кишечнорастворимой оболочкой и минитаблеток плацебо, покрытых кишечнорастворимой оболочкой, приведены в таблице 6. Минитаблетки имеют круглую форму (диаметр 5,5 мм b высота 2,5 мм) с нормальной выпуклостью.
Таблица 6.
|
a FD&C Blue № 2 Aluminum Lake 12-14% (0,0065% от массы минитаблетки, покрытой EUDRAGIT L30 D-55), включен для обеспечения визуальной дифференциации минитаблеток ДВ
[0190] Композиции лекарственных форм капсулы SYN-010 21 мг и 42 мг и плацебо дополнительно подробно представлены в таблице 7.
Таблица 7.
|
a FD&C Blue № 2 Aluminum Lake 12-14% (0,0065% от массы минитаблетки, покрытой EUDRAGIT L30 D-55), включен для обеспечения визуальной дифференциации минитаблеток ДВ
[0191] Состав SYN-010 имеет следующие преимущества (i) различия в гидролизе и абсорбции ловастатина в разных областях кишечника и (ii) внутренние различия абсорбции лактона и ß-гидроксикислоты ловастатина с увеличением количества лактона ловастатина в просвете кишечника и минимизацией абсорбции видов ловастатина в системный кровоток. В частности, кишечнорастворимая защита предотвращает абсорбцию и предотвращает превращение хуже абсорбируемого лактона ловастатина (активного антиметаногенного агента) в более легко абсорбируемую ß-гидроксикислоту (не являющуюся антиметаногенной). Кроме того, высвобождение основной части ловастатина из SYN-010, 21 мг и 42 мг происходит после первичного «окна» абсорбции ловастатина в тонкой кишке, тем самым увеличивая доставку лактона ловастатина в ободочную кишку.
[0192] Первичным «окном» абсорбции лактона ловастатина и ß-гидроксикислоты является тонкая кишка; однако, как представляется, существует значимый желудочный компонент пероральной абсорбции ловастатина. Например, ~ 30% внутрижелудочной дозы лактона или ß-гидроксикислоты ловастатина выходит из желудочного сока крыс с лигированным привратником в пределах 30 мин. Как представляется, после перорального введения происходит сравнительно небольшой препортальный гидролиз лактона ловастатина in vivo (~ 10%), причем основная часть превращения лактона в ß-гидроксикислоту происходит в печени и плазме. Исследования также показывают, что кишечные бактерии могут способствовать гидролизу ловастатина в кишечнике, и инкубация лактона ловастатина с фракциями бактериальных ферментов кала человека и крыс приводила к потере 8‒19% лактона ловастатина за период 12 часов. На Фиг. 6 показаны прогнозируемые уровни лактона ловастатина в желудочно-кишечном тракте после перорального введения.
[0193] Ловастатин представляет собой кристаллический порошок белого цвета или белого цвета с желтоватым или сероватым оттенком, который совместно измельчали и смешивали со вспомогательными веществами во время переработки, но не проводили другую обработку для уменьшения размера частиц или преобразования в аморфное состояние. При настоящих показаниях к назначению (СРК-З) может не требоваться системная биодоступность ловастатина, и его растворимость может не быть основным фактором, определяющим потенциальную эффективность. Скорее необходимо диспергирование ловастатина в просвете кишечника, и исследования по растворению показали соответствующее высвобождение ловастатина из лекарственной формы SYN-010.
[0194] Разработка продукта с соответствующим профилем высвобождения ловастатина требует тщательного тестирования растворения в средах с различным уровнем рН, которые представляют различные отделы желудочно-кишечного тракта. Стратегия растворения, используемая во время разработки SYN-010, представлена на Фиг. 7. В исследованиях растворения использовали аппарат типа 2 (что запрещено для ловастатина в монографии USP; USP раздел 37 «Ловастатин») и оценивали ряд переменных, в том числе скорости лопастей и концентрацию додецилсульфата натрия (ДСН), включенного в среду для растворения. В процессе разработки было установлено, что повышенная скорость лопастей (100 оборотов в минуту) не подходит для сохранения целостности кишечнорастворимой оболочки, в то время как более низкая скорость лопастей (50 оборотов в минуту) не обеспечивают достаточное перемешивание лекарственных форм для обеспечения растворения ловастатина. Концентрации ДСН в среде для растворения при pH 5,9 (20 г/л) и при pH 7,0 (10,75 г/л) были достаточными для того, чтобы обеспечить соответствующее растворение ловастатина; однако концентрации ДСН 5-20 г/л в кислой среде (0,1 M HCl) отрицательно сказались на кишечнорастворимой оболочке для pH 5,5. Эта проблема была решена путем применения более толстого покрытия из кишечнорастворимого полимера (15% увеличения массы по сравнению с ядром минитаблетки), которое использовали в составе SYN-010 для клинического применения. Более низкая концентрация ДСН (0,625 г/л) была использована в среде для растворения 0,1 M HCl без отрицательного влияния на растворение ловастатина.
[0195] Данные исследований растворения капсул SYN-010, 42 мг представлены на Фиг. 8. Каждая минитаблетка содержала ядро ANH-056. Одна (1) минитаблетка ДВ была покрыта EUDRAGIT L 30 D-55+PlasACRYL HTP20 (15,55% увеличения массы по сравнению с ядром минитаблетки). 5 минитаблеток ПСВ были покрыты EUDRAGIT FS 30 D+PlasACRYL T20 (15,87% увеличения массы). Оболочка капсулы из ГПМЦ растворялась в течение 10 минут в 0,1 M HCl (представляет желудок) с обнажением минитаблеток ловастатина. Все минитаблетки были стабильными в 0,1 M HCl в течение периода 2 часа, и при этом в кислотной среде не обнаруживался ни ловастатин, ни продукты разложения ловастатина. Спустя 2 часа пребывания в 0,1 M HCl минитаблетки переносили в новую лунку, содержащую фосфатный буфер с уровнем pH 5,9 (представляет двенадцатиперстную кишку), при этом 1 минитаблетка ДВ распадалась и в течение 10 минут, и ловастатин растворялся полностью. Спустя 60 минут пребывания при уровне pH 5,9 уровень pH поднимали до значения pH 7,2 (представляет подвздошную кишку) посредством добавления NaOH. После 30 мин лаг-периода при уровне pH 7,2 наблюдалось полное разложение 5 таблеток ПСВ и растворение ловастатина.
[0196] Исследования растворения капсул SYN-010, 42 мг продемонстрировали, что лекарственная форма, содержащая капсулы из ГПМЦ, в которых содержалась комбинация минитаблеток ловастатина, покрытых кишечнорастворимой оболочкой, имела соответствующий профиль высвобождения, обеспечивающий доставку ловастатина в двенадцатиперстную кишку и подвздошно-слепокишечный переход/ободочную кишку.
[0197] В исследованиях растворения также было установлено, что толщина кишечнорастворимой оболочки минитаблетки - в частности EUDRAGIT L 30 D-55 - имела важное значения для обеспечения целостности минитаблеток в желудочном соке и, таким образом, для соответствующего профиля высвобождения ловастатина. Как показано в таблице 8, когда комбинации минитаблеток с разной толщиной оболочки перемешивались в 0,1 M HCl, толщина покрытия EUDRAGIT L 30 D-55 менее 15% была неподходящей. В частности, в таблице 8 показано влияние различной толщины кишечнорастворимых оболочек на целостность оболочки при перемешивании минитаблеток в 0,1 M HCl (pH 1,2) в течение периода 120 мин в аппарате для растворения 2 типа согласно USP со скоростью 75 оборотов в минуту. Добавление в среду для растворения ДСН для облегчения солюбилизации ловастатина также отрицательно повлияло на кишечнорастворимую оболочку для pH 5,5 и в исследованиях растворения конечных лекарственных форм SYN-010, 21 мг и 42 мг. Для применения в клинической практике использовали сниженные концентрации ДСН.
Таблица 8
|
a Идентичные ядра таблетки ANH-056
b EUDRAGIT® L 30 D-55+PlasACRYL™ HTP20.
c EUDRAGIT® FS 30 D+PlasACRYL™ T20.
d Одна из 6 таблеток.
e4 из 6 таблеток.
[0198] Стресс-тестирование минитаблеток ловастатина, покрытых кишечнорастворимой оболочкой, проиллюстрировало, что SYN-010, 21 мг м 42 мг можно эффективно хранить в закрытых контейнерах из ПЭВП, содержащих влагопоглотитель. Материалы для клинических исследований SYN-010 (21 мг) и SYN-010 (42 мг) упаковывали в отдельные круглые бутылки из полиэтилена высокой плотности (ПЭВП) с широким горлышком объемом 60 мл с полипропиленовым укупорочным средством с защитой от вскрытия детьми (33 мм) и внутренней герметичной мембраной из индукционной фольги. Каждая бутылка содержала 33 капсулы SYN-010 с пакетами для влагопоглотителя CAN SORB-IT®, содержащими 1,0 г влагопоглотителя силикагеля. Капсулы хранили при температуре 20-25 °C.
Пример 3. Клиническая оценка различных профилей высвобождения
[0199] Профили высвобождения в двенадцатиперстной кишке и подвздошно-слепокишечном переходе сравнивали по отдельности и в комбинации для оценки любого преимущества, имеющего превосходство в одном составе по сравнению с другим, или синергии в комбинации. Может быть предпринята дополнительная оценка фармакокинетики и влияния на уровни метана в выдыхаемом воздухе различных доз и профилей дозирования у субъектов с обнаруженным наличием метана.
Пример 3. Клинический отбор пациентов, отвечающих на терапию
[0200] В данном исследовании был проведен ретроспективный анализ амбулаторных карт и историй болезни за последние 18 месяцев в отношении клинической практики применения статинов в лечении пациентов с метан-положительным избыточным бактериальным ростом и СРК с преобладанием запоров (СРК-З). Несмотря на то что тяжесть запора и вздутия живота в целом пропорционально соответствовали уменьшению уровня метана, это исследование не было проспективным и симптомы были субъективными. Таким образом, ретроспективный анализ амбулаторных карт и историй болезни был сосредоточен на анализе снижения продукции метана. Поскольку отсутствовало нормальное распределение данных для метана, данные были представлены в виде медиан, а для сравнения групп был использован непараметрический тест Манна-Уитни. Большинство подлежащих оцениванию метан-положительных пациентов с СРК с преобладанием запора вначале были пролечены с назначением курса рифаксимина и неомицина. Субъекты, которым была назначена терапия статином, представляли собой пациентов с устойчивостью или невосприимчивостью к стандартному подходу ─ терапии антибиотиками. Без связи с какой-либо теорией, это может также означать, что они в целом более невосприимчивы к лечению.
[0201] Как правило, большая часть лучших ответов наблюдалась у пациентов, получающих ALTOPREV в виде монотерапии или в комбинации с ловастатином с немедленным высвобождением (например, MEVACOR).
[0202] Кроме того, оценка абсолютного изменения уровней метана в выдыхаемом воздухе по сравнению с исходным уровнем показала тенденцию к снижению более высоких уровней метана в выдыхаемом воздухе при применении более высоких доз ALTOPREV; однако существует целый ряд пациентов, явно не отвечающих на терапию (Фиг. 9A). Это, возможно, видно более явно при сравнении процентного изменения по сравнению с исходным уровнем, где происходит разделение между пациентами, отвечающими на терапию ALTOPREV, и пациентами, явно не отвечающими на терапию, причем среди отвечающих на терапию не было явной зависимости ответа от дозы (Фиг. 9B)
[0203] При анализе абсолютного изменения уровней метана в выдыхаемом воздухе наблюдалась почти линейная тенденция, причем пациенты, имеющие наивысшие уровни метана в выдыхаемом воздухе, продемонстрировали наибольшее абсолютное снижение уровней метана в выдыхаемом воздухе независимо от введенной дозы ALTOPREV (Фиг. 9C). В этом анализе была группа пациентов, явно не отвечающих на терапию, причем у них наблюдались различные исходные уровни метана. Сравнение процентного изменения показателей метана в выдыхаемом воздухе относительно исходных показателей метана в выдыхаемом воздухе (Фиг. 9D) продемонстрировало разделение между пациентами, отвечающими на терапию ALTOPREV, и пациентами, явно не отвечающими на терапию, причем среди отвечающих на терапию не было явной зависимости ответа от дозы.
Пример 4. In vivo влияние ловастатина на колонизацию M. smithii у крыс с запором
[0204] В течение 7 недель 30 взрослых самцов крыс Sprague-Dawley кормили рационом с высоким содержанием жиров (60,3% ккал из жира, корм Teklad с высоким содержанием жиров, TD.06414, Harlan Laboratories Inc, Madison, WI). Крыс обследовали на повышенные уровни M. smithii с помощью кПЦР перед и после диеты, после чего делили на 3 группы. Группе 1 давали ловастатин в виде лактона, группе 2 давали гидроксикислоту ловастатина (каждого по 1,5 мг/крыса) и группе 3 вводили через зонд плацебо. Каждую группу кормили через зонд ежедневно в течение 10 суток. Выполняли сбор кала за трое суток для оценки средней массы влажного кала и суточной изменчивости перед началом кормления рационом с высоким содержанием жиров, после 7 недель кормления рационом с высоким содержанием жиров и последние дни введения через зонд ловастатина (все еще с соблюдением рациона с высоким содержанием жиров). На 10 сутки кормления через зонд крыс умерщвляли, экстрагировали ДНК содержимого лигированных сегментов кишечника (двенадцатиперстная кишка, тощая кишка, подвздошная кишка, слепая кишка и левая часть ободочной кишки). Выполняли кПЦР с использованием праймеров для общих бактерий в просвете кишечника и M. smithii.
[0205] Результаты показывают, что рацион питания с высоким содержанием жира увеличивал колонизацию кала M. smithii у крыс Sprague-Dawley (от 7,58×104 ± 6,62×104 КОЕ/мл на исходном уровне до 2,60×105 ± 1,95×105 через 7 недель питания с высоким содержанием жира) (P < 0,01) (Фиг. 10A). Все это сопровождалось снижением массы влажного кала (от 62,4% на исходном уровне до 48,6% через 7 недель) (P < 0,01) (Фиг. 10B). На этом этапе крыс делили на 3 группы. По результатам кПЦР в отношении общего содержания бактерий, их уровни не отличались между группами введения плацебо и любой формы ловастатина. Что касается M. smithii, соотношение M. smithii к общим бактериям уменьшилось в подвздошной кишке крыс, получавших лактон ловастатина, но не гидроксикислоту. Уровни M. smithii в ободочной кишке не изменялись (Фиг. 11).
Пример 5. Фармакокинетика SYN-010 у собак
[0206] Состав SYN-010 содержит капсулы, содержащие комбинацию различных минитаблеток, покрытых кишечнорастворимой оболочкой, предназначенных для прохождения через желудок в неизменном виде и высвобождения ловастатина в различных областях желудочно-кишечного тракта. В настоящем исследовании оценивали фармакокинетику лактона и ß-гидроксикислоты ловастатина в плазме после введения собакам породы бигль различных минитаблеток ловастатина, покрытых кишечнорастворимой оболочкой, SYN-010, в качестве монотерапии или в комбинации. Животным также вводили коммерчески доступные составы ловастатина с немедленным высвобождением и с продленным высвобождением. Ранее было показано, что собаки подходят для изучения характера действия ловастатина и их желудочно-кишечный тракт имеет большое сходство с желудочно-кишечным трактом человека. Пять собак (с массой тела 6,4-8,0 кг) были рандомизированы для получения каждой из перечисленных ниже доз с использованием плана исследования по схеме латинского квадрата, т. e. во время исследования каждая собака получала каждую дозу с разделением периодом вымывания, длящимся одну неделю: доза A представляет 6 минитаблеток ловастатина (по 7 мг) с оболочкой для pH 5,5 (высвобождение в двенадцатиперстной кишке; ДВ); общая доза составляет 42 мг; доза B: представляет 6 минитаблеток ловастатина (по 7 мг) с оболочкой для pH 7,0 (подвздошно-слепокишечное высвобождение; ПСВ); общая доза составляет 42 мг; доза C: представляет 1 минитаблетку ловастатина (7 мг) ДВ+5 таблеток ПСВ; общая доза составляет 42 мг; доза D: представляет 1 таблетку ловастатина с немедленным высвобождением MEVACOR; общая доза составляет 40 мг; доза E: представляет 1 таблетку ловастатина с продленным высвобождением ALTOPREV; общая доза составляет 40 мг.
[0207] Все дозы вводили в одной желатиновой капсуле Torpac размера 000. Собаки голодали в течение ночи перед введением дозы и получали еду через 2,0-2,5 ч после введения дозы состава. Брали робы крови у каждой собаки в течение периода времени 36 часов, и анализировали плазму на содержание лактона ловастатина и ß-гидроксикислоты ловастатина с использованием метода количественной ЖХ-МС/МС. Фармакокинетические параметры рассчитывались с использованием некомпартментных методов.
[0208] Средняя концентрация в зависимости от временных профилей для различных доз представлена на Фиг. 12. Выявленные в плазме уровни ß-гидроксикислоты ловастатина были практически идентичны уровням лактона ловастатина, что соответствует опубликованным отчетам о том, что превращение лактона в ß-гидроксикислоту происходит преимущественно в результате абсорбции из желудочно-кишечного тракта. Соотношение ППКкислота/ППКлактон (1,5-1,7) для доз A, C, D и E не отличалось; но для дозы В составило всего лишь 0,8 вследствие очень низкой абсорбции ловастатина из состава с дозой B.
[0209] Сравнительное фармакокинетическое поведение MEVACOR и ALTOPREV в этом исследовании у собак соответствует опубликованным данным клинических исследований, а фармакокинетические параметры этих составов были аналогичны тем, которые представлены в опубликованных результатах исследований у собак. Основным отличием текущей работы было наличие у некоторых собак большого второго пика концентрации (Cпик, 2) как лактона, так и ß-гидроксикислоты, о чем ранее не сообщалось.
[0210] Минитаблетки ДВ (доза A) обеспечивали общее воздействие ловастатина (ППК) аналогичное составам MEVACOR и ALTOPREV; однако в отличие от MEVACOR, фармакокинетический профиль дозы A указывал на то, что отсроченное высвобождение ловастатина, покрытого кишечнорастворимой оболочкой для pH 5,5 не происходит до тех пор, пока минитаблетки не достигнут верхних отделов тонкой кишки. Это нашло отражение в более длительном периоде времени перед определением первой измеримой концентрации лактона и ß-гидроксикислоты ловастатина (Tлаг 1,0-2,0 ч) и более поздним появлением первой пиковой концентрации в плазме (Tпик, 1 2,0-6,0 ч) для дозы A по сравнению с составом MEVACOR с немедленным высвобождением (Tлаг 0,5-1,0 ч и Tпик, 1 1,0-2,0 ч). Также как и состав MEVACOR, доза A продемонстрировала большой средний Cпик, 2, что произошло, главным образом, из-за двух собак. Этот второй пик может отражать отсроченное высвобождение одной или более минитаблеток из желудка этих животных. В опубликованных отчетах было обнаружено, что привратник желудка собаки является более «сдерживающим», чем привратник желудка человека, и частицы с диаметром ≥ 5 мм (такие как минитаблетки SYN-010) имеют тенденцию удержания в желудке, пока не будут вытолкнуты следующей волной желудочной перистальтики в ЖКТ (фаза III мигрирующего моторного комплекса) независимо от приема пищи. Время между перистальтической волной желудка у сытых собак (5-13 ч) сильно варьирует и является значительно более продолжительной, чем у сытых людей (2-5 ч). В настоящем исследовании собаки получали питание через 2,0-2,5 ч после введения дозы. Если минитаблетки SYN-010 вводили собакам натощак сразу после перистальтической волны желудка, и одна или более минитаблеток не выходили из желудка, эти минитаблетки могли удерживаться в желудке в течение значительного периода времени до высвобождения со следующей перистальтической волной желудка.
[0211] Результаты, полученные для минитаблеток ПСВ (доза B) и комбинации 1 минитаблетки ДВ+5 минитаблеток ПСВ (доза C) были убедительными в отношении потенциальной пользы этих композиций при СРК-З. Наличие от очень низких до неопределяемых уровней лактона и ß-гидроксикислоты ловастатина после введения дозы B указывают на ничтожную абсорбцию ловастатина из ЖКТ и удержание лактона ловастатина в просвете кишечника. В кале собак не было зарегистрировано нераспавшихся минитаблеток или фрагментов таблеток во время обычного осмотра исследователем. Доза C обеспечивала доставку с низкими системными уровнями ловастатина (т. e. средняя нормализованная по дозе ППК лактона ловастатина составляла 56% от средней нормализованной по дозе ППК MEVACOR) и продемонстрировала профиль двойного импульсного высвобождения с двумя пиковыми концентрациями для каждого аналита, разделенными периодом ~ 14 ч. Как и для дозы A, второй пик возникал в значительной степени из-за двух собак, которые имели очень большой Cпик, 2. Учитывая незначительные уровни лактона и ß-гидроксикислоты ловастатина в плазме, наблюдаемые только при монотерапии компонентом ПСВ (доза В), концентрация в плазме в зависимости от временных профилей для этих аналитов в дозе C, по-видимому, главным образом зависит от компонента ДВ данного состава.
[0212] В числе лекарственных составов, используемых в данном исследовании, также были и минитаблетки SYN-010. Каждая минитаблетка, покрытая кишечнорастворимой оболочкой, содержала 7 мг ловастатина в комбинации со вспомогательными веществами согласно Фармакопее США (USP) и была покрыта кишечнорастворимым полимером EUDRAGIT®, который растворяется либо при уровне pH 5,5 (ДВ), либо при уровне pH 7,0 (ПСВ). Каждая минитаблетка имела круглую форму, с диаметром ~ 5 мм, высотой ~3 мм и массой ~54 мг. Минитаблетки ДВ имели бледно-голубой цвет, а минитаблетки ПСВ имели белый цвет. Также использовались: таблетки ловастатина MEVACOR 40 мг НВ; таблетки ловастатина ALTOPREV 40 мг ПВ и ветеринарные капсулы из свиного желатина размера 000 (Torpac, Fairfield NJ). Все материалы были готовы к использованию и хранились при комнатной температуре; ALTOPREV и MEVACOR хранились в сухом темном месте.
Пример 6. Клиническое исследование 2 фазы SYN-010 для лечения СРК-З
[0213] Проводили рандомизированное, двойное слепое, плацебо-контролируемое, в параллельных группах исследование множества доз 2 фазы. Основная цель данного исследования заключается в оценке изменений уровня метана в выдыхаемом воздухе по сравнению с исходными показателями по результатам дыхательного теста с лактулозой у метан-положительных пациентов с СРК-З после семи дней лечения с одним из двух составов SYN-010 по сравнению с плацебо. В исследование были включены около 60 пациентов, которых случайным образом распределили в соотношении 1:1:1 в одну из трех групп, включая две группы, получающие разные дозы SYN-010 (по 21 мг и 42 мг) и группу, получающую плацебо. Пациентам назначили схему ежедневного приема однократной пероральной дозы SYN-010 в течение 28 дней. В исследование были включены шестьдесят субъектов в возрасте от 18 до 65 лет включительно.
[0214] Критерии включения. Субъекты должны иметь СРК-З и при скрининге они должны иметь положительный результат дыхательного теста на метан (> 10 м.д.); субъект должен соответствовать модифицированным Римским критериям III в отношении СРК-З; субъект должен иметь среднюю оценку интенсивности боли в животе ≥ 3 баллов (по шкале 0-10 баллов), зарегистрированную при скрининге и на исходном уровне; субъект должен иметь в среднем менее чем 3 полных спонтанных опорожнения кишечника (ПСОК) в неделю, а также субъект должен согласиться с момента скрининга и до конца исследования воздержаться от внесения каких-либо изменений в свой образ жизни, которые могут повлиять на симптомы СРК-З.
[0215] Критерии исключения. Субъект получал лечение СРК (рецептурными или безрецептурными лекарственными средствами), ингибиторами протонной помпы, слабительными, антибиотиками; в настоящее время субъект имеет какие-либо структурные аномалии желудочно-кишечного тракта (ЖКТ), или заболевание, или патологическое состояние, которое может повлиять на моторику ЖКТ, или какие-либо необъяснимые и клинически значимые симптомы, такие как кровотечение из нижних отделов ЖКТ, кровотечение из прямой кишки, гем-положительный кал, железодефицитная анемия, потеря массы тела или признаки системной инфекции; субъекту был установлен диагноз или в семейном анамнезе имеется аденоматозный полипоз, наследственный неполипозный колоректальный рак или любая другая форма семейного колоректального рака и субъект сообщает о жидком (кашицеобразном) или водянистом кале (оценка по Бристольской шкале формы кала [BSFS] 6 или 7 баллов).
[0216] Ожидается снижение уровня метана в выдыхаемом воздухе по сравнению с исходными показателями по результатам дыхательного теста с лактулозой у метан-положительных пациентов с СРК-З.
Определения
[0217] В контексте данного документа форма единственного числа может относиться к одному или более чем одному.
[0218] Кроме того, термин «около», используемый в связи с приведенным числовым значением, означает приведенное числовое значение плюс или минус до 10% от этого приведенного числового значения. Например, формулировка «около 50%» покрывает диапазон от 45% до 55%.
[0219] Выражение «эффективное количество» при использовании в связи с медицинскими видами применения представляет собой количество, которое эффективно для обеспечения измеряемого лечения, предотвращения или снижения скорости патогенеза представляющего интерес расстройства.
[0220] В контексте данного документа параметр «уменьшается» если показатель активности и/или эффект уменьшается на значительное количество, например, по меньшей мере на около 10%, по меньшей мере на около 20%, по меньшей мере на около 30%, по меньшей мере на около 40%, по меньшей мере на около 50%, по меньшей мере на около 60%, по меньшей мере на около 70%, по меньшей мере на около 80%, по меньшей мере на около 90%, по меньшей мере на около 95%, по меньшей мере на около 97%, по меньшей мере на около 98% или более, вплоть до и включая по меньшей мере около 100%, в присутствии агента или раздражителя по сравнению с отсутствием такого модулирования. Как будет понятно обычному специалисту в данной области техники, в некоторых вариантах реализации изобретения активность снижается, и некоторые зависимые показатели также будут снижаться, но другие при этом могут увеличиваться.
[0221] Напротив, активность «увеличивается» если показатель активности и/или эффект увеличивается на значительное количество, например, по меньшей мере на около 10%, по меньшей мере на около 20%, по меньшей мере на около 30%, по меньшей мере на около 40%, по меньшей мере на около 50%, по меньшей мере на около 60%, по меньшей мере на около 70%, по меньшей мере на около 80%, по меньшей мере на около 90%, по меньшей мере на около 95%, по меньшей мере на около 97%, по меньшей мере на около 98% или более, вплоть до и включая по меньшей мере около 100% или более, по меньшей мере в около 2 раза, по меньшей мере в около 3 раза, по меньшей мере в около 4 раза, по меньшей мере в около 5 раз, по меньшей мере в около 6 раз, по меньшей мере в около 7 раз, по меньшей мере в около 8 раз, по меньшей мере в около 9 раз, по меньшей мере в около 10 раз, по меньшей мере в около 50 раз, по меньшей мере в около 100 раз в присутствии агента или раздражителя по сравнению с отсутствием такого агента или раздражителя.
[0222] Все приведенные в данном документе процентные доли в композициях выражены относительно массы всей композиции, если не указано иное. В контексте данного документа слово «включает» и его варианты не являются ограничивающими, поэтому перечисление элементов в списке не подразумевает исключение других похожих элементов, которые также могут применяться в композициях и способах согласно данной технологии. Аналогично, термин «может» и его варианты не являются ограничивающими, поэтому указание того, что вариант реализации изобретения может включать определенные элементы или признаки, не исключает существование других вариантов реализации данной технологии, которые не включают эти элементы или признаки.
[0223] Хотя неограничивающий термин «содержащий», являющийся синонимом таких терминов как «включающий» или «имеющий», используется в данном документе в описании и формуле изобретения, настоящее изобретение или его варианты реализации могут в ином случае быть описаны при помощи альтернативных терминов, таких как «состоящий из» или «состоящий по существу из».
[0224] В контексте данного документа слова «предпочтительный» и «предпочтительно» относятся к вариантам реализации технологии, которые при определенных обстоятельствах обеспечивают определенные преимущества. Однако при тех же или других условиях также могут быть предпочтительными другие варианты реализации изобретения. Кроме того, указание одного или более предпочтительных вариантов реализации изобретения не подразумевает, что другие варианты реализации являются неприменимыми и не исключает другие варианты реализации из объема технологии.
[0225] Количество описанных в данном документе композиций, необходимое для достижения терапевтического эффекта, можно определить эмпирически в соответствии с традиционными процедурами для конкретной цели. Обычно при введении терапевтических агентов (например, антиметаногенных статинов и/или дополнительных терапевтических агентов, описанных в данном документе) в терапевтических целях терапевтические агенты применяют в фармакологически эффективной дозе. «Фармакологически эффективное количество», «фармакологически эффективная доза», «терапевтически эффективное количество» или «эффективное количество» относится к количеству, достаточному для того, чтобы оказать необходимое физиологическое действие, или к количеству, способному обеспечивать достижение необходимого результата, в частности, в случае лечения расстройства или заболевания. В контексте данного документа эффективное количество включает количество, достаточное, например, для замедления развития симптома расстройства или заболевания, изменения течения симптома расстройства или заболевания (например, замедления прогрессирования симптома заболевания), уменьшения или устранения одного или более симптомов или проявлений расстройства или заболевания и обращения симптома расстройства или заболевания. Терапевтическое преимущество также включает приостановку или замедление прогрессирования лежащего в основе заболевания или расстройства вне зависимости от того, наступило ли улучшение.
[0226] Эффективные количества, токсичность и терапевтическую эффективность можно определить путем проведения стандартных фармацевтических процедур в клеточных культурах, образцах ткани, гомогенатах ткани или экспериментальных животных, например, для определения LD50 (дозы, летальной для около 50% популяции) и ED50 (дозы, терапевтически эффективной для около 50% популяции). Дозировка может изменяться в зависимости от применяемой лекарственной формы и применяемого пути введения. Соотношение дозы между токсическим и терапевтическим видами действия называется терапевтическим индексом, который можно выразить как соотношение LD50/ED50. В некоторых вариантах реализации изобретения предпочтительными являются композиции и способы с высоким терапевтическим индексом. Терапевтически эффективную дозу можно изначально оценить при помощи in vitro анализа, включая, например, анализы клеточных культур или измерения продукции метана в образцах кала. Также дозу можно составить на животных моделях, чтобы достичь диапазона концентрации в циркулирующей плазме, который включает IC50, определенную в клеточной культуре или в соответствующей животной модели. Уровни описанных композиций в плазме можно измерять, например, при помощи высокоэффективной жидкостной хроматографии. Действия любой конкретной дозировки можно отслеживать при помощи подходящего биоанализа. Дозировка может быть определена лечащим врачом и, в случае необходимости, скорректирована в соответствии с наблюдаемыми эффектами лечения.
[0227] В определенных вариантах реализации изобретения действие приводит к количественно оцениваемому изменению, составляющему по меньшей мере около 10%, по меньшей мере около 20%, по меньшей мере около 30%, по меньшей мере около 50%, по меньшей мере около 70% или по меньшей мере около 90%. В некоторых вариантах реализации изобретения действие приводит к количественно оцениваемому изменению, составляющему около 10%, около 20%, около 30%, около 50%, около 70% или даже около 90% или более. Терапевтическое преимущество также включает приостановку или замедление прогрессирования лежащего в основе заболевания или расстройства вне зависимости от того, наступило ли улучшение.
[0228] В контексте данного документа «способы лечения» в равной степени применимы к использованию композиции для лечения заболеваний или расстройств, описанных в данном документе, и/или композициям для применения и/или применений в производстве лекарственных средств для лечения заболеваний или расстройств, описанных в данном документе.
ЭКВИВАЛЕНТЫ
[0229] Поскольку изобретение было описано в связи с конкретными вариантами его реализации, следует понимать, что возможны его дополнительные модификации и предполагается, что данная заявка покрывает любые вариации, применения или адаптации настоящего изобретения, следующие в целом принципам изобретения и включающим подобные отклонения от настоящего описания, как те, которые находятся в пределах известной или общепринятой практики в области техники, к которой относится изобретение, так и те, которые можно применить к существенным признакам, указанным выше, и как следует из объема прилагаемой формулы изобретения.
[0230] Для специалистов в данной области техники очевидны (или они способны установить посредством проведения обычных экспериментов) многочисленные эквиваленты описанных в данном документе конкретных вариантов реализации изобретения. Подразумевается, что такие эквиваленты включены в объем нижеследующей формулы изобретения.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[0231] Все патенты и публикации, на которые в данном документе приведены ссылки, в полном объеме включены в него посредством ссылки.
[0232] Публикации, обсуждаемые в настоящей заявке, приведены исключительно для их описания до даты подачи настоящей заявки. Никакую информацию в настоящей заявке не следует толковать как признание того, что настоящее изобретение не имеет права датировать подобную публикацию более ранним числом в силу действия предыдущего изобретения.
[0233] В контексте данного документа все заглавия служат только для упорядочения и никоим образом не ограничивают изобретение. Содержание любого отдельного раздела может быть одинаково применимо ко всем разделам.