Результат интеллектуальной деятельности: Способ получения 2,3-диалкил-N-фенил-1,2,3,4-тетрагидрохинолин-4-аминов
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органической химии, в частности, к способу получения 2,3-диалкил-N-фенил-1,2,3,4-тетрагидрохинолин-4-аминов общей формулы 1:
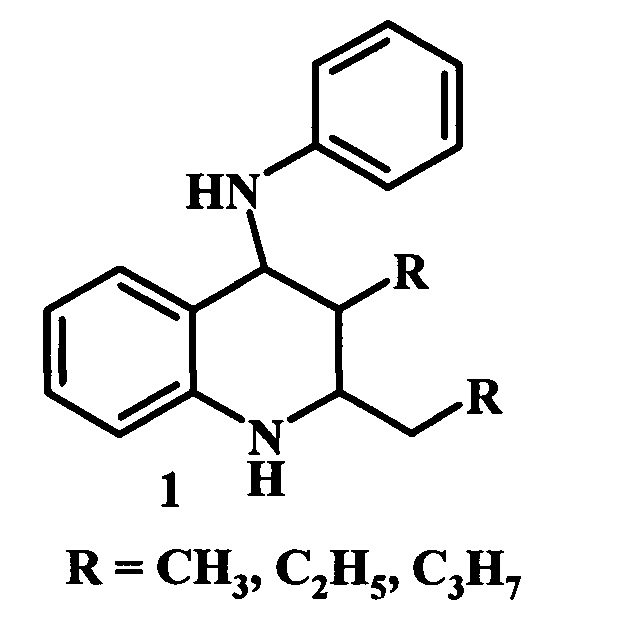
Производные тетрагидрохинолинов (ТГХ) относятся к классу N-гетероциклических соединений, обладающих широким спектром биологической активности. Они нашли применение в качестве антибиотиков [Omura, S.; Nakagawa, A. Tetrahedron Lett. 1981, 22, 2199-2202. Francis, С.L.; Ward, A.D. Aust. J. Chem 1994, 47, 2109-2117. Williamson, N.M.; March, D.R.; Ward, A.D. Tetrahedron Lrtt. 1995, 36, 7721-7724.], антидепрессантов [Buzas, A.; Ollivier, R.; El Ahmad, Y.; Laurent, E. // PCT Int. Appl. WO 9316,057, 1993; Chem. Abstr. 1994, 120, 134523c], антигистаминных [Biller, S.A.; Misra, R.N. // U.S. Pat. US 4,843,082, 1989; Chem Abstr. 1989, 111, 232600j.], сердечнососудистых [Atwal, K. // Eur. Pat. EP 488, 616, 1992; Chem. Abstr. 1992, 117, 89978e], противоопухолевых [Lukevics, E.; Lapina, Т.; Segals, I.; Augustane, I.; Verovskii, V.N. // Khim.-Farm. Zh. 1988, 22, 947-951; Chem. Abstr. 1988, 109, 222016t.], противоязвенных [Uchida, M; Chihiro, M.; Morita, S.; Yamashita, H.; Yamasaki, K.; Kanbe, Т.; Yabuuchi. Y.; Nakagawa, K. // Chem. Pharrm. Bull. 1990, 38, 1575-1586. Uchida, M; Morita, S.; Chihiro, M. // Eur. Pat. EP 239,129, 1987; Chem. Abstr. 1988, 108, 186740t] и других агентов. Помимо фармацевтической области применения, производные тетрагидрохинолина используются, как пестициды [Walter, Н. // Eur. Pat. 555, 183, 1993; Chem. Abstr. 1994, 120, 54551v. Ohsumi, Т.; Mito, N.; Oshio, H.; Itaya, N. // Nippon Noyaku Gokkuishi 1988, 13, 71-75; Chem. Abstr. 1988, 109, 88070a. Shmyreva, Zh. V.; Shikhaliev, Kh. S.; Shpanig, E. B. // Izv. Vyssh. Uchebn. Zaved, KJiim. Khim. Tekhnol. 1988, 31, 45-48; Chem. Abstr. 1989, 111, 23363v. Tsushima, K.; Osumi, Т.; Matsuo, N.; Itaya, N. // Agric. Biol. Chem. 1989, 53, 2529-2530. Kurahashi, Y.; Shiokawa, K.; Goto, Т.; Kagabu, S.; Kamochi, A.; Moriya, K.; Hayakawa, H. // Eur. Pat. EP 198, 264, 1986; Chem. Abstr. 1987, 106, 98115w], антиоксиданты [Luzhkov, V.В.; Fentsov, D.V.; Kasaikina, О.T. Zh. Strukt. Khim. 1988, 29, 37-41. Chem. Abstr. 1989, 111, 22774t. Meier, H.R.; Evans, S. // Eur. Pat EP 273,868, 1988; Chem Abstr. 1989, 110, 98598р. Fentsov, D.V.; Lobanova, Т.V.; Kassaikina, О.T. // Neftekhimiya 1990, 30, 103-108; Chem. Abstr. 1990, 112, 234619s. Evans, S. // Eur. Pat. EP 497,735, 1992; Chem. Abstr. 1992, 117, 233868p], ингибиторы коррозии [Shikhaliev, Kh.S.; Shmyreva, Zh.V.; Gurova, E.M. // Izv. Vyssh. Uchebn. Zaved, Khim. Khim. Tekhnol. 1989, 32, 85-89; Chem. Abstr. 1990, 112, 216659a].
Одним из основных методов синтеза производных ТГХ является трехкомпонентная циклоконденсация (реакция Поварова) ариламина, альдегида и алкена, катализируемая солями переходных металлов [Kobayashi, S.; Ishitani, Н.; Nagayama, S. Chem. Lett. 1995, 423. Annunziata, R.; Cinquini, M.; Cozzi, F.; Molteni, V.; Schupp, O. Tetrahedron, 1997, 53, 9715.] (схема 1).
Схема 1
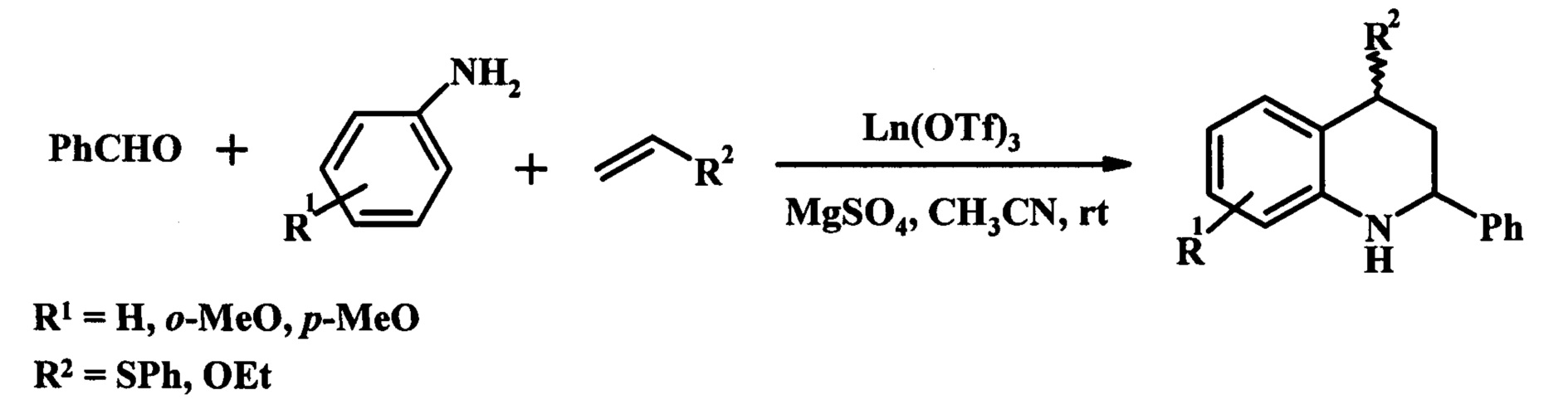
Существенным недостатком классических методов синтеза производных ТГХ в присутствии гомогенных кислотных катализаторов является необходимость проведения стадий нейтрализации и отмывки реакционной смеси, утилизация сточных вод, коррозия оборудования.
Авторами [Ishitani, Н.; Kobayashi, S. Tetrahedron Lett. 1996, 37, 7357] сообщается о получении производных ТГХ реакцией аза-Дильса-Альдера арилимина и алкена, катализируемую (10-20% мольных) хиральными комплексами иттербия (энантиомерный выход 70-91%) (схема 2) или в присутствии фосфорной кислоты, нанесенной на хиральную подложку (энантиомерный выход 87-98%) [Dagousset, G.; Zhu, J.P.; Masson, G.J Am Chem Soc 2011, 133, 14804. He, L.; Bekkaye, M.; Retailleau, P.; Masson, G. Org Lett 2012, 14, 3158].
Схема 2
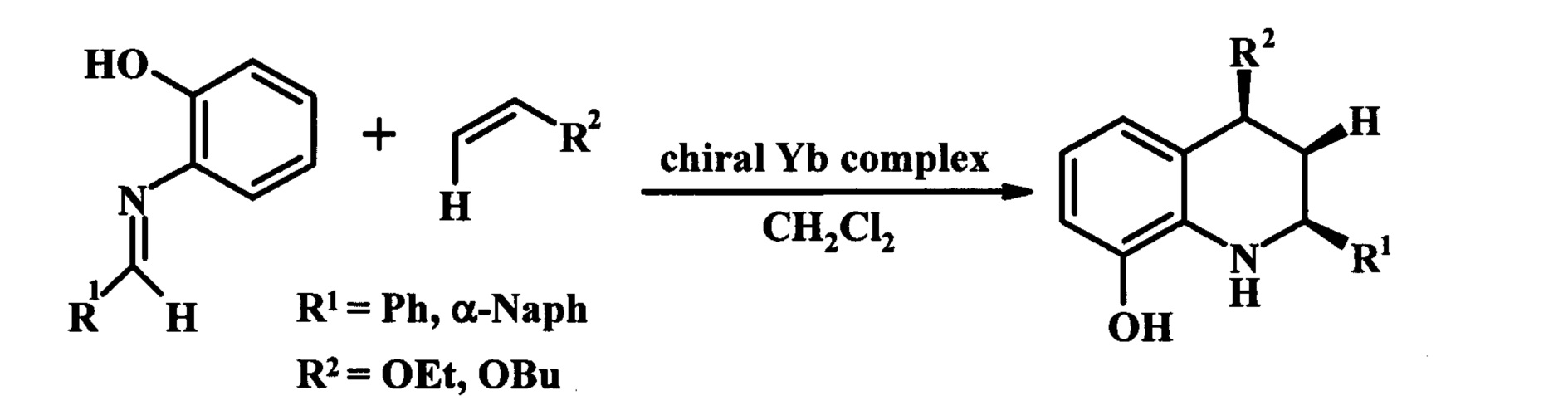
Недостатком данного метода является использование дорогостоящих труднодоступных хиральных комплексов. Кроме того, указанные выше методы приводят к получению 2,4-замещенных ТГХ.
Авторами [Т. Shao, Y. Yin, R. Lee, X. Zhao, G. Chai and Z. Jiang, Adv. Synth. Catal, 2018, 360, 1754. Z. Jiang, T. Shao, X. Zhao, Y. Liu, B. Qiao. Patent CN 108017580. Method for synthesis of 1,2,3,4-tetrahydroquinoline, 2018] разработан и запатентован метод синтеза 2,3-диалкил-N-фенил-1,2,3,4-тетрагидрохинолин-4-аминов (1) путем фотоиндуцируемого каскадного аэробного декарбоксилирования и окислительного дегидрирования N-ариламинокислоты (схема 3). Реакцию проводят при облучении 2×1 W синего света, в присутствии молекулярных сит  при 25°С в растворе хлороформа в течение 5-15 ч. В качестве хромофора используют дицианопиразиновое производное (0.4% мольных). Выход ТГХ (1) составляет 78%.
при 25°С в растворе хлороформа в течение 5-15 ч. В качестве хромофора используют дицианопиразиновое производное (0.4% мольных). Выход ТГХ (1) составляет 78%.
Схема 3
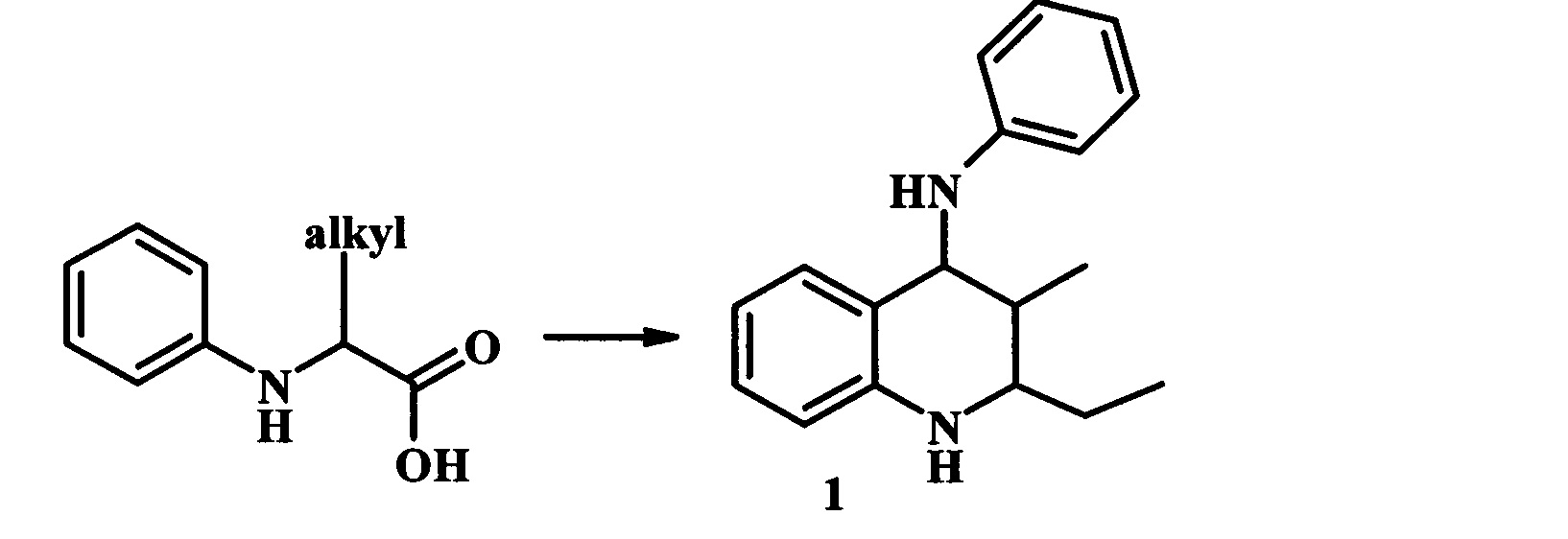
К недостаткам данного метода можно отнести использование специального оборудования для УФ-облучения, сложных в изготовлении и дорогостоящих N-ариламинокислот и хромофора, а также длительное время реакции.
В работе [Т. Job and N. Hagihara, J. Chem. Soc. Japan, 91, 378, 383 (1970); Chem. Abstr.,73, 45, 294, 45, 295(1971)] описано получение производных ТГХ (1) с выходом 78% взаимодействием основания Шиффа и метилвинилового эфира, катализируемого Ni(CO)4 (схема 4). Реакция проводится в инертной атмосфере в растворе ТГФ при 40-50°С в течение 6 ч.
Схема 4
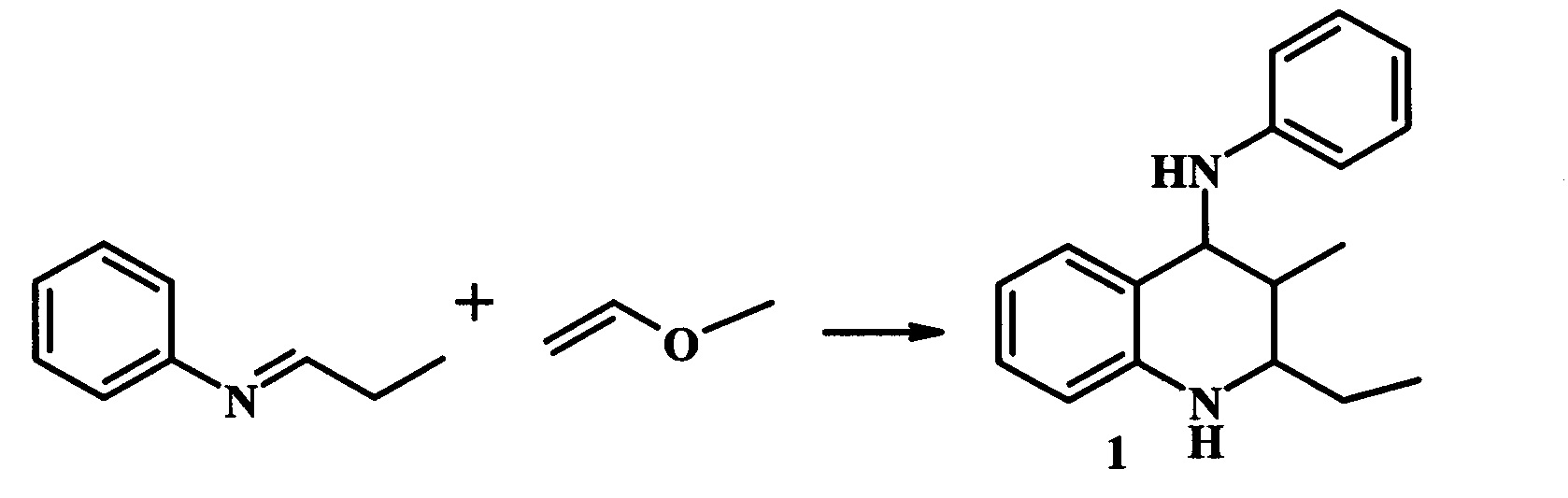
Недостатком данного способа является использование низкокипящих, гидролитически нестабильных виниловых эфиров, а также проведение синтеза во взрывоопасных эфирных растворителях.
Разработан метод синтеза ТГХ (1) из N-аллиланилина в присутствии Rh(I) катализаторов (схема 5) [М. Aresta, Е. Quaranta, S Treglia, J.A. Ibers. Organometallics, 1988, V7, №3, 577-583].
Схема 5
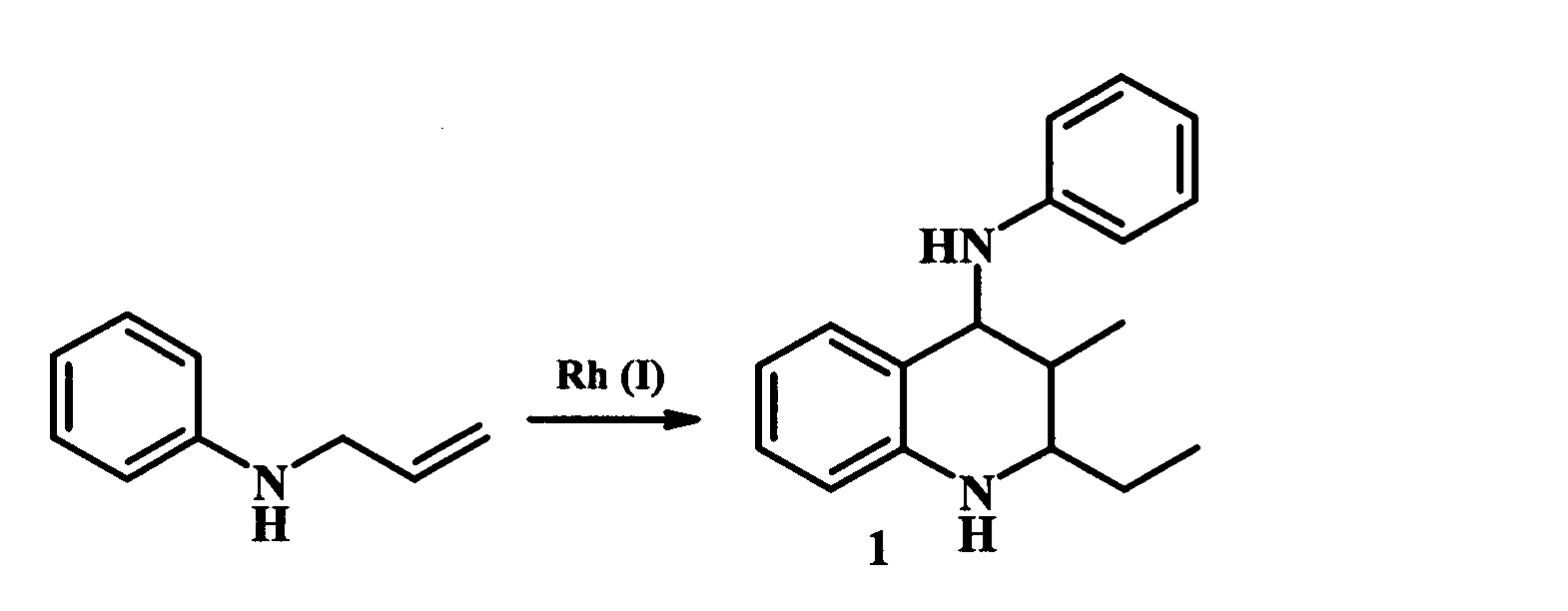
Реакцию проводили при мольном соотношении амин : катализатор = 500:1 в растворе толуола / тетрагидрофурана в инертной атмосфере в течение 2-72 ч. Выход ТГХ (1) не превышал 19%.
К недостаткам данного метода можно отнести низкий выход ТГХ (1) и использование сложных в изготовлении и дорогостоящих катализаторов, содержащих металлокомплексное соединение. Подобные каталитические системы требуют создания специальных условий использования, поскольку термически и гидролитически нестабильны.
Известен метод синтеза ТГХ (1) взаимодействием анилина с пропионовым альдегидом в «мягких условиях» [A.I.M. Ramos, J.S. Mecom, T.J. Kiesow, T.L. Graybill, G.D. Brown, N.V. Aiyar, E.A. Davenport, L.A. Kallal, B.A.K. Reed, P. Li, A.T. Londregan, D.M. Morrow, S. Senadhi, R.K. Thalji, S. Zhao, C.L.B. Kurtis, J.P. Marino. Bioorg. Med. Chem. Lett., 18 (2008), pp. 6222-6226] (схема 6).
Схема 6
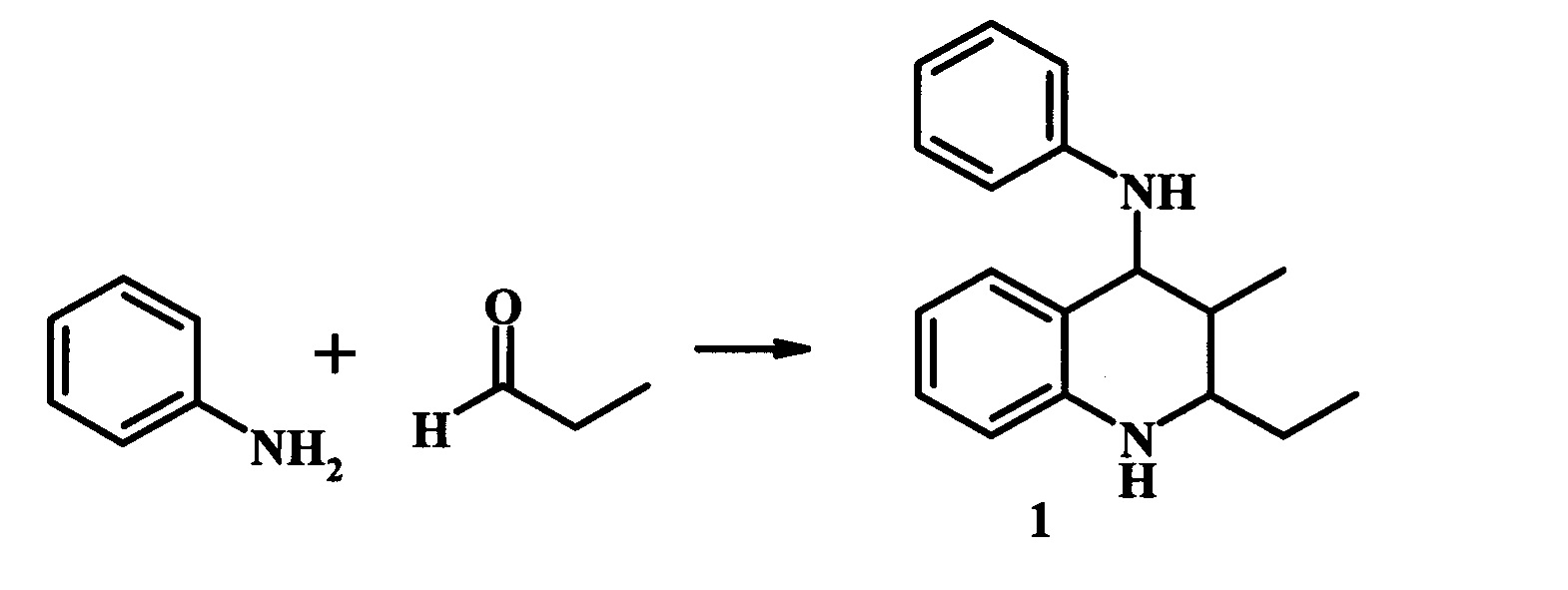
Реакция протекает без участия катализатора в этиловом спирте при 0°С с последующим увеличением температуры до комнатной в течение 14 ч, мольное соотношение анилин : альдегид = 1:1. Выход целевого продукта (1) составил 35%.
Авторами [VI Minkin, LE Nivorozhkin, AV Knyazev, Chem. Heterocycl. Comp, Vol. 2, No. 3, pp. 409-418, 1966] предложен аналогичный метод синтеза ТГХ (1), заключающийся в кислотно-катализируемой (ледяная уксусная кислота) конденсации ариламинов и пропионового альдегида, взятых в эквимольных количествах. Выход продукта (1) составляет 42%. Реакция протекает в метанольном растворе при комнатной температуре в течение 2-4 дней.
Недостатками данных методов является длительное время реакции, низкий выход ТГХ, а использование уксусной кислоты приводит к появлению дополнительных стадий нейтрализации и очистки реакционной массы, а также большого количества сточных вод.
В литературе отсутствует информация о получении производных ТГХ (1) взаимодействием анилина с альдегидами на цеолитных катализаторах.
Задачей настоящего изобретения является разработка селективного гетерогенно-каталитического способа синтеза 2,3-диалкил-N-фенил-1,2,3,4-тетрагидрохинолин-4-аминов.
Решение этой задачи достигается тем, что синтез 2,3-диалкилтетрагидрохинолинов (1) осуществляют реакцией анилина с алифатическими альдегидами (пропионовый, масляный, валерьяновый) в присутствии гранулированного иерархического цеолита Y в Н-форме (Н-Ymmm), имеющего микро-мезо-макропористую структуру.
Степень декатионирования (обмена катионов Na+ на Н+) цеолита Н-Ymmm составляет 95%. Реакцию проводят в проточном реакторе с неподвижным слоем катализатора (H-Ymmm, 1 г) при 250-350°С, атмосферном давлении, объемной скорости подачи сырья (w) 2-10 ч-1, при мольном соотношении анилин : альдегид = 1:2. Конверсия анилина составляет 79-98%. Основным продуктом реакции являются 2,3-диалкилТГХ (1а-в), образующиеся с селективностью 51-69% (схема 7). Кроме 2,3-диалкилТГХ (1а-в), в реакционной массе содержатся другие N-содержащие производные (например, 2,3-диалкилхинолины, 2,3-диалкил-дигидрохинолины) в количестве 31-49%.
Схема 7
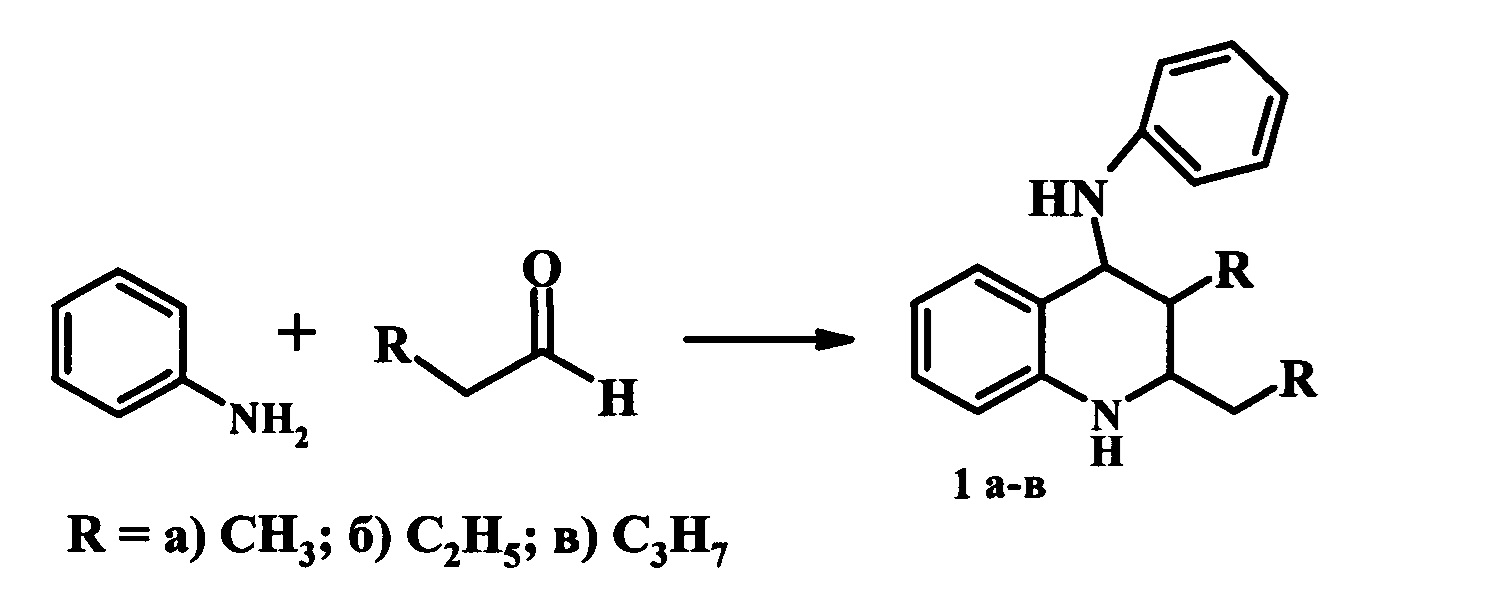
Цеолит H-Ymmm синтезирован в виде гранул без связующих веществ; его гранулы представляют собой единые сростки цеолитных кристаллов и обладают степенью кристалличности, близкой к 100%. Пористая структура гранул состоит из микропористой структуры самого цеолита и мезопористой структуры, сформировавшейся между сростками кристаллов. Применение цеолита H-Ymmm в реакциях синтеза производных хинолина из анилина и альдегидов неизвестно.
Существенным преимуществом цеолита H-Ymmm перед высокодисперсными цеолитами является то, что он синтезируется в гранулах. Гранулированный катализатор обладает лучшими физическими свойствами: не пылит, не слеживается, легко рассеивается и легко отделяется от реакционной массы фильтрованием (в отличие от высокодисперсного, который быстро забивает фильтр или проходит через полотно фильтра).
Кроме того, известно, что при глубоком декатионировании микропористых цеолитов Y (до степени ионного обмена катионов Na+ на H+ выше 90-95%) происходит их частичная аморфизация и степень кристалличности уменьшается. Цеолит H-Ymmm имеет комбинированную микро-мезопористую кристаллическую структуру, которая высокостабильна и не разрушается в процессе декатионирования.
Использование предлагаемого способа имеет следующие преимущества перед известными:
1. Гетерогенно-каталитические способы синтеза производных тетрагидрохинолина позволяют упростить и удешевить процесс их получения за счет уменьшения количества стадий и единиц оборудования.
2. Не требуется использование дорогостоящих и сложных в приготовлении катализаторов.
3. В способе отсутствуют сточные воды, кислоты и основания.
4. Не используются растворители.
Предлагаемый способ синтеза 2,3-диалкилпроизводных ТГХ (1а-в) осуществляют следующим образом.
Используют анилин и карбонильные соединения: пропионовый, масляный, валерьяновый альдегиды.
В качестве катализатора используют гранулированный без связующих веществ цеолит H-Ymmm, синтезированный в Na-форме по методу, приведенному в [O.S. Travkina, M.R. Agliullin, N.A. Filippova, A.N. Khazipova, I.G. Danilova,  N. Narender, MX. Pavlov, B.I. Kutepov, RSC Advances. 7 (2017) 32581-32590. M.Л. Павлов, О.С.Травкина, А.Н. Хазипова, Р.А. Басимова, Н.Н. Шавалеева, Б.И. Кутепов. // Нефтехимия, 2015, т. 55, №5, С. 406. Патент №2540086. Павлов М.Л., Травкина О.С., Кутепов Б.И. Басимова Р.А., Эрштейн А.С, Шавалеева Н.Н. Бюл. №3, 2015. Патент №2553876. Шавалеев Д.А., Павлов М.Л., Кутепов Б.И., Травкина О.С., Шавалеева Н.Н., Басимова Р.А., Эрштейн А.С. Бюл. №17, 2015]. Декатионированием из раствора NH4NO3 и последующим прокаливанием при 540°С цеолит Na-Ymmm переводили в Н-форму со степенью декатионирования ионов Na+ на Н+ 95%. В процессе ионного обмена с промежуточными термообработками аморфизация кристаллического каркаса цеолита не происходит. Удельная поверхность образцов, определяемая методом ртутной порометрии, составляет 12.1 м2/г, а объемы микро-, мезо- и макропор составляют 0.27; 0.15 и 0.15 см2/г, соответственно. Транспортные поры, в основном, представлены порами с радиусом 50-100 нм и 100-1000 нм.
N. Narender, MX. Pavlov, B.I. Kutepov, RSC Advances. 7 (2017) 32581-32590. M.Л. Павлов, О.С.Травкина, А.Н. Хазипова, Р.А. Басимова, Н.Н. Шавалеева, Б.И. Кутепов. // Нефтехимия, 2015, т. 55, №5, С. 406. Патент №2540086. Павлов М.Л., Травкина О.С., Кутепов Б.И. Басимова Р.А., Эрштейн А.С, Шавалеева Н.Н. Бюл. №3, 2015. Патент №2553876. Шавалеев Д.А., Павлов М.Л., Кутепов Б.И., Травкина О.С., Шавалеева Н.Н., Басимова Р.А., Эрштейн А.С. Бюл. №17, 2015]. Декатионированием из раствора NH4NO3 и последующим прокаливанием при 540°С цеолит Na-Ymmm переводили в Н-форму со степенью декатионирования ионов Na+ на Н+ 95%. В процессе ионного обмена с промежуточными термообработками аморфизация кристаллического каркаса цеолита не происходит. Удельная поверхность образцов, определяемая методом ртутной порометрии, составляет 12.1 м2/г, а объемы микро-, мезо- и макропор составляют 0.27; 0.15 и 0.15 см2/г, соответственно. Транспортные поры, в основном, представлены порами с радиусом 50-100 нм и 100-1000 нм.
Реакцию взаимодействия анилина и альдегидов (пропионовый, масляный, валерьяновый) проводят в проточном реакторе с неподвижным слоем катализатора H-Ymmm при температуре 250-350°С, атмосферном давлении, с объемной скоростью подачи сырья (w) 2-10 ч-1, в токе азота, мольное соотношение анилин : альдегид = 1:2. Продукты собирают в охлаждаемый льдом приемник. Количественный анализ реакционной массы осуществляют методом газожидкостной хроматографии на хроматографе Shimadzu GC-9A с пламенно-ионизационным детектором, 3 м насадочная колонка, фаза SE-30, с программированным нагревом 50-250°С, газ-носитель гелий.
Идентификацию продуктов реакции осуществляли с помощью 1D и 2D методик ЯМР 1Н и 13С спектроскопии, рентгеноструктурного анализа для соединения (1а), их брутто-состав подтвержден регистрацией пика молекулярного иона в ГХ-МС спектре.
Изобретение иллюстрируется следующим примером:
Пример 1. Смесь, содержащую 2,5 мл (28 ммоль) анилина и 4 мл (56 ммоль) пропионового альдегида, подают с помощью шприцевого микро-насоса в проточный реактор с неподвижным слоем цеолитного катализатора H-Ymmm (1 г) при 250°С, атмосферном давлении, объемной скорости подачи сырья 7 ч-1, в токе азота. Продукты собирают в охлаждаемый льдом приемник, расположенный в нижней части установки. По окончании синтеза реактор продувают азотом в течение 30 минут, после чего продукты реакции анализируют методом газожидкостной хроматографии. Конверсия анилина составляет 92%, селективность образования 2,3-диалкилТГХ (1а) составляет 55%, т.пл. 104-106°С (лит. 103-104°С [Kozlov, N.S.; Zhurnal Obshchei Khimii 1966, V2(3), P. 461-463], 106-107°C [Joh, Takashi; Nippon KagakuZasshi 1970, V91(4), P. 378-383]).
Спектральные характеристики 2-этил-3-метил-N-фенил-1,2,3,4-тетрагидрохинолин-4-амина (1a): ЯМР 1H (500.17 М Гц, CDCl3, δ, м.д.): 1.01 (т, J=9.5 Гц, 3Н), 1.11 (д, J=8.5 Гц, 3H), 1.61-1.67 (м, 2Н), 1.88-1.94 (м, 1H), 3.14-3.18 (м, 1Н), 3.85 (м, 2Н), 4.34 (д, J=11.5 Гц, 1Н), 6.55 (д, J=10.0 Гц, 1Н), 6.62-6.77 (м, 4Н), 7.06 (т, J=8.8 Гц, 1H), 7.19-7.27 (м, 3H). ЯМР 13С (125.78 МГц, CDCl3, δ, м.д.): 9.12, 15.76, 26.49, 37.39, 56.44, 57.86, 112.50, 113.25, 113.86, 116.85, 117.36, 123.38, 128.05, 128.31, 129.40, 129.45, 144.37, 148.76. Полученные данные соответствуют литературным [Aresta, М., Quaranta, Е., Treglia, S., & Ibers, J.А. (1988). Organometallics, 7(3), 577-583. doi:10.1021/om00093a001.A.I.M. Ramos, J.S. Mecom, T.J. Kiesow, T.L. Graybill, G.D. Brown, N.V. Aiyar, E.A.Davenport, L.A. Kallal, B.A.K. Reed, P. Li, A.T. Londregan, D.M. Morrow, S. Senadhi, R.K. Thalji, S. Zhao, C.L.B. Kurtis, J.P. Marino. Bioorg. Med. Chem. Lett., 18 (2008), pp. 6222-6226].
Пример 2. Сырье - смесь 2,5 мл (28 ммоль) анилина и 5,2 мл (56 ммоль) масляного альдегида - подают с помощью шприцевого микро-насоса в проточный реактор с неподвижным слоем цеолитного катализатора Н-Ymmm (1 г) при 250°С, атмосферном давлении, объемной скорости подачи сырья 7 ч-1, в токе азота. Продукты собирают в охлаждаемый льдом приемник, расположенный в нижней части установки. По окончании синтеза реактор продувают азотом в течение 30 минут, после чего продукты реакции анализируют методом газожидкостной хроматографии. Конверсия анилина составляет 86%, селективность образования 2,3-диалкилТГХ (16) составляет 69%, т.пл. 90-92°С (лит. 91-92°С [Kozlov, N.S.; Zhurnal Obshchei Khimii 1966, V2(3), P461-463]).
Спектральные характеристики 2-пропил-3-этил-N-фенил-1,2,3,4-тетрагндрохинолин-4-амина (1б): ЯМР 1Н (500.17 М Гц, CDCl3, δ, м.д.): 1.01 (т, J=7.5 Гц, 3H), 1.07 (т, J=7.5 Гц, 3H), 1.49-1.63 (м, 4Н), 1.92-2.00 (м, 3H), 3.32-3.34 (м, 1Н), 3.96 (м, 2Н), 4.47 (д, J=9.5 Hz, 1Н), 6.59 (д, J=7.8 Гц, 1Н), 6.71-6.79 (м, 4Н), 7.12 (т, J=7.8 Гц, 1Н), 7.28-7.37 (м, 3H). Спектр ЯМР 13С (125.78 МГц, CDCl3, δ, м.д.): 11.04, 14.14, 19.58, 23.58, 37.05, 41.67, 51.80, 53.24, 112.46, 113.34, 114.35, 116.87, 117.33, 122.30, 128.31, 129.44, 129.50, 129.92, 143.59, 148.05.
Пример 3. Сырье - смесь 2,5 мл (28 ммоль) анилина и 5,9 мл (56 ммоль) валерьянового альдегида - подают с помощью шприцевого микронасоса в проточный реактор с неподвижным слоем цеолитного катализатора H-Ymmm (1 г) при 250°С, атмосферном давлении, объемной скорости подачи сырья 7 ч-1, в токе азота. Продукты собирают в охлаждаемый льдом приемник, расположенный в нижней части установки. По окончании синтеза реактор продувают азотом в течение 30 минут, после чего продукты реакции анализируют методом газожидкостной хроматографии. Конверсия анилина составляет 98%, селективность образования 2,3-диалкилТГХ (1в) составляет 55%, т.пл. 71-73°С.
Спектральные характеристики 2-бутил-3-пропил-N-фенил-1,2,3,4-тетрагидрохннолин-4-амина (1в): ЯМР 1Н (500.17 М Гц, CDCl3, δ, м.д.): 0.91-0.97 (м, 6Н), 1.27-1.48 (м, 10Н), 1.65-1.67 (м, 1Н), 3.24-3.27 (м, 1Н), 3.86 (м, 2Н), 4.39 (д, J=10.0 Hz, 1Н), 6.53-6.77 (м, 5Н), 7.07-7.26 (м, 4Н). Спектр ЯМР 13С (125.78 МГц, CDCl3, δ, м.д.): 14.02, 14.10, 22.63, 22.67, 29.32, 29.41, 35.09, 40.07, 52.62, 53.86, 112.47, 113.34, 114.35, 116.83, 117.23, 121.94, 127.94, 128.32, 129.39, 129.42, 143.44, 147.88.
Другие примеры (2-4) осуществления способа приведены в таблице.
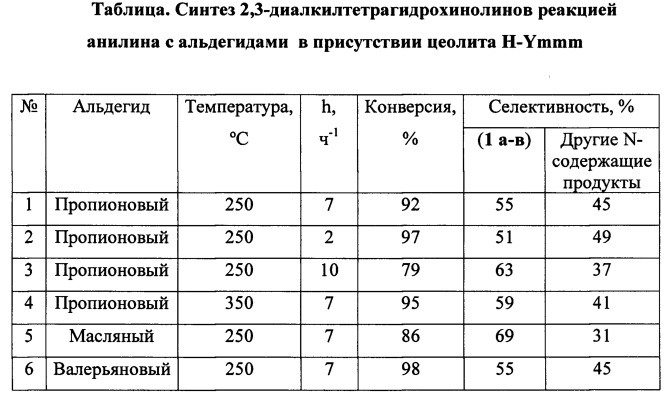
h - объемная скорость подачи сырья.
Реакцию проводят при 250-350°С, мольном соотношении анилин : альдегид = 1:2; объемной скорости подачи сырья h=2-10 ч-1.

