Результат интеллектуальной деятельности: СТЕРИЛЬНАЯ КОМПОЗИЦИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к стерильной (стерилизованной) композиции белка, который сохраняет свою функцию, поскольку он содержится в алифатическом сложном полиэфире.
Предшествующий уровень техники
Натуральные и синтетические белки приобретают все более важное значение как лекарственные средства. Если они используются для медицинских целей, то их продукты должны быть стерилизованными. Из способов стерилизации известны тепловая стерилизация в автоклаве, стерилизация ионизирующим излучением, например, γ-лучами или пучком электронов, газовая стерилизация газом этиленоксидом, плазменная стерилизация плазмой пероксида водорода и раздельная стерилизация с применением химического стерилянта, включающего глутаральдегидный состав, или фильтра. Однако активность белков, таких как биоактивные белки, снижается при стерилизации нагревом или облучением. При стерилизации этиленоксидом существует вероятность того, что в результате химической реакции возможно образование побочного продукта и что высокотоксичный остаточный газ может негативно воздействовать на человеческий организм. Стерилизация химическим стерилянтом связана с проблемой необходимости обязательного учитывания устойчивости белка к стерилянту и изменений рН, интенсивности ионов и температуры. Поэтому процессы производства фармацевтических препаратов и медицинских изделий, содержащих или иммобилизирующих белок, должны осуществляться в полностью стерильных условиях, что требует огромных производственных затрат.
Хотя раствор, содержащий белок, подвергается раздельной стерилизации с использованием фильтра, довольно трудно применить эту раздельную стерилизацию к композиции, содержащей крупные частицы, или к твердой либо полутвердой композиции.
ЕР 0437095 заявляет, что нейтрализованный окисленный целлюлозный продукт в комбинации с гецарином или фрагментом гепарина (nORC) можно стерилизовать гамма-излучением. Однако в этом документе ничего не говорится о стерилизации ORC или n-ORC, связанного с белком.
ЕР 0562864 раскрывает композитное вещество для ухода за ранами, содержащее коллагеновый губчатый матрикс, второй биоабсорбируемый полимер, такой как дисперсное волокно окисленной регенерированной целлюлозы (ORC), и активный агент, такой как пептид. Этот документ сообщает, что активный агент может содержаться в матриксе, биоабсорбируемом полимере или в обоих и что композитное губчатое вещество может стерилизоваться в процессе его упаковки.
US 5730933 описывает способ стерилизации биологически активного пептида гамма-излучением или пучком электронов без потерь биологической активности пептида. Этот способ представляет собой технологию, включающую стадии приготовления смеси биологически активного пептида с чужеродным белком, таким как желатин; замораживания или лиофилизации полученной смеси и ее облучения. Указанный документ заявляет, что присутствие чужеродного белка стабилизирует пептид и препятствует снижению активности пептида.
WO 2000/033893 раскрывает комплекс пептида с терапевтическим действием и полисахарида, выбранного из группы, состоящей из окисленной регенерированной целлюлозы, нейтрализованной окисленной регенерированной целлюлозы и их смесей. Этот документ заявляет, что, если пептид комбинируется с эффективным количеством полисахарида перед стерилизацией ионизирующим излучением, то биологическая активность пептидного терапевтического агента не утрачивается, а стабилизируется при стерилизации пептида ионизирующим излучением.
Однако в вышеперечисленных документах не говорится о том, что структурные изменения белка, такие как агрегация и деактивация белка, которые происходят в процессе стерилизации ионизирующим излучением, могут подавляться алифатическим сложным полиэфиром.
Между тем, JP-A 2011-47089 раскрывает способ производства ферментсодержащего нановолокна, показывающего высокую ферментативную активность. В этом способе из прядильного раствора, содержащего фермент и полимер, растворенный в неводном растворителе, прядется методом электростатического прядения (электроформования) зимогенное нановолокно, которое затем пропитывается водой и высушивается. Однако в этом документе ничего не говорится о стерилизации ферментсодержащего нановолокна.
Раскрытие изобретения
Целью настоящего изобретения является создание стерильной композиции, которая поддерживает структуру и функцию белка.
Авторы настоящего изобретения провели интенсивные исследования для решения вышеуказанной проблемы и им неожиданно удалось установить, что, если белок содержится в алифатическом сложном полиэфире, то структурное изменение белка и его функциональное ухудшение, вызываемые стерилизацией облучением, и либо одно, либо оба из вышеуказанного изменения и вышеуказанного ухудшения, вызываемые хранением после стерилизации облучением, могут подавляться. Настоящее изобретение было создано на основе этого открытия.
То есть настоящее изобретение является стерильной композицией, которая включает белок и алифатический сложный эфир, содержащий белок, и стерилизована облучением.
Краткое описание фигур
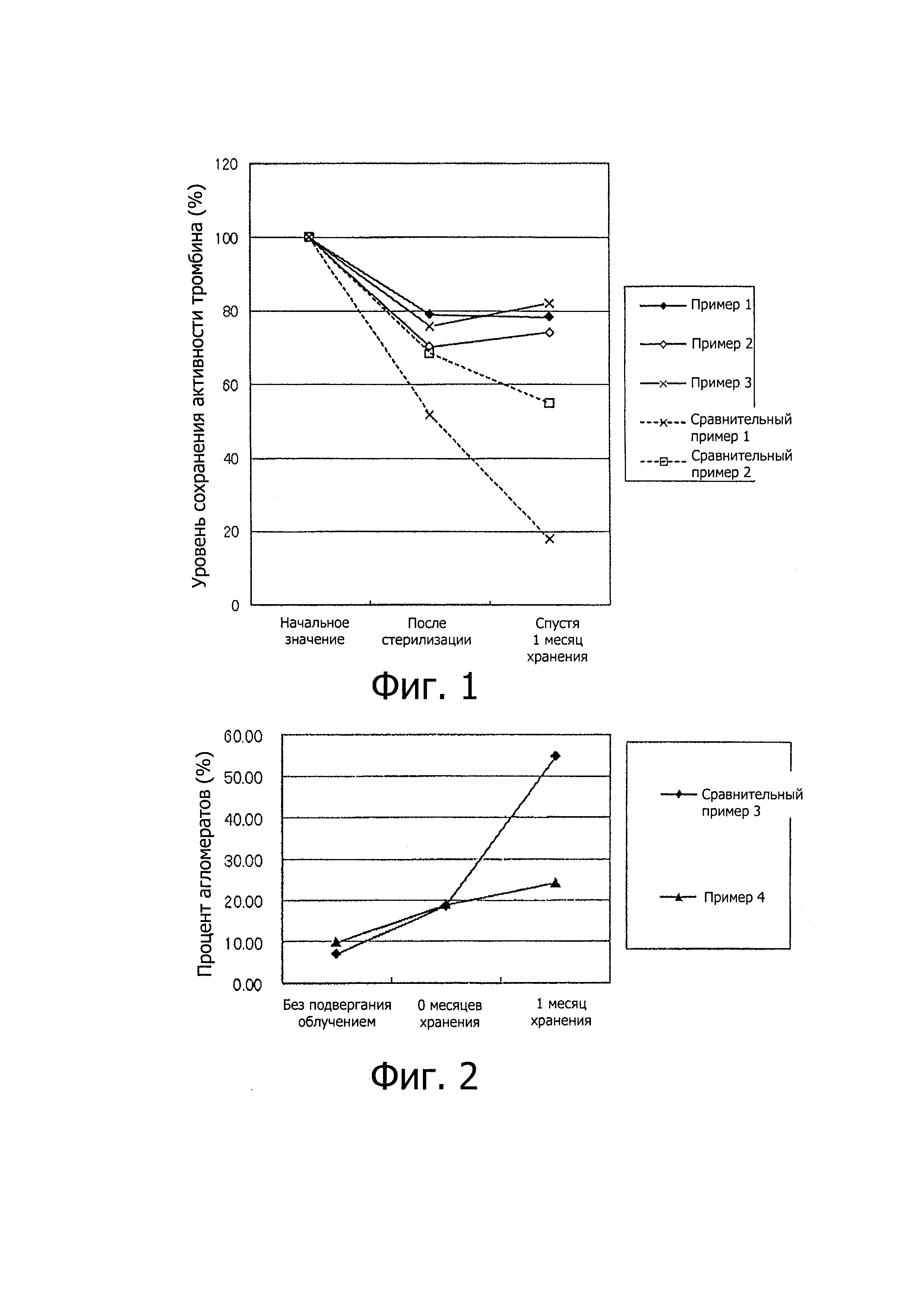
Фиг. 1 показывает каждую из активностей тромбина, полученных путем измерения тромбинсодержащих листовидных волокнистых формованных тел настоящего изобретения, полученных в примерах 1 и 2; тромбинсодержащей пленки настоящего изобретения, полученной в примере 3; тромбинсо держащей частицы сравнительного примера 1 и сравнительного тромбинсодержащего листовидного волокнистого формованного тела, полученного в сравнительном примере 2, как уровни сохранения (удерживания) (%) числового значения после стерилизации и числового значения спустя 1 месяц хранения после стерилизации, основанных на начальном числовом значении до стерилизации.
Фиг. 2 показывает количества агрегатов фибриногена, полученные путем измерения фибриногенсодержащего листовидного волокнистого формованного тела настоящего изобретения, полученного в примере 4, и фибриногенсодержащих частиц сравнительного примера 3, не подвергавшихся облучению, после их стерилизации (ОМ) и спустя 1 месяц хранения после стерилизации (1М).
Предпочтительный вариант осуществления изобретения
Настоящее изобретение представляет собой стерильную композицию, которая включает белок и алифатический сложный полиэфир, содержащий белок, и стерилизована излучением.
Белок, использующийся в настоящем изобретении, особо не ограничивается. Предпочтительные примеры белка включают гемостатические белки, типичными примерами которых являются фибриноген и тромбин; ферменты, типичными примерами которых являются аспарагиназа, катал аза, супероксиддисмутаза и липаза; транспортные белки, типичными примерами которых являются гемоглобин, сывороточный альбумин и липопротеид низкой плотности; мышечные белки, типичными примерами которых являются актин и миозин; защитные белки, типичными примерами которых являются антитела и комплементы; белки токсинов, таких как токсин дифтерии, ботулинический токсин и змеиный яд; белковые гормоны, типичными примерами которых являются инсулин, факторы роста и цитокины; запасные белки, типичными примерами которых являются овальбумин и ферритин; структурные белки, типичными примерами которых являются коллаген и кератин, и факторы роста, типичными примерами которых являются эпидермальный фактор роста (EGF), инсулиноподобный фактор роста (IGF), трансформирующий фактор роста (TGF), фактор роста нерва (NGF), нейротрофический фактор головного мозга (BDNF), сосудистый эндотелиальный фактор роста (VEGF), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), фактор роста, происходящий из тромбоцитов (PDGF), эритропоэтин (ЕРО), тромбопоэтин (ТРО), основной фактор роста фибробластов (bFGF или FGF2) и фактор роста гепатоцитов (HGF). Из вышеперечисленного особенно предпочтительными являются ферменты, транспортные белки, мышечные белки, защитные белки, белки токсинов, белковые гормоны, запасные белки, структурные белки и факторы роста.
Белок, использующийся в настоящем изобретении, может быть животного происхождения или может быть получен методом генетической рекомбинации. Если белок животного происхождения, то он предпочтительно человеческого происхождения. Белок, полученный методом генетической рекомбинации, может представлять собой вариант, полученный заменой аминокислотной последовательности на другую аминокислотную последовательность, если основная биоактивность их одинакова. Могут также использоваться белки, полученные модификацией этих белков, и их смеси.
К белку, использующемуся в настоящем изобретении, могут добавляться добавки, которые являются фармацевтически приемлемыми. Предпочтительные примеры добавок включают фактор свертывания крови XIII, альбумин, изолейцин, глицин, аргинин, глутаминовую кислоту, фенилаланин, гистидин, поверхностно-активные вещества, хлорид натрия, сахарные спирты (такие как глицерин, маннитол и др.), трегалозу, цитрат натрия, апротинин и хлорид кальция. Используется по меньшей мере одна добавка, выбранная из группы перечисленных добавок.
Белок, использующийся в настоящем изобретении, или смесь белка с добавками может диспергироваться в алифатическом сложном полиэфире в виде молекул, но предпочтительно - в виде частиц (обозначаемых как "белковые частицы", включающие смешанные частицы с добавками), образовавшихся в результате агрегации молекул.
Алифатический сложный полиэфир, применяемый в настоящем изобретении, предпочтительно является биоабсорбируемым или биодеградируемым полимером. Примеры биоабсорбируемого полимера включают полимолочную кислоту, полигликолевую кислоту, сополимер полимолочной и полигликолевой кислот, поликапролактон, сополимер полимолочной кислоты и поликапролактона, полиглицеринсебациновую кислоту, полигидроксиалканоевую кислоту, полибутиленсукцинат и их производные.
Из вышеперечисленного предпочтительными являются полигликолевая кислота, полимолочная кислота, поликапролактон, их сополимеры и их смеси; полимолочная кислота и сополимер полимолочной и полигликолевой кислот являются наиболее предпочтительными. Например, может использоваться стереокомплекс поли-L-молочной кислоты и поли-D-молочной кислоты.
Молекулярная масса алифатического сложного полиэфира, использующегося в настоящем изобретении, составляет от 1×103 до 5×106, предпочтительно - от 1×104 до 1×106, наиболее предпочтительно - от 5×104 до 5×105. Концевая структура полимера и катализатор для полимеризации полимера могут выбираться произвольно.
В стерильной композиции настоящего изобретения другой полимер или другое соединение могут использоваться в комбинации при условии, что это не противоречит цели настоящего изобретения. Примеры таких комбинаций включают сополимеры, смеси полимеров и смеси соединений.
Алифатический сложный полиэфир, применяемый в настоящем изобретении, предпочтительно имеет высокую степень чистоты. В основном, количества добавок и пластификатора, содержащихся в алифатическом сложном полиэфире, и остатков, таких как остаточный катализатор, остаточные мономеры и остаточный растворитель, используемый для формования и последующей обработки, предпочтительно являются по возможности низкими. В том случае, если композиция применяется для медицинских целей, необходимо снизить эти количества до значений, ниже стандартов безопасности.
В настоящем изобретении выражение "содержащий белок" означает, что по меньшей мере часть белка входит внутрь алифатического сложного полиэфира. Это состояние отличается от состояния лиофилизированного комплекса, в котором белок присутствует на поверхности композиции или в пустотах композиции.
Форма стерильной композиции по настоящему изобретению особо не ограничивается, и композиция может быть в форме волокна, пленки, листа, пластинчатого тела, трубкообразного тела, линейного тела, стержнеобразного тела, амортизирующего материала, пенного или пористого тела. Способ формования для получения формованного изделия особо не ограничивается, если это способ, в котором структурное изменение и снижение активности белка подавляются. Например, могут использоваться такие подходящие способы формования как экструзионное формование, инжекционное формование, каландрование, формование прессованием, формование раздувом, вакуумное формование, формование порошков, формование отливкой без давлением и литьевое формование. Стерильная композиция настоящего изобретения пригодна для производства волокон и пленок и может применяться любой из способов формования, традиционно использующихся для производства волокон или пленок из пластиков. Например, могут применяться способы экструзионного формования, такие как экструзионно-раздувное формование и экструзионное формование через Т-образную фильеру, и способы каландрования и литьевого формования. Вышеуказанное формование может быть формованием из расплава или формованием из раствора, из которых предпочитается использовать формование из раствора для облегчения диспергирования белка с тем, чтобы предотвратить функциональное ухудшение белка.
Волокнистая форма в контексте изобретения относится к 3D-формованному телу, полученному ламинированием, плетением, вязанием или другим способом соединения одного или множества волокон. Волокнистая форма может представлять собой, например, нетканый материал. Кроме того, волокнистая форма включает трубчатую и сетчатую формы, полученные обработкой нетканого материала.
Средний диаметр волокна стерильной композиции, имеющей волокнистую форму настоящего изобретения, составляет, например, от 0,01 до 50 мкм и может быть определен соответствующим образом специалистом в данной области техники согласно предполагаемому применению.
Стерильная композиция, имеющая волокнистую форму настоящего изобретения, может быть в виде длинного волокна. Длинное волокно - это волокно, сформированное без добавления стадии резания волокна в процессе перехода от прядения к обработке волокнистого формованного тела. Оно может быть получено способом электропрядения (электроформования), фильерным (спанбонд-способ) и фильерно-раздувным (мелтблаун-способ) способами из расплава. Из перечисленных способов предпочитается способ электропрядения (электроформования).
Способ электропрядения (электроформования) - это способ, в котором волокнистое формованное тело получают на электроде путем приложения высокого электрического напряжения к раствору, содержащему полимер. Процесс включает стадии приготовления прядильного раствора, содержащего полимер; прикладывания высокого электрического напряжения к раствору; формирования струи раствора; образования волокнистого формованного тела в результате испарения растворителя из струи раствора; снятия электрического заряда с образовавшегося волокнистого формованного тела (необязательная стадия) и отложения волокнистого формованного тела на электроде в результате потери электрического заряда.
Ниже дается последовательное описание способа производства стерильной композиции, имеющей волокнистую форму или форму нетканого материала по изобретению, с применением способа электропрядения (электроформования) в качестве примера.
Разъясняется стадия приготовления прядильного раствора в способе электропрядения - (электроформования). Так как прядильный раствор в настоящем изобретении особо не ограничивается, то в качестве прядильного раствора могут использоваться эмульсия, содержащая раствор органического растворителя для алифатического сложного эфира и водный раствор белка; суспензия, содержащая раствор органического растворителя для алифатического сложного эфира и белковые частицы, либо раствор органического растворителя, содержащий алифатический сложный эфир и белок. Из перечисленного предпочтение отдается суспензии, содержащей раствор органического растворителя для алифатического сложного эфира и белковые частицы.
Концентрация алифатического сложного полиэфира в растворе алифатического полиэфира предпочтительно составляет от 1 до 30 мас. %. Если концентрация алифатического полиэфира ниже 1 мас. %, то образование волокнистого формованного тела крайне затрудняется, что является недостатком. Если концентрация выше 30 мас. %, то диаметр волокон полученного волокнистого формованного тела становится большим, что является недостатком. Более предпочтительно, если концентрация алифатического сложного полиэфира, содержащегося в растворе органического растворителя, составляет от 2 до 20 мас. %.
Растворитель для алифатического сложного полиэфира особо не ограничивается, если он способен растворять алифатический сложный полиэфир, испаряется на стадии прядения и способен к образованию волокна. Можно использовать только один растворитель либо комбинацию двух или более растворителей. Примеры растворителя включают хлороформ, 2-пропанол, толуол, бензол, бензиновый спирт, дихлорметан, четыреххлористый углерод, циклогексан, циклогексанон, трихлорэтан, метилэтилкетон, этилацетат и их смеси. Для образования эмульсии может содержаться такой растворитель, как ацетон, этанол, метанол, тетрагидрофуран, 1,4-диоксан, 1-пропанол, фенол, пиридин, уксусная кислота, муравьиная кислота, гексафтор-2-пропанол, гексафторацетон, N,N-диметилформамид, N,N-диметилацетамид, ацетонитрил, N-метил-2-пирролидинон, N-метилморфолин-N-оксид или 1,3-диоксолан. Из вышеперечисленного предпочтительнее использовать дихлорметан или этанол с точки зрения несложности обработки и физических свойств.
Белок в настоящем изобретении может добавляться к и смешиваться с раствором органического растворителя для алифатического сложного полиэфира в твердом, жидком виде или в виде раствора.
В настоящем изобретении., если в качестве прядильного раствора используется эмульсия, содержащая раствор органического растворителя для алифатического сложного полиэфира и водный раствор белка, то водный растворитель для белка особо не ограничивается, если он способен растворять белок, образует эмульсию с раствором органического растворителя для алифатического сложного полиэфира, испаряется на стадии прядения и способен к образованию волокна. Например, могут использоваться физиологические и буферные растворы. Кроме того, могут добавляться стабилизатор для белка и добавки. Из перечисленного предпочтительно используется фосфорно-кислотный буферный раствор или физиологический раствор.
Концентрация белка в водном растворе белка, использующегося в настоящем изобретении, особо не ограничивается и может определяться соответствующим образом с учетом характерных свойств белка. Она составляет, например, от 0,5 до 50 мас. %.
При приготовлении эмульсии из раствора органического растворителя для алифатического сложного полиэфира и водного раствора белка соотношение смешивания этих растворов особо не ограничивается, если они образуют стабильную эмульсию. Например, объемное отношение (водный раствор белка)/(раствор органического растворителя для-алифатического сложного полиэфира) составляет от 1/100 до 1/2. Если это значение превышает 1/2, то эмульсия становится нестабильной, что является недостатком.
Хотя способ приготовления эмульсии смешиванием раствора органического растворителя для алифатического сложного полиэфира с водным раствором белка особо не ограничивается, может применяться ультрафиолетовое излучение или перемешивающее средство. В качестве перемешивающего средства может использоваться высокоскоростное перемешивающее средство, такое как гомогенизатор, или перемешивающее средство, такое как аттритор или шаровая мельница. Из вышеперечисленного предпочтение отдается приготовлению дисперсии с помощью ультразвука.
Следовательно, прядильный раствор может приготовляться путем добавления алифатического сложного полиэфира после образования эмульсии из органического растворителя и водного раствора белка.
В настоящем изобретении, если в качестве прядильного раствора используется суспензия, содержащая раствор органического растворителя для алифатического сложного полиэфира и белок, то размеры белковых частиц особо не ограничиваются, но предпочтительно они составляют от 0,01 до 100 мкм. Технически сложно получить белковые частицы размером менее 0,01 мкм; если же размер частиц превышает 100 мкм, то диспергируемость ухудшается и стерильная композиция становится хрупкой, что является недостатком.
Хотя способ приготовления суспензии смешиванием раствора органического растворителя для алифатического сложного полиэфира с белковыми частицами особо не ограничивается, может применяться ультрафиолетовое излучение или перемешивающее средство. В качестве перемешивающего средства может использоваться высокоскоростное перемешивающее средство, такое как гомогенизатор, или перемешивающее средство, такое как аттритор или шаровая мельница. Из вышеперечисленного предпочтение отдается приготовлению дисперсии с применением ультразвука.
Помимо этого, прядильный раствор может приготовляться путем добавления алифатического сложного полиэфира после образования суспензии из органического растворителя и белковых частиц.
Перед приготовлением суспензии белковые частицы могут быть подвергнуты микрообработке. Для микрообработки существуют сухой и мокрый способы измельчения, которые оба могут использоваться и также могут комбинироваться в настоящем изобретении.
Сухой способ может проводиться путем измельчения в шаровой мельнице, планетарной мельнице или качающейся мельнице, путем растирания в ступке пестиком либо путем помола в мельнице тонкого измельчения со среднескоростным перемешиванием, струйной мельнице или жерновой мельнице.
В то время как мокрый способ измельчения осуществляется перемешиванием с помощью мешалки или месилки, работающей с высоким усилием среза, в процессе диспергирования белковых частиц в подходящей дисперсионной среде либо с применением шаровой мельницы или бисерной мельницы в процессе диспергирования белковых частиц в среде. Помимо этого, могут использоваться белковые частицы, полученные распылительной сушкой.
Способ стерилизации, использующийся в настоящем изобретении, представляет собой стерилизацию облучением. Примеры включают облучение альфа-лучами, бета-лучами, гамма-лучами, нейтронами, пучком электронов и рентгеновскими лучами. Из вышеперечисленного предпочтение отдается облучению гамма-лучами и пучком электронов, наиболее предпочтительным является облучение пучком электронов. Хотя метод стерилизации особо не ограничивается, доза облучения составляет от 10 до 80 кГр (килогрей), предпочтительно - от 20 до 30 кГр. Хотя температурный режим особо не ограничивается, он составляет от -80 до 40°C, предпочтительно - от -80 до 30°C.
Облучение, например, альфа-лучами, позитронами, гамма-лучами, нейтронами, пучком электронов или рентгеновскими лучами отрывает электрон от молекул или атомов, составляющих вещество, при воздействии его на вещество. При этом молекулярная связь разрывается и образуется высокореактивный радикал, который химически реагирует с окружающим веществом вторично.
Хорошо известно, что белок под воздействием облучения имеет тенденцию терять свою функцию (активность). Считается, что это происходит вследствие деструкции "структуры высшего порядка", которая является источником формирования функции при разрыве молекулярной связи под воздействием облучения. Кроме того, как показано в сравнительных примерах описания к настоящей заявке, структурная деструкция или деактивация белка происходит также в процессе хранения его после подвергания облучению. Однако структурная деструкция и потеря функции белка, содержащегося в алифатическом сложном эфире в настоящем изобретении, подавляются, даже если белок подвергнут облучению, и структурная деструкция и потеря функции белка также подавляются в процессе хранения после подвергания облучению. Это означает, что структура высшего порядка белка сохраняется в композиции, и этот эффект является общим независимо от вида белка. Его нельзя рассматривать в зависимости от толщины алифатического сложного полиэфира, через которую проходит излучение: этот эффект является скорее эффектом экранирования, и механизм контроля его не известен.
Содержащий белок алифатический сложный полиэфир до стерилизации облучением в настоящем изобретении может также содержать акцептор электронов/ионов, агент-переносчик энергии, акцептор радикалов, антиоксидант и пластификатор. Примеры акцептора электронов/ионов включают N,N'-тетраметилфенилендиамин, дифенилендиамин, пирен и хинон. Примеры агента-переносчика энергии включают аценафтен. Примеры акцептора радикалов включают меркаптаны, октагидрофенантрены, моноалкилдифениловые эфиры, токоферол, лимонную кислоту, бутилированный гидроксианизол, бутилированный гидрокситолуол (ВНТ), t-бутилгидрохинон, пропилгаллат и производные аскорбиновой кислоты. Примеры антиоксиданта включают ВНТ, фосфитные триэфиры, фенольные агенты, предотвращающие старение, и соли органических тиокислот. Предпочтение отдается добавкам, которые повсеместно одобрены как безопасные к применению в пищевой промышленности и фармацевтике. Количество добавки, которое особо не ограничивается, составляет, например, от 0,01 до 10 мас. % в пересчете на массу алифатического полиэфира в стерильной композиции.
Содержащий белок алифатический сложный полиэфир на стадии стерилизации предпочтительно не содержит воды. Влагосодержание алифатического сложного полиэфира предпочтительно составляет не выше 10 мас. %, более предпочтительно - не выше 4 мас. %, наиболее предпочтительно - в основном 0 мас. %.
Алифатический полиэфир, содержащий белок, может быть завернут в упаковочный материал, стерилизуемый облучением. В качестве упаковочного материала предпочтительно используется материал с высокой газонепроницаемостью, такой как алюминий. Алифатический сложный полиэфир может герметически запечатываться и упаковываться вместе с восстановителем или десикантом либо в процессе заполнения упаковки инертным газом после удаления из нее воздуха, либо оба способа могут комбинироваться друг с другом. В качестве восстановителя и десиканта предпочитается использовать такие, которые не оказывают вредного воздействия на человеческий организм и которые не деактивируются при подвергании облучению.
Стерильная композиция настоящего изобретения может применяться как медицинский материал, который требует активности (функции) и стерильности белка.
Примеры
Следующие примеры приводятся с целью дополнительной иллюстрации настоящего изобретения, но ни в коей мере не должны рассматриваться как ограничивающие его.
1. Измерение активности тромбина
20 мкл образца, 60 мкл [50 мМ трис-HC1 (рН 8,5)+50 мМ NaCl]-буфера и 20 мкл 0,1% PLURONIC F-68 добавляли в инкубационную пробирку 2008 FALCON Corporation, которую затем инкубировали при 37°C в течение 3 минут. Очищенный α-тромбин, выделенный из человеческой плазмы (закуплен у Haematologic Technologies, Inc.: НСТ-0020), разбавляли вышеуказанным буфером до 5, 2,5, 1,25, 0,625 и 0,3125 ед./мл; разбавление 0,3125 ед./мл использовали в качестве стандарта. Добавляли 100 мкл хромогенного субстрата S-2238 для исследований (1 мМ: Daiichi Pure Chemicals Co., Ltd.) и смешивали с полученным реакционным раствором при перемешивании для проведения реакции при 37°C в течение 5 минут, затем добавляли 800 мкл 0,1 М раствора лимонной кислоты для прекращения реакции. 200 мкл реакционного раствора переносили на 96-луночные планшеты для измерения оптической плотности при 405/650 нм (OD405/650).
Для измерения активности тромбина в примерах и сравнительных примерах, за исключением примеров 5-7 и сравнительного примера 4, использовался следующий метод. 20 мкл образца и 80 мкл разбавленного раствора для измерения активности (0,01% F-68, 50 ммол/л NaCl, 50 ммол/л Трис-HCl, рН 8,4) добавляли в полистироловую пробирку BD для последующей инкубации при 37°C в течение 3 минут. В качестве стандарта использовался рекомбинантный тромбин (400 JPU/мл (японских единиц/мл) согласно стандарту Японии для тромбина или 110 IU/мл согласно стандарту ВОЗ/США для тромбина), разбавленный вышеуказанным буфером до 4, 2, 1, 0,5 и 0,25 ед./мл в случае JPU и до 6, 3, 1,5, 0,75 и 0,375 МЕ/мл в случае Ш (ВОЗ/США). Добавляли 100 мкл хромогенного субстрата S-2238 для исследований (1 мМ: Daiichi Pure Chemicals Co., Ltd.) и смешивали с полученным реакционным раствором в условиях перемешивания для проведения реакции при 37°C в течение 7 минут, затем добавляли 800 мкл 0,1 М раствора лимонной кислоты для прекращения реакции. 200 мкл реакционного раствора переносили на 96-луночные планшеты для измерения OD405/650.
2. Измерение количества агрегатов фибриногена
После обрезки листа до диаметра 1 см проводили экстракцию фибриногена разбавленным раствором для измерения количества его агрегатов высокоскоростной жидкостной хроматографией.

3. Толщина
Толщину 15 формованных тел измеряли с измерительным усилием 0,01 Н (ньютон) с помощью высокоточного измерительного прибора с устройством для вывода данных digimatic (LITEMATIC VL-50 от Mitutoyo Corporation) для расчета среднего значения как толщины формованного тела. Это измерение проводилось с минимальным измерительным усилием, на которое рассчитан измерительный прибор.
4. Масса
Формованное тело обрезали до размера 50 ммх100 мм и измеряли его массу с тем, чтобы рассчитать массу формованного тела.
5. Насыпная плотность
Насыпную плотность формованного тела рассчитывали, исходя из значений толщины и массы, полученных в вышеописанных измерениях.
6. ELISA-измерение тромбина
5 мкг/мл античеловеческого антитела к тромбину (No. SAHT-AP от Affinity Biologicals Inc.) иммобилизовали на планшете для ELISA (NUNC 468667). После отмывки его PBS (фосфатно-солевой буферный раствор), содержащим 0,05% Tween 20 (эмульгатор), в каждую лунку добавляли Block Асе (блокирующий буфер) (UK-B80 от DS Pharma Biomedical Co., Ltd.) для проведения маскирования. После отмывки PBS, содержащим 0,05% Tween 20, добавляли тестируемое тело. В качестве стандарта для построения калибровочной кривой использовали человеческий тромбин (НСТ-0020 от Haetologic Technologies, Inc.). После отмывки PBS, содержащим 0,05% Tween 20, добавляли 0,1 мкг/мл HPRпероксидазой хрена)-меченого античеловеческого антитела к тромбину (No. SAHT-HRP от Affinity Biologicals Inc.). По окончании реакции продукт реакции отмывали PBS, содержащим 0,05% Tween 20, добавляли реагент ТМВ (тетраметилбензидин) (DaKo SI599) и общую смесь оставляли в покое на 10 минут для появления окрашивания. 1 N H2SO4 добавляли для прекращения окрашивания с тем, чтобы измерить оптическую плотность OD450-650 нм с помощью микропланшетного ридера (считывателя).
7. Измерение активности ферментов липазы и β-глюкозидазы
(1) Измерение степени извлечения фермента при экстракции
Формованное тело обрезали до размера 2 см х×2 см и погружали в 1 мл физиологического раствора на 3 минуты или на 3 часа для извлечения иммобилизованного фермента. Этот процесс проводили на трех формованных телах для измерения изменений их массы с тем, чтобы получить среднее значение степени извлечения фермента при экстракции, рассчитываемое по следующему уравнению. Теоретическую массу иммобилизованного фермента рассчитывали, исходя из массы композиции и мас. % заряженного фермента в порошке.

(2) Измерение активности фермента
Для измерения активности липазы использовали набор реагентов для непрерывного флуориметрического определения липазы (изготовитель - ROGEN BIOTECHNIK GmbH). Уровень восстановления активности рассчитывали по следующему уравнению. Количество активного фермента вычисляли в рамках концентрации, исходя из значения активности. Теоретическую массу фермента/единицу площади рассчитывали, исходя из мас. % заряженного фермента в порошке и массы композиции.

Для измерения активности (3-глюкозидазы применяли флуоресцентный метод измерения с Tokyogreen (флуоресцентный краситель) (зарегистрированная торговая марка; то же относится и к остальному тексту) -βGlu (Sekisui Medical Co., Ltd.). Уровень восстановления активности рассчитывали по следующему уравнению. Теоретическую массу иммобилизованного фермента вычисляли, исходя из мас. % заряженного фермента в порошке и массы композиции.

Уровень сохранения (удерживания) активности рассчитывали по следующему уравнению.
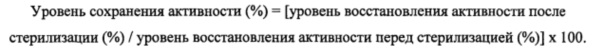
Пример 1
К дисперсии, полученной диспергированием в этаноле тромбинсодержащих частиц (приготовленных лиофилизацией водного раствора, содержащего 1 мг/мл рекомбинантного тромбина, хлорид натрия, цитрат натрия, хлорид кальция и маннитол и имеющего рН 7), добавляли дихлорметан и растворяли в дисперсии сополимер полигликолевой и полимолочной кислот (Purasorb PDLG5010 от PURAC) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение тромбинсодержащие частицы/сополимер полигликолевой и полимолочной кислот, равное 100(1,69 по тромбину)/100 (мас/мас). Прядение волокон проводили способом электропрядения (электроформования) с получением листовидного волокнистого формованного тела. Полученное волокнистое формованное тело имело толщину 131 мкм, массу - 1,44 мг/см2 и насыпную плотность - 111 мг/см3. Полученный лист обрезали до диаметра 1 см и экстрагировали белок физиологическим раствором (200 мкл) для измерения активности белка. В итоге измеренное значение активности составило 26,7 ед./см2. Полученный лист стерилизовали облучением пучком электронов в дозе 20 кГр и хранили при 40°C и относительной влажности 75% в течение 1 месяца для последующего измерения активности тромбина. Если активность тромбина до стерилизации была 100%, то уровень сохранения активности тромбина сразу после облучения пучком электронов составил 79%. Уровень сохранения активности спустя 1 месяц хранения был 78% и при хранении снижения активности тромбина не наблюдалось.
Пример 2
К дисперсии, полученной диспергированием в этаноле тромбинсодержащих частиц (приготовленных лиофилизацией водного раствора, содержащего 1 мг/мл рекомбинантного тромбина, хлорид натрия, цитрат натрия, хлорид кальция и маннитол и имеющего рН 7) и красителя квинизарин зеленый SS (Quinizarin Green SS) (Tokyo Chemical Industry Co., Ltd.), добавляли дихлорметан и растворяли в дисперсии сополимер полигликолевой и полимолочной кислот (Purasorb PDLG5010 от PURAC) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение тромбинсодержащие частицы/сополимер полигликолевой и полимолочной кислот, равное 100(1,69 по тромбину)/100 (мас./мас). Прядение волокон проводили способом электропрядения (электроформования) с получением листовидного волокнистого формованного тела. Полученный лист, содержащий волокнистое формованное тело (средняя толщина: 129 мкм, масса: 1,49 мг/см2, насыпная плотность: 124 мг/см3), обрезали до диаметра 1 см и экстрагировали белок физиологическим раствором (200 мкл) для измерения активности тромбина. В итоге измеренное значение активности составило 40,2 МЕ/см2. Полученный лист стерилизовали облучением пучком электронов в дозе 30 кГр и хранили при 40°C и относительной влажности 75% в течение 1 месяца для последующего измерения активности тромбина. Если активность тромбина перед стерилизацией была 100%, то уровень сохранения активности тромбина сразу после облучения пучком электронов составил 70%. Уровень сохранения активности спустя 1 месяц хранения был 74% и при хранении снижения активности тромбина не наблюдалось.
Пример 3
К дисперсии, полученной диспергированием в этаноле тромбинсодержащих частиц (приготовленных, лиофилизацией водного раствора, содержащего 1 мг/мл рекомбинантного тромбина, хлорид натрия, цитрат натрия, хлорид кальция и маннитол и имеющего рН 7), добавляли дихлорметан и растворяли в дисперсии сополимер полигликолевой и полимолочной кислот (Purasorb PDLG5010 от PURAC) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение тромбинсодержащие частицы/сополимер полигликолевой и полимолочной кислот, равное 100(1,69 по тромбину)/100 (мас./мас). Полученный прядильный раствор использовали для формирования пленки способом формования отливкой. Промежуток между слоями покрытия составлял 127 мкм, скорость отливки - 30,1 мм/сек. Полученный лист имел толщину 58 мкм, массу - 2,9 мг/см и насыпную плотность - 504 мг/3. Полученный лист обрезали до диаметра 1 см, и экстрагировали белок физиологическим раствором (200 мкл) для измерения активности тромбина. В итоге измеренное значение активности составило 71,1 МЕ/см2. Полученный лист стерилизовали облучением пучком электронов в дозе 30 кГр и хранили при 40°C и относительной влажности 75% в течение 1 месяца для последующего измерения активности тромбина. Если активность тромбина перед стерилизацией была 100%, то уровень сохранения активности тромбина сразу после облучения пучком электронов составил 75,7%. Уровень сохранения активности спустя 1 месяц хранения был 82% и снижения активности тромбина в процессе хранения не наблюдалось.
Пример 4
К дисперсии, полученной диспергированием в этаноле фибриногенсодержащих частиц (приготовленных лиофилизацией водного раствора, содержащего 10 мг/мл рекомбинантного фибриногена, аргинин, хлорид натрия и маннитол и имеющего рН 8,5), добавляли дихлорметан и растворяли в дисперсии сополимер полигликолевой и полимолочной кислот (Purasorb PDLG5010 от PURAC) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение фибриногенсодержащие частицы/сополимер полигликолевой и полимолочной кислот, равное 100(50,85 по фибриногену)/100 (мас./мас). Прядение волокон проводили способом электропрядения (электроформования) с получением листовидного волокнистого формованного тела. Полученное волокнистое формованное тело имело толщину 131 мкм, массу - 1,44 мг/см2 и насыпную плотность - 110 мг/см3. Полученный лист обрезали до диаметра 1 см и экстрагировали фибриноген разбавленным раствором для измерения количества его агрегатов высокоскоростной хроматографией. В итоге количество агрегатов составило 9,79%. Полученный лист стерилизовали облучением пучком электронов в дозе 30 кГр и хранили при 40°C и относительной влажности 75% в течение 1 месяца для последующего измерения количества агрегатов. Количество агрегатов сразу после облучения пучком электронов составило 18,81%. Масса агрегатов спустя 1 месяц хранения составила 24,14%.
Сравнительный пример 1
После облучения пучком электронов в дозе 30 кГр тромбинсодержащих частиц (приготовленных лиофилизацией водного раствора, содержащего 1 мг/мл рекомбинантного тромбина, хлорид натрия, цитрат натрия, хлорид кальция и маннитол и имеющего рН 7) для стерилизации их указанные частицы хранили при 40°C и относительной влажности 75% в течение 1 месяца для последующего измерения активности тромбина. Активность тромбина до облучения составляла 404,73 ед./флакон. Если активность тромбина до стерилизации была 100%, то уровень сохранения активности тромбина сразу после облучения пучком электронов составил 51,8%. Спустя 1 месяц хранения уровень сохранения активности составил 17,9% и снижения активности тромбина в процессе хранения не наблюдалось. Сравнительный пример 2
В дисперсии, полученной диспергированием в 2-пропаноле тромбинсодержащих частиц (приготовленных лиофилизацией водного раствора, содержащего 1 мг/мл рекомбинантного тромбина, хлорид натрия, цитрат натрия, хлорид кальция и маннитол и имеющего рН 7), растворяли гидроксипропилцеллюлозу (2,0-2,9 мПа⋅с, изготовитель -Nippon Soda Co., Ltd.) до концентрации 13 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение тромбинсодержащие частицы/гидроксипропилцеллюлоза, равное 100/100 (мас/мас). Прядение волокон проводили способом электропрядения (электроформования) с получением листовидного волокнистого формованного тела. Полученное волокнистое формованное тело имело толщину 204 мкм, массу - 2,08 мг/см2 и насыпную плотность - 101 мг/см. Полученный лист обрезали до диаметра 1 см и экстрагировали белок физиологическим раствором (200 мкл) для измерения его активности. В итоге измеренное значение активности было 110,3 МЕ/см. Полученный лист стерилизовали облучением пучком электронов в дозе 30 кГр и хранили при 40°C и относительной влажности 75% в течение 1 месяца, после чего измеряли активность тромбина. Если до стерилизации активность тромбина была 100%, то после облучения пучком электронов уровень сохранения активности тромбина составил 68,4%. Уровень сохранения активности спустя 1 месяц хранения составил 54,9% и снижения активности тромбина в процессе хранения не наблюдалось.
Сравнительный пример 3
После облучения пучком электронов в дозе 30 кГр фибриногенсодержащих частиц (приготовленных лиофилизацией водного раствора, содержащего 10 мг/мл рекомбинантного фибриногена, аргинин, хлорид натрия и маннитол и имеющего рН 8,5) для стерилизации их указанные частицы хранили при 40°C и относительной влажности 75% в течение 1 месяца для последующего измерения количества агрегатов фибриногена. До облучения количество агрегатов составляло 6,97%. Сразу после облучения пучком электронов количество агрегатов составило 18,51%. Спустя 1 месяц хранения количество агрегатов составило 54,72%.
Результаты (уровни сохранения активности тромбина (Th) после стерилизации и после хранения, рассчитанные, исходя из начального значения до стерилизации) примеров 1-3 и сравнительных примеров 1 и 2 представлены на фиг. 1.
Понятно, что, если белок содержится в алифатическом сложном полиэфире, то структурное изменение и нарушение функции белка, вызываемые стерилизацией облучением, подавляются, если сравнивать со случаем, когда используются только белоксодержащие частицы (сравнительный пример 1), и что структурное изменение и нарушение функции белка, вызываемые хранением после стерилизации облучением, также подавляются по сравнению со случаем, когда используется не алифатический сложный полиэфир, а целлюлоза (гидроксипропилцеллюлоза) (сравнительный пример 2). Результаты (количество агрегатов фибриногена после стерилизации и после хранения после стерилизации) примера 4 и сравнительного примера 3 показаны на фиг. 2.
Понятно, что, если белок содержится в алифатическом сложном полиэфире (пример 4), то структурное изменение белка, вызываемое хранением после стерилизации облучением, подавляется, если сравнивать со случаем, когда используются только белоксодержащие частицы (сравнительный пример 3).
Пример 5
К дисперсии, полученной диспергированием в этаноле тромбинсодержащих частиц (Bolheal (зарегистрированная торговая марка, то же относится и к остальному тексту), тканевой адгезив: ампула 3), добавляли дихлорметан и растворяли в дисперсии полимолочную кислоту (PL 18 от Purac Biomaterials) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение тромбинсодержащие частицы/полимолочная кислота, равное 40 (0,45 по тромбину)/100 (мас./мас). Прядение волокон проводили способом электропрядения (электроформования) с получением листовидного волокнистого формованного тела. Полученный лист стерилизовали пучком электронов в дозе 20 кГр. Полученный лист обрезали до размера 2 см×2 см и экстрагировали белок физиологическим раствором (1 мл) для измерения активности белка и ELISA-измерения. В итоге измеренное значение активности составило 5,0 ед./см2, а значение, измеренное методом ELISA, составило 3,4 мкг/см2. При проведении измерений активности и ELISA на аналогичном нестерилизованном листе измеренное значение активности составило 7,5 ед./см2, а значение, измеренное методом ELISA, - 4,35 мкг/см. То есть уровень сохранения активности стерилизованного листа составил 73% от уровня сохранения активности нестерилизованного листа.
Пример 6
К дисперсии, полученной диспергированием в этаноле тромбинсодержащих частиц (тканевой адгезив Bolheal: ампула 3), добавляли дихлорметан и растворяли в дисперсии полимолочную кислоту (PL 18 от Purac Biomaterials) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение тромбинсодержащие частицы/ полимолочная кислота, равное 70 (0,78 по тромбину)/100 (мас./мас). Прядение волокон проводили способом электропрядения (электроформования) с получением листовидного волокнистого формованного тела. Полученный лист стерилизовали пучком электронов в дозе 20 кГр. Полученный лист обрезали до размера 2 см×2 см и экстрагировали белок физиологическим раствором (1 мл) для измерения активности белка и ELISA. В итоге измеренное значение активности составило 9,575 ед./см, а значение, измеренное методом ELISA, составило 7,0 мкг/см2. При проведении измерений активности и ELISA на аналогичном нестерилизованном листе измеренное значение активности составило 11,15 ед./см2, а значение, измеренное методом ELISA, - 7,2 мкг/см2. То есть уровень сохранения активности стерилизованного листа составил 86% от уровня сохранения активности нестерилизованного листа.
Пример 7
К дисперсии, полученной диспергированием в этаноле лиофилизированных порошков тромбина (тканевой адгезив Bolheal: ампула 3), добавляли дихлорметан и растворяли в дисперсии полимолочную кислоту (PL 18 от Purac Biomaterials) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение лиофилизированный порошок тромбина/ полимолочная кислота, равное 100(1,1 по тромбину)/100 (мас./мас). Прядение волокон проводили способом электропрядения (электроформования) при температуре 22°C и влажности не выше 26% с получением листовидного волокнистого формованного тела. Внутренний диаметр струйного сопла составлял 0,8 мм, напряжение - 15 кВ, скорость потока прядильного раствора - 3,0 мл/ч и расстояние от струйного сопла до плоской пластины - 25 см. Полученный лист стерилизовали пучком электронов в дозе 20 кГр. Полученный лист обрезали до размера 2 см×2 см и экстрагировали белок физиологическим раствором (1 мл) для измерения активности белка и ELISA. В итоге измеренное значение активности составило 15 ед./см2, а значение, измеренное методом ELISA, составило 16 мкг/см2. При проведении измерений активности и ELISA на аналогичном нестерилизованном листе измеренное значение активности составило 23 ед./см2, а значение, измеренное методом ELISA, - 16 мкг/см2. То есть уровень сохранения активности стерилизованного листа составил 64% от уровня сохранения активности нестерилизованного листа.
Сравнительный пример 4
Тромбинсодержащие частицы (Bolheal) стерилизовали пучком электронов в дозе 20 кГр. Белок экстрагировали физиологическим раствором (1 мл) для измерения активности белка и ELISA. В итоге измеренное значение активности составило 22,5 ед./см2, а значение, измеренное методом ELISA, составило 11,5 мкг/см2. При проведении измерений активности и ELISA на аналогичных нестерилизованных тромбинсодержащих частицах измеренное значение активности составило 68,5 ед./см2, а значение, измеренное методом ELISA, - 41,5 мкг/см2. То есть уровень сохранения активности стерилизованного листа составил 32% от уровня сохранения активности нестерилизованного листа. Пример 8
К дисперсии, полученной диспергированием в этаноле порошков липазы (выделенной из поджелудочной железы свиней, изготовитель - Wako Pure Chemical Industries, Ltd., то же самое относится и к остальному тексту), добавляли дихлорметан и растворяли в дисперсии сополимер полимолочной кислоты и гликолевой кислоты (PDLG5010 от Purac Biomaterials) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение порошок липазы/сополимер полимолочной кислоты и гликолевой кислоты, равное 50/100 (мас./мас). Прядение волокон проводили способом электропрядения (электроформования) при температуре 27°C и влажности не выше 25% с получением листовидного волокнистого формованного тела. Внутренний диаметр струйного сопла составлял 0,9 мм, напряжение - 15 кВ, скорость потока прядильного раствора - 4,0 мл/ч и расстояние от струйного сопла до плоской пластины - 25 см. Степень извлечения липазы при экстракции полученного листа составила 79%. Полученный лист стерилизовали пучком электронов в дозе 20 кГр. Полученный стерилизованный лист обрезали до размера 1 см×1 см и экстрагировали липазу буфером для пробы на липазу (1 мл), содержащимся в наборе реагентов для измерения активности липазы. В итоге уровень восстановления активности составил 100%.
Пример 9
К порошкам липазы добавляли дихлорметан и в полученной смеси растворяли сополимер полимолочной кислоты и гликолевой кислоты (PDLG5010 от Purac Biomaterials) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение порошок липазы/ полимолочная кислота, равное 50/100 (мас/мас). Прядение волокон проводили способом электропрядения (электроформования) при температуре 26°C и влажности не выше 25% с получением листовидного волокнистого формованного тела. Внутренний диаметр струйного сопла составлял 0,8 мм, напряжение -15 кВ, скорость потока прядильного раствора - 4,0 мл/ч и расстояние от струйного сопла до плоской пластины - 25 см. Степень извлечения липазы при экстракции полученного листа составила 63%. Полученный лист стерилизовали пучком электронов в дозе 20 кГр. Полученный стерилизованный лист обрезали до размера 1 смх1 см и экстрагировали липазу буфером для пробы на липазу (1 мл), содержащимся в наборе реагентов для измерения активности липазы. В итоге уровень восстановления активности составил 92%.
Пример 10
К дисперсии, полученной диспергированием в этаноле порошков β-глюкозидазы (выделенной из миндаля, изготовитель - Oriental Yeast Co., Ltd, то же относится и к остальному тексту), добавляли дихлорметан и растворяли в дисперсии сополимер полимолочной кислоты и гликолевой кислоты (PDLG5010 от Purac Biomaterials) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение порошок β-глюкозидазы/сополимер полимолочной кислоты и гликолевой кислоты, равное 38/62 (мас./мас.). Прядение волокон проводили способом электропрядения (электроформования) при температуре 27°C и влажности не выше 25% с получением листовидного волокнистого формованного тела. Внутренний диаметр струйного сопла составлял 0,9 мм, напряжение - 15 кВ, скорость потока прядильного раствора - 4,0 мл/ч и расстояние от струйного сопла до плоской пластины - 25 см. После обрезки полученного листа до размера 2 см×2 см его стерилизовали пучком электронов в дозе 20 кГр. β-глюкозидазу экстрагировали физиологическим раствором (1 мл) для измерения ее активности с применением Tokyogreen-βGlu. В итоге уровень восстановления активности составил 92%. При измерении активности на аналогичном нестерилизованном листе уровень восстановления активности составил 94%. Из вышесказанного понятно, что уровень сохранения активности стерилизованного волокнистого формованного тела составляет 98% от уровня сохранения активности нестерилизованного волокнистого формованного тела и что β-глюкозидаза не деактивируется стерилизацией пучком электронов.
Пример 11
К дисперсии, полученной диспергированием в этаноле порошков β-глюкозидазы, добавляли дихлорметан и растворяли в дисперсии сополимер полимолочной кислоты и капролактона (PLCA8812 от Taki Chemical Co., Ltd.) до концентрации 10 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение порошок β-глюкозидазы/сополимер полимолочной кислоты и капролактона, равное 38/62 (мас/мас). Прядение волокон проводили способом электропрядения (электроформования) при температуре 27°C и влажности не выше 25% с получением листовидного волокнистого формованного тела. Внутренний диаметр струйного сопла составлял 0,9 мм, напряжение -15 кВ, скорость потока прядильного раствора - 3,0 мл/ч и расстояние от струйного сопла до плоской пластины - 25 см. После обрезки полученного листа до размера 2 см×2 см его стерилизовали пучком электронов в дозе 20 кГр. β-глюкозидазу экстрагировали физиологическим раствором (1 мл) для измерения ее активности с Tokyogreen-βGlu. В итоге уровень восстановления активности составил 81%. При измерении активности на аналогичном нестерилизованном листе уровень восстановления активности был 80%. Из вышесказанного понятно, что уровень сохранения активности стерилизованного волокнистого формованного тела составляет 101% от уровня сохранения активности нестерилизованного волокнистого формованного тела и что β-глюкозидаза не деактивируется стерилизацией пучком электронов.
Пример 12
К дисперсии, полученной диспергированием в этаноле порошков β-глюкозидазы, добавляли дихлорметан и растворяли в дисперсии полимолочную кислоту (PL 18 от Purac Biomaterials) до концентрации 11 мас. % с тем, чтобы получить прядильный раствор, имеющий отношение порошок β-глюкозидазы/полимолочная кислота, равное 38/62 (мас./мас). Прядение волокон проводили способом электропрядения (электроформования) при температуре 27°C и влажности не выше 25% с получением листовидного волокнистого формованного тела. Внутренний диаметр струйного сопла составлял 0,9 мм, напряжение - 15 кВ, скорость потока прядильного раствора - 3,0 мл/ч и расстояние от струйного сопла до плоской пластины - 25 см. После обрезки полученного листа до размера. 2 см×2 см его стерилизовали пучком электронов в дозе 20 кГр. β-глюкозидазу экстрагировали физиологическим раствором (1 мл) для измерения ее активности с Tokyogreen-βGlu. В итоге уровень восстановления активности составил 62%. При измерении активности на аналогичном нестерилизованном листе уровень восстановления активности был 71%. Из вышесказанного понятно, что уровень сохранения активности стерилизованного волокнистого формованного тела составляет 87% от уровня сохранения активности нестерилизованного волокнистого формованного тела и что β-глюкозидаза не деактивируется стерилизацией пучком электронов.
Сравнительный пример 5
Порошки липазы стерилизовали пучком электронов в дозе 20 кГр. 1 мл буфера для пробы на липазу добавляли к 1 мг порошков для измерения активности липазы. В итоге уровень восстановления активности составил 74%.
Сравнительный пример 6
Порошки β-глюкозидазы стерилизовали пучком электронов в дозе 20 кГр. 2 мг порошков растворяли в 1 мл физиологического раствора для измерения активности β-глюкозидазы с Tokyogreen-pGlu. В итоге уровень сохранения активности составил 81%.
Эффект от изобретения
Стерильная композиция настоящего изобретения сохраняет структуру и функцию белка, хотя она является стерилизованной.
Промышленная осуществимость изобретения
Стерильная композиция настоящего изобретения применяется в производстве медицинских изделий, которые требуют активности (функции) и стерильности белка.