Результат интеллектуальной деятельности: СИСТЕМЫ И СПОСОБЫ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ РАКА МОЧЕВОГО ПУЗЫРЯ ГЕМЦИТАБИНОМ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет по предварительной заявке на патент США № 61/949215, поданной 6 марта 2014 года, которая включена в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к усовершенствованному варианту лечения рака и, в частности, относится к композициям, устройствам и способам для лечения раковых заболеваний мочевого пузыря.
УРОВЕНЬ ТЕХНИКИ
Рак мочевого пузыря представляет собой важную медицинскую проблему, а имеющиеся в настоящее время варианты лечения являются неудовлетворительными по ряду причин.
В целом, раковые заболевания мочевого пузыря классифицируются как мышечно-инвазивный рак мочевого пузыря (МИРМП) или немышечно-инвазивный рак мочевого пузыря (НМИРМП). Классификация патологий и стадирование рака мочевого пузыря выглядит следующим образом: pTa (поражение уротелия); pTis (уротелиальная карцинома высокой степени злокачественности); pT1 (поражение собственной пластинки слизистой оболочки мочевого пузыря); pT2 (мышечное поражение); pT3 (поражение перивезикального жира); и pT4 (распространение в органы малого таза). Раковые заболевания мочевого пузыря могут также классифицироваться по степеням, таким как Grade 1/3 (с высокой степенью дифференцировки); Grade 2/3 (с умеренной степенью дифференцировки); Grade 3/3 (с низкой степенью дифференцировки). Кроме того, раковые заболевания мочевого пузыря могут классифицироваться по стадиям, таким как Стадии 0-IV. Большинство раковых заболеваний мочевого пузыря представляют собой переходно-клеточные карциномы эпителиального происхождения и классифицируются как немышечно-инвазивный рак (НМИРМП), ограниченный внутренней оболочкой мочевого пузыря. При начальном проявлении большинство раковых заболеваний мочевого пузыря представляют собой поверхностные НМИРМП и включают стадии заболевания pTa, pTis и pT1. МИРМП включает стадии pT2, pT3 и pT4.
Типичным клиническим протоколом ранней стадии рака мочевого пузыря является визуализация при цистоскопии с последующим хирургическим удалением опухоли (опухолей), известным как трансуретральная резекция (ТУР). Тем не менее, существует высокий процент рецидивов после хирургического вмешательства, и рак может прогрессировать в мышечно-инвазивное заболевание. В силу этих обстоятельств, хирургическое вмешательство зачастую сочетают с адъювантной инстилляцией в мочевой пузырь (прямым введением химиотерапевтического средства в мочевой пузырь через катетер) химиотерапевтических или иммунотерапевтических средств с целью предотвращения или уменьшения числа случаев и выраженности рецидивов. Таким иммунотерапевтическим средством является бацилла Кальметта-Герена (БЦЖ), и, как правило, ее инстилируют в мочевой пузырь после хирургического вмешательства. Тем не менее, многие пациенты не реагируют на БЦЖ, и лечение с помощью БЦЖ может также вызывать ряд побочных эффектов, приводящих к прекращению лечения. Химиотерапевтические средства, как правило, предназначены для пациентов, которым не подошла терапия с помощью БЦЖ. Химиотерапию, как правило, применяют внутрипузырно для сосредоточения химиотерапевтического средства на локализациях опухоли и устранения любой остаточной опухоли после резекции, избегая при этом всасывание лекарственного средства в системный кровоток.
Одним из таких химиотерапевтических средств, применяемых в клинических исследованиях для лечения рака мочевого пузыря, является гемцитабин. Гемцитабин (2',2'-дифтордезоксицитидин) представляет собой аналог пиримидина, обладающий активностью в отношении метастатического рака мочевого пузыря. Гемцитабин также применяют в клинических исследованиях для лечения поверхностного рака мочевого пузыря и НМИРМП посредством инстилляции в мочевой пузырь с различными недельными графиками. Гемцитабин, как правило, инстилируют на протяжении 1-2 часов один или два раза в неделю в течение нескольких недель в дозах, как правило, находящихся в пределах от 500 до 2000 мг в солевом растворе объемом до 100 мл.
Известно, что такие препараты выводятся с мочой из мочевого пузыря до достижения полной эффективности. Короткое время пребывания, составляющее от 1 до 2 часов, ограничивает терапевтический эффект. Кроме того, высокие концентрации (40 мг/мл) и высокие дозы (до 2 грамм за инстилляцию) применяют в попытке достижения терапевтических уровней в тканях, с тем, чтобы попытаться преодолеть ограничения времени пребывания. Тем не менее, внутрипузырное введение высоких доз гемцитабина может привести к значительной системной абсорбции и вызывать токсическое воздействие на желудочно-кишечный тракт, мочевой пузырь и костный мозг, дополнительно ограничивая клиническое применение в дополнение к проблемам местной переносимости.
В литературе также сообщается, что внутривенное системное введение гемцитабина посредством болюсной инъекции, например, в течение 1-2 минут, лучше переносится пациентами, чем медленная внутривенная инфузия, например, в течение 90 минут. Это свидетельствуют о том, что длительное воздействие гемцитабина увеличивает токсическое воздействие и его следует избегать.
Соответственно, сохраняется потребность в улучшенных способах и системах доставки лекарственных средств для лечения рака мочевого пузыря. Например, сохраняется потребность во введении терапевтических уровней гемцитабина пациенту в течение длительных периодов времени, при этом избегая или минимизируя проблемы токсического воздействия и переносимости, которые были отмечены в качестве ограничения клинического применения гемцитабина.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте изобретения предлагается лекарственное средство, которое содержит гемцитабин для применения в лечении рака мочевого пузыря посредством местного введения гемцитабина в мочевой пузырь пациента с целью достижения устойчивой концентрации гемцитабина в моче в мочевом пузыре, достаточной для получения терапевтической концентрации гемцитабина в тканях мочевого пузыря, при этом местное введение в мочевой пузырь пациента равняется среднему количеству, составляющему от 1 мг/день до около 300 мг/день эквивалента свободного основания (FBE) гемцитабина. В одних вариантах реализации изобретения местное введение в мочевой пузырь пациента равняется среднему количеству, составляющему от 1 мг/день до 200 мг/день гемцитабина (FBE), от 5 мг/день до 100 мг/день гемцитабина (FBE), от 10 мг/день до 50 мг/день гемцитабина (FBE) или от 15 мг/день до 25 мг/день гемцитабина (FBE). В одном случае местное введение в мочевой пузырь пациента равняется среднему количеству, составляющему около 20 мг/день гемцитабина (FBE). Местное введение в мочевой пузырь пациента может быть непрерывным или с перерывами. В одних вариантах реализации изобретения непрерывное или прерывистое введение осуществляется в течение периода времени, составляющего от 1 дня до 30 дней, от 1 дня до 14 дней или от 1 дня до 7 дней.
В предпочтительном варианте реализации изобретения гемцитабин доставляется в мочевой пузырь из внутрипузырного устройства для доставки лекарственного средства, которое непрерывно высвобождает гемцитабин в мочу в мочевом пузыре в течение длительного периода времени. В другом варианте реализации изобретения гемцитабин доставляется в мочевой пузырь из покрывающего вещества, нанесенного на мочевой пузырь, при этом покрывающее вещество (например, мукоадгезивный препарат) высвобождает гемцитабин в мочу в мочевом пузыре в течение длительного периода времени. В еще одном варианте реализации изобретения жидкая форма гемцитабина закачивается в мочевой пузырь в течение длительного периода времени через уретральный или 5 надлобковый катетер, который введен в мочевой пузырь.
В другом аспекте изобретения предлагается устройство для доставки лекарственного средства для введения гемцитабина пациенту, нуждающемуся в лечении рака мочевого пузыря посредством внутрипузырного введения гемцитабина в мочевой пузырь пациента с целью достижения устойчивой концентрации гемцитабина в моче в мочевом пузыре, достаточной для получения терапевтически эффективной концентрации гемцитабина в тканях мочевого пузыря. В конкретном варианте реализации изобретения устройство для доставки лекарственного средства включает корпус, выполненный с возможностью внутрипузырного введения, а также лекарственную форму, содержащую гемцитабин, при этом корпус удерживает лекарственную форму и выполнен с возможностью высвобождения гемцитабина в мочевой пузырь в количестве, терапевтически эффективном для лечения мочевого пузыря, при этом устройство выполнено с возможностью высвобождения гемцитабина в мочевой пузырь в среднем количестве, составляющем от 1 мг/день до около 300 мг/день гемцитабина.
В предпочтительном варианте реализации изобретения корпус высвобождает гемцитабин без заданного выпускного отверстия. В конкретном варианте этого предпочтительного варианта реализации изобретения корпус высвобождает гемцитабин посредством диффузии через полимерную стенку, пропускающую лекарственное средство. Корпус, который содержит и контролируемо высвобождает гемцитабин, может упруго деформироваться между формой для удерживания, выполненной с возможностью удерживать устройство в мочевом пузыре пациента, и формой для введения для прохождения устройства через мочеиспускательный канал пациента.
В еще одном аспекте изобретения способы лечения рака мочевого пузыря представлены местным введением гемцитабина в мочевой пузырь пациента с целью достижения устойчивой концентрации гемцитабина в моче в мочевом пузыре, достаточной для получения терапевтической концентрации гемцитабина в тканях мочевого пузыря. В одних вариантах реализации изобретения местное введение в мочевой пузырь пациента равняется среднему количеству, составляющему от 1 35 мг/день до около 300 мг/день гемцитабина (FBE). В одном варианте реализации изобретения способ дополнительно включает введение по меньшей мере второго терапевтического средства пациенту. Второе терапевтическое средство может быть введено внутрипузырно. В другом варианте реализации изобретения способ дополнительно включает введение мочевины или другого изменяющего растворимость средства в мочевой пузырь в количестве, эффективном для повышения или изменения растворимости гемцитабина иным образом. В одних вариантах реализации изобретения второе терапевтическое средство и/или изменяющее растворимость средство высвобождается из внутрипузырного устройства, которое высвобождает гемцитабин.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1A-1B иллюстрируют один вариант реализации внутрипузырного устройства для доставки лекарственного средства, которое может применяться для введения гемцитабина, как описано в данном документе.
Фиг. 2A-2B иллюстрируют другой вариант реализации внутрипузырного устройства для доставки лекарственного средства, которое может применяться для введения гемцитабина, как описано в данном документе.
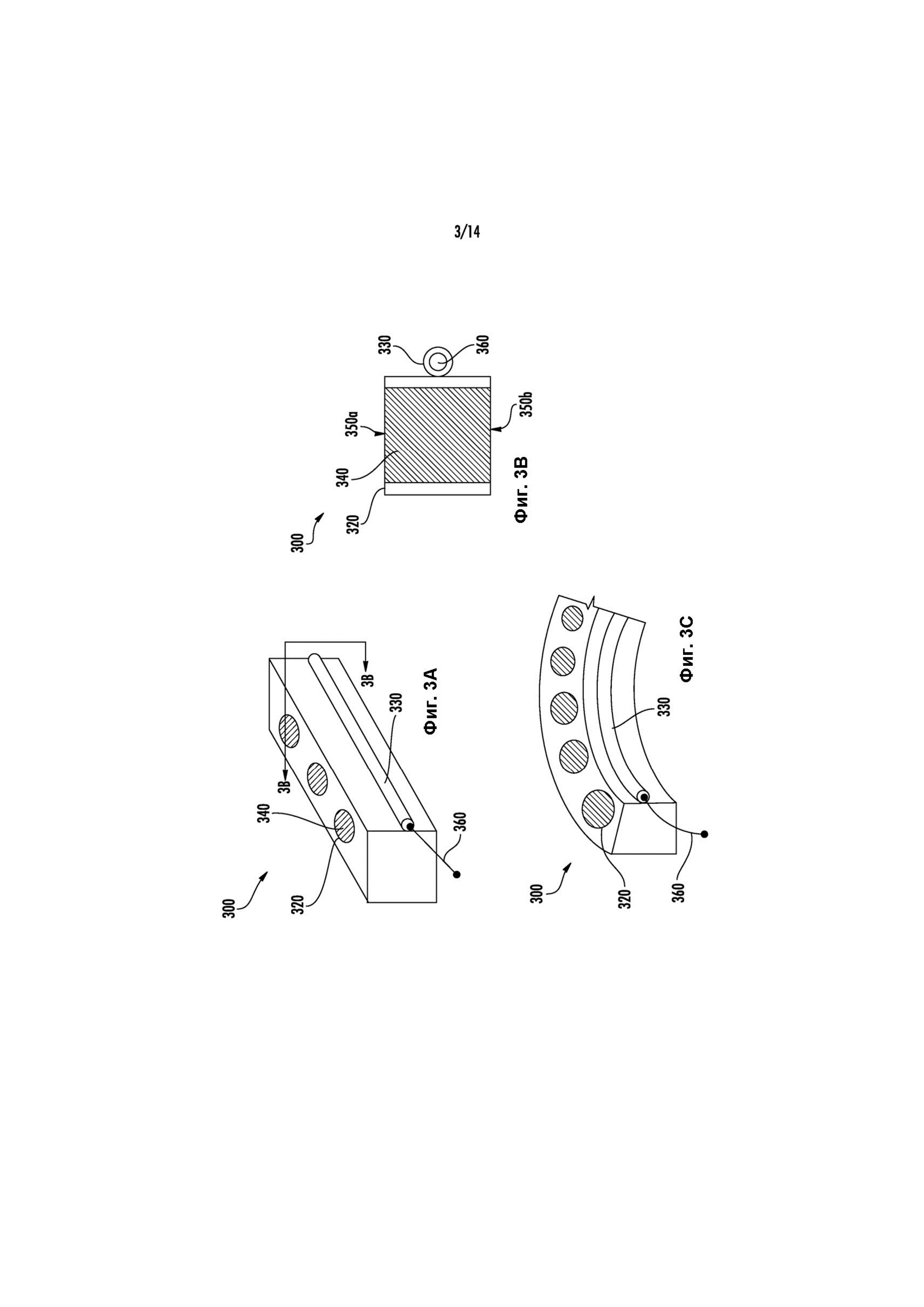
Фиг. 3A-3C иллюстрируют еще один вариант реализации внутрипузырного устройства для доставки лекарственного средства, которое может применяться для введения гемцитабина, как описано в данном документе.
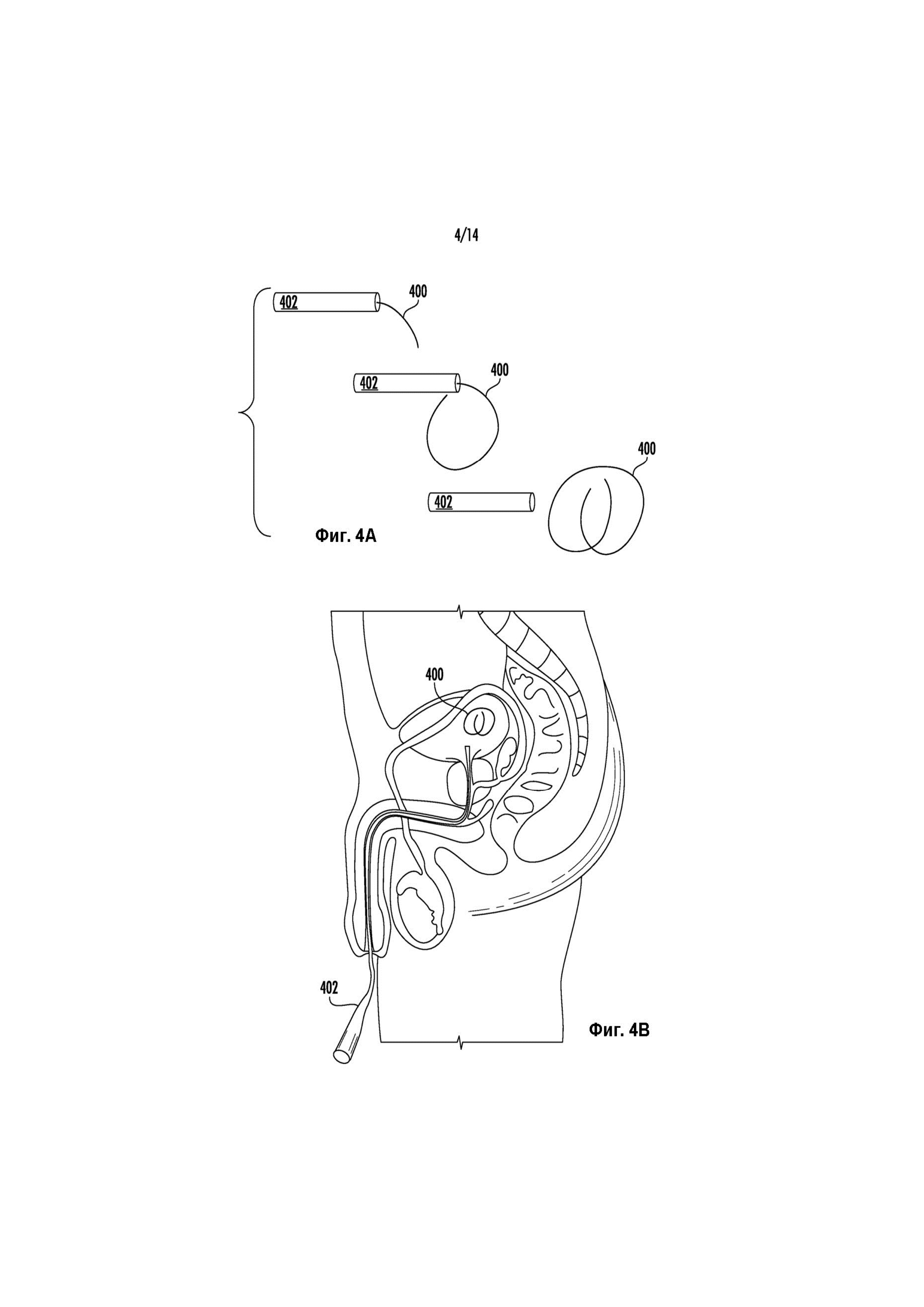
Фиг. 4A-4B иллюстрируют способ введения внутрипузырного устройства для доставки лекарственного средства в мочевой пузырь пациента для местного введения гемцитабина, как описано в данном документе.
Фиг. 5A иллюстрирует вещество, наносимое на внутреннюю поверхность стенки мочевого пузыря для местного введения гемцитабина, как описано в данном документе.
Фиг. 5B иллюстрирует способ нанесения покрывающего вещества на внутреннюю поверхность стенки мочевого пузыря для местного введения гемцитабина, как описано в данном документе.
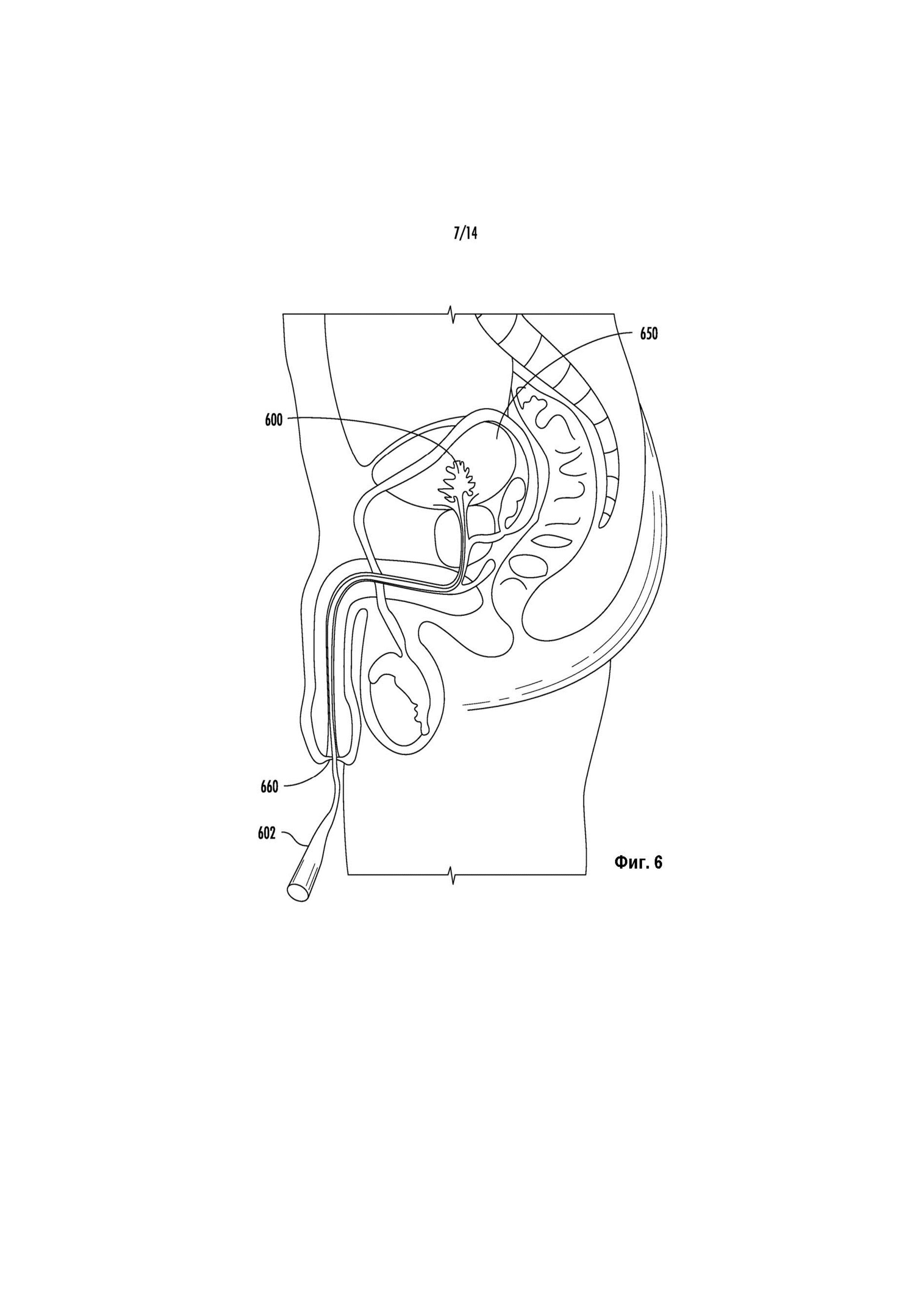
Фиг. 6 иллюстрирует способ введения жидкого лекарственного средства или лекарственного препарата в мочевой пузырь.
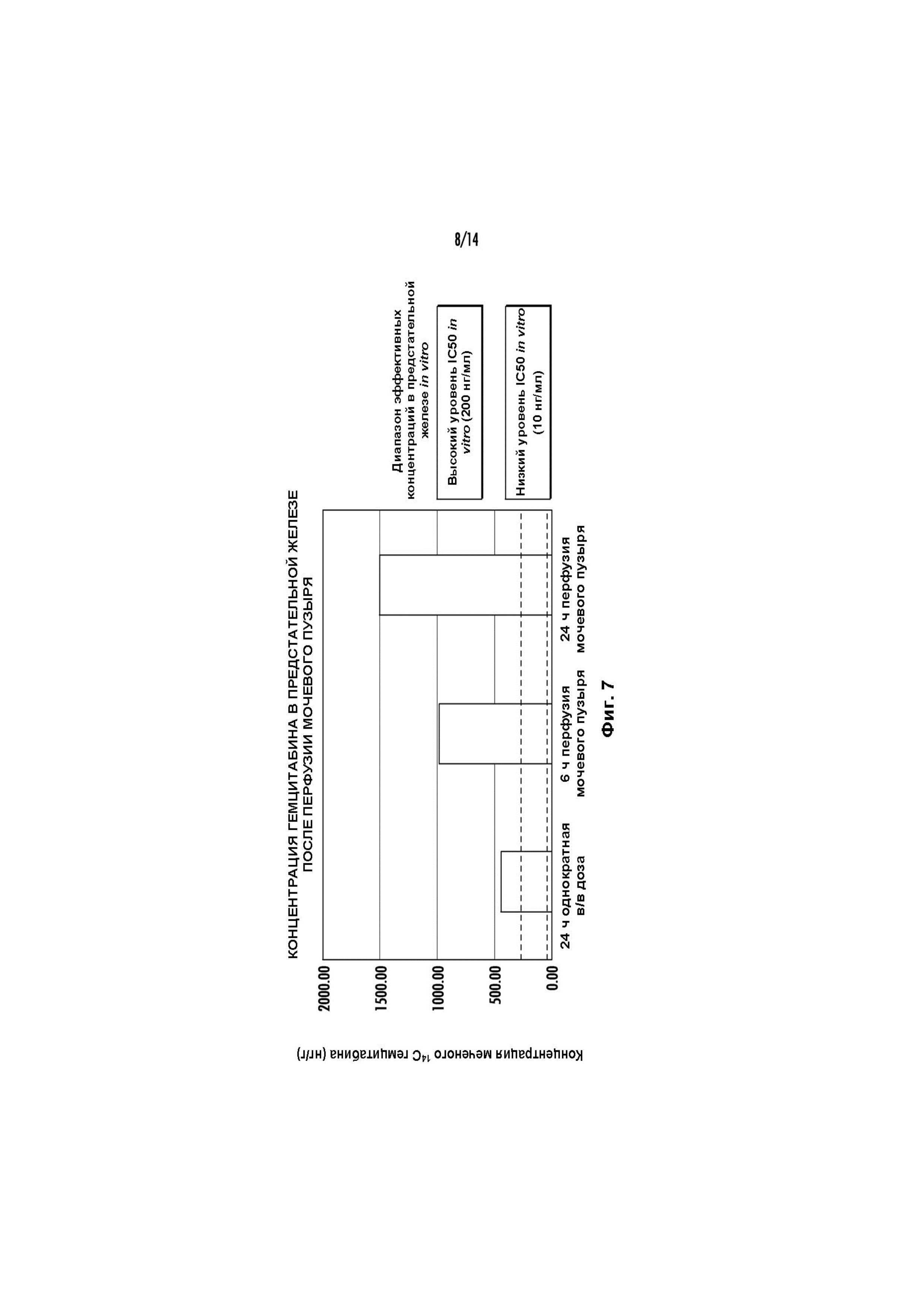
Фиг. 7 иллюстрирует концентрацию гемцитабина в предстательной железе после перфузии мочевого пузыря и внутривенного введения.
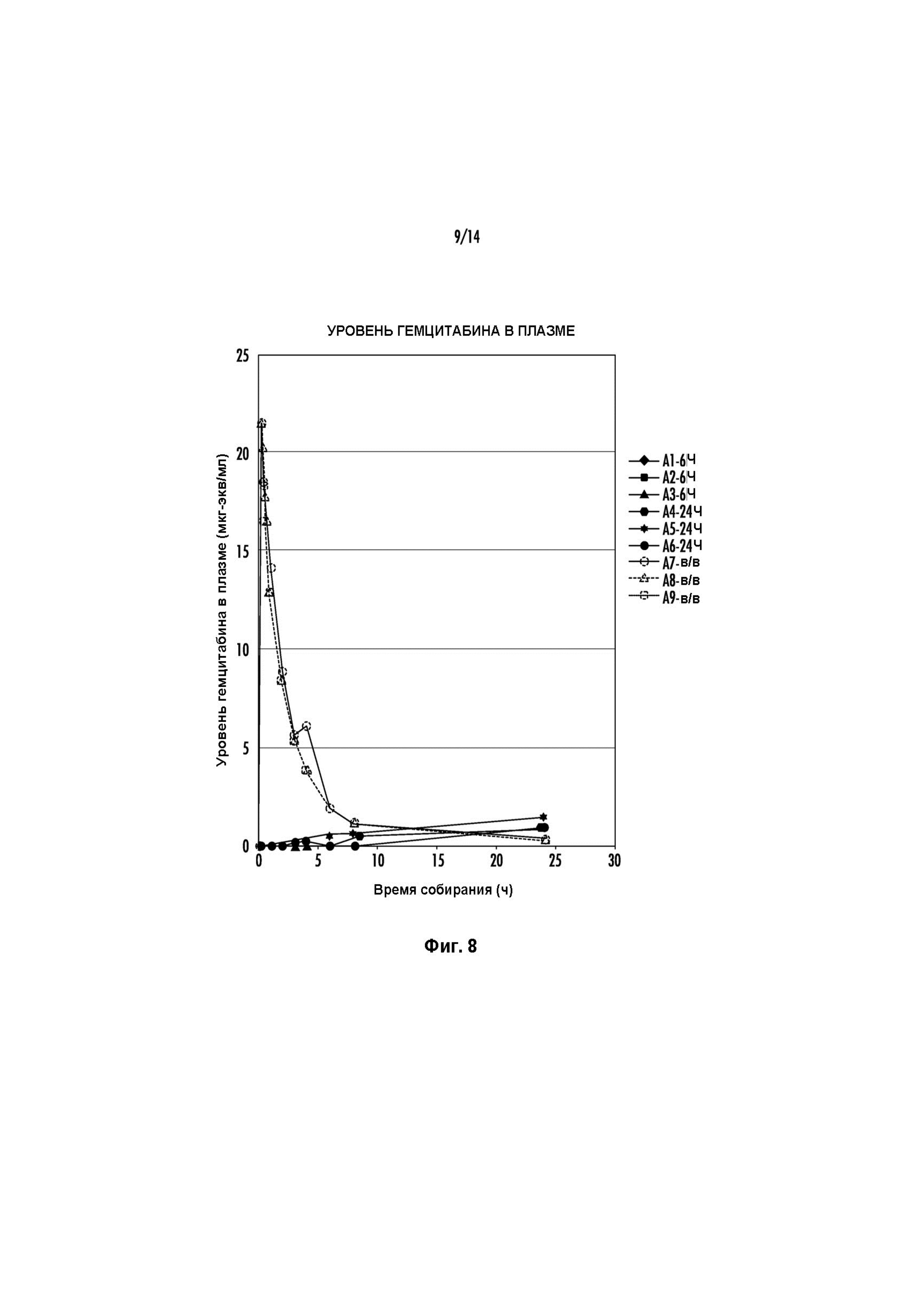
Фиг. 8 иллюстрирует уровни гемцитабина в плазме после перфузии мочевого пузыря и внутривенного введения.
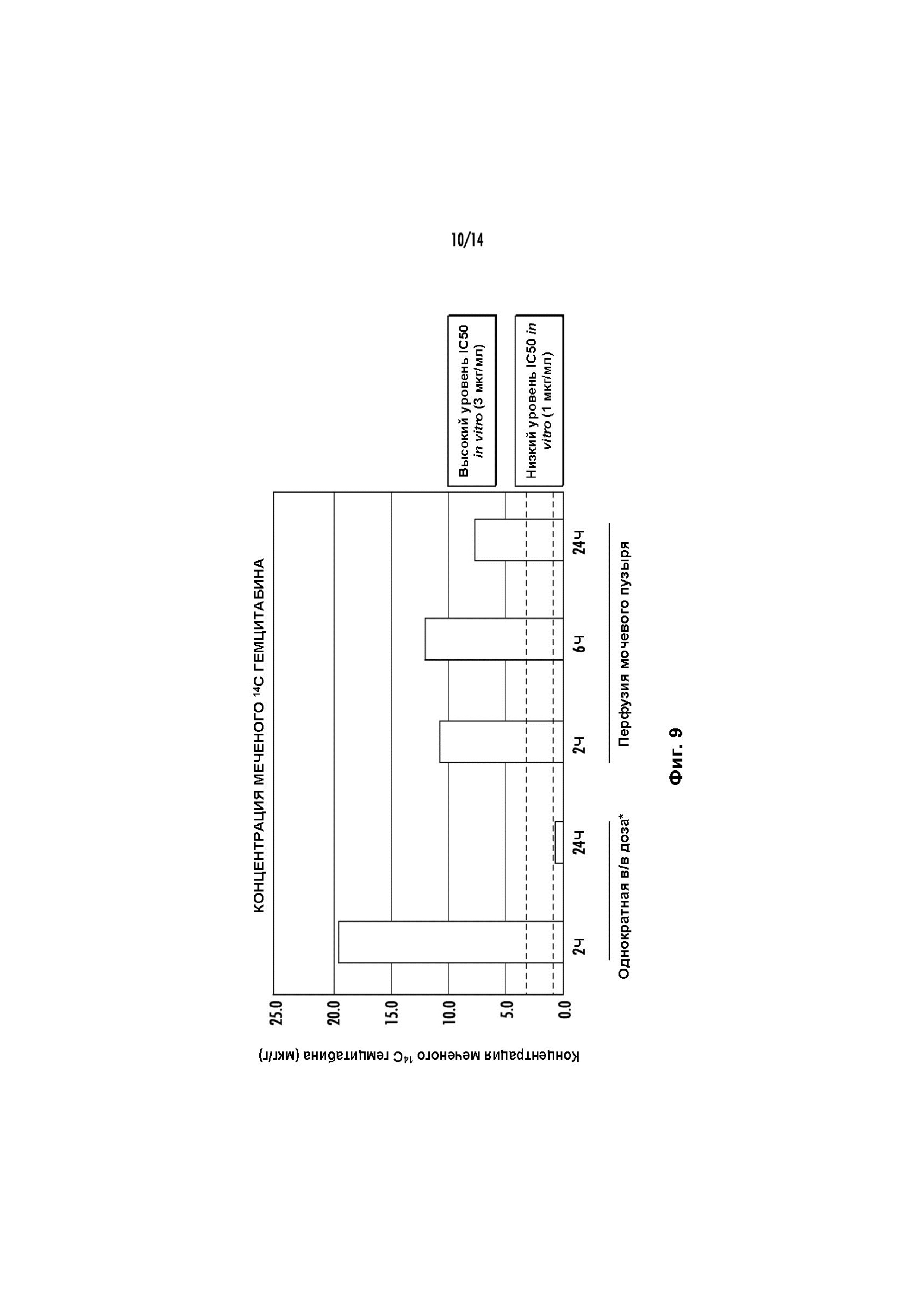
Фиг. 9 иллюстрирует концентрацию меченого 14C гемцитабина в мочевом пузыре после перфузии мочевого пузыря и внутривенного введения.
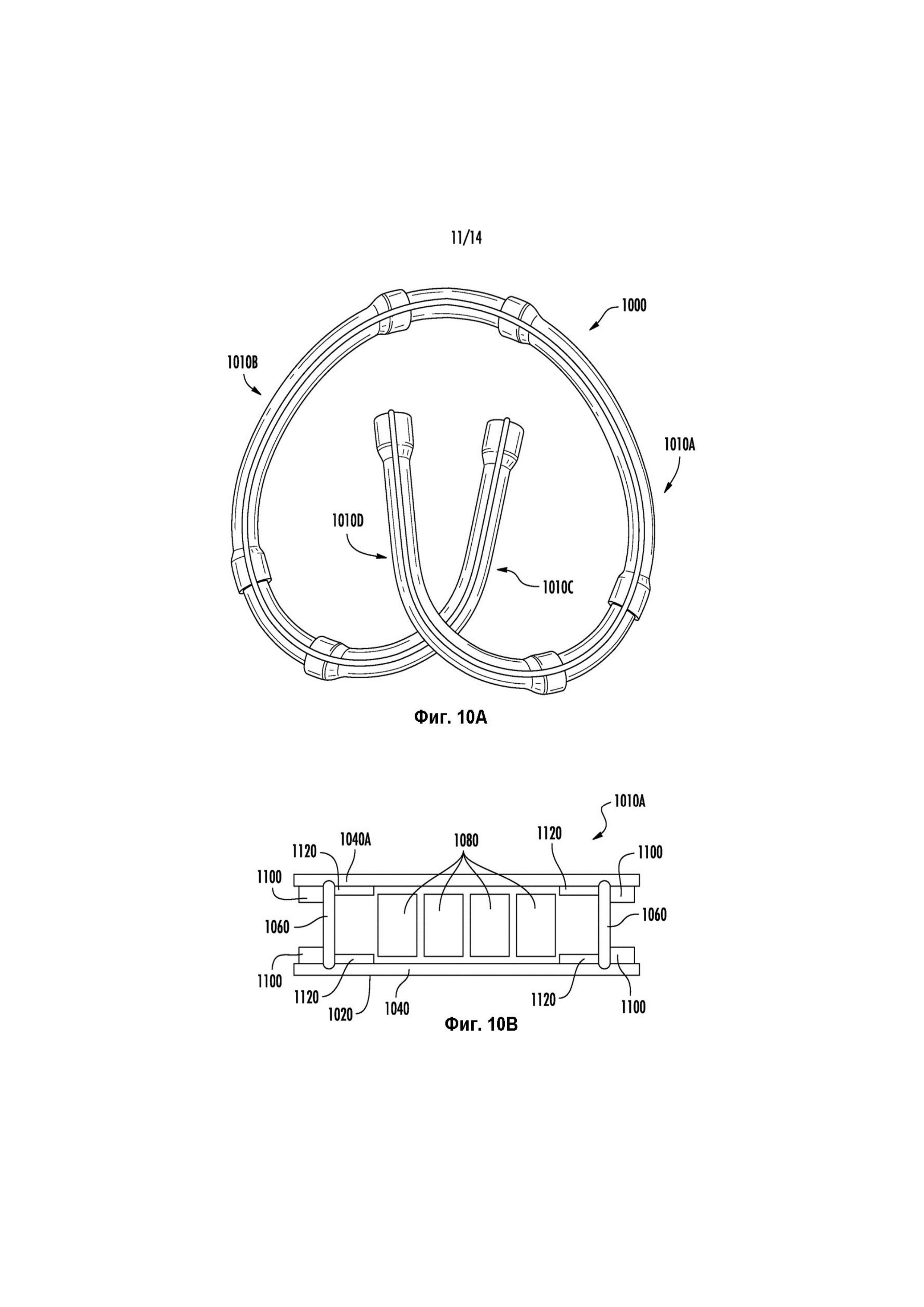
Фиг. 10A-C иллюстрируют один вариант реализации внутрипузырного устройства для доставки лекарственного средства для высвобождения гемцитабина через проницаемые диски. Фиг. 10A представляет собой вид данного устройства сверху. Фиг. 10B представляет собой вид в поперечном разрезе одного из четырех модулей резервуара с лекарственным средством устройства, показанного на Фиг. 10A, иллюстрирующий таблетированные лекарственные средства и проницаемые диски каждого модуля. Фиг. 10C представляет собой вид в перспективе части участка корпуса/остова устройства, показанного на Фиг. 10A, до компоновки с другими элементами устройства.
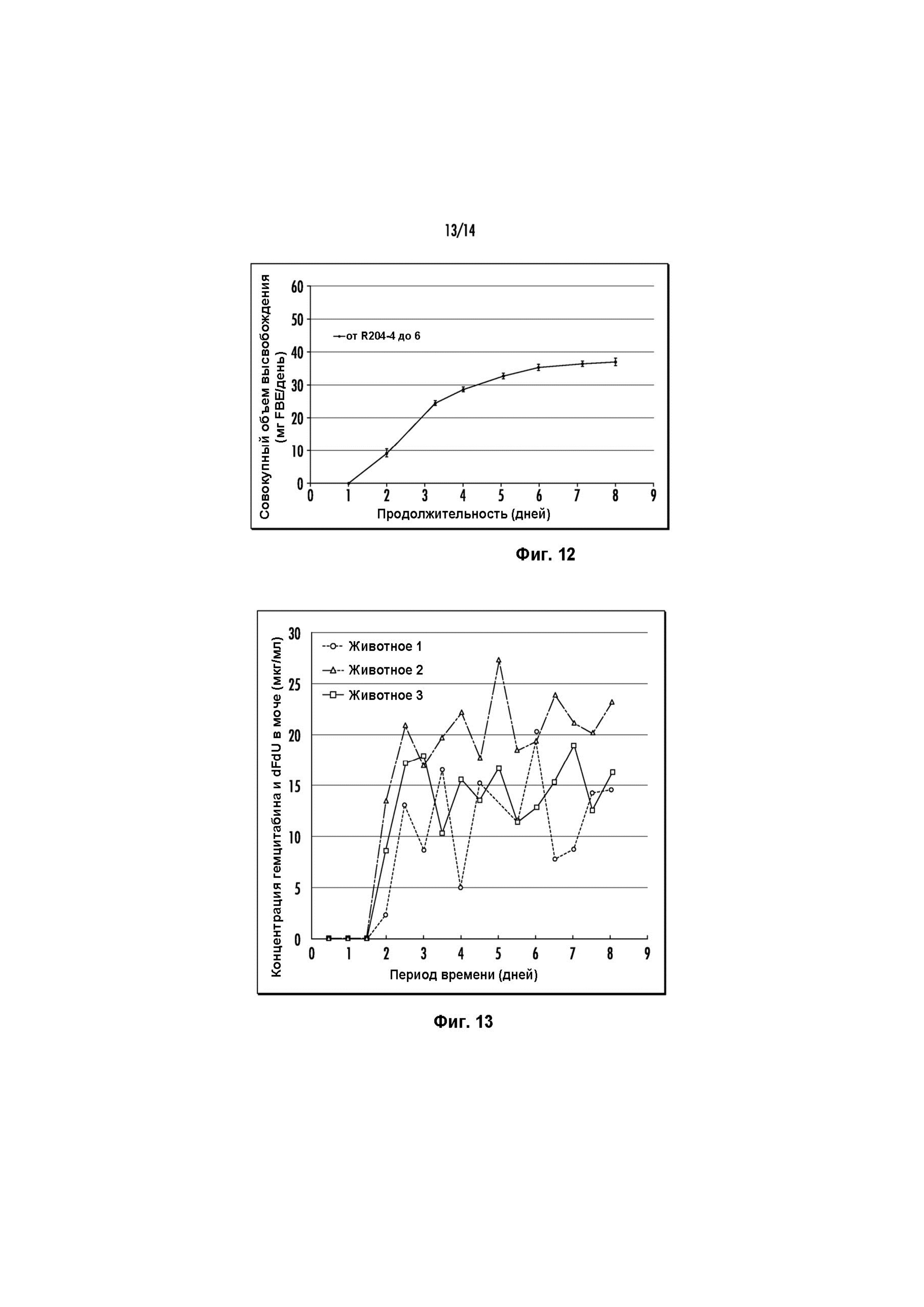
Фиг. 11-12 представляют собой графики, представляющие совокупные количества гемцитабина, высвобождаемого in vitro из устройств, показанных на Фиг. 10A-C.
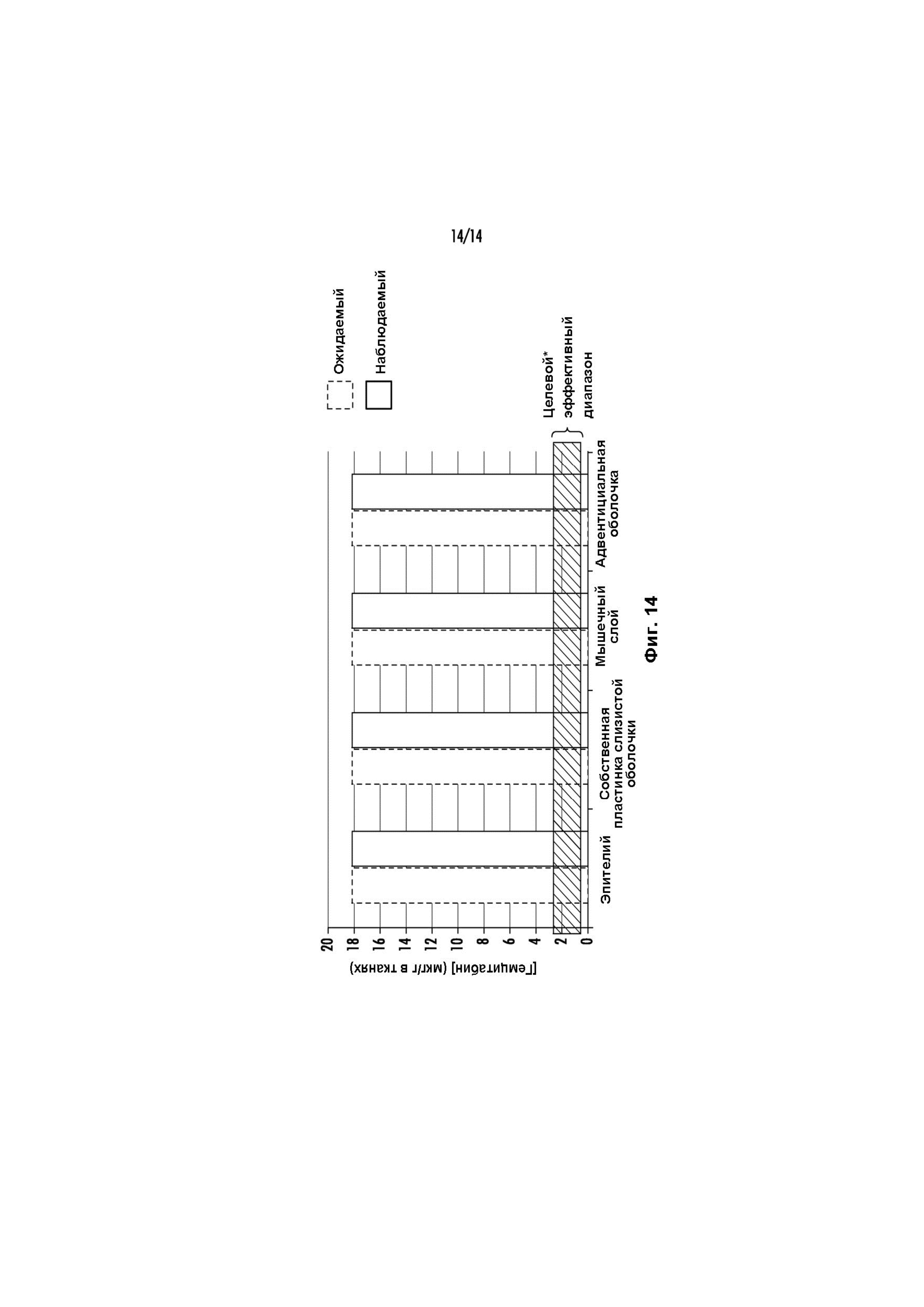
Фиг. 13-14 представляют собой графики, показывающие концентрации в моче гемцитабина, dFdU, а также их комбинации, соответственно, из исследования на животных.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что непрерывная доставка гемцитабина посредством внутрипузырного введения привела к неожиданному распределению лекарственного средства по стенке мочевого пузыря и к достижению показателей лекарственного средства, находящихся на уровне или выше прогнозируемого терапевтического порога во всех слоях мочевого пузыря - без значительного содержания вещества в плазме крови/всасывания в системный кровоток. Таким образом, композиции, системы и способы, описанные в данном документе, могут применяться для достижения терапевтически эффективных количеств гемцитабина в тканях мочевого пузыря, где это необходимо, и в то же время хорошо переноситься нормальной тканью мочевого пузыря и минимизировать всасывание в системный кровоток.
При использовании по тексту данного документа термин "гемцитабин" включает соединение гемцитабина, а также его фармацевтически приемлемые соли, сложные эфиры, амиды, сольваты и пролекарственные препараты. В частности, включает хлористоводородную соль гемцитабина. Гемцитабин может быть составлен с одним или более подходящими фармацевтически приемлемыми вспомогательными веществами.
В некоторых вариантах реализации изобретения регулируемое количество гемцитабина растворяют в моче в мочевом пузыре пациента в концентрации и в течение периода времени, достаточных для получения и поддержания терапевтических концентраций лекарственного средства в тканях мочевого пузыря. Тем не менее, так как мочевой пузырь ограничивает абсорбцию компонентов мочи в общий кровоток, всасывание лекарственного средства в системный кровоток выгодно минимизируется.
Для достижения требуемых концентраций гемцитабина в моче могут применяться различные способы. В одном варианте реализации изобретения лекарственное средство может предоставляться посредством непосредственной инстилляции однородного раствора в мочевой пузырь. Например, раствор лекарственного средства может закачиваться в мочевой пузырь через уретральный или надлобковый катетер непрерывным или пульсирующим образом в течение периода лечения. В другом варианте реализации изобретения лекарственное средство высвобождается из устройства или композиции, введенных в мочевой пузырь, при этом устройство или композиция высвобождает лекарственное средство (непрерывно или с перерывами) со скоростью, эффективной для получения желаемой концентрации лекарственного средства в моче в течение определенного периода лечения. Например, лекарственное средство может высвобождаться в мочевой пузырь из вводимого внутрипузырно устройства с последующей диффузией лекарственного средства в мочевой пузырь. В конце периода лечения устройство может быть извлечено из мочевого пузыря, или же оно может быть удалено из организма посредством всасывания, растворения, выведения из организма или их комбинации.
В предпочтительном варианте реализации изобретения гемцитабин вводят в мочевой пузырь из внутрипузырного устройства. Примеры внутрипузырных устройств для доставки лекарственных средств, которые могут быть адаптированы с целью достижения описанных в данном документе схем приема, и способы введения этих устройств в мочевой пузырь описаны в следующих публикациях заявок на патент США: US 2012/0203203 (Lee et al.); US 2012/0089122 (Lee et al.); US 2012/0089121 (Lee et al.); US 2011/0218488 (Boyko et al.); US 2011/0202036 (Boyko et al.); US 2011/0152839 (Cima et al.); US 2011/0060309 (Lee et al.); US 2010/0331770 (Lee et al.); US 2010/0330149 (Daniel et al.); US 2010/0003297 (Tobias et al.); US 2009/0149833 (Cima et al.); US 2007/0202151 (Lee et al.); WO 2014/144066 (Lee et al.); U.S. 2014/0276636 (Lee et al.); и WO 2015/026813 (Lee et al.).
В одних вариантах реализации изобретения, в которых гемцитабин доставляется из внутрипузырного устройства для доставки лекарственного средства, лекарственное средство может быть размещено в устройстве в различных формах, которые могут зависеть от конкретного механизма, с помощью которого устройство регулируемо высвобождает лекарственное средство в жидкость (например, мочу) в мочевом пузыре. В некоторых вариантах реализации изобретения лекарственное средство представлено в твердой, мягкой или другой нежидкой форме, которая преимущественно может облегчить стабильное хранение лекарственного средства перед применением устройства и преимущественно может обеспечивать возможность полезной нагрузки устройства лекарственным средством для хранения в меньшем объеме, чем было бы возможно, если бы препарат был размещен в виде жидкого раствора. В одном варианте реализации изобретения нежидкую лекарственную форму выбирают из таблеток, гранул, мягких лекарственных форм (например, мазь, крем, паста или гель), капсул и их комбинаций. В одном варианте реализации изобретения лекарственное средство находится в форме множества таблеток, таких как микротаблетки, описанные в патенте США № 8343516. В других вариантах реализации изобретения лекарственное средство может находиться в жидкой форме, например, в растворе с одним или более фармацевтически приемлемыми вспомогательными веществами.
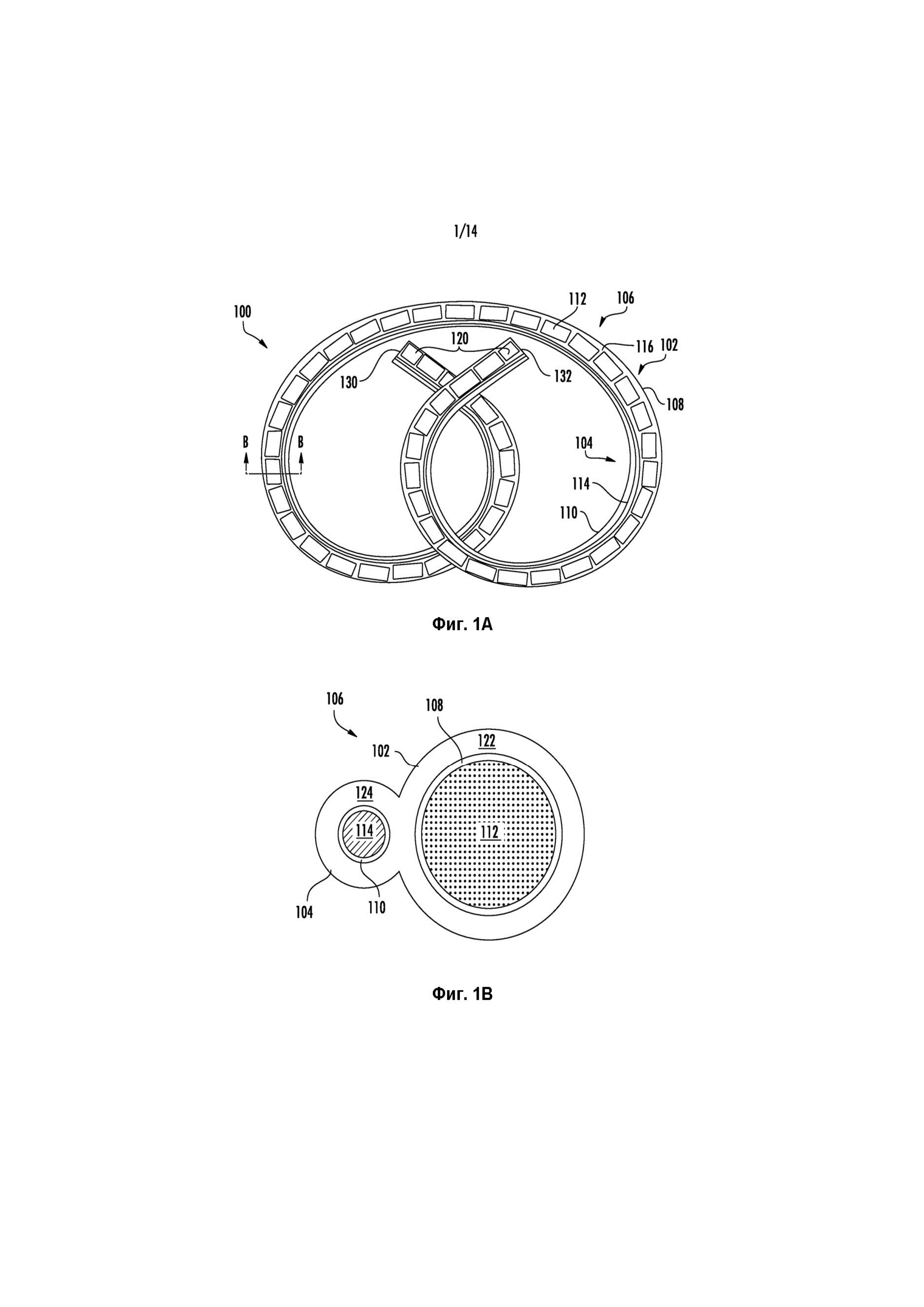
Вариант реализации устройства 100 для доставки лекарственного средства показан на Фиг. 1A. Устройство 100 включает корпус устройства, имеющий область резервуара с лекарственным средством 102 и область удерживающей рамки 104. На Фиг. 1 устройство 100 показано в относительно увеличенной в объеме форме, подходящей для удерживания в организме. После введения в корпус устройство 100 может принимать относительно увеличенную в объеме форму, чтобы удерживать устройство для доставки лекарственного средства в полости тела или просвете.
В контексте этого описания такие термины как "относительно увеличенная в объеме форма", "относительно высокопрофильная форма" или "форма для удерживания", как правило, означают любую форму, пригодную для удерживания устройства в предполагаемом месте имплантации, в том числе, без ограничения ей, форму кренделя, показанную на Фиг. 1, которая подходит для удерживания устройства в мочевом пузыре. Аналогичным образом, такие термины, как "относительно низкопрофильная форма" или "форма для введения", как правило, означают любую форму, пригодную для введения устройства для доставки лекарственного средства в организм, в том числе линейную или удлиненную форму, которая подходит для введения устройства через рабочий канал катетера, цистоскопа или другого инструмента для введения, расположенного в мочеиспускательном канале. В одних вариантах реализации изобретения устройство для доставки лекарственного средства может само собой принимать относительно увеличенную в объеме форму, а может деформироваться, либо вручную, либо с помощью внешнего устройства, в относительно низкопрофильную форму для введения в организм. После введения устройство может самостоятельно или само собой возвращаться к исходной, относительно увеличенной в объеме форме для удерживания в организме.
В показанном варианте реализации изобретения области 102, 104 резервуара с лекарственным средством и удерживающей рамки устройства 100 для доставки лекарственного препарата соосны и соединены друг с другом по всей своей длине, хотя возможны и другие конфигурации. Устройство 100 для доставки лекарственного средства включает упругий или гибкий корпус 106 устройства, который определяет просвет 108 резервуара с лекарственным средством (то есть корпуса с лекарственным средством) и просвет 110 удерживающей рамки. Просвет 108 резервуара с лекарственным средством выполнен с возможностью размещения лекарственного препарата, который содержит лекарственное средство. В показанном варианте реализации изобретения лекарственный препарат, содержащий гемцитабин, имеет форму ряда твердых единиц 112 лекарственного средства, которые могут представлять собой таблетки. Просвет 110 удерживающей рамки выполнен с возможностью размещения удерживающей рамки 114 с образованием области 104 удерживающей рамки. Изображенные просветы 108, 110 отделены друг от друга, хотя возможны и другие конфигурации.
Как показано на виде в поперечном разрезе Фиг. 1B, корпус 106 устройства включает трубку или стенку 122, которая определяет просвет 108 резервуара с лекарственным средством, и трубку или стенку 124, которая определяет просвет 110 удерживающей рамки. Трубки 122, 124 и просветы 108, 110 могут иметь, по сути, цилиндрическую форму, при этом просвет 108 резервуара с лекарственным средством имеет относительно больший диаметр, чем просвет 110 удерживающей рамки, хотя можно выбрать другие конфигурации, основываясь, например, на количестве подлежащего доставке лекарственного средства, диаметре удерживающей рамки, а также особенностях введения, таких как внутренний диаметр инструмента для введения. Стенка 124, которая определяет просвет 110 удерживающей рамки, может проходить по всей длине стенки 122, которая определяет просвет 108 резервуара с лекарственным средством, так что просвет 110 удерживающей рамки имеет ту же длину, что и просвет 108 резервуара с лекарственным средством, как показано на рисунке, хотя одна стенка может быть короче, чем другая стенка в других вариантах реализации изобретения. Две стенки 122, 124 соединены по всей длине устройства в показанном варианте реализации изобретения, хотя может применяться и крепление с промежутками.
Как показано на Фиг. 1A, в просвет 108 резервуара с лекарственным средством загружается ряд последовательно расположенных лекарственных единиц 112 (содержащих гемцитабин). По сути, может быть использовано любое число лекарственных единиц, например, в зависимости от размеров резервуара и лекарственных единиц. Просвет 108 резервуара с лекарственным средством включает первое торцевое отверстие 130 и второе торцевое отверстие 132 с противоположной стороны. После загрузки лекарственных единиц 112, в отверстия 130 и 132 помещают сдерживающие пробки 120. Сдерживающие пробки 120, в этом варианте реализации изобретения, представляют собой пробки цилиндрической формы, вставленные в отверстия 130, 132. В других вариантах реализации изобретения отверстия 130 и 132 закрываются другими структурами или материалами, которые могут, в зависимости от конкретных вариантов реализации изобретения, включать отверстие или пропускающую воду или лекарственное средство стенку, чтобы облегчить проникновение или выход воды или лекарственного средства во время применения.
В других вариантах реализации изобретения в просвет резервуара с лекарственным средством могут быть загружены формы гемцитабина, отличные от твердых единиц лекарственного средства. Например, гемцитабин может быть в таких формах как суспензии, растворы или эмульсии в масляных или водных носителях, и может содержать вспомогательные вещества, такие как суспендирующие, стабилизирующие вещества и/или диспергаторы. В альтернативном варианте реализации действующие вещества могут быть в форме порошка, полученного асептическим выделением стерильного твердого вещества или посредством лиофилизации из раствора, для смешивания с подходящим носителем, например, стерильной, апирогенной водой, перед применением.
В одном варианте реализации изобретения гемцитабин смешивают с одним или более вспомогательными веществами, которые включают загущающее средство для регуляции высвобождения солюбилизированного гемцитабина из выпускного отверстия в корпусе устройства. В другом варианте реализации изобретения резервуар устройства содержит как гемцитабин, так и загущающее средство, но они не скомбинированы, а наоборот расположены в отдельных областях внутри резервуара, например, в виде отдельных таблеток. В фармацевтической области известны подходящие загущающие средства, в том числе, без ограничения им, полиэтиленоксид (ПЭО). В некоторых версиях варианта реализации изобретения загущающее средство может предоставляться в виде композиции, например, с мочевиной или другим осмотическим средством.
В одном варианте реализации изобретения гемцитабин вводят пациенту с усилителем растворимости. В одном варианте реализации изобретения усилитель растворимости представляет собой мочевину. В одном варианте реализации изобретения мочевина предоставляется в таблетированной или другой твердой форме и вместе с гемцитабином загружается в резервуар с лекарственным средством внутрипузырного устройства для доставки лекарственного средства. Мочевина может также действовать, в зависимости от устройства, в качестве осмотического средства для облегчения генерации осмотического давления в резервуаре с лекарственным средством. В конкретном варианте реализации изобретения гемцитабин и осмотическое средство выполнены в виде отдельных таблеток (или других твердых форм), расположенных внутри разных областей резервуара с лекарственным средством, как описано в PCT WO 2015/026813 (Lee et al.), которая включена в данный документ посредством ссылки.
В просвет 110 удерживающей рамки загружается удерживающая рамка 114, которая может представлять собой упругую проволоку, например, из сверхупругого сплава, такого как нитинол. Удерживающая рамка 110 может быть выполнена с возможностью самостоятельно возвращаться к форме для удерживания, такой как форма "кренделя" на изображенном примере или другая свернутая форма, например, к формам, описанным в ранее включенной заявке. В частности, удерживающая рамка 114 может удерживать устройство 100 в организме, например, в мочевом пузыре. Например, удерживающая рамка 114 может иметь предел упругости и модуль упругости, что обеспечивает возможность ввода устройства 100 в организм в относительно низкопрофильной форме, позволяет устройству 100 возвращаться к относительно увеличенной в объеме форме после помещения внутрь организма и мешает устройству принимать относительно низкопрофильную форму в организме в ответ на ожидаемые силы, такие как гидродинамические силы, обусловленные сокращением мышцы-сжимателя и мочеиспусканием. Таким образом, устройство 100 может удерживаться в организме после имплантации, ограничивая или предотвращая случайное удаление.
Материал, применяемый для образования корпуса 106 устройства, по меньшей мере частично, может быть упругим или гибким для обеспечения перехода устройства 100 между формой для введения и формой для удерживания. Когда устройство находится в форме для удерживания, область 104 удерживающей рамки может, как правило, лежать внутри области 102 резервуара с лекарственным средством, как показано, хотя область 104 удерживающей рамки может быть расположена внутри, снаружи, сверху или снизу области 102 резервуара с лекарственным средством в других случаях.
Материал, применяемый для образования корпуса 106, может быть водопроницаемым, чтобы растворяющая жидкость (например, моча) могла поступать в область 102 резервуара с лекарственным средством для растворения лекарственных единиц 112 после имплантации устройства. Например, может применяться силикон или другой биологически совместимый эластомерный материал. В других вариантах реализации изобретения корпус устройства может быть выполнен, по меньшей мере частично, из водонепроницаемого материала.
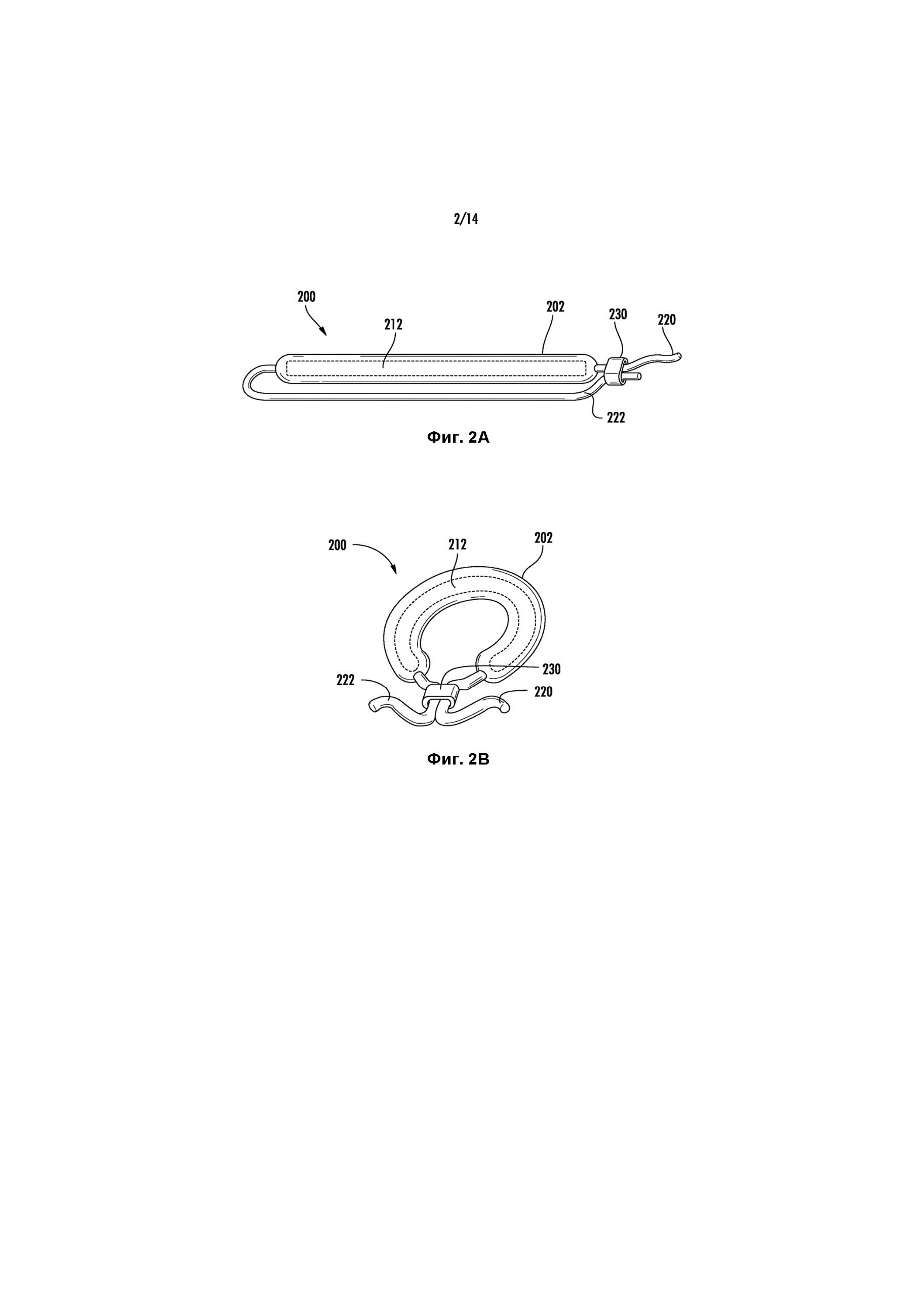
Фиг. 2A иллюстрирует другой вариант реализации внутрипузырного устройства 200 для доставки лекарственного средства, который включает резервуар 202 с лекарственным средством, заполненный лекарственным средством 212, и удерживающую структуру, которая включает две нити 220, 222, соединенные крепежным элементом 230. Как показано, резервуар 202 с лекарственным средством представляет собой удлиненную трубку, которая может деформироваться между относительно линейной формой для введения, такой как форма, показанная на Фиг. 2A, и относительно кольцевой формой для удерживания, такой как форма, показанная на Фиг. 2B. Лекарственное средство 212 может быть загружено в трубку в гибкой форме, таким образом, чтобы резервуар 202 с лекарственным средством мог осуществлять переход между двумя этими формами. Например, лекарственное средство 212 может представлять собой несколько твердых лекарственных форм в виде таблеток, жидкость или гель. Нити 220, 222 могут быть прикреплены к противоположным концам резервуара 202 с лекарственным средством и соединены с помощью крепежного элемента 230. Крепежный элемент 230 можно регулировать для регулировки положения одной нити 220 относительно другой 222, тем самым регулируя положение одного конца резервуара 202 с лекарственным средством относительно другого конца. Устройство 200 может принимать форму для удерживания за счет регулировки нитей 220, 222 для сближения концов резервуара 202 с лекарственным средством друг с другом, и после этого устройство 200 может оставаться в форме для удерживания за счет предотвращения регулировки нитей 220, 222 с помощью крепежного элемента 230. В таком варианте реализации изобретения устройство 200 вручную приводится в форму для удерживания посредством ручной регулировки нитей 220, 222 после того, как устройство 200 было введено в мочевой пузырь.
В показанном варианте реализации изобретения крепежный элемент 230 представляет собой стопорную гайку, которая позволяет уменьшить часть нитей 220, 222 между концами резервуара с лекарственным средством и стопорной гайкой, при этом предотвращает вытягивание этих частей нитей 220, 222. Таким образом, концы резервуара 202 с лекарственным средством можно сближать друг с другом, потянув одну или обе из нитей 220, 222 через стопорную гайку, заставляя устройство 200 принять форму для удерживания. После того, как нити 220, 222 были отрегулированы таким образом, стопорная гайка предотвращает вытягивание нитей 220, 222, сохраняя устройство в форме для удерживания. Таким образом, ручное приведение устройства 200 к форме для удерживания после имплантации требует только тянуть одну или обе из нитей 220, 222, хотя могут применяться и другие крепежные элементы 230, которые требуют отдельной манипуляции. Также могут применяться другие крепежные элементы.
Другой вариант реализации внутрипузырного устройства для доставки лекарственного средства показан на Фиг. 3A-3C. В этом варианте реализации изобретения устройство включает корпус 300, имеющий единую непрерывную структуру с множественными, отдельными просветами 320 резервуара с лекарственным средством и, необязательно, имеющий по меньшей мере один просвет 330 удерживающей рамки, в котором расположена удерживающая рамка 360. Каждый просвет 320 резервуара с лекарственным средством имеет два заданных отверстия, как показано на виде в поперечном разрезе на Фиг. 3B, и имеет такие размеры, чтобы удерживать по меньшей мере одну твердую единицу 340 лекарственного средства. Например, твердая единица 340 лекарственного средства может представлять собой таблетированное лекарственное средство или капсулу. В другом варианте реализации изобретения, который не показан, каждый просвет резервуара с лекарственным средством имеет одно заданное отверстие. Корпус может быть выполнен из гибкого полимера, такого как силикон. Фиг. 3B представляет собой вид в поперечном разрезе плоскости, которая делит один из просветов 320 резервуара с лекарственным средством корпуса, показанного на Фиг. 3A, вдоль линии 3B-3B. Как показано на Фиг. 3B, монолитный корпус 300 имеет два заданных отверстия (350a, 350b) в своем просвете 320 резервуара с лекарственным средством, которые открывают оба конца твердой лекарственной единицы 340 лекарственного средства. Просвет 330 удерживающей рамки, в этом варианте реализации изобретения, выровнен параллельно продольной оси корпуса и перпендикулярно просвету 320 резервуара с лекарственным средством. Фиг. 3C представляет собой вид в перспективе области варианта реализации устройства 300, показанного на Фиг. 3A, когда устройство находится в своей форме для удерживания, принимаемой, когда удерживающая рамка 360 расположена в просвете 330 удерживающей рамки. Просветы 320 резервуара с лекарственным средством и удерживающая рамка 360 в корпусе этого варианта реализации ориентированы таким образом, чтобы просветы 320 резервуара с лекарственным средством находились за пределами дуги удерживающей рамки 360. В альтернативном варианте реализации корпус на Фиг. 3C может поворачиваться на 180 градусов относительно удерживающей рамки 360 с получением конфигурации, в которой просветы 320 резервуара с лекарственным средством расположены в пределах дуги удерживающей рамки 360. С помощью этого варианта реализации изобретения устройства обеспечивают достаточный непосредственный контакт между твердыми единицами лекарственного средства и мочой, окружающей данное устройство после введения в мочевой пузырь и при удерживании в нем. В одних вариантах реализации изобретения высвобождение лекарственного средства из устройства регулируется эрозией открытой области поверхности твердой единицы лекарственного средства, так что скорость высвобождения лекарственного средства из устройства для доставки лекарственного средства может быть прямо пропорциональна общей открытой площади поверхности твердых единиц лекарственного средства и ограничена ей.
Высвобождение гемцитабина из внутрипузырного устройства, описанного в данном документе, может быть обусловлено и регулироваться различными механизмами действия. В различных вариантах реализации изобретения лекарственное средство может высвобождаться из внутрипузырного устройства для доставки лекарственного средства посредством диффузии через стенку корпуса с лекарственным средством, посредством диффузии через одно или более заданных отверстий в стенке корпуса с лекарственным средством, посредством осмотического давления через отверстие в корпусе с лекарственным средством, посредством осмотического давления через один или более временно образованных микроканалов, посредством эрозии лекарственного препарата при контакте с мочой в мочевом пузыре или посредством их комбинации. В предпочтительном варианте реализации изобретения высвобождение лекарственного средства регулируется посредством диффузии лекарственного средства через пропускающий лекарственное средство полимер или матричный элемент, определяющий область корпуса устройства. В одном варианте реализации изобретения устройство включает пропускающий лекарственное средство элемент.
В конкретном варианте реализации изобретения устройство для доставки лекарственного средства включает корпус, имеющий закрытый просвет резервуара с лекарственным средством, ограниченный первой стеновой конструкцией и гидрофильной второй стеновой конструкцией; и лекарственный препарат, содержащий гемцитабин, содержащийся в просвете резервуара с лекарственным средством, при этом первая стеновая конструкция является проницаемой или непроницаемой для воды и непроницаемой для лекарственного средства, а вторая стеновая конструкция является проницаемой для гемцитабина. Стенки, ограничивающие и определяющие резервуар с лекарственным средством устройства изготовлены из первого материала, который служит в качестве первой стеновой конструкции, и второго материала, который служит в качестве второй стеновой конструкции, так что высвобождение лекарственного препарата происходит, по сути, только через второй материал. В одном варианте реализации изобретения устройство не имеет отверстия; высвобождение лекарственного средства происходит только посредством диффузии через вторую стеновую конструкцию. При использовании по тексту данного документа термины "непроницаемый для лекарственного средства" и "водонепроницаемый" относятся к стеновой конструкции, по сути, непроницаемой для лекарственного средства или воды, так что, по сути, ни лекарственное средство, ни вода не высвобождаются через стеновую конструкцию в течение периода терапевтического высвобождения. Для применения в мочевом пузыре желательно, чтобы устройство было эластичным (то есть легко сгибалось, было мягким по ощущениям) во время сокращения мышцы-сжимателя, чтобы избежать или уменьшить дискомфорт и раздражение у пациента. Таким образом, твердость первого и второго материалов конструкции являются проектным решением, а процент материала высокой твердости может быть ограничен разработкой корпуса устройства заданного размера, соблюдая при этом надлежащую ему эластичность в мочевом пузыре. Например, термопластичный полиуретан TecophilicTM (Lubrizol Corp.) может иметь твердость по Шору, составляющую более 70А, например, от 80А до 65D, в то время как силиконовые трубки могут иметь твердость по Шору, составляющую от 50А до 70А. Соответственно, может быть предпочтительнее использовать сочетание этих двух разных полимерных материалов, а не делать устройство полностью из влагопоглощающего гидрофильного, пропускающего лекарственное средство второго материала.
В продолжение по этому конкретному варианту реализации, первая стеновая конструкция может быть выполнена из силикона. Например, корпус может включать силиконовую трубку, стенку из силиконовой трубки, выступающую в качестве первой стеновой конструкции. В других вариантах реализации изобретения первая стеновая конструкция может быть выполнена из других водопроницаемых материалов. Лекарственное средство предпочтительно находится в твердой форме (например, таблетка или множество таблеток), и первая стеновая конструкция является водопроницаемой, чтобы обеспечивать растворимость лекарственного средства in vivo во время пребывания в просвете резервуара с лекарственным средством. Например, первая стеновая конструкция может быть выполнена из силикона, имеющего значение твердости на дюрометре по Шору, составляющее от около 50А до около 70А. Вторая стеновая конструкция может представлять собой гидрофильный полимер, который предназначен для поглощения воды. Например, вторая стеновая конструкция может представлять собой гидрофильный эластомерный материал, который по меньшей мере частично выполнен из гидрофильного полиуретана, гидрофильных полиэфиров или гидрофильных полиамидов. В предпочтительном варианте реализации изобретения вторая стеновая конструкция содержит термопластичный полиуретан, такой как термопластичный полиуретан TecophilicTM, термопластичный полиуретан HydroThane™ (AdvanSource Biomaterials Corp.), термопластичный полиуретан Quadraphilic™ (Biomerics, LLC) (гидрофильные полиуретаны марки ALC на основе алифатических поликарбонатов и марки ALE на основе алифатических полиэфиров), HydroMed™ (AdvanSource Biomaterials Corp.) или Dryflex® (HEXPOL TPE). Другим гидрофильным полимером является полиэфирблокамид Pebax® MV 1074 SA 01 MED (Arkema), который представляет собой термопластичный эластомер, полученный из гибкого и гидрофильного простого полиэфира и жесткого полиамида. Например, гидрофильный материал второй стеновой конструкции может иметь твердость на дюрометре по Шору, составляющую от около 70А до около 65D. Можно выбирать конкретный материал и его толщину, а также площадь стенки, чтобы регулировать скорость проникновения воды и лекарственного средства и, таким образом, достигать определенного профиля высвобождения гемцитабина.
Конструкция первой и второй стеновых конструкций может принимать различные формы. В некоторых вариантах реализации изобретения первая стеновая конструкция представляет собой цилиндрическую трубку, а вторая стеновая конструкция представляет собой торцевую стенку, расположенную по меньшей мере на одном конце цилиндрической трубки, или первая стеновая конструкция и вторая стеновая конструкция прилегают друг к другу и вместе образуют цилиндрическую трубку. То есть, высвобождение лекарственного средства регулируется посредством диффузии через пропускающий лекарственное средство элемент, определяющий область закрытого корпуса устройства. Пропускающая лекарственное средство стеновая конструкция может быть расположена, иметь такие размеры и свойства материала, чтобы обеспечивать желаемую скорость контролируемой диффузии лекарственного средства из устройства. В одном варианте реализации изобретения, как описано ниже в Примере 4, первая стеновая конструкция представляет собой цилиндрическую трубку, а вторая стеновая конструкция представляет собой торцевую стенку, расположенную по меньшей мере на одном конце цилиндрической трубки.
Один из вариантов реализации введения внутрипузырного устройства 400 для последующего контролируемого высвобождения лекарственного средства в мочевой пузырь показан на Фиг. 4A и 4B. Здесь устройство 400 показано находящимся в форме для удерживания, так как устройство выходит из инструмента для введения 402. Инструмент 402 для введения может представлять собой любое подходящее устройство. Это может быть полостное устройство, такое как катетер, уретральный катетер или цистоскоп. Инструмент 402 для введения может представлять собой коммерчески доступное устройство или устройство, специально приспособленное для устройств для доставки лекарственных средств по настоящему изобретению. Фиг. 4B иллюстрирует введение устройства 400 в мочевой пузырь, при этом в качестве примера показано тело взрослого мужчины. Инструмент 402 для введения вводят через мочеиспускательный канал в мочевой пузырь, а устройство 400 может пропускаться из/через инструмент 402 для введения за счет зонда или потока смазывающего вещества, или их комбинации, до тех пор, пока устройство 400 не выйдет в мочевой пузырь и, как показано, не примет форму для удерживания.
Из описанных в приведенных ниже Примерах исследований было неожиданно обнаружено, что варианты реализации устройства с чрезвычайно малыми выпускными отверстиями, или каналами, являются более предпочтительными, и что варианты реализации устройства, которые высвобождают лекарственное средство без заданного отверстия, являются более предпочтительными. Это потому, что было обнаружено, что эти варианты реализации могут быть эффективными в исключении или по меньшей мере существенном уменьшении числа случаев повреждения уротелия, по сравнению с вариантами реализации устройства, использующими выпускные отверстия относительно большего размера. Не будучи связанными какой-либо теорией, полагают, что устройства с отверстиями большего размера способствуют образованию высоких локальных концентраций препаратов гемцитабина на поверхности ткани уротелия в области, прилегающей к выпускным отверстиям устройства, и что эти локальные области ткани могут быть в результате повреждены. В отличие от этого, такие высокие локальные концентрации 5 лекарственного средства с меньшей вероятностью встречаются в случае систем устройства, использующих механизмы высвобождения, не имеющие заданного отверстия или имеющие очень маленькие выпускные отверстия. Примеры таких подходящих систем высвобождения "без отверстий" описаны в публикации заявки РСТ №WO 2014/144066 (ТВ 130) и публикации заявки на патент США №102014/0276636 (ТВ 134), которые включены в данный документ посредством ссылки.
В некоторых вариантах реализации изобретения, в которых устройство содержит лекарственное средство в твердой форме, элюирование лекарственного средства из устройства происходит после растворения лекарственного средства в устройстве. Физиологическая жидкость поступает в устройство, вступает в контакт с лекарственным средством и растворяет данное лекарственное средство, и после этого растворенное лекарственное средство диффундирует из устройства или вытекает из устройства под воздействием осмотического давления или посредством диффузии. Например, лекарственное средство может растворяться при контакте с мочой в тех случаях, когда устройство имплантировано в мочевой пузырь.
В различных вариантах реализации изобретения внутрипузырное устройство может высвобождать лекарственное средство непрерывно или с перерывами для достижения концентрации лекарственного средства в мочевом пузыре, которая обеспечивает устойчивую, терапевтически эффективную концентрацию лекарственного средства в мочевом пузыре в течение периода времени, составляющего от 1 часа до 1 месяца, например, от 2 часов до 2 недель, от 6 часов до 1 недели, от 24 часов до 72 часов и т.д. В некоторых вариантах реализации изобретения внутрипузырное устройство может высвобождать гемцитабин в количестве, составляющем от 1 мг/день до 1000 мг/день, например, от 20 мг/день до 300 мг/день или от 25 мг/день до 300 мг/день. В некоторых вариантах реализации изобретения эти скорости высвобождения предоставляются в течение периода лечения, составляющего от 14 дней до 21 дня.
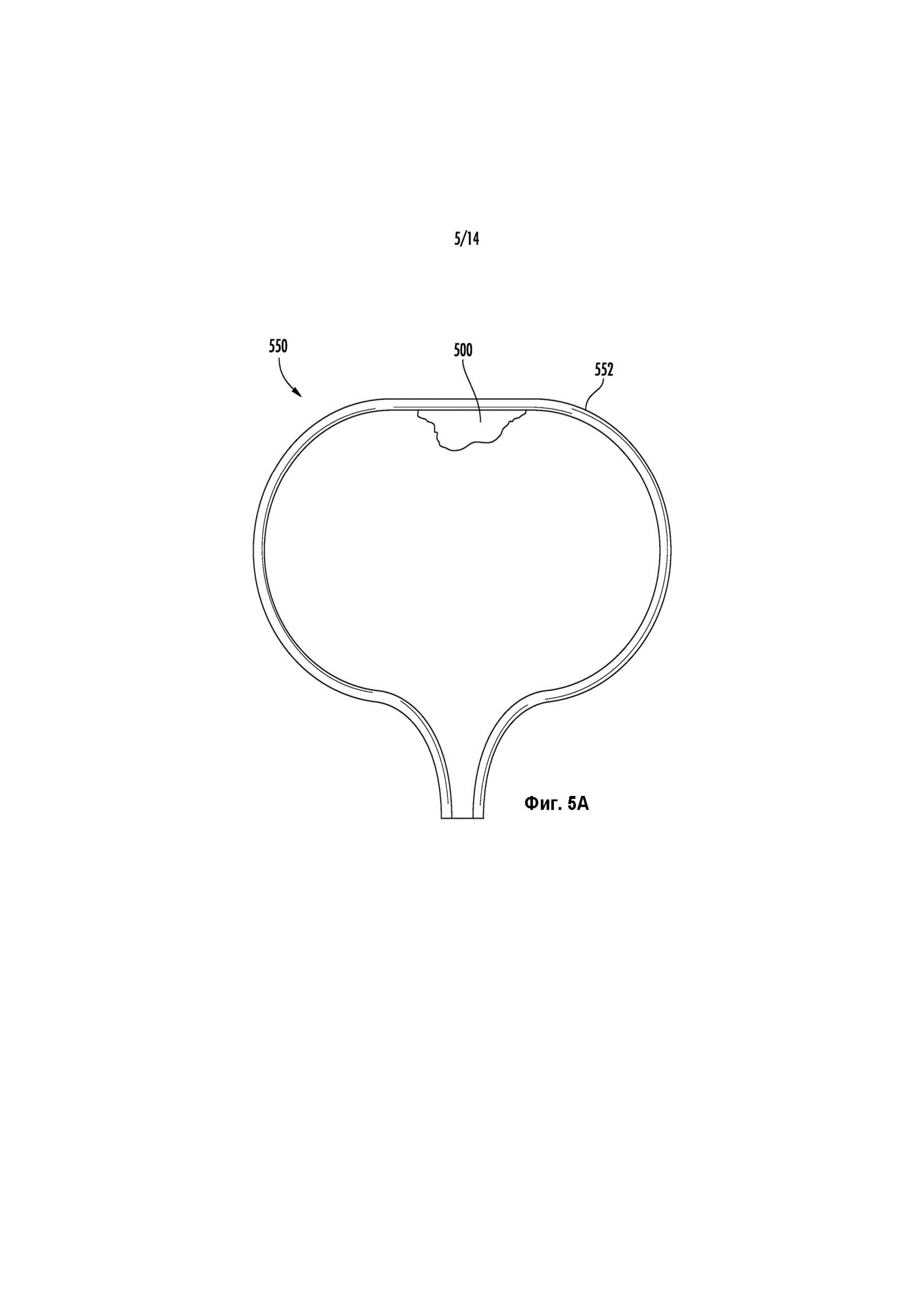
В другом варианте реализации изобретения покрывающее вещество может быть внутрипузырно нанесено на стенку мочевого пузыря (например, в область уротелия внутри мочевого пузыря), при этом покрывающее вещество включает гемцитабин или другое лекарственное средство и один или более вспомогательных материалов, которые способствуют прилипанию покрывающего вещества к стенке мочевого пузыря, а также обеспечивает непрерывное контролируемое высвобождение лекарственного средства в течение периода лечения. Покрывающее вещество может представлять собой мукоадгезивный препарат, такой как гели, мази, кремы, пасты, пленки, гели, гель-эмульсии, таблетки, полимеры или их комбинация. Мукоадгезивные полимеры для применения в фармации могут включать гидрогели или гидрофильные полимеры, поликарбофил (то есть карбополы и т.д.), хитозан, поливинилпирролидон (PVP), лектин, полиэтиленгликолированные полимеры, целлюлозы или их комбинацию. Подходящие целлюлозы включают метилцеллюлозу (МЦ), карбоксиметилцеллюлозу (КМЦ), гидроксипропилцеллюлозу (ГПЦ) или их комбинации. Покрывающее вещество может включать усилитель проницаемости. Неограничивающие примеры усилителей проницаемости включают диметилсульфоксид (ДМСО), натрий-карбоксиметилцеллюлозу (NaCMC), липиды, поверхностно-активные вещества или их комбинации. Как показано на Фиг. 5A, покрывающее вещество 500 может быть введено в мочевой пузырь 550 таким образом, чтобы покрывающее вещество 500 входило в зацепление со стенкой 552 мочевого пузыря.
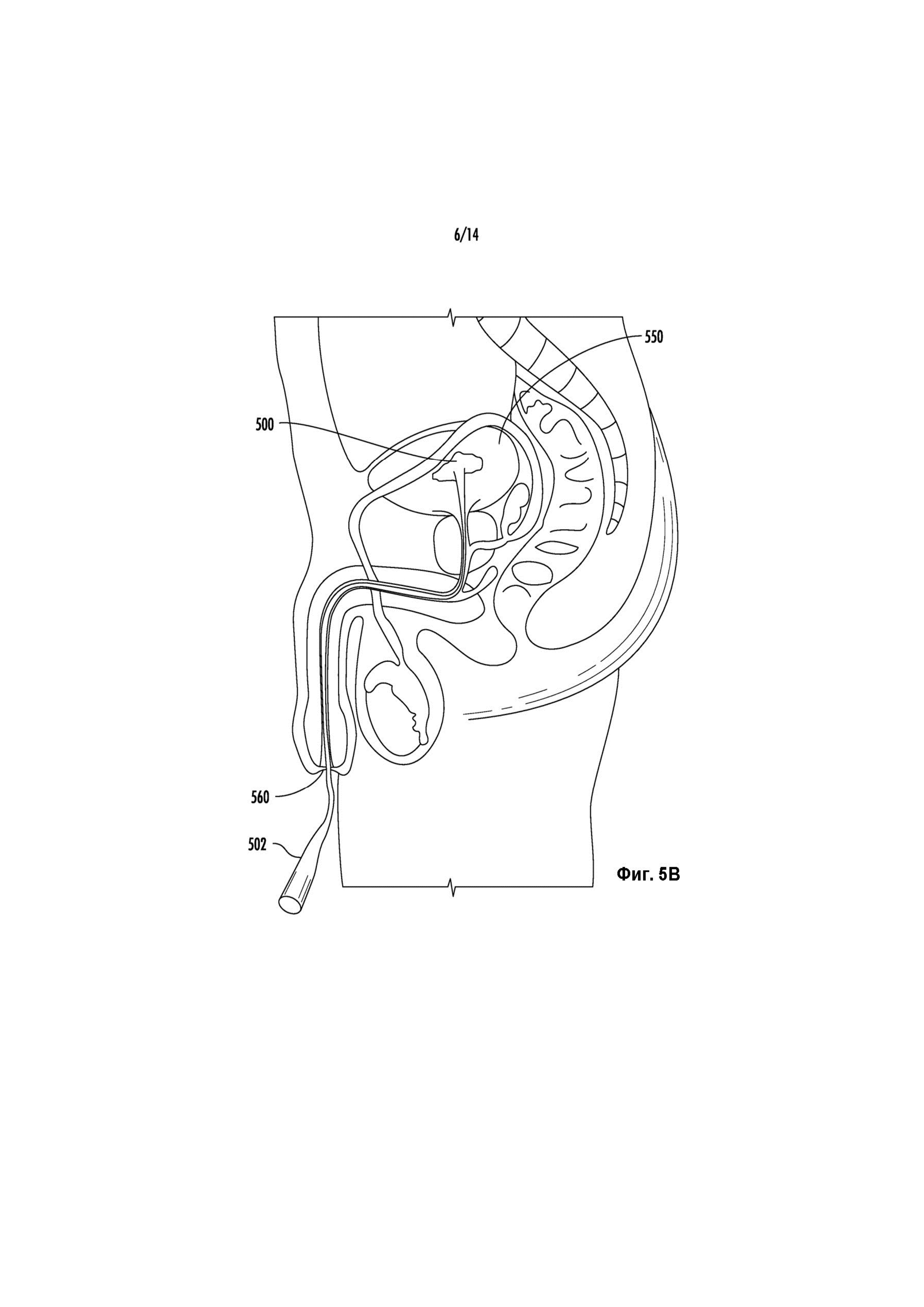
Покрывающее вещество может быть введено в мочевой пузырь с помощью инструмента для введения. Фиг. 5B представляет собой сагиттальный вид мужской мочеполовой системы, иллюстрирующий покрывающее вещество 500, введенное через инструмент 502 для введения в место имплантации. В качестве примера показано тело мужчины, а в качестве места имплантации показан мочевой пузырь 550. Покрывающее вещество 500 может представлять собой вариант реализации одного из покрывающих веществ, описанных в данном документе. Инструмент 502 для введения может представлять собой любое устройство, выполненное с возможностью управления естественными полостями организма для достижения предполагаемого места имплантации. Для введения в мочевой пузырь 550 инструмент 502 для введения имеет такой размер и форму, чтобы проходить через мочеиспускательный канал 560 пациента в мочевой пузырь 550, как показано. Инструмент 502 для введения может представлять собой известное устройство, такое как катетер или цистоскоп, или специально сконструированное устройство. Инструмент 502 для введения применяют для введения покрывающего вещества 500 в организм и затем удаляют из организма, в результате чего покрывающее вещество 500 полностью имплантируется в организм. После такой имплантации покрывающее вещество 500 может высвобождать лекарственное средство в организм в течение длительного периода времени. Аналогичную процедуру можно использовать для введения любого из устройств или лекарственных средств, описанных в данном документе, в другие части организма через другие естественные полости. Например, как показано на Фиг. 6, инструмент 602 для введения может применяться для введения жидкого лекарственного средства или лекарственного препарата 600 в мочевой пузырь 650 посредством пропускания инструмента 602 для введения через мочеиспускательный канал 660.
В одном варианте реализации изобретения пациенту вводят второе терапевтическое средство. Второе средство можно вводить одновременно, последовательно или совмещенно по отношению к введению гемцитабина. Второе терапевтическое средство может быть введено внутрипузырно. Способы и системы, описанные в данном документе, могут применяться для введения второго терапевтического средства внутрипузырно. Второе терапевтическое средство может включать цитотоксическое средство, болеутоляющее средство, противовоспалительное средство или их комбинацию. Второе средство может работать по механизму действия, отличному от гемцитабина, и/или может работать с гемцитабином синергетически. В одном варианте реализации изобретения второе терапевтическое средство предотвращает, лечит или уменьшает интенсивность цистита мочевого пузыря. В еще одном варианте реализации изобретения гемцитабин применяют в качестве первого химиоиммунотерапевтического средства (например, в течение первой недели после ТУР опухоли мочевого пузыря) с бациллами Кальметта-Герена (БЦЖ), впоследствии периодически вводимыми в течение последующего периода. См., например, Cho et al., J. Int'l Med. Res. 37:1823-30 (2009).
В различных вариантах реализации изобретения внутрипузырное введение гемцитабина пациенту может быть выполнено до ТУР опухоли мочевого пузыря, после ТУР опухоли мочевого пузыря, как до, так и после ТУР опухоли мочевого пузыря, или без ТУР опухоли мочевого пузыря.
В одном варианте реализации изобретения гемцитабин применяют внутрипузырно в лечении немышечно-инвазивного рака мочевого пузыря (НМИРМП). В другом варианте реализации изобретения гемцитабин применяют внутрипузырно при НМИРМП, трудноподдающемся лечению с помощью БЦЖ. В еще одном варианте реализации изобретения его применяют в повторных дозах в рамках периода индукционной терапии с последующими сериями поддерживающих доз, например, неделя лечения раз в месяц в течение трех месяцев, а затем неделя поддерживающих доз один раз в каждые три месяца при необходимости.
Термины "пациент" или "субъект", при использовании по тексту данного документа, относятся к людям или другим млекопитающим, например, в области ветеринарии, животноводства и клинических исследований. В конкретном варианте реализации изобретения пациентом или субъектом является взрослый человек. В других вариантах реализации изобретения пациент или субъект включает коров, собак, кошек, коз, овец и свиней.
Настоящее изобретение может быть лучше понято со ссылкой на следующие неограничивающие примеры.
Пример 1: Накопление предстательной железой гемцитабина из мочевого пузыря
Исследование выполняли на самцах крыс линии Спрег-Доули посредством введения с помощью вводимой внутрь мочевого пузыря канюли меченого 14C гемцитабина в течение 6- или 24-часовой непрерывной перфузии, или посредством однократного в/в болюсного введения. 6- и 24-часовые непрерывные перфузии перфузировали 6,9 и 26,6 мг, соответственно, гемцитабина в мочевой пузырь. Однократное в/в болюсное введение включало 5,0 мг гемцитабина.
Образцы крови (Фиг. 8), мочи и ткани (например, мочевого пузыря, предстательной железы) (Фиг. 7 и 9) собирали и анализировали на предмет содержания гемцитабина. Результаты показаны на Фиг. 7-9. Как показывают результаты, было обнаружено, что устойчивые концентрации гемцитабина в моче приводят к значительным уровням гемцитабина в ткани мочевого пузыря, которые находятся на уровне терапевтических концентраций или превышают их, основываясь на экспериментах с клетками рака мочевого пузыря in vitro. Уровни гемцитабина в мочевом пузыре показаны на Фиг. 9, которая также изображает значительно более низкую концентрацию гемцитабина в мочевом пузыре через 24 часа после в/в введения клинически значимой дозы. Уровни гемцитабина, наблюдаемые для каждой из таких тканей мочевого пузыря, как эпителий, собственная пластинка слизистой оболочки, мышечный слой и адвентициальная оболочка, показаны на Фиг. 14, которая также иллюстрирует целевой эффективный диапазон для концентрации гемцитабина в тканях.
Пример 2: Исследование гемцитабина на крупных смешанных породах собак
Проводили скрининг двух систем высвобождения гемцитабина (устройств, показанных на Фиг. 1A-1B), выполненных с возможностью высвобождения терапевтических уровней (4 мг/день и 40 мг/день) в мочу. Для высвобождения гемцитабина в устройствах использовались либо полученные лазерной прошивкой отверстия, либо полученные штамповкой отверстия. Испытуемые системы сравнивали с внутрипузырными инстилляциями, которые были разработаны с возможностью имитации стандартных внутрипузырных доз, применяемых в клинической практике. Испытуемые животные представляли собой крупные смешанные породы собак, где N=3 для каждой группы.
Каждая система in vitro обладала различными скоростями высвобождения гемцитабина. In vivo, одна система приводила к очень низким концентрациям в моче и тканях, но хорошо переносилась испытуемым животным. Другая система обеспечивала целевые уровни концентрации в моче, но плохо переносилась испытуемым животным. Профили мочи также отличались, а продолжительность высвобождения лекарственного средства была неприемлемо короткой. Также было отмечено, что внутрипузырное введение приводило к значительным повреждениям уротелия в соответствии с симптомами, описанными в литературе.
В целом, это исследование показало, что конструкция устройства/таблетированного препарата влияет как на концентрации гемцитабина в моче через некоторое время, так и на переносимость мочевым пузырем.
Пример 3: Исследование перфузии мочевого пузыря гемцитабином у мини-свиней
Свиньям перфузировали различные концентрации гемцитабина в течение 7 дней, N=5 (2 самца и 3 самки в каждой группе лечения). Перфузионным животным препарат вводили дозами в концентрациях, выбранных для охвата целевых доз для лечения рака мочевого пузыря у людей. Для сравнения, отдельной группе животных вводили высвобождающее гемцитабин устройство (как показано на Фиг. 1A-1B) с большим диаметром торцевых заглушек (сдерживающие пробки с проходящим через них большим отверстием для высвобождения лекарственного средства) со средней скоростью высвобождения in vitro. Все перфузионные группы хорошо переносили гемцитабин, в том числе самую высокую перфузионную дозу. В противоположность этому, высвобождающие гемцитабин устройства обеспечивали средние концентрации в моче, но плохо переносились.
Пример 4: Модульное устройство, высвобождающее гемцитабин с помощью проницаемой системы
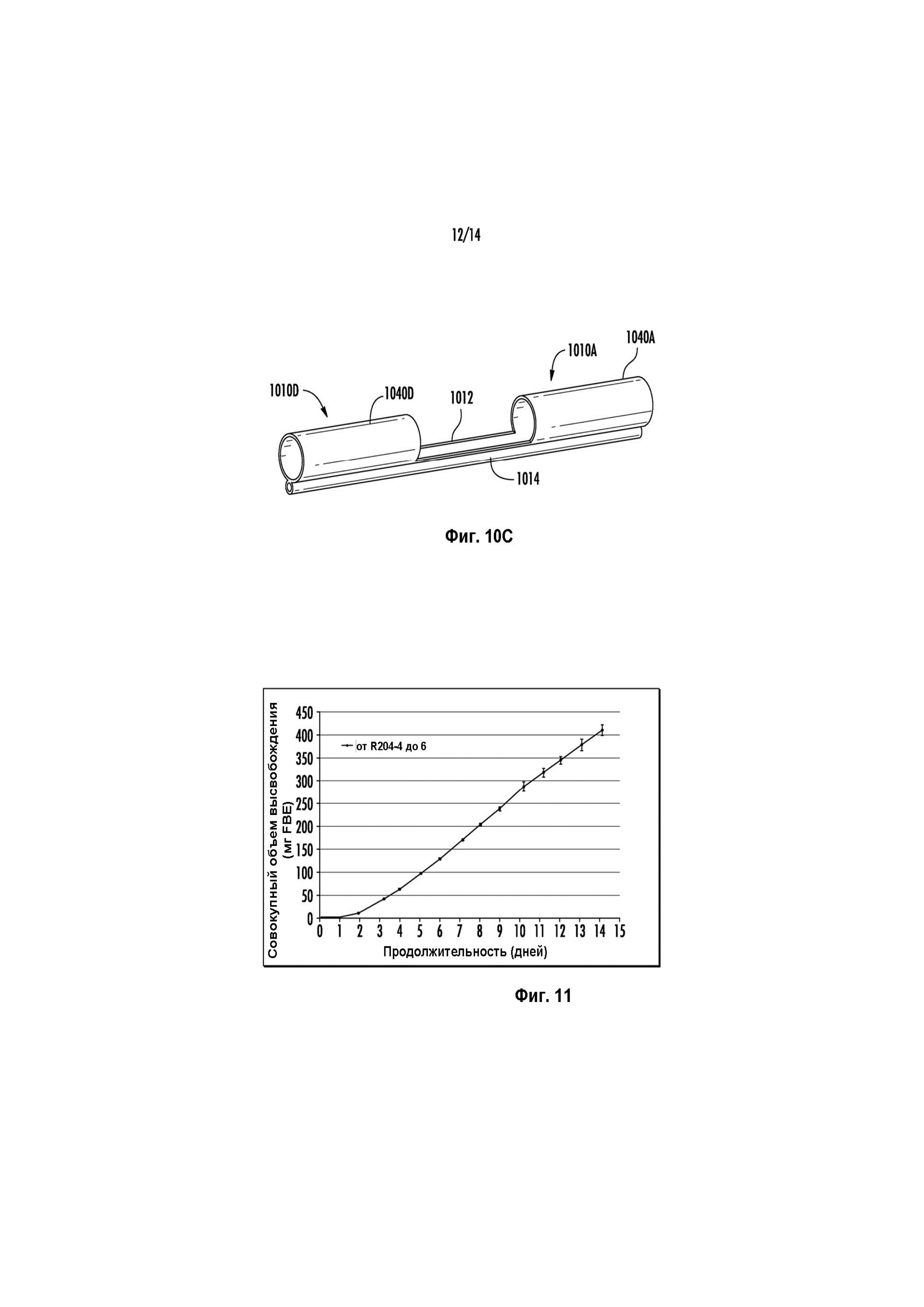
Гемцитабин HCl испытывали в четырехмодульном устройстве 1000, которое показано на Фиг. 10A-C. Фиг. 10A показывает, что устройство 1000 включает четыре модуля 1010A, 1010B, 1010C и 1010D резервуаров с лекарственным средством. Для ясности, Фиг. 10C показывает только часть корпуса устройства (другие элементы опущены) и только для модулей 1010A и 1010D резервуаров с лекарственным средством. Фиг. 10C иллюстрирует, как боковые стенки 1040A и 1040D резервуара модулей 1010A и 1010D резервуаров с лекарственным средством, соответственно, как единое целое соединены стеновым сегментом 1012 и просветом 1014 удерживающей рамки. Боковые стенки 1040A и 1040D, а также стеновой сегмент 1012 и просвет 1014 удерживающей рамки получали, вырезая сегмент из двухпросветной силиконовой трубки. (Четырехмодульное устройство получали, вырезая три разнесенных сегмента из двухпросветной силиконовой трубки.) Каждый модуль резервуара с лекарственным средством состоял из силиконовой трубки, изготовленной из MED-4750 (Nusil), с размером 2,64 мм по внутреннему диаметру и толщиной стенки, составляющей 0,20 мм. Силиконовая трубка включала просвет удерживающей рамки, имеющий 0,51 мм по внутреннему диаметру и толщину стенки, составляющую 0,20 мм. Удерживающую рамку из нитинола вставляли в просвет 1014 удерживающей рамки. Фиг. 10B иллюстрирует структуру модуля 1010A резервуара с лекарственным средством, в том числе диски 1060, через которые солюбилизированное лекарственное средство высвобождалось посредством диффузии. (Остальные три модуля резервуаров с лекарственным средством по конструкции были идентичны с модулем 1010A.) Диск 1060 закрепляют в просвете боковых стенок 1040A цилиндрической трубки посредством размещения диска 1060 между наружной шайбой 1100 и внутренней шайбой 1120. Каждый диск 1060 был изготовлен из HP-93A-100 (термопластичных полиуретанов Tecophilic®), а размеры каждого диска 1060 составляли примерно 0,5 мм по толщине и 3,0 мм по внешнему диаметру. Внешний диаметр (3,0 мм) диска был больше, чем внутренний диаметр (2,64 мм) силиконовой трубки, и поэтому диск плотно сидел в силиконовой трубке. Внутренние и наружные силиконовые шайбы 1120, 1100 были изготовлены из MED-4780 (Nusil) и размещены рядом с дисками 1060 с помощью силиконового клея, нанесенного вокруг шайб 1120, 1100 для фиксации шайб в силиконовой трубке 1040A. Силиконовая наружная шайба 1100 имела параметры внутреннего диаметра, внешнего диаметра и длины, составляющие примерно 2,5 мм, 3,2 мм и 2 мм, соответственно, а силиконовая внутренняя шайба 1120 имела параметры внутреннего диаметра, внешнего диаметра и длины, составляющие примерно 1,58 мм, 2,77 мм и 2 мм, соответственно.
Несколько таблетированных лекарственных средств 1080, составляющих 2,6 мм по внешнему диаметру, загружали в силиконовую трубку 1040A перед тем, как заглушить оба конца резервуара диском 1060, а также внутренней и наружной шайбами 1120 и 1100. Состав таблетированного препарата включал 90 % гемцитабина HCl, 5 % PVP, 2,5 % Neusilin и 2,5 % стеарата магния. Общая масса таблеток, загруженных в каждое четырехмодульное устройство составляла примерно 800 мг.
Испытание высвобождения in vitro выполняли с тремя единицами (R204-4 до 6) при 37°С. Среда высвобождения представляла собой деионизированную воду, и образцы собирали в контрольный момент времени. Высвобождение гемцитабина регулировалось посредством диффузии через диски Tecophilic. Совокупный объем и скорость высвобождения в эквиваленте свободного основания (FBE) показаны на Фиг. 11 и Фиг. 12, соответственно. Каждая планка погрешностей отображает среднеквадратическое отклонение от среднего значения (n=3). Некоторые планки погрешностей меньше обозначений.
Устройства с такой же конструкцией испытывали in vivo на трех гёттингенских мини-свиньях. Каждое устройство вводили в мочевой пузырь каждого животного через мочеиспускательный канал нехирургическим путем с помощью цистоскопа. Концентрацию гемцитабина и 2',2'-дифтор-2'-дезоксиуридина (dFdU) в моче измеряли в течение 8-дневного периода. После 8-дневного исследования каждое устройство извлекали через мочеиспускательный канал нехирургическим путем с помощью цистоскопа и щипцов. Концентрация комбинации гемцитабина и dFdU в моче показана на Фиг. 13.
Пример 5: Скрининговые исследования устройства для доставки гемцитабина у мини-свиней
Серию скрининговых исследований прототипа выполняли для внесения улучшений в конструкцию системы доставки лекарственного средства, основываясь на врожденной переносимости гемцитабина, обнаруженной при исследовании перфузии у мини-свиней, описанном выше. В этом исследовании три устройства прототипа были выполнены с возможностью высвобождения терапевтических уровней гемцитабина в мочу. Два устройства имели конструкцию Фиг. 1A-1B (с торцевыми заглушками большого диаметра или полученными лазерной прошивкой отверстиями для высвобождения лекарственного средства) и одно устройство имело конструкцию Фиг. 10A-10C (с пропускающими лекарственное средство дисками для высвобождения лекарственного средства). Три исследования завершали, в каждом исследовании испытывали конструкцию одного прототипа на трех мини-свиньях, образцы крови и мочи которых интенсивно собирали в течение 7-дневного периода времени.
Было обнаружено, что устройства конструкции Фиг. 1A-1B, имеющие торцевые заглушки большого диаметра для высвобождения лекарственного средства, обязательно приводили к повреждению уротелия у животного. Тем не менее, было обнаружено, что устройства конструкции Фиг. 1A-1B, имеющие полученное лазерной прошивкой отверстие, в котором вместе с гемцитабином содержалось загущающее средство, уменьшали число случаев повреждений уротелия. Было обнаружено, что устройства без отверстий конструкции Фиг. 10A-10C полностью исключали число случаев повреждений уротелия. Полагают, что такая конструкция предотвращает промежуточные высокие локальные концентрации гемцитабина (на поверхностях тканей, прилегающих к отверстиям высвобождающего лекарственное средство устройства), которые, как полагают, способствуют числу случаев повреждения уротелия.
Пример 6: Скрининговые исследования устройства для доставки гемцитабина у мини-свиней
В этом исследовании осмотические опытные устройства были выполнены с возможностью высвобождения терапевтических уровней гемцитабина в мочу. Устройства были выполнены с возможностью использования таблеток гемцитабина и таблеток осмотического средства, расположенных в отдельных местах в пределах резервуара с лекарственным средством, как в целом описано в PCT WO 2015/026813, которая включена в соответствующей части данного документа. В первой подгруппе каждое устройство имело силиконовую трубку с полученным лазерной прошивкой 75-микронным отверстием в области, расположенной по центру между концами трубки для высвобождения лекарственного средства. В просвет трубки загружали таблетки из смеси гемцитабина и мочевины в центральной области около выпускного отверстия и таблетки из мочевины/Lubritab в концевые области просвета. Во второй подгруппе каждое устройство имело силиконовую трубку с полученным лазерной прошивкой 150-микронным отверстием в области, расположенной по центру между концами трубки для высвобождения лекарственного средства. В просвет трубки загружали таблетки из смеси гемцитабина и мочевины в центральной области около выпускного отверстия и таблетки из мочевины/ПЭО в концевые области просвета. Устройства испытывали in vivo на мини-свиньях и in vitro, измеряя общее и среднее высвобождаемое количество гемцитабина в течение 7 дней. Скорости высвобождения гемицитабина составляли около 120 мг в течение 7 дней из устройства с 75-микронным отверстием и около 140 мг в течение 7 дней из устройства со 150-микронным отверстием. Наблюдали, что со временем концентрация в моче была умеренно меньшей в случае применения композиции мочевина/ПЭО по сравнению с композицией мочевина/Lubritab. В силу этих обстоятельств, вязкость солюбилизированного раствора лекарственного средства в просвете устройства может являться фактором в регулировании высвобождения лекарственного средства.
Выводы из Примеров
Анализ литературы с предоставлением целевых концентраций - концентрации in vitro среди опухолевых клеточных линий, как правило, имеют значения IC50, находящиеся в диапазоне от 0,5 до 3,0 мкг/г (микрограмм на грамм) для чувствительных клеточных линий (см. Jeon et al., J. Urol. 186(5):2084-93 (2011)). В литературе также говорится о том, что высокие концентрации в моче (например, 2000 мг в объеме до 50 мл) необходимы для эффективности, и что внутрипузырные инстилляции для достижения таких концентраций связаны с вопросами безопасности и переносимости, системным токсическим воздействием и симптомами со стороны нижних мочевыводящих путей (СНМП) (см. Cattel et al., Annals Oncol. 17(Supp 5): v142-47 (2006)).
Тем не менее, в исследованиях, описанных в приведенных выше Примерах, были определены концентрации гемцитабина в моче, необходимые для достижения этих терапевтических концентраций в тканях, а также обнаружено, что они переносятся уротелием. То есть, высокие внутрипузырные концентрации в моче не обязательны. В частности, было обнаружено, что внутрипузырная система, доставляющая 1/100ую этих уровней (например, 20 мг в объеме до 50 мл), может быть эффективной.
Кроме того, было обнаружено, что такая длительная внутрипузырная доставка гемцитабина может осуществляться без нанесения повреждений уротелию, в отличие от того, что сообщается в литературе относительно внутривенной перфузии гемцитабина.
Публикации, приведенные в данном документе, и материалы, для которых они приведены, специально включены в данный документ посредством ссылки. Модификации и варианты способов и устройств, описанных в данном документе, будут очевидны для специалистов в данной области техники из предшествующего подробного описания. Такие модификации и варианты предназначены для внесения в объем прилагаемой формулы изобретения.