Результат интеллектуальной деятельности: ИМПЛАНТАТ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Область техники
Изобретение относится к биотехнологии и медицине, а именно к области создания биорезорбируемых, биосовместимых имплантатов на основе фиброина шелка Bombyx mori и желатина, и предназначено для ускорения восстановления и регенерации костной ткани.
Уровень техники
Существует ряд травм и заболеваний, например, травматические переломы, переломы, требующие скрепления отломков, костные кисты, критические дефекты костей, ослабление на границе кости и протеза, злокачественные опухоли и т.д., требующих восстановления части кости или нескольких костей, а также замены целой кости или нескольких костей. Традиционные методы восстановления костной ткани предполагают использование аутотрансплантатов - трансплантацию собственных тканей пациента, взятых из здорового участка, или аллотрансплантатов - трансплантацию тканей или органа, взятых от донора. При этом предпочтение отдается аутотрансплантатам, несмотря на высокую стоимость такой процедуры и дополнительное травмирование пациента, дополнительный риск инфицирования, повреждение нервов, большую потерю крови и, как следствие, необходимость переливания крови, сопровождающуюся дополнительными рисками для пациента. Кроме того, существуют ограничения в максимальном объеме тканей, который можно взять у пациента в качестве аутотрансплантатов. Аллотрансплантаты также обладают рядом недостатков, в том числе низким качеством тканей, обусловленным забором донорского материала у трупов, риском заражения ВИЧ или гепатитом, иммуногенностью и т.д.
Недостатки аутотрансплантатов и аллотрансплантатов стимулировали поиск новых подходящих материалов - костных заменителей, которые могли бы использоваться в качестве альтернативы при восстановлении костной ткани. Параллельно развивается три основных направления создания костных имплантатов. Первое - костные заменители, основанные на биоматериалах, соответствующих физическим свойствам замещаемой ткани, при этом сохраняющих инертность по отношению к тканевой микросреде. К таким материалам относятся металлы, например, нержавеющая сталь, титан и сплавы, керамика на основе соединений алюминия и циркония, и полимеры, такие как силикон, полипропилен и полиметилметакрилат. Такие материалы вызывают неспецифический иммунный ответ по причине своей низкой биосовместимости.
Второе направление - разработка костных заменителей с одной стороны с учетом необходимости избегания неспецифического иммунного ответа, с другой - наличия биологически активных поверхностей, которые бы вызывали определенную биологическую реакцию (например, остеокондукцию), чтобы избежать образования волокнистого слоя и улучшить остеоинтеграцию. Общая стратегия заключается в модификации биоматериалов, используемых в первом направлении, путем нанесения покрытий, которые обладают биологической активностью и способны к биодеградации. Такая биоактивность обеспечивается поверхностными химическими реакциями, которые либо направлены на минерализацию посредством гетерогенной кристаллизации гидроксиапатитов, либо покрытием поверхности биоматериала биоактивной керамикой, такой как гидроксиапатиты, β-трикальцийфосфат β-ТСР) или биологически активное стекло. Другой тип костных имплантатов сконструирован таким образом, что скорость его деградации соответствует скорости заживления травмированный костной ткани. Это биоматериалы на основе натуральных или синтетических полимеров, обеспечивающих контролируемое химическое разложение в физиологических условиях до инертных продуктов, которые могут рассасываться в организме. Примеры синтетических полимеров включают полилактид, поли(ε-капролактон) и полигликолид; среди природных полимеров - хитозан и гиалуроновая кислота [M. Navarro, A. Michiardi, O. 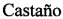 and J.A. Planell. Biomaterials in orthopaedics // J.R. Soc. Interface. 2008. V. 5 (27). P. 1137-1158]. Механические и остеокондуктивные свойства этих полимеров могут быть улучшены путем формирования композитов с биоактивной керамикой. Другой альтернативой для улучшения полимеров является их химическая модификация путем присоединения остеоиндуктивных биомолекул.
and J.A. Planell. Biomaterials in orthopaedics // J.R. Soc. Interface. 2008. V. 5 (27). P. 1137-1158]. Механические и остеокондуктивные свойства этих полимеров могут быть улучшены путем формирования композитов с биоактивной керамикой. Другой альтернативой для улучшения полимеров является их химическая модификация путем присоединения остеоиндуктивных биомолекул.
Третье направление - костные заменители, максимально приближенные к стандартам аутотрансплантатов, которые создаются на основе биоматериалов, способных индуцировать специфические клеточные ответы на молекулярном уровне, посредством введения биоактивных компонентов и способности к биологическому разложению. Данный тип костных трансплантатов предназначен для усиления регенерации кости путем включения клеток-предшественников костной ткани, а также факторов роста, чтобы стимулировать клетки на матриксе, сконструированном из различных природных или синтетических биоматериалов, или их комбинации, которые создают необходимую поддержку и достаточную васкуляризацию, чтобы обеспечить доступ питательных веществ для поддержания процесса регенерации [A.R. Amini, C.T. Laurencin and S.P. Nukavarapu. Bone tissue engineering: recent advances and challenges // Crit. Rev. Biomed. Eng. 2012. V. 40 (5). Р. 363-408]. В этом случае процесс регенерации костной ткани является остеокондуктивным, поскольку мезенхимальные стволовые клетки стимулируются к дифференцировке в преостеобласты, и процесс зависит от условий микросреды.
В дополнение к биохимическим факторам роста экзогенное механическое воздействие влияет на микросреду костной ткани, а также является важным компонентом в поддержания здоровья костей и гомеостаза. Такое механическое воздействие преобразуется в биохимические сигналы, которые затем интегрируются в систему клеточных ответов посредством механотрансдукции. Костную ткань можно рассматривать как клеточную сеть, где остеоциты служат сенсорными клетками, ответственными за механотрансдукцию, а остеобласты и остеокласты являются эффекторными клетками. Текущая парадигма механотрансдукции утверждает, что нагрузки, приложенные к целой кости, вызывают пульсирующий ток жидкости через канальцы остеоцитов. Остеоциты способны ощущать напряжение сдвига, порожденного этим током, а затем продуцировать сигнальные молекулы, которые регулируют ремоделирование кости за счет остеокластов и остеобластов. Хотя точная последовательность событий и комплекс сигналов, участвующих в процессе механотрансдукции, не вполне ясны, известно, что механическое напряжение и пульсирующий ток жидкости индуцируют синтез сигнальных молекул остеоцитами. Считается, что эффекты механической нагрузки на механическую деформацию и пульсирующий ток жидкости, индуцируемый в костных клетках, возникает в результате растяжения из-за гидростатического давления и сжатия/расслабления внеклеточного матрикса, а напряжение сдвига - за счет тока жидкости [W.R. Thompson, C.T. Rubin and J. Rubin. Mechanical regulation of signaling pathways in bone // Gene. 2012. V. 503 (2). P. 179-193]. Кости в естественных условиях генерируют все эти силы одновременно, так что волны, создаваемые давлением, не могут быть отделены от эффектов напряжения сдвига жидкости или деформации клеток. Это представляет интерес для инженерии костной ткани, чтобы использовать эти сжимающие или растягивающие механизмы для механической стимуляции трехмерных каркасов, содержащих клетки-предшественники костной ткани, что способствует образованию костной матрицы перед имплантацией [A.B. Yeatts, D.T. Choquette and J.P. Fisher. Bioreactors to influence stem cell fate: augmentation of mesenchymal stem cell signaling pathways via dynamic culture systems // Biochim. Biophys. Acta. 2013. V. 1830 (2). Р. 2470-2480].
Механические свойства кости зависят от масштаба и структурного уровня. Например, модуль Юнга при больших растяжениях кортикальных фрагментов бедренной кости человека (размер до 15 мм) находится в диапазоне от 14 до 20 ГПа (макроструктурная организация) [Reilly D. The elastic modulus for bone / D. Reilly, A. Burstein, V. Frankel // J. Biomech. - 1974]. В то же время модуль Юнга на изгиб из диафиза задней стороны большеберцовой кости (размер 100 мкм) показал 5.4 ГПа (микроструктурная организация) [Choi K. The elastic moduli of human subchondral, trabecular, and cortical bone tissue and the size-dependency of cortical bone modulus / K. Choi, J.L. Kuhn, M.J. Ciarelli, S.A. Goldstein // J. Biomech. - 1990. - T. 23 - №11 - 1103-1113]. Однако неясно, является ли причиной этого различия методов измерения или влияния микроструктуры. Модуль Юнга остеонов большеберцовой кости, измеренный с помощью наноиндентации, составляет примерно 22 ГПа, что близко к значениям модуля Юнга макроструктуры [Rho J.Y. Mechanical properties and the hierarchical structure of bone / J. Y. Rho, L. Kuhn-Spearing, P. Zioupos // Med. Eng. Phys. - 1998. - T. 20 - №2 - 92-102]. Таким образом, изучение механических свойств кости необходимо производить на разных уровнях организации внутри костного материала.
Механические свойства субстрата оказывают существенное влияние на эукариотические клетки. Для нормального развития клеток и, соответственно, тканей субстрат должен отвечать определенным требованиям, одно из которых - это способность поддерживать клеточную адгезию. Такие важные процессы как пролиферация, дифференцировка клеток, их миграция и даже выживаемость в той или иной степени зависят от наличия и поддержания контактов клеток с субстратом. Поэтому механические свойства имплантатов, используемых в регенеративной медицине, являются их важной характеристикой, стоящей в одном ряду с отсутствием токсичности, кинетикой биодеградации и т.д. Таким образом, изделия, предназначенные для ускорения заживления и регенерации костной ткани, должны обладать определенным набором механических свойств, в первую очередь, это модуль Юнга, который показывает способность материала (в общем случае - изделия) сопротивляться механической нагрузке.
В тканевой инженерии и, в частности, в инженерии костной ткани, важную роль играют биодеградируемые полимеры. По сравнению с неорганическими материалами, полимеры более эластичны и часто проще поддаются обработке. На основе полимеров могут быть получены трехмерные пористые структуры, которые обеспечивают проникновение клеток в глубину имплантата и хорошо имитируют губчатую кость. Путем вариации мономерного состава полимеров и количества межмолекулярных сшивок можно тонко оптимизировать механические свойства и время деградации имплантатов.
Таким образом, при разработке изделий для восстановления костей необходимо подобрать материал так, чтобы по своим механическим свойствам он был близок к материалу кости. При этом кость имеет сложную многоуровневую структуру, и каждому уровню соответствует свой набор механических характеристик. Чем меньше размер структурных элементов кости, тем сложнее для измерения становятся их механические свойства. Для восстановления костей используют неорганические материалы, полимеры и композиты. Неорганические материалы обычно сравнительно жесткие и хрупкие, полимеры сравнительно мягкие, эластичные и относительно быстро деградируют. Композиты могут наиболее точно сымитировать кость, т.к. их структуру и состав можно наиболее гибко и тонко оптимизировать.
Активные разработки заменителей костной ткани на основе биополимеров, в том числе структурных белков шелка, подтверждаются множеством патентных документов, среди которых наиболее близкие решения раскрыты в следующих документах.
Из уровня техники известно изобретение KR 100762928 (В1), где описано использование нетканых волокон из фиброина, которые могут содержать керамику. Материал может быть использован для регенерации костной ткани.
Однако, материал предназначен только для направления регенерации костной ткани и не предназначен для использования в качестве несущего на себе нагрузку материала для регенерации кости.
Известно техническое решение по международной заявке на получение патента на изобретение WO 2005012606 (А2), где раскрыто использование раствора фиброина, сконцентрированного обратным диализом, против гигроскопичного полимера для получения губчатой структуры с использованием частиц соли и/или путем пропускания газа через раствор, а также раскрыты пористые фиброиновые губки, которые могут содержать соответствующие сигнальные факторы, включая костный морфогенный белок, в том числе витализированный стромальными клетками. В одном аспекте осуществления данного изобретения трехмерный пористый шелковый каркас сам (без дополнительной витализации) может быть имплантирован in vivo и служить заменителем костной ткани.
Однако материал не обеспечивает несущую нагрузку во время имплантации.
В патентных документах WO 2004108180 A1, WO 2008099190 А2 раскрыт стимулирующий костные клетки синтетический заменитель костного трансплантата для заполнения костных дефектов, не требующих стабилизации костной структуры, выполненный из полилактогликолида. Высокая пористость обеспечивает приток жидкости и питательных веществ, а также возможность миграции клеток к месту регенерации. Основным недостатком полилактогликолида как материала является локальное закисление продуктами его распада - молочной и гликолевых кислот, вследствие чего развивается асептическое воспаление и замедляются процессы остеогенеза. Предлагаемое изобретение лишено вышеуказанного недостатка.
На основе сополимера лактида и гликолида выполнен и многофункциональный биодеградируемый композит, применяемый в частности для регенерации костной ткани (см. патент ЕР 1646410 В1). Данный композит может быть произведен в форме кости, хряща или мягкой ткани. В состав композита может быть включен активный агент, стимулирующий регенерацию ткани. Достоинством данного продукта, присущим также предлагаемому изобретению, является возможность включения в имплантат активных агентов. Недостатком, как было указано выше, является использование полилактогликолида, ухудшающего биосовместимость полученного продукта.
Еще один патент раскрывает способ получения трехмерных матриц для тканеподобных структур из клеток животного происхождения (RU 2396342). Изобретение относится к способу получения трехмерных матриц для тканеподобных структур из клеток животного происхождения. Данный способ предусматривает ковалентное связывание гистонов с поверхностью предварительно активированных биосовместимых полимерных микросфер из кристаллизованного декстрана. Затем проводят осаждение центрифугированием микросфер с ковалентно связанными гистонами. Полученный слой микросфер на поверхности субстрата с нанесенными на него клетками используют в качестве основы для получения тканеподобных клеточных структур. Известное изобретение обладает одним существенным недостатком, а именно модификация проводится природными катионными белками - гистонами из ткани тимуса телят, что повышает риск возникновения инфекционных заболеваний и/или иммунной реакции организма в ответ на трансплантацию и, как следствие, отторжение имплантата.
Раскрытие изобретения
Задачей заявляемой группы технических решений является необходимость создания биосовместимого биорезорбируемого имплантата для регенерации костной ткана, обеспечивающего ускорение восстановления и регенерации костной ткани без введения дополнительных компонентов и химической модификации в фиброин-желатиновые скаффолды.
Технический результат заявляемого изобретения заключается в упрощении технологии получения имплантата в сочетании с улучшением механических характеристик получаемого имплантата, в частности, модуля Юнга при измерении на сжатие, повышением его остеиндуктивных свойств, что способствует ускорению заживления и регенерации костной ткани.
Заявляемый имплантат и способ его получения также характеризуются невысокой стоимостью сырья, что в сочетании с уникальными свойствами имплантата, обусловленными улучшенными показателями модуля Юнга по сравнению с фиброин-желатиновыми скаффолдами, на основе которых сформирован имплантат, позволит создать доступный конкурентоспособный продукт и занять лидирующие позиции в данной области, т.к. изделия на основе фиброина превосходят по биосовместимости существующие на рынке имплантаты для регенерации костной ткани, которые представлены в основном ксеноматериалами и изделиями из полилактогликолидов. Кроме того, важным техническим результатом, достигаемым заявляемой группой изобретений, является усиление стимуляции остеогенеза в отсутствии каких-либо индукторов, что подтверждается стимуляцией дифференцировки остеобластоподобных клеток MG-63 при культивировании на поверхности имплантата.
Поставленная задача решается тем, что заявляемый имплантат для регенерации костной ткани, характеризуется пористой структурой с размером пор от 10 до 85 мкм, содержанием фиброина шелка от 65 до 75 мас. %, содержанием желатина от 25 до 35 мас. %, и имеет значение модуля Юнга на сжатие в дегидратированном состоянии 83±1 МПа, во влажном - 590±60 кПа. Поставленная задача решается также тем, что способ получения имплантата для регенерации костной ткани, включает следующие стадии:
а) подготовку водного раствора фиброина шелка путем растворения фиброина из расчета 100-150 мг/мл в смеси CaCl2:C2H5OH:H2O при молярном соотношении компонентов смеси в течение 5-7 часов при нагревании до 70°С±5°С и последующего диализа против воды, доведение полученного раствора водой до концентрации 20-30 мг/мл;
б) подготовку водного раствора желатина путем растворения сухого желатина в воде из расчета 20-30 мг/мл;
в) формирование композитного скаффолда путем заморозки в течение 6-8 суток при температуре - 18-25°С смеси растворов, полученных на стадиях а) и б), в объемном соотношении 7:3 и 0,8-1,2 об% диметилсульфоксида (ДМСО) с последующей разморозкой и обработкой 96%-ным этанолом, что обеспечивает формирования β - складчатой структуры;
г) криоизмельчение скаффолда, полученного на стадии в), в 70%-ном этаноле с использованием диспергатора, и последующую сортировку полученных фрагментов скаффолда с получением композитных микрочастиц размером 50-500 мкм;
д) осаждение композитных микрочастиц, полученных на стадии г), из суспензии в 70%-ном этаноле при 13000-18000 g в течение 30-40 минут с последующим высушиванием при 50-55°С в течение не менее 2 суток для формирования имплантата для регенерации костной ткани.
Основным преимуществом шелка по сравнению с другими природными биополимерами являются его отличные механические свойства: предел прочности на разрыв шелковой нити тутового шелкопряда Bombyx mori составляет 500 МПа, шелковой нити, очищенной от серицина - 610-690МПа, модуль упругости 5-12 ГПа и 15-17 ГПа и удлинение при разрыве 19% и 4%-16% соответственно. Другие важные преимущества шелка как материала для регенерации тканей: хорошая биосовместимость, возможность получения водных растворов, способность к биологическому разложению, термостабильность, присутствие легкодоступных химических групп для функциональных модификаций, возможность газовой стерилизации и устойчивость к радиации [Yahong Zhao, et al. // J. Biomedical Science and Engineering, 2011, V. 4, P. 397-402].
В предлагаемом изобретении может быть использован фиброин шелка каркасной нити пауков, фиброин шелка тутового шелкопряда и других видов шелкопрядов, фиброин рекомбинантного шелка, а также искусственные аналоги шелка.
Имплантаты, полученные в соответствии с заявляемым изобретением могут применяться для регенерации костной ткани, в частности ретикулофиброзной и пластинчатой.
Краткое описание чертежей
Изобретение поясняется следующими чертежами.
На фиг. 1 представлен внешний вид заявляемого имплантата для регенерации костной ткани. Линейка 1 мм.
На фиг. 2 представлена структура заявляемого имплантата для регенерации костной ткани. Изображение поперечного среза имплантата, полученное с использованием сканирующей электронной микроскопии.
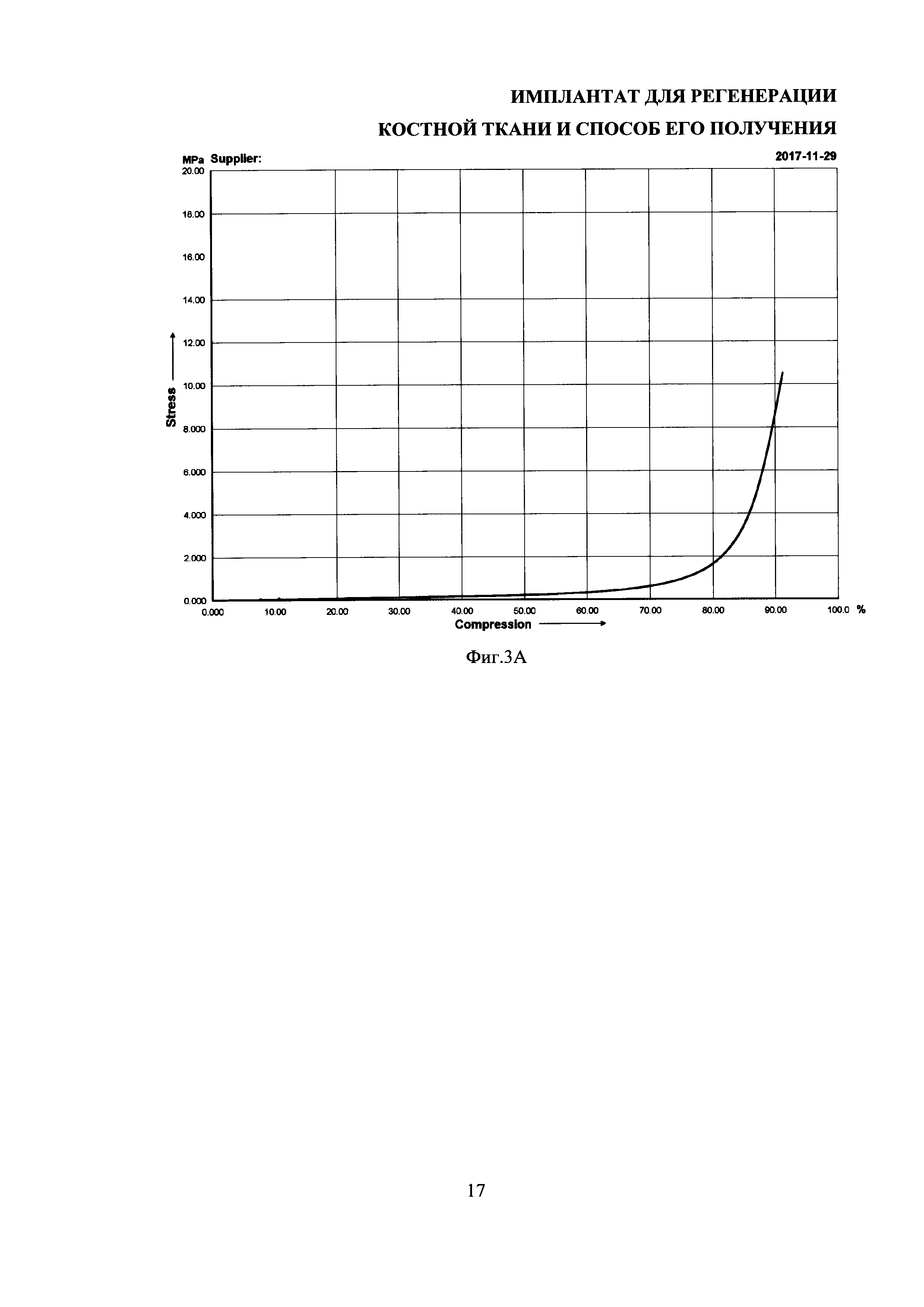
На фиг. 3А и 3Б представлены зависимости "напряжение-деформация" для образцов имплантатов: сверху - образец в воде, снизу - сухой образец.
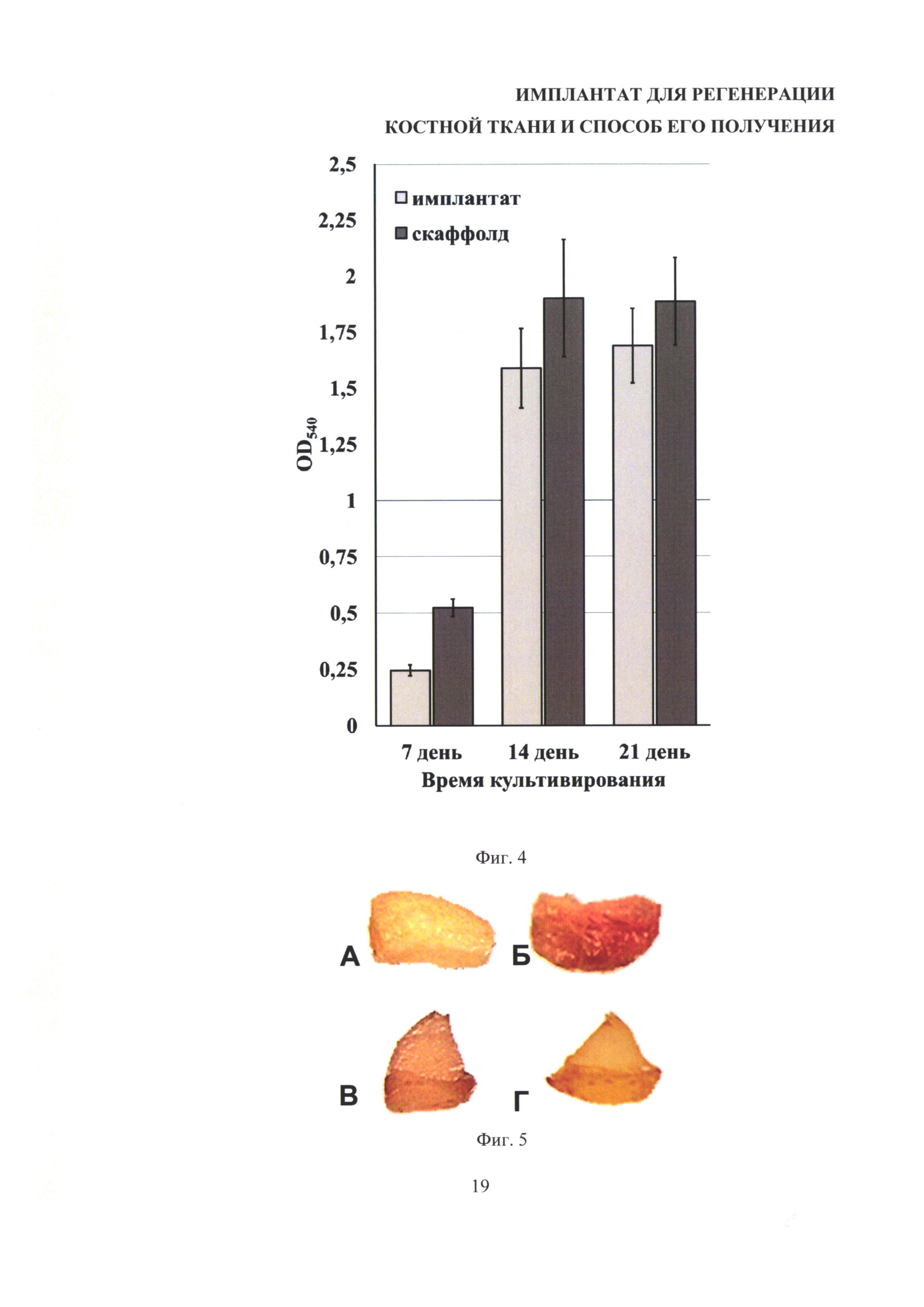
На фиг. 4 представлены результаты МТТ-теста, отражающего количество и метаболическую активность клеток, в виде средних значений оптической плотности ± стандартное отклонение, полученные на образцах имплантата и фиброин-желатиновых скаффолдов при культивировании остеобластоподобных клеток MG-63.
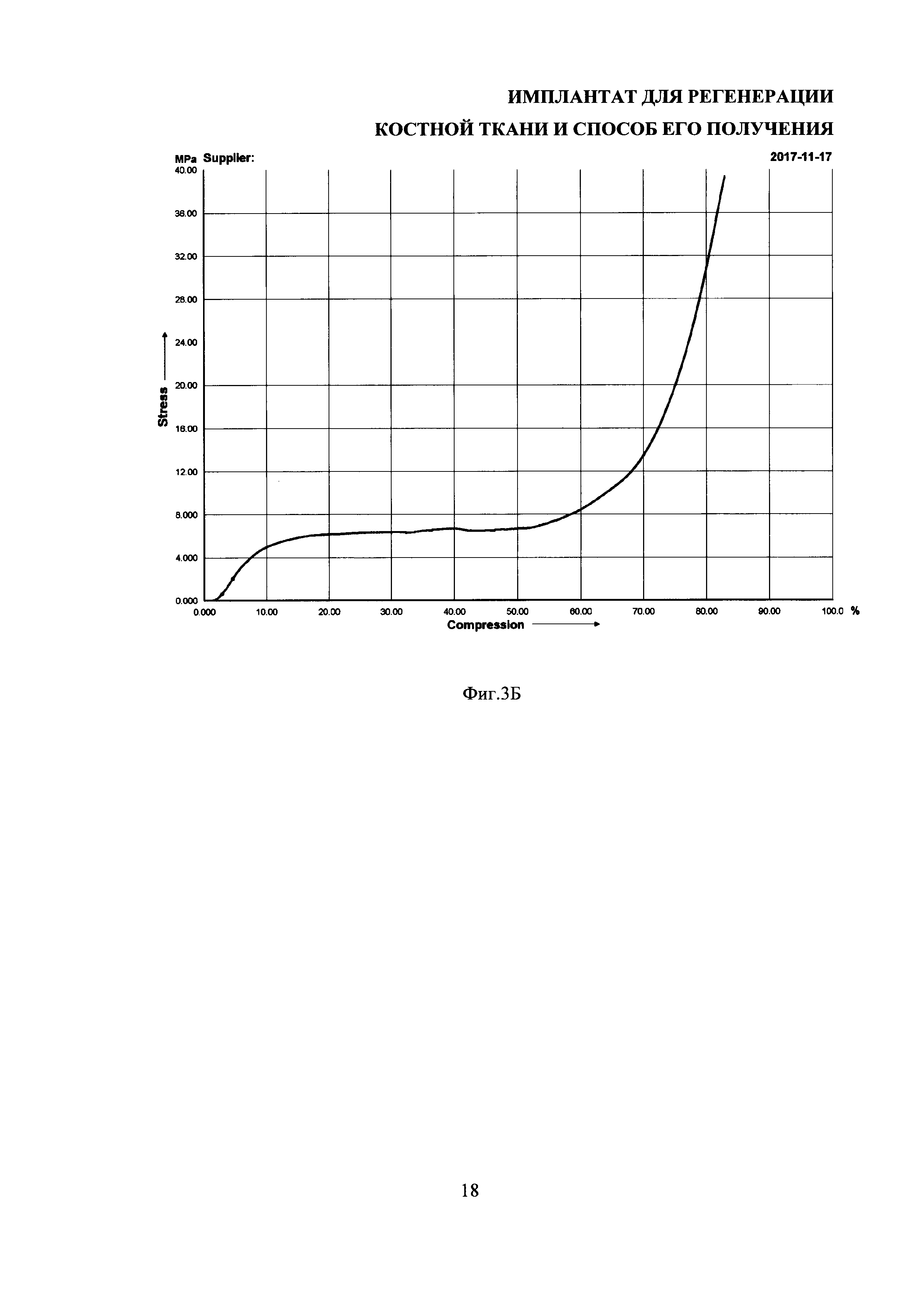
На фиг. 5 представлены изображения имплантатов (А, Б) и фиброин-желатиновых скаффолдов (В, Г), окрашенные ализариновым красным на 7 (А, В) и 21 день (Б, Г) культивирования остеобластоподобных клеток MG-63.
Осуществление изобретения
Получение водного раствора фиброина шелка осуществляли с использованием Нитей хирургических нестерильных 100% натуральный шелк, произведенных по ГОСТ 396-84 (Соответствие упаковки и маркировки ГОСТу 396-84, наличие сертификата соответствия №0302120, гарантии производителя, срок годности, условия хранения по ГОСТ 396-84, сертификат соответствия), при растворении навески в смеси dH2O, кальция хлористого (х.ч., о.с.ч., ГОСТ 450-77; Соответствие упаковки и маркировки ГОСТу 3885-73, наличие гарантии производителя, срок годности, внешний вид) и спирта этилового ректификованного 96%-ного (ГОСТ 5962-67). Фиброин берут в количестве 100-150 мг/мл, обеспечивающем полное растворение в смеси в хлориде кальция, этанола и воды, и получение после диализа раствора с концентрацией не менее 30 мг/мл. Раствор желатина в dH2O готовят таким образом, чтобы получить концентрацию эквивалентную концентрации фиброина в водном растворе. Для получения композита готовили смесь водных растворов полимеров, используя полученный раствор фиброина и водный раствор желатина (ГОСТу 23058-89). Формирование скаффолда для дальнейшего криоизмельчения с целью получения микроносителей проводили путем заморозки смеси водного раствора фиброина и водного раствора желатина с добавлением 1% ДМСО (х.ч., ТУ 2635-114-44493179-08). Криоизмельчение сформированных макрочастиц выполняли с помощью диспергатора. Осаждение микрочастиц проводили в центрифуге для микропробирок Eppendorf 5418R.
Все перечисленные выше процедуры осуществлялись с использованием следующего оборудования: Система очистки воды Elix 70, «Millipore» (Франция, система включает: картридж предварительной очистки Progard TL, картридж обратного осмоса, модуль Elix; производительность 70 л/час при температуре 7-30о С, рабочее давление 0,7-1,0 МПа, 220 В, 50 Гц, габариты (ШГВ): 662×441×733 мм, 56 кг); Резервуар для сбора очищенной воды SDS 200, «Millipore» (Франция, объем 200 л), Весы электронные RV 1502, «OHAUS» (США, (1500,00±0,01) г, 220 В, 50 Гц); Шкаф вытяжной 1200 ШВМкв (Россия, ООО «ЛаМО» макс, мощность подключаемых приборов 3,5 кВт, 220 В, габариты (ШГВ): 1280×750×2400 мм); Холодильник бытовой Атлант МХМ 1707-02 (Минск, Белоруссия, емкость камеры холодильника 175 л, температура от 0°С до 10°С, емкость мороз, камеры 115 л, температура минус 18 до минус 24°С, 220 В, 50 Гц); Диспергатор Bosch MSM 66150 ERGOMIXX (Словения, мощность 600 Вт, 220 В, погружной, турборежим, габариты (ВГШ):210×620×550, вес: 1.15 кг); Центрифуга MiniSpin, «Eppindorf», (Германия, скорость вращения 13 400 об/мин, ротор F-45-12-11, 12×1,5/2 мл, 220 В, 70 Вт, габариты (ВГШ): 122×240×226 мм, 4,3 кг); Баня водяная BWT-U/20, Biosan (Латвия, ванна из н/ж стали объем 20 л. Диапазон регулирования температуры от 30°С до 100°С, точность поддержания температуры ±0,1°С, внутренняя циркуляция, внутр. размеры ванны: 300×320×140 мм, габариты: 345×550×290 мм, 11 кг, 220 В, 50 Гц, 1 кВт), Термостат ТС-1/80, СКТБ (80 л, температура до +60°С, принудительная вентиляция, камера - нержавеющая сталь), Центрифуга для микропробирок Eppendorf 5418R 18×1,5/2 мл, 14000 об/мин, 16873g, с охлаждением, ротор FA-45-18-11, 18×1,5/2 мл.
Ниже приведены примеры конкретного выполнения. Специалисту в данной области техники понятно, что приведенные примеры не ограничивают заявляемую группу изобретений, а призваны показать возможность реализации способа получения имплантата с заявленными характеристиками.
Пример 1.
Получение имплантата для регенерации костной ткани.
Фиброин шелка тутового шелкопряда Bombyx mori растворяют в смеси CaCl2:С2Н5ОН:Н2О (молярное соотношение 1:2:8) в течение 5 часов при температуре 70°С и диализуют против дистиллированной воды, проводя 4 смены диализа. Полученный раствор, содержащий фиброин, центрифугируют 10 минут при 13400 g, определяют концентрацию фиброина в супернатанте по ОД280, доводят концентрацию дистиллированной водой до 20 мг/мл. Желатин растворяют в дистиллированной воде из расчета 20 мг/мл. Смешивают полученные растворы фиброина и желатина в соотношении 7:3, добавляют 1% ДМСО, переносят в форму для формирования скаффолда и замораживают при -20°С 7 дней. В результате получают композитные скаффолды, которые в течение 120 минут обрабатывают 96%-ным этанолом при комнатной температуре.
Полученные композитные скаффолды замораживают в дистиллированной воде, помещают в сосуд с 70% этанолом и криоизмельчают с использованием диспергатора. Полученные фрагменты композитных скаффолдов - микрочастицы, сортируют путем последовательного пропускания через сита с диаметром отверстий 500 мкм, 250 мкм и 100 мкм. Собирают фракцию, прошедшую через сита с диаметром отверстий 500 мкм и 250 мкм и непрошедшую через сито с отверстиями 100 мкм.
Полученную фракцию микрочастиц размером 100-250 мкм переносят в 70%-ный этанол, помещают в центрифужные микропробирки типа Eppendorf объемом 2 мл и центрифугируют при 16 900 g 30 минут. Супернатант отбирают, а осадок помещают на трое суток в термостат на высушивание с принудительной вентиляцией на 50°С. Высушенный образец - имплантат на основе фиброина и желатина, извлекают из пробирки и хранят в сухом виде или 70%-ном этаноле. Полученный имплантат (фиг. 1) представлен пористой структурой с диаметром пор 10-85 мкм (фиг. 2).
Пример 2.
Оценка механических свойств имплантата.
Механические испытания образцов имплантатов проводили на универсальной машине Autograph AGS-10 kNG фирмы Shimadzu (Япония). Сжатие образцов проводилось с линейной скоростью 0,5 мм/мин. Проводились механические испытания сухих образцов и образцов, помещенных в воду. Полного разрушения не происходило в обоих случаях (материал пластичен).
Деформация образцов остеоиндуктивных имплантатов во влажном состоянии (в воде) и в сухом состоянии происходила по-разному (фиг. 3А,Б). При деформации сухого образца наблюдалось характерное плато текучести при напряжении ~6.5 МПа и значениях деформации 20-50%. Модули Юнга для сухого и влажного образцов составили соответственно 83±1 МПа и 590±60 кПа. При этом механические характеристики фиброин-желатиновых скаффолдов, из которых получен имплантат, исследованные ранее, значительно хуже. Так модуль Юнга известных из уровня техники фиброин-желатиновых скаффолдов [Архипова А.Ю. Диссертация на соискание ученой степени канд. биологических наук «Биорезорбируемые скаффолды на основе фиброина шелка для тканевой инженерии и регенеративной медицины». МГУ имени М.В. Ломоносова, Москва, 2016] во влажном состоянии составляет 7,625±0,825 кПа, а в сухом - 175±25 кПа. Таким образом, полученные имплантаты обладают существенным преимуществом в части механических характеристик, в частности, модуля Юнга, перед фиброин-желатиновыми скаффолдами.
Пример 3
Исследование биосовместимости и остеоиндуктивной активности остеобластоподобных клеток MG-63 при культивировании на имплантатах.
Оценку биосовместимости имплантатов проводили с использованием МТТ-теста. Остеобластоподобные клетки MG-63 культивировали в среде ЕМЕМ (Eagle's Minimum Essential Medium) с добавлением 10% сыворотки и 1% NEAA (Non-Essential Amino Acid) в течение 7 дней на образцах заявляемых имплантатов и известных из уровня техники фиброин-желатиновых скаффолдов, из которых получены имплантаты. На 7 день в среду добавляли индукторы остеогенеза: дексаметазон, бета-глицерофосфат и аскорбиновую кислоту. На 7, 14 и 21 дни были проведен МТТ-тест. Для этого в лунки с образцами, содержащие 500 мкл культуральной среды, вносили по 50 мкл 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромида (МТТ), и инкубировали при 37°С в атмосфере, содержащей 5% СО2 в течение 4 часов. Образованные кристаллы формазана растворяли в ДМСО и проводили колориметрические измерения при 540 нм.
По результатам МТТ-теста (фиг. 4) достоверные отличия в сигнале МТТ выявлены только на 7 день. Это может быть связано с разной площадью поверхности образцов, т.к. пористые фиброин-желатиновые скаффолды имеют более крупные и округлые поры, а, соответственно, и большую площадь поверхности на единицу объема. Также замедление пролиферации может объясняться дифференцировкой клеток и таким образом свидетельствовать о стимуляции дифференцировки остеобластоподобных клеток в отсутствии индукторов остеогенеза.
Оценку остеондуктивной активности имплантатов проводили по выявлению отложений солей кальция на 7 и 21 день культивирования остеобластоподобных клеток MG-63 на образцах имплантатов и фиброин-желатиновых скаффолдов, из которых получены имплантаты. Для определения Са2+ переносили образцы в фосфатно-солевой буфер и трижды промывали их, помещали в деионизованную воду, а затем переносили в 2%-ный раствор ализаринового красного рН 4.3 и инкубировали в темноте в течение 30 минут, после чего образцы отмывали от не связавшегося красителя деионизированной водой. Окрашенные ализариновым красным образцы фотографировали (фиг. 5). На 21 день культивирования остеобластоподобных клеток MG-63 на имплантатах выявляется интенсивное окрашивание ализариновым красным, т.е. поверхность имплантата минерализована культивируемыми на нем клетками, что доказывает остеоиндуктивные свойства разработанных имплантатов и делает их перспективными для применения в качестве средства для ускорения заживления и регенерации костной ткани. При этом интенсивность окрашивания имплантатов ализариновым красным была существенно выше, чем фиброин-желатиновых скаффолдов, что указывает на улучшенные остеоиндуктивные свойства образцов имплантатов по сравнению с фиброин-желатиновыми скаффолдами, что видимо связано с разными механическими характеристиками изделий из одного материала.
Традиционно регуляция механических свойств разрабатываемых изделий для регенеративной медицины и тканевой инженерии предполагает химическую модификацию используемых полимеров или введение в состав имплантата новых компонентов, что не только ухудшает их биосовместимость, но и существенно удорожает и усложняет технологию получения таким имплантатов. Раскрытый в заявляемом изобретении способ формирования имплантата для регенерации костной ткани не предполагает применения дополнительных реагентов и дорогостоящего оборудования, при этом обеспечивает получение биосовместимого остеоиндуктивного материала.