Результат интеллектуальной деятельности: Способ получения N-[3-оксо-20(29)лупен-28-оил]-ω-аминокислот
Вид РИД
Изобретение
Изобретение относится к способу получения бетулоноил-ω-аминокислот кислоты формулы 1.
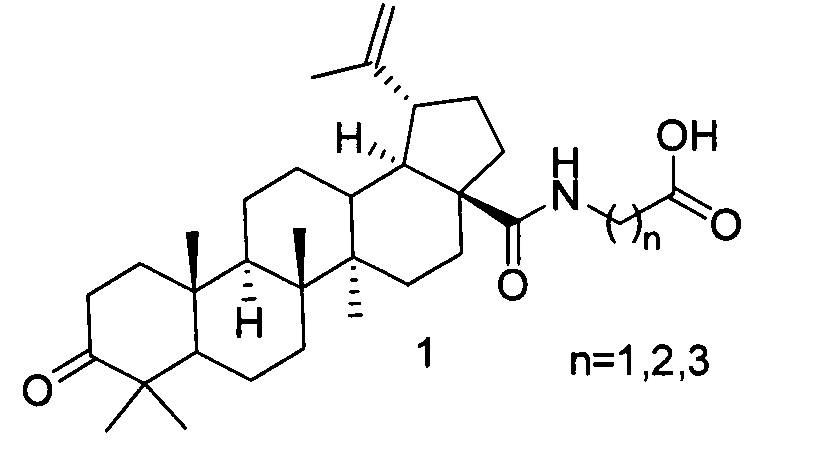
Амиды тритерпеновых кислот (ТТК) проявляют противоопухолевую и противовирусную активность [В.В. Saxena, L. Zhu, М. Нао Boc-lysinated-betulonic acid: a potent, anti-prostate cancer agent. Bioorg. Med. Chem. 14(18), 6349-6358 (2006); О.B. Flekhter, E.I. Boreko, L.R. Nigmatullina, E.V. Tret'yakova, N.I. Pavlova, L.A. Baltina, S.N. Nikolaeva, O.V. Savinova, V.F. Eremin, F.Z. Galin, and G.A. Tolstikov Synthesis and Antiviral Activity of Betulonic Acid Amides and Conjugates with Amino Acids. Rus J Bioorg. Chem, Vol. 30, No. 1, 2004, pp. 80-88]. Производные бетулоновой кислоты, содержащие остатки аминокислот, являются перспективными корректорами цитостатической полихимиотерапии опухолей [Т.Г. Толстикова, Г.А. Толстиков, И.В. Сорокина, Э.Э. Шульц, Н.И. Петренко, Н.Ф. Салахутдинов Корректор цитостатической полихимиотерапии Пат РФ 2353623, 17.09.2007; И.В. Сорокина, Т.Г. Толстикова Н.А. Жукова, Д.С. Баев, Т.Г. Толстиков, А.Н. Антимонова, Н.И. Петренко, Э.Э. Шульц, В.П. Николин, Н.А. Попова Средство для коррекции цитостатической полихимиотерапии с противовоспалительной активностью Пат РФ 2425680, 19.05.2010]. Наиболее удобным и рациональным способом получения амидов ТТК является взаимодействие хлорангидридов ТТК с аминами [S. Sommerwerk, L. Heller, J. Kuhfs, R. Csuk Selective Killing of Cancer Cells with Triterpenoic Acid Amides - The Substantial Role of an Aromatic Moiety Alignment European Journal of Medicinal Chemistry 122 (2016) 452-464; M. Kahnt, L. Fischer, A. Al-Harrasi, R. Csuk Ethylenediamine Derived Carboxamides of Betulinic and Ursolic Acid as Potential Cytotoxic Agents, Molecules 2018, 23(10), 2558]. Для ряда ТТК содержащих кетогруппы (урсоновая, бетулоновая), для получения хлорангидридов используют взаимодействие ТТК с оксалил хлоридом (ОХ), поскольку кетопроизводные могут образовывать побочные продукты при взаимодействии с производными серы и фосфора, обычно применяемыми для получения хлорангидридов. Для полноты превращения в хлорангидрид используют избыток ОХ (обычно используют двукратное мольное количество ОХ по отношению к ТТК). Удаление остаточного ОХ необходимо для предотвращения образования побочных продуктов при ацилировании аминов. Во избежание деструкции бетулоноилхлорида удаление ОХ проводят в вакууме при низкой температуре, для полного удаления используют многократную совместную отгонку с легкокипящим растворителем (дихлорметаном). Прототипом данного изобретения является способ получения амидов бетулоновой кислоты взаимодействием бетулоноилхлорида с гидрохлоридом эфира аминокислоты в присутствии триэтиламина с последующим гидролизом сложноэфирной группы неорганическим основанием в системе метанол-тетрагидрофуран вода [N.I. Petrenko, N.V. Elantseva, V.Z. Petukhova, M.M. Shakirov, Е.Е. Shul'ts, and G.A. Tolstikov, Synthesis of Betulonic Acid Derivatives Containing Amino-Acid Fragments, Chemistry of Natural Compounds, Vol. 38, No. 4, 2002, pp. 331-339.
По методу-прототипу после образования бетулоноилхлорида остаточный ОХ удаляют трех-четырехкратным растворением-концентрированием реакционной смеси в вакууме при температуре ≤30°С, с добавлением CH2Cl2 в качестве растворителя для осуществления полноты удаления остаточного ОХ.
Технологическими недостатками способа-прототипа - являются трудоемкость, большие временные затраты на процесс, использование сложного оборудования (роторный испаритель, вакуум-насос, многократное растворение и концентрирование в узком температурном диапазоне), большой расход хлорорганического растворителя.
Экологическими недостатками способа-прототипа являются выброс паров хлористого метилена в атмосферу, использование токсичных растворителей для гидролиза сложноэфирной группы эфироамида.
Предлагаемый способ приведен на схеме 1.
Бетулоновую кислоту в растворе дихлорметана обрабатывают избытком ОХ. Остаточный ОХ удаляют быстрой промывкой органической фазы ледяной водой. При обработке водой ОХ быстро гидролизуется с образованием газообразных продуктов и хлористого водорода, который отделяют вместе с водной фазой. При обработке водой тритерпеновое производное находится в органической фазе вследствие исключительно низкой растворимости тритерпеноидов в воде, кроме этого, стерическая затрудненность хлоркарбонильной группы бетулоноилхлорида препятствует его взаимодействию с водой, поэтому бетулоноилхлорид сохраняется в органическом растворе. Водную фазу отделяют, а органическую фазу, содержащую хлорангидрид ТТК, используют в реакции с аминами.
Гидролиз эфироамидов 4 для получения целевого соединения осуществляют неорганическим основанием в водно-спиртовой среде, поскольку амиды тритерпеновых кислот являются исключительно стабильными к гидролизу в отличие от эфиров аминокислот. Преимуществами предлагаемого способа при получении бетулоноилхлорида и ацилировании являются сокращение времени и упрощение обработки, уменьшение энергетических затрат, снижение расхода растворителя (хлористого метилена), уменьшение выбросов в окружающую среду. Преимуществом предлагаемого способа при гидролизе эфира является также использование менее токсичного и доступного растворителя (водного спирта) в отличие от системы метанол-тетрагидрофуран-вода по способу прототипу.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение раствора бетулоноилхлорида.
Бетулоновую кислоту (30 г, 66 ммоль) загружают в 500 мл колбу Эрленмейера, с хлоркальциевой трубкой и капельной воронкой и растворяют в сухом CH2Cl2 (120 мл) при перемешивании на магнитной мешалке. К охлажденному раствору прибавляют по каплям в течение 20-30 мин раствор хлористого оксалила (16.9 г, 12.3 мл, 132 ммоль) в сухом CH2Cl2 (30 мл), предварительно охлажденный до +2÷+10°С. Реакционную массу выдерживают в течение 12 ч при Т комн. Смесь промывают водой со льдом (~250 мл) в течение ~10 мин, температура смеси при обработке 0-10°С. Органическую фазу отделяют и немедленно используют в реакции ацилирования.
Пример 2а. Получение N-[бетулоноил]-2-амино-этановой кислоты
К раствору бетулоноилхлорида в CH2Cl2 после промывки водой, полученному согласно примеру 1, немедленно добавляют предварительно измельченный метиловый эфир глицина гидрохлорид (10.8 г, 86 ммоль) и Et3N (26 г, 35,8 мл 200 ммоль), (температура при прибавлении ≤10-15°С) при перемешивании и оставляют на ночь (10-14 час).
Реакционную массу обрабатывают смесью 10% раствора HCl (200 мл). Органический раствор отделяют, сушат и концентрируют в вакууме (роторный испаритель) при Т бани 50-60°С. Полученный концентрат растворяют в 200 мл EtOH. К полученному раствору продукта в EtOH прибавляют при перемешивании заранее приготовленный и охлажденный до комнатной температуры раствор NaOH (65,0 г) в дистиллированной воде (0,133 л). Реакционную смесь перемешивают при комнатной температуре в течение 10-14 час и выливают на смесь льда и соляной кислоты. Осадок продукта отделяют на фильтре, промывают водой и сушат на воздухе при 30-50°С, получают 28 г целевого продукта (84% считая на исходную бетулоновую кислоту).
ИК, ν/см-1: 1640 (CONH); 1700 (С=О); 3450 (NH).
ЯМР 1Н (400 МГц, CDCl3, δ, м.д., Гц): 0.91 (с, 3Н), 0.95 (с, 3Н), 0.97 (с, 3Н), 1.01 (с, 3Н), 1.06 (с, 3Н), 1.18-2.10 (м, 21Н, СН2, СН); 1.67 (с 3Н, С(20)Ме); 2.30-2.55 (м, 3Н, С(13)Н, С(16)Н2); 3.07 (м, 1Н, С(19)Н); 4.03 (м, 2Н, CH2NH); 4.59 с, 4.72 с (2Н, С(29)Н2); 6.32 (1Н, NH).
ЯМР 13С (100 МГц, CDC13, δ, м.д., Гц): 39.39 (С-1, т); 33.89 (С-2, т); 218.82 (С-3, с); 47.13 (С-4, с); 54.74 (С-5, д); 19.43 (С-6, т); 33.42 (С-7, т); 40.45 (С-8, с); 49.74 (С-9, д); 36.67 (С10, с); 21.22 (С-11, т); 25.39 (С-12, т); 37.55 (С-13, д); 42.31 (С-14, с); 29.08 (С-15, т); 33.26 (С-16, т); 55.52 (С-17, с); 49.74 (С-18, д); 46.38 (С-19, д); 150.43 (С-20, с); 30.51 (С-21, т); 38.04 (С-22, т); 26.42 (С-23, к); 20.80 (С-24, к); 15.72а (С-25, к); 15.58а (С-26, к); 14.32 (С-27, к); 177.07 (С-28, с); 109.30 (С-29, т); 19.21 (С-30, к); 41.05 (С-31, т); 173.16 (СООН, с).
Характеристики продукта соответствуют литературным данным N.I. Petrenko, N.V. Elantseva, V.Z. Petukhova, M.M. Shakirov, Е.Е. Shul'ts, and G.A. Tolstikov, Synthesis of Betulonic Acid Derivatives Containing Amino-Acid Fragments, Chemistry of Natural Compounds, Vol. 38, No. 4, 2002, pp. 331-339.
Пример 2б. Получение N-[бетулоноил]-3-амино-пропионовой кислоты
К раствору бетулоноилхлорида в CH2Cl2 после промывки водой, полученному согласно примеру 1, немедленно добавляют предварительно измельченный метиловый эфир β-аланина гидрохлорид (12 г, 86 ммоль) и Et3N (26 г, 35,8 мл 200 ммоль), (температура при прибавлении ≤10-15°С) при перемешивании и оставляют на ночь (10-14 час).
Выделение эфироамида и его гидролиз проводят аналогично примеру 2а. После подкисления, промывки водой и осушки выделяют N-[бетулоноил]-3-амино-пропионовую кислоту в виде белого порошка. Выход в расчете на исходную бетулоновую кислоту 81%. Характеристики продукта соответствуют литературным данным.
ИК, ν/см-1: 1637 (CONH); 1705 (С=O); 3400 (NH).
ЯМР 1H (400 МГц, CDCl3, δ, м.д., Гц): 0.87 (3Н, с, Ме-25), 0.92 (6Н, с, Ме-26, Ме-27), 0.97 (3Н, с, Ме-24), 1.01 (3Н, с, Ме-23), 1.62 (3Н, с, Ме-29), 2.56 (2Н, дд, J1=5.1, J2=5.1, H-2'a, H-2'b), 3.03 (1H, ддд, J1=10.8, J2=10.3, J3=3.6, H-19), 3.48 (2H, м, H-31a, H-31'b), 4.54 (1H, y.c., H-30), 4.68 (1H, y.c., н-30), 6.30 (1H, дд, J1=5.7, J2=5.7, -NH).
39.37 (С-1, т); 33.84 (С-2, т); 218.74 (C-3, c); 47.08 (C-4, c); 54.69 (С-5, д); 19.40 (С-6, т); 33.40 (C-7, т); 40.43 (C-8, c); 49.66 (С-9, д); 36.64 (C-10, c); 21.23 (C-11, т); 25.37 (С-12, т); 37.57 (C-13, д); 42.26 (C-14, c); 29.13 (С-15, т); 33.27 (С-16, т); 55.43 (С-17, с); 49.69a (С-18, д); 46.43 (C-19, д); 150.38 (C-20, c); 30.53 (С-21, т); 38.04 (С-22, т); 26.40 (С-23, к); 20.75 (С-24, к); 15.70 (C-25, к); 15.57 (С-26, к); 14.29 (С-27, к); 176.55 (C-28, c); 109.27 (С-29, т); 19.19 (С-30, к); 34.48 (C-31, т); 33.62 (C-32, с); (C-33, c); 176.22 (СООН, c).
Пример 2в. Получение N-[бетулоноил]-4-амино-бутановой кислоты
К раствору бетулоноилхлорида в CH2Cl2 после промывки водой, полученному согласно примеру 1, немедленно добавляют предварительно измельченный метиловый эфир γ-аминомасляной кислоты гидрохлорид (13.2 г, 86 ммоль) и Et3N (26 г, 35,8 мл 200 ммоль), (температура при прибавлении ≤10-15°С) при перемешивании и оставляют на ночь (10-14 час). Выделение эфироамида и его гидролиз проводят аналогично примеру 2а. После подкисления, промывки водой и осушки выделяют N-[бетулоноил]-4-амино-бутановую кислоту в виде белого порошка. Выход в расчете на исходную бетулоновую кислоту 83%.
ИК, ν/см-1: 1637 (CONH); 1707 (С=О); 3400 (NH).
ЯМР 1Н (400 МГц, CDCl3, δ, м.д., Гц): 0.90 (3Н, с, Ме-25), 0.94 (6Н, д, J=2.6 Hz, Ме-26, Ме-27), 0.99 (3Н, с, Ме-24), 1.04 (3Н, с, Ме-23), 1.66 (3Н, с, Ме-29), 1.77-1.96 (6Н, м, H-2'a, H-2'b), 2.33-2.43 (4Н, м, Н-3'а, H-3'b), 3.01 (1H, ддд, J1=J2=11.4, J3=3.4, Н-19), 3.31 (2Н, м, H-1'a, Н-1'b), 4.57 (1Н, y.c., Н-29), 4.71 (1H, y.c., Н-29), 5.86 (1Н, дд, J1=J2=6.1, -NH).
ЯМР 13С (100 МГц, CDCl3, δ, м.д., Гц): 38.31 (С-1, т); 34.01 (С-2, т); 218.40 (С-3, с); 47.22 (С-4, с); 54.86 (С-5, д); 19.49 (С-6, т); 33.54 (С-7, т); 40.54 (С-8, с); 49.9 (С-9, д); 36.77 (С10, с); 21.32 (С-11, т); 25.46 (С-12, т); 37.64 (С-13, д); 42.38 (С-14, с); 29.31 (С-15, т); 31.48 (С-16, т); 55.52 (С-17, с); 49.84 (С-18, д); 46.48 (С-19, д); 150.6 (С-20, с); 30.68 (С-21, т); 36.77 (С-22, т); 26.46 (С-23, к); 20.88 (С-24, к); 15.77 (С-25, к); 15.82 (С-26, к); 14.42 (С-27, к); 177.35 (С-28, с); 109.34 (С-29, т); 19.34 (С-30, к); 39.49 (С-31, т); 24.88 (С-32, т); 38.45 (С-33, т); 176.90 (СООН).
![Способ получения N-[3-оксо-20(29)лупен-28-оил]-ω-аминокислот](https://fips.edrid.ru/images/rid/d9/6f/a6/327f506ff93dfd232c1549e9b22c14e6.png)
![Способ получения N-[3-оксо-20(29)лупен-28-оил]-ω-аминокислот](https://fips.edrid.ru/images/rid/d9/6f/a6/bdeec779cd75ce677ece054fd4b70724.jpg)
![Способ получения N-[3-оксо-20(29)лупен-28-оил]-ω-аминокислот](https://fips.edrid.ru/images/rid/d9/6f/a6/9bbe766ac973fa21c81fda07cdeb9b14.jpg)

