Результат интеллектуальной деятельности: Способ терапевтического лечения острого нарушения мозгового кровообращения - инсульта по ишемическому типу в бассейне сонных артерий
Вид РИД
Изобретение
Изобретение относится к области медицины и может быть использовано для эффективного терапевтического лечения острого нарушения мозгового кровообращения - инсульта по ишемическому типу в бассейне сонных артерий в острый период.
Из уровня техники широко известны различные, в том числе и инъекционные, лекарственные средства для лечения ишемического инсульта (Регистр лекарственных средств России. Энциклопедия лекарств. М.: «РЛС-2006», вып. 14, с. 489-490; RU 2330680 C1, А61К 38/05, 2008; RU 2385722 С2, А61К 31/44, 2010; RU 2554500 С2, А61К 31/122, 2015). Основным недостатком известных лекарственных средств является наличие различных побочных действий, что ограничивает их терапевтическую эффективность.
Технический результат, на получение которого направлено изобретение, заключается в создании эффективного терапевтического способа лечения острого нарушения мозгового кровообращения - инсульта по ишемическому типу в бассейне сонных артерий в острый период без заметных побочных эффектов.
Решение поставленной задачи с достижением заявленного технического результата обеспечивается тем, что в способе терапевтического лечения острого нарушения мозгового кровообращения - инсульта по ишемическому типу в бассейне сонных артерий, включающий введение пациенту лекарственного средства, отличающийся тем, что в острый период в первые 48 часов от начала развития инсульта пациенту вводят лекарственное средство в виде энергетически обработанной жидкой субстанции, полученной путем пропускания электрического тока под действием разности потенциалов, приложенной к помещенным в исходный жидкий нейтральный носитель токовым электродам, которая пропорциональна разности биоэлектрических потенциалов, зарегистрированных - отведенных с различных точек головного мозга - поверхности кожи головы, и дополнительно активированной в процессе последовательного многократного разведения в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения по гомеопатической технологии.
Предпочтительно, заявленное лекарственное средство вводят в организм пациента в течение, по меньшей мере, 14 дней.
При этом в качестве исходного - первоначального жидкого нейтрального носителя используют дистиллированную или очищенную - особо чистую воду или водно-спиртовой раствор с удельной электрической проводимостью при 25°С не более 0,1 мСм/м или активированный - потенцированный носитель, содержащий дистиллированную или очищенную - особо чистую воду или водно-спиртовой раствор с удельной электрической проводимостью при 25°С не более 0,1 мСм/м, который обработан в процессе последовательного многократного разведения в водном или водно-спиртовом растворителе в сочетании с промежуточным внешним воздействием по гомеопатической технологии.
При этом разность потенциалов, приложенная к помещенным в исходный жидкий нейтральный носитель токовым электродам, пропорциональна по амплитуде разности биоэлектрических потенциалов референтного отведения, образованного активным электродом, расположенным на поверхности кожи головы и референтным электродом, расположенным на мочке уха.
Предпочтительно, энергетическую обработку исходного нейтрального носителя осуществляют путем пропускания электрического тока под действием разности потенциалов, приложенной к помещенным в исходный жидкий нейтральный носитель двум токовым электродам, которая пропорциональна по амплитуде объединенной суммарной или усредненной усиленной разности биоэлектрических потенциалов индивидуальных референтных отведений, отведенных с различных точек поверхности кожи головы пациента и/или поверхности кожи головы одного или нескольких доноров и зарегистрированных в вид электроэнцефалограммы.
Кроме того, для заявленного терапевтического лечения острого нарушения мозгового кровообращения - инсульта по ишемическому типу в бассейне сонных артерий в острый период используют жидкую форму лекарственного средства в виде энергетически обработанной активированной субстанции, приготовленной в виде смеси различных, предпочтительно, сотенных гомеопатических разведений.
Как вариант, заявленное лекарственное средство может быть выполнено и в твердой форме (в виде порошка, гранул или таблеток), которая содержит технологически необходимое (эффективное) количество нейтрального носителя, например, лактозы, насыщенного путем пропитывания до насыщения, жидкой формой активированного энергетически обработанного носителя, и фармацевтически приемлемые добавки, включающие, например, лактозу, целлюлозу микрокристаллическую и магния стеарат.
Заявленное оральное введение пациенту в острый период в первые 48 часов от начала развития инсульта в качестве лекарственного средства энергетически обработанной жидкой субстанции, приготовленной путем пропускания электрического тока под действием разности потенциалов, приложенной к помещенным в исходный жидкий нейтральный носитель токовым электродам, которая пропорциональна разности биоэлектрических потенциалов, зарегистрированных - отведенных с различных точек головного мозга - поверхности кожи головы, активированной в процессе последовательного многократного разведения в водном или водно-спиртовом растворителе в сочетании с последовательным вертикальным встряхиванием каждого разведения по гомеопатической технологии жидкого носителя, и дополнительно активированной в процессе последовательного многократного разведения в водном или водно-спиртовом растворителе в сочетании с промежуточным встряхиванием каждого разведения по гомеопатической технологии, обеспечивает клинически подтвержденное эффективное лечение острого нарушения мозгового кровообращения - инсульта по ишемическому типу в бассейне сонных артерий, сопровождающееся существенным повышением функциональной дееспособности, значительным уменьшением тревожно-депрессивных расстройств и сокращением сроков восстановления. Кроме того, энергетически обработанной жидкой субстанции, приготовленной путем пропускания электрического тока через жидкий нейтральный носитель (дистиллированную или очищенную - особо чистую воду или водно-спиртовой раствор с удельной электрической проводимостью при 25°С не более 0,1 мСм/м), который не содержит молекул токсических веществ, в сочетании с последующим активированием в виде многократного разведения в водном или водно-спиртовом нейтральном растворителе, например, для сотенных гомеопатических разведений С12 эквивалентно разведению в 10012 раз, априори безвреден и не оказывает побочных нежелательных эффектов, что подтверждено экспериментально.
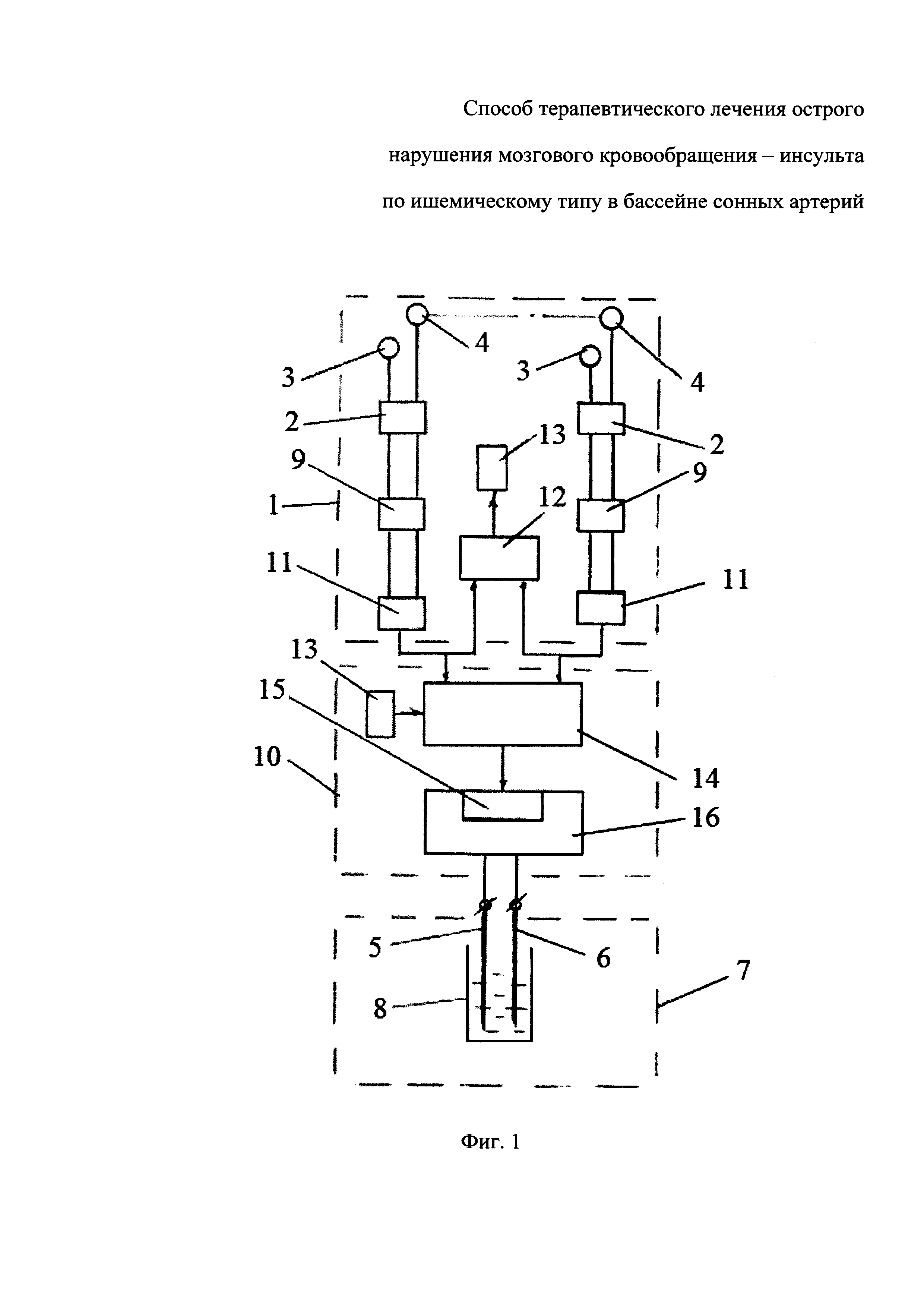
На чертеже представлен вариант блок-схемы устройства для получения лекарственного средства.
Устройство для получения заявленного лекарственного средства включает блок 1 регистрации биоэлектрических потенциалов головного мозга в виде электроэнцефалограммы, отображающей его биоэлектрическую активность, генерирующую в коре, блок 2 обработки информации и блок 3 энергетической обработки. При этом блок 1 регистрации электроэнцефалограммы содержит несколько канальных усилителей 4, на первый вход которых подключены регистрирующие активные электроды 5 референтных отведений, расположенные на различных точках поверхности кожи головы (над мозгом), а на второй вход - регистрирующий референтный (нулевой) электрод 6, расположенный на удалении от мозга (как правило, на мочке уха). При этом выходы каждого канального усилителя 4 по отдельности подсоединены к входам соответствующих аналого-цифровых преобразователей 7, цифровые выходы которых включены на вход программируемого блока 18 записи цифровой информации на электронный носитель 9. Блок 2 обработки информации включает программируемый блок 10 суммирования цифровых сигналов - сумматор, выполненный в виде микрокомпьютера, на вход которого вводят зарегистрированную цифровую информацию с выхода соответствующих аналого-цифровых преобразователей 7 блока 1 регистрации электроэнцефалограммы и/или цифровую информацию, зарегистрированную на индивидуальных файлах электронных носителей 9, а выход которого связан с входом цифро-аналогового преобразователя 11 генератора 12 сигналов произвольной формы, формирующего выходные сигналы в виде колебаний напряжения - разности потенциалов, аппроксимирующих форму колебаний суммарной разности зафиксированных биоэлектрических потенциалов. К аналоговому выходу генератора 12 сигналов произвольной формы с пиковым значением амплитуды выходного сигнала до 5-10 вольт подключены, по меньшей мере, два токовых электрода 13 и 14 блока 3 энергетической обработки, помещенным в емкость 15 с исходным нейтральным носителем, в качестве которого, предпочтительно, используют дистиллированную или очищенную - особо чистую воду или водно-спиртовой раствор с удельной электрической проводимость при 25°С не более 0,1 мСм/м. На выходе канальных усилителей 4 может быть включен полосовой низкочастотный фильтр 16 с прозрачностью (полосой пропускания) от 0, 5 до 35 Гц.
Регистрирующие активные электроды 5 референтных отведений и регистрирующий референтный (нулевой) электрод 6, могут быть выполнены в виде металлических пластин или стержней различной формы, преимущественно, используют чашечковые, пластинчатые, игольчатые электроды с диаметром контактной поверхности 0,4÷1,0 см, которые удерживаются на коже головы с помощью гелей, сеток или силиконового шлема-шапочки (в международных стандартах рекомендуются чашечковые хлор-серебряные электроды).
Лекарственное средство для заявленного способа терапевтического лечения острого нарушения мозгового кровообращения - инсульта ишемическому типу в бассейне сонных артерий приготовляют следующим образом.
На первом этапе посредством индивидуальных референтных отведений регистрируют электроэнцефалограммы в виде индивидуальных разностей биоэлектрических потенциалов с различных точек поверхности кожи головы пациента, который во время исследования находится в свето- и звукоизолированном помещении в удобном кресле с закрытыми глазами, и/или по отдельности у различных, предпочтительно, здоровых доноров.
Для регистрации электроэнцефалограммы на голову пациента или донора, как правило, надевают специальную силиконовую или тканевую шапочку с присоединенными к ней электродами, регистрирующими электрическую активность в разных точках головы, в виде референтных отведений, поступающих на вход многоканальных усилителей блока 1 регистрации электроэнцефалограммы. Предпочтительно, используют, согласно применяемой в клинической практике Международной Системе 10-20, 19 равномерно распределенных по поверхности головы регистрирующих активных электродов 5, и один референтный электрод 6, расположенный на удалении от мозга, как правило, на мочке уха (или два, закороченных между собой референтных электрода 6, расположенных на мочках ушей). При этом на первый вход каждого из канальных усилителей 4 подают потенциалы референтных отведений с регистрирующих активных электродов 5, расположенных на различных точках поверхности кожи головы (над мозгом) пациента и/или донора, а второй вход соединяют с регистрирующим референтным (нулевым) электродом 6. Усиленные потенциалы по каждому каналу отведений с выходов каждого канального усилителя 4 по отдельности фильтруют посредством полосового низкочастотного фильтра 16 с прозрачностью (полосой пропускания) от 0, 5 до 35 Гц и направляют к входам соответствующих аналого-цифровых преобразователей 7, где аналоговые сигналы преобразуются в цифровую форму, и направляют индивидуальные цифровые файлы с оцифрованными в дискретный код цифровыми сигналами индивидуальных разностей потенциалов в память программируемого блока 8 для записи на электронные носители 9. Регистрацию индивидуальных электроэнцефалограмма производят в течение 5÷10 минут.
На втором этапе в память программируемого блока 10 суммирования цифровых сигналов - сумматора, выполненного на базе миникомпьютера, блока 2 обработки информации вводят индивидуальную информацию пациента и/или доноров, предварительно зарегистрированную на электронных носителях 9 и/или цифровую информации с выходов аналого-цифровых преобразователей 7, и производят суммирования цифровых сигналов индивидуальной информации по заданной программе, которая обеспечивает возможность формирования выходного сигнала в виде комбинации различных индивидуальные цифровые файлы с индивидуальными разностями потенциалов различных электроэнцефалограмма, зарегистрированных у различных людей (пациента или доноров), или их отдельных участков (фрагментов). С выхода программируемого блока 10 суммирования цифровых сигналов - сумматора, объединенный суммарный цифровой сигнал, отображающий объединенную суммарную разность потенциалов индивидульных референтных отведений пациента и/или доноров, поступает на вход цифро-аналогового преобразователя 11 генератора 12 сигналов произвольной формы, где суммарный цифровой сигнал преобразуется в аналоговый результирующий сигнал и происходит формирование усиленного выходного сигнала в виде колебаний напряжения - разности потенциалов, аппроксимирующих форму колебаний, пропорциональных по амплитуде объединенной суммарной разности зафиксированных биоэлектрических потенциалов индивидуальных референтных отведений пациента и/или нескольких доноров. Усиленный выходной сигнал с выхода генератора 12 сигналов произвольной формы поступают на токовые электроды 13 и 14 блока 3 энергетической обработки, помещенные в емкость 15 с исходным нейтральным носителем.
Под действием разности потенциалов, приложенной к токовым электродам 13 и 14, в исходном нейтральном носителе, в качестве которого используют, преимущественно дистиллированную или очищенную - особо чистую воду с удельной электрической проводимость при 25°С не более 0,1 мСм/м, протекает электрический ток, осуществляя энергетическую обработку исходного нейтрального носителя.
Указанную энергетическую обработку исходного нейтрального носителя производят, предпочтительно, в течение 5÷10 минут.
На конечном этапе полученную промежуточную жидкую субстанцию в виде энергетически обработанного нейтрального носителя дополнительно активируют путем последовательного многократного разведения в нейтральном водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения по гомеопатической технологии (см., например, В. Швабе "Гомеопатические лекарственные средства", М., 1967 г., с. 14-29 или Г. Келлер, Гомеопатия, М.: Медицина, 2000, ч. 1, с. 37-40; RU 2500426; US 7,229,648; US 4,311,897).
При этом производят последовательное разведения 1 части каждого подвергаемого разведению энергетически обработанного раствора, начиная с первоначально полученной промежуточной энергетически обработанной жидкой субстанции, в 9 частях (для десятичного разведения D по гомеопатической шкале) или в 99 частях (для сотенного разведения С) или в 999 частях (для тысячного разведения М) нейтрального растворителя (предпочтительно, начальные разведения на 10÷15% водном растворе этилового спирта и конечные разведения на дистиллированной воде) в сочетании с промежуточным внешним воздействием - многократным вертикальным встряхиванием (потенцированием, или "динамизацией") каждого полученного разведения и использованием одной или отдельных емкостей для каждого последующего разведения до получения требуемой потенции - кратности разведения активированной - потенцированной формы энергетически обработанной жидкой субстанции по гомеопатическому методу.
Например, для приготовления 12-го сотенного разведения С12 одну часть первоначально полученной промежуточной энергетически обработанной жидкой субстанции, разводят в 99 частях водно-спиртового растворителя и многократно (10 и более раз), предпочтительно, вертикально встряхивают - потенцируют, получая 1-е сотенное С1 разведение. Из 1-го сотенного С1 разведения приготовляют 2-ое сотенное разведение С2. Данную операцию повторяют 11 раз, получая 12-е сотенное разведение С12, при этом конечные разведения выполняют на дистиллированной воде. Таким образом, 12-е сотенное разведение С12 представляет собой водного раствор, полученный разбавлением последовательно 12 раз в разных емкостях 1-ой части исходного матричного раствора в 99-ти частях нейтрального растворителя, т.е. раствор, полученный разведением первоначально полученной промежуточной энергетически обработанной жидкой субстанции в 10012 раз. Аналогичные операции с соответствующей кратностью разведения проводят для получения других разведений, например, С30, С50, С200 и т.д.
Предпочтительно, для лекарственного средства в соответствии с заявленным способом терапевтического лечения острого нарушения мозгового кровообращения - инсульта использование активированной формы энергетически обработанной жидкой субстанции в сотенном разведении С200.
Возможно, использование в качестве лекарственного средства активированной формы энергетически обработанной жидкой субстанции в виде смеси различных, преимущественно сотенных, разведений. При этом каждое разведение (например, С12, С30, С50) приготовляют раздельно по описанной выше технологии до разведения на 3 разведения меньше, чем конечное (соответственно, до получения С9, С27, С47), и затем вносят в соответствии с составом смеси в одну емкость по одной части каждого компонента и смешивают с требуемым количеством растворителя (соответственно, с 97 частями для сотенного разведения). Далее полученную смесь последовательно дважды разводят в соотношении 1 к 100, потенцируя полученный раствор после каждого разведения, и получают активированную форму в сверхмалой дозе разведенной в 10012, 10030, 10050 раз, эквивалентной смеси сотенных разведений С12, С30, С50.
Возможно, использование активированной формы энергетически обработанной жидкой субстанции в виде смеси сочетаний других различных разведений, например, десятичных и/или сотенных, (D20, С30, С100; D10, С12, М30 или С12, С30, С200 и т.д.), приготовленных по гомеопатической технологии, эффективность которых определяют экспериментально.
При этом смеси различных разведений (например, С12, С30, С50) смешивают, преимущественно, в объемном соотношении 1:1:1 и используют в жидкой лекарственной форме.
Заявленное лекарственное средство может быть выполнено по известной технологии также и в твердой форме (в виде порошка, гранул или таблеток), которая содержит технологически необходимое (эффективное) количество твердого нейтрального носителя, например, лактозы, насыщенного путем пропитывания до насыщения жидкой формой активированного энергетически обработанного носителя, и фармацевтически приемлемые добавки, включающие, преимущественно, лактозу, целлюлозу микрокристаллическую и магния стеарат (см., например, RU 2309732 C1, А61К 9/20, 2007).
Пример 1
В открытом исследовании определяли эффективность улучшения функциональной дееспособности у пациентов при терапевтическом лечении острого нарушения мозгового кровообращения (ОНМК) по ишемическому типу в бассейне сонных артерий в остром периоде с использованием заявленного лекарственного средства, выполненного в виде водного раствора активированной формы энергетически обработанной жидкой субстанции в сверхмалой дозе, полученной путем активирования в процессе последовательного многократного сверхразведения энергетически обработанного нейтрального носителя (промежуточной энергетически обработанной жидкой субстанции) в нейтральном растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения в 100200 раз, эквивалентной сотенному гомеопатическому разведению С200. Энергетическую обработку осуществляли путем пропускания электрического тока под действием разности потенциалов, приложенной к электродам, помещенным в исходный нейтральный носитель (очищенную - особо чистую воду с удельной электрической проводимостью при 25°С не более 0,1 мСм/м), которая пропорциональна по амплитуде усиленному объединенному суммарному сигналу, образованному сложением результирующих сигналов - разностей биоэлектрических потенциалов индивидуальных референтных отведений, зарегистрированных у пяти различных здоровых доноров по Международной Системе 10-20, включающей 19 равномерно распределенных по поверхности кожи головы регистрирующих активных электродов и референтный электрод, расположенный на мочке уха.
В исследование были включены пациенты, находящиеся на лечении в стационаре, обоего пола, в возрасте от 40 до 75 лет с установленным диагнозом первичное ОНМК по ишемическому типу в бассейне сонных артерий в первые 48 часов от начала развития инсульта. В исследование приняли участие 16 пациентов. Количество мужчин и женщин было одинаковым. Средний возраст пациентов, включенных в исследование, составил 61,9 лет.
При исследовании проводился сбор жалоб и анамнеза, объективный осмотр. Врач оценивал состояние по шкале оценки тяжести инсульта NIHSS (National Institute of Health Stroke Scale) и модифицированной шкале Рэнкина (mRs). В исследование включались пациенты с тяжестью инсульта 13-21 баллов по шкале NIHSS (тяжелая степень тяжести), с функциональной дееспособностью 3-4 балла по шкале mRs. Регистрировалась сопутствующая терапия, проводилась оценка изменений картины КТ/МРТ головного мозга (объем и локализация ишемического очага). Прием заявленного лекарственного средства продолжался в течение 14 дней (острый период).
В ходе визита 1 (День 1) и визита 2 (неделя 2±3 дня) врач проводил сбор жалоб, регистрировал данные объективного осмотра, осуществлял контроль назначенной и сопутствующей терапии, оценивал безопасность проводимого лечения, степень приверженности пациента исследуемой терапии (комплаентность); врач заполнял шкалу mRs, оценивал нарушение равновесия по шкале баланса Берга (the Berg Balance Scale, BBS). Пациент заполнял шкалы МоСа, HADS, оценки качества жизни, связанного с инсультом (Stroke Specific Quality of Life Scale, SS-QOL).
В результате лечения было показано статистически значимое улучшение основных показателей эффективности лечения ОНМК (Таблица 1).
Наряду с регрессом неврологической симптоматики, отмечалось повышение функциональной дееспособности пациентов по шкале mRs в 1,5 раза (с 4,1 до 2,6 баллов). У пациентов значимо улучшались координационные функции (с 2,2 до 36,9 баллов по шкале баланса Берга). На фоне лечения произошло уменьшение когнитивных нарушений (с 17,3 до 23,4 баллов по шкале МоСа), и выраженности тревожно-депрессивных расстройств (уменьшение среднего балла по шкале HADS с 23,6 до 14,9). На фоне положительной динамики основных проявлений ОНМК, наблюдалось улучшение качества жизни, связанного с инсультом.
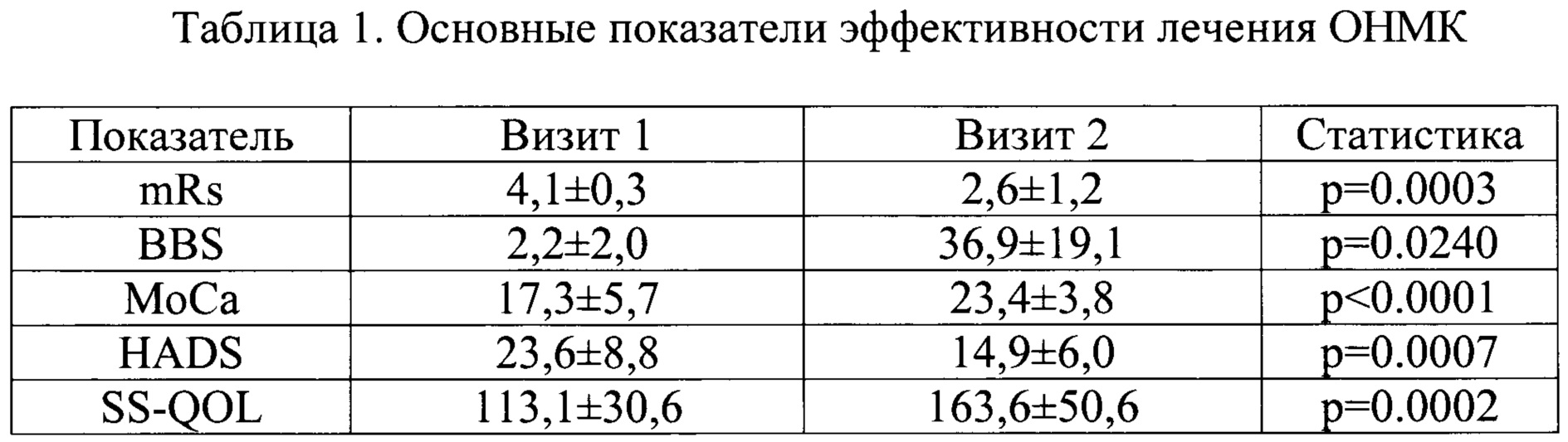
Анализ долей пациентов с улучшением функциональной дееспособности, приведенный в Таблица 2, показал, что у четверти пациентов, получавших лечение заявленным лекарственным средством, через 2 недели симптомы функциональной дееспособности либо отсутствовали либо были незначительными (0-1 балла по шкале mRs), а у 62,5% пациентов к концу лечения не регистрировались симптомы функциональной дееспособности выше средней степени. Когнитивные нарушения, после двух недель лечения отсутствовали у 37,5% пациентов.

Данные известных рандомизированных клинических исследований препаратов для лечения инсульта демонстрируют сравнимые результаты.
В исследовании применения цитиколина при остром инсульте хорошее восстановление (0-1 балл по шкале mRs) отмечалось у 26% больных, принимавших препарат. Следует отметить, что в данном исследовании длительность терапии составила 12 недель [Clark WM, Wechsler LR, Sabounjian LA, Schwiderski UE. Citicoline Stroke Study Group. A phase III randomized efficacy trial of 2000 mg citicoline in acute ischemic stroke patients. Neurology, 2001, 57: 1595-1602.].
В исследовании десмотеплазы при ОНМК было показано, что в группе препарата уровня восстановления до 0-2 баллов по шкале mRs достигли 48.9% пациентов через 90 дней от дебюта ОНМК [Desmoteplase 3 to 9 Hours After Major Artery Occlusion Stroke: The DIAS-4 Trial (Efficacy and Safety Study of Desmoteplase to Treat Acute Ischemic Stroke. von Kummer R1, Mori E2, Truelsen T2, Jensen JS2,  BA2, Fiebach JB2, Lovblad KO2, Pedraza S2, Romero JM2, Chabriat H2, Chang KC2,
BA2, Fiebach JB2, Lovblad KO2, Pedraza S2, Romero JM2, Chabriat H2, Chang KC2,  A2, Ford GA2, Grotta J2, Kaste M2, Schwamm LH2, Shuaib A2, Albers GW2; DIAS-4 Investigators.Stroke. 2016 Dec; 47(12): 2880-2887. Epub 2016 Nov 1].
A2, Ford GA2, Grotta J2, Kaste M2, Schwamm LH2, Shuaib A2, Albers GW2; DIAS-4 Investigators.Stroke. 2016 Dec; 47(12): 2880-2887. Epub 2016 Nov 1].
Таким образом, применение заявленного лекарственного средства в остром периоде инсульта приводит к уменьшению неврологической симптоматики и улучшению функциональной дееспособности, сокращая сроки восстановления у пациентов перенесших острое нарушения мозгового кровообращения по ишемическому типу в бассейне сонных артерий.
Пример 2
Целью исследования явилось изучение хронической токсичности и безопасности при 6-ти месячном пероральном введении кроликам заявленного лекарственного средства, выполненного в виде водного раствора активированной формы энергетически обработанной жидкой субстанции в сверхмалой дозе, полученной путем активирования в процессе последовательного многократного сверхразведения энергетически обработанного нейтрального носителя (промежуточной энергетически обработанной жидкой субстанции) в нейтральном растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения в 100200 раз, эквивалентной сотенному гомеопатическому разведению С200. Энергетическую обработку осуществляли путем пропускания электрического тока под действием разности потенциалов, приложенной к электродам, помещенным в исходный нейтральный носитель (очищенную - особо чистую воду с удельной электрической проводимостью при 25°С не более 0,1 мСм/м.), которая пропорциональна по амплитуде усиленному объединенному суммарному сигналу, образованному сложением результирующих сигналов - разностей биоэлектрических потенциалов индивидуальных референтных отведений, зарегистрированных у пяти различных здоровых доноров по Международной Системе 10-20, включающей 19 равномерно распределенных по поверхности кожи головы регистрирующих активных электродов и референтный электрод, расположенный на мочке уха.
Задачи исследования:
1. Характеристика потенциального повреждающего действия заявленного лекарственного средства у кроликов при его длительном (6-месячном) введении;
2. Выявление наиболее чувствительных к действия заявленного лекарственного средства органов и систем организма при его длительном (6-месячном) введении;
3. Изучение влияния заявленного лекарственного средства на общее состояние, электрокардиограмму, биохимические и гематологические показатели кроликов по окончании 6ти месячного курса введения и 1-го месяца отмены;
4. Изучение зависимости повреждающих эффектов заявленного лекарственного средства на органы и системы от длительности введения;
5. Исследование возможности обратимости вызываемых изменений.
Материалы и методы исследования:
Эксперименты выполнены на половозрелых кроликах (самках и самцах) породы «Шиншилла». Перед началом введения заявленного лекарственного средства кроликов расформировывали, соответственно полу, на 2 группы: опытную и контрольную. Тестируемое лекарственное средство (опытной группе) и дистиллированная вода (контрольной группе), подавались ежедневно в форме питья в объеме 50 мл/кг. С этой целью данными веществами заполнялись поилки для животных.
В период проведения хронического эксперимента у кроликов оценивали общее состояние, поведение, клинические признаки интоксикации. Кроликов взвешивали еженедельно в течение всего исследования (7 месяцев). Через 1, 3, 6 месяцев введения препарата, а также через 1 месяц его отмены (7-й месяц исследования) оценивали частоту дыхания кроликов. По окончании 3х и 6-ти месяцев введения заявленного лекарственного средства, а также через один месяц после его отмены проводили гематологические и биохимические исследования. Кроме того, на 6-й и 7-й месяцы исследования записывали электрокардиограмму и проводили патоморфологическое изучение внутренних органов.
Результаты исследования:
Результаты исследования приведены в таблицах 1-21.
Таблица 1. Влияние заявленного лекарственного средства на динамику прироста массы тела кроликов-самок (кг, M±m).
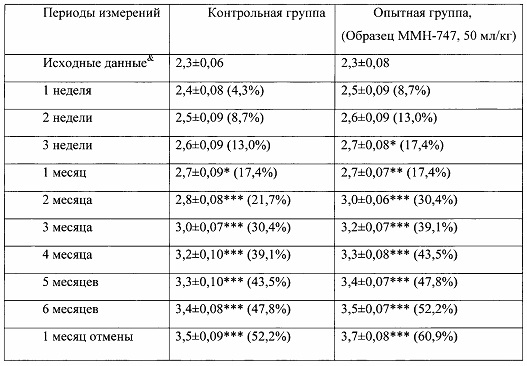
Примечание: *р<0,05, **р<0,01, ***р<0,001 различия статистически значимы по сравнению с исходными данными.
& - данные, зарегистрированные в первый день введения веществ;
Показатель прироста массы животных (%) рассчитан относительно исходных значений для соответствующей группы. (%)
Таблица 2. Влияние заявленного лекарственного средства на динамику прироста массы тела кроликов-самок (кг, M±m).
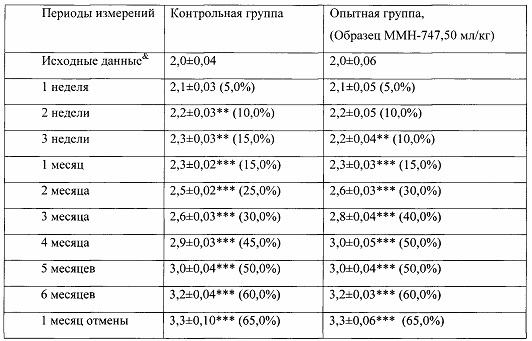
Примечание: *р<0,05, **р<0,01, ***р<0,001 различия статистически значимы по сравнению с исходными данными.
& - данные, зарегистрированные в первый день введения веществ;
Показатель прироста массы животных (%) рассчитан относительно исходных значений для соответствующей группы. (%)
Таблица 3. Влияние заявленного лекарственного средства по окончании его 6-месячного введения на электрокардиограмму кроликов (М±m)
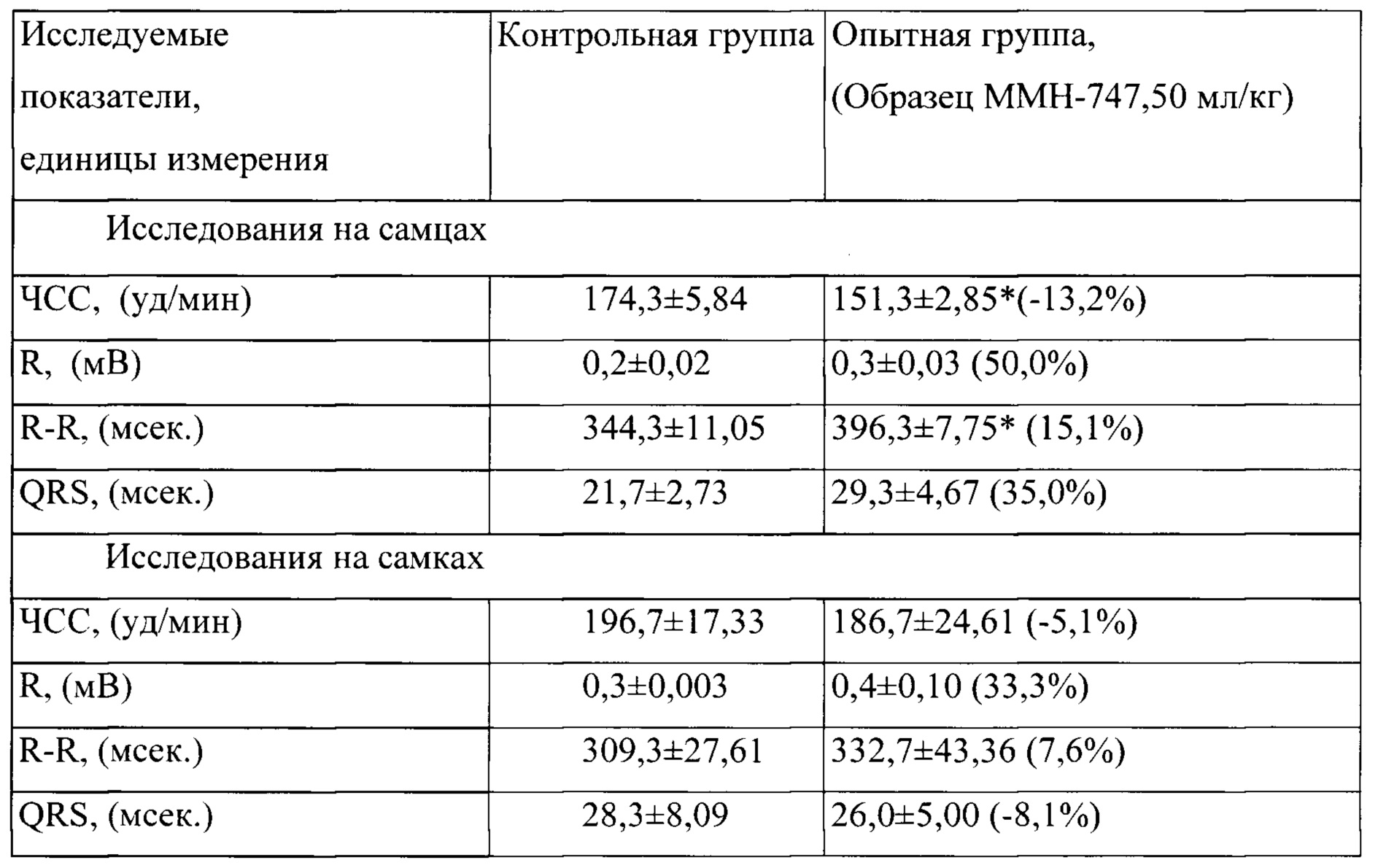
Примечание: *р<0,05 различия статистически значимы по сравнению с группой контроля;
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 4. Влияние заявленного лекарственного средства по окончании периода его отмены введения на электрокардиограмму кроликов (М±m)
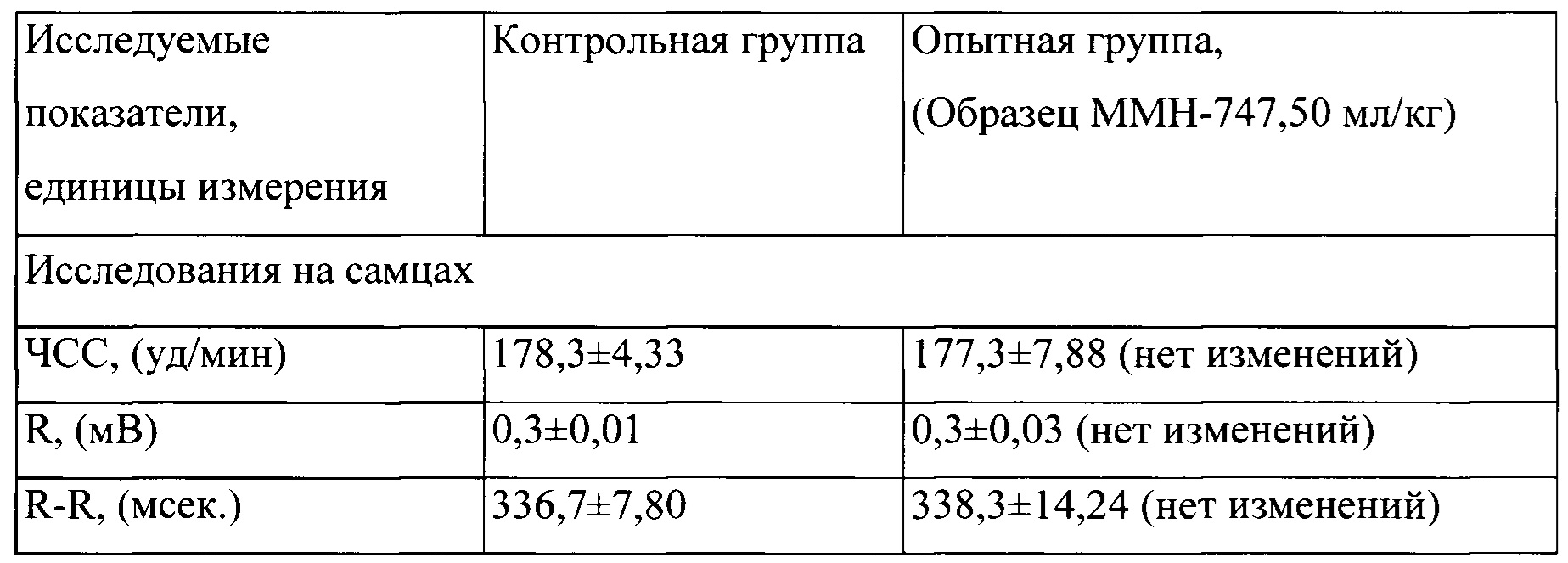
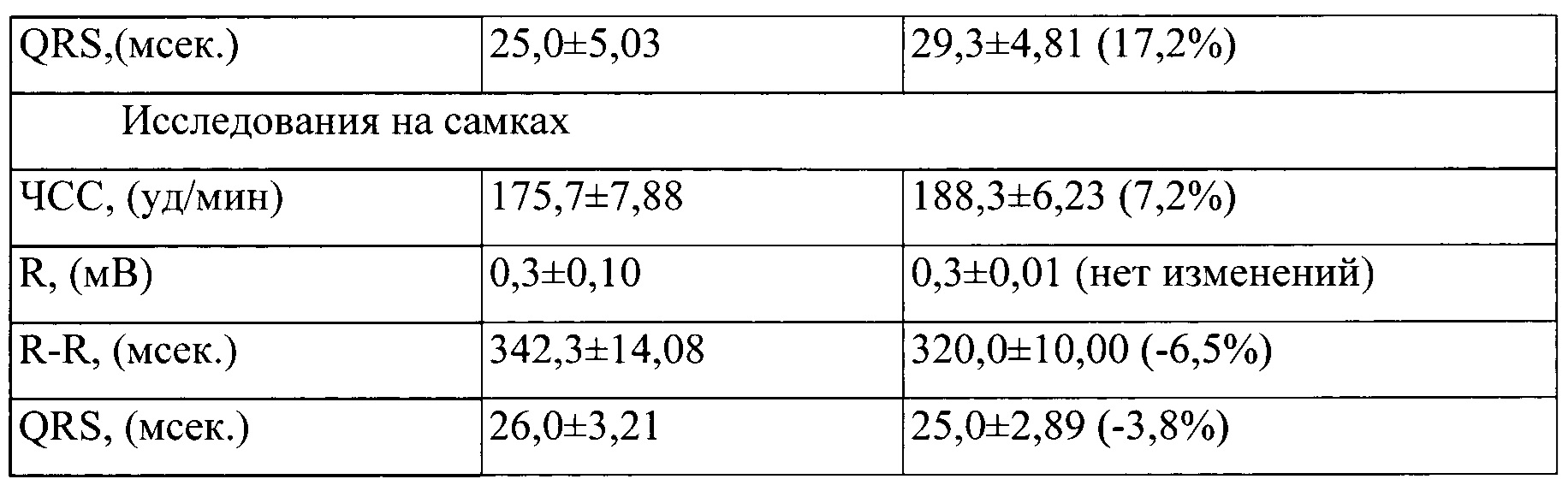
Примечание: *р<0,05 различия статистически значимы по сравнению с группой контроля;
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 5. Влияние заявленного лекарственного средства на частоту дыхания кроликов (М±m).
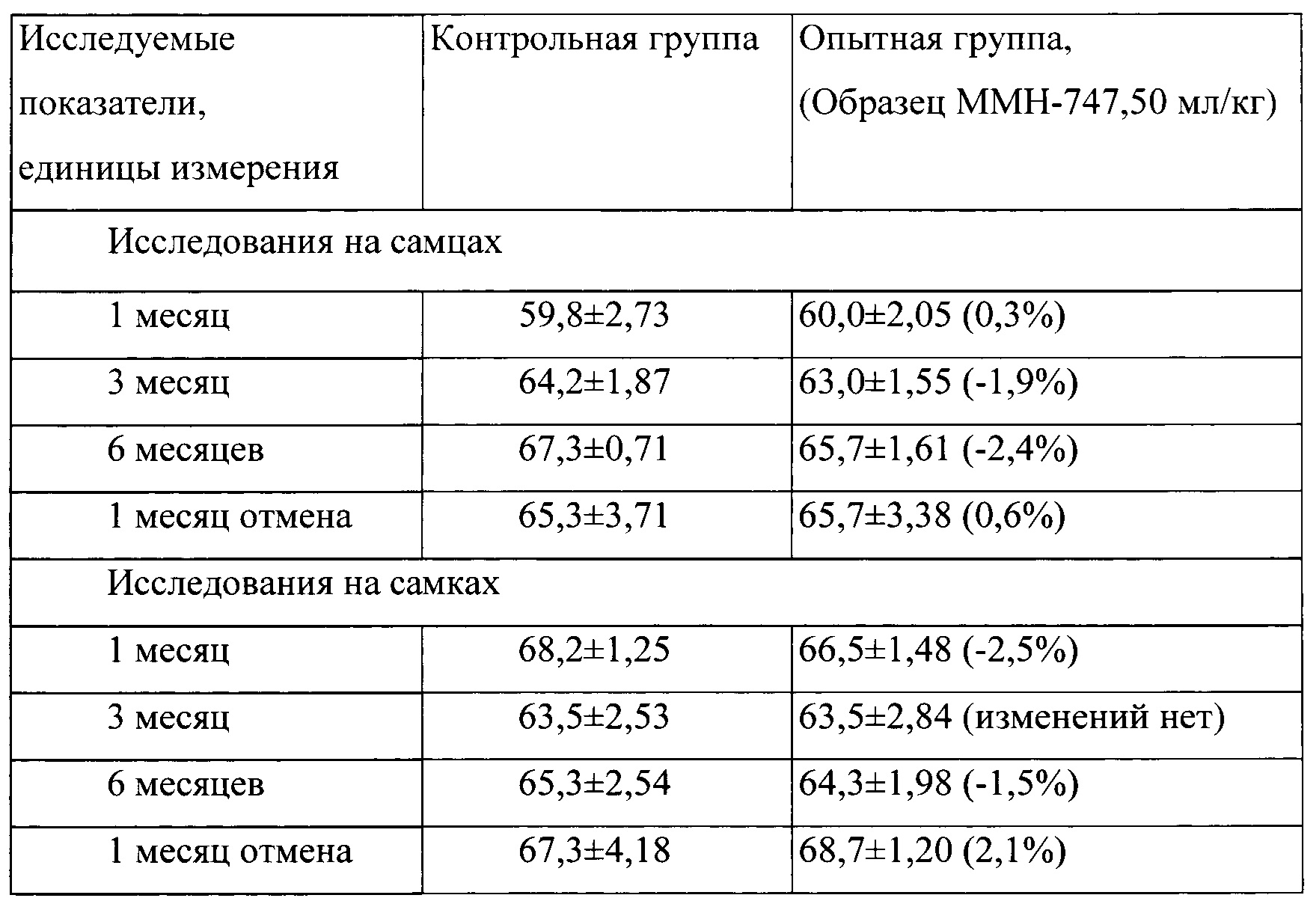
Примечание:
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 6. Влияние заявленного лекарственного средства по окончании 3хмесячного периода введения на показатели периферической крови кроликов-самцов (М±m).

Примечание: *р<0,05 различия статистически значимы по сравнению с группой контроля.
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 7. Влияние заявленного лекарственного средства по окончании 6тимесячного периода введения на показатели периферической крови кроликов-самцов (М±m).

Примечание:
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 8. Влияние заявленного лекарственного средства по окончании периода отмены введения на показатели периферической крови кроликов-самцов (М±m).
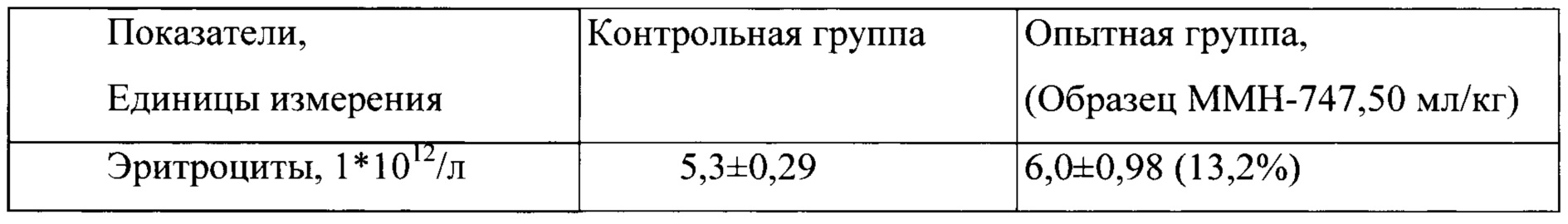
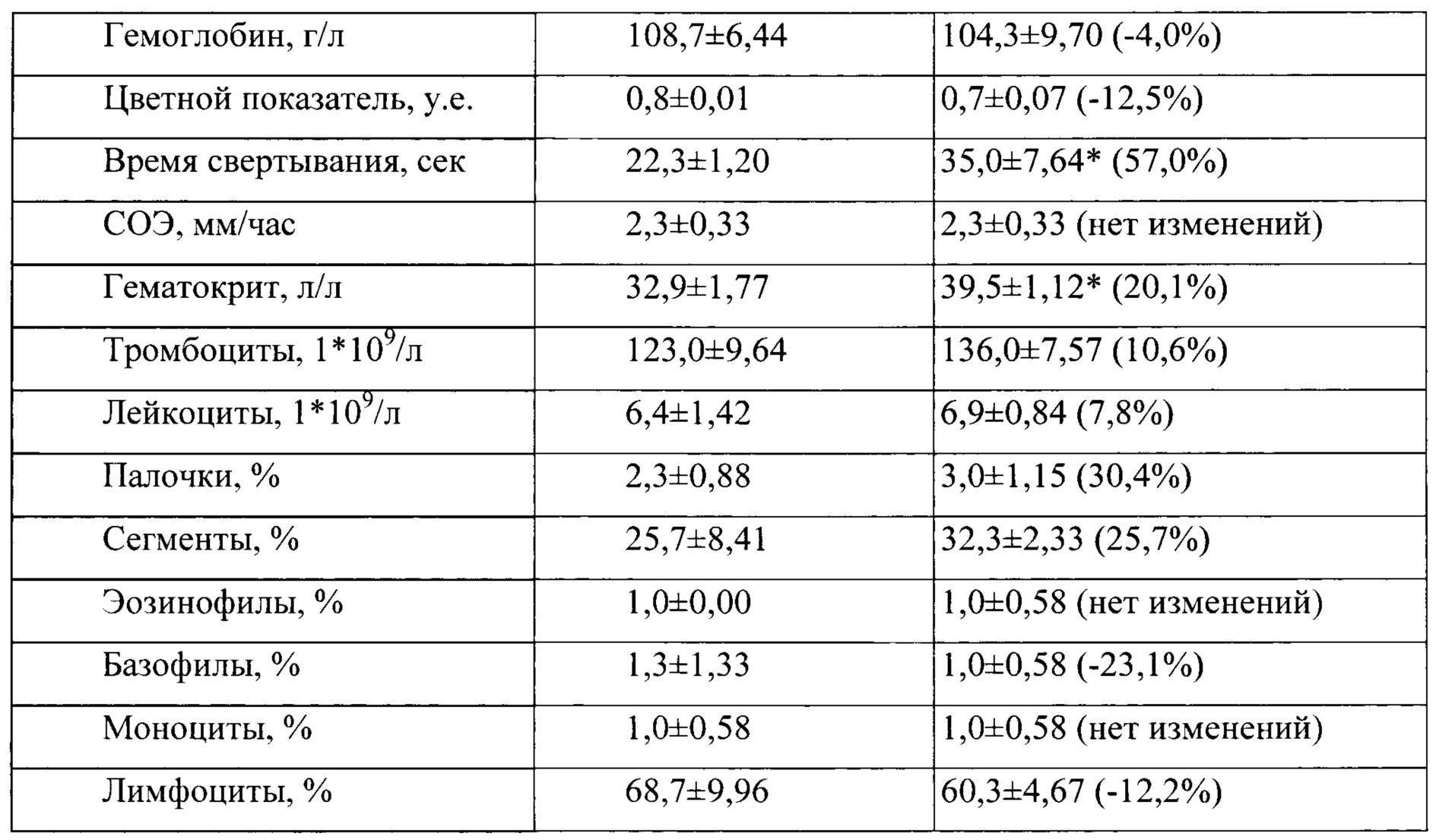
Примечание: *р<0,05 различия статистически значимы по сравнению с группой контроля. Разница между опытной и контрольной группами подсчитана в процентах (%)
Таблица 9. Влияние заявленного лекарственного средства по окончании 3хмесячного периода введения на показатели периферической крови кроликов-самок (М±m).
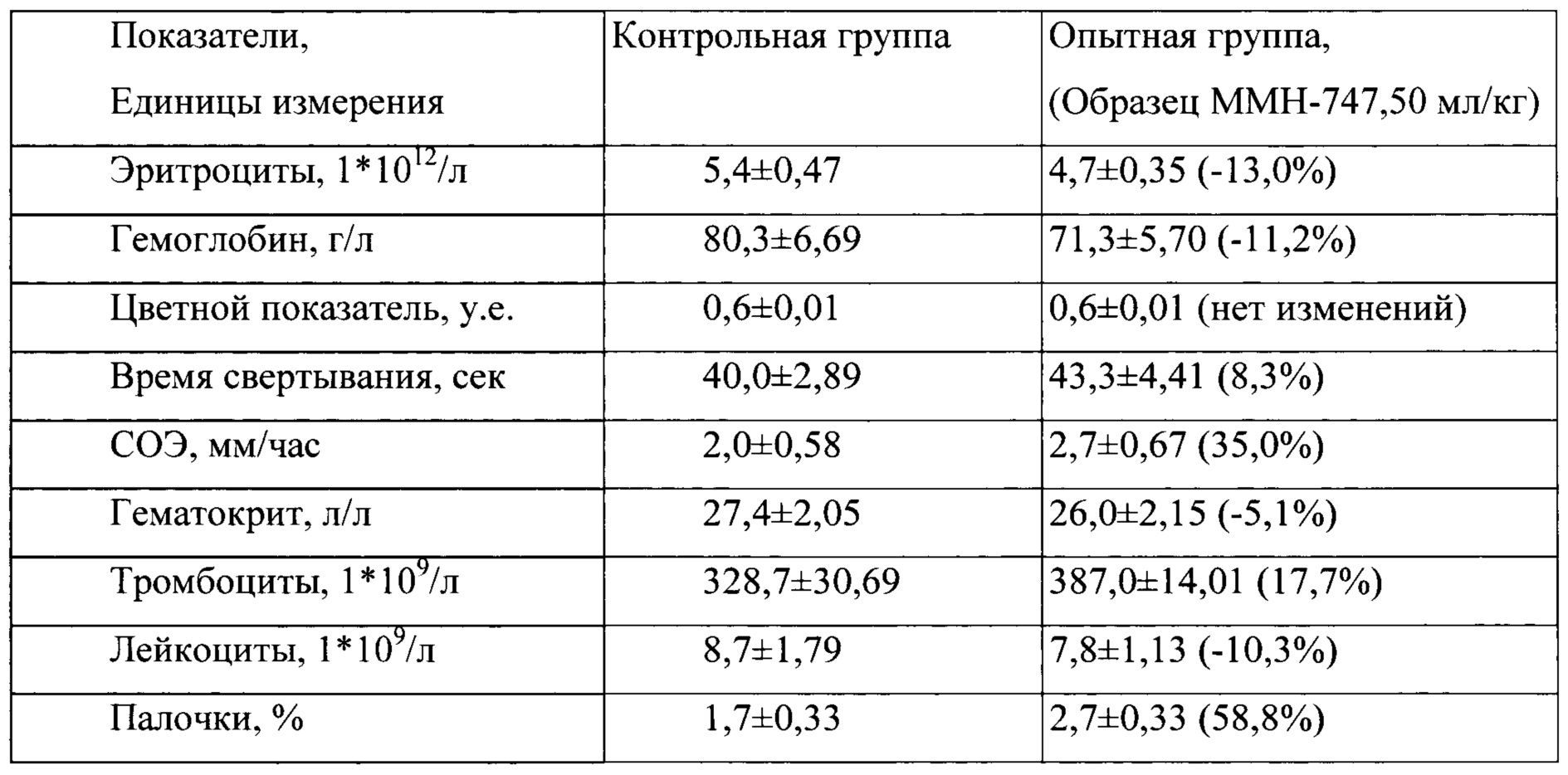
Примечание:
Разница между опытной и контрольной группами подсчитана в процентах (%).
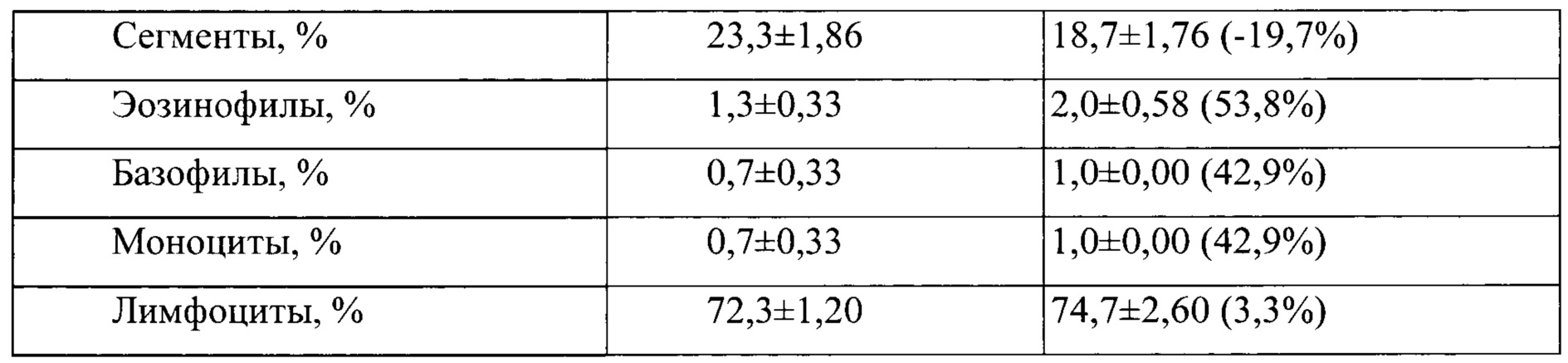
Таблица 10. Влияние заявленного лекарственного средства по окончании 6тимесячного периода введения на показатели периферической крови кроликов-самок (М±m).

Примечание: *р<0,05 различия статистически значимы по сравнению с группой контроля. Разница между опытной и контрольной группами подсчитана в процентах (%)
Таблица 11. Влияние заявленного лекарственного средства по окончании периода отмены введения периода введения на показатели периферической крови кроликов-самок (М±m).
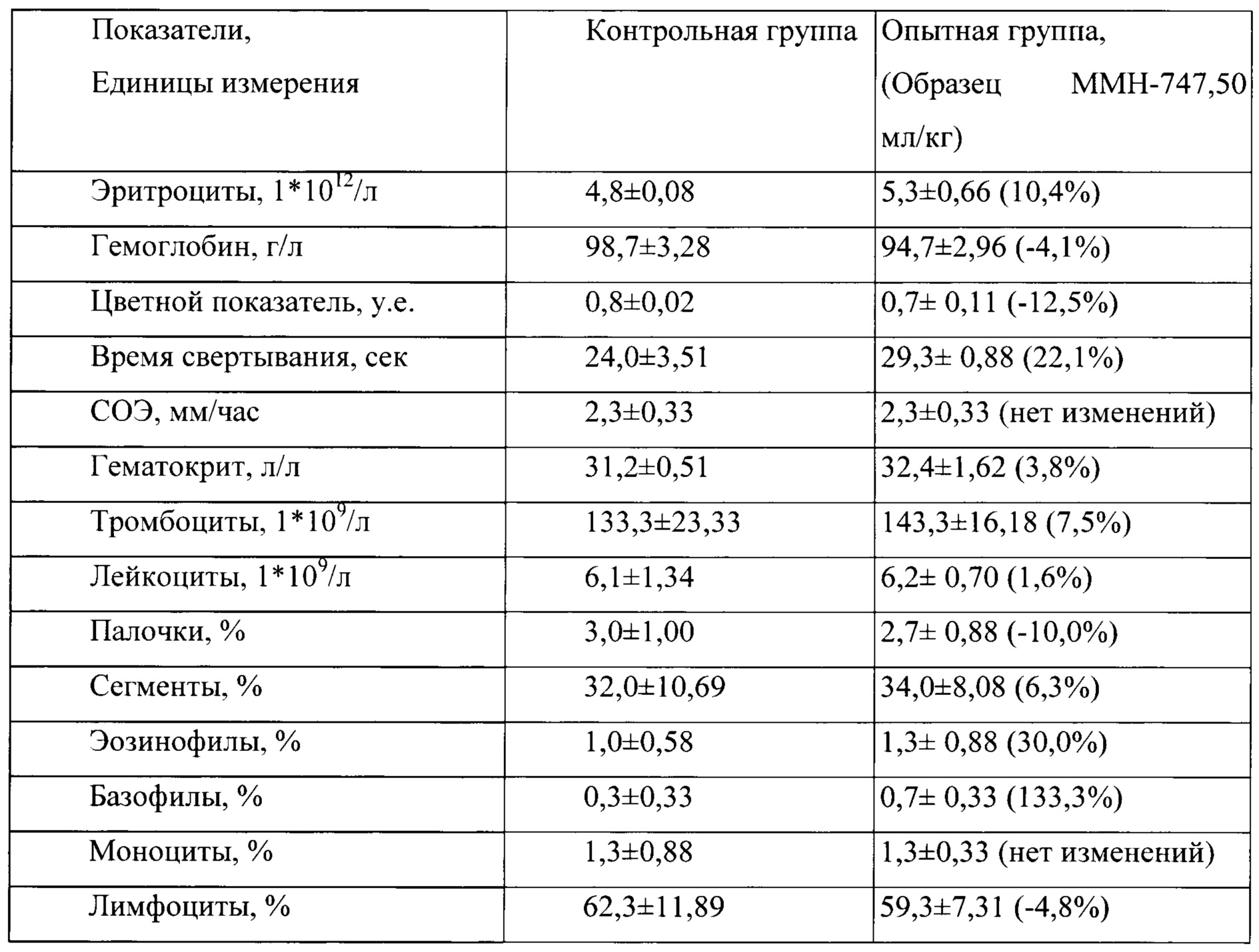
Примечание:
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 12. Влияние заявленного лекарственного средства по окончании 3хмесячного периода введения на биохимические показатели плазмы крови кроликов-самцов (М±m).
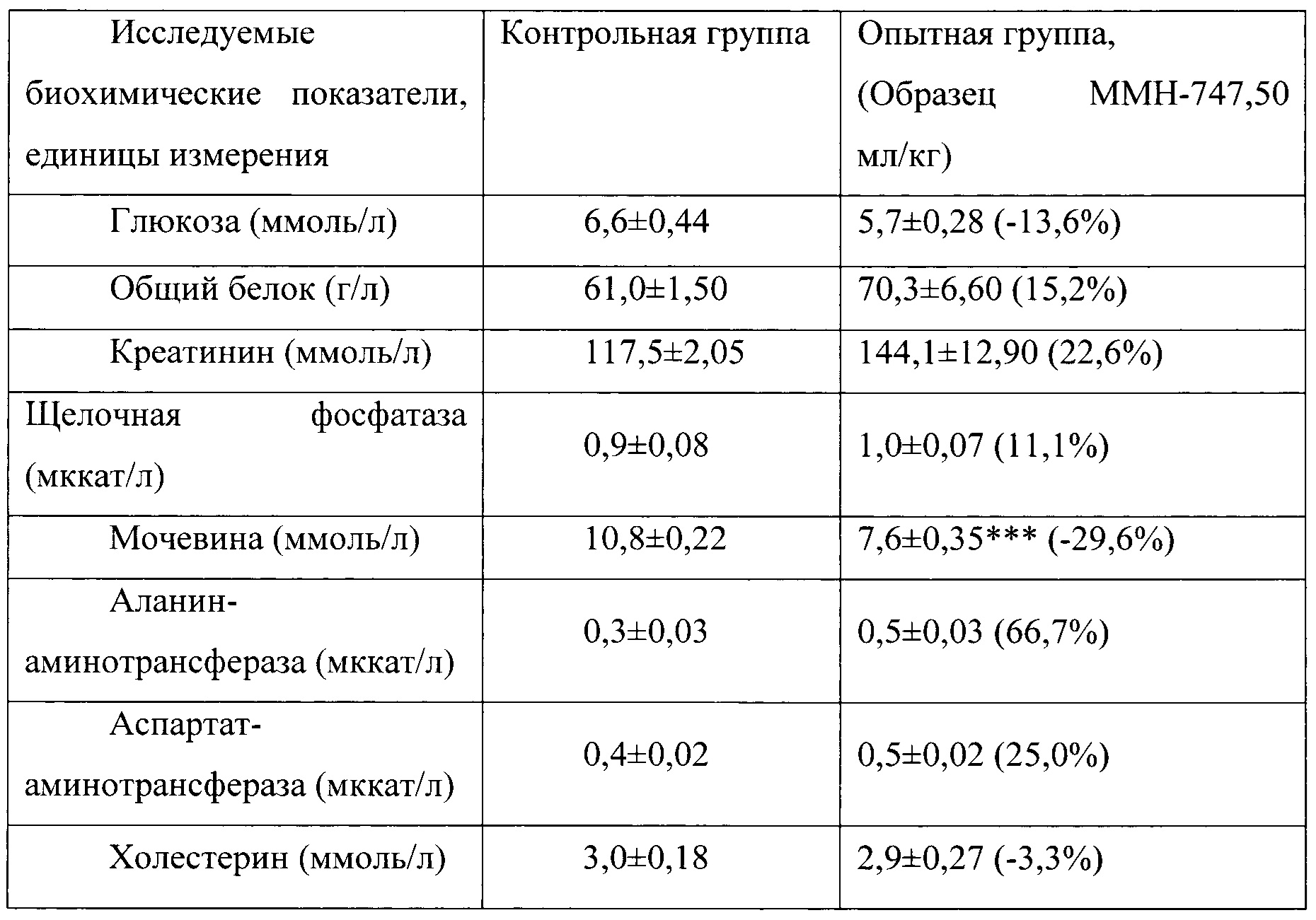
Примечание: ***р<0,001 различия статистически значимы по сравнению с группой контроля
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 13. Влияние заявленного лекарственного средства по окончании 6тимесячного периода введения на биохимические показатели плазмы крови кроликов-самцов (М±m).
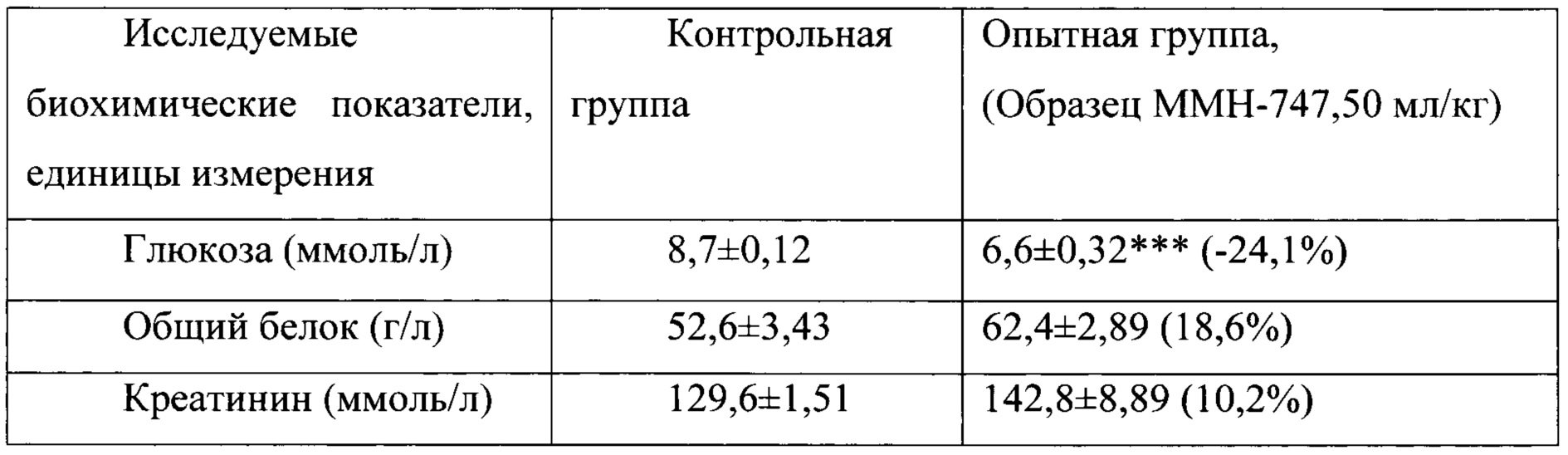
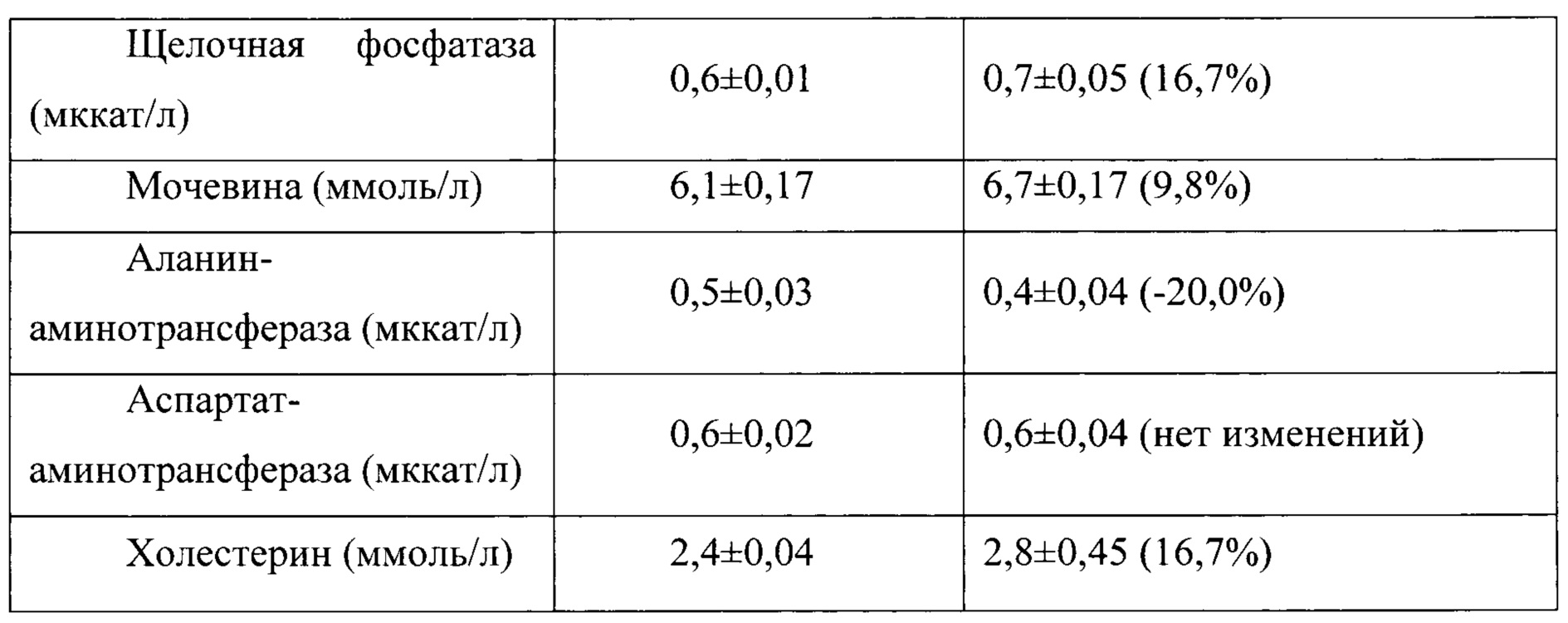
Примечание: ***р<0,001 различия статистически значимы по сравнению с группой контроля
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 14. Влияние заявленного лекарственного средства по окончании периода отмены введения на биохимические показатели плазмы крови кроликов-самцов (М±m).
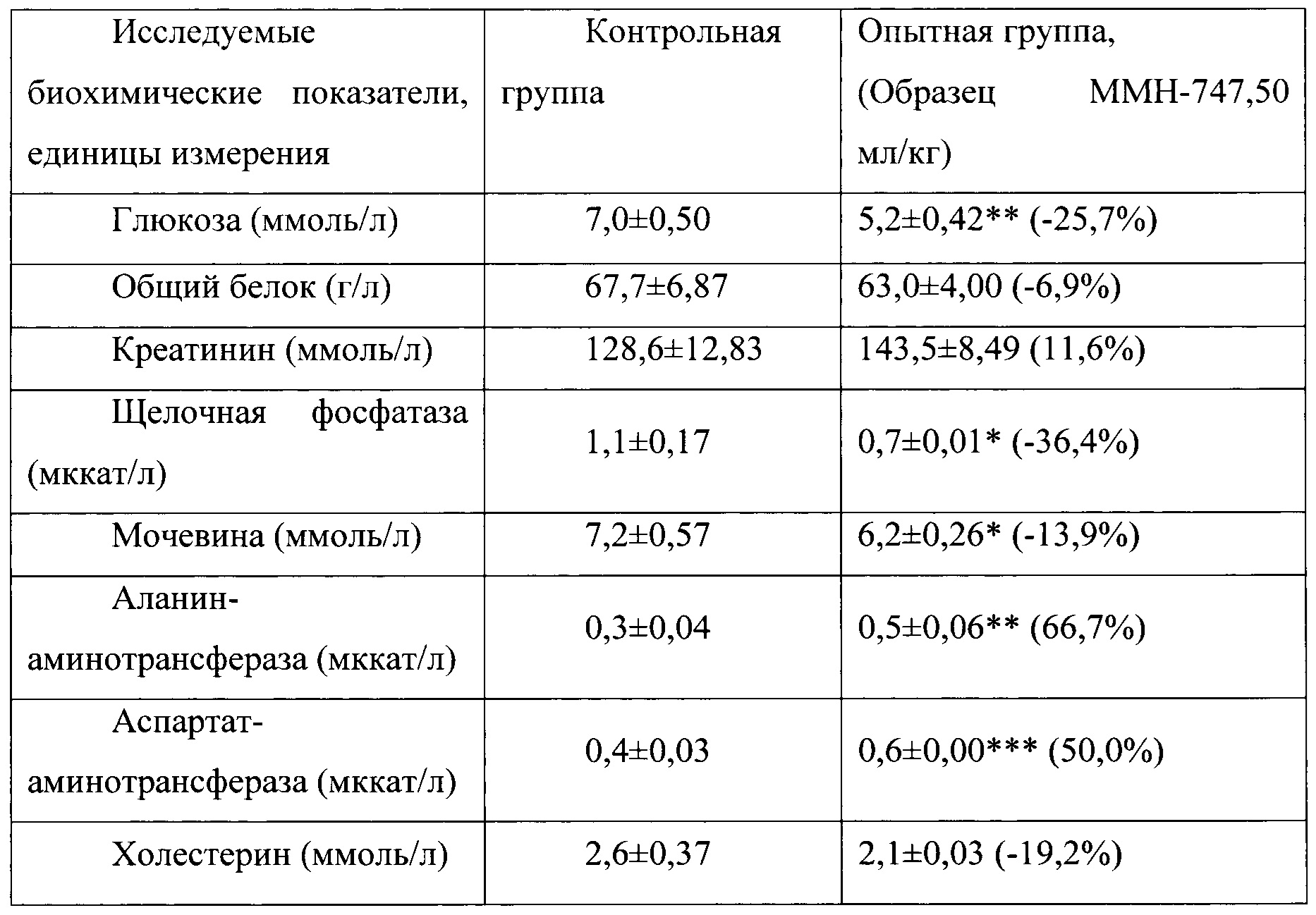
Примечание: *р<0,05; *р<0,01; ***р<0,001 различия статистически значимы по сравнению с группой контроля
Разница между опытными и соответствующими контрольными группами подсчитана в процентах (%).
Таблица 15. Влияние заявленного лекарственного средства по окончании 3хмесячного периода введения на биохимические показатели плазмы крови кроликов-самок (М±m).
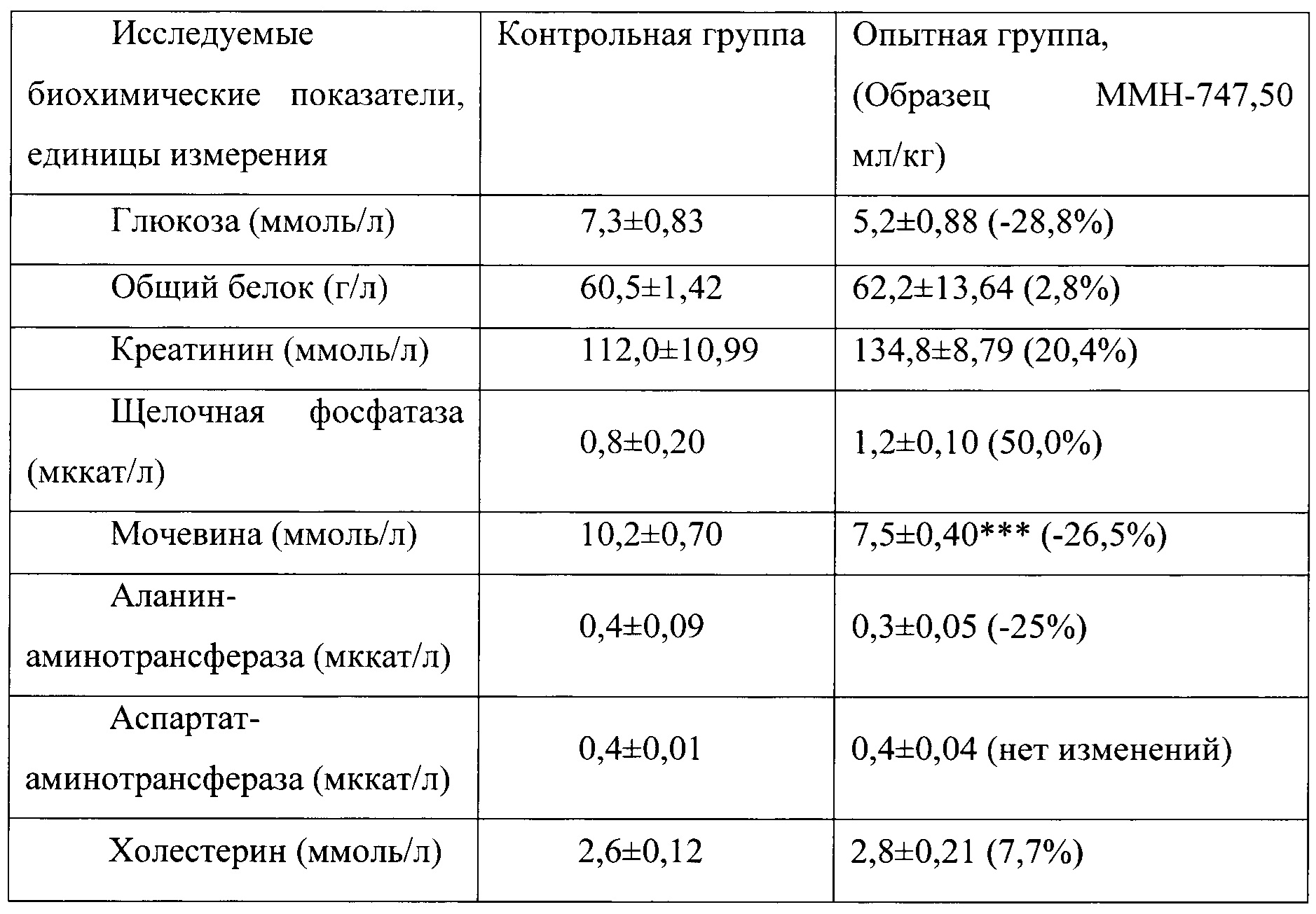
Примечание: ***р<0,001 различия статистически значимы по сравнению с группой контроля
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 16. Влияние заявленного лекарственного средства по окончании 6тимесячного периода введения на биохимические показатели плазмы крови кроликов-самок (М±m).
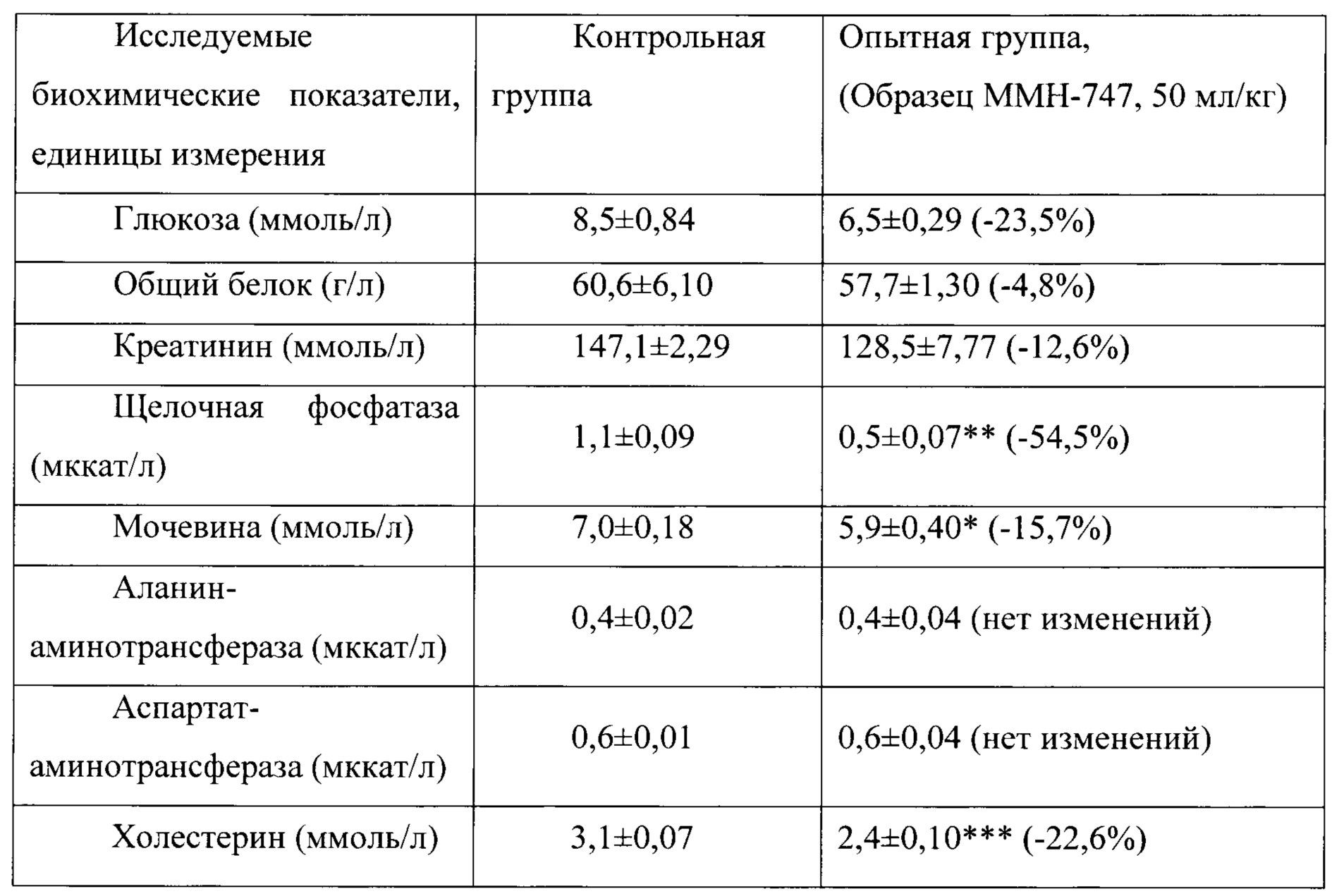
Примечание: *р<0,05; **р<0,01; ***р<0,001 различия статистически значимы по сравнению с группой контроля
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 17. Влияние заявленного лекарственного средства по окончании периода отмены введения на биохимические показатели плазмы крови кроликов-самок (М±m).
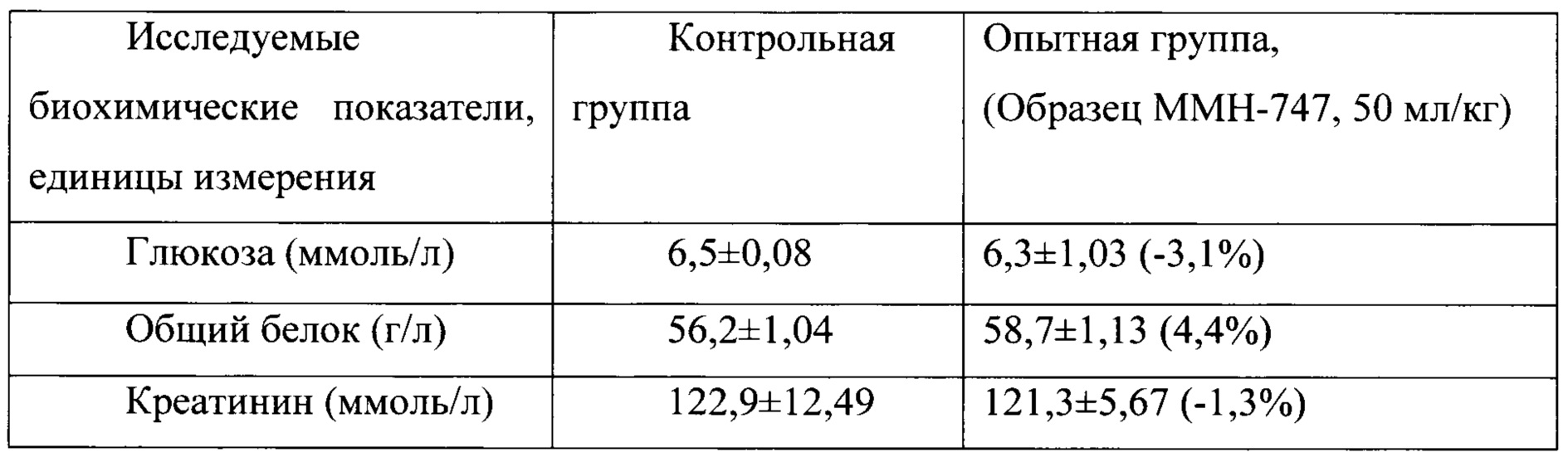
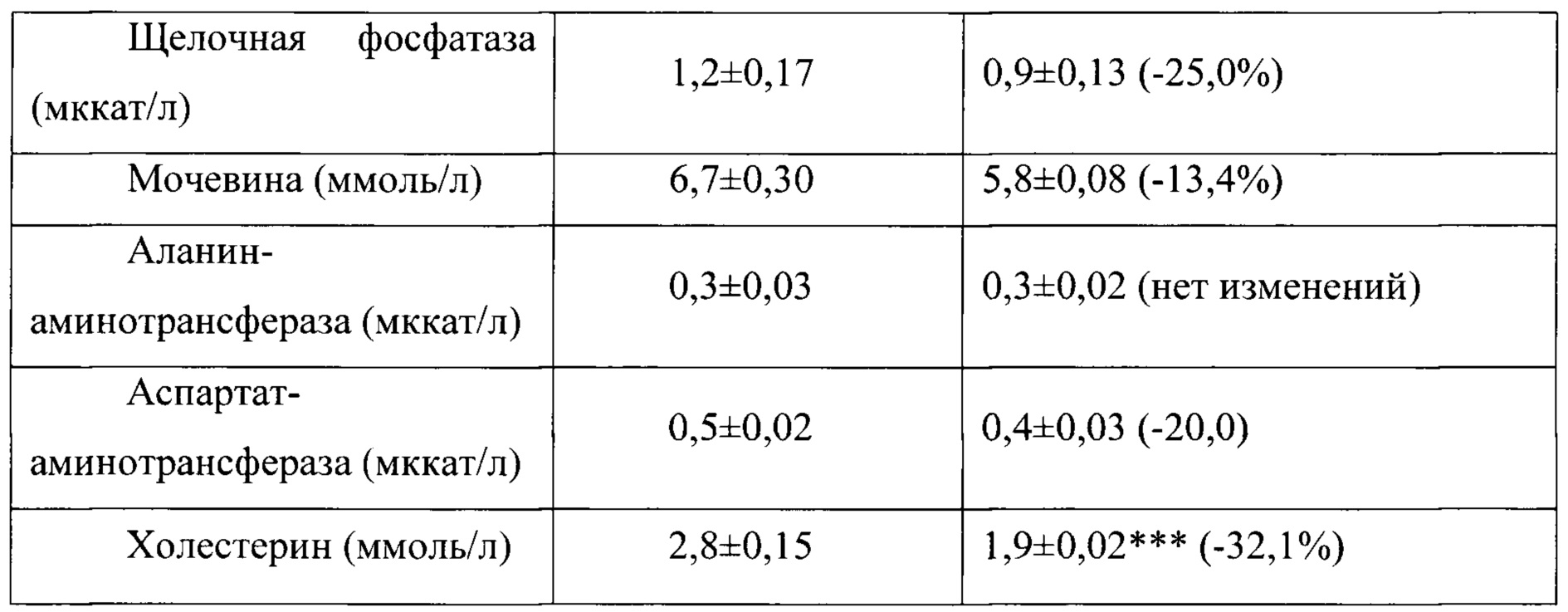
Примечание: ***р<0,001 различия статистически значимы по сравнению с группой контроля;
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 18. Влияние заявленного лекарственного средства по окончании 6ти месячного введения на биохимические показатели мочи кроликов (М±m).
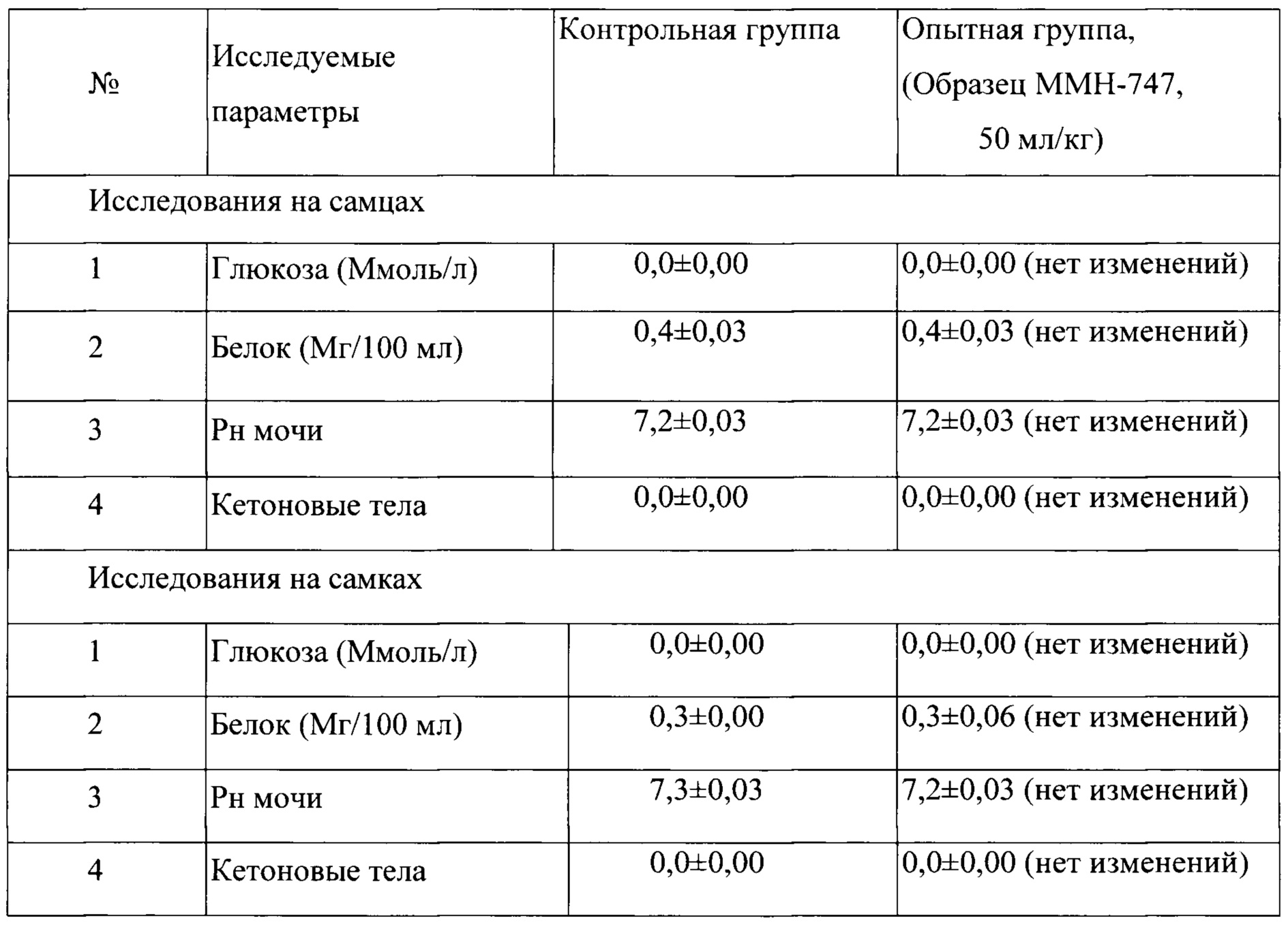
Примечание:
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 19. Влияние заявленного лекарственного средства по окончании отмены введения на биохимические показатели мочи кроликов (М±m).
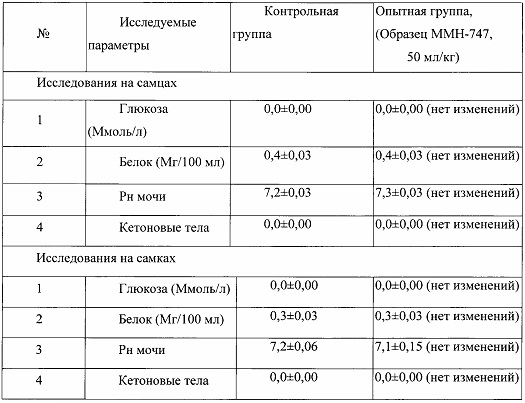
Примечание:
Разница между опытной и контрольной группами подсчитана в процентах (%).
Таблица 20. Влияние заявленного лекарственного средства по окончании 6ти месячного введения на коэффициенты масс внутренних органов кроликов (М±m).
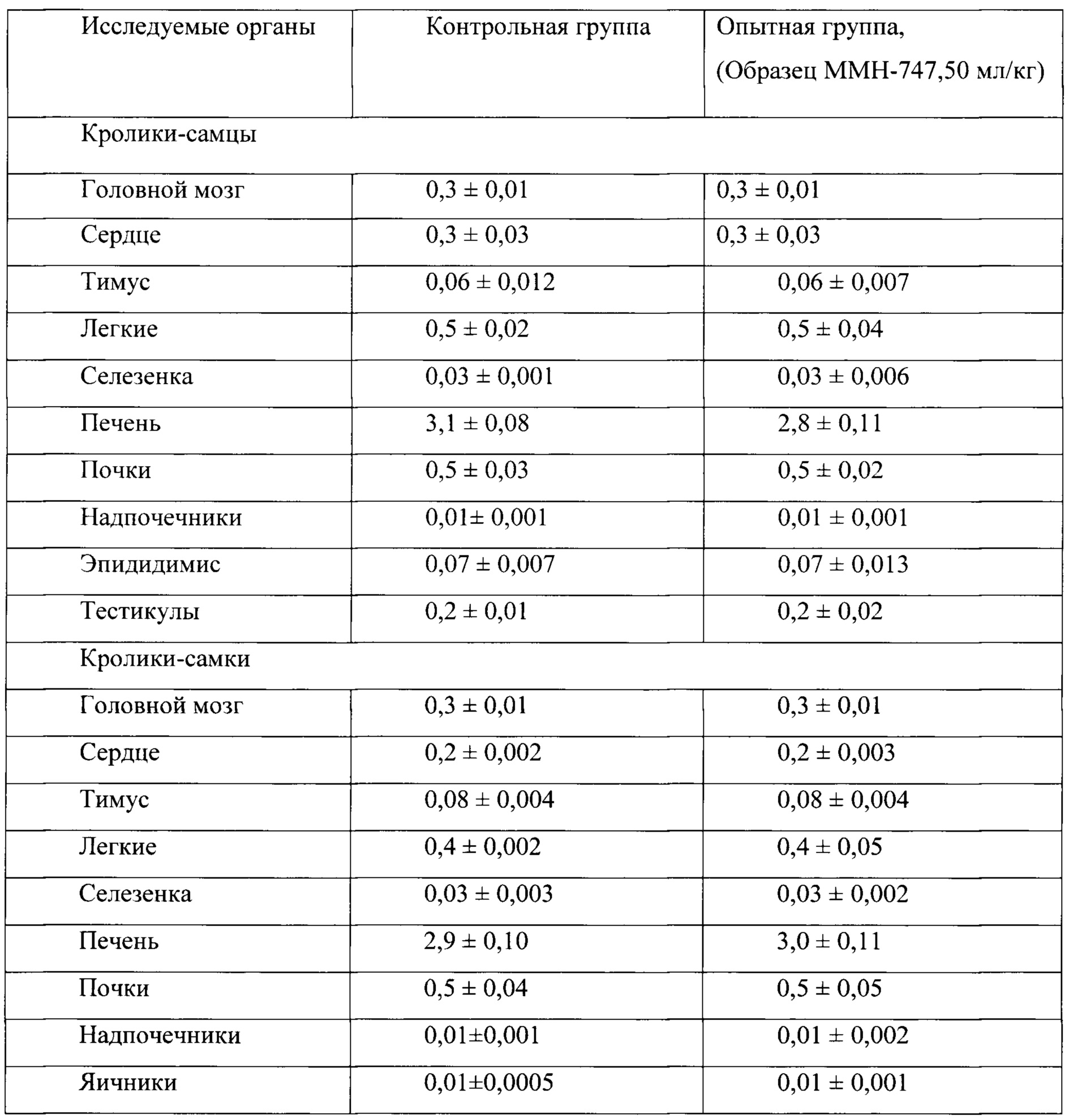
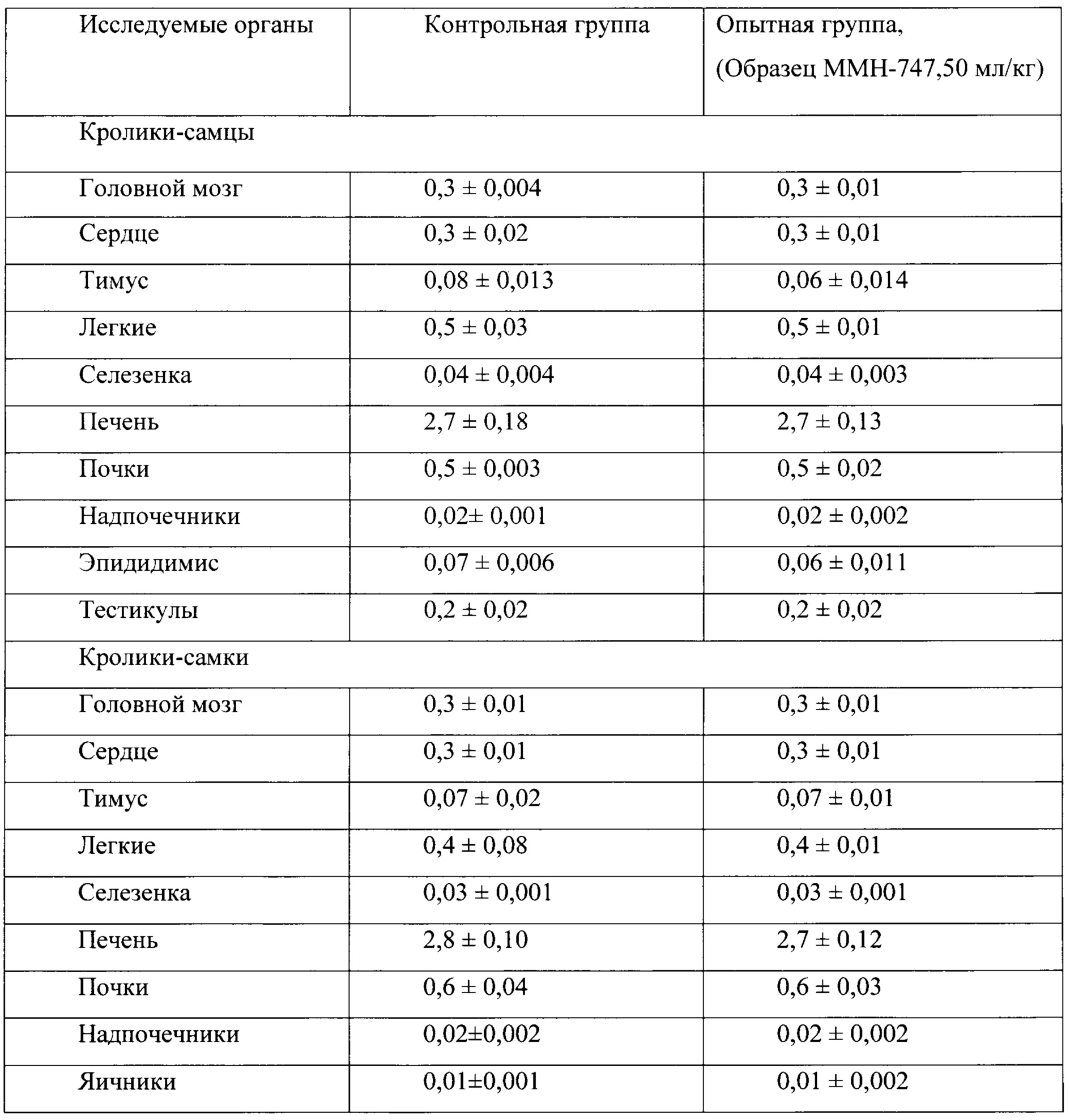
Таблица 21. Влияние заявленного лекарственного средства по окончании отмены введения на коэффициенты масс внутренних органов кроликов (М±m).
Обсуждение результатов:
По результатам проведенных испытаний установлено отсутствие повреждающего действия заявленного лекарственного средства на общее состояние и поведение кроликов. Прирост массы тела у опытных животных в период эксперимента был положительным, достоверно с контролем не различался, но при этом у животных в опытной группе прослеживалась тенденция большего прироста массы тела, начиная со второго месяца исследования. По результатам гематологических и биохимических, а также и электрокардиографических исследований у кроликов, получавших заявленного лекарственного средства, не обнаружено патологических изменений. В периферической крови у кроликов опытной группе не фиксировалось нарушений в показателях красной и белой крови, а также и со стороны свертывающей системы крови. Некоторые зарегистрированные эффекты не выходили за рамки физиологической нормы и, по-видимому, не были связаны с действием тестируемого препарата.
Биохимические исследования плазмы крови выявили тенденцию к снижению уровня глюкозы и у самцов и у самок, получавших в течение 6 месяцев заявленного лекарственного средства. Эта тенденция сохранялась как на протяжении 6 месяцев введения препарата, так и через 1 месяц после его отмены. При этом уровень холестерина у самцов в опытной группе незначительно повышался, а у самок, наоборот, снижался. Ни один из этих эффектов не зависел от длительности введения заявленного лекарственного средства, не усиливался между 3 и 6 месяцами введения препарата и не выходил за пределы физиологической нормы.
Биохимическое исследование мочи не выявило никаких эффектов заявленного лекарственного средства на рН мочи и содержание в ней белка, глюкозы и кетоновых тел.
По результатам электрокардиографических исследований у опытных кроликов зафиксировано наличие обратимого влияния на частоту сердечных сокращений, которая несколько снижалась относительно контрольных величин с тенденцией обратимого повышения вольтажа. В исследованиях, проведенных через один месяц после отмены введения заявленного лекарственного средства, указанные изменения в электрофизиологической активности миокарда у опытных животных не прослеживались, все исследуемые параметры ЭКГ у животных в опытной группе соответствовали показателям у контрольных животных.
Под влиянием заявленного лекарственного средства частота дыхания кроликов также не изменялась.
Таким образом, на основании проведенных гематологических, биохимических, электрокардиографических исследований можно сделать заключение об отсутствии повреждающего влияния заявленного лекарственного средства на органы и системы кроликов при 6-ти месячном введении в дозе 50 мл/кг. Данное заключение согласуется с результатами патоморфологических исследований, в которых у животных опытной группы в сравнении с контролем не было зафиксировано изменений в коэффициентах масс обследуемых органов, а также и патологических изменений в морфоструктуре головного мозга и морфоструктуре внутренних органов. Слабовыраженные дистрофические изменения в печени у кроликов самцов (но не самок), обнаруженные по окончанию 6-ти месячного курса введения заявленного лекарственного средства, не выявлялись подробными патоморфологическими исследованиями печени самцов и самок через один месяц после отмены заявленного лекарственного средства.
Исходя из анализа полученных данных, заявленное лекарственное средство не обладает хронической токсичностью и безопасно.