Результат интеллектуальной деятельности: 17α-АЦЕТОКСИ-3β-ГЕКСАНОИЛОКСИ-6-МЕТИЛПРЕГНА-4,6-ДИЕН-20-ОН, ОБЛАДАЮЩИЙ ГЕСТАГЕННОЙ, КОНТРАЦЕПТИВНОЙ И ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
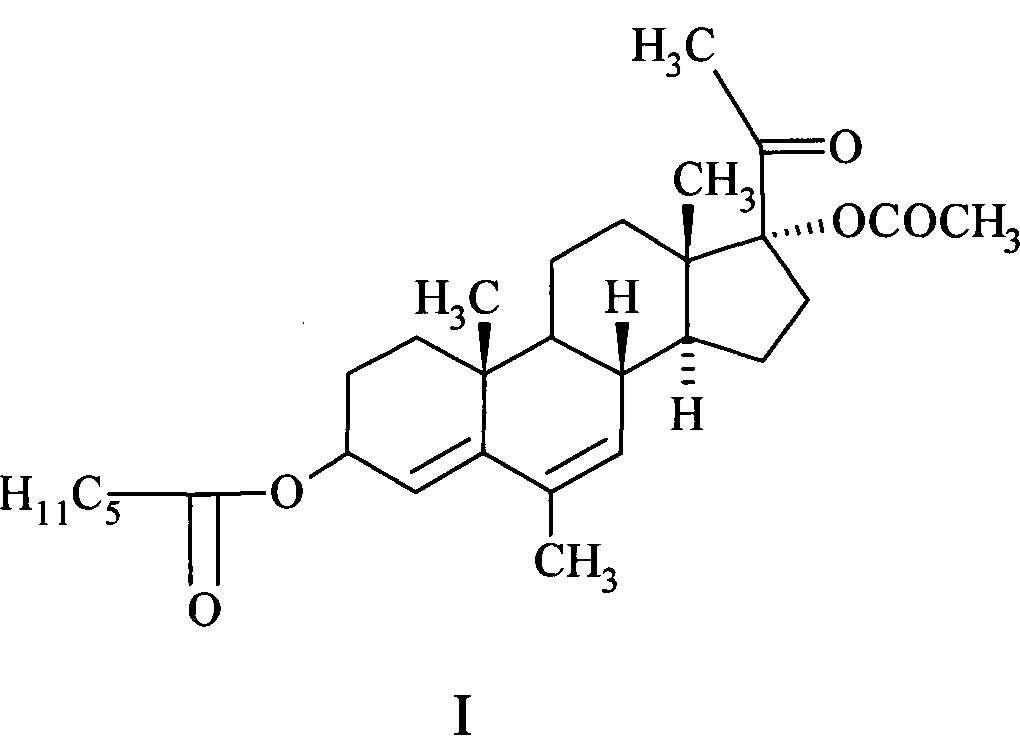
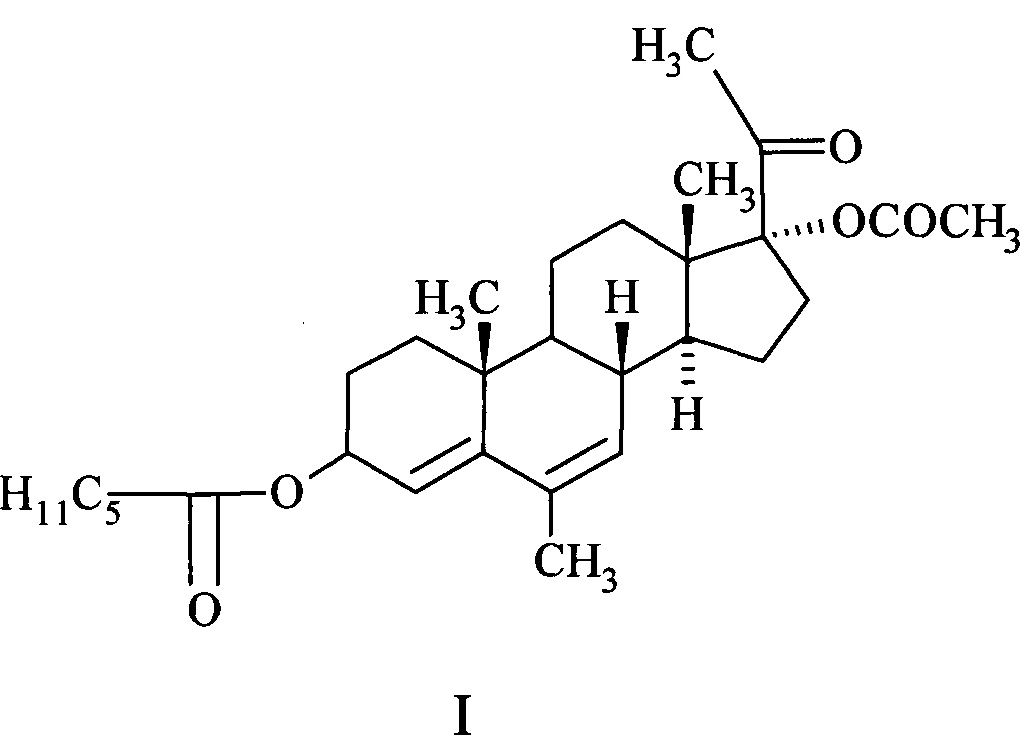
Изобретение относится к медицине, в частности к химии стероидов, и касается синтеза и применения нового химического соединения - 17α-ацетокси-3β-гексаноилокси-6-метилпрегна-4,6-диен-20-она (I) обладающего гестагенной, контрацептивной и противоопухолевой активностью и способа его получения.

Соединение - 17α-ацетокси-3β-гексаноилокси-6-метилпрегна-4,6-диен-20-он (I) относится к классу стероидов и представляет собой кристаллический продукт белого цвета, не растворимый в воде, растворимый в хлороформе, бензоле, ацетоне, спиртах, с температурой плавления 114-117°С. Строение его подтверждено данными ИК-, ПМР- и масс-спектров.
ПМР: 0,66 с (3Н 19-СН3); 0,87 т (3Н СН3-СН2-); 0,95 с (3Н 18-СН3); 1,75 ш.с.(3Н 6-СН3); 2,01 с и 2,05 с (по 3Н СОСН3 и ОСОСН3); 2,28 т (-СН2-СО-); 5,3-5,5 (3 по1Н м-О-СН ш.с. СН=С).
Масс-спектр, М+:484
НК-спектр, ν, см-1; 1711 и 1731 (С=0 эфиров), 1246 (С=0 ацетата), 1169 (С=0 бутирата), 1459.
Данное соединение (1) не токсично и обладает высокой гестагенной, контрацептивной и противоопухолевой активностью, превосходящей известные препараты этой группы, используемые в клинической практике. Соединение может быть использовано в медицине в программе планирования семьи и в заместительной терапии (гинекология, эндокринология), а также в онкологии.
Соединение I относится к группе препаратов называемых гестагенами, которые являются стероидными гормонами участвующими в функционировании гипоталамо-гипофизарно-яичниковой системы. 17α-ацетокси-3β-гексаноилокси-6-метилпрегна-4,6-диен-20-он является эфиром мепрегенола ацетата (Амола II) -синтетическим гестагеном - производным 17α-гидроксипрогестерона.

Препараты на основе гестагенов широко применяются в современной медицине. Спектр использования этих препаратов достаточно широк. В медицине их применяют для регуляции рождаемости, профилактики и лечения гинекологических заболеваний и в акушерской практике, для контрацепции, гормональной заместительной терапии, а также для терапии онкологических заболеваний [1].
В настоящее время чаще всего применяют синтетические аналоги природных гестагенов, лишенные, как правило, нежелательных побочных эффектов и обладающие более высокой активностью. Благодаря широкому спектру использования синтетических гестагенов исследования в области их синтеза, изучения свойств, механизма действия и практического применения вызывают неослабевающий интерес, а поиск веществ, обладающих высокой и пролонгированной гестагенной активностью, не отягощенной сопутствующими гормональными эффектами, является актуальной задачей. Из двух существующих классов синтетических гестагенов, используемых в мировой практике, норстероидов и прегнанов, последние заслуживают особого внимания, так как им не свойственны побочные гормональные эффекты, такие как андрогенная, эстрогенная и анаболическая, сопутствующие в силу строения большинству 19-норстероидов. Это делает прегнановые гестагены предпочтительными при лечении гинекологических заболеваний, при использовании их в контрацептивных целях, а также в онкологии, то есть во всех случаях, где нужна длительная терапия гестагенами. Относящиеся к прегнановому классу эфиры Амола, являющиеся ближайшими структурными аналогами прогестерона с блокированными центрами метаболизма по 3, 6 и 17-положениям и имеющие две сложноэфирные группировки, представляют особый интерес с точки зрения безопасности, высокой активности и пролонгированности действия. Тем более, что два эфира Амола, чьи фармакологические свойства наиболее изучены, 3-ацетат Амола, известный как ацетомепрегенол (Acetomepregenol, CAS №3116-07-2), и 3-циклопентилпропионат Амола - цимегесолат (Cymegesolate, CAS №72648-88-5), производимые в настоящее время китайскими компаниями, отличаются высокой гестагенной, контрацептивной и канцеролитической активностями при отсутствии эмбриотоксичности, а также тератогенного, канцерогенного и мутагенного эффектов [1-9].
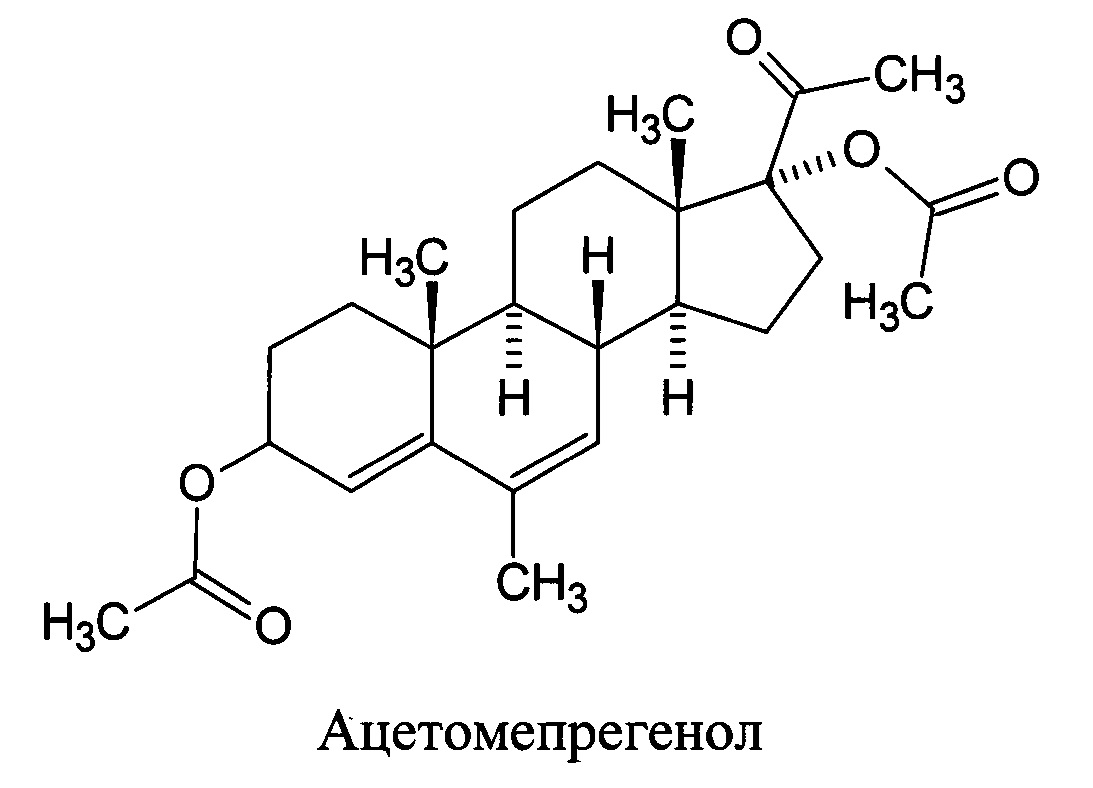

Ацетомепрегенол был разрешен к медицинскому применению в России для лечебных целей в гинекологии под названием «Ацетомепрегенол» и в качестве контрацептивного средства в комбинации с этинилэстрадиолом, под названием «Эгестренол» [1]. Препарат входил в перечень жизненно-необходимых лекарств. Из-за кризиса 90-х годов выпуск препарата был прекращен. В настоящее время препарат не производится.
Особого внимания заслуживает наличие у прегнановых гестагенов, в том числе и у эфиров Амола наряду с высокой гестагенной противооопухолевой активности [4,7,10,11]. В качестве паллиативной гормональной терапии рака молочной железы, рака шейки матки, рака эндометрия, почки применяются такие производные прегнана как медроксипрогестерона ацетат, мегестрола ацетат, Депостат. Этот класс соединений, несомненно, заслуживает дальнейшего изучения всего спектра активностей, свойственных его отдельным представителям, а также разработки эффективного метода их синтеза и промышленных технологий для возможности широкого использования в медицине и ветеринарии.
Несмотря на большое количество используемых в медицине гестагенов, наличие нежелательных побочных эффектов ограничивает широкое использование многих из них. Так, норстероидные соединения, которые включены в качестве гестагенного компонента во все современные комбинированные контрацептивы, помимо гестагенной обладают, к сожалению, в большей или меньшей степени андрогенной, анаболической и эстрогенной активностью. Соединения прегнанового ряда, как правило, лишены подобных нежелательных эффектов, их активность не уступает норстероидам, а разнообразие представителей этого ряда более чем скромно. Несмотря на все достоинства производных прегнана, используемых в медицинской практике в настоящее время, они также имеют ряд недостатков, которые проявляются в небольшом проценте случаев: межменструальные кровянистые выделения; тошнота; прибавка массы тела; нагрубание молочных желез; головная боль и др.
По этой причине научные исследования направлены на получение более активных гестагенов для снижения дозировки стероида и, как следствие, уменьшение их влияния на регуляцию менструального цикла, параметры гемостатической системы и обменные функции организма, в итоге улучшение переносимости и безопасности с клинической точки зрения.
Что касается использования гестагенов в онкологии, то, несмотря на достигнутые в настоящее время успехи в области медикаментозного лечения онкологических заболеваний, поиск препаратов для терапии этого широко распространенного недуга по-прежнему актуален особенно в связи с тем, что недостатком большинства известных противоопухолевых гормональных препаратов является адаптация организма к примененному веществу и ослабление вплоть до прекращения их действия. Поэтому, дальнейший поиск новых эффективных и достаточно безвредных прогестинов представляет актуальную задачу, решение которой послужит делу лечения ряда акушерских, гинекологических и эндокринных заболеваний, контрацепции и гормонотерапии опухолей.
Потребность в гестагенсодержащих препаратах в России не удовлетворена. Основным препятствием к более полному обеспечению потребностей пациентов является, как правило, довольно дорогостоящее лечение - средняя цена одной упаковки наиболее популярных гестагенсодержащих гормональных препаратов составляет 700-1000 руб. На сегодняшний день практически весь рынок таких лекарственных средств представлен дорогостоящими импортными торговыми марками препаратов норстероидного ряда, в то время как изученные эфиры Амола по терапевтическим характеристикам превосходят имеющиеся на рынке аналоги. Среди лекарственных препаратов отечественного производства на рынке представлены только медроксипрогестерон, его ацетат и ацетат мегестрола, а также масляные растворы прогестерона 2,5% и 1,0% и оксипрогестерона капроната 12,5%.
Наиболее близким по структуре и фармакологическому действию к изобретению является гестаген стероидной структуры - 3β-бутаноилокси-6-метил-17α-ацетокси-прегна-4,6-диен-20-он (бутират Амола, бутирол).

Синтез и биологическая активность бутирола описаны [12,13]. Бутирол известен как высокоактивный гестаген [12], как контрацептивное средство в композиции с этинилэстрадиолом [14], а также как противоопухолевое средство. [15]. Гестагенная и контрацептивная активности бутирола изучены в лаборатории фармакологии НИИ Акушерства, Гинекологии и Репродуктологии им. Д.О. Отта (НИИ АГиР им. Д.О. Отта, г. Санкт -Петербург). Для определения гестагенной активности бутирола был использован информативный метод Clauberg-McPhail, основанный на изучении влияния соединений на секреторные изменения слизистой матки инфантильных крольчих.
Известно использование препаратов стероидного ряда в онкологии для лечения гормонозависимых опухолей, таких как рак тела матки, рак молочной железы и рак эндометрия. В качестве таких препаратов прегнанового ряда применяют Мегейс, Депо-провера, Депостат (Машковский М.Д. «Лекарственные средства», Москва, «Медицина», часть 2, 1993 год, стр. 547-548). Основным недостатком их является только парентеральное применение в высоких дозах, а также адаптация при длительном использовании препарата. Наиболее широкое применение получил препарат Депо-провера, в котором в качестве действующего вещества используют производное прегнана - медроксипрогестерона ацетат для лечения рака молочной железы и эндометрия («Федеральное руководство по использованию лекарственных средств для врачей», выпуск 1, 2000, стр. 517).
Целью изобретения является получение нового соединения ряда прегнана, содержащего сложноэфирные группы в положениях 17α- и 3β-, проявляющего высокую гестагенную активность без сопутствующего гормонального эффекта, а также контрацептивную активность в сочетании с этинилэстрадиолом и противоопухолевую активность, превышающую активность использующегося в клинической практике гестагена депо-провера.
Поставленная цель достигается химической структурой нового соединения, а именно 17α-ацетокси-3β-гексаноилокси-6-метилпрегна-4,6-диен-20-она (I), обладающего гестагенной, контрацептивной и противоопухолевой активностью, превышающей активность известных препаратов, а также методом его синтеза.
Соединение I и синтез его в литературе не описаны. Авторами были досконально изучены физико-химические свойства и биологическая активность нового соединения.
Так, гестагенная и контрацептивная активности нового соединения (1) были изучены в лаборатории фармакологии НИИ Акушерства, Гинекологии и Репродуктологии им. Д.О. Отта (НИИ АГиР им. Д.О. Отта, г. Санкт -Петербург). Относительная гестагенная активность соединения I определяемая методом Clauberg-McPhail на рандомизированных самках кроликов оказалась в 17,5 раза выше активности прогестерона и выше бутирола (табл. 1).
Результаты изучения сравнительной гестагенной активности и контрацептивной активности в сочетании с этинилэстрадиолом заявляемого объекта - капроната Амола и бутирата Амола приведены в таб. 1

Как видно из табл. 1 экспериментальное изучение биологической активности полученных нами и исследуемых эфиров установило наличие у всех эфиров гестагенной активности более высокой, чем у природного гормона -прогестерона, а в комбинации с этинилэтрадиолом все эфиры проявили выраженный контрацептивный эффект. Из данного исследования понятно, что, несмотря на наличие у всех изученных эфиров гестагенной и контрацептивной активностей разной величины предсказать достоверно, что любой полученный эфир окажется с высокой активностью и может рассматриваться в качестве лекарственного средства невозможно. Не выявлено прямой зависимости величины активности от строения эфира.
Противоопухолевая активность заявляемого средства изучалась в РОНЦ им. Н.Н. Блохина РАМН проф. Смирновой З.С. в опытах на мышах линии СВА. Для оценки противоопухолевой активности соединений с гестагенной активностью использовался рак шейки матки РШМ-5 при ортотопической перевивке. В качестве препарата сравнения использовали Депо-провера (медроксипрогестерона ацетат - МА). В результате было показано, что эффект торможения одинаковой опухоли для бутирола [15] и капроната по отношению к Депо-провера в дозе 2 мг/мышь превосходит Депо-провера в 1,6 раза для капроната, в то время как бутирол превосходит его в 1,3 раза. Ацетомепрегенол изучали по сравнению с капронатом оксипрогестерона и на других видах опухолей.
Авторами разработан способ получения 17α-ацетокси-3β-гексаноилокси-6-метилпрегна-4,6-диен-20-она- капроната Амола(1) из ацетата мегестрола, который представлен на мировом рынке в виде доступной и недорогой коммерческой субстанции (CAS №595-33-5). Разработанный нами способ его получения из мегестрола ацетата позволяет проводить процессы регио- и стереоселективно с высоким выходом и получать соединение высокой степени чистоты. Способ обеспечивает возможность масштабирования процесса.
Известны способы получения эфиров Амола из мегестрола ацетата [11,12,15]. Все они представляют собой двухстадийный синтез, включающий стадию восстановления мегестрола ацетата борогидридом натрия в метаноле и стадию этерификации полученного в результате восстановления спирта (Амола, II) ангидридом кислоты в пиридине. Небольшим отличием в этих способах является метод выделения целевого эфира: в одном случае реакционную массу разбавляют подкисленной водой, в другом водой с добавлением аммиака. Используемый в этих патентах способ восстановления кетогруппы при С-3 позволяет обеспечить селективность и стереохимический контроль реакции восстановления. Борогидрид натрия при взаимодействии с метанолом выделяет активный водород и избирательно восстанавливает 3-кетогруппу, не затрагивая кетогруппы в положениях 20 и 11 [http.//chem21.info/info/467340], и в этом случае является одним из наиболее эффективных восстановителей. Вместе с тем, проведение реакции в метаноле существенно ограничивает возможности использования данного метода в промышленных масштабах. Согласно действующим в РФ санитарным нормам применение метанола может допускаться лишь в тех производственных процессах, где он не может быть заменен другими, менее токсичными, веществами. Кроме того, введение технологических процессов с применением метанола или веществ, содержащих метанол, подлежит согласованию с органами государственного санитарного надзора. Это связано с высокой токсичностью метанола: смертельная доза метанола при приеме внутрь равна 30 граммов, но тяжелое отравление, сопровождающееся слепотой, может быть вызвано попаданием в организм 5-10 граммов. Кроме того, метанол может проникать в организм через неповрежденную кожу. Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 5 мг/м. Поэтому метод имеет ограничение для использования в промышленности.
Для этерификации Амола на второй стадии получения эфиров из ацетата мегестрола наиболее часто предлагаются методы, основанные на взаимодействии стероидного спирта с ангидридом или хлорангидридом кислоты в среде пиридина или его смеси с другими растворителями в присутствии азотистого основания в качестве катализатора [11,19,20]. Однако, эта группа методов имеет такие существенные недостатки, как использование значительных количеств высокотоксичного пиридина, создающего экологические проблемы, и значительные расходы на избыток ацилирующих агентов, осаждение, промывку и последующую очистку целевого продукта в предлагаемых условиях, что требуют больших объемов воды и создает дополнительные трудности при масштабировании процесса.
В качестве наиболее близкого аналога заявляемого метода получения капроната Амола из III может быть рассмотрен способ, раскрытый в патенте [15]. В прототипе описан двух стадийный метод получения бутирола из III, где на первом этапе применяется метод восстановления субстрата борогидридом натрия в метаноле при комнатной температуре, с получением (после высаживания водой, нейтрализации соляной кислотой, фильтрования, промывки и сушки) кристаллического Амола с выходом 96,9%. Константы полученного спирта не приведены. На втором этапе проводят ацилирование полученного Амола масляным ангидридом в пиридине (1 час при 30°С и затем 5 часов при комнатной температуре), разложение избытка масляного ангидрида водой, а затем аммиаком и высаживание целевого продукта путем выливания реакционной массы в водный аммиак, фильтрование, промывку водой и метанолом и сушку осадка. Выход бутирола на этой стадии составляет 89,25%. Общий выход бутирола при получении согласно способу-прототипу (в расчете на ацетат мегестрола) - 86,6%.
Помимо недостаточно высокого общего выхода, к числу недостатков прототипа следует отнести рассмотренные выше негативные качества, общие для всех методов восстановления ацетата мегестрола борогидридом натрия в метаноле (технические и экологические проблемы при работе с высоко токсичным растворителем) и ацилирование стероидных спиртов в пиридине (длительность процесса и избыточные количества реагентов, в том числе, высокотоксичного пиридина, создающие трудности при масштабировании в промышленном производстве).
Одной из важнейших задач при создании настоящего изобретения была разработка способа получения нового соединения I, который обеспечивал бы получение с высоким выходом качественного продукта, с чистотой не менее 98%, более простым и безопасным в сравнении с известными аналогами методом, а также обеспечивал возможность масштабирования процесса. Поставленная задача была решена благодаря:
а) отказу от использования метанола на первом этапе способа получения эфиров Амола и проведению реакции восстановления ацетата мегестрола борогидридом натрия в водном 87%-ном изопропаноле, в присутствии соляной кислоты и при температуре (12±2)°С;
б) проведению второй стадии способа (ацилирования Амола) в хлорированных углеводородах в присутствии каталитических количеств третичных аминов.
Изопропиловый спирт был выбран нами в качестве альтернативы метанолу, поскольку он, является значительно менее токсичным соединением, чем метанол и менее реакционноспособным реагентом. Как третичный спирт он практически не взаимодействует с борогидридом натрия, поэтому для получения активного водорода в реакции восстановления III мы предложили использовать разбавленную водой соляную кислоту, интенсивно реагирующую с борогидридом натрия с выделением атомарного водорода. С точки зрения возможности масштабирования процесса, существенным моментом является и то, что изопропиловый спирт легко регенерируется из маточного раствора: регенерация 87% изопропанола составляет более 80%, в то время как регенерация 90%-ного метанола обычно не превышает 50-60%. Соответственно, при использовании на этом этапе изопропанола в концентрации, близкой к указанной, возникает возможность практически безотходного использования растворителя. С учетом этого, нами были подобраны оптимальные условия проведения реакции восстановления ацетата мегестрола борогидридом натрия в среде 87% изопропилового спирта. В результате было установлено, что в водном 87% изопропаноле удается получить качественный продукт (с чистотой не менее 98%) с выходом не ниже 98%. Согласно проведенным исследованиям необходимыми условиями для полноценного восстановления ацетата мегестрола борогидридом в среде водного изопропанола является поддержание температуры реакции в интервале 10-14°С, а также присутствие в реакционной смеси соляной кислоты в количестве 1 моль на 1 моль борогидрида натрия (достаточном для выделения водорода, необходимого для восстановления кетогруппы при С-3). При соблюдении названных выше необходимых для получения технического результата условий проведения первой стадии (существенных признаков изобретения) Амол, полученный после осаждения фильтрования и сушки, в количестве не ниже 98%, содержит минимальные количества примесей (не более 2% - ТСХ и ВЭЖХ - анализ), что позволяет использовать его на следующей стадии способа без проведения дополнительной очистки;
На второй стадии предлагаемого нами способа предложено проведение реакции в хлористом метилене в присутствии каталитических количеств третичных аминов. Существенным отличительным признаком от известных ранее методов является проведение реакции ацилирования в хлорированных углеводородах, например, в хлористом метилене, хлороформе и др. В известных из литературы источниках реакцию проводят или в пиридине или в диалкилкетонах.
Анализ уровня техники показал отсутствие какой-либо информации о технических решениях, полностью совпадающих по совокупности существенных признаков с заявленным средством, а также со способом его получения, что позволяет сделать вывод о соответствии предложенных технических решений условию патентоспособности «новизна».
Также не выявлены решения, имеющие признаки, совпадающие с отличительными признаками предложенных технических решений, что позволяет сделать вывод о соответствии их условию патентоспособности «изобретательский уровень».
Предлагаемый нами двух стадийный способ (схема 1) получения 17α-ацетокси-3β-гексаноилокси-6-метилпрегна-4,6-диен-20-она (I) из мегестрола ацетата (III), включает стадию его восстановления борогидридом и стадию ацилирования полученного интермедиата (II, Амола) ангидридом или хлорангидридом капроновой кислоты, в котором первая стадия осуществляется в водном изопропаноле в присутствии соляной кислоты при температуре (11±2)°С, а вторая - в хлористом метилене с последующим удалением растворителя. Изобретение позволяет получить качественный продукт с общим выходом 96% -98% на мегестрола ацетат и содержанием основного вещества по -98% (ВЭЖХ).

Заявляемые соотношения компонентов и условия синтеза, найденные экспериментальным путем, являются оптимальными и позволяют получить технический результат, соответствующий поставленной задаче. Технический результат, получаемый при осуществлении изобретения, выражается в расширении спектра высокоактивных стероидных препаратов, а также возможности проводить процесс синтеза нового стероидного препарата регио- и стереоселективно с высоким выходом и получать соединение высокой степени чистоты.
Изобретение иллюстрируется, но не ограничивается следующими примерами:
Пример 1.
Заявляемое соединение не токсично. Острая токсичность была изучена в опытах на крысах линии «Вистар» массой 180-220 г в НИИ АГиР им. Д.О. Отта при введении доз соединения, превышающих терапевтическую в 50-100 раз (с учетом широкого интервала предполагаемых доз). Введение субстанции I в максимальных дозах, превышающих терапевтическую в 20000 раз, не привело к гибели ни одного животного, признаков интоксикации не отмечалось. Макроскопическое обследование внутренних органов патологии не выявило.
Пример 2.
Изучение гестагенной активности соединения 1 проводили на инфантильных самках кроликов породы «Шиншилла». Животные были получены из питомника «Рапполово» РАМН и содержались в регламентированных условиях вивария НИИ АГиР им. Д.О. Отта РАМН на стандартном рационе.
Гестагенная активность соединений была изучена методом Clauberg-McPhail. Согласно этому методу, эстрогенподготовленным самкам кроликов в течение 5 дней ежедневно вводили испытуемые препараты в определенном диапазоне доз (5 доз - 5 кроликов на 1 дозу). Все подопытные животные получали изучаемые соединения в виде масляного раствора (растворитель -растительное масло) в объеме 0,3 мл перорально (в желудок) с использованием зонда. Введение препаратов производили ежедневно в утренние часы 09.00-11.00.
Оценку гестагенной активности проводили по 4-хбалльной шкале McPhail, принимая во внимание степень прегравидных изменений эндометрия.
Для каждого фрагмента матки оценивали несколько срезов, после чего проводили статистическую обработку полученных в группе данных. Результаты опытов обрабатывали методом регрессионного анализа.
Вычисления вели по уравнению регрессии у=а+b lgx, где у - индекс McPhail, х - доза гестагена в мг/кг, а и b - коэффициенты регрессии.
Биологическая активность соединений оценивалась по ЕД50, соответствующей индексу McPhail равному 2.
Относительную прогестагенную активность вычисляли, принимая за единицу активность прогестерона. В результате обработки экспериментальных данных методом регрессионного анализа для каждого изучаемого соединения была определена биологическая активность, оцениваемая по ED50. Полученные результаты, представлены в табл. 2.

Примечание: a, b - коэффициенты регрессии вычисленные по уравнению у=a+b⋅lg (х), OA - относительная гестагенная активность.
Как видно из табл. 2, все изученные соединения способны вызывать секреторную трансформацию эндометрия инфантильных крольчих в большей степени, чем прогестерон.
В результате проведенного экспериментального исследования установлено, что наиболее высокой гестагенной активностью обладает капронат Амола.
Пример 3.
Изучение контрацептивной активности капроната Амола проводили в НИИ АГиР им. Д.О. Отта. Опыты проводили на половозрелых белых крысах линии «Вистар» массой 180-200 г (самки) и 200-250 г (самцы). Все животные были получены из питомника «Рапполово» и содержались в регламентированных условиях вивария НИИАГ им. Д.О. Отта РАМН. Изучаемые эстроген-гестагенные комбинации вводили в виде масляного раствора (растворитель - растительное масло) в желудок (перорально) в объеме 0,3 мл с использованием зонда в течение 14 дней. Доза этинилэстрадиола и гестагена в обеих комбинациях была одинаковой и составила 0,04 мг/кг и 0,8 мг/кг соответственно. Животные контрольной группы получали растительное масло в том же объеме и в те же сроки, что и животные подопытных групп.
Введение препаратов и взятие влагалищных мазков проводили в утренние часы 09.00-11.00. На третий день введения препаратов самок подсаживали к самцам. Ежедневно проводили цитологический анализ влагалищных мазков. День обнаружения сперматозоидов в мазке считали первым днем беременности. Покрытых самок отсаживали в отдельные клетки и завершали 14-дневный курс введения испытуемых комбинаций. На 20-21 день после покрытия всех животных подвергали эвтаназии под эфирным наркозом. После вскрытия проводили ревизию полости матки на наличие плодов, плацент и мест имплантаций.
Контрацептивную активность (КА) рассчитывали по формуле:

где Бо и Бк - число беременных крыс в опыте и контроле, соответственно;
По и Пк - число покрытых крыс в опыте и контроле, соответственно. Контрацептивная активность комбинаций этинилэстрадиола (0,04 мг/кг) и гестагенов бутирата Амола и капроната Амола (0,8 мг/кг) приведена в табл. 3.

Примечание: КА - контрацептивная активность.
Из 17 самок подопытной группы, получавшей комбинацию из этинилэстрадиола и бутирата Амола, покрылись 11 крыс в течение 8 дней. Из такого же количества животных, получавших сочетание этинилэстрадиола и капроната Амола, в те же сроки покрылись 14 самок. В контрольной группе на фоне введения растворителя из 15 самок за 8 дней покрылись 14. Активность спаривания крыс в обеих подопытных группах была такой же как в контроле, в среднем по 1-3 крысы в день.
Результаты исследования показали, что комбинации изучаемых гестагенов с этинилэстрадиолом обладают высокой контрацептивной активностью.
Пример 4.
Противоопухолевая активность заявляемого средства изучалась в РОНЦ им. Н.Н. Блохина РАМН проф. Смирновой З.С. в опытах на мышах линии СВА. Для оценки противоопухолевой активности соединений с прогестиновой активностью используется рак шейки матки РШМ-5 при ортотопической перевивке. В качестве препарата сравнения использовали депо-провера (МА).
Опухоль первоначально индуцирована метилхолантреном в подкожном аутотрансплантате шейки матки мыши - СВА в 1970 г. При ортотопической перевивке РШМ-5 перевивается после лапаротомии кусочком опухоли размером 1 мм3 в один из рогов матки с помощью троакара. РШМ-5 перевивают мышам линии СВА, массой 18-20 гр., находящихся под гексеналовым наркозом. Ранее нами было установлено, что РШМ-5 при подкожной перевивке содержит рецепторы эстрогенов - РЭ: 9,3±1,9 фмоль/мг белка, РП: 16,9±3,8 фмоль/мг белка, РГ: 24,6±4,9 фмоль/мг белка и РА: 4,9±0,3 фмоль/мг белка, тогда как при ортотопической перевивке содержание РЭ и РП увеличивается 3-3.6 раза (РЭ до 28,8±10,3 фмоль/мг белка, и РП до 61,5±0,8 фмоль/мг белка). Наличие достаточно высокого содержания рецепторов прогестерона делают опухолевую модель РШМ-5 чувствительной к прогестинам при ортотопической перевивке.
Штамм РШМ-5 поддерживается на мышах-самках линии СВА при подкожной перевивке в область правой подмышечной впадины по 0,5 мл взвеси опухолевой ткани, разведенной средой 199 в соотношении 1:10.
Лечение при ортотопической перевивке начинали на 3-й день после перевивки опухоли. Капронат мепрегенола (3β-гексаноилоокси-6-метил-17α-ацетоксипрегна-4,6-диен-20-он), нерастворимый в воде, растворяли в оливковом масле и вводили внутримышечно ежедневно в течение 14 дней в дозах 1 мг/мышь и 2 мг/мышь. В качестве препарата сравнения использовали Депо-провера в дозе 2 мг/мышь также в при внутримышечном введение в течение 14 дней. Забой мышей проводили на 17-й день после начала опыта.
Противоопухолевый эффект оценивали по торможению роста опухоли (ТРО), т.е. по изменению массы опухоли. ТРО вычисляли по формуле:

где Vк - средняя масса опухолей в контрольной группе (мг),
Vo - средняя масса опухолей в опытной группе (мг).
В опытных группах использовали по 9 мышей, в контрольной - 10 мышей.
Схема эксперимента
Исследуемое вещество:
Капронат мепрегенола - субстанция
Дозы исследуемого вещества: 1,0 мг/мышь и 2,0 мг/мышь.
Путь и длительность введения исследуемого вещества: внутримышечно ежедневно в течение 14 дней.
Вещество сравнения (позитивный контроль): Депо-провера (МА) в дозе 2,0 мг/мышь
Путь и длительность введения позитивного контроля: внутримышечно ежедневно в течение 14 дней.
Результаты:
Данные по противоопухолевой активности капроната мепрегенола при внутримышечном введении в течение 14 дней на РШМ-5, перевитой ортотопически представлены в табл. 4.

Примечание: * - р < 0,01 достоверные отличия от контроля.
Проведенное исследование показывает, что капронат мепрегенола в дозе 1 мг/мышь при ежедневном внутримышечном введении в течение 14 дней тормозит рост РШМ-5 на 44% и в дозе 2 мг/мышь - на 58%, причем по терапевтическому эффекту превосходит препарат сравнения. МА в дозе 2 мг/мышь при ежедневном внутримышечном введении в течение 14 дней тормозит рост РШМ-5 только на 37%.
Пример 5.
Заявляемое соединение обладает выраженным химиосенсибилизирующим действием, повышая противоопухолевое действие винкристина в отношении перевиваемого острого лимфолейкоза мыши Р388, резистентного к винкристину.
Для оценки химиосенсибилизирующего действия капроната Амола сравнивали противоопухолевую активность винкристина с противоопухолевой активностью винкристина в комбинации с капронатом Амола.
Мышам линии DBA2 привили лимфолейкоз Р388, устойчивый к винкристину, 2 млн. клеток/мышь, на следующий день группе «Винкристин» (6 мышей) ввели винкристин 1 мкг/г внутрибрюшинно (20 мкг/мышь), группе «Винкристин + соединение 1» (6 мышей) винкристин 1 мкг/г внутрибрюшинно (20 мкг/мышь) и через 2 часа капронат Амола 1 мг/мышь (50 мг/кг) перорально в масле.
Контрольная группа (6 мышей) получила масло перорально. На 7 день после прививания подсчитали нарастание опухоли по количеству клеток асцитной жидкости.
В контрольной группе опухоль наросла за 7 дней на 190%, в группе «Винкристин» - на 85%, в группе «Винкристин + капронат Амола» - на 30%.
Таким образом, капронат Амола в дозе 1 мг/мышь (50 мг/кг) проявляет химиосенсибилизирующее действие, повышая противоопухолевый эффект винкристина на 18% и ингибируя в комбинации с винкристином рост опухоли на 55%. Винкристин как самостоятельное соединение ингибирует рост опухоли на 37%.
Таким образом, в результате проведенного исследования установлено, что капронат Амола достоверно (Р<0,001) усиливает противоопухолевое действие винкристина в отношении гормоннезависимого резистентного острого лимфолейкоза мыши Р388, следовательно, является по отношению к данной опухоли химиосенсибилизатором.
Пример 6.
Получение 17-Ацетата мепрегенола (Амола - III).
К раствору 20 г ацетата мегестрола в 170 мл 87%-ного изопропилового спирта, охлажденной при перемешивании до (12±2)°С, прибавляют 2 г борогидрида натрия (с содержанием основного вещества 96%) и медленно, по каплям добавляют 10 мл 9%-ного раствора соляной кислоты в воде с такой скоростью, чтобы температура в реакционной массе не поднималась выше 15°С. По окончании прибавления перемешивают в тех же условиях 15 мин. Затем к реакционной массе добавляют 400 мл охлажденной до температуры (12±2)°С воды с такой скоростью, чтобы температура реакционной смеси не превышала 15°С, после чего при постоянном перемешивании и той же температуре медленно, по каплям добавляют 10 мл 9%-ного раствора соляной кислоты. Реакционную массу перемешивают при температуре (12±2)°С еще примерно в течение 1 часа. Осадок образовавшегося 17-ацетата мепрегенола отделяют на фильтре, промывают водным изопропанолом, а затем водой до рН=6,5-7 и сушат при температуре (50±5)°С до постоянного веса. Получают 19,7 г Амола (98% от теоретич.) в виде белого кристаллического порошка с температурой плавления не ниже 186°С и суммой примесей не более 2%
Пример 7.
Получение капроната Амола (Схема 2).

В одногорлую колбу на 50 мл снабженную магнитной мешалкой и капельной воронкой загружают 5 г (0,013 моль) Амола, 15 мл хлористого метилена, 2,16 мл триэтиламина и 0,05 г диметиламинопиридина. К полученному раствору при перемешивании и комнатной температуре прикапывают за 10 минут 3,6 мл (0,016 моль) гексанового (капронового) ангидрида. Реакционную массу перемешивают 30 минут при комнатной температуре. По окончании реакции берут пробу на конец реакции -контроль осуществляют по ТСХ до исчезновения исходных веществ. Растворитель упаривают в вакууме при комнатной температуре досуха. К остатку при (0±2)°С прибавляют смесь 7 мл изопропилового спирта и 2,5 мл 9%-ного раствора HCI, выдерживают 2 часа при этой температуре. Осадок отфильтровывают, промывают водой и 50%-ным изопропанолом. Получают 6,14 г белого кристаллического осадка капроната 17α-ацетокси-3β-гидрокси-6-метилпрегна-4,6-диен-20-она с выходом 98% от теоретического с т. пл. 114-117°С и содержанием основного вещества по ВЭЖХ - 98%. После перекристаллизации из двукратного количества изопропанола т. пл. 116-118°С.
Масс-спектр, М+:486. ПМР: 0,66 с (3Н 19-СН3); 0,87 т (3Н СН3-СН2-); 0,95 с (3Н 18-СН3); 1,75 ш.с. (3Н 6-СН3); 2,01 с и 2,05 с (по 3Н СОСН3 и ОСОСН3); 2,28 т (-СН2-СО-); 5,3-5,5 (3 по 1H м-О-СН ш.с. СН=С).
Литература.
1. Машковский М.Д. Лекарственные средства. - М.: Медицина, 1993, Т. 1, с. 694.
2. Кадатский Г.М., Гриненко Г.С., Терехина А.И., Лисица Л.И., Ганина И.В., Горенбургова Е.И. Хим.-фарм.ж., 1979, №6, с. 63-68.
3. Абсава Г.И., Корхов В.В. М.: Экспресс-информация Новые лекарственные препараты, 1987, №9, с. 1-14.
4. Shengzhi Yu. Biyun, 1988, Vol.8, №4, p.50-53.
5. Корхов B.B., Бойкова B.B., Гриненко Г.С., Кадатский Г.М., Акалаев А.А., Андрюшина В.А. Хим.-фарм.ж., 1983, Т.17, №12, с. 1454-1457.
6. Никитина Г.В., Савченко О.Н., Степанов М.Г. Проблемы эндокринологии, 1987, №3, с. 60-63.
7. Shengzhi Yu. Biyun, 1982, Vol.2, №4, p.23-27.
8. Топильская Н.И. Невынашивание беременности: патогенез, клиника, фармакология, коррекция. - СПб.: Грэм, 2002, 96 с.
9. Корхов В.В., Ярославский В.К., Турлак Е.В. Охрана материнства и детства, №1-6, 2005, с. 13-16.
10. Корхов В.В. Вопр. онкол., 1997, Т.43, №3, с. 317-320.
11. Патент РФ №2039560. Кадатский Г.М., Гриненко Г.С., Корхов В.В., Никитина Г.В. и др., 20.07.1995.
12. Патент РФ №2099347. Гриненко Г.С., Морозова Л.С., Корхов В.В. и др., 20.12.1997.
13. Зейналов О.А., Ядерец В.В., Стыценко Т.С., Петросян М.А., Андрюшина В.А. Хим.-фарм.ж.,2012, Т. 46, №4, с. 90-94
14. Пат.РФ №2091019. Гриненко Г.С, Андрюшина В.А., Корхов В.В., и др. 27.09.1997.
15. Патент РФ №2292209. Гриненко Г.С.и др., 27.01.2007.
16. Зейналов О.А., Андрюшина В.А., Егоров И.М., Попова Е.В., Золотарева В.А., Кокорина Л.М., Скрябин К.Г. Вопросы биологической, медицинской и фармацевтической химии, 2005, №4, с. 10-12.
17. Зейналов О.А., Андрюшина В.А., Савинова Т.С., Попова Е.В, Золотарева В.А., Кокорина Л.М., Скрябин К.Г. Вопросы биологической, медицинской и фармацевтической химии», 2005, №1, с. 32-36.
18. Патент РФ №2091388. Андрюшина В.А., Савинова Т.С., Скрябин К.Г., 27.09.1997.
19. GB 1055534, 18.01.1967.
20. US 3126399, 24.03.1964.