Результат интеллектуальной деятельности: СИСТЕМА ДЛЯ ЭКСПРЕССИИ FAB-ФРАГМЕНТОВ АНТИТЕЛ В МЕТИЛОТРОФНЫХ ДРОЖЖАХ PICHIAPASTORIS, НА ОСНОВЕ РЕКОМБИНАНТНЫХ ПЛАЗМИДНЫХ ДНК Ab-HCh-HIS/pPICZ_α_A И Ab-LCh-LAMBDA/pPICZα_A, ПРЕДНАЗНАЧЕННЫХ ДЛЯ КЛОНИРОВАНИЯ ВАРИАБЕЛЬНЫХ ДОМЕНОВ ТЯЖЕЛОЙ И ЛЕГКОЙ ЦЕПЕЙ АНТИТЕЛ, СООТВЕТСТВЕННО
Вид РИД
Изобретение
Изобретение относится к области генной инженерии и биотехнологии, а именно к: рекомбинантным плазмидным ДНК Ab-HCh-HIS/pPICZ_α_A и Ab-LCh-LAMBDA/pPICZ_α_A, позволяющим клонировать любые вариабельные домены тяжелых и легких цепей, соответветственно, системе экспрессии Fab-фрагментов антител с лямбда изотипом легкой цепи при котрансформации обеих генетических конструкций с предварительно встроенными интересующими вариабельными доменами тяжелых и легких цепей антитела в клетки метилотрофных дрожжей Pichia pastoris, получению Fab-фрагментов антител с лямбда изотипом легкой цепи из культультуральной среды без протеолитической деградации конечного препарата. Изобретение может быть использовано в научных исследованиях и биотехнологии для получения рекомбинантных Fab-фрагментов антител, требующих высокой степени чистоты, гомогенности и воспроизводимости опытных партий образцов.
Объектом изобретения является система из двух модифицированных рекомбинантных плазмидных ДНК Ab-HCh-HIS/pPICZ_α_A и Ab-LCh-LAMBDA/pPICZα_A, предназначенных для клонирования вариабельных доменов тяжелой и легкой цепей антител, соответственно, с последующей котрансформацией смеси обеих генетических конструкций в эквимолярном соотношении в клетки метилотрофных дрожжей Pichia pastoris и получением стабильных рекомбинантных Fab-фрагментов антител с лямбда изотипом легкой цепи.
Известен способ получения одноцепочечных антител в клетках линии P. pastoris в составе слитного белка с константным доменом иммуноглобулина мыши (Wang DD, Su MM, Sun Y, Huang SL, Wang J, Yan WQ. Protein Expr Purif. 2012 Nov; 86(1):75-81). В данной работе использовалась одноцистронная система векторов. Авторам удалось получить выход продукта 60 мг/л при использовании 80 литрового ферментера. Недостатком этой системы является получение антитела в виде одноцепочечного фрагмента, так как существуют данные о различии в уровнях специфической активности между Fab-фрагментами и одноцепочечными антителами в пользу первых (Захаров А.В., Смирнов И.В., Серебрякова М.В. и др.//Молекуляр. биология. 2011. Т. 45, №1, С. 86-95).
Известна система получения Fab-фрагмента антитела в составе моноцистронного вектора содержащего сайт гидролиза протеазой KEX2 (Burtet RT1, Santos-Silva MA, Buss GA, Moraes LM, Maranhao AQ, Brigido MM. J Biochem. 2007 Dec; 142(6):665-9). В результате, авторам удалось получить функционально активный Fab-фрагмент, однако уровень экспрессии не превышал 10 мг/л культуральной среды.
Описана система получения Fab-фрагмента антитела, состоящая из двух моноцистронных векторов, кодирующих легкие и тяжелые цепи антител, соответственно (Захаров А.В., Смирнов И.В., Серебрякова М.В. и др.//Молекуляр. биология. 2011. Т. 45, №1, С. 86-95). Система позволяла получать до 15 мг/л активного Fab-фрагмента, однако впоследствии была обнаружена невысокая стабильность получаемых препаратов белка, предположительно по причине совыделения и расщепления Fab-фрагментов протеиназами хозяйской клетки. Легкие цепи могут принадлежать к каппа или лямбда изотипу и соответствуют одному константному домену. Показано, что изотип легкой цепи может оказывать значительное влияние на структуру рекомбинантного Fab-фрагмента антитела, при этом вариант с лямбда изотипом легкой цепи обладает большей конформационной жесткостью и термической стабильностью (Ponomarenko N, Chatziefthimiou SD, Kurkova I, Mokrushina Y, et al. Role of κ→λ light-chain constant-domain switch in the structure and functionality of A17 reactibody. Acta Crystallogr D Biol Crystallogr. 2014;70:708-19).
Задачей настоящего изобретения является создание системы для экспрессии Fab-фрагментов антител с высокой стабильностью конечных препаратов белка. Поставленная задача решается за счет создания двух модифицированных рекомбинантных плазмидных ДНК Ab-HCh-HIS/pPICZ_α_A и Ab-LCh-LAMBDA/pPICZ_α_A, у которых в отличии от описанных ближайших аналогов (Захаров А.В., Смирнов И.В., Серебрякова М.В. и др.//Молекуляр. биология. 2011. Т. 45, №1, С. 86-95 и Ponomarenko N.A., Chatziefthimiou S.D., Kurkova I.N. et al. //Acta Crystallogr. Section D. 2014. Vol.70, N3. P. 708-719) удалены маркерные последовальности 3xFLAG эпитопа в случае тяжелой цепи и с-myc эпитопа в случае легкой цепи, с целью минимизации протеолитической деградации конечного рекомбинантного продукта - Fab-фрагмента антитела - в процессе его наработки в дрожжевой системе и хроматографической очистки. Сайты деградации Fab-фрагментов соответствуют двум типам эндогенных протеаз дрожжей P. pastoris - протеазе А (ЕС 3.4.23.8) и карбоксипептидазе Y (ЕС 3.4.16.5). Такие сайты деградации как His-X, Asn-X, Asp-X, Gln-X, Glu-X в избытке представлены в ближайших аналогах в последовательностях 3xFLAG и с-myc эпитопов, расположенных на С-концах тяжелой и легкой цепей, соответственно. Также в полилинкерные области рекомбинантных плазмидных ДНК Ab-HCh-HIS/pPICZ_α_A и Ab-LCh-LAMBDA/pPICZ_α_A в сравнении с ближайшими аналогами были внесены изменения, а именно сайт узнавания для эндонуклеазы рестрикции BsmBI сохранен, но сдвинут в обоих случаях на 12 нуклеотидов для расщепления последовательностей непосредственно в области, кодирующей лидерный пептид, в рекомбинантную плазмидную ДНК Ab-LCh-LAMBDA/pPICZα_A были добавлены уникальные рестриктные сайты между последовательностями, кодирующими лидерный пептид и константный домен легкой цепи. Таким образом, рекомбинантные плазмидные ДНК Ab-HCh-HIS/pPICZ_α_A и Ab-LCh-LAMBDA/pPICZ_α_A (Фиг. 1) содержат уникальные сайты рестрикции BsmBI и XhoI, Ace65I для клонирования любых вариабельных доменов тяжелой цепи и BsmBI и KpnI, AvrII, HindIII для клонирования любых вариабельных доменов легкой цепи антител между последовательностями, кодирующими лидерный пептид и константный домен тяжелой или легкой цепи и предназначены для последующей котрансформации в метилотрофные дрожжи Pichia pastoris и получения стабильных рекомбинантных Fab-фрагментов антител с лямбда изотипом легкой цепи. При наличии указанных вариантов рестриктных сайтов в последовательности интересующего вариабельного домена тяжелой или легкой цепи для его амплификации методом ПЦР с помощью праймеров могут быть введены сайты для эндонуклеаз рестрикции II типа (BspMI, BsaI и др.), образующие далее при клонировании в рекомбинантные векторы совместимые липкие концы.
Обозначение «pPICZ_α_A» в рекомбинантных плазмидных ДНК Ab-HCh-HIS/pPICZ_α_A и Ab-LCh-LAMBDA/pPICZ_α_A (Фиг. 1) отражает содержание структурных элементов генетической конструкции pPICZαA ("Invitrogen", США) на основе которой были получены ближайшие аналоги (Захаров А.В., Смирнов И.В., Серебрякова М.В. и др.//Молекуляр. биология. 2011. Т. 45, №1, С. 86-95 и Ponomarenko N.A., Chatziefthimiou S.D., Kurkova I.N. et al. //Acta Crystallogr. Section D. 2014. Vol. 70, N3. P. 708-719), а именно индуцибельного промотора гена алкогольоксидазы АОХ1 дрожжей P. pastoris дикого типа, нативного терминатора и сигнала полиаденилирования АОХ1 гена, последовательности гена Sh ble, продукт которого обеспечивает устойчивость трансформантов к антибиотику зеоцин, нуклеотидной последовательности сигнального пептида альфа-фактора из S. cerevisiae, необходимую для секреции экспрессируемых продуктов в культуральную среду. Последовательность, кодирующая сигнальный пептид альфа-фактора была изменена, а именно, были удалены 12 нуклеотидов, кодирующих два ЕА повтора. Удаление ЕАЕА последовательности при процессинге рекомбинантного продукта дипептидил-аминопептидазой дрожжевой клетки STE13 часто проходит неэффективно, поэтому в настоящем изобретении С-конец альфа-факторного пептида оканчивается сайтом узнавания Kex2 протеазы, при этом для клонирования вариабельных доменов тяжелых и легких цепей антител в стык с Kex2 сайтом присутствует сайт узнавания для эндонуклеазы рестрикции II типа BsmBI, что в результате обеспечивает сохранение нативной последовательности N-конца тяжелых и легких цепей Fab-фрагментов антител.
Рекомбинантная плазмида Ab-HCh-HIS/pPICZ_α_A (Фиг. 1А) содержит нуклеотидную последовательность первого константного домена γ1 цепи иммуноглобулина человека (СН1), часть участка шарнирной области, последовательность шести-гистидинового кластера для очистки белкового препарата с использованием металл-аффинной хроматографии. Указанные структурные признаки отражены во введенном обозначении «Ab-HCh-HIS».
Рекомбинантная плазмида Ab-LCh-LAMBDA/pPICZ_α_A (Фиг. 1Б) содержит нуклеотидную последовательность, 12-фрагмента, а также константного лямбда-2 домена легкой цепи, оканчивающуюся стоп-кодоном. Указанные структурные признаки отражены во введенном обозначении «Ab-LCh-LAMBDA».
В рекомбинантной плазмидной ДНК Ab HCh-His/pPicZαA (Фиг. 1А) для экспрессии фрагментов тяжелой цепи антител С-конец гена константного домена слит с 6xHis последовательностью, которая используется для очистки белка на первой стадии с помощью металл-хелатной хроматографии. В рекомбинантной плазмидной ДНК Ab-LCh_lambda/pPICZαA (Фиг. 1Б) для экспрессии фрагментов легкой цепи антител на С-конец гена константного домена перед 6xHis последовательностью введен стоп-кодон. Синтез полноразмерной легкой цепи заканчивается перед 6xHis кластером и, таким образом, она экспрессируется в нативной форме и очищается только в комплексе с тяжелой цепью в виде Fab-фрагмента.
Техническим результатом котрансформации плазмидных ДНК Ab-HCh-HIS/pPICZ_α_A и Ab-LCh-LAMBDA/pPICZ_α_A с предварительно встроенными интересующими вариабельными доменами тяжелых и легких цепей антитела в клетки дрожжей P. pastoris является получение Fab-фрагментов антител с последующей хроматографической очисткой с выходом до 30%, чистотой более 95% и стабильностью не менее 60 дней при хранении при +4°С.
Изобретение иллюстрируют следующими графическими материалами: Фиг. 1. Схематическое изображение модифицированных генетических конструкций для экспрессии Fab-фрагментов антител в дрожжевой системе P. pastoris. (А) - рекомбинантная плазмидная ДНК Ab HCh-His/pPicZ_α_A. (Б) - рекомбинантная плазмидная ДНК Ab-LCh_lambda/pPICZ_α_A.
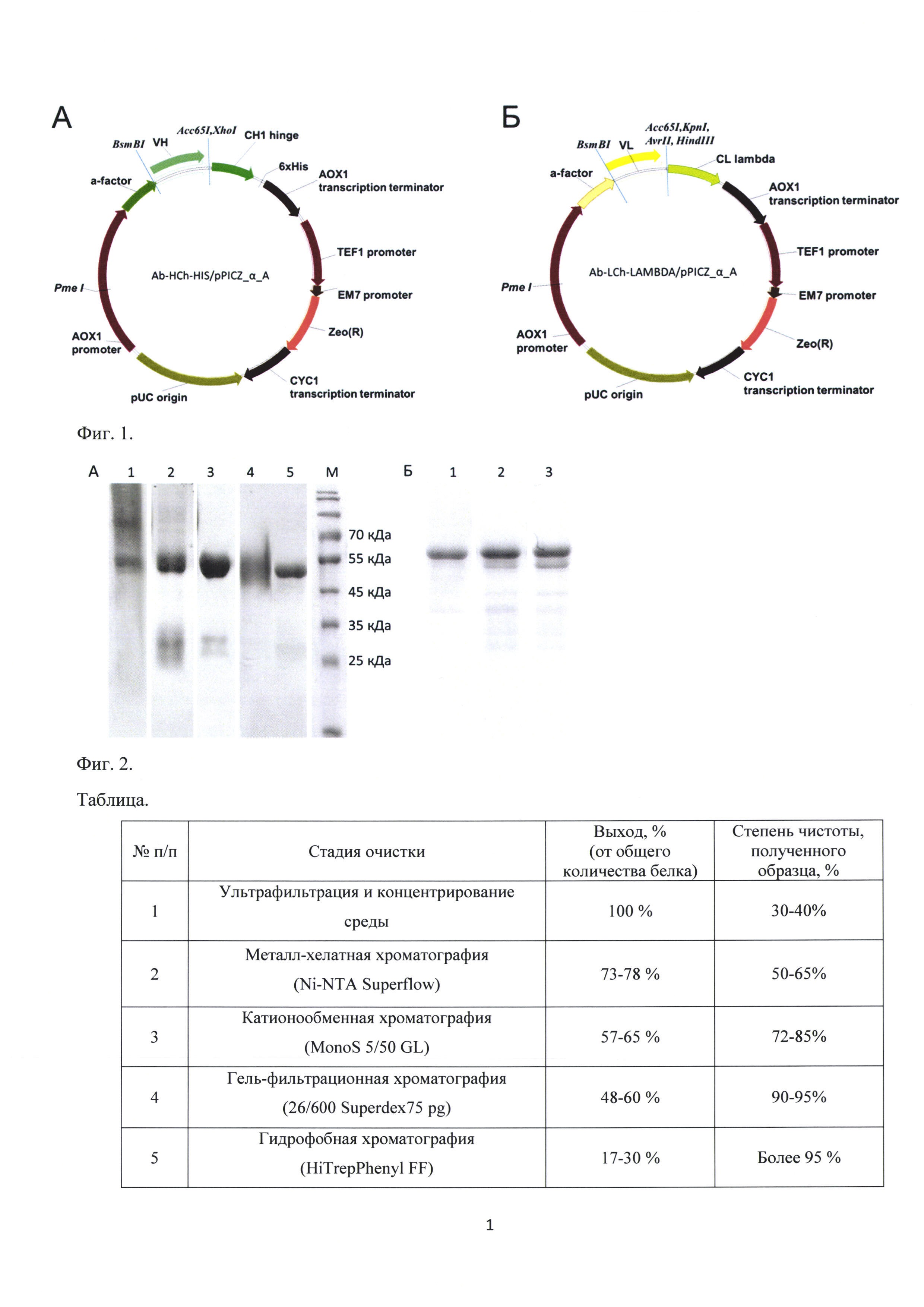
Фиг. 2. Электрофоретический анализ чистоты (А) препаратов Fab-фрагмента антитела А5 lambda на разных стадиях хроматографического выделения (Б) очищенного препаратов Fab-фрагмента антитела А17, с наблюдаемой деградацией по С-концевым эпитопам. На рисунке А: 1 - элюат после металл-хелатной хроматографической очистки, 2 - основная фракция после разделения образца на катионообменной хроматографии, 3 - фракция после проведения гель-фильтрации, 4 - проскок, не связывающийся с гидрофобным сорбентом, 5 - элюат Fab-фрагмента с гидрофобного сорбента, М - маркер молекулярной массы. На рисунке Б: 1 - препарат Fab-фрагмента антитела, содержащего на С-концах цепей с-myc и 3xFLAG эпитопы сразу после процедуры очистки, 2 - после хранения образца на +4°С в течение недели, 3 - после хранения образца на +4°С в течение двух недель. Таблица. Характеристика методики выделения препаратов рекомбинантных Fab-фрагментов антител.
Изобретение иллюстрируют следующими примерами, которые не должны рассматриваться как ограничивающие настоящее изобретение.
ПРИМЕР 1
Создание системы генетических конструкций Ab-LCh_kappa/pPICZ_α_A и Ab-LCh_lambda/pPICZ_α_A.
Оптимизацию генетических конструкций осуществляют на основе полученных ранее векторов pPICZαA/Hch и pPICZαA/Lch (Захаров А.В., Смирнов И.В., Серебрякова М.В. и др.//Молекуляр. биология. 2011. Т. 45, №1, С. 86-95) и pPICZαA/Jλ2 (Ponomarenko N.A., Chatziefthimiou S.D., Kurkova I.N. et al. //Acta Crystallogr. Section D. 2014. Vol. 70, N3. P. 708-719). Для получения оптимизированного вектора Ab HCh-His/pPicZαA для экспрессии фрагментов тяжелой цепи антител первый константный домен γ1 цепи иммуноглобулина человека (СН1) и часть участка шарнирной области амплифицируют методом полимеразной цепной реакции (ПЦР) с конструкции pPICZαA/Hch с использованием специфических праймеров. Полученный ПЦР продукт клонируют в исходный вектор pPICZαA/Hch по сайтам рестрикции Acc65I и SalI с элиминацией 3xFLAG эпитопа. Аналогичным образом для получения конструкций Ab-LCh_kappa/pPICZαA и Ab-LCh_lambda/pPICZαA J-фрагменты и константные домены легких цепей амплифицируют с использованием специфических праймеров методом ПЦР и затем лигируют в вектор pPICZαA/Lch по сайтам рестрикции XhoI-SalI и Acc65I-SalI соответственно. При этом на С-конце элиминируют с-myc эпитоп и с помощью праймеров вводят стоп-код он. На основе созданных векторов получают конструкции для экспрессии антитела А5 - A5_lambda/pPICZαA, A5_kappa/pPICZαA и A5-HCh-His/pPicZαA. Амплификацию вариабельных доменов осуществляют с помощью специфических праймеров с ранее полученной конструкции, кодирующей одноцепочечное антитело, A5ScFvFLAG/pHEN2 (Reshetnyak A.V., Armentano M.F., Ponomarenko N.A. et al. //J. Am. Chem. Soc. 2007. Vol. 129, N51. P. 16175-16182) (Фиг. 1).
При конструировании вектора Ab HCh-His/pPicZαA (Фиг. 1А) для экспрессии фрагментов тяжелой цепи антител удаляют последовательность 3xFLAG эпитопа, а С-конец гена константного домена объединяют с 6xHis последовательностью, которая будет использоваться для очистки белка на первой стадии с помощью металл-хелатной хроматографии. При клонировании сохраняют универсальные сайты рестрикции BsmBI и XhoI, а также Acc65I для встраивания любых вариабельных доменов тяжелой цепи. В векторе Ab-LCh_lambda/pPICZαA (Фиг. 1Б) помимо удаления с-myc эпитопа перед 6xHis последовательностью вводят стоп-кодон. Синтез полноразмерной легкой цепи будет заканчиваться перед 6xHis маркером и, таким образом, она будет экспрессироваться в нативной форме и очищаться только в комплексе с тяжелой цепью в виде Fab-фрагмента. Для клонирования вариабельных доменов легкой цепи в Jl2 участок в процессе ПЦР вводят универсальные сайты рестрикции KpnI, AvrII и HindIII и сохраняют сайт узнавания для BsmBI.
ПРИМЕР 2
Получение штамма-продуцента рекомбинантного Fab-фрагмента в дрожжах Р. pastoris.
Клетки P. pastoris штамма GS115 котрансформируют методом электропорации предварительно линеаризованными по сайту рестрикции Pmel конструкциями A5-HCh-His/pPicZα в паре с A5_lambda/pPICZαA или A5_kappa/pPICZαA. Селекцию трансформантов проводят на антибиотике зеоцин, клон-продуцент с максимальным уровнем продукции отбирают, анализируя суммарные белки культуральной среды в 12% ДСН-ПААГ.
Препаративную наработку Fab-фрагмента антитела А5 проводят в 3-9 л питательной среды BMMY с использованием качалочных колб на 750 мл по рекомендациям фирмы изготовителя ("Invitrogen") с некоторыми модификациями: стартовая плотность культуры для индукции метанолом составляет А600=5.0, метанол добавляют до концентрации 0,5% каждые 24 часа, в это же время также вносят сорбитол до 0,15%, экспрессию проводят на протяжении трех суток.
Полученную после экспрессии Fab-фрагмента антитела А5 культуральную среду центрифугируют для удаления клеток. Далее проводят ультрафильтрацию с использованием фильтрационных модулей 0,45 мм и 0,22 мм и концентрирование среды с помощью ультрафильтрационного модуля Pelicon2 10 кДа. Концентрированный раствор Fab-фрагмента подвергают металл-хелатной хроматографии с использованием сорбента Ni-NTA Superflow (QIAGEN) по протоколу фирмы производителя. Полученный элюат диализуют против 20 мМ CH3COONa рН 6.0. Вторую стадию очистки осуществляют с помощью катионообменной хроматографии с использованием колонки MonoS 5/50 GL (GE Healthcare) согласно инструкции производителя. Для нанесения используют буфер, содержащий 20 мМ CH3COONa рН 6.0, элюцию проводят солевым градиентом NaCl от 0 до 0,35 М в 20 мМ CH3COONa рН 6.0 в 20 объемах колонки при скорости потока 1 мл/мин. Далее фракции, содержащие Fab-фрагмент, очищают гель-фильтрацией на колонке HiLoad 26/600 Superdex75 pg (GE Healthcare) в буфере, содержащем 20 mM NaxH3-xPO4, рН7.4, 300 mM NaCl. Для дальнейшей очистки проводят гидрофобную хроматографию с использованием HiTrepPhenyl HP 5ml (GE Healthcare) в буфере - 1 M (NH4)2S04, 20 mM NaxH3-xPO4, pH7.4. Изократическую элюцию проводят раствором 20 mM NaxH3-xPO4, pH7.4. После каждой стадии очистки проводят электрофорез в ПААГ в не восстанавливающих условиях по стандартной методике Леммли с последующей оценкой чистоты препарата с помощью денситометрического анализа. Результаты очистки представлены в Таблице.
На Фиг. 2А представлен электрофоретический анализ проведения хроматографического фракционирования Fab-фрагмента антитела A51ambda. Полученный конечный образец (Фиг. 2А, дорожка 5) не изменяет свойств электрофоретической подвижности и остается стабильным не менее 60 дней при хранении на +4°С. На Фиг. 2Б представлена сравнительная электрофореграмма очищенного образца Fab-фрагмента, содержащего на С-концах цепей маркерные эпитопы 3xFLAG и с-myc и претерпевающего постепенную деградацию при тех же условиях хранения. Таким образом, разработанная нами система позволяет получать высоко очищенные, гомогенные и стабильные препараты рекомбинантных Fab-фрагментов антител, имеющих терапевтическое значение.