Результат интеллектуальной деятельности: ПРЕПАРАТЫ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к готовым препаративным формам, содержащим макролидное соединение, обладающим высокой способностью к замедленному высвобождению и предназначенным для применения в медицине.
Готовые препаративные формы макролидных соединений для перорального применения, а именно такролимуса с иммуносупресивной активностью, получают как композицию в виде твердой дисперсии, которая характеризуется быстрым высвобождением благодаря использованию полимеров, таких как гидроксипропил-метилцеллюлоза, и дезинтегратора (смотри, например, Европейский патент 0240773). Благодаря наличию дезинтегратора, она является готовой формой с быстрым высвобождением. Она высоко оценивается в клинической практике благодаря ее высокой способности к абсорбции. С другой стороны в клинической практике ожидается появление готовой формы такролимуса для перорального применения с достаточно длительным действием и хорошей способностью к абсорбции. Однако, для квалифицированных специалистов очевидно, что в настоящем уровне техники способность к абсорбции фармацевтически активного агента при введении пероральным путем в виде готовой формы с замедленным высвобождением обычно снижена, и/или что при этом наблюдаются значительные колебания в абсорбционной способности. Авторы настоящего изобретения провели большое количество исследований. В результате, авторы разработали готовые формы макролидных соединений, представителем которых является такролимус, характеризующиеся тем, что макролидное соединение прекрасно абсорбируется при пероральном применении и/или колебания в его абсорбционной способности подавлены.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к готовой препаративной форме макролидного соединения с замедленным высвобождением, где растворение макролидного соединения происходит в условиях замедленного высвобождения.
Целью данного изобретения является создание готовой препаративной формы макролидного соединения с замедленным высвобождением, где время (Т63,2%), требующееся для растворения 63,2% максимального количества соединения макролида составляет от 0,7 до 15 часов, что измерено в соответствии Фармакопеей Японии, 13-ое издание, тест на растворение №2, (метод Puddle, 50 об/мин), с использованием тестового раствора, который является водным 0,005% раствором гидроксипропилцеллюлозы, доведенным до рН 4,5.
Другой целью настоящего изобретения является создание композиции макролидного соединения в виде твердой дисперсии, пригодной для вышеуказанной готовой формы с замедленным высвобождением, где макролидное соединение присутствует в аморфном состоянии на твердой основе.
Еще одной целью настоящего изобретения является создание тонкоизмельченного порошка макролидного соединения, характеризующегося распределением диаметра частиц в пределах от 0,1 до 50 мкм и/или средним диаметром частиц в пределах 0,2-20 мкм для использования в вышеуказанной готовой форме с замедленным высвобождением.
Значение Т63,2%, как определено с помощью теста на растворение в соответствии с данным изобретением, может быть установлено по кривой высвобождения с помощью данных графического теста на разграфленной бумаге. Однако, профиль высвобождения лекарственного средства в целом может быть проанализирован с помощью данных подходящего теста для растворения на модели высвобождения, и подобный способ также может быть использован в вычислении названного значения Т63,2%. Подходящая для использования модель включает модель первого порядка или линейную модель, модель нулевого порядка, модель кубической апроксимации и т.д., как описано в Yamaoka, K. & Yagahara, Y.: Introduction to Pharmacokinetics with a Microcomputer, Nankodo, p.138, но в качестве модели, с помощью которой все виды высвобождаемых частиц могут быть выражены с высокой степенью обоснованности, известна функция Вейбла (Weibull), которая описана в вышеприведенной книге и в L.J. Leeson & J.Т. Carstensen (ed): Release of Pharmaceutical Product (American Pharmaceutical Society) (Chizin Shokan), p. 192-195.
Функция Вейбла представляет собой такую функцию, в которой скорость растворения (%) во времени (Т) и может быть выражена следующим уравнением:
Скорость растворения (%) = Dmax × (1-ехр[-((T-Ti)n)/m])
где Dmax представляет собой максимальную скорость растворения за неограниченное время, m является параметром масштабирования, представляющим скорость растворения, n является параметром формы, представляющим собой профиль кривой растворения, Ti является позиционным параметром, представляющим время запаздывания начала растворения, и характеристика растворения фармацевтического продукта может быть выражена с помощью сочетания этих параметров.
Для того, чтобы приспособить тест растворения к функции Вейбла и подсчитать соответствующие параметры, используется нелинейный метод наименьших квадратов, описанный в Yamaoka, K. & Yagahara, Y.: Introduction to Pharmacokinetics with a Microcomputer, Nankodo, p.40, упомянутом выше. Более конкретно, параметры определяются при значении времени, когда сумма квадратов разниц между значениями, рассчитанными с помощью вышеприведенного уравнения, и измеренными значениями в каждый момент времени, является минимальной, и кривая растворения, рассчитанная с помощью вышеприведенного уравнения с использованием этих параметров, представляет собой такую кривую, которая наиболее достоверно представляет измеренные значения.
Ниже представлено объяснение значения каждого параметра функции Вейбла.
Dmax (максимальная скорость растворения) представляет собой максимальную скорость растворения за неопределенное время, как отмечалось выше, и в целом значение Dmax предпочтительно насколько возможно близко к 100 (%).
m (параметр масштабирования) является параметром, представляющим быстроту растворения фармацевтического продукта, и чем меньше значение m, тем выше скорость растворения, и подобным же образом, чем больше значение m, тем ниже скорость растворения.
n (параметр формы) является параметром, представляющим форму кривой растворения. Когда значение n равно 1, функция Вейбла может быть записана, как скорость растворения (%) = Dmax × {1-ехр[-((Т-Ti)/m]}, и если она эквивалентна кинетике первого порядка, кривая растворения является линейной. Когда значение n меньше 1, кривая растворения выходит на плато. Когда значение n больше 1, преобладает сигмоидная кривая растворения.
Ti (позиционный параметр) представляет собой параметр, представляющий время задержки до начала растворения.
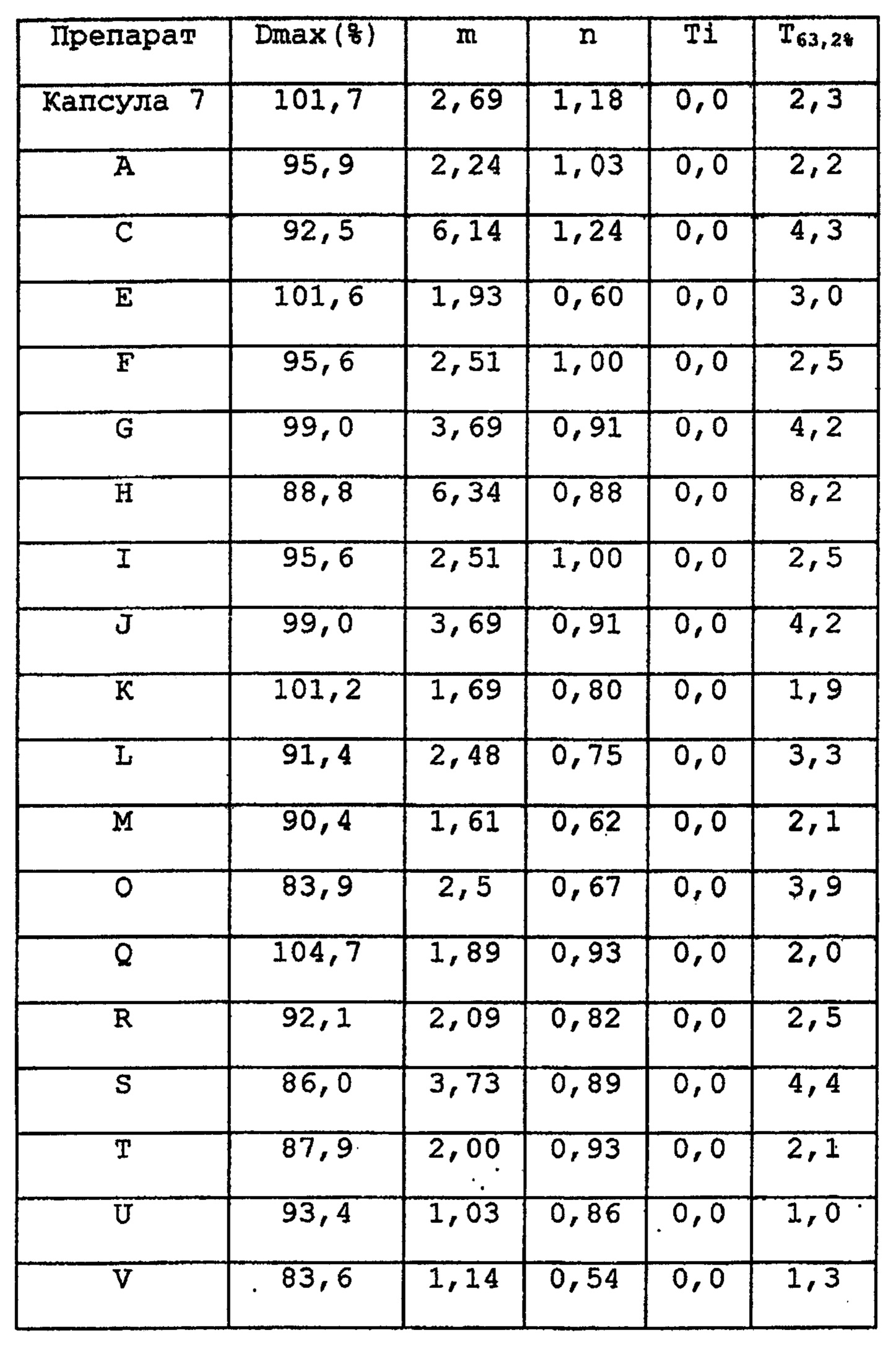
Готовую форму, содержащую макролидное соединение, в соответствии с настоящим изобретением также можно охарактеризовать с помощью функции Вейбла. Так, являющаяся целью настоящего изобретения готовая препаративная форма с замедленным высвобождением может быть получена путем доведения Dmax (максимальной скорости растворения) до 80% и более, предпочтительно до 90% и более, и наиболее предпочтительно до 95% и более, m (параметра масштабирования) до 0,7-20, предпочтительно до 1-12, более предпочтительно до 1,5-8, n (параметра формы) до 0,2-5, предпочтительно до 0,3-3, более предпочтительно до 0,5~1,5 и Ti (позиционного параметра) до 0~12, предпочтительно до 0~8, и более предпочтительно до 0~4.
Значение, найденное путем замены значений параметров m и n с вышеприведенной функции Вейбла на в m1/n, представляет время, за которое 63,2% максимального количества растворения активного ингредиента высвобождается из готовой препаративной формы (Т63,2%). Следует сказать, что Т63,2% (часы) = m1/n. Характеристики высвобождения готовой формы с замедленным высвобождением по данному изобретению могут быть оценены с помощью теста для растворения, Способ 2 ((Paddle способ, 50 об/мин) Фармакопея Японии XIII, с использованием тестового раствора, который представляет собой 0,005% водный раствор гидроксипропилцеллюлозы, доведенный до рН 4,5. В готовой форме с замедленным высвобождением, содержащей макролидное соединение, в соответствии с настоящим изобретением, время (Т63,2%) за которое 63,2% максимального количества макролидного соединения, предназначенного для растворения, высвобождается из готовой формы, составляет 0,7~15 часов. В прошлом, хотя уже получали готовые формы с быстрым высвобождением, включавшие макролидное соединение, никогда не получали какие-либо готовые формы с замедленным высвобождением, Т63,2% которых составляла бы 0,7~15 часов, и которые достаточно удобны для применения в клинической практике. Настоящее изобретение впервые осуществило эту задачу. Если значение Т63,2% меньше, чем 0,7 часа, период эффективности макролидного соединения после перорального применения не будет достаточно длительным. Когда значение Т63,2% готовой формы - более 15 часов, высвобождение активного ингредиента будет таким замедленным, что активный ингредиент будет выводиться из организма до установления его эффективной концентрации в крови, что, таким образом, делает ее непригодной в качестве готовой формы настоящего изобретения. Когда Т63,2% равно 1,0~12 часам, может быть достигнуто более желательное замедленное высвобождение. Более предпочтительно Т63,2% составляет 1,3-8,2 часа, и наиболее предпочтительной готовой формой является такая, у которой значение Т63,2% составляет 2~5 часов.
Термин «макролидное соединение» при использовании в соответствии с настоящим изобретением, обозначает родовое название соединений с 12 членами и более, которые относятся к лактонам с большим кольцом. Макролидные соединения, полученные из микроорганизмов рода Streptomyces, такие как рапамицин, такролимус (FK506) и аскомицин, и их аналоги и производные, включаются в термин «макролидное соединение».
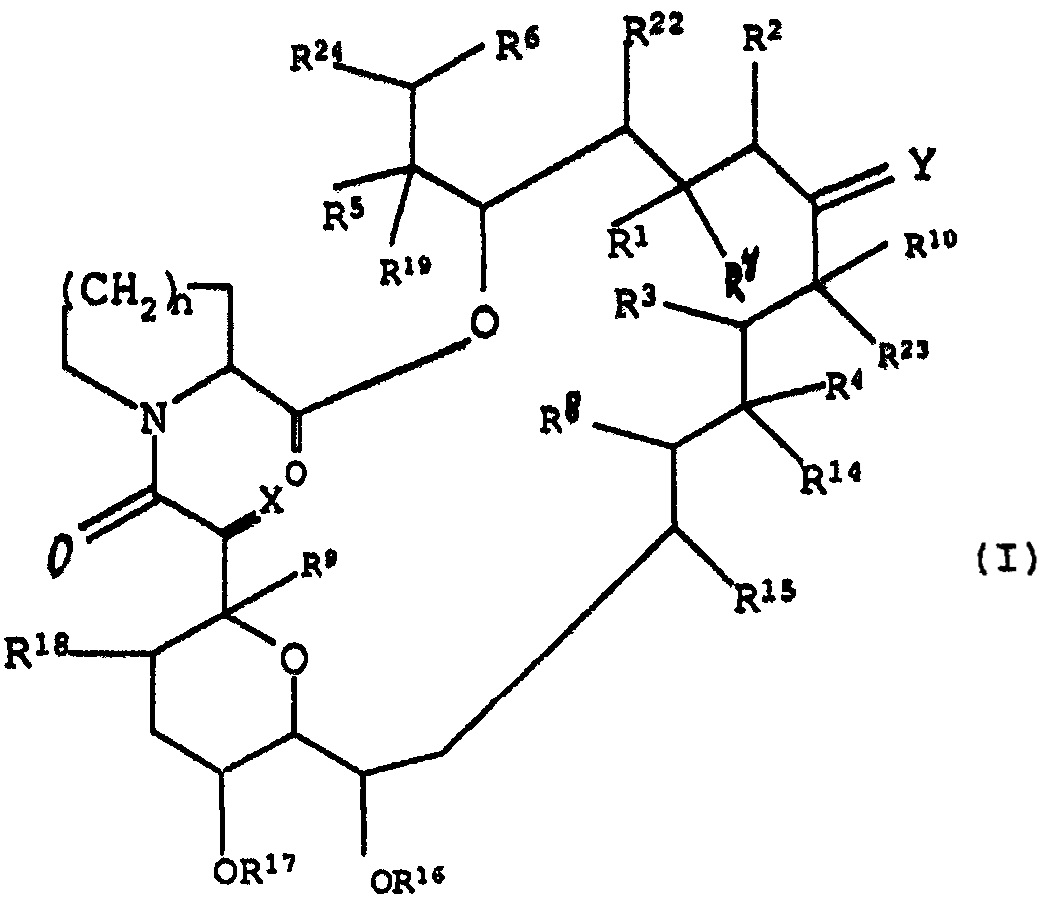
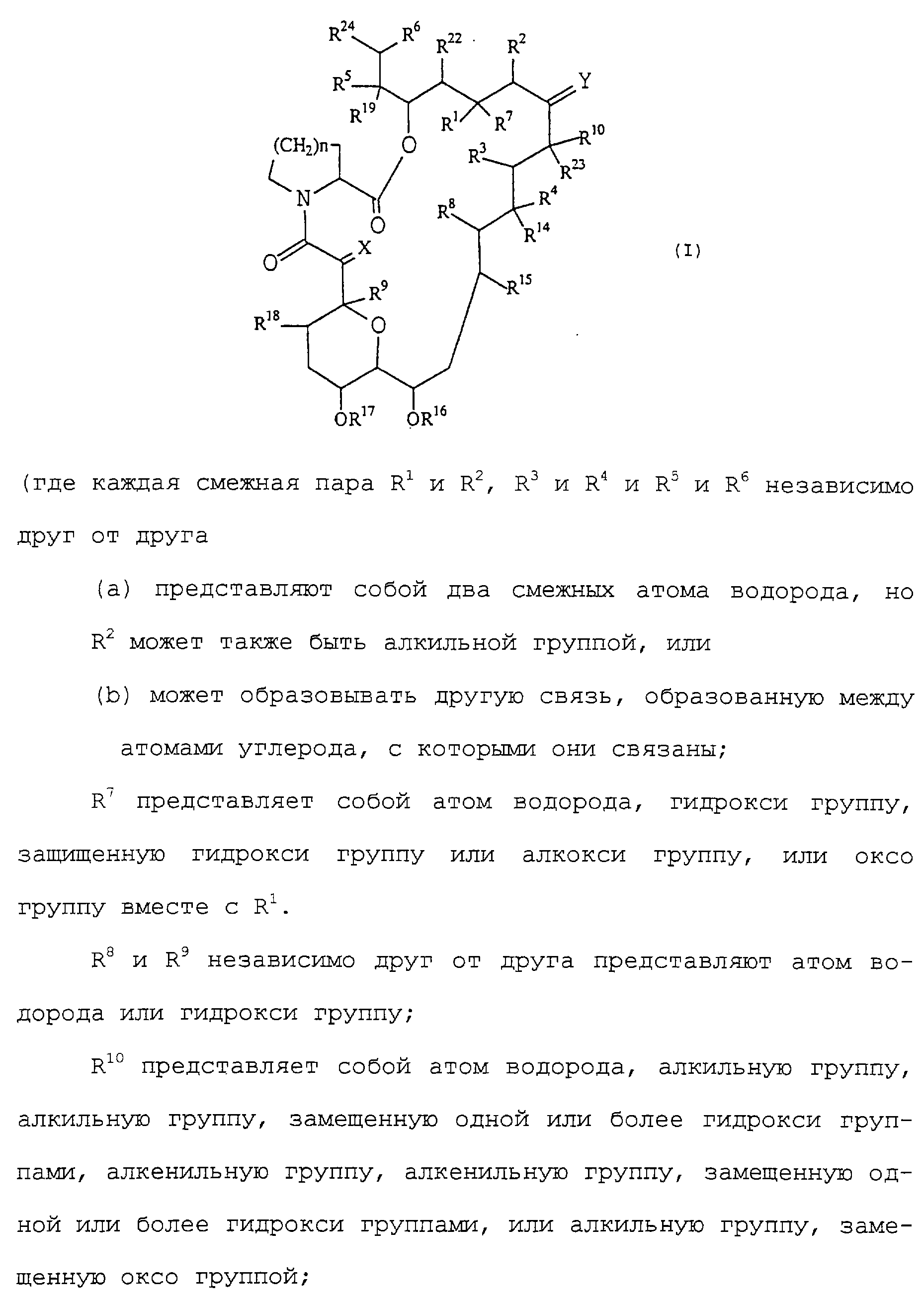
В качестве конкретного примера макролидного соединения может быть приведено трициклическое соединение следующей формулы (I)
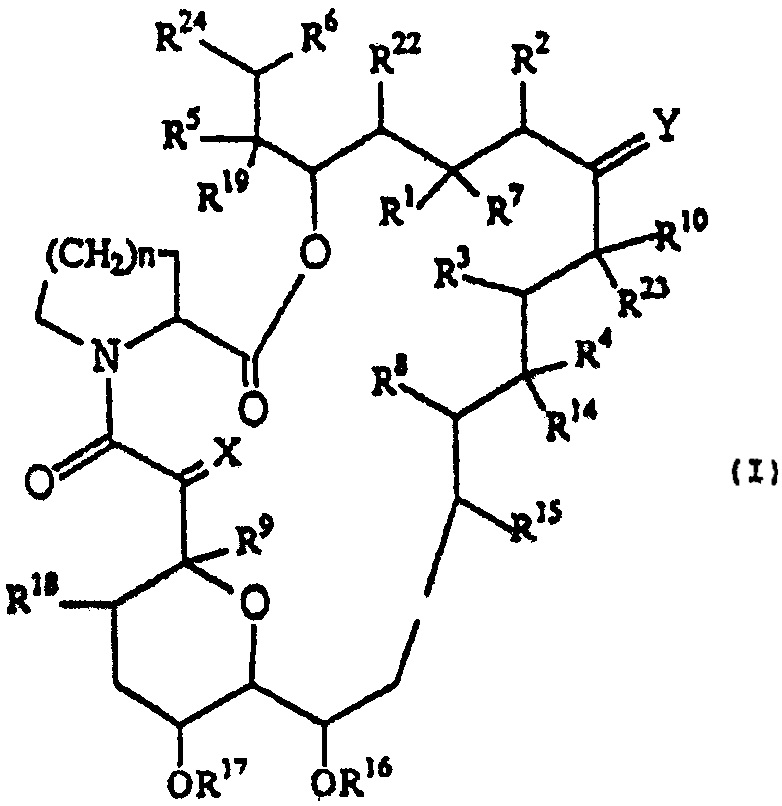
(где каждая смежная пара R1 и R2, R3 и R4 и R5 и R6 независимо друг от друга
(a) представляют собой два смежных атома водорода, но R2 может также быть алкильной группой, или
(b) может образовывать другую связь, образованную между атомами углерода, с которыми они связаны;
R7 представляет собой атом водорода, гидрокси группу, защищенную гидрокси группу или алкокси группу, или оксо группу вместе с R1.
R8 и R9 независимо друг от друга представляют атом водорода или гидрокси группу;
R10 представляет собой атом водорода, алкильную группу, алкильную группу, замещенную одной или более гидрокси группами, алкенильную группу, алкенильную группу, замещенную одной или более гидрокси группами, или алкильную группу, замещенную оксо группой;
X представляет оксо группу (атом водорода и гидрокси группу), (атом водорода и атом водорода) или группу, представленную формулой -СН2О-;
Y представляет оксо группу, (атом водорода и гидрокси группу), (атом водорода и атом водорода) или группу, представленную формулой N-NR11R12 или N-OR13;
R11 и R12 независимо друг от друга представляют атом водорода, алкильную группу, арильную группу или группу тозила;
R13, R14, R15, R16, R17, R18, R19, R22 и R23 независимо друг от друга представляют атом водорода или алкильную группу;
R24 представляет необязательно замещенную кольцевую систем, которая может содержать один или более гетероатомов;
n представляет число 1 или 2; и
в добавление к вьшеприведенным определениям, Y, R10 и R23 вместе с атомами углерода, с которыми они соединены, могут представлять насыщенное или ненасыщенное 5- или 6-членное гетероциклическое кольцо, содержащее азот, серу и/или кислород, необязательно замещенное одной или более групп, выбранных из группы, состоящей из алкила, гидрокси, алкокси, бензила, группы формулы -CH2Se(C6H5) и алкила, замещенного одной или большим количеством гидрокси групп. Предпочтительно R24 может быть цикло (С5-7) алкильной группой и следующими группами, приведенными в виде примера.
(a) 3,4-диоксоциклогексильная группа;
(b) 3-R20-4-R21-циклогексильная группа,
в которой R20 представляет гидрокси, алкокси группу и оксо группу,
или -ОСН2ОСН2СН2ОСН3 группу и
R21 представляет гидрокси, -OCN, алкокси группу,
гетероарилокси, которая может быть замещенной подходящими заместителями, -ОСН2ОСН2СН2ОСН3 группу, замещенную гидрокси группой, хлор, бром, йод, аминооксалилокси, азидо группу, паратолилокситиокарбонилокси, или R25R26CHCOO-,
в которой R25 представляет необязательно защищенную группу
гидрокси или защищенный аминогруппу, и
R26 представляет водород или метил, или
R20 и R21 вместе образуют атом кислорода в эпоксидном кольце; или
(с) циклопентильная группа, замещенная метоксиметилом, необязательно защищенная гидроксиметилом, ацилоксиметилом (в котором ацильный остаток необязательно содержит или диметиламино группу, которая может быть четвертичной, или карбокси группу, которая может быть эстерифицирована), одной или большим количеством амино и/или гидрокси групп, которые могут быть защищенными или аминооксалилоксиметилом. Предпочтительный пример представляет собой 2-формил-циклопентильную группу.
Определения, используемые в вышеприведенной общей формуле (I) и конкретные и их предпочтительные примеры далее будут объяснены и представлены более детально.
Термин «низший» означает, если не указано другое, группу, имеющую от 1 до 6 атомов углерода.
Предпочтительные примеры «алкильных групп» и алкильного фрагмента «алкокси группы» включают алифатический углеводородный остаток с прямой или разветвленной цепью, например, низшую алкильную группу, такую как метил, этил, пропил, изопропил, бутил, изобутил, пентил, неопентил и гексил.
Предпочтительные примеры «алкенильных групп» включают алифатический углеводородный остаток с прямой или разветвленной цепью, имеющий одну двойную связь, например, низшую алкенильную группу, такую как винил, пропенил (например, аллильную группу), бутенил, метилпропенил, пентенил и гексенил.
Предпочтительные примеры «арильной группы» включают фенил, толил, ксилол, куменил, мезитил и нафтил.
Предпочтительные защитные группы в «защищенных гидрокси группах» и защищенном амино представляют 1-(низший алкилтио) - (низшую) алкильную группу, такую как низшая алкилтиометильная группа (например, метилтиометил, этилтиометил, пропилтиометил, изопропилтиометил, бутилтиометил, изобутилтиометил, гексилтиометил и т.д.), более предпочтительно С1-С4 алкилтиометильную группу и наиболее предпочтительно метилтиометильную группу;
тризамещенную силильную группу, такую как три(низший)алилсилил (например, триметилсилил, триэтилсилил, трибутилсилил, трет-бутилдиметилсилил, три-трет-бутилсилил и т.д.) или низший алкилдиарилсилил (например, метилдифенилсилил, этилдифенилсилил, пропилдифенилсилил, трет-бутилдифенилсилил и т.д.), более предпочтительна три(С1-С4)алкилсилильная группа и С1-С4алкилдифенилсилильная группа, наиболее предпочтительна трет-бутилдиметилсилильная группа и трет-бутилдифенилсилильная группа; и ацильную группу, такую как алифатическая, ароматическая ацильная группа или алифатическая ацильная группа, замещенная ароматической группой, которая является производной карбоновой кислоты, серной кислоты или карбаминовой кислоты.
Примеры алифатических ацильных групп включают низшую алканоильную группу, необязательно имеющую один или более подходящих заместителей, таких как карбокси, например, формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил, карбоксиацетил, карбоксипропионил, карбоксибутирил, карбоксигексаноил и т.д.;
цикло (низший) алкокси (низшую) алканоильную группу, необязательно имеющую один или большее количество подходящих заместителей, таких как низший алкил, например, циклопропилоксиацетил, циклобутилпропионил, циклогептилоксибутирил, метилоксиацетил, метилоксипропионил, метилоксибутирил, метилоксипентаноил, метилоксигексаноил и т.д.; камфорсульфонильную группу; или низшую алкилкарбамоильную группу, имеющую один или большее количество подходящих заместителей, таких как карбокси или защищенный карбокси, например, карбокси(низшая)алкоксикарбамоильная группа (например карбоксиметилкарбамоил, карбоксиэтилкарбамоил, карбоксипропилкарбамоил, карбаоксибутилкарбамоил, карбоксипентилкарбамоил, карбоксигексилкарбамоил и т.д.), три(низший)алкилсилил(низший) алкоксиалкоксикарбонил(низшая)алкилкарбамоильная группа (например, триметилсилилметоксикарбонилэтилкарбамоил, триметилсилилэтоксикарбонилпропилкарбамоил, триэтилсилилэтокси-карбонилпропилкарбамоил, трет-бутилдиметилсилилэтокси-карбонилпропилкарбамоил, триметилсилилпропоксикарбонилбутил-карбамоил и т.д.) и т.д.
Примеры ароматических ацильных групп включают ароильную группу, необязательно имеющую один или большее количество подходящих заместителей, таких как нитро, например, бензоил, толуоил, ксилоил, нафтоил, нитробензоил, динитробензоил, нитронафтоил и т.д.; и аренсульфонильную группу, необязательно имеющую один или большее количество заместителей, таких как галоген, например, бензилсульфонил, толуолсульфонил, ксилолсульфонил, нафталинсульфонил, фторбензолсульфонил, хлорбензолсульфонил, бромбензолсульфонил, йодбензолсульфонил и т.д.
Примеры алифатических ацильных групп, замещенных ароматической группой, включают ар(низшую)алканоильную группу, необязательно имеющую один или более подходящих заместителей, таких как низший алкокси или тригалоген(низший)алкил, например, фенилацетил, фенилпропионил, фенилбутирил, 2-трифторметил-2-метокси-2-фенилацетил, 2-этил-2-трифторметил-2-фенилацетил, 2-трифторметил-2-пропокси-2-фенилацетил и т.д.
Более предпочтительными ацильными группами среди вышеперечисленных являются С1-С4алканоильная группа, необязательно имеющая карбокси, цикло(C5-C6)алкокси(C1-С4)алканоильную группу, имеющую два (C1-C4)алкила на циклоалкильном фрагменте, камфоросульфонильная группа, карбокси-(C1-C4)алкилкарбамоильная группа, три(С1-С4)алкилсилил(С1-С4)алкоксикарбонил (С1-С4)-алкилкарбамоильная группа, бензоильная группа, необязательно имеющая одну или более нитро групп, бензолсульфонильная группа, имеющая галоген, или фенил(С1-С4)алканоильная группа, имеющая С1-С4алкокси, и тригалоген(С1-С4)алкильная группа. Среди них наиболее предпочтительными являются ацетил, карбоксипропионил, метилоксиацетил, камфорсульфонил, бензоил, нитробензоил, динитробензоил, йодбензолсульфонил и 2-трифторметил-2-метокси-2-фенилацетил.
Предпочтительные примеры «5- или 6-членного гетероциклического кольца, содержащего азот, серу и/или кислород, включают пирролильную группу и тетрагидрофурильную группу.
«Гетероарильный фрагмент, который может быть замещенным подходящими заместителями» «гетероарилокси, который может быть замещенным подходящими заместителями» может представлять один из примеров, приведенных для R1 соединения формулы ЕР-А-532 088, причем предпочтение отдается 1-гидроксиэтилиндол-5-илу, раскрытие которого включено в виде ссылки.
Хорошо известно, что трициклические соединения (I) и их фармацевтически приемлемая соль, предназначенные для использования в соответствии с настоящим изобретением, обладают прекрасной иммуносупрессивной активностью, противомикробной активностью и другими видами фармакологической активности, и являясь таковыми имеют ценность в лечении или предупреждении реакции отторжения при трансплантации органов и тканей, заболеваний трансплантат-против-хозяина, аутоиммунных заболеваний и инфекционных заболеваний [ЕР-А-0184162, ЕР-А-0323042, ЕР-А-423714, ЕР-А-427680, ЕР-А-465426, ЕР-А-480623, ЕР-А-532088, ЕР-А-532089, ЕР-А-569337, ЕР-А-62-6385, WO89/05303, WO93/05058, W096/31514, W091/13889, WO91/19495, WO93/5059 ид.].
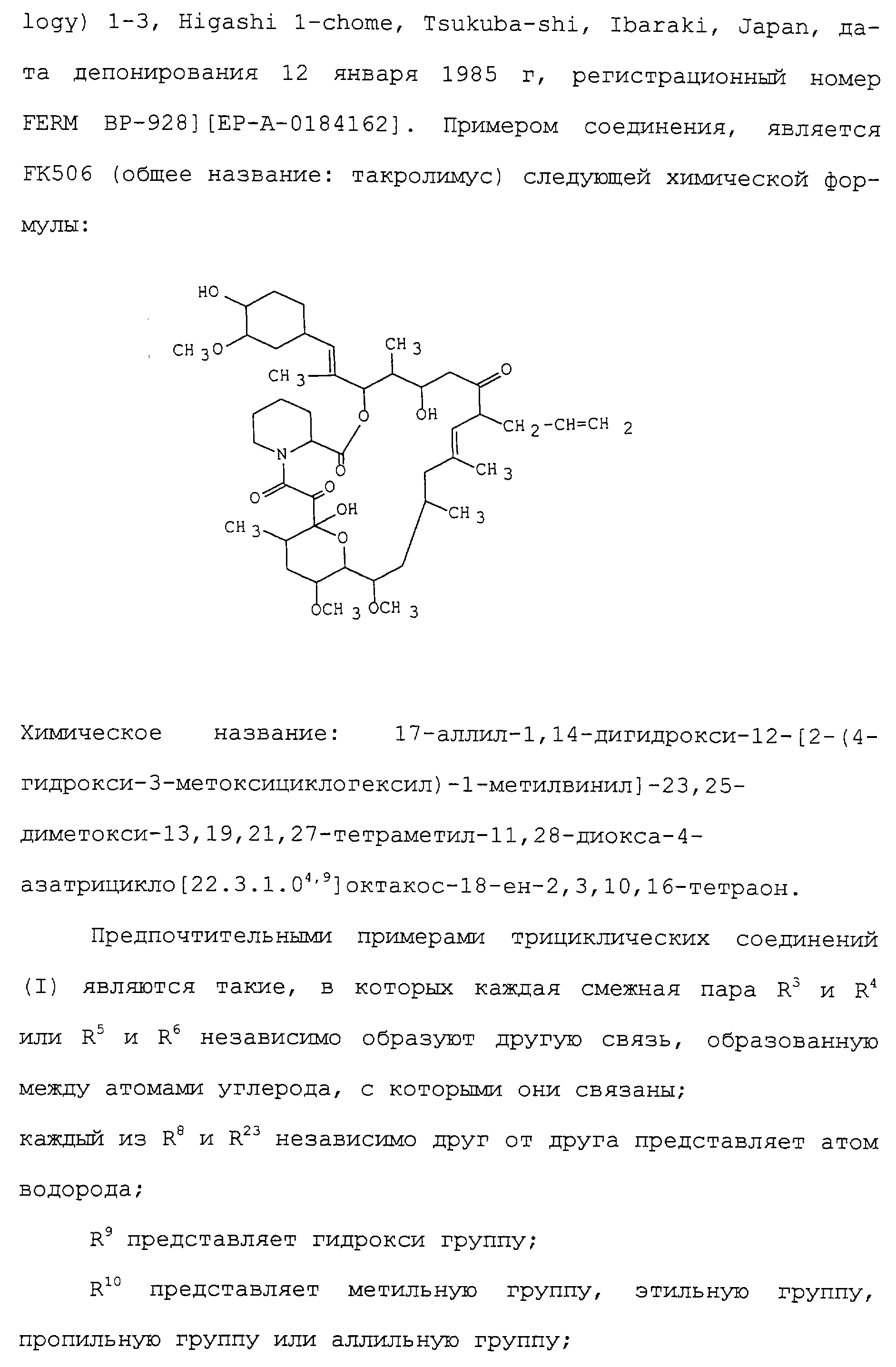
В частности, соединения, которые обозначены как FR900506 (=FK506), FR900520 (аскомицин), FR900523 и FR900525, являются продуктами, продуцируемыми микроорганизмами рода Streptomyces, такими как Streptomyces tsukubaensis №9993 [депонированные в National Institute of Bioscience and Human Technology Agency of Industrial Science and Technology (бывшее Fermentation Research Institute Agency of Industrial Science and Technology) 1-3, Higashi 1-chome, Tsukubashi, Ibaraki, Japan, дата депонирования 5 октября 1984 г, регистрационный номер FERM ВР-927] или Streptomyces hygroscopicus subsp. Yakushimaensis №7238 [депонированные National Institute of Bioscience and Human Technology Agency of Industrial Science and Technology (бывшее Fermentation Research Institute Agency of Industrial Science and Technology) 1-3, Higashi 1-chome, Tsukuba-shi, Ibaraki, Japan, дата депонирования 12 января 1985 г, регистрационный номер FERM ВР-928] [ЕР-А-0184162]. Примером соединения, является FK506 (общее название: такролимус) следующей химической формулы:
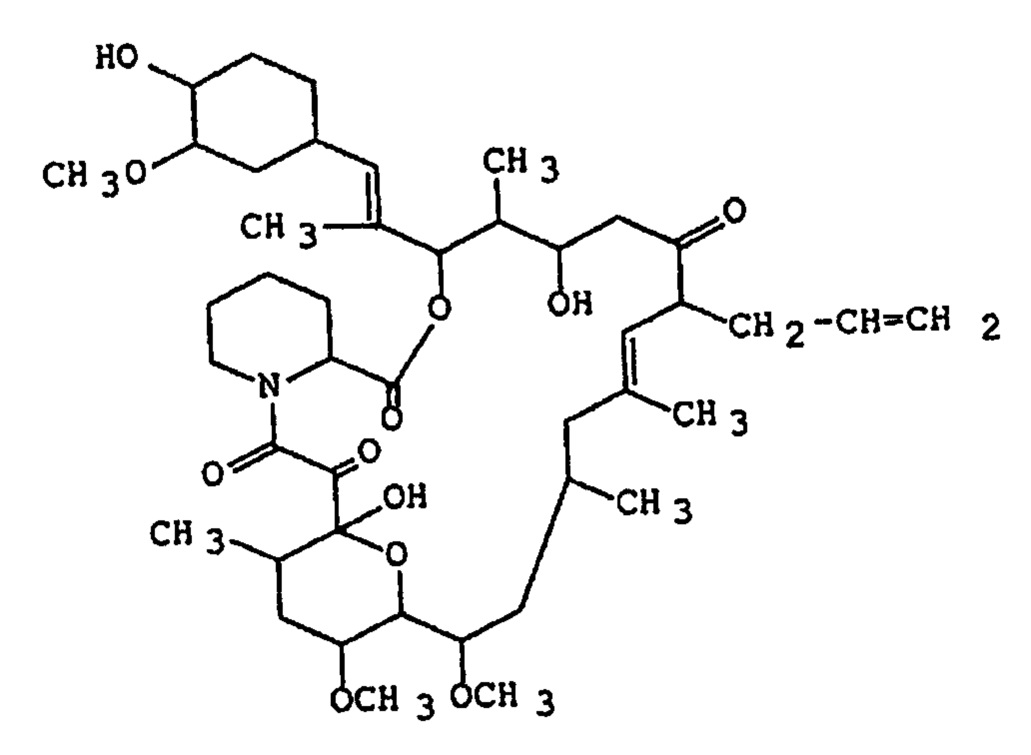
Химическое название: 17-аллил-1,14-дигидрокси-12-[2-(4-гидрокси-3-метоксициклогексил)-1-метилвинил]-23,25-диметокси-13,19,21,27-тетраметил-11,28-диокса-4-азатрицикло [22.3.1.04,9]октакос-18-ен-2,3,10,16-тетраон.
Предпочтительными примерами трициклических соединений (I) являются такие, в которых каждая смежная пара R3 и R4 или R5 и R6 независимо образуют другую связь, образованную между атомами углерода, с которыми они связаны;
каждый из R8 и R23 независимо друг от друга представляет атом водорода;
R9 представляет гидрокси группу;
R10 представляет метильную группу, этильную группу, пропильную группу или аллильную группу;
X представляет (атом водорода и атом водорода) или оксо группу;
Y представляет оксо группу;
каждый из R14, R15, R16, R17, R18, R19 и R20 представляет метильную группу;
R24 представляет 3-R20-4-R21-циклогексильную группу,
в которой каждая R20 представляет собой гидрокси, алкокси группу и оксо группу,
или -ОСН2ОСН2СН2ОСН3 группу, и
R21 представляет гидрокси, -OCN, алкокси группу, гетероарилокси, которая может быть замещенной подходящими заместителями, -ОСН2ОСН2СН2ОСН3 группу, защищенную гидрокси группой, хлор, бром, йод, аминооксалилокси, азидо группу, пара-толилокситиокарбонилокси или R25R26CHCOO-,
в которой R25 является необязательно защищенной гидрокси
или защищенной амино, и
R26 является водородом или метилом или
R20 и R21 вместе образуют атом кислорода в эпоксидном кольце; и
n представляет число 1 или 2.
Наиболее предпочтительными трициклическими соединениями (I) кроме FK506 являются производные аскомицина, такие как галогенированный аскомицин (например, 33-эпи-хлор-33-дезоксиаскомицин), который раскрывается в ЕР 427680, пример 66а.
В качестве другого предпочтительного примера макролидов, как иммуносупрессантов, можно привести рапамицин [THE MERCK INDEX (12-ое издание) №8288] и его производные. Предпочтительным примером производных является О-замещенное производное, в котором гидрокси в положении 40 формулы А, представленной на стр. 1 WO 95/16691, включенного в качестве ссылки, замещен на OR1, в которой R1 представляет гидроксиалкил, гидроалкоксиалкил, ациламиноалкил и аминоалкил; например, 40-О-(2-гидрокси)этилрапамицин, 40-О-(3-гидрокси) пропилрапамицин, 40-О-[2-(2-гидрокси)этокси]этилрапамицин и 40-O-(2-ацетаминоэтил)-рапамицин. Эти O-замещенные производные могут быть получены путем взаимодействия рапамичина (или дигидро- или деоксирапамицина) с органическим радикалом, связанным с удаляемой группой (например RX, где R представляет органический радикал, который обозначают, как О-заместитель, такой как алкильный, аллильный или бензильный фрагмент, и X представляет удаляемую группу, такую как CCl3(NH)O или CF3SO3) при соответствующих условиях реакции. Условия могут быть кислотными или нейтральными, например, в присутствии кислоты, такой как трифторметансульфоновая кислота, камфорсульфоновая кислота, пара-толуолсульфоновая кислота или соответствующие им пиридиновые или замещенные пиридиновые соли, когда X представляет CCl3C(NH)О, или в присутствии основания, такого как пиридин, замещенный пиридин, диизопропилэтиламин или пентаметилпиперидин, когда X представляет собой CF3SO3. Наиболее предпочтительным является 40-O-(2-гидрокси)этилрапамицин, который раскрывается в WO 94/09010, раскрытие которого включено в качестве ссылки.
Трициклическое соединение (I) и рапамицин и их производные имеют одинаковую базовую структуру, то есть структуру трициклического макролида, и по крайней мере одно из исходных биологических свойств (например, иммуносупрессивную активность).
Трициклические соединения и рапамицин и их производные могут быть в форме соли, которые включают общепринятые нетоксичные и фармацевтически приемлемые соли, такие как соли с неорганическим или органическим основанием, в частности, соль щелочного металла, такую как натриевая соль и калиевая соль, и соль щелочноземельного металла такую как кальциевая соль и магниевая соль, соль аммония и соль амина, такую как соль триэтиламина и соль N-бензил-N-метиламина.
Что касается макролидного соединения, используемого в настоящем изобретении, следует понимать, что они могут быть представлены в виде конформеров и одного или большего количества стереоизомеров, таких как оптические и геометрические изомеры благодаря асимметричному(ым) атому(мам) углерода или двойной(ым) связи(ям), и что в настоящем изобретении подобные конформеры и изомеры также включаются в область макролидных соединений. Кроме того, соединения макролида могут иметь вид сольвата, который включается в область настоящего изобретения. Сольват предпочтительно включает гидрат и этанолат.
Один из конкретных предпочтительных примеров готовой препаративной формы с замедленным высвобождением в соответствии с настоящим изобретением представляет препарат, содержащий композицию в виде твердой дисперсии, где макролидное соединение присутствует Ь виде аморфного вещества на твердой основе, которое показывает Т63,2 равное 0,7-15 часам. Присутствие или отсутствие дифракционного пика, полученного с помощью рентгеновской кристаллографии лучей, температурного анализа и т.д., указывает на то, присутствует или нет макролидное соединение в аморфном состоянии на твердой основе в композиции в виде твердой дисперсии.
В качестве твердой основы для использования в упомянутой выше композиции в виде твердой дисперсии применима такая фармацевтически приемлемая основа, которая способна поддерживать соединение макролида в аморфном состоянии и сама находящаяся в твердом состоянии при температуре окружающей среды. Предпочтительно, твердая основа представляет собой фармацевтически приемлемое водо-растворимую основу; и более предпочтительно, такая основа, например, представляет собой следующие водорастворимые полимеры:
поливинилпирролидон (PVP), целлюлозный полимер [гидроксипропилметилцеллюлоза (НРМС), гидроксипропилметил-целлюлозы фталат, метилцеллюлоза (МС), натриевая соль карбоксиметилцеллюлозы (CMC-Na), гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза (НРС) и т.д.], пектин, циклодекстрины, галактоманнан, полиэтиленгликоль (PEG) со средним молекулярным весом 4000 и более, желатин и т.д.
Кроме того, водорастворимые полимеры используются сами по себе или в смеси двух или более. Более предпочтительной водорастворимой основой является целлюлозный полимер или PVP; и наиболее предпочтительной водорастворимой основой является НРСМ, PVP или их сочетание. В частности, более желательный эффект замедленного высвобождения может быть достигнут при использовании НРМС с низкой вязкостью; водный 2% раствор НРМС имеет вязкость от 1 до 4000 сПз, предпочтительно от 1 до 50 сПз более предпочтительно от 1 до 15 сПз, при измерении при 20°С измерителем вязкости типа Bookfield; в частности, предпочтительной является НРМС с вязкостью 3 сПз (ТС-5Е, EW, Shin-estu chemical Co., Ltd.).
Весовое соотношение акролидного соединения и подобной водо-растворимой основы предпочтительно составляет от 1:0,05 до 1:2, более предпочтительно от 1:0,1 до 1:1, и наиболее предпочтительно от 1,0,2 до 1:0,4.
Кроме того, примером твердой основы может служить водо-нерастворимая фармацевтически приемлемая основа, способная поддерживать макролидное соединение в аморфном состоянии, и которая сама при этом находится в твердом состоянии при температуре окружающей среды. Более конкретно, твердая основа включает, например, воск и водонерастворимые полимеры.
Конкретно, предпочтительные примеры воска включают моностеарат глицерина и сложные эфиры жирных кислот и сахарозы (например, моно-, ди- или три- сложные эфиры сахарозы с умеренным до высокого содержанием жирных кислот с 8-20 атомами углерода, например, каприловая кислота, каприновая кислота, лауриловая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, арахиновая кислота, бегеновая кислота, олеиновая кислота, линолевая кислота и т.д.). Дополнительные примеры смол включают сложный эфир жирных кислот и полиглицерина. Любой сложный эфир жирных кислот и полиглицерина, включая моноэфир, диэфир или полиэфир полиглицерина с жирной кислотой, является удовлетворительным. Характерные примеры сложных эфиров жирных кислот и полиглицерина включают, например, бегенат гекса(тетра)глицерида, каприлат моно(дека)глицерида, каприлат ди(три)глицерида, капрат ди(три)глицерида, лаурат моно(тетра)глицерида, лаурат моно(гекса) глицерида, лаурат моно(дека) глицерида, олеат моно(тетра)глицерида, олеат моно(гекса)глицерида, олеат моно(дека)глицерида, олеат ди(три)глицерида, олеат ди(тетра)глицерида, олеат сескви(дека)глицерида, олеат пента(тетра)глицерида, олеат пента(гекса)глицерида, олеат дека(дека)глицерида, линолеат моно(гепта)глицерида, линолеат ди(три)глицерида, линолеат ди(тетра)глицерида, линолеат ди(гекса)глицерида, стеарат моно(ди)глицерида, стеарат моно(тетра)глицерида, стеарат моно(гекса)глицерида, стеарат моно(дека)глицерида, стеарат три(тетра)глицерида, стеарат три(гекса)глицерида, стеарат сескви(гекса)глицерида, стеарат пента(тетра)глицерида, стеарат пента(гекса)глицерида, стеарат дека(дека)глицерида, пальмитат моно(тетра)глицерида, пальмитат моно(гекса)глицерида, пальмитат моно(дека)глицерида, пальмитат три(тетра)глицерида, пальмитат три(гекса)глицерида, пальмитат сескви(гекса)глицерида, пальмитат пента(тетра)глицерида, пальмитат пента(гекса)глицерида и пальмитат дека(дека)глицерида. Предпочтительные сложные эфиры жирных кислот и полиглицерина представляют собой, например, бегенат гекса(тетра)глицерида [например, Poem J-46B под коммерческим наименованием, производства Rinken Vitamin Co., Ltd.], стеарат пента(тетра)глицерид [например, PS-310 под коммерческим наименованием, производства Sakamoto Yakuhin Kogyo Co., Ltd.], стеарат моно(тетра)глицерида [например, MS-310 под коммерческим наименованием, производства Sakamoto Yakuhin Kogyo Co., Ltd.], стеарат пента(гекса)глицерида [например, PS-500 под коммерческим наименованием, производства Sakamoto Yakuhin Kogyo Co., Ltd.], стеарат сескви(гекса)глицерида [SS-500 под коммерческим наименованием, производства Sakamoto Yakuhin Kogyo Co., Ltd.], стеарат моно(дека)глицерида и их смесь. Более предпочтительными восками являются моностеарат глицерина и сложный эфир низшего-HLB и сахарозы с жирной кислотой [например, F-50, F-20, F-10 и т.д., поизводства Dai-ichi Kogyo Seiyaku Co., Ltd.].
Весовое соотношение макролидного соединения и воска, когда воск представляет собой, например, моностеарат глицерина, составляет предпочтительно от 1:10 до 1:100, более предпочтительно от 1:40 до 1:60; когда воск представляет собой, например, сложный эфир жирных кислот и сахарозы, весовое соотношение макролидного соединения и воска предпочтительно составляет от 1:0,2 до 1:20, более предпочтительно от 1:0,5 до 1:5; и когда воск представляет собой сложный эфир жирных кислот и полиглицерина, их весовое соотношение составляет предпочтительно 1:0,1 до 1:100, более предпочтительно от 1;0,5 до 1:50.
Предпочтительные водонерастворимые полимеры включают, например, этилцеллюлозу, метакрилатные сополимеры (например, Eudragits, такой как Eudragit Е, R, S, RS, LD и т.д.). В случае, когда водонерастворимые полимеры представляют этилцеллюлозу, в настоящем изобретении может быть использован ее фармацевтически приемлемый полимер. Однако, его предпочтительная вязкость составляет от 3 до 110 сПз, более предпочтительно от 6 до 49 сПз, наиболее предпочтительно от 9 до 11 сПз, когда вязкость 5% раствора этилцеллюлозы-толуола/этанола (80/20) измеряется с помощью теста вязкости, описанного в патенте США 23, NF18. Например, предпочтительным является ETHOCELL (вязкость: 10) (товарный знак, Dow Chemical (VS)).
Весовое соотношение макролидного соединения и водонерастворимого полимера предпочтительно составляет от 1:0,01 до 1:10, более предпочтительно от 1:0,1 до 1:5; когда водонерастворимый полимер представляет этилцеллюлозу, наиболее предпочтительно – от 1:0,1 до 1:1; когда водонерастворимый полимер представляет собой метакрилатный сополимер, их весовое соотношение наиболее предпочтительно составляет от 1:0,5 до 1:5.
При получении композиции в виде твердой дисперсии настоящего изобретения вышеприведенная твердая основа, такая как водорастворимая основа и водонерастворимая основа, может быть использована как сама по себе, так и в виде сочетания нескольких основ. В случае, когда твердая основа в настоящем изобретении представлена в виде водонерастворимой основы, подходящий профиль растворения композиции в виде твердой дисперсии может быть получен при смешивании подходящего количества водорастворимой основы, такой как водорастворимый полимер (например, НРМС). При необходимости для получения композиции в виде твердой дисперсии для обычного использования добавляют другую, отличную от описанной выше твердую основу, подходящие эксципиенты (лактозу и т.д.), связывающие вещества, красящий агент, подсластители, ароматизатор, разбавители, антиоксиданты (витамин Е и т.д.) и смазывающие вещества (например, синтетический силикат алюминия, стеарат магния, гидрофосфат кальция, стеарат кальция, тальк и т.д.).
Следует добавить, что в зависимости от вида твердой основы скорость растворения маролидного соединения из композиции в виде твердой дисперсии иногда слишком медленна, или иногда в ускорении нуждается начальная скорость растворения. В этом случае скорость растворения макролидного соединения из композиции в виде твердой дисперсии может быть доведена до необходимого уровня добавлением к композиции в виде твердой дисперсии соответствующих дезинтеграторов [например, кроскармелозы натрия (CC-Na), карбоксиметилцеллюлозы/кальция (CC-Na), низшей-замещенной гидроксипропилцеллюлозы (L-НРС), гликолята натрий крахмала, мелко-дисперсной целлюлозы, кроссповидона и т.д.] или соответствующего сурфактанта [например, отвержденного полиоксиэтилена касторовое масло, полиоксистеарата 40, полисорбата 80, лаурилсульфата натрия, сложного эфира жирной кислоты и сахарозы (HLB более 10) и т.д.]. Однако, когда твердая основа представляет собой водорастворимую основу, предпочтительно, чтобы при получении готовой формы с замедленным высвобождением настоящего изобретения композиция в виде твердой дисперсии не содержала существенного количества дизинтегратора.
Размер частиц композиции в виде твердой дисперсии, в которой макролидное соединение присутствует в аморфном состоянии на твердой основе, предпочтительно равен или меньше 500 мкм. Более предпочтительно композиция состоит из части размером около 300 мкм, и наиболее предпочтительно 250 мкм.
Кроме того, композиция макролидного соединения в виде твердой дисперсии, входящая в готовую препаративную форму с замедленным высвобождением в соответствии с настоящим изобретением, может быть получена способом, описанным в европейском патенте ЕР 0240773 и WO 91/19495 и им подобным; более подробно эти способы будут описаны ниже.
Макролидное соединение растворяют в органическом растворителе, например, этаноле, дихлорметане или их водной смеси и т.д.), с последующим добавлением соответствующего количества твердой основы, и полученную в результате смесь соответствующим образом растворяют или суспендируют вместе или дают набухнуть. Затем смесь соответствующим образом смешивают в общую массу. После удаления из смеси органического растворителя остаток сушат и размалывают и затем подвергают уменьшению размера частиц, получая при этом композицию в виде твердой дисперсии, в которой макролидное соединение присутствует в аморфном состоянии на твердой основе. Помимо этого в процессе измельчения к смеси при необходимости добавляют смазывающее вещество, такое как гидрофосфат кальция, зксципиенты, такие как лактоза, и им подобные.
Готовая препаративная форма с замедленным высвобождением, содержащая макролидное соединение в соответствии с настоящим изобретением также может быть получена с использованием тонкоизмельченного порошка макролидного соединения. Контроль размера частиц макролидного соединения может быть осуществлен с помощью размалывающих механизмов, которые обычно используются в фармакологической промышленности, таких как, к примеру, игольчатая мельница, молотковая мельница, струйная мельница и сухая или влажная шаровая мельница. Тонкоизмельченный порошок макролидного соединения должен иметь распределение диаметра частиц в границах 0,1~50 мкм, предпочтительно 0,2~20 мкм, и наиболее предпочтительно 0,5~10 мкм, и/или средний диаметр частиц 0,2~20 мкм, предпочтительно 0,5~10 мкм и наиболее предпочтительно 1~5 мкм.
Композиция в виде твердой дисперсии и тонкоизмельченный порошок макролидного соединения, полученный таким образом с помощью вышеприведенных способов, могут быть использованы сами по себе в виде готовой препаративной формы с замедленным высвобождением. С точки зрения удобства применения готовой препаративной формы, способности к образованию дисперсии в воде и образованию дисперсии после перорального применения, композицию предпочтительно получать в виде готовой препаративной формы с замедленным высвобождением в форме порошка, мелкого порошка, гранул, таблеток или капсул с помощью обычных способов получения готовых препаративных форм (например, формирование компрессионным способом).
При необходимости, готовую препаративную форму с замедленным высвобождением можно также получать смешиванием композиции в виде твердой дисперсии или тонкоизмельченного порошка макролидного соединения с, например, обычно применяющимися разбавителями или смазывающими веществами (такими как сахароза, лактоза, крахмал, кристаллическая целлюлоза, синтетический кремний, силикат алюминия, стеарат магния, стеарат кальция, гидрофосфат кальция и тальк) и/или красящими агентами, подсластителями, ароматизаторами и дезинтеграторами. Полученную в результате смесь затем тщательно перемешивают до получения готовой формы с замедленным высвобождением. Готовая форма с замедленным высвобождением или композиция в виде твердой дисперсии или тонкоизмельченный порошок макролидного соединения настоящего изобретения могут быть предварительно диспергированы в воде и соке для перорального применения в виде жидкой готовой формы.
Эффективная доза макролидного соединения варьируется в зависимости от вида соединения, возраста пациента, его (ее) заболевания, тяжести заболевания или от других факторов. В общем, эффективный ингредиент используется в дозе от около 0,001 до 1000 мг, предпочтительно от 0,01 до 500 мг, более предпочтительно от 0,1 до 100 мг в день для терапевтического лечения заболевания; в общем средняя единичная доза составляет около 0,01 мг, 0,1 мг, 0,5 мг, 1 мг, 5 мг, 10 мг, 50 мг, 100 мг, 250 мг и 500 мг.
После перорального применения готовая форма макролидного соединения с замедленным высвобождением в соответствии с настоящим изобретением характеризуется тем, что высвобождает макролидное соединение замедленным образом, и фармацевтическая активность поддерживается в течение длительного периода. В соответствии с настоящим изобретением частота применения фармакологически активного макролидного соединения может быть снижена. Более конкретно, стало возможным предложить готовую форму, содержащую макролид, которая может применяться только один раз в день. Более того, теперь стало возможным получение такой фармацевтической композиции, которая не несет риска нежелательных эффектов, вызванных случайной избыточной концентрацией, и обеспечивает проявление фармакологической эффективности в течение достаточно протяженного периода времени.
Готовая форма с замедленным высвобождением настоящего изобретения может применяться для лечения и/или предупреждения следующих заболеваний и состояний, благодаря фармакологической активности, которой обладают названные макролидные соединения, в особенности трициклические соединения (I).
Реакции отторжения при трансплантации органов и тканей, таких как сердце, почки, печень, костный мозг, кожа, роговица, легкие, поджелудочная железа, тонкая кишка, конечности, мышцы, нервы, межпозвоночный диск, трахея, миобластичестная ткань, хрящ и т.д.; реакция ховяин-против-гостя после трансплантации костного мозга;
аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, тиреоидит Хашимото, множественных склероз, псевдопаралитическая миастения, диабет типа I и т.д.;
и инфекционные заболевания, вызванные патогенными микроорганизмами (например, Aspergillus fumigatus, Fusarium oxysporum, Trichophyton asteroides и т.д.).
Воспалительные или гиперпролиферативные кожные заболевания или кожная манифестация иммунологически-вызванных заболеваний (например, псориаз, атонический дерматит, контактный дерматит, экзематозный дерматит, себорейный дерматит, плоский лихен, пузырчатка, буллезный пемфигоид, врожденных буллезный эпидермолиз, крапивница, ангиоэдема, васкулит, эритема, дермальная эозонофилия, красная волчанка, акне и гнездная алопеция);
аутоиммунные заболевания глаза (например, кератоконъ-юнктивит, хронический двухсторонний конъюнктивит, увеит, связанный с болезнью Бичета, кератит, герпетический кератит, конический кератит, эпителиальная дистрофия роговицы, кера-толейкома, premphigus глазного яблока, язва Мурена, офтальмопатия Грависа, синдром Vogt-Koyanagi-Harada, сухой керато-конъюктивит (сухой глаз), фликтенула, иридоциклит, сакроидоз, эндокринная офтальмопатия и т.д.);
реверсивные обструктивные заболевания дыхательных путей [астма (например, бронхиальная астма, аллергическая астма, внутренняя астма, наружная астма, пылевая астма), в особенности хроническая и застарелая астма (например, поздняя астма и повышенная нечувствительность воздушных путей) бронхиты и т.д.];
воспалительные заболевания слизистых или сосудов (например, язва желудка, ишемическое поражение сосудов или в результате тромбообразования, ишемические заболевания пищеварительного тракта, энтериты, некротический энтероколит, заболевания кишечника, связанные с термическими ожогами, заболевания, медиированные лейкотриеном В4);
воспалительные/аллергические заболевания кишечника (например, кишечнополостные заболевания, проктит, эозинофильный гастроэнтерит, мастоцитоз, заболевания Крона и язвенный колит);
пищевые аллергические заболевания с отдаленной манифестацией симптомов в желудочно-кишечном тракте (например, мигрень, риниты и экзема);
почечные заболевания (например, интестинальный нефрит, синдром Гудпасчера, гемолитический уремический синдром и диабетическая нефропатия);
заболевания нервной системы (например, множественный миозит, синдром Гийена-Барре, заболевание Меньера, множественный неврит, единичный неврит, инфаркт мозга, болезнь Альцгеймера, болезнь Паркинсона, амиотрофический латеральный склероз (ALS) и радикулопатия);
церебральные ишемические заболевания (например, ранения головы, кровоизлияние в мозг (например, субарахноидальное кровоизлияние, внутрицеребральное кровоизлияние), церебральный тромбоз, эмболия мозга, замедление сердечного ритма, инсульт, скоротечный ишемических приступ, гипертензивная энцефалопатия, инфаркт мозга);
эндокринные заболевания (например, гипертиреоз и Базедова болезнь);
заболевания крови (например, аплазия красных клеток крови, апластическая анемия, гипопластическая анемия, идеопатическая тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия, агранулоцитоз, злокачественная анемия, мегалобластическая анемия и анэритроплазия);
заболевания костей (например, остеопороз);
респираторные заболевания (например, сакроидоз, фиброз легких и идиопатическая интестинальная пневмония);
заболевания кожи (например, дерматомиозит, лейкодерма обыкновенная, ихтиоз обыкновенный, светочувствительность и кожная Т-клеточная лимфома);
нарушения циркуляции (например, артериосклероз, атеросклероз, синдром аортита, полиартрит нодозный и миокардоз);
коллагеновые заболевания (например, склеродерма, гранулема Вегенера и синдром Шегрена);
адипоз;
эозинофильный фасцит;
пероидонтальные заболевания (например, поражения десен, периодонта, альвеолярной кости или костного вещества зуба;
нефротический синдром (например, гломерулонефрит);
облысение по мужскому типу, возрастное облысение;
мышечная дистрофия;
пиодерма и синдром Сезари;
заболевания, связанные с хромосомными аномалиями (например, синдром Дауна);
болезнь Аддисона;
заболевания, медиированные активным кислородом [например, повреждение органов (например, ишемические нарушения циркуляции в органах (например, сердце, печени, почке, пищеварительном тракте и т.д.), связанные с консервацией, трансплантацией или ишемическим заболеванием (например, тромбозом, инфарктом миокарда и т.д.))];
интестинальные заболевания (например, эндотоксиновый шок, псевдомембранный колит и лекарственно- или радиационно-вызванный колит);
почечные заболевания (например, ишемическая острая почечная недостаточность, хроническая почечная недостаточность);
легочные заболевания (например, токсикоз, вызванный легочным кислородом или лекарственным средством (например, паракортом, блеомицином и т.д.), рак легкого и эмфизема легкого);
заболевания глаза (например, катаракта, заболевания радужки (сидероз глазного яблока), ритинит, пигментные сенильные бляшки, рубцевание стекловидного тела, ожог роговицы щелочью);
дерматит (например, мультиформная эритема, линейного иммуноглобулина А булезный дерматит, цементный дерматит);
и другие заболевания (например гингивиты, периодонтиты, сепсис, панкреатит и заболевания, вызванные загрязнением окружающей среды (например, загрязнением воздуха), старение, карциногенные заболевания, метастазы карциномы и гипобаропатия)];
заболевания, вызванные высвобождением гистамина или лейкотриена С4;
рестеноз коронарной артерии с после ангиопластики и предупреждение постхирургических спаек;
аутоиммунные заболевания и воспалительные состояния (например, первичная эдема слизистой, аутоиммунный гастрит, преждевременная менопауза, стерильность у мужчин, ювенильный диабетический mellitus, пузырчатка обыкновенная, пемфигоид, симпатический офтальмит, вызванный линзами увеит, идиопатическая лейкопения, активный хронический гепатит, идиопатический цирроз, дискоидная красная волчанка, аутоиммунный орхит, артрит (например, деформирующий артрит) или полихондрит);
ВИЧ-инфекция человека;
аллергический конъюктивит;
гипертрофический рубец или келоид в результате травмы, ожога или операции.
Кроме того, названный трициклический макролид обладает активностью по регенерации печени и/или активностью по стимуляции гипертрофии и гиперплазии гепатоцитов. Таким образом, фармацевтическая композиция настоящего изобретения пригодна для повышения эффекта терапии и/или профилактики заболеваний печени [например, иммуногенных заболеваний (например, хронических аутоиммунных заболеваний печени, таких как аутоиммунные заболевания печени, первичный билиарный цирроз или склеротический холангит), частичной резекции печени, острый некроз печени (например, некроз, вызванный токсинами, вирусным гепатитом, шоком или аноксией), гепатит В, гепатит, отличный от гепатита А и гепатита В, гепатоцирроз и печеночная недостаточность (например, молниеносный гепатит, поздний гепатит и острое заболевание на фоне хронической печеночной недостаточности (острая недостаточность печени на фоне хронического заболевания печени))].
И кроме того, настоящая композиция также пригодна для повышения эффекта от предупреждения и/или течения различных заболеваний, благодаря полезной фармакологической активности макролидного соединения, такой как активность по усилению химиотерапевтического эффекта, активность по отношению к цитамегаловирусной инфекции, противовоспалительная активность, активность по ингибированию пептидил-пропил изомеразы или ротамазы, противомалярийная активность, противоопухолевая активность и т.д.
Данное изобретение также предлагает способ проведения теста для растворения для твердой готовой формы, содержащей макролидное соединение, в котором используется тестовый раствор, содержащий соответствующее количество целлюлозного полимера. В целом, тест для растворения для анализа характеристик высвобождения терапевтически активного ингредиента из содержащей его твердой готовой формы, приводится в соответствии с тестом на растворение способ 2 (способ 2 Paddle, 50 об/мин), фармакопея Японии XIII или тестом для растворения, представленным в патенте США 23, NF18 или в Европейской Фармакопее США (3 издание). Однако, при проведении теста для растворения с готовой формой, содержащей небольшое количество макролидного соединения, высвобождение макролидного соединения не достигает 100% даже после нескольких часов, если брать за основу его содержание в препарате. Это происходит вследствие того, что, когда макролидное соединение невелико, абсорбция макролидного соединения на поверхность сосуда, в котором проводится тест, фильтре и т.д. будет оказывать влияние на результат теста вследствие ее относительно большой величины. После большого количества исследований авторы настоящего изобретения обнаружили, что добавляя подходящее количество целлюлозного полимера (такого как НРМС, фосфата гидроксипропилцеллюлозы, МС, CMC-Na, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы (НРС) и т.д.) к тестовому раствору или, добавляя при необходимости фосфорную кислоту или им подобные вещества к тестовому раствору так, чтобы довести его рН до выше 7 с целью исключения неблагоприятного влияния, возникающего в результате повышения в рН, на стабильность макролидного соединения, можно уменьшить влияние абсорбции макролидного соединения на поверхность оборудования, чтобы достигнуть степени извлечения близкой к 100%. Предпочтительный целлюлозный полимер представляет собой гидроксипропилцеллюлозу или ее эквиваленты, предпочтительная вязкость которых такая, что когда 5,0 г его растворяют в 95 мл воды, то после центрифугирования для удаления осадка, если необходимо, и измерения вязкости раствора с помощью роторного измерителя вязкости при 25±0,1°С, раствор показывает вязкость 75-150 сПз. Например, гидроксипропилцеллюлоза со средним молекулярным весом около 100000, полученная от Aldrich, соответствует этим показателям.
«Подходящее количество» целлюлозного полимера для добавления к тестовому раствору составляет 0,001~0,1%, предпочтительно 0,002~0,01%, и наиболее предпочтительно 0,005%, во всех случаях беря за основу общее количество тестового раствора.
Тест для растворения, способ 2 (метод Paddle), фармакопея Японии XIII, и тест для растворения, показанный в патенте США. 23, NF18 или в европейской фармакопее (3 издание) являются хорошо известными способами для анализа кинетики высвобождения активного ингредиента из твердого фармацевтического продукта. Они представляют собой тесты для растворения с использованием специальных сосудов, лопатной или другой техники при контроле количества тестового раствора, температуры тестового раствора, скорости вращения и других условий. При необходимости тест проводится с тестовым раствором, доведенным до подходящей рН. В настоящем изобретении предпочтительная рН не выше 7. В данном изобретении «Тест для растворения, способ 2 (метод Paddle, 50 об/мин), Фармакопея Японии XIII» означает «Тест для растворения, способ 2 (способ Paddle, 50 об. мин), Фармакопея Японии XIII, который проводится при перемешивании при 50 оборотах в минуту. Соответствующие описания в Фармакопее Японии XIII, Фармакопее США 23 (NF18) и Европейской Фармакопее (3 издание) включены в это описание в качестве ссылке.
Далее данное изобретение будет описано с помощью следующих примеров, не ограничиваясь ими. В следующих примерах FK 506 при получении содержащей его композиции смешивается в виде своего моногидрата, хотя его количество выражено, как вес FK506, но не как вес его моногидрата,
ПРИМЕР 1

FK506 растворяют в этаноле, и к полученному раствору добавляют НРМС 2910, для того, чтобы дать FK506 достаточным образом набухнуть. После этого смесь перемешивают. Полученную в результате перемешанную смесь переносят в лоток из нержавеющей стали, сушат в вакууме и размалывают на кофейной мельнице. Позже полученный в результате порошок подвергают уменьшению размера с помощью следующего процесса, для получения твердой дисперсионной композиции (здесь и далее ссылаются как SDC) с 1-1) по 1-6).
(1) Размолотый порошок пропускают через 250-мкм сито, и фракцию, оставшуюся на сите, называют, как SDC 1-1) (>250 мкм).
(2) Фракцию, просеянную через сито в процессе (1) пропускают через 180-мкм сито, и фракцию, оставшуюся на сите, называют SDC 1-2) (180-250 мкм).
(3) Фракцию, просеянную через сито в процессе (2) пропускают через 150-мкм сито, и фракцию, оставшуюся на сите, называют SDC 1-3) (150-180 мкм).
(4) Фракцию, просеянную через сито в процессе (3) пропускают через 106-мкм сито, и фракцию, оставшуюся на сите, называют SDC 1-4) (106-150 мкм).
(5) Фракцию, просеянную через сито в процессе (4) пропускают через 75-мкм сито, и фракцию, оставшуюся на сите, называют SDC 1-4) (75-106 мкм).
(6) Фракцию, просеянную через сито в процессе (5), называют SDC 1-6) (<75 мкм).
ПРИМЕР 2
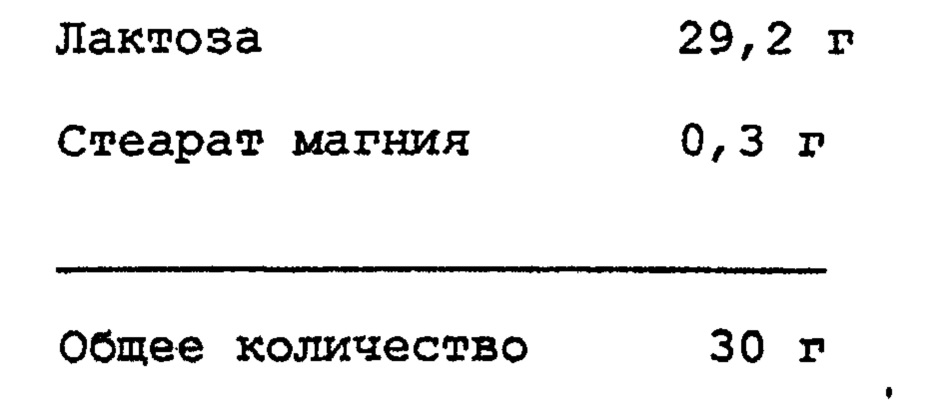
SDC 1-2), полученную в примере 1, как следует смешивают с лактозой (58,0 мг), и полученной смесью наполняют капсулу, получая препарат в виде капсулы.
ПРИМЕР 3
Таким же образом, как в примере 1, получают размолотый порошок следующих SDC с размером частиц от 180 до 250 мкм.
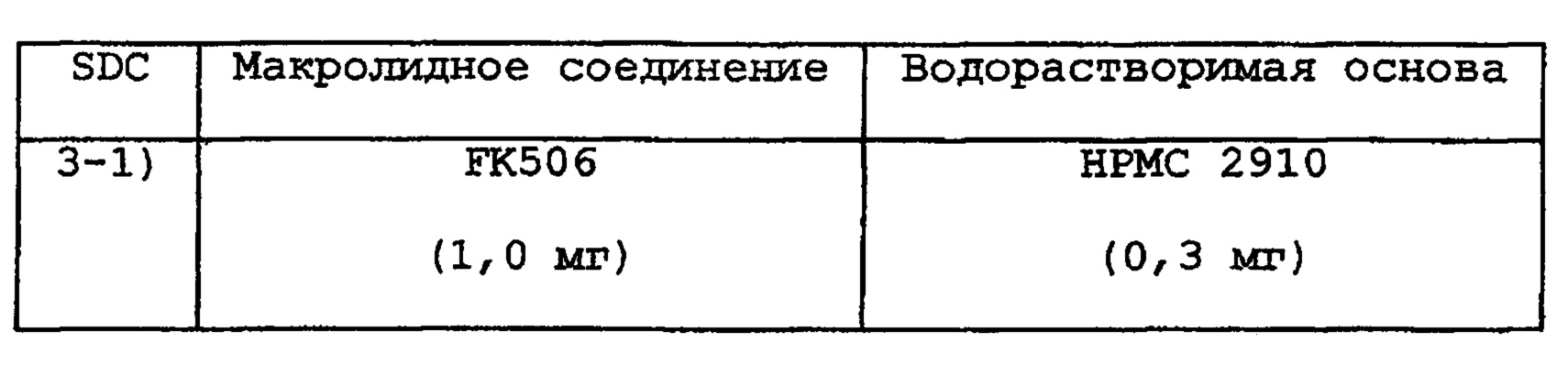
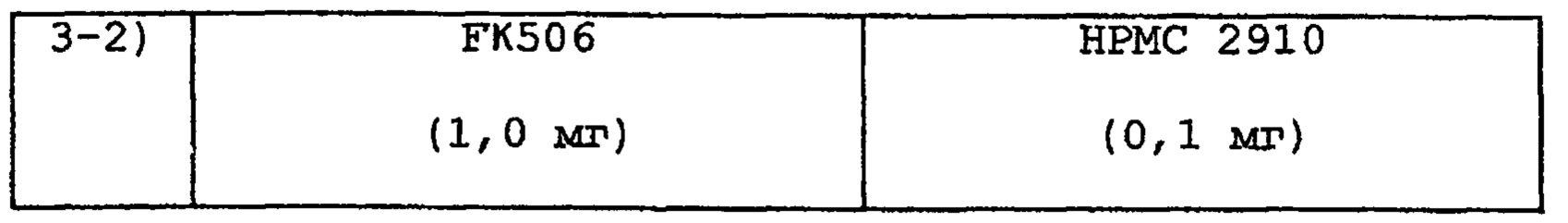
Кроме того, SDC 3-1) как следует смешивают с лактозой (58,7 мг), и полученной смесью наполняют капсулу, получая препарат в виде капсулы 3-1). SDC 3-2) должным образом смешивают с лактозой (58,9 мг), и полученной смесью наполняют капсулу, получая препарат в виде капсулы 3-2)
ПРИМЕР 4
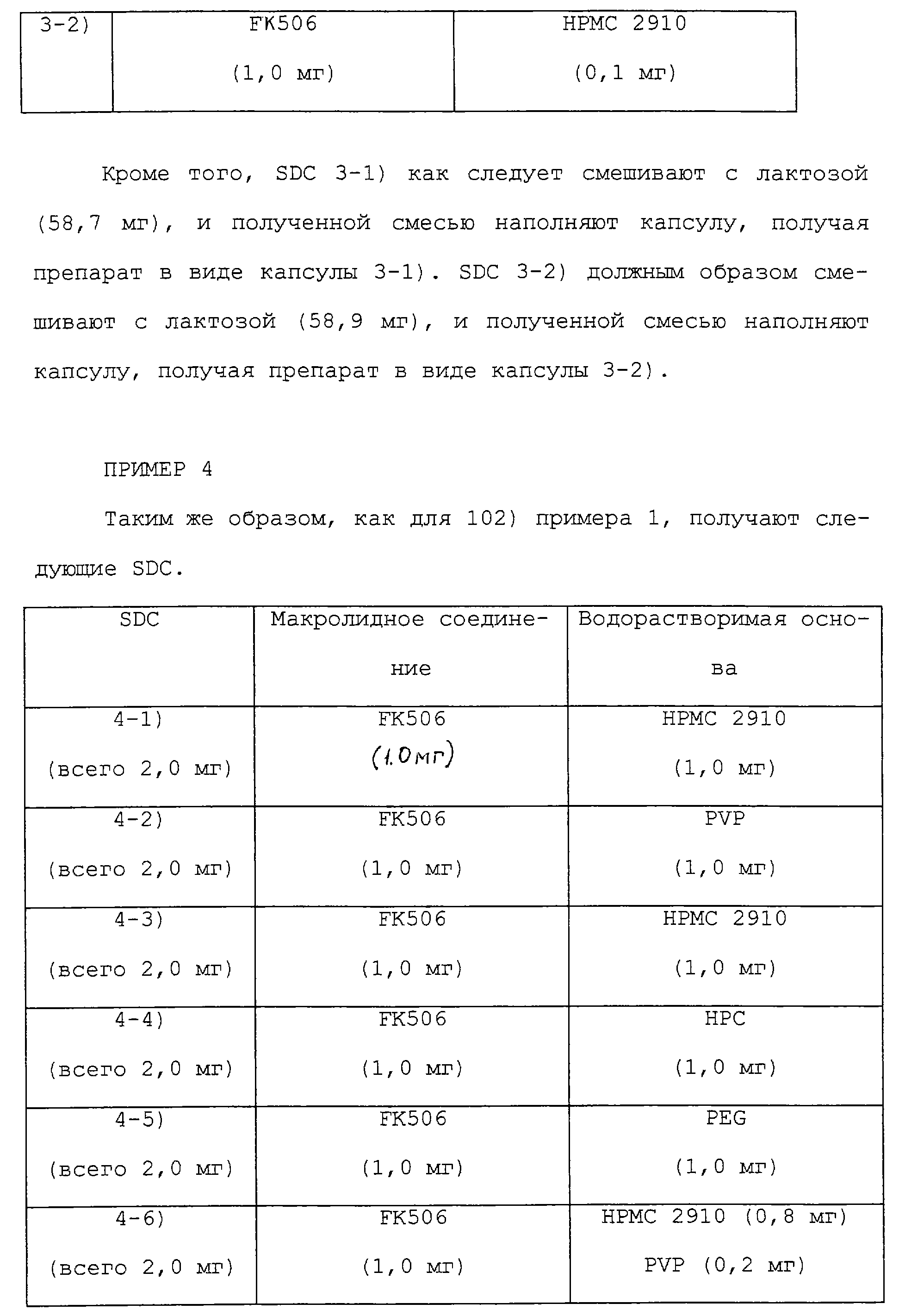
Таким же образом, как для 102) примера 1, получают следующие SDC.
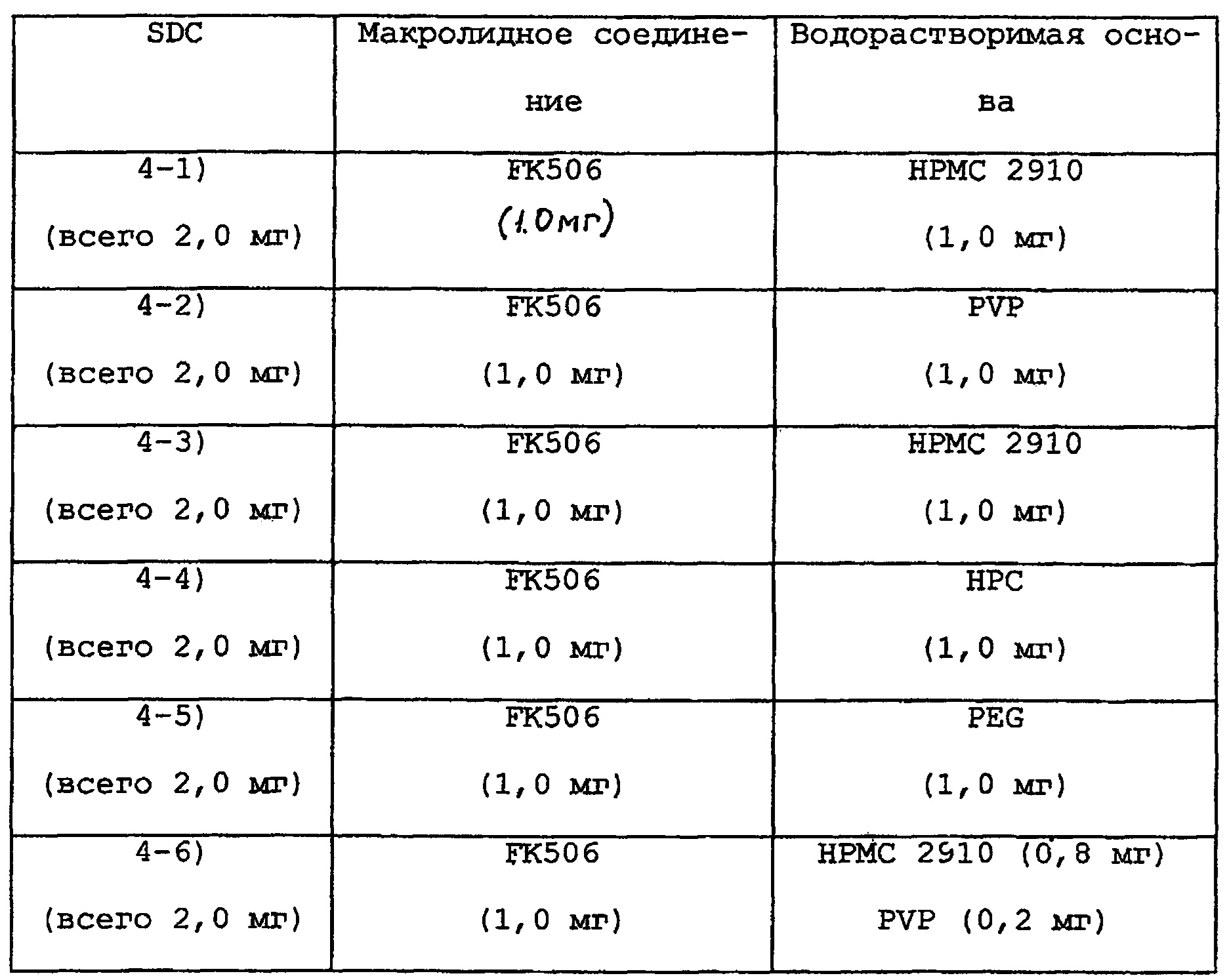
Таким же образом, как в примере 2, лактозу (в соответствующем количестве) и стеарат магния (0,6 г) добавляют к соответствующим SDC для получения соответствующих капсул, каждая из которых содержит в целом по 60,0 мг
ПРИМЕР 5
Таким же образом, как для SDC 1-2) в примере 1, получают SDC, используя FK506, (1,0 мг) и НРМС 2910 (1,0 мг). Таким же образом, как в примере 2, соответствующие добавки соответственно добавляют к SDC, получая капсулы с 5-1) до 5-4), каждая из которых содержит в целом по 60.0 мг.
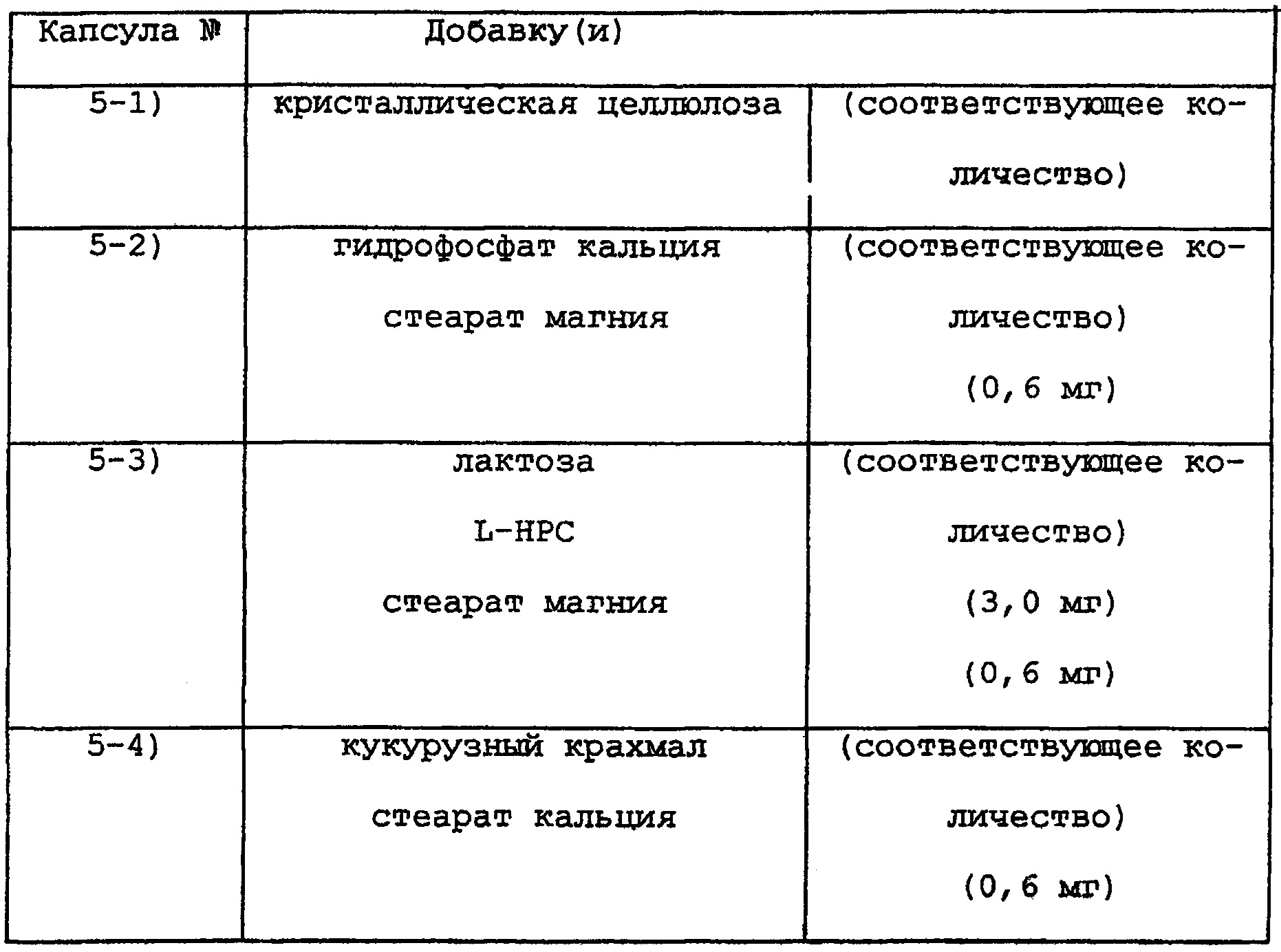
ПРИМЕР 6

FK506 растворяют в этаноле, и к полученному в результате раствору добавляют НРМС 2910, позволяя достаточно набухнуть. Затем смесь перемешивают. Полученное в результате перемешанное вещество переносят в лоток из нержавеющей стали, сушат в вакууме и размалывают на кофейной мельнице. Затем полученный порошок подвергают уменьшению размера с помощью следующих процедур, получая SDC с 6-1) по 6-6).
(1) Размолотый порошок пропускают через 250-мкм сито, и фракцию, оставшуюся на сите, называют SDC 6-1) (>250 мкм).
(2) Фракцию, просеянную через сито в процессе (1) пропускают через 180-мкм сито, и фракцию, оставшуюся на сите, называют SDC 6-2) (180-250 мкм).
(3) Фракцию, просеянную через сито в процессе (2) пропускают через 150-мкм сито, и фракцию, оставшуюся на сите, называют SLC 6-3) (150-180 мкм).
(4) Фракцию, просеянную через сито в процессе (3) пропускают через 106-мкм сито, и фракцию, оставшуюся на сите, называют SDC 6-4) (106-150 мкм).
(5) Фракцию, просеянную через сито в процессе (4) пропускают через 75-мкм сито, и фракцию, оставшуюся на сите, называют SDC 6-5) (75-106 мкм).
(6) Фракцию, просеянную через сито в процессе (5), называют SDC 6-6).
ПРИМЕР 7
SDC 6-4 (1,3 мг), полученную в примере 6, как следует смешивают с лактозой (58,1 мг) и стеаратом магния (0,6 мг), и полученную в результате смесь помещают в капсулы, которые обозначают, как капсула 7.
ПРИМЕР 8
Таким же образом, как в примере 1, получают следующие SDC с размером частиц 180-250 мкм.
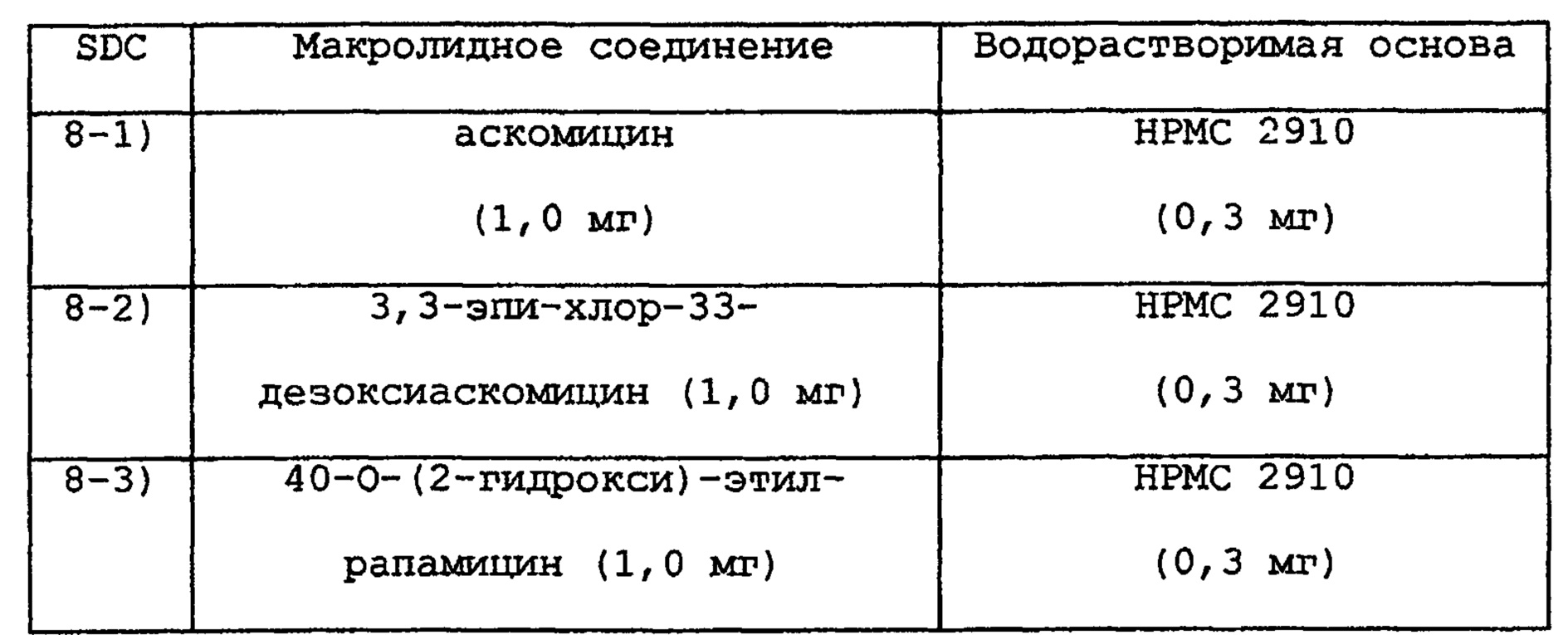
Таким же образом, как в примере 7, каждую капсулу получают, добавляя лактозу (58,1 мг) и стеарат магния (0,6 мг).
ПРИМЕР 9


FK506 растворяют в этаноле, добавляют НРМС 2910 и как следует смешивают с полученным раствором с последующим добавлением гидрофосфата кальция. После сушки в вакууме в течение ночи полученную смесь подвергают уменьшению размера частиц, используя скоростную мельницу или шаровой гранулятор; полученный в результате порошок просеивают через 212-мкм сито; фракцию, пропущенную через сито, называют SDC 9. SDC 9, лактозу и стеарат магния смешивают вместе, получая готовую 9. Готовую форму 9 помещают в количестве 350 мг в капсулу №1, и в количестве 70 мг в желатиновую капсулу №5, называя их препарат А и препарат В, соответственно.
ПРИМЕР 10


Таким же образом, как в примере 9, получают SDC 10 и готовую форму 10, соответственно.
ПРИМЕР 11

FK506 растворяют в этаноле, и добавляют НРМС 2910 и как следует смешивают с полученным в результате раствором, с последующим добавлением гидрофосфата кальция. После сушки полученной в результате смеси в вакууме в течение ночи, смесь подвергают уменьшению размера частиц используя скоростную мельницу и шаровой гранулятор; полученный в результате порошок просеивают через 250-мкм сито и 180-мкм сито; фракцию 180-250 мкм называют, как SDC 11. SDC 11, лактозу и стеарат магния смешивают вместе, получая готовую форму 11. Готовую форму 11 помещают в количестве 350 мг в капсулу №1, и в количестве 70 мг в желатиновую капсулу №5, которые называют препарат С и препарат D, соответственно.
ПРИМЕР 12

Моностеарат глицерина нагревают и размалывают при 80°С, к нему добавляют FK509 инициируя растворение FK509. К полученной в результате смеси добавляют НРМС 2910 для тщательного смешивания, и полученную в результате смесь затем переносят в лоток и оставляют для самопроизвольного охлаждения. Полученное при охлаждении твердое вещество размалывают на кофейной мельнице и затем просеивают через 500-мкм сито. Фракцию, пропущенную через сито, называют SDC 12. SDC 12 смешивают со стеаратом магния, получая готовую форму 122, которую затем помещают в количестве 60,6 мг в капсулу №5. Полученную капсулу называют препарат Е.
ПРИМЕР 13

В этаноле растворяют FK506 и аминоалкилметакрилатный сополимер, с последующим добавлением гидрофосфата кальция, и полученную в результате смесь тщательно смешивают вместе. Смесь сушат в вакууме в течение ночи, размалывают в ступке, и градуируют, используя 150-мкм сито и 160-мкм сито, получая фракцию 106-150 мкм, как SDC 13. SDC 13 смешивают с лактозой и получают готовую форму 13, которую затем помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат F.
ПРИМЕР 14

Таким же образом, как в примере 13, получают SDC 14 с размером частиц 106-150 мкм и готовую форму 14. Затем готовую форму 14 помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат G.
ПРИМЕР 15


Таким же образом, как в примере 13, получают SDC 15 размером частиц 106-150 мкм и готовую форму 15. Затем готовую форму 15 помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат Н.
ПРИМЕР 16

В этаноле растворяют FK506 и этилцеллюлозу с последующим добавлением лактозы, и полученную в результате смесь как следует смешивают вместе. Смесь сушат в вакууме в течение ночи, размельчают в ступке и градуируют, используя 150-мкм сито и 106-мкм сито, получая фракцию 106-150 мкм. Как SDC 16. SDC 16 смешивают в лактозой, и получают готовую форму 16, которую затем помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат I.
ПРИМЕР 17

Таким же образом, как в примере 16, получают SDC 17 с размером частиц 106-150 мкм и готовую форму 17. Затем готовую форму 17 помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат J.
ПРИМЕР 18

Таким же образом, как в примере 16, получают SDC 18 размером частиц 106-150 мкм и готовую форму 18. Затем готовую форму 18 помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат К.
ПРИМЕР 19


Таким же образом, как в примере 16, получают SDC 19 с размером частиц 106-150 мкм и готовую форму 19. Затем готовую форму 19 помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат L.
ПРИМЕР 20

FK506 растворяют в этаноле и добавляют и растворяют этилцеллюлозу. НРМС 2910 и лактозу смешивают тщательно с полученным раствором. После сушки в вакууме в течение ночи полученную в результате смесь подвергают уменьшению размера частиц с использованием силовой мельницы и шарового гранулятора; полученный в результате порошок просеивают через 250 мкм сито; фракцию, которая прошла через сито, называют SDC 20. SDC 20, лактозу и стеарат магния смешивают вместе, получая готовую форму 20. Готовую форму 20 помещают в количестве 350 мг в капсулу №1 и в количестве 70 мг в желатиновую капсулу №5, которые называют препарат М и препарат N, соответственно.
ПРИМЕР 21

Таким же образом, как в примере 20, фракцию, прошедшую через 212-мкм сито называют SDC 21, и получают готовую форму 21. Затем готовую форму 21 помещают в количестве 350 мг в желатиновую капсулу №1 и в количестве 70 мг в желатиновую капсулу №5, получая препарат О и препарат Р, соответственно.
ПРИМЕР 22

В этаноле/ацетоне (1/1) растворяют FK506. После нагревания этого раствора при 75°С, добавляют сложный эфир жирных кислот и сахарозы и затем охлаждают до комнатной температуры. Смесь сушат в вакууме в течение ночи, размельчают в ступке и градуируют с использованием 150-мкм и 106-мкм сита, получая фракцию 106-150 мкм, как SDC 22. SDC 22 смешивают с лактозой и получают готовую форму 22, которую затем помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат Q.
ПРИМЕР 23
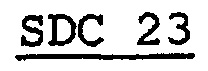

Таким же образом, как в примере 22, получают SDC 23 с размером частиц 106-150 мкм и готовую форму 23. Готовую форму 23 затем помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат R.
ПРИМЕР 24


Таким же образом, как в примере 22, получают SDC 24 с размером частиц 106-150 мкм и готовую форму 24. Готовую форму 24 затем помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат S.
ПРИМЕР 25

Таким же образом, как в примере 22, получают SDC 25 с размером частиц 106-150 мкм и готовую форму 25. Готовую форму 25 затем помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат Т.
ПРИМЕР 26
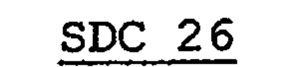

Таким же образом, как в примере 22, получают SDC 26 с размером частиц 106-150 мкм и готовую форму 26. Готовую форму 26 затем помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат U.
ПРИМЕР 27

К сложному эфиру трижирной кислоты и тетраглицерина, расплавленной нагреванием при 80°С добавляют FK506 и растворяют в нем при перемешивании. Туда же добавляют лактозу и затем самопроизвольно охлаждают в лотке. Полученное в результате твердое вещество размельчают в кофейной мельнице и градуируют, используя 150-мкм и 106-мкм сито, получая фракцию с размером частиц 106-150 мкм, как SDS 27. SDC 27 смешивают с лактозой и получают готовую форму 27, и затем готовую форму 25 помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат V.
ПРИМЕР 28

Таким же образом, как в примере 27, получают SDC 28 с размером частиц 106-150- мкм и готовую форму 28. Готовую форму 28 затем помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат W.
ПРИМЕР 29

Этанол добавляют к сложному эфиру трижирной кислоты и тетраглицерина. Полученную в результате смесь плавят при 40°С, добавляют FK506 и плавят при перемешивании. Туда же добавляют лактозу и затем оставляют в лотке для самопроизвольного охлаждения. Полученное в результате твердое вещество размельчают в кофейной мельнице, сушат в вакууме в течение ночи и градуируют, используя 150-мкм и 106-мкм сито, получая фракцию с размером частиц 106-150 мкм, как SDC 29. SDC 29 смешивают с лактозой и получают Готовую форму 29. Готовую форму 29 затем помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат X.
ПРИМЕР 30
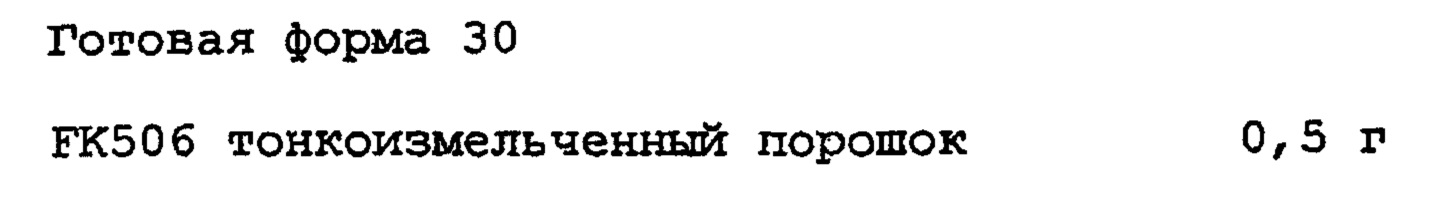
Кристаллический FK50 размельчают на струйной мельнице и смешивают с лактозой и стеаратом магния, получая готовую форму 30. Затем готовую форму 30 помещают в количестве 70 мг в желатиновую капсулу №5, получая препарат Z.. Размер частиц FK506 тонкоизмельченного порошка, размолотого на струйной мельнице, составляет 1-10 мкм, и их средний размер частиц составляет около 3 мкм.
ПРИМЕР 31
Тест на растворение
Тестовый образец:
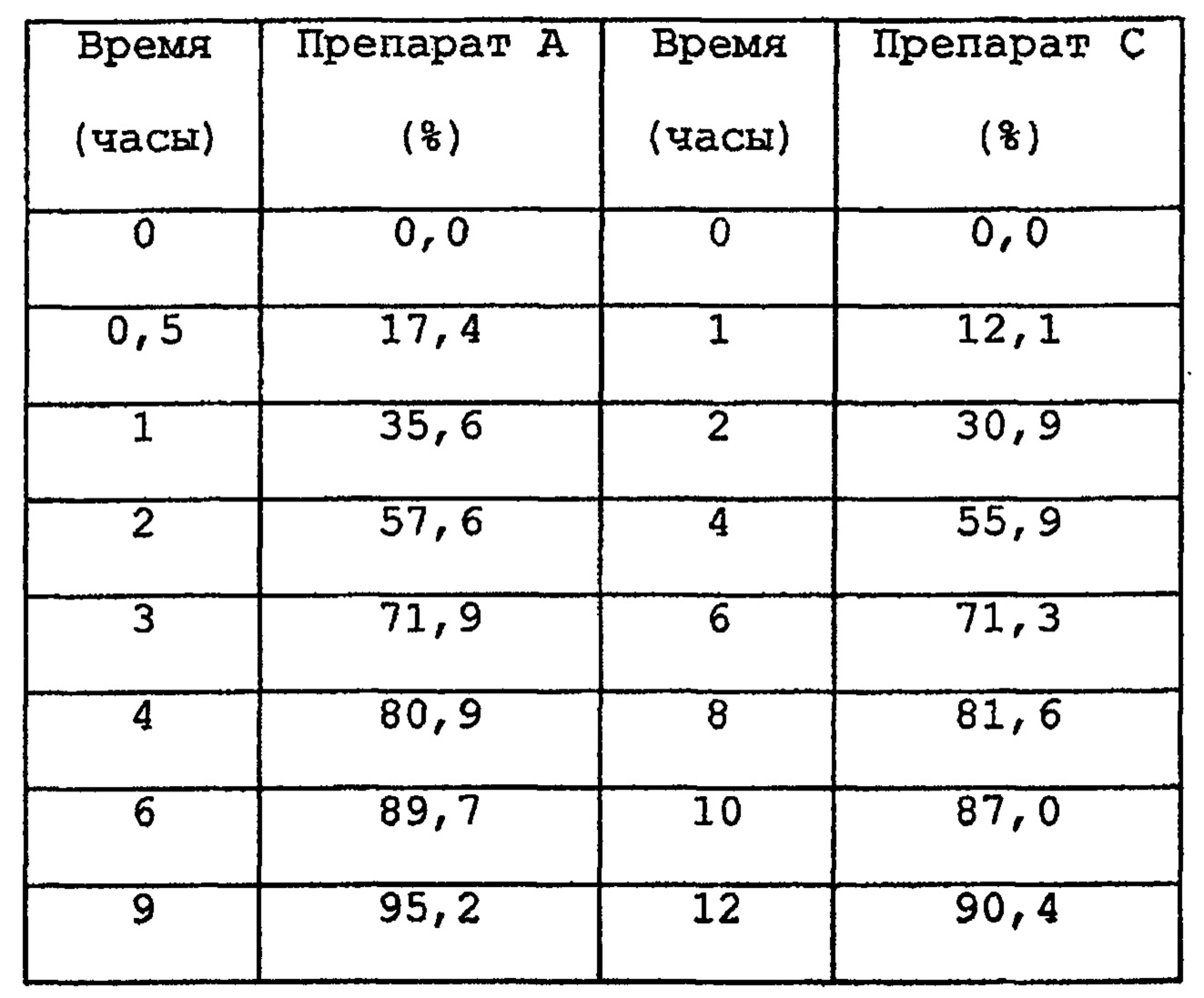
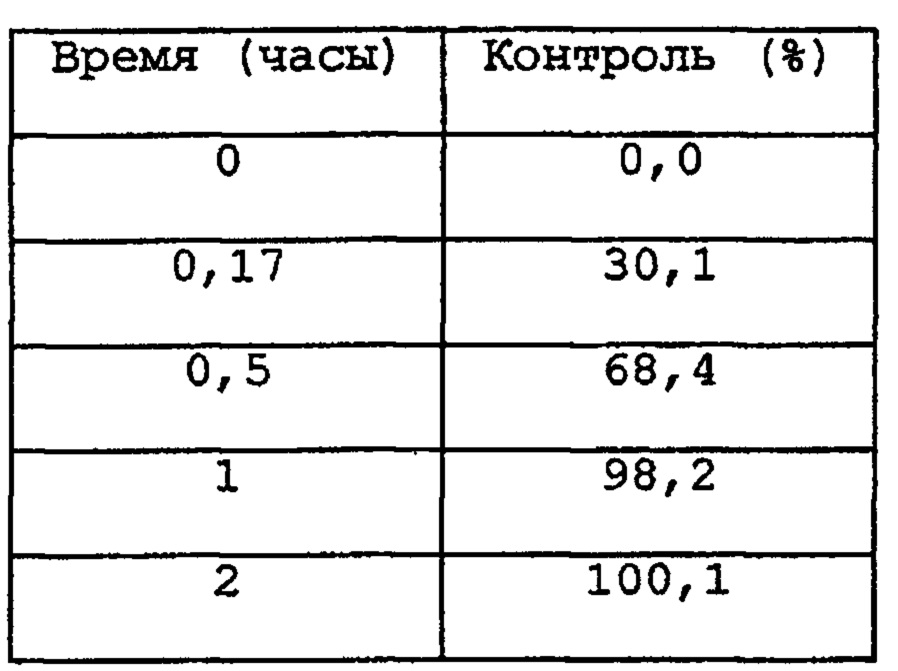
(1) Препараты А и С, полученные в ранее приведенных примерах.
(2) Контрольный препарат (готовая форма с быстрым высвобождением), который представляет собой 1-мг капсулу, содержащую приведенные ниже ингредиенты. Его получают таким же образом, как в примерах 1 и 2 WO 91/19495, путем смешивания ингредиентов (е) и (f) с композицией в виде твердой дисперсии, состоящей из ингредиентов с (а) по (d), и которые затем помещают в капсулу.
|
Способ тестирования:
Тест проводился в соответствии с Фармакопеей Японии, 13 издание, тест для растворения, №2 (метод Paddle, 50 об/мин) с использованием в качестве тестового раствора 0,005% раствор гидроксипропилметилцеллюлозы, доведенный до рН 4,5. Полученные данные представлены в следующей таблице.
ПРИМЕР 32
Тест для растворения приводится таким же образом, как в примере 31. Различные параметры функции Вейбла и Е63,2% получены путем расчета.
РЕЗУЛЬТАТ

ПРИМЕР 33
Абсорбционная способность при пероральном введении
Тестовый образец:
(1) Препарат В и D, полученные в приведенных выше примерах.
(2) Контрольный препарат (такой же, как контроль в примере 31)
Способ тестирования:
Тестируемый образец дается перорально 6 обезьянам cynomologus (в дозе 1 мг FK506 на обезьяну), для анализа концентрации FK506 в крови после применения. За семнадцать часов до применения давалась пища из рациона, предназначенного для обезьян cynomologus с весом около 6 кг. Затем животные голодали до истечения 12 часов после применения препарата. Воду давали в неограниченном количестве до начала исследования, во время приема тестовых образцов и после него. При приеме препарата, воду (20 мл) животные получали одновременно с образцом. Через определенные интервалы времени после приема дозы препарата, делали забор 1 мл крови из вены предплечья, используя стерильный шприц, в пластмассовую пробирку, содержащую гепарин и хранящуюся до начала определения концентрации лекарственного средства при -80°С. Общая концентрация в крови лекарственного средства FK506 определялась с помощью EK506-специфического ферментного иммуноанализа (EIA), известного из JP-A-1-92659. Его раскрытие приведено здесь и входит в описание.
СРЕДНЕЕ ЗНАЧЕНИЕ
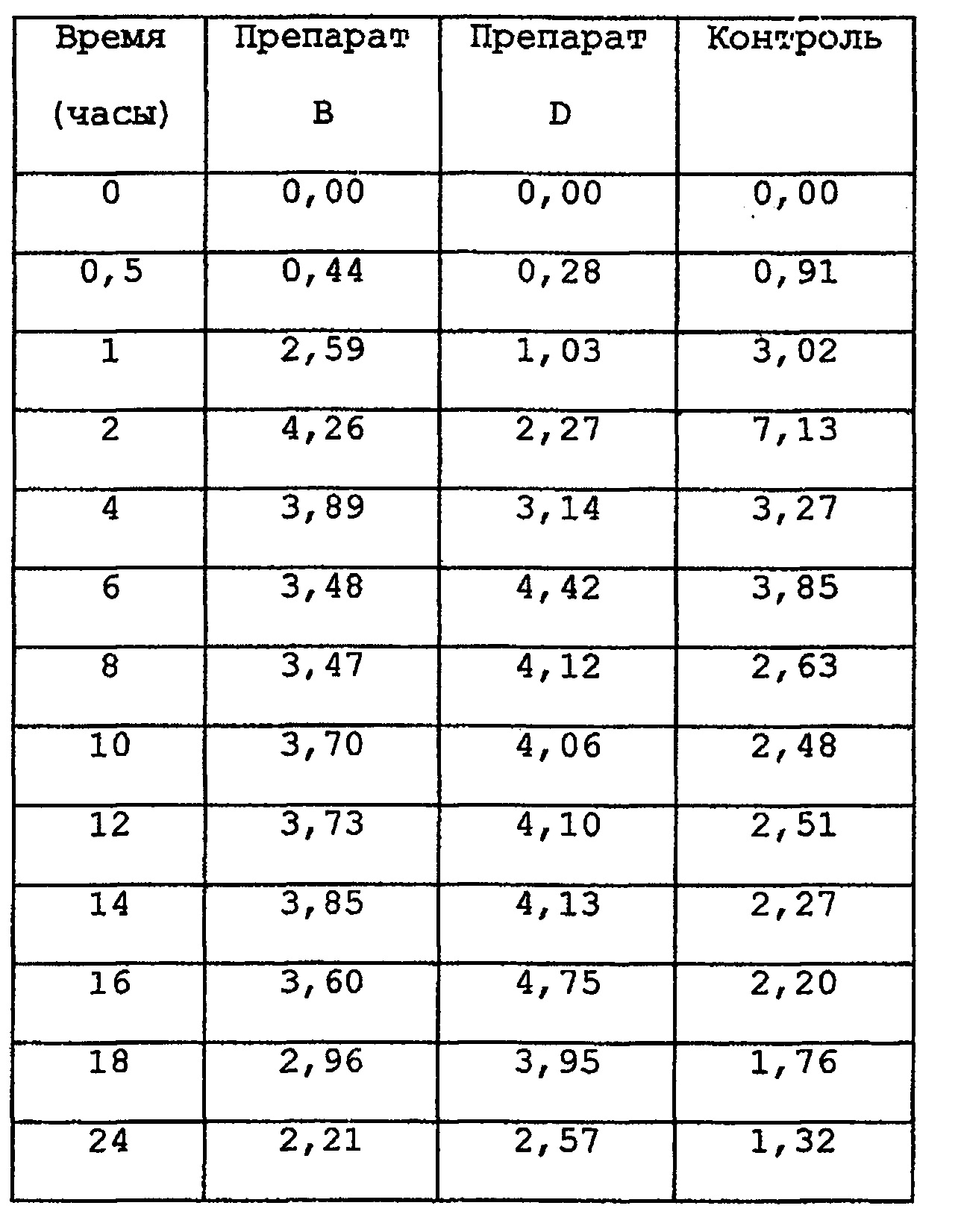
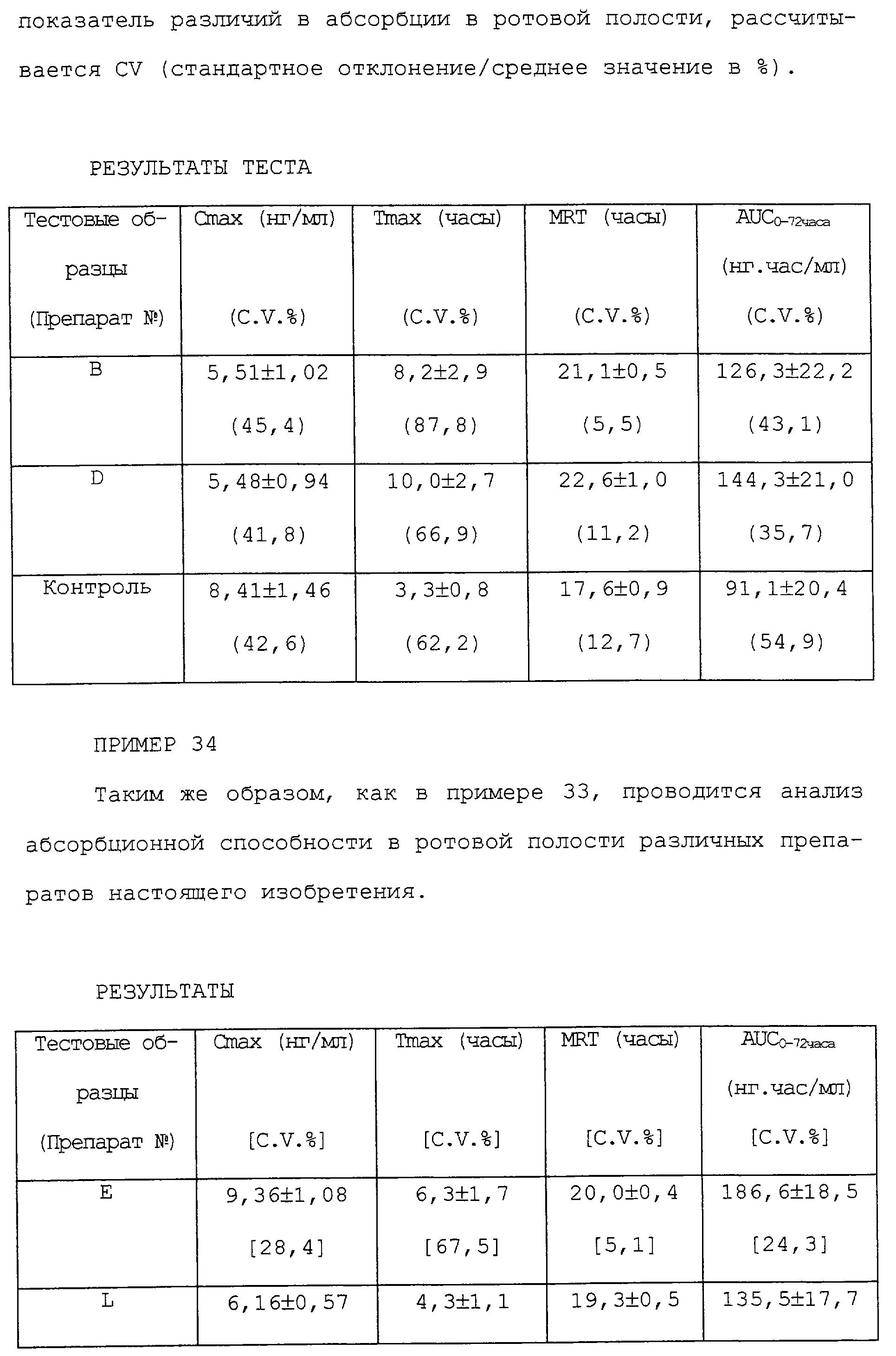
Максимальная концентрация в крови (Cmax) определялась, как максимальное значение всего лекарственного средства в крови. Tmax представляет собой время, требующееся, для достижения максимальной концентрации в крови. MRT представляет среднее время задержки. Область под кривой концентрация в крови - время (AUC) рассчитывается по методу трапеции. И как показатель различий в абсорбционной способности при пероральном введении, рассчитывается CV (стандартное отклонение/среднее значение в %).
РЕЗУЛЬТАТЫ ТЕСТА
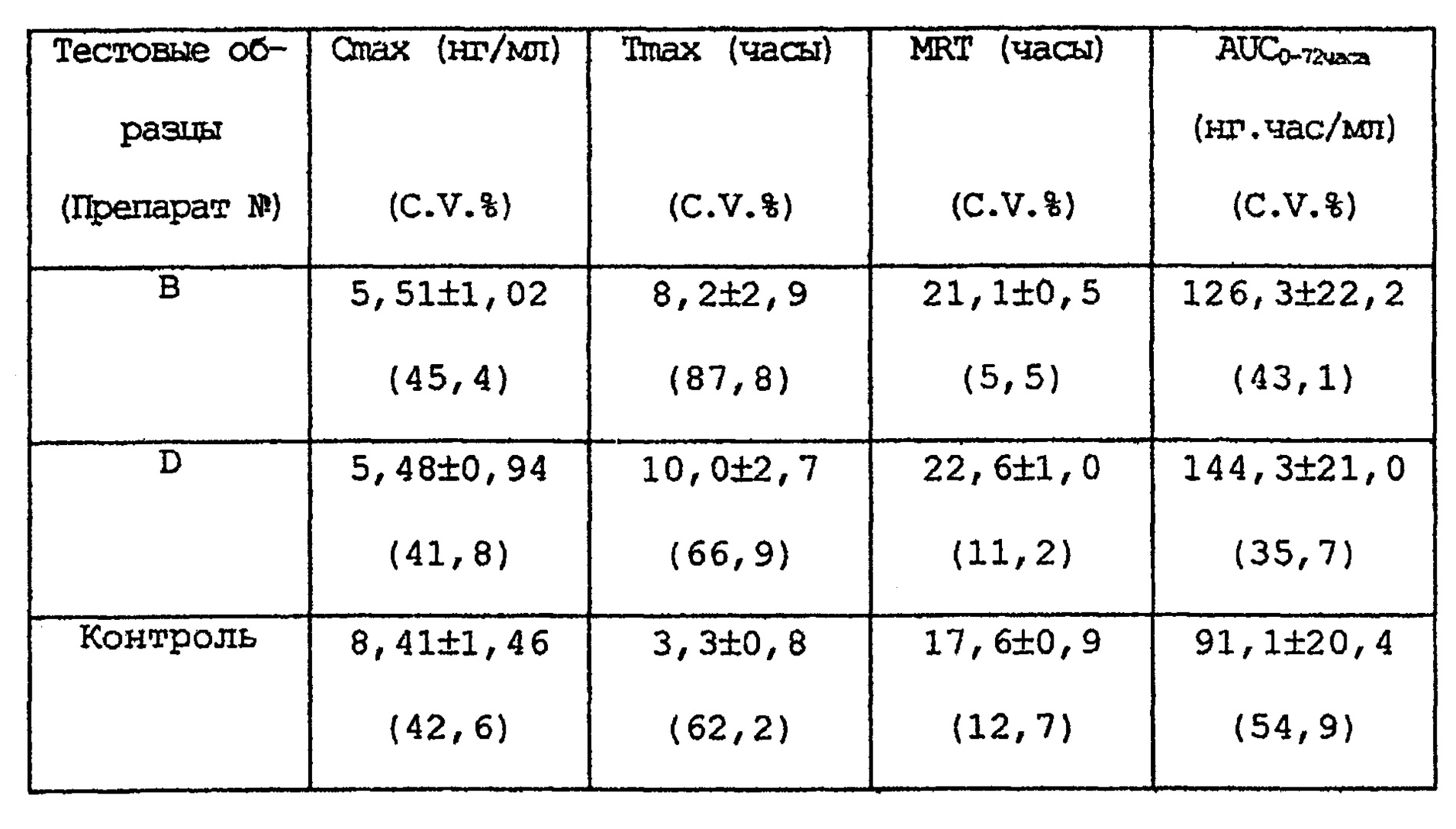
ПРИМЕР 34
Таким же образом, как в примере 33, проводится анализ абсорбционной способности при пероральном введении различных препаратов настоящего изобретения.
РЕЗУЛЬТАТЫ
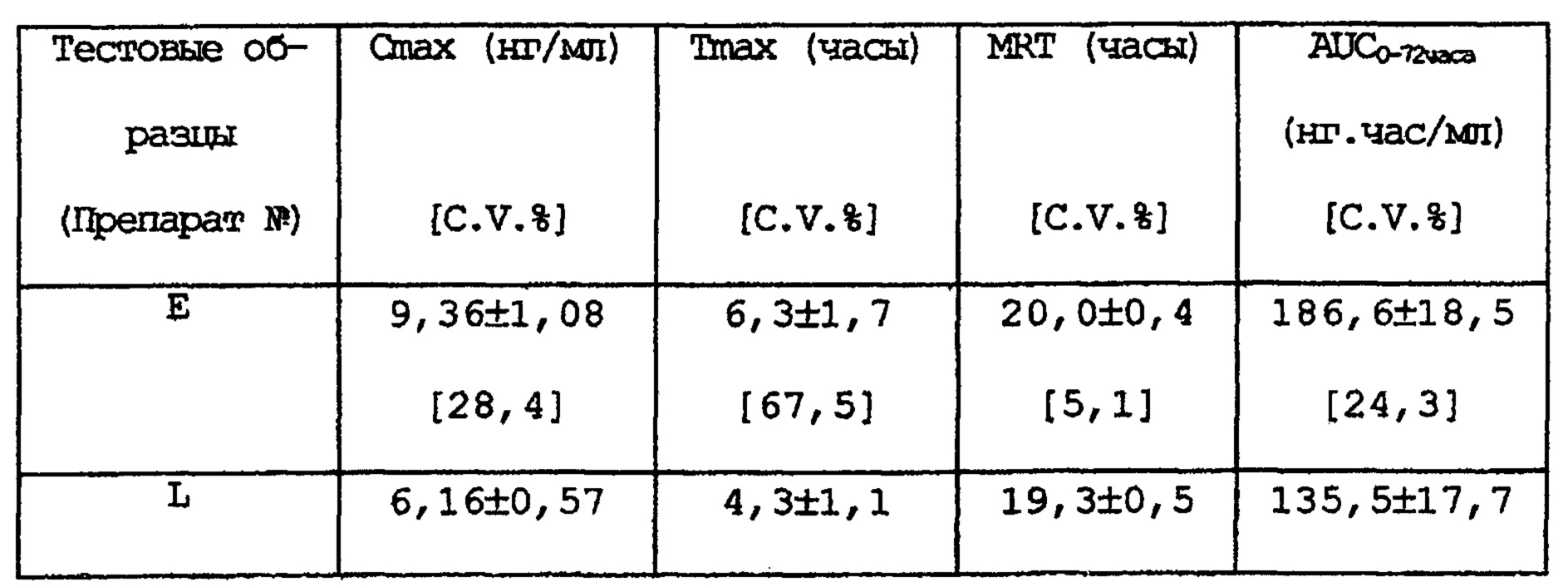
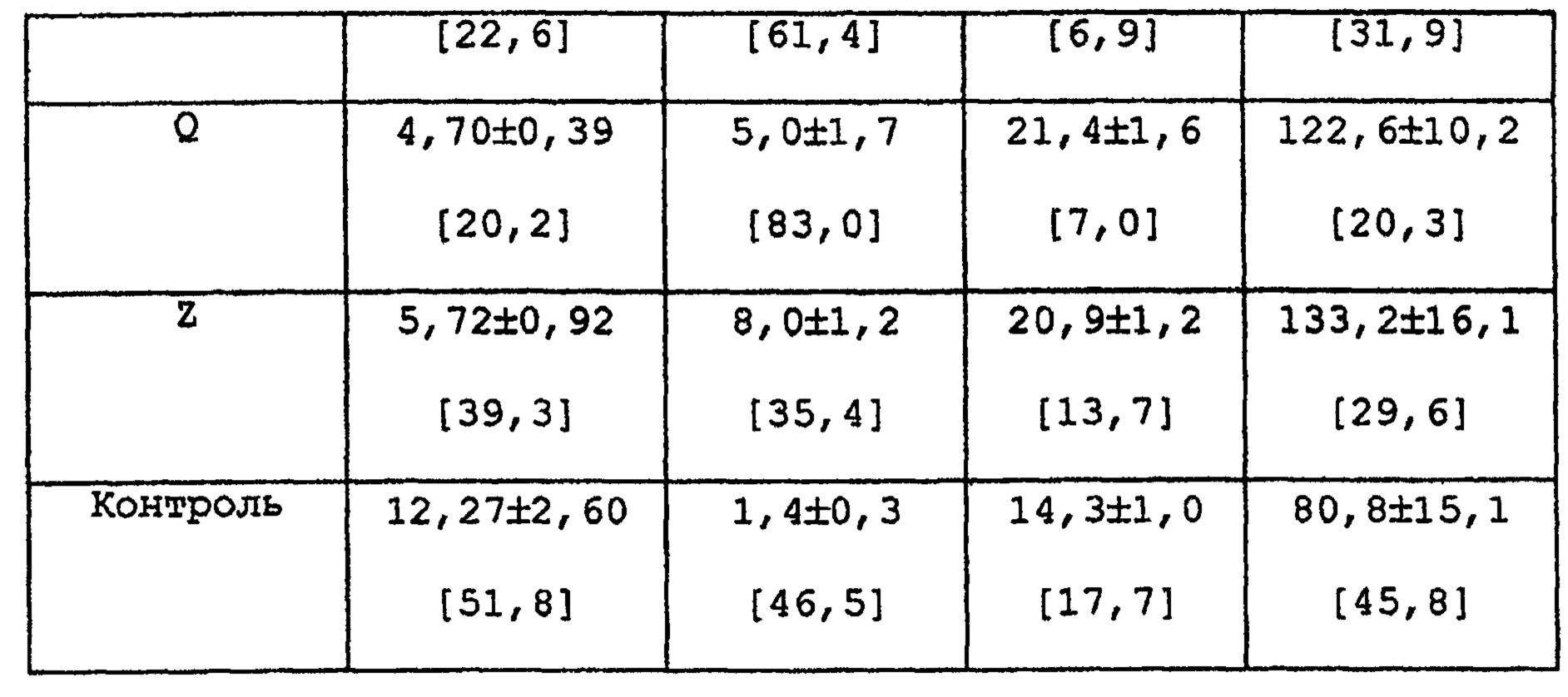
Вышеприведенные результаты показывают, что готовые формы, полученные в вышеприведенных экспериментах, после перорального применения имеют меньшее Cmax, существенно более длительное Tmax и MRT, чем те же показатели у препарата с быстрым высвобождением (контроль). И по сравнению с препаратом с быстрым высвобождением, AUC вышеприведенных препаратов почти такое же или больше. Или вышеприведенные препараты с замедленным высвобождением имеют меньшие различия в индивидуальных Cmax и/или AUC по сравнению с препаратом с быстрым высвобождением.
В соответствии с изобретением данной заявки небольшие различия максимальной концентрации в крови или площади под кривой концентрация в крови - время макролидного соединения, наблюдающиеся в различных образцах после перорального применения по сравнению с препаратом с быстрым высвобождением могут быть определены с помощью показателя различий способности к абсорбции в крови макролидного соединения, а именно по показателю стандартное отклонение/среднее значение (CV в %) максимальной концентрации в крови или площади под кривой концентрация в крови - время. Термин «небольшие различия» означает небольшие различия в значении CV; более конкретно, термин означает, что значение CV меньше, чем его значение у препарата с быстрым высвобождением, как было обсуждено выше.
Описание патентов, патентных заявок и ссылок, приведенных в данной заявке, включены в описание.