Результат интеллектуальной деятельности: Рекомбинантная плазмидная ДНК pSAT1-ZmZeinB1, кодирующая кормовой белок альфа-зеин В1 кукурузы вида Zea mays, и рекомбинантный штамм Myceliophthora thermophila/pSAT1-ZmZeinB1 - продуцент кормового белка альфа-зеин В1
Вид РИД
Изобретение
Рекомбинантная плазмидная ДНК pSAT1-ZmZeinB1, кодирующая кормовой белок α-зеин В1 кукурузы вида Zea mays, и рекомбинантный штамм Myceliophthora thermophila/pSAT1-ZmZeinB1 - продуцент кормового белка α-зеин В1
Изобретение относится к биотехнологии, в частности к генетической инженерии, и позволяет получать микробиологическим синтезом по оптимизированной технологии запасный белок α-зеин В1 семян кукурузы вида Zea mays, который может быть использован в животноводстве для обогащения кормов. Изобретение может быть использовано в производстве кормов путем обогащения растительных отходов сельскохозяйственного производства продуктами микробного синтеза с использованием термофильного мицелиального гриба Myceliophthora thermophila, модифицированного рекомбинантной плазмидой, кодирующей кормовой белок кукурузы α-зеин В1.
В рецептах комбикормов, произведенных по традиционной технологии, доля зерновых компонентов составляет 60-80% [Красильников, О.Ю. Возможности альтернативного кормопроизводства в России / О.Ю. Красильников // Птицеводческое хозяйство. Птицефабрика. - 2011. - №7]. При этом интенсивное увеличение спроса влечет за собой сокращение мировых запасов зерна, которые уже невозможно восполнить увеличением производства. В то же время во многих хозяйствах имеются и постоянно накапливаются большие запасы малоиспользуемых отходов растениеводства, животноводства, зерноперерабатывающих и других производств, характеризующиеся низкой кормовой ценностью из-за наличия трудногидролизуемых полисахаридов и невысокого содержания усваиваемого белка, которые после соответствующей обработки могут приобретать кормовые свойства в 1,5-3,0 раза превосходящие фуражное зерно хорошего качества [Гнеушева, И.А. Биотехнологические подходы для получения белково-углеводных кормовых добавок для животноводства / И.А. Гнеушева, И.В. Горькова, В.Н. Дедков // Развитие инновационного потенциала агропромышленного производства: Материалы Всероссийской научно-практической конференции 24 ноября 2010 года. - Орел: Изд-во ОрелГАУ, 2010. - С. 45-48; Перегудов, С.С. Отходы в доходы / С.С. Перегудов // Торгпред. - 2005. - №1. - С. 28].
Большинство кормов, используемых в животноводстве, не содержат в достаточном количестве белков и витаминов [Хохрин, С.Н. Корма и кормление животных / С.Н. Хохрин. - Санкт-Петербург: Лань, 2003. - 512 с.]. Даже такие ценные корма, как кукуруза и сахарная свекла, дающие максимальное количество кормовых единиц с гектара, богаты углеводами, но не содержат достаточного количества азотистых веществ, что приводит к дефициту кормового белка. Этот дефицит покрывается увеличением производства растительного протеина, содержащегося в сельскохозяйственных кормовых культурах: зерне, люцерне, выпуском рыбной и мясной муки, сухих молочных продуктов [Панфилов, В.И. Биотехнологическая конверсия углеводсодержащего растительного сырья для получения продуктов пищевого и кормового назначения: дис. … д-ра техн. наук: 03.00.23 / В.И. Панфилов; РГБ ОД. - М., 2004 - 371 с.]. Если содержание белков в растительной массе, используемой для кормления сельскохозяйственных животных, ниже требуемой нормы, то во избежание перерасхода кормов и повышения себестоимости животноводческой продукции количество белка в корме балансируют путем добавления белковых концентратов [Нормы и рационы кормления сельскохозяйственных животных: справ, пособие / А.П.
Калашников, В.И. Фисинин, В.В. Щеглов [и др.]. – 3-е издание переработанное и дополненное. – М. : Изд-во ГНУ ВИЖ Россельхозакадемии, 2003. – 456].
В животноводстве для обогащения кормов используют обычно кукурузный глютен, в котором содержится 40 - 65 % протеина – проламинов, называемых зеинами. По энергии 1 кг глютена эквивалентен 7 кг кукурузы, а по протеину - 1 кг рыбной муки. Добавление глютена кукурузы в состав кормов до 10% позволяет частично заменять дорогостоящую рыбную муку. Проламины кукурузы (зеины) отличаются между собой по растворимости и структурным особенностям. Гетерогенность молекул проламинов в основном обусловлена варьированием числа повторяющихся последовательностей и модификацией в них аминокислотных остатков.
Несмотря на наличие в геноме кукурузы большого числа генов зеинов (от 110 до 130 генов), анализ к-ДНК библиотеки развивающегося эндосперма кукурузы Zea mays показал наличие ограниченного количества специфических матричных РНК, соответствующего разному уровню экспрессии генов белковых семейств α-, γ-, или δ-зеинов [Boston RS, Larkins BA (2009) The Genetics and Biochemistry of Maize Zein Storage Proteins. J.L. Bennetzen and S. Hake (eds.), Maize Handbook - Volume II: Genetics and Genomics, 715. Springer Science + Business Media LLC 2009; Wua Y, Holdingb DR, Messinga J. (2010) γ-Zeins are essential for endosperm modification in quality protein maize. PNAS 107: 12810–12815]. Было установлено, что γ-зеины синтезируются в количестве не более 15% от общего числа транскриптов перед тем, как начнут синтезироваться основные запасные белки - α- и δ-зеины, вероятно, обеспечивая им защиту от преждевременного ферментативного и механического разрушения в процессе длительного хранения зерна. Из основных форм запасных белков наиболее высокий уровень экспрессии в период созревания зерна кукурузы был обнаружен у α-зеинов (около 30% от общего числа транскриптов) с молекулярной массой 19 кДа (aZ19B1) и 22 кДа (aZ22z1), тогда как общее количество кодирующих α-зеины последовательностей в разных хромосомах генома кукурузы насчитывается от 75 до 100. α-Зеины – маленькие белки, имеющие структурную идентичность от 75 до 95% внутри подгрупп, а последовательности белков разных подгрупп идентичны между собой лишь на 40-55%. Все белки имеют одинаковые повторы, обогащенные глютаминовыми остатками, кодирующие нуклеотидные последовательности которых имеют наиболее высокую вероятность рекомбинаций и мутаций [Hagen, G., and Rubenstein, I. (1981). Complex organization of zein genes in maize. Gene 13, 239–249; Coleman, C.E., and Larkins, B.A. (1998). The prolamins of maize. In Seed Proteins, P.R. Shewry and R. Casey, eds (Dordrecht, The Netherlands: Kluwer Academic Publishers), pp. 109–139].
Ранее предпринимались попытки с помощью генетической инженерии модифицировать гены, кодирующие проламины, с целью повышения в них содержания положительно заряженных аминокислот (лизина, аргинина), и, таким образом, увеличения их биологической ценности [Shimoni Y, Blechl AE, Anderson OD, Galili G. A Recombinant Protein of Two High Molecular Weight Glutenins Alters Gluten Polymer Formation in Transgenic Wheat. J BIOL CHEM 1997; 272, pp. 15488–15495]. Кроме того, имеются результаты модификации высокомолекулярных глютенинов зерна пшеницы для улучшения свойств муки за счет контролирования их клейковинообразующих свойств [Anderson O., Hill P. Altering wheat dough viscoelasticity with modified glutenins. Patent US 6174725B1, 16 Jan, 2001]. Этого можно достичь путем введения в состав субъединиц глютенинов искусственные аминокислотные повторы с различным аминокислотным составом и/или длиной последовательности. Введение в состав природного глютенина пшеницы повторов, таких как гексамер P/SGQGQQ, наномер GY/HYPTSPQQ, гексамер+тример PGQGQQ+GQQ, способствует образованию глютенового олигомера с S-S связями с N-конца субъединиц, содержащего от 10 до 150 повторов, преимущественно 15 повторов, что на 14,5-30,7% меньше по молекулярной массе, чем природный белок, и на 17,2-36,6% короче по последовательностям повторов субъединиц Dx5. Это улучшает вискозоэластичные свойства муки из зерен такой модифицированной пшеницы [Anderson O., Hill P. Altering wheat dough viscoelasticity with modified glutenins. Patent US 6174725B1, 16 Jan, 2001].
Однако получение мутантных сортов кукурузы (мутации opaque-2 (o2) и floury-2 (fl2)), обогащенных дефицитными для растительных белков аминокислотами лизином и триптофаном методами генной инженерии и селекции, приводили к получению растений, дающих мягкие и быстро портящиеся зерна [Prasanna BV, Vasal SK, Kassahun B, Singh NN. (2001) Quality protein maize. Current Science 81: 1308-1319; Wua Y, Holdingb DR, Messinga J. (2010) γ-Zeins are essential for endosperm modification in quality protein maize. PNAS 107: 12810–12815]. Получение рекомбинантных зеинов методом гетерологической экспрессии в микробиальных штаммах-продуцентах в литературных источниках не освещено.
Тем не менее, одним из путей решения проблемы кормового белка является получение его микробиологическим путем. Микроорганизмы отличаются высоким (до 60 % сухой массы) содержанием белка, сбалансированного по аминокислотному составу. Кроме того, микроорганизмы содержат углеводы, липиды, витамины, макро- и микроэлементы. Важным достоинством производства кормового белка на основе микроорганизмов является использование сельскохозяйственных отходов, возможность организации промышленного производства, отсутствие сезонности и зависимости от погодно-климатических условий [Мхитарян, Г.А. Современные технологии переработки свекловичного жома / Г.А. Мхитарян, А.П. Леснов, В.М. Ткаченко // Сахарная свекла. – 2009. - № 2. – С. 33 – 35; Chadd, S.A. Practical production of protein for food animals / S.A. Chadd, W.P. Davies, J.M. Koivisto // Protein sources for the animal feed industry. Expert Consultation and Workshop Bangkok, 29 April – 3 May 2002. – 2004. - № 1. – p. 77 – 125].
Таким образом при использовании микроорганизмов в качестве продуцентов целлюлолитических ферментов и кормового белка одновременно решаются две важные задачи — получение белковой массы и утилизация отходов растениеводства, деревообрабатывающей и целлюлозно-бумажной промышленности, которые могут быть источниками загрязнения окружающей среды [Базунова, М.В. Способы утилизации отходов полимеров / М.В. Базунова, Ю.А. Прочухан // Вестник башкирского университета. – 2008. – Т. 13, № 4. – С. 875 – 885; Пат. 2354633 Российская федерация, МПК C 05 F 11/08, C 02 F 3/34 . Способ утилизации жиросодержащих отходов и продукт, получаемый этим способом / Н.С. Фунтикова, Н.Б. Сократова, М.С. Тришкин ; заявители и Н.С. Фунтикова, Н.Б. Сократова, М.С. Тришкин. – № 2007124272/13 ; заявл. 28.06.2007 ; 10.05.2009, Бюл. № 13. – 6 с.]. В отличие от бактериальных и дрожжевых клеток, которые продуцируют ДНК в количестве, вызывающем интоксикацию у животных, концентрация нуклеиновых кислот в грибном мицелии почти такая же, как в тканях растительного организма (1 – 4 % от сухой массы). Однако в биомассе мицелиальных грибов синтезируется значительно меньше белков (20 – 60 % от сухой массы), чем в дрожжах, и у них относительно медленней происходит рост биомассы [Дедков, В.Н. Биоконверсия соломы злаковых культур грибами рода Trichoderma в кормовые продукты для животноводства / В.Н. Дедков, И.А. Гнеушева, Н.Е. Павловская // Вестник ОрелГАУ. – 2012. – №4(37). – С. 102 – 105].
В целях ускорения роста грибов проводится предварительная обработка растительного сырья, повышающая доступность его компонентов для утилизации микроорганизмами [Низкотемпературный гидролиз растительного сырья / Р.М. Нуртдинов, Р.Т. Валеева, С.Г. Мухачев [и др.] // Вестник казанского технологического университета. – 2011. - № 15. – С. 150 – 153]. Чаще всего применяют кислотно-щелочной способ обработки целлюлозо- и лигнинсодержащих отходов, отпаривание под давлением, обработка аммиаком и каустической содой [Высокотемпературный гидролиз растительного сырья // Р.М. Нуртдинов, С.Г. Мухачев, Р.Т. Валеева [и др.] // Вестник казанского технологического университета. – 2011. - № 10. – С. 204 – 208; Голязимова, О.В. Увеличение эффективности измельчения лигноцеллюлозного растительного сырья с помощью химической обработки / О.В. Голязимова, А.А. Политов, О.И. Ломовский // Химия растительного сырья. – 2009. - № 2. – С. 53 – 58.]. После такой обработки происходит полное или частичное разложение трудногидролизуемых полисахаридов и лигнина, что обеспечивает ускоренный рост грибной массы и сокращение сроков промышленного культивирования грибов (до 7 - 8 суток). В зависимости от способа подготовки растительного сырья для культивирования микроскопических грибов применяют и соответствующие технологии их выращивания. Для культивирования грибов на твердой питательной среде разработан метод твердофазной ферментации. Это гетерофазный процесс, который включает измельчение и обработку растительного сырья парами воды и аммиака, обогащение этого сырья минеральными веществами, посев и выращивание мицелия грибов в заданном режиме аэрации и поддержание оптимальной температуры [Смирнов, К.А. Особенности твердофазной ферментации / К.А. Смирнов, Ю.Д. Алашкевич, Н.С. Решетова // Химия растительного сырья. – 2009. - № 3. – С. 161 – 164]. Однако, при такой технологии культивирования грибов коэффициент использования растительного сырья невысокий, что предопределяет и сравнительно невысокий уровень содержания белка в выращиваемой грибной массе (20 – 30 % от сухой массы). Так, прямое культивирование мицелиальных грибов на соломе и других отходах растениеводства обеспечивает включение углерода из этих источников в органическое вещество грибного мицелия на 17 – 25 %. Более высокий коэффициент использования сырья обычно достигается при выращивании грибов на гидролизатах растительных отходов и жидких отходах деревообрабатывающей и целлюлозно-бумажной промышленности [Егорова, Т.А. Основы биотехнологии: учеб. пособие для высш. пед. учеб. заведений / Т.А. Егорова, С.М. Клунова, Е.А. Живухина. – 4-е изд., стер. – М. : Издательский центр «Академия», 2008. – 208 с]. В пересчете на сухую массу количество протеина в грибном мицелии, культивируемом на среде с высокой влажностью, может составлять 50 – 60 %. Для более эффективной переработки сырья в некоторых случаях применяется одновременное культивирование бактерий и грибов. Разработаны технологии по переработке в грибной белок торфа, навоза [Пат. РФ № 2005789, МПК C12P1/00, C02F3/34, 1994г.].
Хорошая перевариваемость грибной белковой массы в организме животных, а также низкий уровень содержания нуклеиновых кислот позволяют использовать её в качестве кормовой добавки в значительно большей концентрации, чем кормовые дрожжи. Обычно при кормлении молодняка животных допускается введение в кормовые рационы грибного белка в пределах 15 – 20 % от белка корма, а при кормлении взрослых животных - до 50 %.
Практическое использование термофильных мицелиальных грибов в технологических процессах имеет преимущества перед мезофильными микроорганизмами [Билай Т.И. Термофильные грибы и их ферментативные свойства. Киев: Наукова думка. 1985. 172 с.]. Недостатком использования для ферментации многих видов мезофильных грибов является их отношение к группе условно-патогенных грибов. Способность многими видами плесневых грибов образовывать обильное спороношение может привести к пылению субстрата, что создает неблагоприятные условия для работы персонала, приводит к развитию профзаболеваний. Температурный режим, при котором могут существовать и развиваться мезофильные грибы, не исключает развитие патогенной и условно-патогенной микобиоты. Кроме того, многие виды атоксигенных термофильных грибов, обладая более высоким уровнем образования целлюлолитических ферментов и биомассы, являются перспективными продуцентами кормового источника белка, витаминов, липидов и других физиологически активных метаболитов с использованием дешевых растительных субстратов. Основными критериями в селекции штаммов мицелиальных грибов для производства обогащенных грубых кормов и различных растительных отходов являются следующие: атоксигенность, высокая скорость роста на субстрате (высокая белоктрансформирующая активность), высокое содержание белка с набором незаменимых аминокислот, степень безвредности при производстве обогащенного корма и его скармливании животным, стабильность и технологичность при изготовлении посевного материала культуры, проведение твердофазной ферментации [Смирнов и др., 2009; Смирнов К.А., Ю.Д. Алашкевич, Н.С. Решетова. Особенности твердофазной ферментации. Химия растительного сырья. 2009. №3. С. 161–164].
Так, например, известен способ переработки отходов растительного сырья, предусматривающий жидкофазную ферментацию с использованием термофильного штамма гриба M. termophila F-2109, гидролиз растительного сырья жидкофазной фракцией, полученной при жидкофазной ферментации и содержащей ферменты, обеспечивающие деградацию крахмала, целлюлозы и лигнина, и твердофазную ферментацию, осуществляемую на смеси продуктов жидкофазной ферментации и ферментативного гидролиза растительного сырья в слое смеси, не превышающем 15 мм, при этом переработку осуществляют в условиях порционного замещения целевого продукта свежей средой [Патент РФ № 2354135, МПК A23K 1/14 , C05F 11/00, C02F 3/00, 2009г.]. Способ позволяет перерабатывать 27 кг опилок и получать 27,5 кг ферментированного продукта, обогащенного легкодоступными углеводами и биомассой грибов, а производительность переработки (биодеградации) растительного сырья при использовании гидролизного аппарата емкостью 3 дм3 достигает 5,4 кг/сутки.
Таким образом, путь прямой трансформации полимеров грубых отходов сельского хозяйства в белок и другие полезные метаболиты грибной массы решает вопрос обогащения белком и другими биологически активными метаболитами целлюлозосодержащих субстратов. Однако для выбранного штамма-продуцента всегда остается необходимость либо
увеличения эффективности имеющихся ферментативных систем методами метаболического инжиниринга для более глубокой переработки субстратов, либо создания новых метаболитов в виде рекомбинантных белков и ферментов. Кроме того, в отличие от бактерий мицелиальные грибы могут обеспечить рекомбинантному белку эукариотического происхождения, каким является белок семян кукурузы (зеин), необходимую пострансляционную модификацию и фолдинг, что обеспечит биологическую ценность продукта.
Таким образом, одной из задач изобретения является разработка векторной системы, позволяющей переносить и экспрессировать в клетке термофильного мицелиального гриба гетерологичный белок, что позволит создавать рекомбинантные штаммы с комбинированными свойствами.
Задача изобретения - конструирование рекомбинантного штамма-продуцента Myceliophthora thermophila, несущего такую экспрессирующую конструкцию (плазмиду), которая позволит получать в препаративных количествах целевой продукт - кормовой белок α-зеин В1 семян кукурузы вида Zea mays, используемый для обогащения животноводческих кормов.
Поставленная задача решена путем конструирования рекомбинантной плазмидной ДНК pSAT1-ZmZeinB1, кодирующей кормовой белок α-зеин В1 семян кукурузы вида Zea mays.
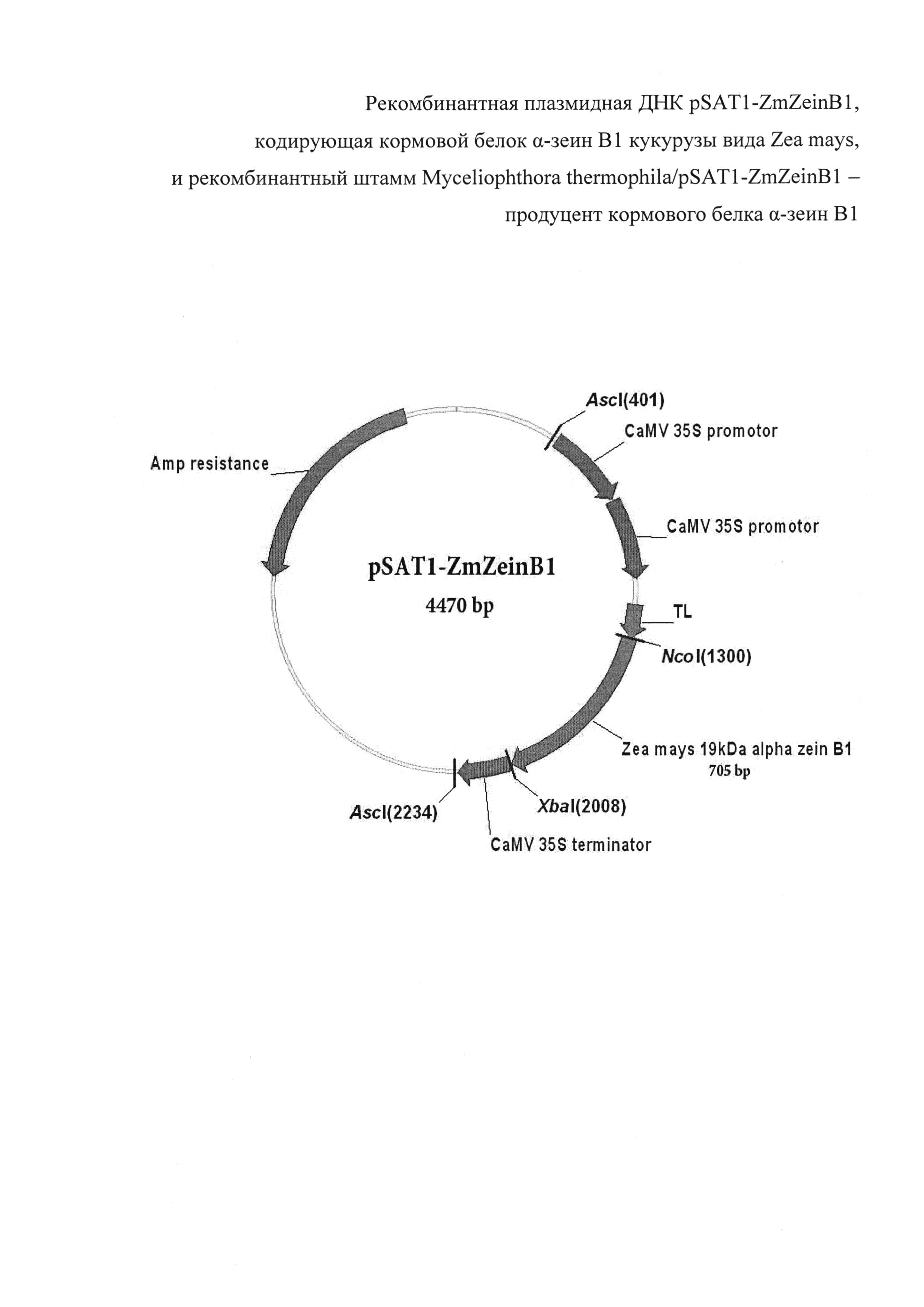
Технический результат заявленного изобретения - получение кормового белка α-зеин В1 кукурузы вида Zea mays в штамме мицелиального гриба с высоким выходом (145±10 мг из 1 л культуры). Плазмида pSAT1-ZmZeinB1 имеет 4470 пар оснований (п.о.) и характеризуется наличием NcoI/XbaI-фрагмента плазмиды pSAT1-MCS [Tzfira Т, Tian G-W, Lacroix В, Vyas S, Li J, Leitner-Dagan Y, Krichevsky A, Taylor T, et al. pSAT vectors: a modular series of plasmids for autofluorescent protein tagging and expression of multiple genes in plants. Plant Mol Biol 2005; 57:503-16], или последовательности фрагмента ДНК размером 705 п.о., содержащего белок-кодирующий участок гена α-зеин В1 кукурузы вида Zea mays со стартовым кодоном.
На фиг. 1 представлена физическая карта плазмиды pSAT1-ZmZeinB1 и область плазмиды, ответственная за экспрессию рекомбинантного белка α-зеина В1. Нуклеотидная последовательность фрагмента плазмиды pSAT1-ZmZeinB1, фланкированная сайтами NcoI и XbaI, содержит последовательность структурного гена α-зеина В1, соответствующую открытой рамке считывания для зрелого белка α-зеина В1.
Экспрессия гена ZmZeinB1 обеспечивается наличием двойного промотора гена 35S рРНК вируса мозаики цветной капусты (CaMV), участком усиления трансляции (TL) вируса гравировки табака (TEV), а также терминаторным участком гена 35S CaMV. Кроме того, плазмида pSAT1-ZmZeinB1 несет ген, кодирующий фермент бета-лактамазу, обеспечивающий устойчивость к ампицилину (AmpR) в процессе селекции (см. фиг. 1)
Рекомбинантный штамм Myceliophthora thermophila/pSAT1-ZmZeinB1 - продуцент запасающего белка α-зеина В1, получен трансформацией клеток М. thermophila F-859 (ВКМ) плазмидой pSAT1-ZmZeinB1 с использованием традиционного метода электропорации [Sambrook J., Fritsch E.F., Maniatis Т. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989].
Рекомбинантный штамм Myceliophthora thermophila/pSAT1-ZmZeinB1 характеризуется следующими признаками:
1) культурально-морфологические признаки: колонии на агаризованном солодовом экстракте быстро растущие, достигающие 60-65 мм в диаметре через 7 дней, распростертые, сначала белые, затем светло-коричневые, текстура поверхности гранулированная. Вегетативные гифы септированные, неокрашенные. Конидиеносцы простые или разветвленные, бесцветные. Конидии образуются одиночно или небольшими группами, неокрашенные, гладкие, овальные до грушевидных, 4-10(12)×3-5 мкм. Пигмент отсутствует. Штамм хорошо растет на таких средах, как агаризованный солодовый экстракт (мальт-пептонный агар: мальт-экстракт - 30 г; пептон - 1 г; агар-агар - 15 г), картофельно-глюкозный агар (картофельный отвар - 200 г; глюкоза - 20 г; агар-агар - 15 г), а также на твердофазной среде при влажности 60%, содержащей растительные субстраты: рисовая шелуха (5%), мучка рисовая (65%), соевый шрот (30%) при температуре 45°С.
2) физико-биологические признаки: штамм характеризуется высокой гемицеллюлолитечской активностью (целлюлазы, ксиланазы, 1,3(1,4)-глюканазы, амилазы, гликозидазы).
Штамм не патогенен и не токсичен для теплокровных животных.
Штамм хранится обычным способом в суспензии с глицерином (30%) при -70°С.
Способ получения рекомбинантного белка α-зеина В1 заключается в следующем: мицелий штамма М. thermophila/pSAT1-ZmZeinB1 культивируют в жидкой питательной среде на основе картофельно-глюкозного бульона или 10-% смеси мучки рисовой и дистиллированной воды, или среды Вогеля в течение 7 дней при 45°С, затем биомассу осаждают центрифугированием, суспензию дезинтегрируют в буфере с 8М мочевиной, далее экстракт центрифугируют, надосадочную жидкость собирают и помещают на колонку с Ni-сефарозой (GE Healthcare). Элюцию белка проводят 0,5-М имидазолом в том же буфере и анализируют методом электрофореза в ПААГ. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в штамме М. thermophila/pSAT1-ZmZeinB1 составляет не менее 30% от всех белков клеточной фракции. Выход рекомбинантного белка составляет 145±10 мг из 1 л культуры.
Рекомбинантный белок α-зеин В1 кукурузы вида Zea mays имеет молекулярную массу 25,3 кДа и полностью соответствует природному белку, т.е. не содержит каких-либо плазмидных довесков. Преимущества использования термофильного атоксигенного мицелиального гриба Myceliophthora thermophila/pSAT1-ZmZeinB1 позволяют разработать способ получения белкового корма без разделения питательного субстрата и штамма-продуцента по завершении процесса ферментации, что предполагает снижение затрат на трудоемкие и дорогостоящие процедуры очистки белков при производстве обогащенных комбикормов.
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование плазмиды pSAT1-ZmZeinB1.
Рекомбинантную плазмиду pSAT1-ZmZeinB1, содержащую ген, кодирующий полноразмерный кормовой белок α-зеин В1 кукурузы вида Zea mays, фланкированный сайтами рестрикции NcoI и XbaI, конструируют на основе плазмиды pSAT1-MCS [Tzfira Т, Tian G-W, Lacroix В, Vyas S, Li J, Leitner-Dagan Y, Krichevsky A, Taylor T, et al. pSAT vectors: a modular series of plasmids for autofluorescent protein tagging and expression of multiple genes in plants. Plant Mol Biol 2005; 57:503-16].
Фрагмент кДНК, содержащий ген α-зеина В1 кукурузы вида Zea mays [GenBank № AF371269], получают в три этапа. На первом этапе проводят выделение РНК из проростков кукурузы Zea mays. Для этого навеску растительной ткани весом 100 мг растирают в жидком азоте до получения гомогенной массы и экстрагируют при помощи буфера следующего состава: 100 mM Трис-HCl (рН8,0), 2М NaCl, 25 mM ЭДТА, 2% ЦТАБ, 2% ПВП, 2% 2-меркаптоэтанол. Полученный лизат инкубируют 5 минут при температуре 65°С периодически перемешивая. По истечении времени инкубации раствор дважды обрабатывают смесью хлороформ/изоамиловый спирт (24/1) с последующим центрифугированием 10 мин при 18000 g и верхнюю фазу, содержащую фракцию нуклеиновых кислот переносят в новые пробирки. Для отделения молекул РНК от ДНК, к раствору добавляют 0,25 объема 10М LiCl и инкубируют при +4°С в течении 16 часов. Смесь центрифугируют 15 мин при 18000 g. Для очистки от избытка соли, осадок РНК растворяют в 0,1 мл стерильной бидистиллированной воды и осаждают добавлением 2,5 объема охлажденного 96% этанола с последующим центрифугированием 15 мин при 18000 g. Осадок РНК промывают последовательно 70%-ным раствором этанола и подсушивают на воздухе. РНК растворяют в 0,02 мл стерильной бидистиллированной воды. Количество РНК определяют спектрофотометрическим методом по величине оптической плотности раствора при 260 нм. Качество РНК оценивают по соотношению оптической плотности при 260 нм, с поглощением раствора при 230 и 280 нм. На втором этапе 2 мкг полученной РНК используют для синтеза кДНК. Реакцию обратной транскрипции проводят при помощи набора реактивов Mint (Евроген, Москва) согласно протоколу фирмы-производителя. На третьем этапе проводят полимеразную цепную реакцию с использованием кДНК кукурузы в качестве матрицы для получения гена ZmZeinB1 и праймеров aZ19B1-pSAT-NcoI-dir и aZ19B1-pSAT-XbaI-rev, где aZ19B1-pSAT-NcoI-dir - праймер, специфичный по отношению к N-концевой последовательности ZmZeinB1, включающий сайт для рестриктазы NcoI; aZ19B1-pSAT-XbaI-rev - обратный праймер, специфичный по отношению к С-концевой последовательности ZmZeinB1, включающий сайт рестрикции XbaI:

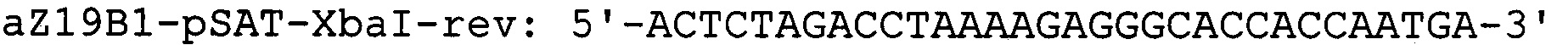
Данную реакцию проводят в следующих условиях: 10×Encyclo буфер, 50×смесь полимераз Encyclo («Encyclo PCR kit», Евроген, Москва), 50× смесь dNTP (10 mM каждого), смесь праймеров (5 μМ каждого), 20 нг ДНК. Процесс амплификации состоит из следующих стадий: 30 циклов ПЦР (15 с - 95°С, 15 с - 55°С, 1 мин - 72°С) и инкубация 10 мин при 72°С. После амплификации ПЦР-продукт очищают электрофорезом в 1% агарозном геле. Фрагмент (1 мкг) обрабатывают рестриктазами NcoI и XbaI в оптимальном буфере (Fermentas) в течение 24 ч, затем ферменты удаляют из реакционной среды по стандартной методике фенолом (1:1) [Sambrook J. et. al. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989]. В водную фракцию, содержащую фрагмент, добавляют 1/10 объема 0,3 М ацетата Na, рН 5,2 и 1/2 объема изопропилового спирта и оставляют на -20°С в течение 30 мин. Затем центрифугируют при 18000 g в течение 20 мин, осадок промывают 70% этанолом и высушивают при комнатной температуре. Осадок растворяют в 20 мкл деионизованной воды. Для сравнения нуклеотидной последовательности полученного фрагмента с последовательностью целевого гена его секвенируют с использованием смеси флуоресцентно-
меченных терминаторов BigDye™ Terminator v3.1 Cycle Sequencing Kit по методике производителя (Applied Biosystems).
2 мкг плазмидной ДНК pSAT1-MCS обрабатывают рестриктазами NcoI и XbaI в соответствии с методикой, описанной выше, и из полученного гидролизата выделяют векторную часть плазмиды в 1% геле легкоплавкой агарозы.
Полученный фрагмент гена α-зеина В1 кукурузы вида Zea mays и векторную часть плазмиды pSAT1-MCS сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования согласно инструкции (Fermentas). 10 мкл реакционной смеси используют для трансформации компетентных клеток Е. coli DH5α. Трансформанты высевают на LB-агар, содержащий 50 мкг/мл ампициллина. После инкубирования в течение 16 ч при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют на наличие мутаций при помощи автоматического секвенирования. Отбирают плазмидную ДНК pSAT1-ZmZeinB1, содержащую последовательность α-зеина В1 кукурузы вида Zea mays.
Пример 2. Получение рекомбинантного штамма М. thermophila/pSAT1-ZmZeinB1 - продуцента запасного белка кукурузы α-зеина В1 кукурузы вида Zea mays.
Рекомбинантный штамм-продуцент М. thermophila/pSAT1-ZmZeinB1 получают путем электропорации конидий штамма М. thermophila F-859 (ВКПМ) рекомбинантной плазмидой pSAT1-ZmZeinB1. Конидии М. thermophila собирают с поверхности мицелия 15-дневной культуры гриба М. thermophila F-859, выращенного на обедненной агаризованной среде Вогеля с добавлением 2% сахарозы, путем их суспендирования стерильной водой с 2% Твин-80. Далее конидии переводят в буфер, содержащий 1 мМ HEPES, рН 7,0, 50 мМ маннитола, 0,01% Твина-20, и доводят до концентрации 106/мл с использованием камеры Горяева. Далее суспензию конидий смешивают с 10 мкг плазмидной ДНК в объеме 250 мкл и помещают в ячейку для электропорации с зазором 0,2 см (Bio-Rad). Процедуру электропорации проводят в кюветном электропораторе Gene Pulser Xcell (BioRad) в следующем режиме: два импульса по 1 мс каждый при 1,70 кВ с интервалом 5 с.
Для определения эффективности трансформации и наличия вставки гена, кодирующего белок α-зеин В1, рекомбинантные колонии высевают на агаризованной среде Вогеля, выращивают в течение 5 дней при 45°С, отбирают с чашки отдельно стоящие колонии и используют в качестве матрицы для ПЦР с использованием пар специфических праймеров для плазмиды:
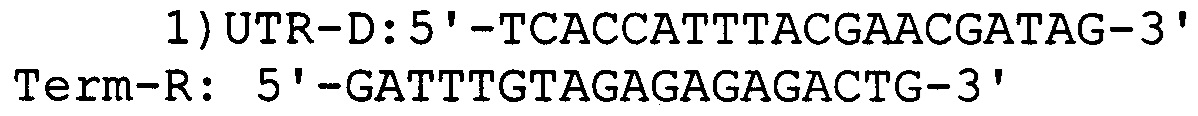
и гена α-зеина В1:
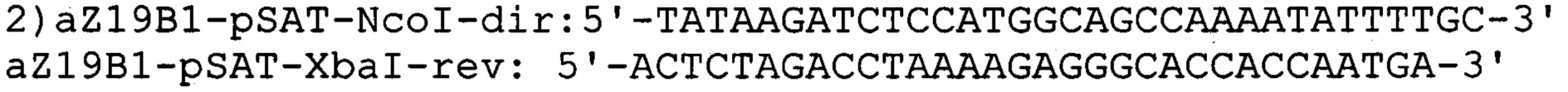
Для определения продуктивности штамма по рекомбинантному белку экстракты грибной биомассы анализируют определением концентрации белка по методу Брэдфорд и электрофорезом в ПААГ. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в клеточной фракции составляет не менее 30% от всех белков этой фракции.
Пример 3. Выделение и характеристика рекомбинантного белка α-зеина В1 кукурузы вида Zea mays.
Штамм-продуцент рекомбинантного белка α-зеина В1 кукурузы вида Zea mays - М. thermophila/pSAT1-ZmZeinB1, инкубируют в трехлитровой
колбе в жидкой среде, содержащей на 1 л культуры 200 г картофельного отвара, 20 г сахарозы, рН 5,1, в течение 7 суток при 45°С при перемешивании 2 раза в день. Грибную биомассу отделяют от культуральной среды центрифугированием, затем осадок промывают физраствором на фильтровальной бумаге. Биомассу дезинтегрируют жидким, экстрагируют в буфере с 8 М мочевиной. Затем экстракт, содержащий рекомбинантный белок, центрифугируют при 14000 об/мин в течение 20 мин и надосадочную жидкость собирают и помещают на колонку с Ni-сефарозой (GE Healthcare). Элюцию белка проводят 0,5-М имидазолом в том же буфере и анализируют методом электрофореза в ПААГ. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в штамме М. thermophila/pSAT1-ZmZeinB1 составляет не менее 30% от всех белков фракции.
Выход рекомбинантного белка составляет 145±10 мг из 1 л культуры.
Идентификацию полученного рекомбинантного полипептида проводят по первым 10 аминокислотам на автоматическом секвенаторе. Секвенирование препарата рекомбинантного белка, выделенного из клеток штамма М. thermophila/pSAT1-ZmZeinB1, показало, что N-концевая последовательность рекомбинантного белка соответствует первым 10 аминокислотам α-зеина В1 семян кукурузы Zea mays (GenBank № Р06675).
Заявленное изобретение позволяет с помощью использования рекомбинантного штамма-продуцента М. thermophila/pSAT1-ZmZeinB1 получать путем биосинтеза запасный белок α-зеин В1 кукурузы вида Zea mays, который может быть использован в животноводстве для разработки технологий обогащения растительных кормов.