Результат интеллектуальной деятельности: Рекомбинантная плазмидная ДНК pSAT1-AhA1, кодирующая запасный белок А1 семян Amaranthus hypochondriacus, и рекомбинантный штамм Myceliophthora thermophila/pSAT1-AhA1 - продуцент запасного белка А1
Вид РИД
Изобретение
Рекомбинантная плазмидная ДНК pSAT1-AhA1, кодирующая запасный белок А1 семян Amaranthus hypochondriacus, и рекомбинантный штамм Myceliophthora thermophila/pSAT1-AhA1 - продуцент запасного белка А1
Изобретение относится к биотехнологии, в частности к генетической инженерии, и позволяет получать микробиологическим синтезом по оптимизированной технологии запасный белок А1 семян Amaranthus hypochondriacus L., который может быть использован в животноводстве для обогащения грибного мицелия и кормов сбалансированным по аминокислотному составу белком.
В качестве одного из альтернативных источников кормового протеина может использоваться перспективная высокобелковая культура - амарант {Amaranthus L).
В последние годы во многих странах мира проводятся интенсивные исследования с этой культурой. Семена и фитомасса амарантовых представляют собой прекрасный корм для животных в свежем, сушеном или засилосованном состоянии, а также высокотехнологичное сырье для извлечения белка и сопутствующих ценных компонентов, таких как пектин, пигменты, витамины, пищевые красители и др. Семена амаранта содержат в среднем 15-18% белка, 5-8% масла и 3,7-5,7% клетчатки, что выше, чем у большинства зерновых культур [Магомедов, И.М. Физиологические особенности конкурентоспособности амаранта / И.М. Магомедов // Успехи современного естествознания. - 2008. - №5. - С. 41 - 43].
Родиной амаранта является Центральная и Южная Америка, где он уже тысячелетия служит пищевой культурой для местных народов. Амарант устойчив против болезней, засухи, жары. Хорошо приспосабливается к новым условиям, в том числе и таким, которые для других растений невыносимы. Семейство амарантовых представлено 65 родами и 850 видами, распространенными главным образом в субтропических областях земного шара. Все они являются древними зерновыми культурами. Именно поэтому за последние 25 лет многие виды амаранта интродуцируются и широко используются в качестве пищевых, кормовых и лекарственных культур в странах Америки, Европы, Азии и Африки [Алексеев Г.В. Переработка нетрадиционного растительного сырья с целью дальнейшего его использования в продуктах питания / Г.В. Алексеев, В.А. Головацкий, И.В. Краснов [и др] // Электронный научный журнал процессы и аппараты пищевых производств [Электронный ресурс] / СПб НИУ ИТМО ИХиБТ. - Электрон, текстовые дан. - С-Петербург: СПБГУНиПТ, 2007. - Режим доступа: http://processes.open-mechanics.com/articles/29.pdf.; Журавель, Н.В. Амарант перспективная зернокормовая культура для возделывания на юге России / Н.В. Журавель, В.В. Чумакова // Зерновое хозяйство России. - 2012. - №2. - С. 18 - 25].
В отличие от низкокачественных белков зерновых злаков, ценность белка амаранта определяется преобладанием легкорастворимых в воде и слабых солевых растворах фракций альбуминов и глобулинов, не образующих клейковины, с повышенным содержанием незаменимых аминокислот [Чернов, И.А. Специфика биосинтеза высоколизинового белка у растений рода Amaranthus 1., состав, свойства и технология его выделения из фитомассы амаранта / И.А. Чернов, Г.А. Гасимова, И.А. Дегтярева, Ю.А. Куликов // Ученые записки казанского государственного университета. Естественные науки. - 2007. - Т. 149, кн. 4. - С. 8 - 19]. При применении зерна амаранта в кормлении домашней птицы повышается яйценоскость кур-несушек, ускоряется ростцыплят, повышается производство мяса птицы. Особый интерес зерно амаранта как корм, представляет при выращивании мелких пернатых (перепелов, попугаев и другой мелкой птицы). Однако стоит отметить, что семена амаранта, имеющие темную оболочку, включают в себя небольшое количество токсичных веществ. Исходя из этого факта, для пищевых и кормовых целей, в большинстве случаев, подходят сорта только со светлой окраской семян. Следует учитывать способность амаранта к переопылению сортов.
В России сорняк - щирица обыкновенная, является подвидом семейства Амарантовые, имеет сходства с амарантом культурных видов, но сильно уступает им в продуктовых и качественных показателях. Поэтому, щирица не представляет ценности как сельскохозяйственная культура и, как правило, отделяется от понятия амарант.
По содержанию незаменимой аминокислоты - лизина, амарант в 2 раза превосходит пшеницу и в 3 раза кукурузу. При недостатке лизина пища плохо усваивается и белок проходит через организм транзитом. По содержанию незаменимых аминокислот - треонина, фенилаланина, тирозина и триптофана структура амаранта приравнивается к белку женского молока. Амарант имеет наибольшее совпадение с теоретически рассчитанным идеальным белком. Для сравнения, коэффициент оценки к идеальному белку: амарант - 75, коровье молоко - 72, соя - 68, ячмень - 62, пшеница - 60, кукуруза - 44, арахис - 32. Однако из всех белков амарантовых стоит выделить проламиноподобный запасный белок А1 из Amaranthus hypochondriacus L., который содержит в своем составе наибольшее количество дефицитных в кормопроизводстве аминокислот: 8,36% лизина, 6,13% треонина, 2,99% метионина, 6,37% валина, 4,09% триптофана, что превышает в несколько раз содержание этих аминокислот в таких белках, как казеин, овальбумин, лактальбумин, белок сои и пр. Поэтому аминокислотная последовательность проламиноподобного запасного белка амаранта А1, созданная природой, является лучшей альтернативой для целей получения наиболее сбалансированного по аминокислотному составу протеина рекомбинантным способом.
Известны способы обогащения белком Al Amaranthus hypochondriacus L. плодов трансгенных растений томатов, кукурузы или табака путем внедрения в растения гена, кодирующего запасной белок Al [Accession no: AF49129, Chakraborty et al., 2000) (SEQ ID NO: 5) (U.S. patent 5846736); Chakraborty, S., Chakraborty, N., and Datta, A. (2000). Increased nutritive value of transgenic potato by expressing a nonallergenic seed albumin gene from Amaranthus hypochondriacus. Proceedings of the National Academy of Sciences USA 97, 3724-3729.]. Методы получения рекомбинантного белка амаранта A1 микробиальным синтезом не известны.
Тем не менее, одним из путей решения проблемы обогащения животноводческих кормов белками является получение белка микробиологическим путем. Микроорганизмы отличаются высоким (до 60% сухой массы) содержанием белка, сбалансированного по аминокислотному составу. Кроме того, микроорганизмы содержат углеводы, липиды, витамины, макро- и микроэлементы. Важным достоинством производства кормового белка на основе микроорганизмов является использование сельскохозяйственных отходов, возможность организации промышленного производства, отсутствие сезонности и зависимости от погодно-климатических условий [Мхитарян, Г.А. Современные технологии переработки свекловичного жома / Г.А. Мхитарян, А.П. Леснов, В.М. Ткаченко // Сахарная свекла. - 2009. - №2. - С. 33-35; Chadd,
S.A. Practical production of protein for food animals / S.A. Chadd, W.P. Davies, J.M. Koivisto // Protein sources for the animal feed industry. Expert Consultation and Workshop Bangkok, 29 April – 3 May 2002. – 2004. - № 1. – p. 77 – 125].
Таким образом при использовании микроорганизмов в качестве продуцентов целлюлолитических ферментов и кормового белка одновременно решаются две важные задачи — получение белковой массы и утилизация отходов растениеводства, деревообрабатывающей и целлюлозно-бумажной промышленности, которые могут быть источниками загрязнения окружающей среды [Базунова, М.В. Способы утилизации отходов полимеров / М.В. Базунова, Ю.А. Прочухан // Вестник башкирского университета. – 2008. – Т. 13, № 4. – С. 875 – 885; Пат. 2354633 Российская федерация, МПК C 05 F 11/08, C 02 F 3/34 . Способ утилизации жиросодержащих отходов и продукт, получаемый этим способом / Н.С. Фунтикова, Н.Б. Сократова, М.С. Тришкин ; заявители и Н.С. Фунтикова, Н.Б. Сократова, М.С. Тришкин. – № 2007124272/13 ; заявл. 28.06.2007 ; 10.05.2009, Бюл. № 13. – 6 с.]. В отличие от бактериальных и дрожжевых клеток, которые продуцируют ДНК в количестве, вызывающем интоксикацию у животных, концентрация нуклеиновых кислот в грибном мицелии почти такая же, как в тканях растительного организма (1 – 4 % от сухой массы). Однако в биомассе мицелиальных грибов синтезируется значительно меньше белков (20 – 60 % от сухой массы), чем в дрожжах, и у них относительно медленней происходит рост биомассы [Дедков, В.Н. Биоконверсия соломы злаковых культур грибами рода Trichoderma в кормовые продукты для животноводства / В.Н. Дедков, И.А. Гнеушева, Н.Е. Павловская // Вестник ОрелГАУ. – 2012. – №4(37). – С. 102 – 105].
В целях ускорения роста грибов проводится предварительная обработка растительного сырья, повышающая доступность его компонентов для утилизации микроорганизмами [Низкотемпературный гидролиз растительного сырья / Р.М. Нуртдинов, Р.Т. Валеева, С.Г. Мухачев [и др.] // Вестник казанского технологического университета. – 2011. - № 15. – С. 150 – 153]. Чаще всего применяют кислотно-щелочной способ обработки целлюлозо- и лигнинсодержащих отходов, отпаривание под давлением, обработка аммиаком и каустической содой [Высокотемпературный гидролиз растительного сырья // Р.М. Нуртдинов, С.Г. Мухачев, Р.Т. Валеева [и др.] // Вестник казанского технологического университета. – 2011. - № 10. – С. 204 – 208; Голязимова, О.В. Увеличение эффективности измельчения лигноцеллюлозного растительного сырья с помощью химической обработки / О.В. Голязимова, А.А. Политов, О.И. Ломовский // Химия растительного сырья. – 2009. - № 2. – С. 53 – 58.]. После такой обработки происходит полное или частичное разложение трудногидролизуемых полисахаридов и лигнина, что обеспечивает ускоренный рост грибной массы и сокращение сроков промышленного культивирования грибов (до 7 - 8 суток). В зависимости от способа подготовки растительного сырья для культивирования микроскопических грибов применяют и соответствующие технологии их выращивания. Для культивирования грибов на твердой питательной среде разработан метод твердофазной ферментации. Это гетерофазный процесс, который включает измельчение и обработку растительного сырья парами воды и аммиака, обогащение этого сырья минеральными веществами, посев и выращивание мицелия грибов в заданном режиме аэрации и поддержание оптимальной температуры [Смирнов, К.А. Особенности твердофазной ферментации / К.А. Смирнов, Ю.Д. Алашкевич, Н.С. Решетова // Химия растительного
сырья. – 2009. - № 3. – С. 161 – 164]. Однако, при такой технологии культивирования грибов коэффициент использования растительного сырья невысокий, что предопределяет и сравнительно невысокий уровень содержания белка в выращиваемой грибной массе (20 – 30 % от сухой массы). Так, прямое культивирование мицелиальных грибов на соломе и других отходах растениеводства обеспечивает включение углерода из этих источников в органическое вещество грибного мицелия на 17 – 25 %. Более высокий коэффициент использования сырья обычно достигается при выращивании грибов на гидролизатах растительных отходов и жидких отходах деревообрабатывающей и целлюлозно-бумажной промышленности [Егорова, Т.А. Основы биотехнологии: учеб. пособие для высш. пед. учеб. заведений / Т.А. Егорова, С.М. Клунова, Е.А. Живухина. – 4-е изд., стер. – М. : Издательский центр «Академия», 2008. – 208 с]. В пересчете на сухую массу количество протеина в грибном мицелии, культивируемом на среде с высокой влажностью, может составлять 50 – 60 %. Для более эффективной переработки сырья в некоторых случаях применяется одновременное культивирование бактерий и грибов. Разработаны технологии по переработке в грибной белок торфа, навоза [Пат. 2005789 Российская Федерация, МПК C 12 P 1/00 A, C 02 F 3/34 B. Способ очистки животноводческих стоков и получение биомассы / М.В. Левчикова, Р.А. Мельник, Л.И. Ульченко, А.А. Ковалев; заявитель и патентообладатель «Всероссийский институт электрофикации сельского хозяйства». - № 4856861/13 ; заявл. 26.06.1990 ; 15.01.1994, Бюл. № 1. – 6 с.].
Хорошая перевариваемость грибной белковой массы в организме животных, а также низкий уровень содержания нуклеиновых кислот позволяют использовать её в качестве кормовой добавки в значительно большей концентрации, чем кормовые дрожжи. Обычно при кормлении молодняка животных допускается введение в кормовые рационы грибного белка в пределах 15 – 20 % от белка корма, а при кормлении взрослых животных - до 50 %.
Практическое использование термофильных мицелиальных грибов в технологических процессах имеет преимущества перед мезофильными микроорганизмами [Билай Т.И. Термофильные грибы и их ферментативные свойства. Киев: Наукова думка. 1985. 172 с.]. Недостатком использования для ферментации многих видов мезофильных грибов является их отношение к группе условно-патогенных грибов. Способность многими видами плесневых грибов образовывать обильное спороношение может привести к пылению субстрата, что создает неблагоприятные условия для работы персонала, приводит к развитию профзаболеваний. Температурный режим, при котором могут существовать и развиваться мезофильные грибы, не исключает развитие патогенной и условно-патогенной микобиоты. Кроме того, многие виды атоксигенных термофильных грибов, обладая более высоким уровнем образования целлюлолитических ферментов и биомассы, являются перспективными продуцентами кормового источника белка, витаминов, липидов и других физиологически активных метаболитов с использованием дешевых растительных субстратов. Основными критериями в селекции штаммов мицелиальных грибов для производства обогащенных грубых кормов и различных растительных отходов являются следующие: атоксигенность, высокая скорость роста на субстрате (высокая белоктрансформирующая активность), высокое содержание белка с набором незаменимых аминокислот, степень безвредности при производстве обогащенного корма и его скармливании животным, стабильность и технологичность при изготовлении посевного материала культуры, проведение твердофазной ферментации [Смирнов и др., 2009; Смирнов К.А., Ю.Д. Алашкевич, Н.С. Решетова. Особенности твердофазной ферментации. Химия растительного сырья. 2009. №3. С. 161-164].
Так, например, известен способ переработки отходов растительного сырья, предусматривающий жидкофазную ферментацию с использованием термофильного штамма гриба М. termophila F-2109, гидролиз растительного сырья жидкофазной фракцией, полученной при жидкофазной ферментации и содержащей ферменты, обеспечивающие деградацию крахмала, целлюлозы и лигнина, и твердофазную ферментацию, осуществляемую на смеси продуктов жидкофазной ферментации и ферментативного гидролиза растительного сырья в слое смеси, не превышающем 15 мм, при этом переработку осуществляют в условиях порционного замещения целевого продукта свежей средой [Кудряшов В.К., Шкидченко А.Н., Редикульцев Ю.В. Способ переработки отходов растительного сырья. Патент. RU 2354135]. Способ позволяет перерабатывать 27 кг опилок и получать 27,5 кг ферментированного продукта, обогащенного легкодоступными углеводами и биомассой грибов, а производительность переработки (биодеградации) растительного сырья при использовании гидролизного аппарата емкостью 3 дм3 достигает 5,4 кг/сутки.
Таким образом, путь прямой трансформации полимеров грубых отходов сельского хозяйства в белок и другие полезные метаболиты грибной массы решает вопрос обогащения белком и другими биологически активными метаболитами целлюлозосодержащих субстратов. Однако для выбранного штамма-продуцента всегда остается необходимость либо увеличения эффективности имеющихся ферментативных систем методами метаболического инжиниринга для более глубокой переработки субстратов, либо создания новых метаболитов в виде рекомбинантных белков и ферментов. Кроме того, в отличие от бактерий мицелиальные грибы могут обеспечить рекомбинантному белку эукариотического происхождения, каким является белок семян амаранта А1, необходимую пострансляционную модификацию и фолдинг, что обеспечит биологическую ценность продукта.
Таким образом, одной из задач изобретения является разработка векторной системы, позволяющей переносить и экспрессировать в клетке термофильного мицелиального гриба гетерологичный растительный белок, что позволит создавать рекомбинантные штаммы с комбинированными свойствами.
Задача изобретения - конструирование рекомбинантного штамма-продуцента Myceliophthora thermophila, несущего такую экспрессирующую конструкцию (плазмиду), которая позволит получать в препаративных количествах целевой продукт - кормовой белок А1 семян амаранта вида Amaranthus hypochondriacus L., который можно будет использовать для балансирования аминокислотного состава кормового белка.
Поставленная задача решена путем конструирования рекомбинантной плазмидной ДНК pSAT1-AhA1, кодирующей запасный белок А1 семян амаранта Amaranthus hypochondriacus.
Технический результат заявленного изобретения - получение с высоким выходом кормового белка А1 амаранта в термофильном мицелиальном грибе Myceliophthora thermophila.
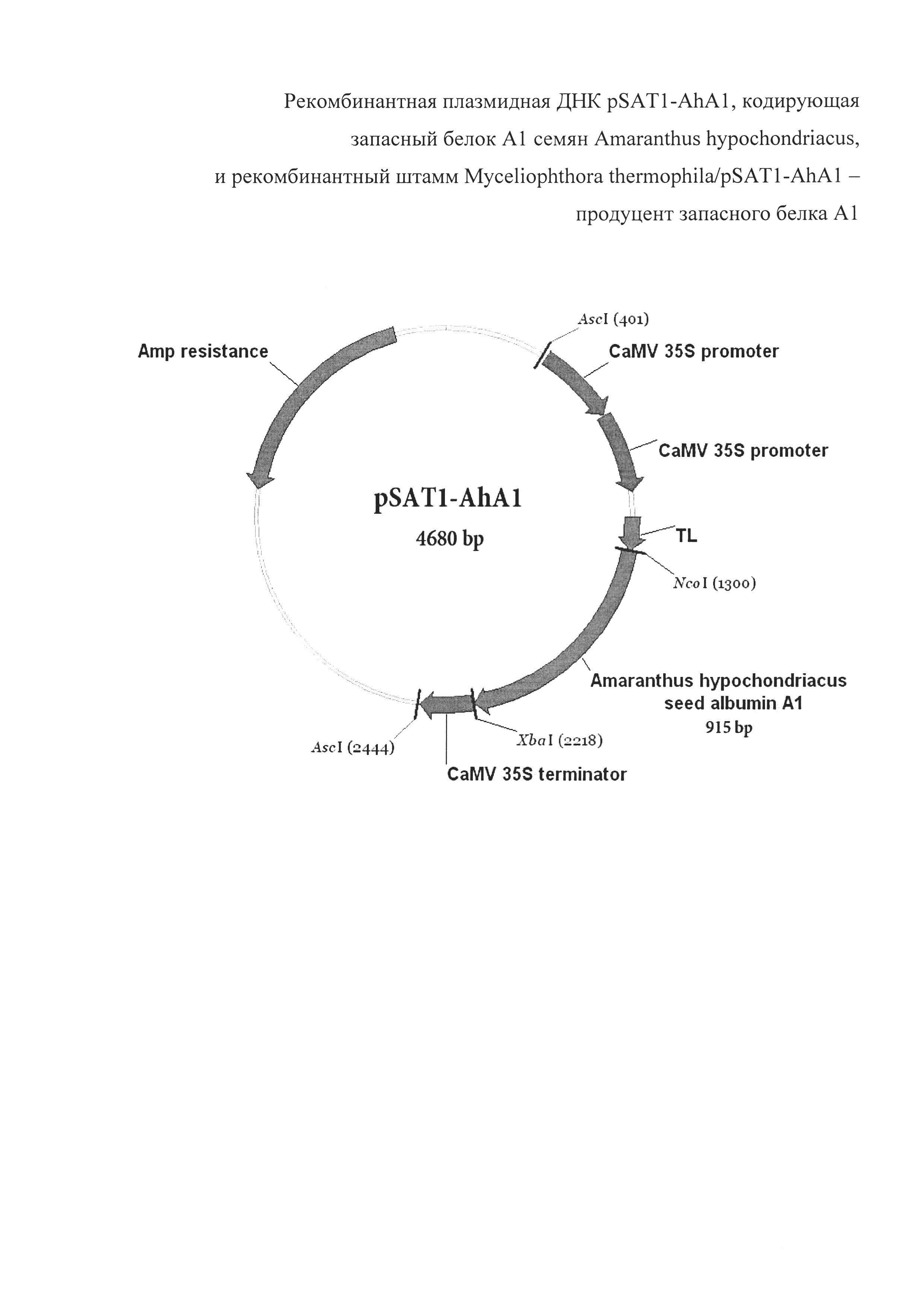
Плазмида pSAT1-AhA1 имеет 4680 пар оснований (п.о.) и характеризуется наличием NcoI/XbaI-фрагмента плазмиды pSAT1-MCS [Tzfira Т, Tian G-W, Lacroix В, Vyas S, Li J, Leitner-Dagan Y, Krichevsky A, Taylor T, et al. pSAT vectors: a modular series of plasmids for autofluorescent protein tagging and expression of multiple genes in plants. Plant Mol Biol 2005; 57:503-16] и последовательности фрагмента ДНК размером 915 п. о., содержащего белок-кодирующий участок гена AhA1 со стартовым кодоном.
На фиг. 1 представлена физическая карта плазмиды pSAT1-AhA1 и область плазмиды, ответственная за экспрессию гибридного белка А1 амаранта. Нуклеотидная последовательность фрагмента плазмиды pSAT1-AhA1, фланкированная сайтами NcoI и XbaI, содержит последовательность структурного гена AhA1, соответствующую открытой рамке считывания для зрелого белка А1. Экспрессия гена AhA1 обеспечивается наличием двойного промотора гена 35S рРНК вируса мозаики цветной капусты (CaMV), участком усиления трансляции (TL) вируса гравировки табака (TEV), а также терминаторным участком гена 35S CaMV. Кроме того, плазмида pSAT1-AhA1 несет ген, кодирующий фермент бета-лактамазу, обеспечивающий устойчивость к ампицилину (AmpR) в процессе селекции (см. фиг. 1)
Рекомбинантный штамм Myceliophthora thermophila/pSAT1-AhA1 продуцент запасного белка А1 семян Amaranthus hypochondriacus L., получен трансформацией клеток М. thermophila F-859 (ВКПМ) плазмидой pSAT1-AhA1 с использованием традиционного метода электропорации [Sambrook J., Fritsch E.F., Maniatis Т. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989].
Рекомбинантный штамм Myceliophthora thermophila/pSAT1-AhA1 характеризуется следующими признаками:
1) культурально-морфологические признаки: колонии на агаризованном солодовом экстракте быстро растущие, достигающие 60-65 мм в диаметре через 7 дней, распростертые, сначала белые, затем светло-коричневые, текстура поверхности гранулированная. Вегетативные гифы септированные, неокрашенные. Конидиеносцы простые или разветвленные, бесцветные. Конидии образуются одиночно или небольшими группами, неокрашенные, гладкие, овальные до грушевидных, 4-10(12)×3-5 мкм. Пигмент отсутствует. Штамм хорошо растет на таких средах, как агаризованный солодовый экстракт (мальт-пептонный агар: мальт-экстракт - 30 г; пептон - 1 г; агар-агар - 15 г), картофельно-глюкозный агар (картофельный отвар - 200 г; глюкоза - 20 г; агар-агар - 15 г), а также на жидкой среде, содержащей воду и мучку рисовую 25%, при температуре 45°С.
2) физико-биологические признаки: штамм характеризуется высокой гемицеллюлолитечской активностью (целлюлазы, ксиланазы, 1,3(1,4)-глюканазы, амилазы, гликозидазы).
Штамм не патогенен и не токсичен для теплокровных животных.
Штамм хранится обычным способом в суспензии с глицерином (30%) при -70°С.
Способ получения рекомбинантного белка А1 семян Amaranthus hypochondriacus L. заключается в следующем: мицелий штамма М. thermophila/pSAT1-AhA1 культивируют в жидкой питательной среде на основе картофельно-глюкозного бульона, или 25-% смеси мучки рисовой и воды дистиллированной, или среды Вогеля в течение 7 дней при 45°С при перемешивании 2 раза в день, затем биомассу осаждают центрифугированием, суспензию дезинтегрируют в буфере с 8М мочевиной, далее экстракт центрифугируют, затем в надосадочной жидкости оценивают количество синтезированного белка с использованием металлафинной хроматографии, метода Бредфорда, метода электрофореза в полиакриламидном геле (ПААГ).
Рекомбинантный белок Al семян Amaranthus hypochondriacus L. имеет молекулярную массу 34,8 кДа и полностью соответствует природному белку, т.е. не содержит каких-либо дополнительных аминокислотных последовательностей плазмиды.
Существенными преимуществами вышеописанного способа получения рекомбинантного аналога белка амаранта А1 являются:
- использование рекомбинантного штамма-продуцента термофильного мицелиального гриба М. thermophila/pSAT1-AhA1, что позволяет получать при биосинтезе большое количество функционального белкового аналога А1, биологически равноценного запасному белку А1 из амаранта Amaranthus hypochondriacus, и улучшать аминокислотный баланс мицелиального белка при обогащении производимого им корма на растительных субстратах;
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование плазмиды pSAT1-AhA1.
Рекомбинантную плазмиду pSAT1-AhA1, содержащую ген, кодирующий полноразмерный кормовой белок А1 семян Amaranthus hypochondriacus L., фланкированный сайтами рестрикции Ncol и Xbal, конструируют на основе плазмиды pSAT1-MCS [Tzfira Т, Tian G-W, Lacroix В, Vyas S, Li J, Leitner-Dagan Y, Krichevsky A, Taylor T, et al. pSAT vectors: a modular series of plasmids for autofluorescent protein tagging and expression of multiple genes in plants. Plant Mol Biol 2005; 57:503-16].
Фрагмент кДНК, содержащий ген AhA1 (GenBank ID: Z11577), получают в три этапа. На первом этапе проводят выделение РНК из проростков амаранта Amaranthus hypochondriacus. Для этого навеску растительной ткани весом 100 мг растирают в жидком азоте до получения гомогенной массы и экстрагируют при помощи буфера следующего состава: 100 mМ Трис-HCl (рН8,0), 2М NaCl, 25 mM ЭДТА, 2% ЦТАБ, 2% ПВП, 2% 2-меркаптоэтанол. Полученный лизат инкубируют 5 минут при температуре 65°С периодически перемешивая. По истечении времени инкубации раствор дважды обрабатывают смесью хлороформ/изоамиловый спирт (24/1) с последующим центрифугированием 10 мин при 18000 g и верхнюю фазу, содержащую фракцию нуклеиновых кислот переносят в новые пробирки. Для отделения молекул РНК от ДНК, к раствору добавляют 0,25 объема 10 М LiCl и инкубируют при +4°С в течении 16 часов. Смесь центрифугируют 15 мин при 18000 д. Для очистки от избытка соли осадок РНК растворяют в 0,1 мл стерильной бидистиллированной воды и осаждают добавлением 2,5 объема охлажденного 96% этанола с последующим центрифугированием 15 мин при 18000 д. Осадок РНК промывают последовательно 70%-ным раствором этанола и подсушивают на воздухе. РНК растворяют в 0,02 мл стерильной бидистиллированной воде. Количество РНК определяют спектрофотометрическим методом по величине оптической плотности раствора при 260 нм. Качество РНК оценивают по соотношению оптической плотности при 260 нм, с поглощением раствора при 230 и 280 нм. На втором этапе 2 мкг полученной РНК используют для синтеза кДНК. Реакцию обратной транскрипции проводят при помощи набора реактивов Mint (Евроген, Москва) согласно протоколу фирмы-производителя. На третьем этапе проводят полимеразную цепную реакцию с использованием кДНК амаранта в качестве матрицы для получения гена AhA1 и праймеров AhA1-pSAT-NcoI-dir и AhA1-pSAT-XbaI-rev, где AhA1-pSAT-NcoI-dir - праймер, специфичный по отношению к N-концевой последовательности AhAl, включающий сайт для рестриктазы NcoI; AhA1-pSAT-XbaI-rev - обратный праймер, специфичный по отношению к С-концевой последовательности AhA1, включающий сайт рестрикции XbaI:
AhA1-pSAT-NcoI-dir: 5'-TATAAGATCTCCATGGCGGGATTACCAGTGAT-3' AhA1-pSAT-XbaI-rev: 5'-ACTCTAGACCTAGTTGTTGGATCCCAATTCTA-3'
Данную реакцию проводят в следующих условиях: 10х Encycio буфер, 50х смесь полимераз Encycio («Encyclo PCR kit», Евроген, Москва), 50х смесь dNTP (10 mM каждого), смесь праймеров (5 μМ каждого), 20 нг ДНК. Процесс амплификации состоит из следующих стадий: 30 циклов ПЦР (15 с - 95°С, 15 с - 55°С, 1 мин - 72°С) и инкубация 10 мин при 72°С. После амплификации ПЦР-продукт очищают электрофоретически в 1% агарозном геле. Фрагмент (1 мкг) обрабатывают рестриктазами NcoI и XbaI в оптимальном буфере (Fermentas) в течение 24 ч, затем ферменты удаляют из реакционной среды по стандартной методике фенолом (1:1) [Sambrook J. et. al. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989]. В водную фракцию, содержащую фрагмент, добавляют 1/10 объема 0,3 М ацетата Na, рН 5,2 и 1/2 объема изопропилового спирта и оставляют на -20°С в течение 30 мин. Затем центрифугируют при 18000 g в течение 2 0 мин, осадок промывают 70% этанолом и высушивают при комнатной температуре. Осадок растворяют в 20 мкл деионизованной воды. Для сравнения нуклеотидной последовательности полученного фрагмента с последовательностью целевого гена его секвенируют с использованием смеси флуоресцентно-меченных терминаторов BigDye™ Terminator v3.1 Cycle Sequencing Kit по методике производителя (Applied Biosystems).
2 мкг плазмидной ДНК pSAT1-MCS обрабатывают рестриктазами NcoI и XbaI в соответствии с методикой, описанной выше, и из полученного гидролизата выделяют векторную часть плазмиды в 1% геле легкоплавкой агарозы.
Полученный фрагмент гена AhA1 и векторную часть плазмиды pSATl-MCS сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования согласно инструкции (Fermentas). 10 мкл реакционной смеси используют для трансформации компетентных клеток Е. coli Rosetta (DE3). Трансформанты высевают на LB-агар, содержащий 50 мкг/мл ампициллина. После инкубирования в течение 16 ч при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют на наличие мутаций при помощи автоматического секвенирования. Отбирают плазмидную ДНК pSAT1-AhA1, содержащую последовательность AhA1.
Пример 2. Получение рекомбинантного штамма М. thermophila/pSAT1-AhA1 - продуцента запасного белка А1 семян Amaranthus hypochondriacus L.
Рекомбинантный штамм-продуцент М. thermophila/pSAT1-AhA1 получают путем электропорации клеток штамма М. thermophila F-859 рекомбинантной плазмидой pSAT1-AhA1.
Конидии М. thermophila собирают с поверхности мицелия 15-дневной культуры гриба М. thermophila F-859, выращенного на обедненной агаризованной среде Вогеля с добавлением 2% сахарозы, путем их суспендирования стерильной водой с 2-% Твином-80. Далее конидии переводят в буфер, содержащий 1 мМ HEPES, рН 7,0, 50 мМ маннитол, 0,01% Твин-20, и доводят до концентрации 106/мл с использованием камеры Горяева. Далее суспензию конидий смешивают с 10 мкг плазмидной ДНК в объеме 250 мкл и помещают в ячейку для электропорации с зазором 0,2 см (Bio-Rad). Процедуру электропорации проводят в кюветном электропораторе Gene Pulser Xcell (BioRad) вследующем режиме: два импульса по 1 мс каждый при 1,70 кВ с интервалом 5 с.
Для определения эффективности трансформации и наличия вставки гена запасного белка амаранта А1 конидии штамма М. thermophila F-859 после электропорации высевают на агаризованную среду Вогеля, инкубируют в течение 5 дней при 45°С. Далее отбирают отдельно стоящие колонии в качестве матрицы для проведения ПЦР с парами специфических праймеров для плазмиды pSAT:
UTR-D:5'-TCACCATTTACGAACGATAG-3'
Term-R: 5'-GATTTGTAGAGAGAGACTG-3'
и гена белка A1 семян амаранта:
AhA1-pSAT-NcoI-dir: 5'-TATAAGATCTCCATGGCGGGATTACCAGTGAT-3'
AhA1-pSAT-XbaI-rev: 5'-ACTCTAGACCTAGTTGTTGGATCCCAATTCTA-3'
Для определения продуктивности штамма по рекомбинантному белку экстракты грибной биомассы в буфере с 8 М мочевиной анализируют электрофорезом в 12,5% ПААГ. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в клеточной фракции составляет не менее 30% от всех белков этой фракции.
Пример 3. Выделение и характеристика рекомбинантного белка
AhAl.
Штамм-продуцент рекомбинантного белка А1 семян амаранта - М. thermophila/pSAT1-AhA1, инкубируют в трехлитровой колбе в жидкой среде, содержащей на 1 л культуры 200 г картофельного отвара, 20 г сахарозы, рН 5,1, в течение 7 суток при 45°С при перемешивании 2 раза в день. Грибную биомассу отделяют от культуральной среды центрифугированием и промывают физраствором на фильтровальной бумаге. Суспензию дезинтегрируют жидким азотом, экстрагируют в буфере с 8 М мочевины и центрифугируют при 14000 об/мин в течение 20 мин. Надосадочную жидкость собирают и помещают помещают на колонку с Ni-сефарозой (GE Healthcare). Элюцию белка проводят 0,5-М имидазолом в том же буфере и анализируют методом Бредфорд и электрофорезом в ПААГ. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в штамме М. thermophila/pSAT1-AhA1 составляет не менее 30% от всех белков клеточной фракции.
Выход рекомбинантного белка составляет 8 9±7 мг из 1 л культуры.
Идентификацию полученного рекомбинантного полипептида проводят по первым 10 аминокислотам на автоматическом секвенаторе. Секвенирование препарата рекомбинантного белка, выделенного из клеток штамма М. thermophila/pSAT1-AhA1, показало, что N-концевая последовательность рекомбинантного белка соответствует первым 10 аминокислотам MAGLPVIMCL белка А1 из семян амаранта Amaranthus hypochondriacus.
Заявленное изобретение позволяет:
- с помощью использования рекомбинантного штамма-продуцента М. thermophila/pSAT1-AhA1 получать путем биосинтеза большое количество запасного белка А1 семян Amaranthus hypochondriacus L., что может быть использовано в животноводстве для разработки способов получения кормов из растительных субстратов и обогащения кормов сбалансированным по аминокислотному составу белком.