Результат интеллектуальной деятельности: ШТАММ STREPTOMYCES HYGROSCOPICUS BKM AC-2737D - ПРОДУЦЕНТ АНТИБИОТИКА РАПАМИЦИНА И СПОСОБ УВЕЛИЧЕНИЯ ЕГО ПРОДУКТИВНОСТИ
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и фармацевтической промышленности и касается способа получения биологически активного соединения - рапамицина для использования в качестве иммуносупрессора.
Рапамицин, также известный как Сиролимус, является продуктом метаболизма актиномицета Streptomyces hygroscopicus и представляет собой азотсодержащий макролид с эмпирической формулой C51H79NO13, имеющий в своем составе 31-членное лактонное кольцо (рис. 1).
Рапамицин был впервые выделен в 1972 году и показана его антифунгицидная активность в отношении патогенных дрожжей Candida albicans и некоторых дерматофитов {Microsporum gypseum и Trichophyton granulosum) (Vezina G., Kudelski A., Sehgal S.N., 1975. Rapamycin (AY-22, 989), Journal of Antibiotics 10(XXVIII), 721-726), US 3929992 (Surendra Sehgal 1975). Дальнейшее изучение препарата позволило установить, что он является мощным иммуносупрессором и с 2001 года его стали применять в трансплантологии для предотвращения отторжения трансплантатов. Рапамицин успешно применяют в ангиопластике в качестве лекарственного покрытия стентов для предотвращения рестеноза коронарных артерий. (Marks S.O. and Marks A.R., 2001, 104: 852-855). Также он используется для лечения системной красной волчанки, аутоиммунных кишечных [US 5286731] и кожных заболеваний, таких как псориаз [US 5286730].
Помимо вышеописанных способов применения, рапамицин используют в качестве антипролиферанивного агента, а также в биологических исследованиях в качестве агента для химически индуцированной димеризации.
Производится рапамицин фирмами Pfizer (Пфайзер) США и ее филиалами, а также индийской фирмой Biocon Ltd. В России рапамицин не производится.
Несмотря на широкий спектр возможностей применения рапамицина в медицине, его использование в значительной мере ограничивается тем, что существующие природные штаммы-продуценты не отличаются высокой продуктивностью, что увеличивает себестоимость субстанции и снижает возможные объемы ее промышленного производства.
В первых работах по биосинтезу рапамицина с использованием актиномицета S. hygroscopicus, продуктивность штаммов не превышала 110-130 мг/л (Lee M.S., Kojima I., Demain A.L. Microbiology and Biotechnology. 1995. V. 43, P. 1096-1098).
Продуктивность существующих в настоящее время промышленных штаммов остается в основном в пределах 700-900 мг/л [Zhu et al. (2010), Zou and Li (2013)]. Таким образом, проблема разработки высокопродуктивных штаммов и технологий биосинтеза рапамицина остается актуальной.
В существующих публикациях, касающихся способов получения высокопродуктивных штаммов, описаны различные методы, такие как слияние протопластов близкородственных штаммов, классический мутагенез с последующей селекцией, селекция с использованием антибиотиков в качестве селективного агента, оптимизация питательных сред и их совместные комбинации.
Наиболее близким к заявляемому изобретению является способ получения рапамицина описанный в патенте US 2015/0079642 А1. Штамм - МТСС 5681, продуцент рапамицина, получен в результате совместного применения физического (УФ-облучение) и химического (NTG) мутагенов. Продуцирующая способность данного штамма при глубинном культивировании составляет 900 мг/л рапамицина.
Однако, для обеспечения достаточного объема производства рапамицина этой продуктивности недостаточно. Необходимы не только эффективные технологии его промышленного производства, выделения и очистки, но и высокопродуктивные штаммы-продуценты.
Задачей данного изобретения было получение нового высокопродуктивного штамма продуцента рапамицина, способного обеспечить необходимые объемы его промышленного производства, а также дальнейшее повышение его продуктивности за счет оптимизации состава питательной среды и условий культивирования.
Задача была решена в три этапа:
1. Применением метода ненаправленного индуцированного многоступенчатого УФ-мутагенеза и последующей селекции исходного штамма S. hygroscopicus АТСС 29253 с продуктивностью (43±5) мг/л был получен штамм S. hygroscopicus (R 33-41) с продуктивностью (655±5) мг/л рапамицина, что более чем в 15 раз превышает продуцирующую способность исходного штамма S. hygroscopicus АТСС 29253. Штамм S.hygroscopicus (R 33-41) депонирован Всероссийской коллекцией микроорганизмов ИБФМ им. Г.К.Скрябина 30.05.2016 с регистрационным номером ВКМ Ac-2737D.
2. Оптимизацией состава питательной среды, в том числе подбором альтернативных источников углерода, органического и минерального азота, а также макроэлементов и их соотношений, максимально стимулирующих биосинтез рапамицина обеспечено дополнительное значительное (в 1.89 раза) повышение продуктивности штамма S. hygroscopicus ВКМ Ac-2737D при глубинном культивировании в колбах до (1215±5) мг/л рапамицина.
3. Усовершенствованием условий культивирования штамма S. hygroscopicus ВКМ Ac-2737D с применением оптимизированной ферментационной среды в опытно-промышленных условиях удалось повысить продуктивность штамма с (1215±5) мг/л до 1275±10 мг/л рапамицина.
На первом этапе был получен новый штамм - продуцент рапамицина S. hygroscopicus ВКМ Ac-2737D.
Штамм получен путем ненаправленного индуцированного многоступенчатого УФ-мутагенеза и последующей селекции с применением мутагенных факторов, и направленных методов отбора изолятов исходного штамма S. hygroscopicus АТСС 29253. В качестве мутагенного фактора были использованы УФ - лучи с длиной волны 250-280 нм (лампа Mineralight, мощность 12,5 Вт). Облучение проводили в водной суспензии спор на расстояние 40 см от лампы, при этом интенсивность излучения лампы составляла 0,25 мВт/см2.
Далее суспензию переносили на поверхность агаризованной среды и равномерно распределяли по поверхности. Культивирование на твердой агаризованной среде проводили в течение 12-14 суток при температуре 29°С. По окончанию культивирования из выросших на агаризованной среде колоний отбирали от 20 до 50 морфологически измененных колоний и повторно пересевали на агаризованную среду, а затем культивировали в колбах с использованием ферментационной среды и определяли их продуктивность хроматографическим методом (ВЭЖХ). Изоляты, обладающие максимальной продуктивностью, использовали в следующем цикле УФ-мутагенеза и отбора.
Продуктивность полученного таким образом нового штамма S. hygroscopicus (R 33-41) определялась методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Полученный новый штамм S. hygroscopicus (33-41) депонирован во Всероссийской коллекции микроорганизмов под номером ВКМ Ac-2737D.
Штамм S. hygroscopicus ВКМ Ac-2737D обладает повышенной продуктивностью рапамицина в колбах (655±5) мг/л.
Культурально-морфологические признаки штамма ВКМ Ac-2737D.
Морфологические признаки. Размер 3-4 мм; форма округлая со светлым валиком по краю; воздушный мицелий белого цвета; споры светло-серые; профиль колонии выпуклый, вросший в агар; структура однородная.
Физиолого-биохимические свойства. Аэроб. Растет при (24-37)°С, оптимум роста 29°С и в диапазоне значений рН (5,0-10,0) с оптимумом роста при рН 6,8. Глюкозу инвертирует. Крахмал гидролизует. На клетчатке не растет.
Использование источников углерода. В отличие от исходного штамма, хорошо утилизирует в высоких концентрациях такие источники углерода как, глюкозу и глицерин.
Антагонистические свойства Штамм S. hygroscopicus (R 33-41) ВКМ Ас-2737D при росте на агаровых средах умеренно угнетает рост патогенных дрожжей Candida albicans и некоторых дерматофитов (Microsporum gypseum и Trichophyton granulosum).
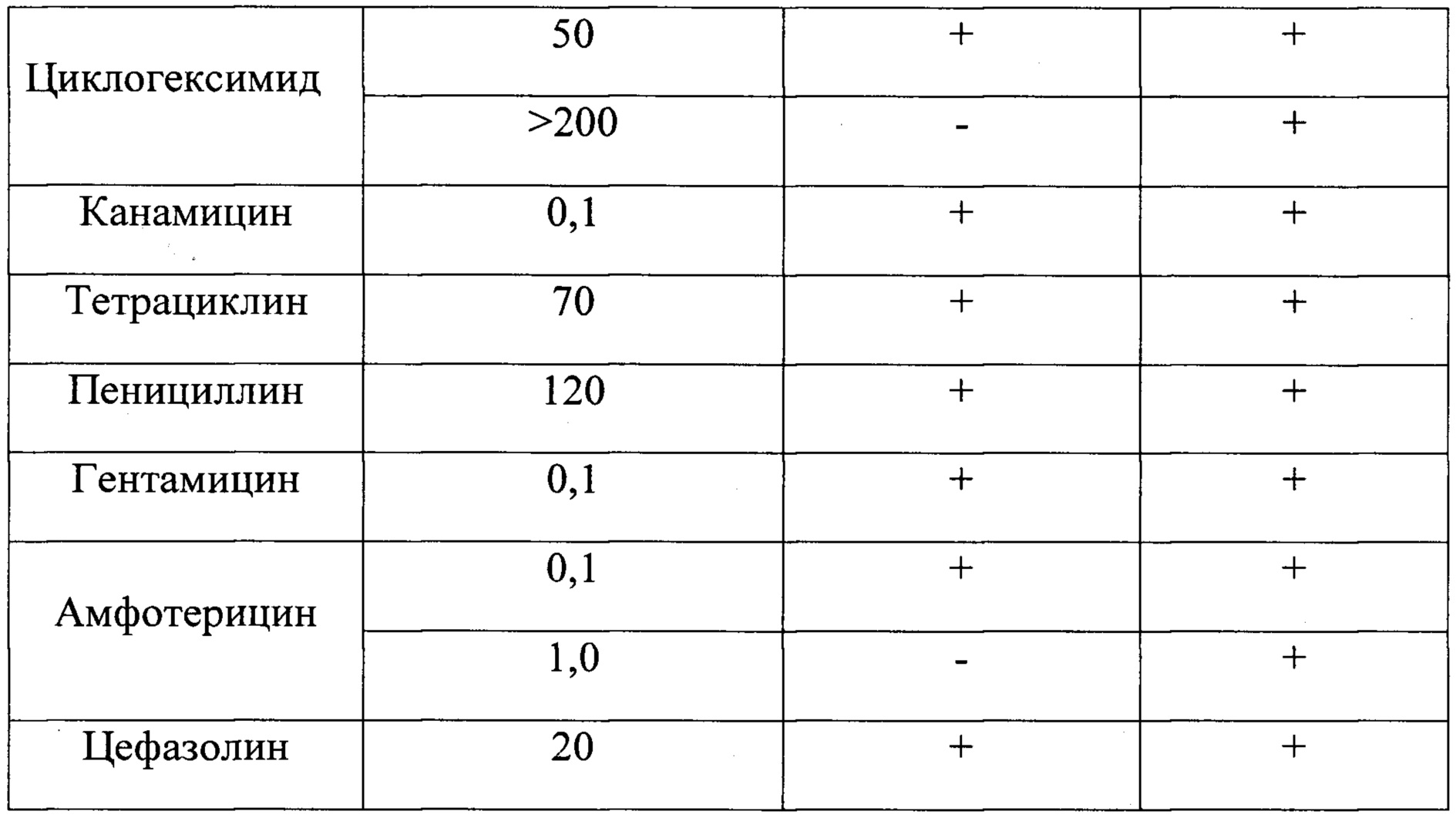
Отношение к антибиотикам В отличие от исходного штамма S. hygroscopicus АТСС 29253, штамм ВКМ Ac-2737D устойчив к повышенным концентрациям собственного антибиотика (МИК>1000 мкг/мл), к циклогексимиду (МИК>200 мг/мл) и амфотерицину (МИК 1.0 мкг/мл). По отношению к другим видам антибиотиков чувствительность штаммов оказалась одинаковой.
ПИТАТЕЛЬНЫЕ СРЕДЫ
Агаризованная питательная среда
Для поддержания, хранения и приготовления посевного материала культуры используется агаризованная среда состава (г/л): агар-агар - 20.0, соевая мука - 1.0, растворимый крахмал - 10.0, сульфат магния - 1.0, калий фосфорнокислый двузамещенный - 0.5, дистиллированная вода - до 1 л. рН - 6.8±0.1.
Вегетативная питательная среда
Приготовление посевного материала осуществляется на вегетативной среде следующего состава: соевая мука (г/л): соевая мука -21.0, L-лизин-6.0, дрожжевой экстракт - 6.0, глюкоза - 20.0, дистиллированная вода - до 1 л. рН 6.6±0.1.
Ферментационная питательная среда
В качестве исходной ферментационной среды использовали питательную среду следующего состава (г/л): хлопковая мука - 21.0, L-лизин - 15.0, NaCl - 5.0, глицерин - 10.0, глюкоза - 80.0, вода дистиллированная до 1 л. рН 6.8±0.1.
Хранение культуры
Штамм S. hygroscopicus ВКМ Ac-2737D хранят на агаризованной среде состава (г/л): агар-агар - 20.0, соевая мука - 1.0, растворимый крахмал - 10.0, сульфат магния - 1.0, калий фосфорнокислый двузамещенный - 0.5, дистиллированная вода - до 1, рН - 6.8±0.1 не более трех месяцев при температуре около 5°С в холодильной камере. Для длительного хранения культуру лиофилизируют или хранят в жидком глицерине при -70°С.
Поддержание культуры
Культуру продуцента рапамицина поддерживают на агаризованной среде состава (г/л): агар-агар - 20.0, соевая мука - 1.0, растворимый крахмал - 10.0, сульфат магния - 1.0, калий фосфорнокислый двузамещенный - 0.5, дистиллированная вода - до 1. рН- -6.8±0.1. Для поддержания уровня продуктивности культуры, перед каждым пересевом ее на свежие питательные среды, проводят моноспоровый рассев на чашки Петри.
Выращивание культуры продуцента в чашках Петри проводят в течение 10-12 суток при температуре 29°С.
Таким образом, создан новый штамм S. hygroscopicus ВКМ Ac-2737D, отличающийся от известного по характеру роста на диагностических агаровых средах, по степени усвоения источников углерода (глюкоза, глицерин), по отношению к антибиотикам и по продуктивности, которая во много раз превосходит продуктивность исходного штамма S. hygroscopicus АТСС 29253. Продуктивность нового штамма S. hygroscopicus ВКМ Ас-2737D, определенная методом ВЭЖХ составляет (655±5) мг/мл, что значительно превосходит продуктивность известных штаммов продуцентов рапамицина.
2. Следующим этапом работы было дальнейшее повышение продуктивности штамма S. hygroscopicus ВКМ Ac-2737D. путем оптимизации состава питательной среды.
Получение штаммов с высоким уровнем биосинтеза антибиотических веществ зачастую сопровождается изменением требований не только к условиям культивирования, но и к составу питательных веществ и соотношению концентраций тех или иных компонентов индивидуально для каждого штамма.
Для того чтобы выяснить какие компоненты питательной среды и в каком количестве способствуют повышению продуктивности, был проведен ряд экспериментов по подбору оптимального состава жидкой питательной среды. Результаты оценивали по изменению продуцирующей способности штамма S. hygroscopicus ВКМ Ac-2737D. Исследуемые компоненты добавляли в среду перед стерилизацией.
Так было проверено:
1. Влияние различных источников углерода на рост культуры S. hygroscopicus и уровень биосинтеза рапамицина
Установлено, что положительное влияние на биосинтез рапамицина оказывают глюкоза и глицерин. Было оценено влияние различных концентраций, дополнительно добавляемых в среду глюкозы или глицерина на биосинтез целевого соединения штаммом S. hygroscopicus ВКМ Ac-2737D. Максимальная продуктивность штамма S. hygroscopicus ВКМ Ac-2737D была достигнута при дополнительном внесении глюкозы в количестве 20 г/л (общее содержание глюкозы в питательной среде составило 100 г/л) и составила 741±4 мг/л. Дальнейшее увеличение концентрации глюкозы в питательной среде ингибировало биосинтез целевого вещества. Дополнительное внесение в среду глицерина не привело к существенному повышению продуктивности штамма.
2. Влияние альтернативного источника органического азота
Хлопковая мука, входящая в состав исходной питательной среды, отличается высоким содержанием белка (45-50%), однако относится к дорогостоящим компонентам, в связи с чем, ее использование в процессе биосинтеза рапамицина экономически нецелесообразно.
Влияние источников органического азота на продуктивность штамма S. hygroscopicus ВКМ Ac-2737D. оценивали относительно исходного компонента (хлопковой муки). Исследуемый диапазон концентраций составлял 20-40 г/л для различных видов муки и 1-15 г/л для пептонов и экстрактов. (Табл. 1)
Максимально положительный эффект на биосинтез рапамицина был выявлен в случае совместного использования соевой муки (30 г/л), соевого пептона (5 г/л) и дрожжевого экстракта (5 г/л). Максимальная концентрация рапамицина в культуральной жидкости на данном этапе оптимизации составила (792±5) мг/л.

* концентрация компонента, оказывающая максимально положительный эффект на биосинтез целевого вещества.
3. Влияние источников неорганического азота
Было изучено влияние неорганических источников азота на продуцирующую способность штамма S. hygroscopicus ВКМ Ac-2737D. В качестве контрольной питательной среды использовали среду следующего состава (г/л): соевая мука (полножировая) - 30, соевый пептон - 10, дрожжевой экстракт - 5, L-лизин - 15, NaCl - 5, глицерин - 20, глюкоза - 100, дистиллированная вода - до 1 л. Для получения сред №1-15 к контрольной среде добавляли неорганические источники азота в концентрациях, указанных в Табл. 2.
Штамм S. hygroscopicus ВКМ Ac-2737D оказался не способен утилизировать мочевину (CH4N2O) и нитраты (KNO3), но хорошо усваивал азот в виде солей аммония ((NH4)2SO4, NH4Cl, C6H8O7⋅2NH3). При этом максимальное содержание рапамицина (835±6 мг/л) наблюдали при использовании сульфата аммония в концентрации 1 г/л.

4. Влияние макроэлементов
Авторы установили, что в период интенсивного роста (первые 48 ч) падение уровня рН ниже значения 5.5 негативно сказывается на накоплении биомассы и оказывает ингибирующее воздействие на биосинтез рапамицина.
В связи с этим было изучено влияние дополнительных количеств макроэлементов (фосфора, магния, калия, кальция) на поддержание рН среды и на биосинтез рапамицина в процессе культивирования. (Табл. 3)
В качестве контрольной питательной среды использовали среду следующего состава г/л: соевая мука (полножировая) - 30.0, соевый пептон -10.0, дрожжевой экстракт - 5.0, L-лизин - 15.0, NaCl - 5.0, (NH4)2SO4 - 1.0, глицерин - 20.0, глюкоза - 100.0, дистиллированная вода - до 1 л.
Максимальная концентрация рапамицина в культуральной жидкости была отмечена при добавлении к исходной питательной среде Na2HPO4 (5 г/л) и MgSO4 (1 г/л). При совместном внесении данных компонентов питательную среду содержание рапамицина к концу периода культивирования достигало 937±3 мг/л.


Проведенная оптимизация питательной среды для штамма S. hygroscopicus ВКМ Ac-2737D позволила получить данные необходимые для разработки ферментационной среды следующего состава (г/л): соевая мука -36.2±0.2, лизин - 20.4±0.4, дрожжевой экстракт - 5.0±0.05, соевый пептон - 5.0±0.05, глюкоза - 85.2±0.2, хлорид натрия - 5.0±0.05, сульфат магния - 1.0±0.05, сульфат аммония - 1.0±0.05, натрий фосфорнокислый 2-замещенный -5.0±0.05, вода дистиллированная до 1 л (рН 6.8-6.9).
Заявляемые соотношения компонентов в этой ферментационной среде, найденные экспериментальным путем, являются оптимальными и позволяют при их использовании достичь к концу периода культивирования штамма S. hygroscopicus ВКМ Ac-2737D содержания рапамицина (1215±5) мг/л.
3. Следующим этапом работы по повышению продуктивности штамма S. hygroscopicus ВКМ Ac-2737D является оптимизация условий его культивирования. Основными параметрами условий культивирования штаммов являются температура процесса, рН среды, концентрация растворенного кислорода. Авторы проверили влияние данных параметров на биосинтез рапамицина с целью подбора оптимальных значений
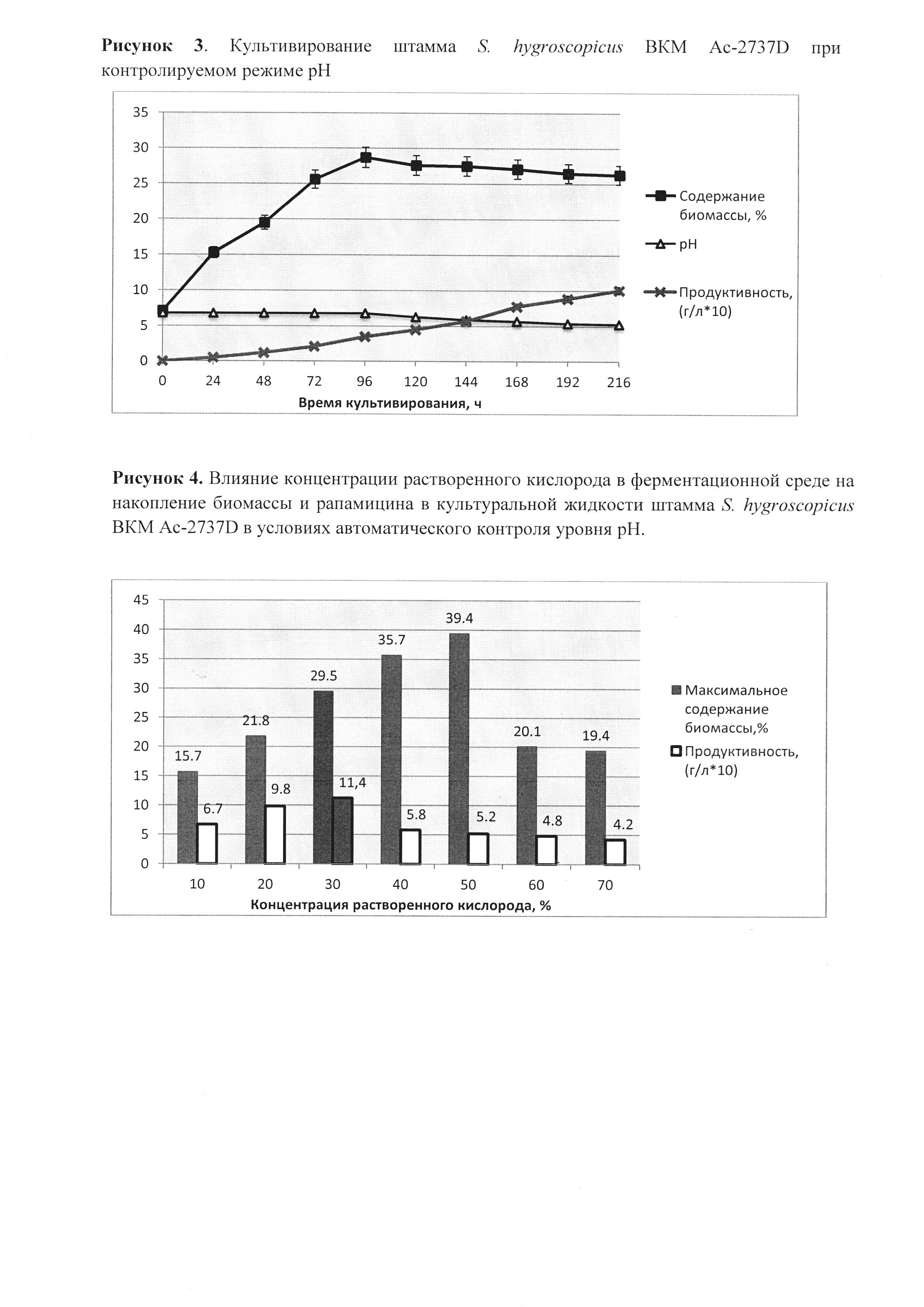
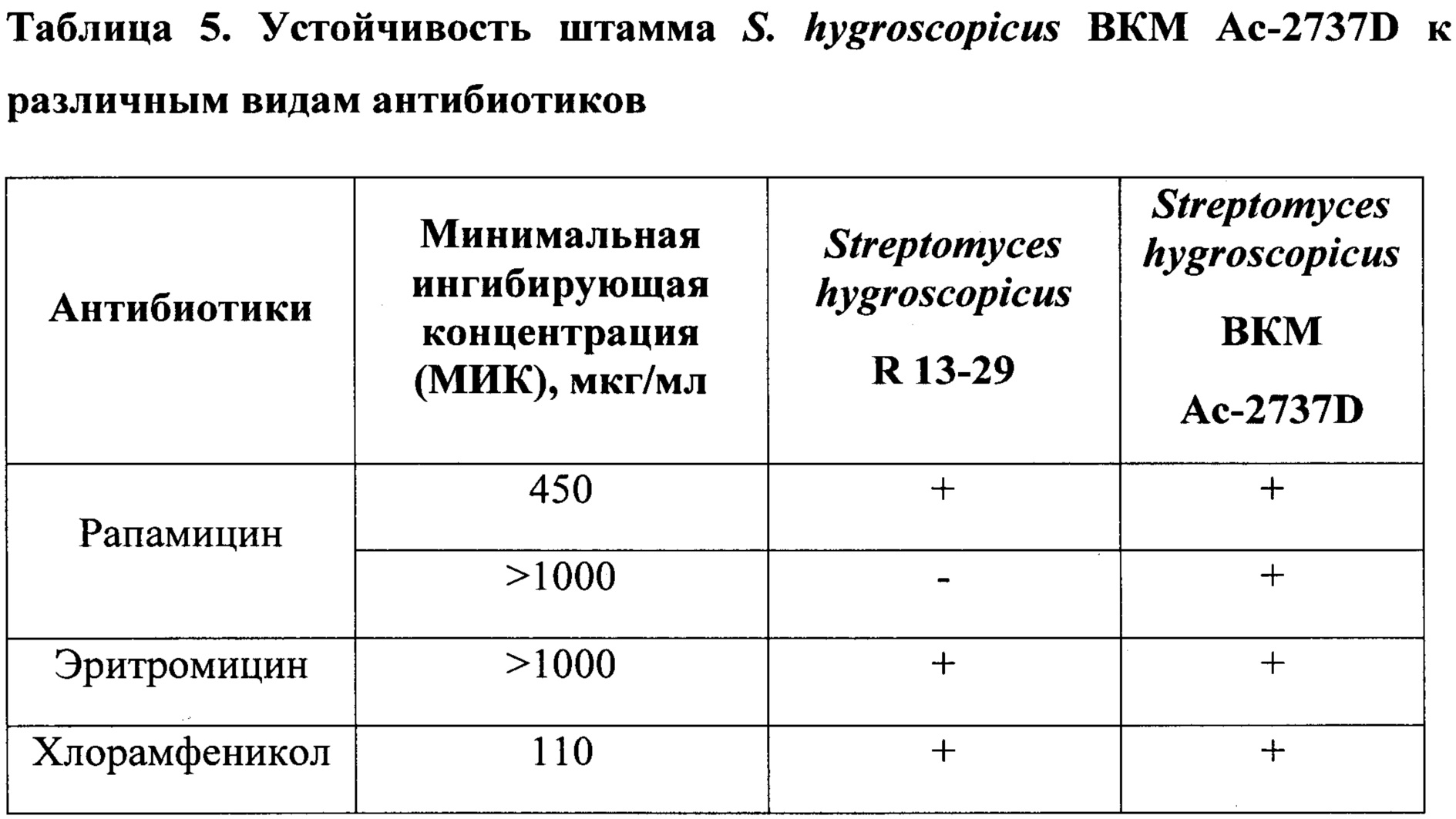
А. Для проверки влиянии рН на биосинтез целевого продукта и определения его оптимальных значений проведен ряд ферментаций при различных рН среды. Поддержание заданных уровней рН производили в автоматическом режиме. Наилучшие показатели ферментации были достигнуты при уровне рН равном 6.8-7.0 (рис. 2, 3).
Б. Одним из важных факторов, влияющих на продуктивность биосинтеза микроорганизмами биологически активных веществ, в том числе и рапамицина, является содержание растворенного кислорода в ферментационной среде. В связи с этим были проведены эксперименты по оценке влияния различных концентраций растворенного кислорода на рост биомассы и продуктивности штамма S. hygroscopicus ВКМ Ac-2737D в условиях автоматического контроля значения рН на уровне 6.8-7.0. Содержание растворенного кислорода в среде изменяли путем изменения оборотов перемешивающего устройства и изменения количества расходуемого в процессе ферментации воздуха. Наибольшая продуктивность по рапамицину и максимальный прирост биомассы были отмечены при концентрации растворенного кислорода 30% (рис. 4).
В. Изменения метаболизма мутантных штаммов, связанные с повышением их продуктивности, как правило, оказывают влияние на интенсивность потребления источников питательных веществ и возможность их усвоения. Так, высокопродуктивные штаммы обычно отличаются более интенсивным ростом, в связи, с чем нуждаются в более высокой концентрации питательных элементов (в первую очередь, углеводов) в среде.
К наиболее доступным для микроорганизмов источникам углерода в первую очередь следует отнести моно и дисахара. Авторами было показано, что оптимальным дополнительным источником углерода является глюкоза.
Непрерывную подачу 50% стерильного раствора глюкозы в ферментер осуществляли в автоматическом режиме при рН 6.8, начиная с 72 ч ферментации, в условиях поддержания рН и концентрации растворенного кислорода на ранее определенных оптимальных уровнях (6.8-7.0 и 30%, соответственно).
Добавление в ферментационную среду 50% раствора глюкозы в процессе ферментации обеспечило дополнительную стабилизацию рН среды культивирования за счет образования органических кислот в процессе метаболизма культуры и увеличило содержание сырой биомассы, тем самым позволив увеличить время активного синтеза рапамицина. Это положительно сказалось на накоплении рапамицина в культуральной жидкости, достигшем к 216 ч роста 1275±5 мг/л. Потребление глюкозы культурой в среднем, составило 10 г/л/сутки.
Таким образом, поддержание активной кислотности среды в процессе ферментации на оптимальном уровне (6.8-7.0), концентрации растворенного кислорода на уровне 30%, использование дополнительных количеств глюкозы в процессе ферментации в концентрации Юг/л в сутки позволило увеличить содержание рапамицина в культуральной жидкости с (1215±5) до (1275±5) мг/л.
Авторами проведено успешное масштабирование процесса биосинтеза и тем самым продемонстрирована возможность проведения процесса биосинтеза рапамицина с использованием штамма S. hygroscopicus ВКМ Ас-2737D в промышленном масштабе.
Технический результат предлагаемого изобретения состоит в получении высокопродуктивного штамма способного в специально разработанных для него условиях синтезировать рапамицин в промышленных масштабах с высоким выходом, составляющим 1275±5 мг/л.
Изобретение иллюстрируется, но не ограничивается следующими примерами:
Пример 1
Получение нового высокопродуктивного штамма культуры S. hygroscopicus
Мутагенез.
В качестве исходного штамма в работе использовали штамм Streptomyces hygroscopicus АТСС 29253.
В качестве мутагенного фактора были использованы УФ-лучи с длиной волны, 250-280 нм (лампа Mineralight, мощность 12.5 Вт).
Суспензию, полученную путем смыва с поверхности агаризованной среды и содержащую споры и обрывки мицелия, фильтровали через стерильный ватный фильтр или через фильтровальную воронку Шотта (размер пор 100 мкм). В полученной суспензии при помощи камеры Горяева-Тома подсчитывали концентрацию спор; при необходимости суспензию разводили до конечной концентрации (1.5-2)*106 спор/мл. После подсчета и разведения суспензию подвергали облучению в открытой чашке Петри на расстоянии 40 см от лампы. Время экспозиции варьировало от 20 до 25 минут. Далее облученную суспензию в объеме 100-200 мкл переносили на твердую агаризованную среду и равномерно распределяли по ее поверхности. Культивирование проводили в течение 10-12 суток при температуре 29°С, после чего из развившихся колоний отбирали 20-50 морфологически измененных колоний.
Степень выживаемости колоний определяли по соотношению выросших колоний в необлученном контроле и после УФ-облучения. Эффективность мутагенеза определяли по количеству возникающих морфологически измененных колоний. Выросшие изолированные колонии повторно пересевали на агаризованную среду, затем культивировали в колбах с использованием питательной среды (ферментационной). Для предварительной оценки продуктивности отобранных изолятов использовали метод тонкослойной хроматографии. Изоляты, обладающие максимальной продуктивностью, пересевали и повторно подвергали УФ-облучению. Для определения содержания рапамицина в культуральной жидкости использовали метод высокоэффективной жидкостной хроматографии. Продуктивность нового штамма S. hygroscopicus ВКМ Ac-2737D, определенная методом ВЭЖХ составляла (655±5) мг/мл.
Пример 2
Идентификация исходного и полученного штаммов
Для генетической идентификации исходного АТСС 29253 и полученного ВКМ Ac-2737D штаммов S. hygroscopicus было проведено секвенирование штаммов и определена частичная последовательность амплификата гена (1472 bp), кодирующего 16S рРНК. Нуклеотидные последовательности ПЦР-фрагментов для обоих образцов оказались идентичными между собой. Анализ полученной последовательности был проведен путем сравнения с аналогичными последовательностями, помещенными в базу данных GenBank (Табл. 4). Филогенетически наиболее близкими к исследованным образцам среди описанных образцов оказались штаммы S. hygroscopicus АТСС 14891 и S. sp. 219847. Уровень сходства последовательностей исследуемых образцов с указанными штаммами составил 99.3% и 98.0%, соответственно. Согласно современным стандартам, обнаруженный уровень сходства последовательностей 16S рРНК позволяет отнести изучаемый штамм к роду Streptomyces hygroscopicus.

Пример 3
Определение устойчивости к антибиотикам
Для определения чувствительности штамма ВКМ Ac-2737D к различным видам антибиотиков использовали метод серийных разведений в плотных средах. Для этого подготавливали тройные серийные разведения препаратов в различных концентрациях и по 1 мл каждого разведения вносили в пробирки, содержащие по 20 мл охлажденной до 45°С среды R1 и тщательно перемешивали. Содержимое пробирок переносили в чашки Петри и оставляли до полного застывания, после чего засевали исследуемыми штаммами S. hygroscopicus, производя сплошной посев петлей либо внося по 100-200 мкл предварительно подготовленной суспензии, и культивировали при 29°С в течение 10-12 суток. После инкубации определяли минимальную ингибирующую концентрацию (МИК) по отсутствию роста на чашках, содержащих наименьшую концентрацию препарата. Штамм ВКМ Ac-2737D устойчив к повышенным концентрациям собственного антибиотика (МИК>1000 мкг/мл), к циклогексимиду (МИК>200 мг/мл) и амфотерицину (МИК 1.0 мкг/мл) (Табл. 5).
Пример 4
Биосинтез рапамицина в биореакторе объемом 15 литров в режиме регистрации основных технологических и биохимических параметров.
Подготовка посевного материала.
Для приготовления посевного материала в чашках Петри используют агаризованную среду состава г/л: агар-агар - 20.0, соевая мука - 1.0, растворимый крахмал - 10.0, сульфат магния - 1.0, калий фосфорнокислый двузамещенный - 0.5, дистиллированная вода - до 1 л, рН - 6.8±0.1.
Проверенную агаризованную среду засевают мицелием исходной рабочей культуры, полученной моноспоровым рассевом, и выдерживают в термостате от 10 до 12 суток, при температуре 29°С.
Выращивание посевного материала 1 генерации.
Выращивание посевного материала в колбах проводят в одну стадию (маточные колбы) на вегетативной среде следующего состава, (г/л): соевая мука -21.0, L-лизин-6.0, дрожжевой экстракт - 6.0, глюкоза - 20.0, дистиллированная вода - до 1 л. рН 6.6±0.1. Культивирование осуществляют при 29°С в течение 48 часов на термостатируемой качал очной установке при 230-250 об/мин (эксцентриситет 5 см). При микроскопии наблюдается негустая базофильная сетка, протоплазма в гифах дифференцирована.
Биосинтез рапамицина.
Выросший посевной материал в объеме 1.0 л засевали в 15-л ферментационную установку. Ферментацию проводили на среде следующего состава (г/л): соевая мука - 36.2, лизин - 20.4, дрожжевой экстракт - 5.0, соевый пептон - 5.0, глюкоза - 85.2, хлорид натрия - 5.0, сульфат магния - 1.0, сульфат аммония - 1.0, натрий фосфорнокислый 2-замещенный - 5.0, вода дистиллированная до 1 л (рН 6.8-6.9).
Общий объем среды в ферментере - 10 л. Выращивание штамма-продуцента в ферментере ведут при следующих условиях: температура (29±1)°С; аэрация 5 л/мин от 0 до 48 часов роста от 48 часов роста до конца ферментации - 10 л/мин; давление от 0,05 до 0,08 Мпа; обороты перемешивающего устройства 200-500 об/мин.
Начиная с 72 часов, ведут контроль содержания рапамицина методом ВЭЖХ. В качестве стандарта используют образец антибиотика с содержанием рапамицина 96% (SIGMA). Время ферментации - (216±24) часа. Параметры культуральной жидкости на момент окончания процесса биосинтеза: - посторонняя микрофлора - отсутствует; - микроскопическая картина - ветвящиеся гифы, собранные в плотные колонии; протоплазма в гифах дифференцирована; содержание рапамицина не менее 1220 мг/мл (ВЭЖХ).
Пример 5. Продуктивность штамма S. hygroscopicus ВКМ Ac-2737D на ферментационной среде с добавлением дополнительного источника углерода.
Биосинтез осуществляют аналогично примеру 4, а с 72 ч ферментации начинают непрерывную подачу 50% стерильного раствора глюкозы в биореактор в автоматическом режиме, в условиях поддержания рН и концентрации растворенного кислорода на ранее определенных оптимальных уровнях (6.8-7.0 и 30%, соответственно).
Параметры культуральной жидкости на момент окончания процесса биосинтеза: - посторонняя микрофлора - отсутствует; - микроскопическая картина - ветвящиеся короткие гифы, колонии округлой формы, протоплазма в гифах дифференцирована; - содержание рапамицина не менее 1270 мг/мл (ВЭЖХ).