Результат интеллектуальной деятельности: Адъювант для противовирусных вакцин
Вид РИД
Изобретение
Изобретение предназначено для использования в медицине и касается адъювантов противовирусных вакцин, в частности, против гепатита В и гриппа.
В состав большинства современных вакцин против гепатитов А и В, гриппа, вируса папилломы человека, полиомиелита, гемофильной палочки, пневмококка и др. в качестве адъюванта используют соединения алюминия.
Недостатком соединений алюминия является несовершенство механизмов адъювантной активности, а также недостатки в виде побочных эффектов, включая местные и системные реакции, риск развития болезни Альцгеймера и ряда других нейродегенеративных расстройств [Атауллаханов Р.И., Хаитов P.M. Адъюванты в составе вакцин. Сообщение 1. Микро- и наночастицы // Иммунология. 2011. №1. С. 37-45; Shaw С.А., Petrik M.S. Aluminum hydroxide injections lead to motor deficits and motor neuron degeneration // Journal of Inorganic Biochemistry. 2009. Vol. 103. P. 1555-1562; Shaw C.A., Tomljenovic L. Aluminum in the central nervous system (CNS): toxicity in humans and animals, vaccine adjuvants, and autoimmunity. Immunol Res. 2013. Vol. 56 (2-3). P. 304-316; Vera-Lastra O., Medina G., del Cruz-Dominguez M.P., Jara L.J., Shoenfeld Y. Autoimmune/inflammatory syndrome induced by adjuvants ( syndrome): clinical and immunological spectrum // Expert review of clinical immunology. 2013. Vol. 9 (4). P. 361-373].
syndrome): clinical and immunological spectrum // Expert review of clinical immunology. 2013. Vol. 9 (4). P. 361-373].
Известны адьюванты полисахаридной природы - хитозан и альгинат натрия [I.Z. Gendon, S.G. Markushin, I.M.  et al. Increasing the immunogenicity of inactivated chitosan adjuvanted vaccine from A/California/7/09 (H1N1) strain and analyzing the antigenic specificity of this influenza virus strain // Vopr. Virusol. 2012. Vol. 57 (1). P. 28-33; Chang H., Li X., Teng Y., Liang Y., Peng В., Fang F., Chen Z. Comparison of adjuvant efficacy of chitosan and aluminum hydroxide for intraperitoneally administered inactivated influenza H5N1 vaccine // DNA Cell. Biol. 2010. Vol. 29 (9). P. 563-568; Nourhan H. Abdel Allah, Nourtan F. Abdeltawab, Abeer A. Boseila, Magdy A.A. Chitosan and Sodium Alginate Combinations Are Alternative, Efficient, and Safe Natural Adjuvant Systems for Hepatitis В Vaccine in Mouse Model // Evidence-Based Complementary and Alternative Medicine. 2016. ID 7659684, 8 pages].
et al. Increasing the immunogenicity of inactivated chitosan adjuvanted vaccine from A/California/7/09 (H1N1) strain and analyzing the antigenic specificity of this influenza virus strain // Vopr. Virusol. 2012. Vol. 57 (1). P. 28-33; Chang H., Li X., Teng Y., Liang Y., Peng В., Fang F., Chen Z. Comparison of adjuvant efficacy of chitosan and aluminum hydroxide for intraperitoneally administered inactivated influenza H5N1 vaccine // DNA Cell. Biol. 2010. Vol. 29 (9). P. 563-568; Nourhan H. Abdel Allah, Nourtan F. Abdeltawab, Abeer A. Boseila, Magdy A.A. Chitosan and Sodium Alginate Combinations Are Alternative, Efficient, and Safe Natural Adjuvant Systems for Hepatitis В Vaccine in Mouse Model // Evidence-Based Complementary and Alternative Medicine. 2016. ID 7659684, 8 pages].
Указанные средства обеспечивают повышение иммуногенности вакцинных антигенов и снижение их дозы в составе вакцин против гепатита В и гриппа.
Известен адъювант высокополимерного глутамата хитозония [Патент №2465006, МПК А61К 39/00 «Способ повышения иммуногенности холодоадаптированной живой гриппозной вакцины», опубл. 27.10 2012].
Задача, на решение которой направлено настоящее изобретение, заключается в повышении иммуногенности вакцинных антигенов и снижении их дозы в составе вакцин, а также в расширении арсенала вакцинных адъювантов, обладающих высокой эффективностью и безопасностью.
Задача решается применением в качестве адъюванта фукоидана, выделенного из бурой водоросли Fucus evanescens.
Фукоидан из F. evanescens и способ его получения известны [Anastyuk S.D., Shevchenko N.M., Dmitrenok P.S., Zvyagintseva T.N. Structural similarities of fucoidans from brown algae Silvetia babingtonii and Fucus evanescens, determined by tandem MALDI-TOF mass spectrometry // Carbohydrate Research. 2012. Vol. 358. P. 78-81; Zvyagintseva T.N., Shevchenko N.M., Chizhov A.O. et al. Water-soluble polysaccharides of some far-eastern brown seaweeds. Distribution, structure, and their dependence on the developmental conditions // J. Exp. marine Biol. Ecol. 2003. Vol. 294, Issue 1. P. 1-13].
Фукоидан, полученный из бурой водоросли F. evanescens, представляет нативный фукоидан и имеет молекулярную массу в диапазоне 130-430 кДа [Anastyuk S.D., Shevchenko N.M., Dmitrenok P.S., Zvyagintseva T.N. Structural similarities of fucoidans from brown algae Silvetia babingtonii and Fucus evanescens, determined by tandem MALDI-TOF mass spectrometry // Carbohydrate Research. 2012. Vol. 358. P. 78-81] (таблица 1).
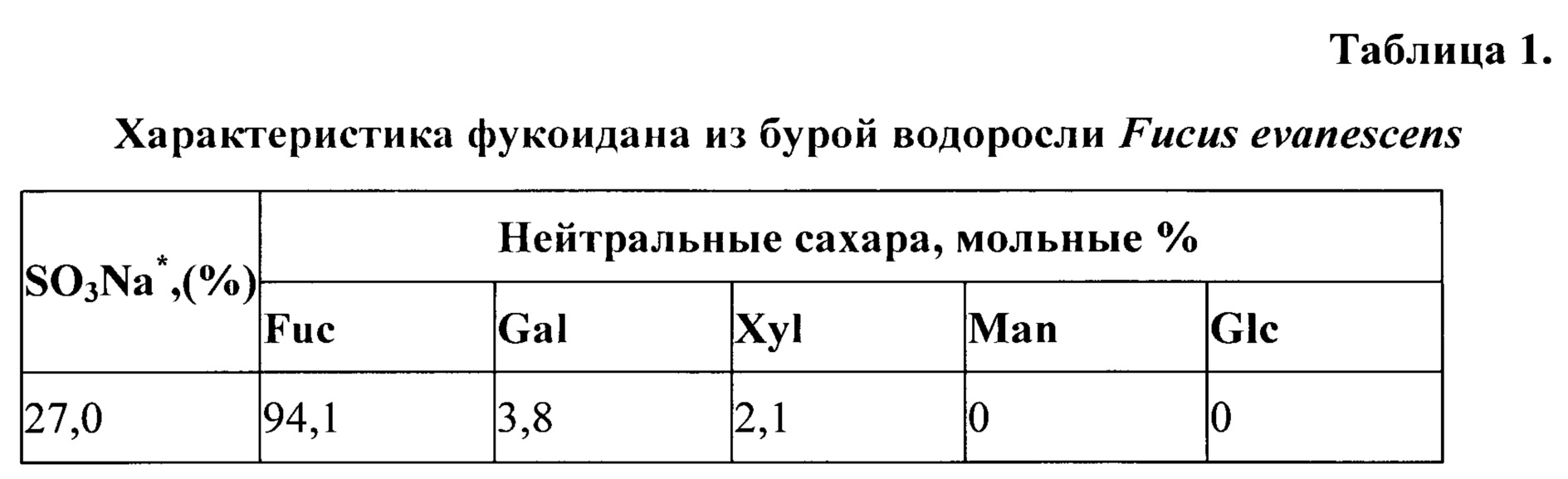
Примечание: * - % от массы.
Данный полисахарид обладает высокой биосовместимостью, низкой токсичностью и безопасностью для человеческого организма. Экспериментально и клинически доказаны различные фармакологические эффекты этого биополимера (иммуномодулирующий, противовоспалительный, противовирусный, противоопухолевый, гиполипидемический, гипогликемический, антиоксидантный и др.). Это определяет большие возможности для конструирования на его основе препаратов для биомедицинского применения [Roza V. Menshova, NataliaM. Shevchenko, TatianaI. Imbs, Tatiana N. Zvyagintseva, Olesya S. Malyarenko, Tatyana S. Zaporoshets, Natalia N. Besednova and Svetlana P. Ermakova Fucoidans from Brown Alga Fucus evanescens: Structure and Biological Activity // Frontiers in Marine Science | 2016. Vol. 3. P. 1-9. doi: 10.3389/fmars.2016.00129].
Однако этот полисахарид до настоящего времени нигде не применялся в качестве адьюванта в составе вакцин для повышения иммуногенности вакцинных антигенов и снижения их дозы.
Экспериментально установлено, что фукоидан из F. evanescens не проявляет токсичности при парентеральном (подкожно, внутрибрюшинно) введении мышам в дозах 5-100 мг/кг (100-2000 мкг/мышь) и при условии применения per os в дозах 5-250 мг/кг (100-5000 мкг/мышь). Оптимальная доза фукоидана для оказания иммуноадъювантного эффекта составляет 100-200 мкг/мышь [Кузнецова Т.А. Коррекция нарушений иммунитета и гемостаза биополимерами из морских гидробионтов (экспериментальные и клинические аспекты. Дис. … д-ра мед. наук. Москва, 2009. 315 с.].
Иммуногенные свойства поверхностного антигена гепатита В (HBs-АГ) были изучены путем оценки специфического гуморального иммунного ответа мышей-самцов BALB/c массой 16-18 г, полученных из питомника лабораторных животных «Пущино».
При оценке иммуногенных свойств HBs-АГ мышам вводили подкожно двукратно с интервалом 2 недели суспензию рекомбинантного поверхностного антигена гепатита В (Abeam Limited, UK) (HBs-АГ) в дозе 1 мкг /мышь с фукоиданом в дозе 200 мг /мышь (1 группа). Во второй группе использовали суспензию рекомбинантного поверхностного антигена гепатита В (HBs-АГ) в дозе 1 мкг /мышь с гидроксидом алюминия (традиционный лицензированный адъювант (Brermtag Biosector, Дания) в дозе 100 мкг/мышь. Третья группа животных (контрольная) была иммунизирована HBs-АГ в фосфатно-буферном растворе рН 7,2.
Суспензию HBs-АГ готовили путем смешивания с фукоиданом или адсорбции на геле гидроксида алюминия в течении 1 часа.
Через 2 и 4 недели от последней иммунизации у экспериментальных животных под эфирным наркозом проводили тотальный забор крови из сонных артерий. В сыворотке крови определяли суммарные IgG антитела с применением тест-системы Mouse Hepatitis В surface Antibody(HBsAb) ELISA Kit (Blue Gene Biotech Co., Ltd.) (Китай).
После двукратной иммунизации мышей композицией HBs-АГ с фукоиданом (группа 1) через 2 недели выявлено усиление HBsAg-специфического IgG ответа по сравнению с контролем (группа 3) (р<0,05), а через 4 недели уровень специфических IgG антител превышал показатели иммунного ответа через 2 недели и значимо отличался от контроля (р<0,01). Эти результаты свидетельствуют об адъювантной активности фукоидана (таблица 2).
При иммунизации мышей композицией HBs-АГ с гидроксидом алюминия (группа 2) также наблюдалось стимуляция специфического иммунного ответа через 2 и 4 недели (таблица 2).
Сравнение иммунного ответа в группах 1 и 2 не выявило статистически значимых различий по уровню специфического ответа между группами 1 и 2 (таблица 2), т.е. адъювантный эффект фукоидана и гидроксида алюминия был сопоставим.
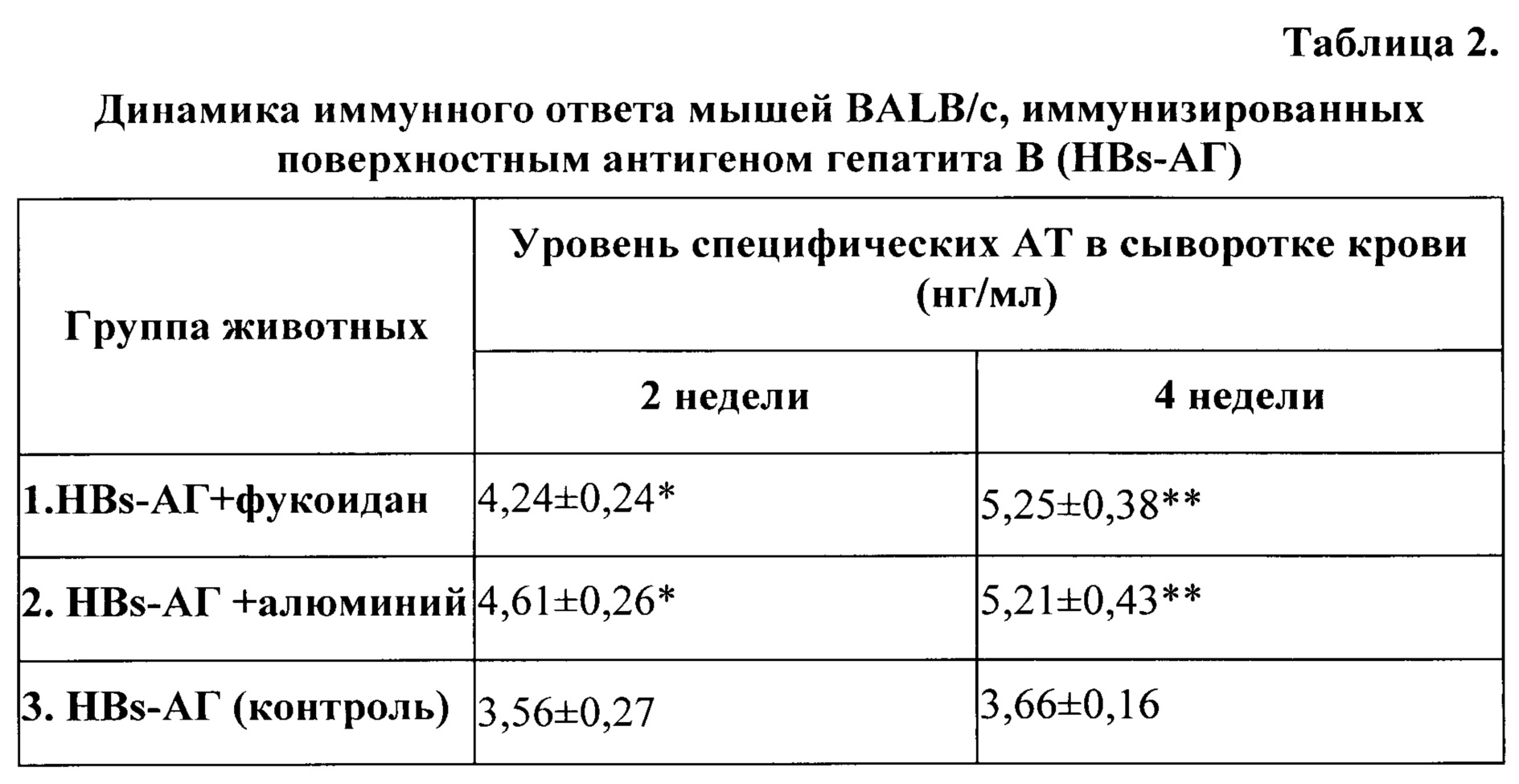
Примечание: показатели М±m; справа - значимость различий по отношению к контролю (группа 3) (*- p<0,05; **- p<0,01); n=6.
Таким образом, фукоидан из бурой водоросли F. evanescens проявляет адъювантную активность, усиливая иммуногенность поверхностного антигена гепатита В (HBs-АГ).
Иммуногенные свойства вируса гриппа А/Калифорния/7/09 (H1N1) были изучены путем оценки специфического гуморального иммунного ответа мышей-самцов BALB/c массой 16-18 г, полученных из ГУ научный центр биомедицинских технологий РАМН «Столбовая».
При оценке иммуногенных свойств инактивированного вируса гриппа А мышей BALB/c иммунизировали внутримышечно одно- и двукратно с двухнедельным интервалом композицией инактивированного вируса пандемического гриппа A/California/7/09 H1N1pdm (экспериментальным аналогом вакцинного штамма для живой гриппозной вакцины) в дозах 5 и 15 мкг/мышь с фукоиданом в дозе 200 мкг/мышь (1 и 2 группы соответственно) или гидроксидом алюминия в дозе 500 мкг/мышь (3 и 4 группы); 5 и 6 группы (контроль) были иммунизированы вирусом гриппа в дозах 5 мкг/мышь и 15 мкг/мышь с фосфатно-буферным раствором рН 7,2.
Оценивали уровень антител через 2 недели после одно- и двукратной иммунизации. Определение гемагглютинирующих антител к вирусу гриппа A/California/07/2009 (H1N1)pdm09 в сыворотке иммунизированных животных проводилось в реакции торможения гемагглютинации (РТГА) с 1,0% куриными эритроцитами. Результаты реакции учитывали после оседания эритроцитов в контрольных лунках планшета (через 30-40 мин). Титром сыворотки считали ее наибольшее разведение, при котором наблюдается полное торможение агглютинации эритроцитов в результате взаимодействия вируса со специфическими антителами. Рассчитывали среднее геометрическое титров антител (СГТ).
В результате однократной иммунизации мышей вирусом гриппа A/California/7/09 H1N1pdm в обеих испытуемых дозах (5 и 15 мкг/мышь) в сочетании с фукоиданом (1 и 2 группы) СГТ антител в сыворотке крови были значимо выше по сравнению с группой животных, иммунизированных вирусом гриппа А в этих же дозах (5 и 6 группы) (р<0,05 и p<0,01 соответственно). При иммунизации вирусом гриппа с гидроксидом алюминия усиление иммунного ответа по сравнению с контролем наблюдалось только в случае введения вируса гриппа в дозе 5 мкг/мышь (3 группа) (р<0,05) (таблица 3). После повторной иммунизации фукоидан оказывал 10-27 - кратный адъювантный эффект, стимулируя формирование антител к вирусу гриппа А. При этом фукоидан также активнее стимулировал антителообразование по сравнению с гидроксидом алюминия, хотя значимых различий в адъювантных эффектах фукоидана и гидроксида алюминия не выявлено (р>0,05) (таблица 3).
Анализ адъювантного эффекта фукоидана в зависимости от вводимой дозы вируса гриппа свидетельствует, что при однократной иммунизации животных инактивированным вирусом гриппа А в дозе 15 мкг/мышь СГТ в РПГА составила 640 (320-1280), а при снижении дозы в 3 раза (5 мкг/мышь) - 278,6 (160-1280) при отсутствии статистически значимых различий (р>0,05). При двукратной иммунизации вирусом гриппа в дозе 15 мкг/мышь СГТ значительно возрастала по сравнению с однократной и составила 1940,1 (640-5120), а в дозе 5 мкг/мышь - 1470,3 (1280-2560) (р>0,05) (таблица 3). Отсутствие статистически значимых различий в СГТ в ответ на введение большей и меньшей испытуемых доз свидетельствует о возможности использования более низкой вакцинирующей дозы вируса.
Таким образом, фукоидан, выделенный из бурой водоросли F. evanescens проявляет адъювантную активность, 7-27 - кратно повышая иммуногенность инактивированного вируса гриппа A/California/7/09 H1N1pdm при использовании более низкой (в 3 раза) вакцинирующей дозы вируса.
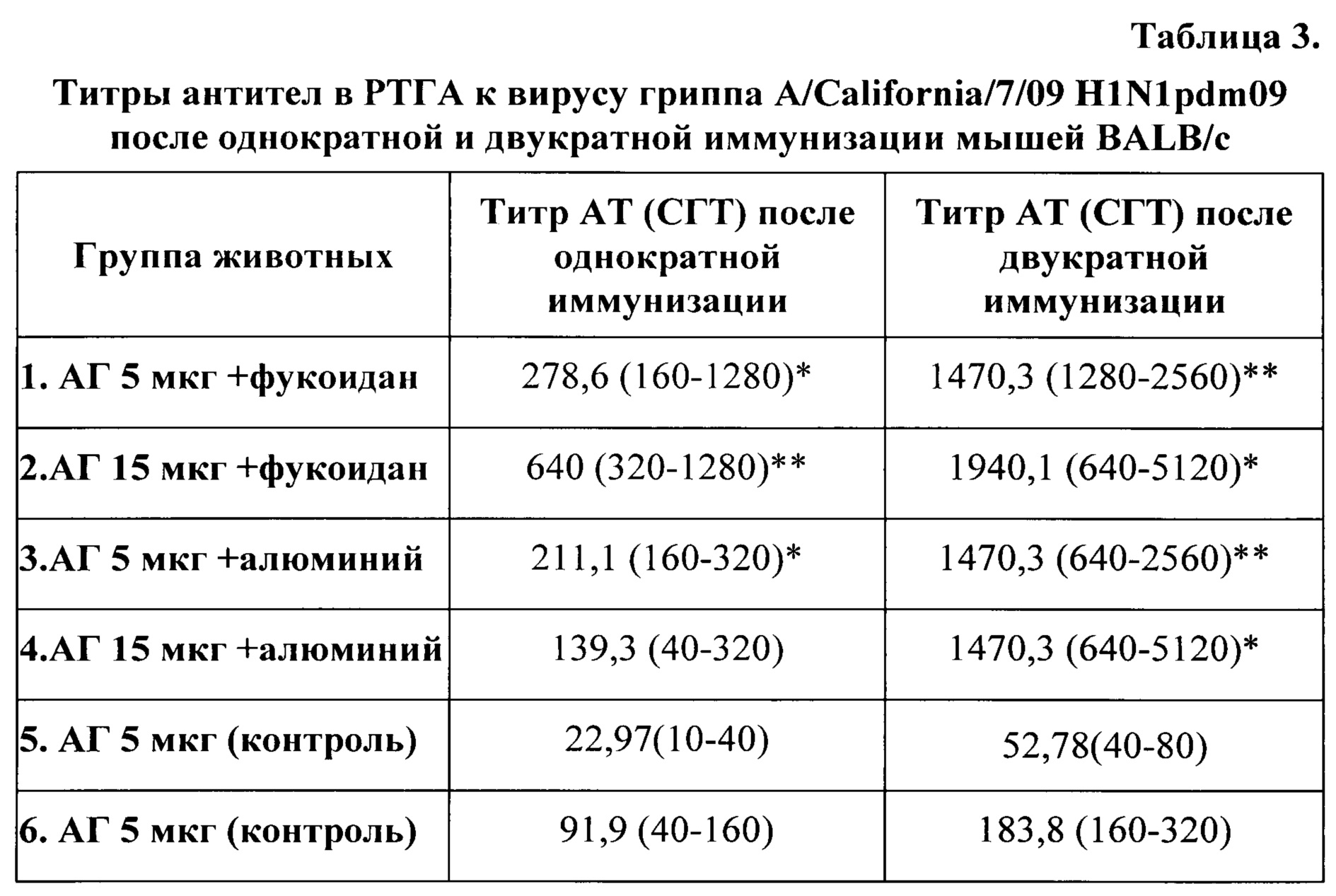
Примечание: показатели СГТ и min-max титры; справа - значимость различий между группами 1-5; 2-6; 3-5; 4-6 (*- p<0,05; **- p<0,01); n=5.
Применение фукоидана, полученного из бурой водоросли Fucus evanescens с молекулярной массой 130-430 кДа, моносахаридным составом фукоза : галактоза : ксилоза в соотношении 94,1:3,8:2,1 мол. %, содержанием сульфатов 27%, в качестве адъюванта вакцин против вирусов гепатита В или гриппа.
