Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ОБКЛАДОЧНЫХ КЛЕТОК ОБОНЯТЕЛЬНОЙ ВЫСТИЛКИ МЛЕКОПИТАЮЩИХ ДЛЯ ЛЕЧЕНИЯ ТРАВМ СПИННОГО МОЗГА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к области медицины, а именно к клеточной нейротрансплантологии и может быть использовано для лечения травм спинного мозга.
УРОВЕНЬ ТЕХНИКИ
Травматические повреждения спинного мозга - актуальная проблема современной нейробиологии и нейрохирургии в связи с постоянным ростом численности пострадавших от таких повреждений центральной нервной системы, высокой летальностью и инвалидизацией пострадавших. В большинстве случаев травмы спинного мозга являются результатом прямых механических повреждений, которые приводят как к частичной, так и полной потери подвижности и чувствительности тела. Травматические повреждения спинного мозга приводят к последствиям, которые оказывают серьезное влияние на качество жизни пациентов: ухудшается не только их физическое, но и психосоциальное состояние. Медикаментозное лечение и хирургическое вмешательство не всегда позволяют добиться желаемых результатов, поскольку при травматических повреждениях происходит гибель большого числа функциональных нейронов. В связи с этим перспективным направлением для лечения травм спинного мозга может стать клеточная терапия. Клеточная трансплантация может вызывать регенерацию аксонов, способствовать замене утраченных нейронов, снижать риск нарушений после травмы спинного мозга посредством секреции нейротрофических факторов (1).
Было проведено большое количество экспериментальных работ и клинических исследований с использованием различных типов клеток: эмбриональных стволовых клеток, индуцированных плюрипотентных стволовых клеток, мезенхимальных стволовых клеток, Шванновских клеток. Применение данных типов клеток при травматических повреждениях спинного мозга во многих случаях дало положительный терапевтический эффект с восстановлением сенсорной и моторной функций спинного мозга. Однако использование некоторых клеточных препаратов связано с определенными методическими и этическими проблемами. Применение других малоэффективно или приводит к возникновению побочных эффектов, таких как образование тератом или возникновение нейропатической боли. Все это затрудняет выбор оптимального клеточного препарата для терапии травм спинного мозга. Наиболее перспективными могут быть клетки обонятельной выстилки носа. Получение обонятельной выстилки является процедурой доступной и безопасной для пациентов. Данные клетки являются тканеспецифичными и аутологичными, так как они могут быть получены от пациента с травмой спинного мозга и после наращивания в культуре и направленной дифференцировки трансплантированы тому же самому пациенту.
Собственная пластинка обонятельной выстилки носа может быть источником обкладочных клеток, регенеративный потенциал которых при травмах спинного мозга активно изучается (2, 3). Обладая одновременно свойствами Шванновских клеток и астроцитов, что доказывает ко-экспрессия ими астроцитарного маркера - кислого глиального фибриллярного белка (GFAP) и олигодендроцитарного - низкоаффинного рецептора фактора роста нервов (p75NTR), они способны выполнять различные функции: создавать микроокружение для нейронов, способствовать росту аксонов и ремиелинизации нервных волокон (4). Также было показано, что трансплантированные обкладочные клетки способны мигрировать через глиальный рубец и таким образом облегчать рост аксонов при регенерации. В экспериментальных работах по трансплантации обкладочных клеток при травмах спинного мозга были получены положительные результаты. Было показано, что происходит восстановление моторных функций конечностей крыс (5), уменьшение площади повреждения, регенерация аксонов и ремиелинизация нервных волокон (6). Было проведено несколько клинических испытаний, которые продемонстрировали, что трансплантация аутологичных обкладочных клеток является безопасной процедурой для лечения пациентов (7). Было продемонстрировано улучшение показателей как моторной, так и сенсорной функции у пациентов с травмами спинного мозга после трансплантации эмбриональных обкладочных клеток обонятельной выстилки человека (8). Способность поддерживать нейрональную регенерацию позволяет рассматривать обкладочные клетки в качестве источника для клеточной терапии травм спинного мозга.
Существуют различные способы для получения обкладочных клеток из обонятельной выстилки человека.
Известен способ получения обкладочных клеток из аутопсийного материала обонятельной выстилки человека (WO 2007/069927 А2, 21.06.2007), заключающийся в том, что ткань обонятельной выстилки обрабатывали диспазой II, затем механически отделяли обонятельный эпителий от собственной пластинки, после чего образцы собственной пластинки подвергали дополнительной ферментативной обработке коллагеназой Н. Полученные из собственной пластинки клетки культивировали в суспензионных культурах в течение 7 или 14 дней, затем пересаживали на культуральные чашки, покрытые поли- L- лизином. После 4-11 дней культивирования в модифицированной по способу Дульбекко среде Игла и субстрате Хэма F-12 (DMEM/F-12), с 10% фетальной бычьей сывороткой (FBS), 2 мМ L-глутамином, 100 мкг/мл стрептомицином, 100 ед/мл пенициллином, количество обкладочных клеток в культуре оценивали методом иммунофлуоресценции по экспрессии маркера p75NTR.
Недостатком известного способа является дополнительная обработка ферментом коллагеназой Н, что может сказаться на выживаемости клеток при получении первичной культуры. Также недостатком данного изобретения является то, что обкладочные клетки, полученные из аутопсийных образцов, применимы только для аллогенной трансплантации. Количество и выживаемость клеток из аутопсийного материала может быть ниже, чем из других источников. Выращивание клеток в суспензионных культурах является более трудоемким методом, чем культивирование адгезивных культур.
Известен также способ получения обкладочных клеток из ткани обонятельного эпителия взрослых пациентов (RU 2394593 С2, 20.07.2010), заключающийся в том, что полученную от пациентов с травмами спинного мозга ткань обонятельной выстилки измельчали и инкубировали в растворе трипсина (0,05%) и этилендиаминтетрауксусной кислоты (ЭДТА) (0,02%) в течение 40 минут, при 36,5°С. Клетки культивировали в 12-луночных планшетах на полилизин - ламининовом субстрате в течение 10-15 суток в среде следующего состава: DMEM/F12, 10% FBS, 2 мМ L-глутамин, 0,8%глюкоза, смесь инсулина, трансферрина и селенита натрия (1:100), буфер HEPES (10 мМ), ростовые факторы человека нейрегулин1-бета1/герегулин1-бета1, эпидермальный ростовой фактор (2 нг/мл). После формирования плотного монослоя клетки пересевали во флаконы с полилизин - ламининовым субстратом. После 3-4 пассажей клетки снимали и полученную суспензию либо использовали для трансплантации, либо замораживали с использованием криопротектора (10% сыворотки, 90% ЭДТА) и хранили в жидком азоте при -70°С. Для трансплантации криоконсервированные клетки размораживали и определяли их жизнеспособность с помощью окраски трипановым синим.
Основным недостатком данного способа является то, что при получении первичной культуры клеток не отделяли собственную пластинку от обонятельного эпителия, что не позволяет получить чистую культуру обкладочных клеток.
Из известных способов наиболее близким по технической сущности к предложенному способу является способ получения обкладочных клеток из собственной пластинки человека (WO 2001/030982 А1, 03.05.2001), заключающийся в том, что ткань обонятельной выстилики обрабатывали диспазой II, затем механически отделяли обонятельный эпителий от собственной пластинки, после чего образцы собственной пластинки подвергали дополнительной ферментативной обработке коллагеназой 1, после чего культивировали клетки собственной пластинки на фибронектине или поли - L - лизине в среде DMEM, содержащей 50 мг/мл гентамицина, 10% FBS. Через 10 дней обкладочные клетки были визуализированы по маркеру р75.
Наиболее существенным недостатком известного способа является отсутствие стадии наращивания клеточной массы в первичной культуре, до культивирования клеток на поли - L - лизине, что значительно снижает количество получаемых клеток. А также дополнительная обработка ферментом коллагеназой 1 может сказаться на выживаемости получаемых клеток.
Техническая проблема, на решение которой направлено предложенное изобретение, заключается в создании способа получения препарата обкладочных клеток из обонятельной выстилки млекопитающего, устраняющего недостатки предыдущих аналогов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Технический результат заявленного изобретения заключается в возможности получения чистой культуры обкладочных клеток, в достаточном для дальнейшей трансплантации количестве и обладающих высокой выживаемостью.
Указанный технический результат достигается предложенным способом получения обкладочных клеток из обонятельной выстилки млекопитающих для лечения травм спинного мозга, включающим этапы на которых: получают образцы ткани из обонятельной выстилки носа млекопитающего; промывают их; инкубируют ткань с диспазой II в концентрации 2 мг/мл в течение 1 часа при 37°С; переносят ткань в DMEM:F12 (1:1) с антибиотиками и механически отделяют обонятельный эпителий от собственной пластинки; собственную пластинку измельчают и культивируют в виде эксплантной культуры в течение 14 дней в среде DMEM:F12 (1:1), содержащей 10% FBS, 2 мМ L-глутамина, 100 мкг/мл стрептомицина, 100 ед/мл пенициллина и 60 мкг/мл гентамицина, смену среды производят каждые три дня; после образования монослоя, инкубируют клетки с 0,05% раствором трипсина 2 минуты при 37°С, инактивируют фермент средой с сывороткой, ресуспендируют и центрифугируют 2 минуты при 900 g; клетки помещают на пластик, покрытый 0,01% поли-L-лизином, и культивируют в среде DMEM:F12 (1:1), содержащей 10% FBS, 2 мМ L-глутамина, 1% добавки инсулина, трансферрина, селенита натрия (ITS), 100 мкг/мл стрептомицина, 100 ед/мл пенициллина и 500 нг/мл гидрокортизона, в течение 3 дней; полученные клетки охарактеризовывают по маркерам p75NTR и GFAP. При необходимости после получения образцов ткани и до момента начала эксперимента по получению первичной культуры, образцы ткани обонятельной выстилки носа млекопитающего транспортируют в питательной среде DMEM:F12 (1:1) и хранят при +4°С не более 2 часов. Промывание образцов ткани обонятельной выстилки осуществляют в среде DMEM:F12 (1:1) с антибиотиками 100 мкг/мл стрептомицина и 100 ед/мл пенициллина не менее 3-х раз. Механическое отделение обонятельного эпителия от собственной пластинки производят посредством микрошпателя в чашке Петри со средой DMEM:F12 (1:1) с антибиотиками 100 мкг/мл стрептомицина и 100 ед/мл пенициллина.
Отличия заявленного способа от ранее известных из уровня техники состоят в том, что ткань обонятельной выстилки подвергали обработке только одним ферментом диспазой II для того, чтобы можно было механически отделить обонятельной эпителий от собственной пластинки с целью получить более чистую культуру обкладочных клеток. Чтобы не подвергать ткань собственной пластинки дополнительной ферментной обработке в заявленном изобретении применяется метод эксплантной культуры, когда собственная пластинка подвергается механическому измельчению и полученные кусочки ткани помещают в культуральные чашки в среду культивирования.
Для получения большего количества клеток произведено наращивание первичной культуры в течение 14 дней. Далее для получения обкладочных клеток пересаживали полученную первичную культуру на пластик или чашки, покрытые поли-L-лизином, в среду (DMEM:F12 (1:1), с 10% FBS, 2 мМ L-глутамином, 100 p.g/mL стрептомицином, 100 μ/mL пенициллином, 1% ITS и 500 нг/мл гидрокортизоном). Гидрокортизон увеличивает чувствительность клеток к ростовым факторам, содержащимся в сыворотке, что позволяет получить большее количество клеток. Кроме того, полученная культура обкладочных клеток человека была более точно охарактеризована по одновременной экспрессии двух маркеров p75NTR и GFAP.
Дополнительным преимуществом изобретения является и возможность аутологичного применения обкладочных клеток при взятии материала обонятельной выстилки у пациентов с травмой спинного мозга, получения из этого материала обкладочных клеток и дальнейшей клеточной трансплантации этим же пациентам.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Предложенный способ иллюстрируется чертежами,
где на фиг. 1 - Первичная культура собственной пластинки обонятельной выстилки человека, полученная методом эксплантной культуры (фазово-контрастная микроскопия);
на фиг. 2 - Культура обкладочных клеток человека, полученная при культивировании на поли-L-лизине (фазово-контрастная микроскопия);
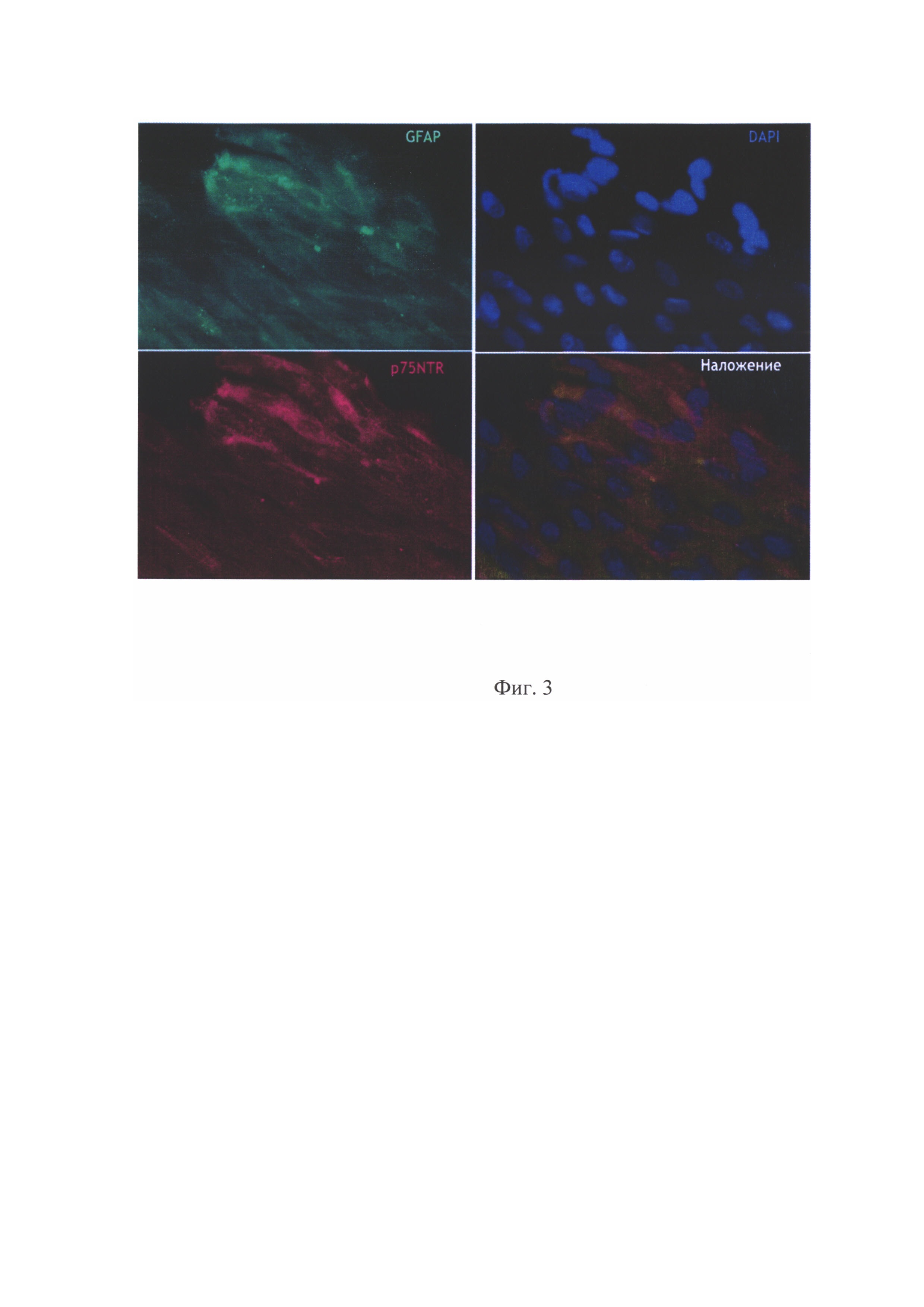
на фиг. 3 - Культура обкладочных клеток человека, охарактеризованная иммунофлуоресцентным методом по одновременной экспрессии маркеров GFAP и p75NTR;
на фиг. 4 - Первичная культура собственной пластинки обонятельной выстилки крыс, полученная методом эксплантной культуры (фазово-контрастная микроскопия);
на фиг. 5. - Культура обкладочных клеток крыс, полученная при культивировании на поли-L-лизине (фазово-контрастная микроскопия);
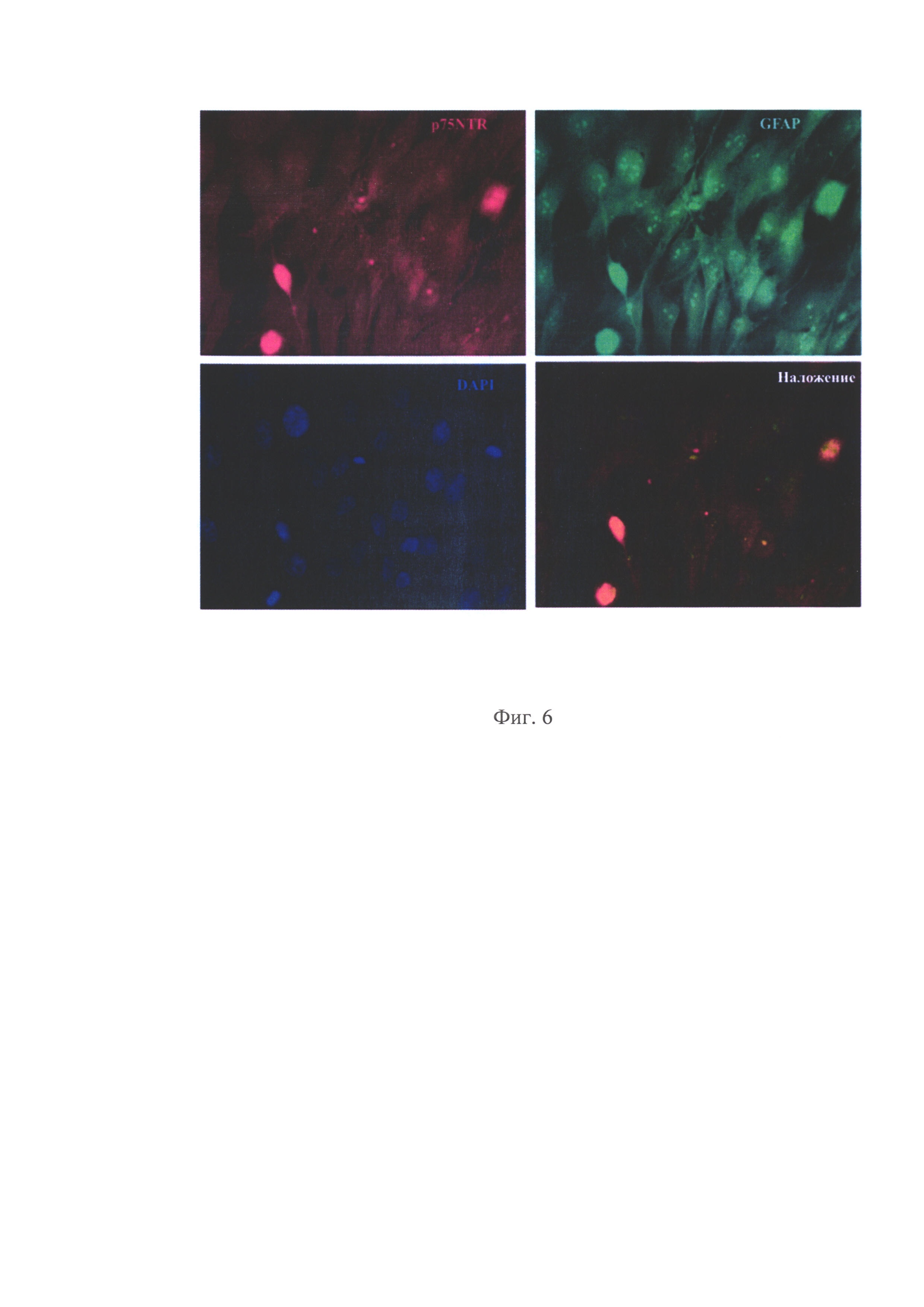
на фиг. 6. - Культура обкладочных клеток крыс, охарактеризованная иммунофлуоресцентным методом по одновременной экспрессии маркеров GFAP и p75NTR;
на фиг. 7. - МРТ изображение формирования посттравматической кисты спинного мозга через 4 недели после травмы спинного мозга, киста указана стрелкой;
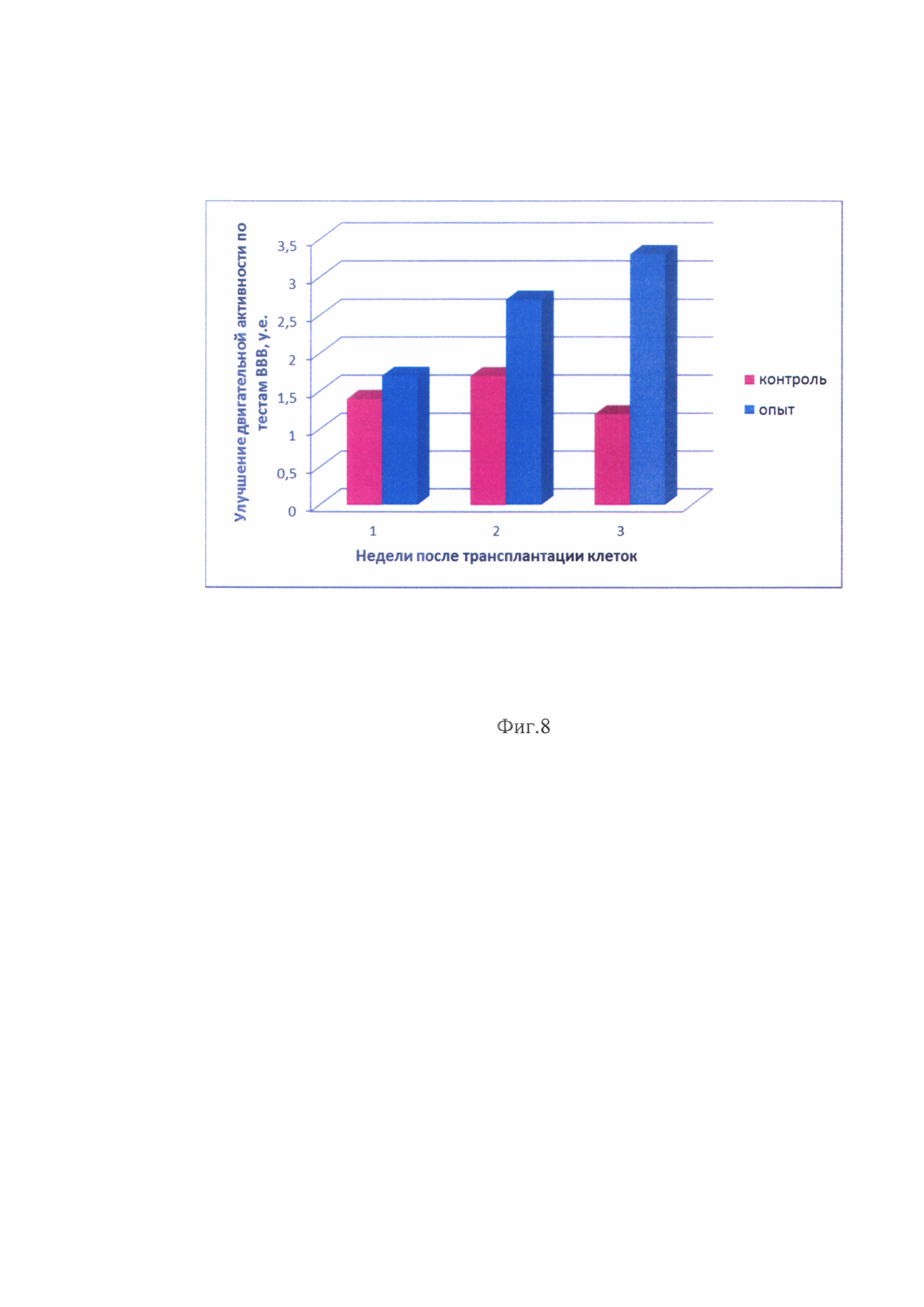
на фиг. 8. - Восстановление двигательной активности задних конечностей крыс после трансплантации обкладочных клеток крыс. В опытной и контрольной группе представлены средние данные по трем животным.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Способ поясняется следующими примерами.
Пример 1.
Обкладочные клетки обонятельной выстилки человека получают известным способом.
Образцы ткани обонятельной выстилки получают из операционного материала области верхнего и среднего носового ходов при проведении плановых хирургических вмешательств. Площадь образцов, необходимая для проведения научного исследования составляет 5-25 мм2. При необходимости после получения образцов ткани и до момента начала эксперимента по получению первичной культуры, образцы ткани обонятельной выстилки носа человека транспортируют в питательной среде DMEM:F12 (1:1) и хранят при +4°С не более 2 часов. Затем ткань промывают в среде DMEM:F12 (1:1) не менее 3 раз. Затем ткань инкубируют с диспазой II с концентрацией 2 мг/мл в течение 1 часа при +37°С, после чего механически отделяют обонятельный эпителий от собственной пластинки. Механическое отделение обонятельного эпителия от собственной пластинки производят посредством микрошпателя в чашке Петри со средой DMEM:F12 (1:1) с антибиотиками 100 мкг/мл стрептомицина и 100 ед/мл пенициллина. Полученную ткань собственной пластинки переносят в чашку Петри со средой для культивирования DMEM:F12 (1:1) с содержанием 10% FBS, 2 мМ L-глутамина и антибиотиков. Собственную пластинку измельчают и культивируют в виде эксплантной культуры в течение 14 дней в среде DMEM:F12 (1:1), содержащей 10% FBS, 2 мМ L-глутамина, 100 мкг/мл стрептомицина, 100 ед/мл пенициллина и 60 мкг/мл гентамицина, в инкубаторе при 5% СО2, +37°С и поддержании влажности 95% (фиг. 1). При этом смену среду производят каждые три дня.
После образования монослоя клетки промывают раствором Версена 3 раза, инкубируют клетки с 0,05% раствором трипсина 2 минуты при 37°С, переносят суспензию с клетками в пробирку, для инактивации трипсина добавляют среду DMEM:F12 (1:1) с 10% FBS, ресуспендируют и далее центрифугируют 2 минуты при 900g. Супернатант удаляют, осадок ресуспендируют в среде DMEM:F12 (1:1), содержащей 10% FBS, 2 мМ L-глутамина, 1% добавки инсулина, трансферрина, селенита натрия (ITS), 100 мкг/мл стрептомицина, 100 ед/мл пенициллина и 500 нг/мл гидрокортизона. Далее полученные клетки помещают на пластик, покрытый 0,01% поли-L-лизином, и культивируют в среде DMEM:F12 (1:1), содержащей 10% FBS, 2 мМ L-глутамина, 1% добавки инсулина, трансферрина, селенита натрия (ITS), 100 мкг/мл стрептомицина, 100 ед/мл пенициллина и 500 нг/мл гидрокортизона, в течение 3 дней (фиг. 2). Полученные клетки охарактеризовывают по маркерам p75NTR и GFAP (фиг. 3). Чистота полученной культуры обкладочных клеток составляет 95-97%).
Пример 2.
Обкладочные клетки обонятельной выстилки крыс выделяют описанным способом. Производят наркотизацию крыс линии Wistar интраперитонеальным введением смеси реланиум/кетамин 1:1 (1 мкл/гр). Затем производят декапитацию животных. Далее производят сечение черепа в сагиттальной плоскости на уровне носовой перегородки и забор материала обонятельной выстилки животного. Затем ткань промывают в среде DMEM:F12 (1:1) не менее 3 раз. Затем ткань инкубируют с диспазой II с концентрацией 2 мг/мл в течение 1 часа при +37°С, после чего механически отделяют обонятельный эпителий от собственной пластинки. Механическое отделение обонятельного эпителия от собственной пластинки производят посредством микрошпателя в чашке Петри со средой DMEM:F12 (1:1) с антибиотиками 100 мкг/мл стрептомицина и 100 ед/мл пенициллина. Полученную ткань собственной пластинки переносят в чашку Петри со средой для культивирования DMEM:F12 (1:1) с содержанием 10% FBS, 2 мМ L-глутамина и антибиотиков. Собственную пластинку измельчают и культивируют в виде эксплантной культуры в течение 14 дней в среде DMEM:F12 (1:1), содержащей 10% FBS, 2 мМ L-глутамина, 100 мкг/мл стрептомицина, 100 ед/мл пенициллина и 60 мкг/мл гентамицина, в инкубаторе при 5% CO2, +37°С и поддержании влажности 95% (фиг. 4). При этом смену среду производят каждые три дня.
После образования монослоя клетки промывают раствором Версена 3 раза, инкубируют клетки с 0,05% раствором трипсина 2 минуты при 37°С, переносят суспензию с клетками в пробирку, для инактивации трипсина добавляют среду DMEM:F12 (1:1) с 10% FBS, ресуспендируют и далее центрифугируют 2 минуты при 900g. Супернатант удаляют, осадок ресуспендируют в среде DMEM:F12 (1:1), содержащей 10% FBS, 2 мМ L-глутамина, 1% добавки инсулина, трансферрина, селенита натрия (ITS), 100 мкг/мл стрептомицина, 100 ед/мл пенициллина и 500 нг/мл гидрокортизона. Далее полученные клетки помещают на пластик, покрытый 0,01% поли-L-лизином, и культивируют в среде DMEM:F12 (1:1), содержащей 10% FBS, 2 мМ L-глутамина, 1% добавки инсулина, трансферрина, селенита натрия (ITS), 100 мкг/мл стрептомицина, 100 ед/мл пенициллина и 500 нг/мл гидрокортизона, в течение 3 дней (фиг. 5). Полученные клетки охарактеризовывают по маркерам p75NTR и GFAP (фиг. 6). Чистота полученной культуры обкладочных клеток составляет 95-97%).
Пример 3.
Полученные обкладочные клетки крыс наращивают в культуре и клетки 2-3 пассажа используют для лечения экспериментальных травм спинного мозга крыс. Модель экспериментальных травм представляет собой посттравматические кисты спинного мозга крыс.
Моделирование посттравматических кист спинного мозга крыс проводят по разработанной нами методике на половозрелых самках крыс линии Wistar, весом от 200 грамм. В течение операции соблюдают стерильные условия. Все манипуляции, причиняющие животным болевую или иную тразму, выполняют при обезболивании, животных наркотизируют интраперитонеальным введением смеси реланиум/кетамин (1 мкл/гр). Перед закреплением животного на операционном столе глубину наркоза определяют выраженностью моргательного и вибрисс рефлексов. Производят подготовку операционного поля с помощью электробритвы и протирания кожи спиртом. Производят срединный надрез вдоль позвоночника на уровне Th9-Th10, частичную резекцию мышц с двух сторон от остистого отростка, при незначительных выделениях крови используют 3% раствор перекиси водорода и марлевые тампоны. Удаляют остистый отросток Th10 с помощью хирургических кусачек, открывают доступ к спинному мозгу. Производят воздействие ударным механизмом силой 200 kilodynes (Precision Systems and Instrumentation LLC, Fairfax, VA). Края операционной раны сводят и закрепляют с помощью скрепляющих скоб и обрабатывают раствором бриллиантовой зеленой. Для общей профилактики послеоперационных инфекционных осложнений используют 300 мкл раствора цефазолина внутримышечно. Образование кисты подтверждают с помощью томографа для животных (ClinScan, Bruker BioSpin) через 4 недели после операции (фиг. 7).
В полость образовавшейся кисты животным трансплантируют обкладочные клетки крыс. Для оценки терапевтического эффекта трансплантируют по 750 тысяч полученных клеток в 20 мкл DMEM:F12 (1:1), содержащей 2 мМ L-глутамина, 100 мкг/мл стрептомицина, 100 ед/мл пенициллина. Животным контрольной группы вводят 20 мкл DMEM:F12 (1:1), содержащей 2 мМ L-глутамина, 100 мкг/мл стрептомицина, 100 ед/мл пенициллина. После трансплантации клеток в место повреждения проводят оценку восстановления двигательной активности задних конечностей крыс. Основным инструментом для оценки восстановления моторной функции является 21-балльная шкала открытого поля, разработанная D. Basso, М. Beattie и J. Bresnanan (ВВВ), которая позволяет изучить динамику восстановления опорно-двигательного аппарата (9). Динамику восстановления двигательной активности задних конечностей крыс оценивают с помощью теста ВВВ раз в неделю в течение 3 недель. У крыс, которым трансплантируют клеточный препарат, наблюдается значительное улучшение двигательной активности задних конечностей по тестам ВВВ (фиг. 8).
Список литературы:
1. Pearse DD, Bunge MB. Designing cell- and gene-based regeneration strategies to repair the injured spinal cord. J Neurotrauma. 2006; 23 (3-4): 438-52.
2. Barnett SC, Riddell JS. Olfactory ensheathing cell transplantation as a strategy for spinal cord repair-what can it achieve? Nat Clin Pract Neurol. 2007; 3: 152-161.
3. Mackay-Sim A St, John JA. Olfactory ensheathing cells from the nose: clinicai application in human spinal cord injuries. Exp Neurol. 2011; 229: 174-180.
4. Borgmann-Winter K, Willard SL, Sinclair D, et al. Translational potential of olfactory mucosa for the study of neuropsychiatric illness. Citation: Transl Psychiatry. 2015; 5, e527.
5. Yamamoto M, Raisman G, Li DQ et al. Transplanted olfactory mucosal cells restore paw reaching function without regeneration of severed corticospinal tract fibres across the lesion. Brain Research. 2009; 1303: 26-31.
6. Richter MW, Fletcher PA, Liu J et al. Lamina propria and olfactory bulb ensheathing cells exhibit differential integration and migration and promote differential axon sprouting in the lesioned spinal cord. J Neurosci. 2005; 25: 10700-10711.
7. Feron F, Perry C, Cochrane J et al. Autologous olfactory ensheathing cell transplantation in human spinal cord injury. Brain. 2005; 128: 2951-2960.
8. Lim РАС, Tow AM. Recovery and regeneration after spinal cord injury: A review ana summary of recent literature. Annals Academy of Medicine Singapore 2007; 36: 49-57.
9. Basso DM, Beattie MS, Bresnahan JC. A sensitive and reliable locomotor rating scale lor open field testing in rats. J Neurotrauma. 1995; 12 (1): 1-21.