Результат интеллектуальной деятельности: ИНГИБИТОРЫ ALK-КИНАЗЫ
Вид РИД
Изобретение
В настоящей заявке раскрыты ингибиторы протеинкиназы, более конкретно новые производные пиримидина и их фармацевтические композиции, а также их применение в качестве лекарственных средств.
Киназа анапластической лимфомы (ALK), представитель суперсемейства инсулиновых рецепторов рецепторных тирозинкиназ, участвует в онкогенезе в гемопоэтических и негемопоэтических опухолей. Сообщали о нарушенной экспрессии полноразмерных ALK-рецепторных белков в нейробластомах и глиобластомах, при этом слитые белки ALK присутствовали в анапластической крупноклеточной лимфоме. Исследование слитых белков ALK также обеспечило возможность разработки новых способов лечения пациентов с ALK-положительными злокачественными новообразованиями (Pulford et al., Cell. Mol. Life. Sci. 61: 2939-2953 (2004)).
Ввиду прояснения связанной с болезнями роли ALK сохраняется потребность в соединениях, которые могут применяться для лечения и предотвращения заболевания, которое отвечает на ингибирование ALK, и которые обладают по меньшей мере одним выгодным свойством, выбранным из активности, стабильности, селективности, токсичности, фармакодинамических свойств и фармакокинетических свойств в качестве альтернативы. В этой связи предложен новый класс ингибиторов ALK.
В настоящей заявке раскрыты некоторые новые производные пиримидина и их фармацевтические композиции, а также их применение в качестве лекарственных средств.
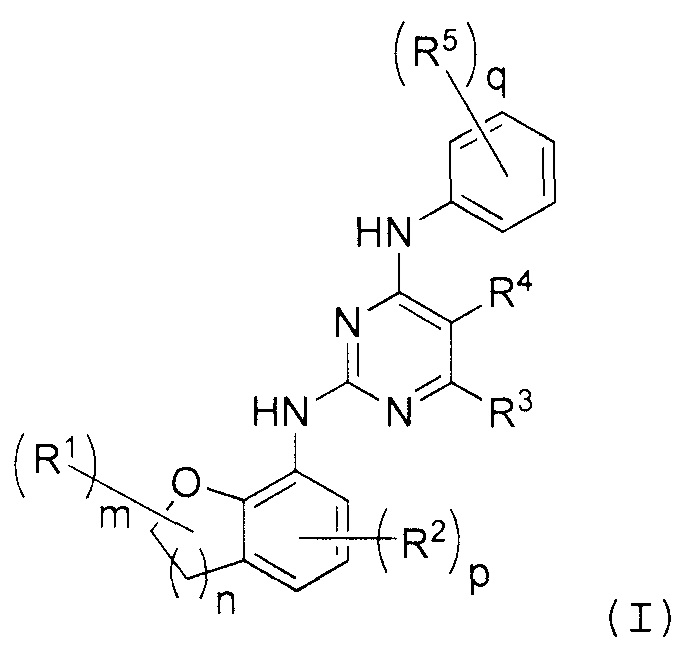
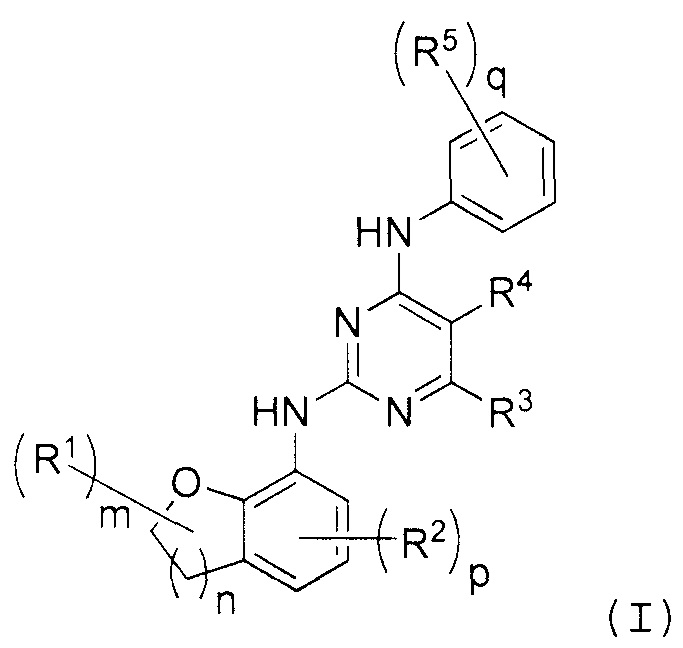
В одном аспекте предложено по меньшей мере одно соединение формулы (I):
и/или по меньшей мере одна его фармацевтически приемлемая соль,
где:
каждый R1 независимо выбран из:
водорода,
галогена,
гидроксила,
C1-10 алкила,
C3-10 циклоалкила,
C3-10 циклоалкил-алкила,
гетероциклила,
гетероциклилалкила,
арила,
арилалкила,
гетероарила и
гетероарилалкила,
где каждый алкил, циклоалкил и гетероциклил не замещены или замещены по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, и где каждый арил и гетероарил не замещены или замещены по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6b;
каждый R2 независимо выбран из:
водорода,
галогена,
гидроксила,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
C3-10 циклоалкила,
C3-10 циклоалкилалкила,
гетероциклила,
гетероциклилалкила,
гетероциклилкарбонила,
арила,
гетероарила,
арилалкила и
гетероарилалкила,
где каждый алкил, алкенил, алкинил, циклоалкил и гетероциклил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, и каждый арил и гетероарил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6b;
каждый R3 независимо выбран из:
водорода,
галогена,
-CN,
-NR7R8 и
C1-10 алкила;
где алкил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a;
каждый R4 независимо выбран из:
водорода,
галогена,
-CN,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила и
C3-10 циклоалкила;
где каждый C1-10 алкил, C2-10 алкенил, C2-10 алкинил и C3-10 циклоалкил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a;
или R3 и R4 вместе с атомами углерода, к которым они присоединены, образуют 5-6-членное кольцо, содержащее 0, 1, 2 или 3 гетероатома, независимо выбранных из кислорода, серы и азота, и необязательно замещенное 1-2 группами R6b;
каждый R5 независимо выбран из:
водорода,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
C3-10 циклоалкила,
-OR8,
-NR7S(O)rR8,
-NO2,
галогена,
-S(O)rR7,
-SR8,
-S(O)2OR7,
-OS(O)2R8,
-S(O)rNR7R8,
-NR7R8,
-O(CR9R10)tNR7R8,
-C(O)R7,
-CO2R8,
-CO2(CR9R10)tCONR7R8,
-OC(O)R7,
-CN,
-C(O)NR7R8,
-NR7C(O)R8,
-OC(O)NR7R8,
-NR7C(O)OR8,
-NR7C(O)NR7R8,
-CR7(N-OR8),
-CHF2,
-CF3,
-OCHF2 и
-OCF3;
где каждый C1-10 алкил, C2-10 алкенил, C2-10 алкинил и C3-10 циклоалкил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a;
каждый R6a независимо выбран из:
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
C3-10 циклоалкила,
-OR8,
-NR7S(O)rR8,
-NO2,
галогена,
-S(O)rR7,
-SR8,
-S(O)2OR7,
-OS(O)2R8,
-S(O)rNR7R8,
-NR7R8,
-(CR9R10)tOR8,
-(CR9R10)tNR7R8,
-(CR9R10)tSR8,
-(CR9R10)tS(O)rR8,
-(CR9R10)tCO2R8,
-(CR9R10)tCONR7R8,
-(CR9R10)tNR7CO2R8,
-(CR9R10)tOCONR7R8,
-(CR9R10)tNR7CONR7R8,
-(CR9R10)tNR7SO2NR7R8,
-O(CR9R10)tNR7R8,
-C(O)R7,
-C(O)(CR9R10)tOR8,
-C(O)(CR9R10)tNR7R8,
-C(O)(CR9R10)tSR8,
-C(O)(CR9R10)tS(O)rR8,
-CO2R8,
-CO2(CR9R10)tCONR7R8,
-OC(O)R7,
-CN,
-C(O)NR7R8,
-NR7C(O)R8,
-OC(O)NR7R8,
-NR7C(O)OR8,
-NR7C(O)NR7R8,
-CR7(N-OR8),
-CHF2,
-CF3,
-OCHF2 и
-OCF3;
каждый R6b независимо выбран из:
R6a,
арила,
арил-C1-4 алкила,
гетероарила и
гетероарил-C1-4 алкила;
каждый R7 и каждый R8 независимо выбраны из:
водорода,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
циклоалкила,
циклоалкил-C1-10 алкила;
гетероциклила,
гетероциклил-C1-10 алкила,
арила,
гетероарила,
арил-C1-10 алкила и
гетероарил-C1-10 алкила;
где каждый алкил, алкенил, алкинил, циклоалкил и гетероциклил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, и каждый арил и гетероарил не замещены или замещены по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6b; или
R7 и R8 вместе с атомом(ами), к которому они присоединены, образуют 4-7-членное гетероциклическое кольцо, содержащее 0, 1, или 2 дополнительных гетероатома, независимо выбранных из кислорода, серы и NR11,
каждый R7 и R8 могут быть не замещены или замещены по атому углерода или азота по меньшей мере одним заместителем, например, одним, двумя или тремя заместителями, выбранными из R12;
каждый R9 и каждый R10 независимо выбраны из:
водорода,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
циклоалкила,
циклоалкил-C1-10 алкила,
гетероциклила,
гетероциклил-C1-10 алкила,
арила,
гетероарила,
арил-C1-10 алкила и
гетероарил-C1-10 алкила; или
R9 и R10 вместе с атомом(ами) углерода, к которому они присоединены, образуют 3-7-членное кольцо, содержащее 0, 1 или 2 гетероатома, независимо выбранных из кислорода, серы и азота;
каждый R11 независимо выбран из:
водорода,
C1-10 алкила,
C3-10 циклоалкила,
C3-10 циклоалкил-C1-4 алкила,
гетероциклила,
гетероциклил-C1-4 алкила,
арила,
арил-C1-4 алкила,
гетероарила,
гетероарил-C1-4 алкила,
-S(O)rR7,
-C(O)R7,
-CO2R7,
-CO2(CR9R10)tCONR7R8, и
-C(O)NR7R8;
каждый R12 независимо выбран из:
галогена,
C1-10 алкила,
C3-10 циклоалкила,
C3-10 циклоалкилалкила,
гетероциклила,
гетероциклилалкила,
арила,
арил-C1-4 алкила,
гетероарила,
гетероарил-C1-4 алкила,
-OR7,
-NR7S(O)rR8,
-S(O)rR7,
-SR7,
-S(O)2OR7,
- OS(O)2R7,
-S(O)rNR7R8,
-NR7R8,
-O(CR9R10)tNR7R8,
-C(O)R7,
-CO2R8,
-CO2(CR9R10)tCONR7R8,
-OC(O)R7,
-CN,
-C(O)NR7R8,
-NR7C(O)R8,
-OC(O)NR7R8,
-NR7C(O)OR8,
-NR7C(O)NR7R8,
-CHF2,
-CF3,
-OCHF2, и
-OCF3;
каждое m независимо выбрано из 0, 1 и 2;
каждое n независимо выбрано из 1, 2 и 3;
каждое p независимо выбрано из 0, 1, 2 и 3;
каждое q независимо выбрано из 0, 1, 2 и 3;
каждое r независимо выбрано из 1 и 2;
каждое t независимо выбрано из 1, 2 и 3.
В еще одном аспекте настоящего описания предложены фармацевтические композиции, включающие по меньшей мере одно соединение формулы (I) и/или по меньшей мере одну его фармацевтически приемлемую соль и фармацевтически приемлемое вспомогательное вещество.
В еще одном аспекте описания предложены способы модулирования ALK, включающие введение в систему или субъекту, нуждающемуся в этом, терапевтически эффективного количества по меньшей мере одного соединения формулы (I) и/или по меньшей мере одной его фармацевтически приемлемой соли, или его фармацевтических композиций, осуществляя таким образом модулирование указанной ALK. В описании также предложены способы лечения, уменьшения тяжести или предотвращения состояния, которое отвечает на ингибирование ALK, включающие введение в систему или субъекту, нуждающемуся в таком лечении, эффективного количества по меньшей мере одного соединения формулы (I) и/или по меньшей мере одной его фармацевтически приемлемой соли, или его фармацевтических композиций и, необязательно, в комбинации со вторым терапевтическим средством, осуществляя таким образом лечение указанного состояния. В альтернативе в настоящем описании предложено применение по меньшей мере одного соединения формулы (I) и/или по меньшей мере одной его фармацевтически приемлемой соли в производстве лекарственного средства для лечения состояния, опосредуемого ALK. В определенных вариантах осуществления соединения согласно описанию могут применяться отдельно или в комбинации со вторым терапевтическим средством для лечения состояния, опосредуемого ALK, где указанным состоянием является аутоиммунное заболевание, реакция "трансплантат против хозяина", инфекционное заболевание или клеточное пролиферативное нарушение.
Кроме того, в описании предложены способы лечения клеточного пролиферативного нарушения, включающие введение в систему или субъекту, нуждающемуся в таком лечении, эффективного количества по меньшей мере одного соединения формулы (I) и/или по меньшей мере одной его фармацевтически приемлемой соли или его фармацевтических композиций и, необязательно, в комбинации со вторым терапевтическим средством, осуществляя таким образом лечение указанного состояния.
В альтернативе в настоящем описании предложено применение по меньшей мере одного соединения формулы (I) и/или по меньшей мере одной его фармацевтически приемлемой соли в производстве лекарственного средства для лечения клеточного пролиферативного нарушения. В определенных примерах, соединения согласно описанию могут применяться отдельно или в комбинации с химиотерапевтическим средством для лечения клеточного пролиферативного нарушения, включающего, без ограничения перечисленными, лимфому, остеогенную саркому, меланому или опухоль молочной железы, опухоль почки, предстательной железы, колоректальную опухоль, опухоль щитовидной железы, яичника, поджелудочной железы, нейронную, легочную, маточную или желудочно-кишечную опухоль.
В вышеуказанных способах применения соединений согласно описанию, по меньшей мере одно соединение формулы (I) и/или по меньшей мере одна его фармацевтически приемлемая соль могут быть введены в систему, включающую клетки или ткани, или млекопитающему, такому как животное или человек.
КРАТКОЕ ОПИСАНИЕ ФИГУР
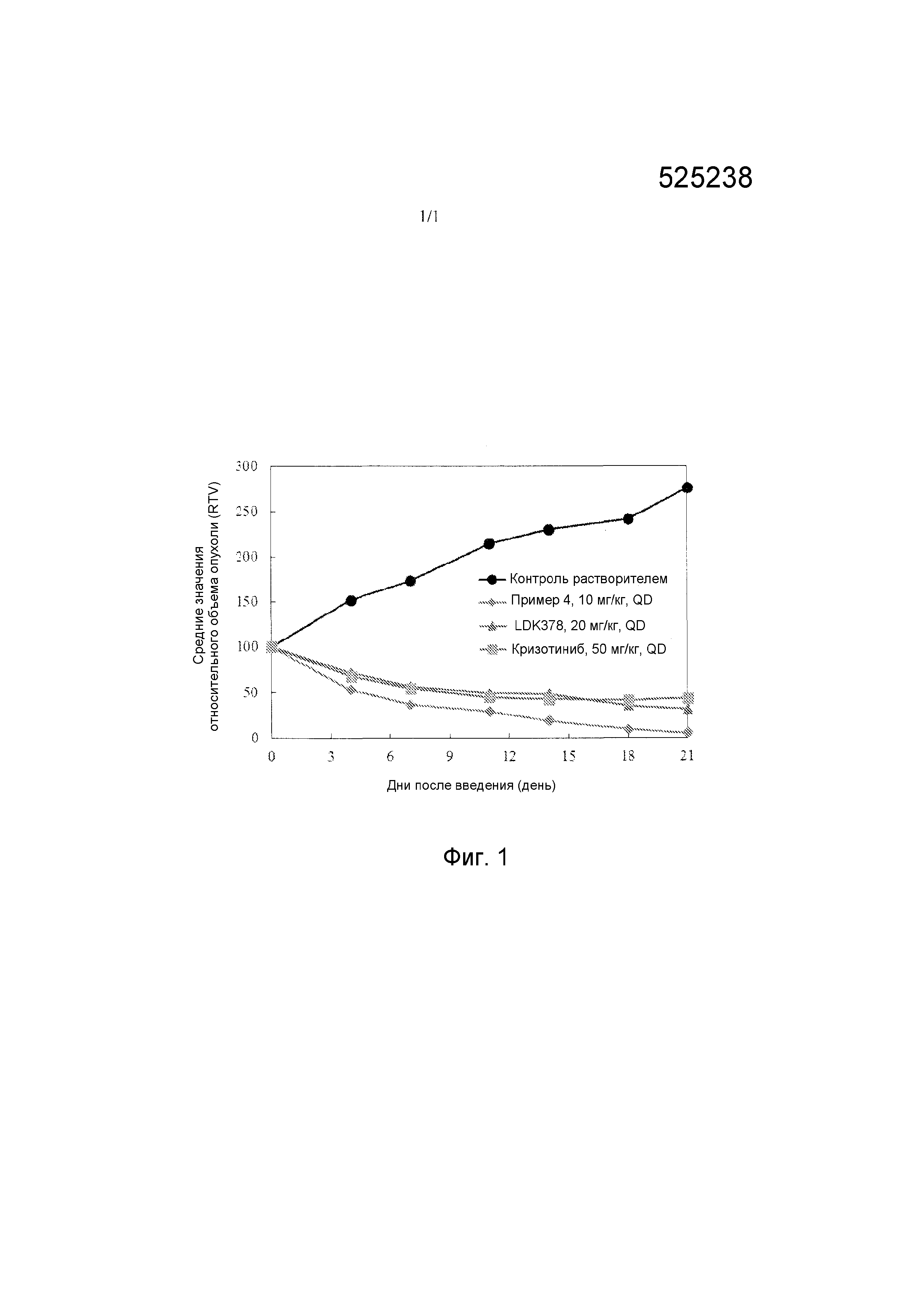
Фигура 1. Влияние соединения, раскрытого в настоящей заявке, на относительный объем опухоли.
В случае использования, в настоящем описании применимы следующие определения.
Термин "алкил" относится к разветвленным и насыщенным алифатическим углеводородным группам с нормальной цепью, которые содержат определенное количество атомов углерода. Если не указано иное, "алкил" относится к C1-10 алкилу. Например, C1-C10, как определено в "C1-10 алкиле", включает группы, содержащие 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода в нормальной или разветвленной конфигурации. Например, "C1-10 алкил" включает, без ограничения перечисленными, метил, этил, н-пропил, изопропил, н-бутил, т-бутил, изобутил, пентил, гексил, гептил, октил, нонил и децил.
Термин "циклоалкил" означает насыщенную алифатическую циклическую углеводородную группу, содержащую определенное количество атомов углерода. Если не указано иное, "циклоалкил" относится к C3-10 циклоалкилу. Например, "циклоалкил" включает, без ограничения перечисленными, циклопропил, метилциклопропил, 2,2-диметил-циклобутил, 2-этил-циклопентил и циклогексил.
Термин "алкенил" относится к неароматическому углеводородному радикалу, нормальному, разветвленнлму или циклическому, который содержит от 2 до 10 атомов углерода и по меньшей мере одну углерод-углеродную двойную связь. В некоторых вариантах осуществления присутствует одна углерод-углеродная двойная связь, при этом может присутствовать до четырех неароматических двойных углерод-углеродных связей. Таким образом, "C2-10 алкенил" обозначает алкенильный радикал, содержащий от 2 до 10 атомов углерода. Алкенильные группы включают, без ограничения перечисленными, винил, пропенил, бутенил, 2-метилбутенил и циклогексенил. Нормальная, разветвленная или циклическая часть алкенильной группы может содержать двойные связи и может быть замещена, если указана замещенная алкенильная группа.
Термин "алкинил" относится к углеводородному радикалу, нормальному, разветвленному или циклическому, который содержит от 2 до 10 атомов углерода и по меньшей мере одну углерод-углеродную тройную связь. В некоторых вариантах осуществления могут присутствовать до трех тройных углерод-углеродных связей. Таким образом, "C2-10 алкинил" обозначает алкинильный радикал, содержащий от 2 до 10 атомов углерода. Алкинильные группы включают, без ограничения перечисленными, этинил, пропинил, бутинил и 3-метилбутинил. Нормальная, разветвленная или циклическая часть алкинильной группы может содержать тройные связи и может быть замещена, если указана замещенная алкинильная группа.
Термин "алкокси" относится к циклической или к нециклической алкильной группе с указанным количеством атомов углерода, присоединенной через кислородный мостик, такой как, например, метокси, этокси, пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, пентокси, 2-пентилокси, изопентокси, неопентокси, гексокси, 2-гексокси, 3-гексокси, 3-метилпентокси, циклопропанилокси и циклобутилокси. "Алкокси", таким образом, охватывает определения алкила и циклоалкила выше.
Термин "арил" охватывает: 5- и 6-членные карбоциклические ароматические кольца, например, бензол; бициклические кольцевые системы, в которых по меньшей мере одно кольцо является карбоциклическим и ароматическим, например, нафталин, индан и 1,2,3,4-тетрагидрохинолин; и трициклические кольцевые системы, в которых по меньшей мере одно кольцо являются карбоциклическим и ароматическим, например, флуорен. В случаях, когда арильный заместитель является бициклическим или трициклическим, и по меньшей мере одно кольцо является неароматическим, подразумевается, что присоединение осуществляется через ароматическое кольцо.
Например, арил включает 5- и 6-членные карбоциклические ароматические кольца, конденсированные с 5-7-членным гетероциклическим кольцом, содержащим один или более гетероатомов, выбранных из N, O и S, при условии, что положение присоединения находится в карбоциклическом ароматическом кольце. Бивалентные радикалы, образованные из замещенных производных бензола и имеющие свободные валентности при атомах в кольце, называются замещенными фениленовыми радикалами. Бивалентные радикалы, получаемые из одновалентных полициклических углеводородных радикалов, названия которых оканчиваются на "-ил", в результате отщепления одного атома водорода от атома углерода со свободной валентностью, называют, добавляя "-иден" к названию соответствующего одновалентного радикала, например, нафтильную группу с двумя положениями присоединения называют нафтилиден. Арил, тем не менее, не охватывает и не перекрывается каким-либо образом с гетероарилом, отдельно определенным ниже. Следовательно, если одно или более карбоциклических ароматических колец конденсировано с гетероциклическим ароматическим кольцом, образующейся в результате кольцевой системой является гетероарил, а не арил, как определено в настоящем описании.
Термин "галоген" (или "гало") относится к фтору, хлору, брому и иоду.
Термин "гетероарил" относится к:
5-8-членным ароматическим, моноциклическим кольцам, содержащим один или больше, например от 1 до 4, или, в некоторых вариантах осуществления, от 1 до 3 гетероатомов, выбранных из N, O и С, при этом остальные атомы в кольце являются углеродом;
8-12-членным бициклическим кольцам, содержащим один или больше, например от 1 до 4, или, в некоторых вариантах осуществления, от 1 до 3 гетероатомов, выбранных из N, O и S, при этом остальные атомы в кольце являются углеродом, и где в ароматическом кольце присутствует по меньшей мере один гетероатом; и
11-14-членным трициклическим кольцам, содержащим один или больше, например от 1 до 4, или, в некоторых вариантах осуществления, от 1 до 3 гетероатомов, выбранных из N, O и S, при этом остальные атомы в кольце являются углеродом, и где в ароматическом кольце присутствует по меньшей мере один гетероатом.
Когда общее количество атомов S и O в гетероарильной группе превышает 1, эти гетероатомы не являются смежными друг с другом. В некоторых вариантах осуществления общее количество атомов S и O в гетероарильной группе не превышает 2. В некоторых вариантах осуществления общее количество атомов S и O в гетероарильной группе не превышает 1.
Примеры гетероарильных групп включают, без ограничения перечисленными (при нумерации от положения связи, приоритетно обозначенного 1), 2-пиридил, 3-пиридил, 4-пиридил, 2,3-пиразинил, 3,4-пиразинил, 2,4-пиримидинил, 3,5-пиримидинил, 1-пиразолил, 2,3-пиразолил, 2,4-имидазолинил, изоксазолил, оксазолил, тиазолил, тиадиазолил, тетразолил, тиенил, бензотиенил, фурил, бензофурил, бензоимидазолинил, индолинил, пиридизинил, триазолил, хинолинил, пиразолил и 5,6,7,8-тетрагидроизохинолин.
Другие гетероарильные группы включают, без ограничения перечисленными, пирролил, изотиазолил, триазинил, пиразинил, пиридазинил, индолил, бензотриазолил, хиноксалинил и изохинолинил. Как и в случае определения гетероцикла ниже, "гетероарил", как также подразумевается, включает N-оксидное производное любого азотсодержащего гетероарила.
Бивалентные радикалы, полученные из одновалентных гетероарильных радикалов, названия которых оканчивается на "-ил", в результате отщепления одного атома водорода от атома со свободной валентностью, называют, добавляя "-иден" к названию соответствующего одновалентного радикала, например, пиридильная группа с двумя положениями присоединения является пиридилиденом. Гетероарил не охватывает и не перекрывается с арилом, как определено выше.
В случаях, когда гетероарильный заместитель является бициклическим или трициклическим, и по меньшей мере одно кольцо является неароматическим или не содержит гетероатомов, подразумевается, что присоединение осуществляется через ароматическое кольцо или через кольцо, содержащее гетероатом, соответственно.
Термин "гетероцикл" (и его вариации, такие как "гетероциклический" или "гетероциклил") в целом относятся к одиночному алифатическому кольцу, обычно с 3-7 атомами в кольце, содержащему по меньшей мере 2 атома углерода в дополнение к 1-3 гетероатомам, независимо выбранным из кислорода, серы и азота, а также комбинаций, включающих по меньшей мере один из предыдущих гетероатомов. "Гетероцикл" также относится к 5-7-членному гетероциклическому кольцу, содержащему один или более гетероатомов, выбранных из N, O и S, конденсированному с 5- и 6-членным карбоциклическим ароматическим кольцом, при условии, что положение присоединения находится в гетероциклическом кольце. Кольца могут быть насыщенными или содержать одну или более двойных связей (то есть быть частично ненасыщенными). Гетероцикл может быть замещен оксогруппой. Положение присоединения может быть углеродом или гетероатомом в гетероциклическом кольце, при условии, что присоединение приводит к образованию стабильной структуры. Если гетероциклическое кольцо содержит заместители, подразумевается, что заместители могут быть присоединены к любому атому в кольце, гетероатому или атому углерода, при условии, что образующаяся в результате химическая структура является стабильной. Гетероцикл не перекрывается с гетероарилом.
Подходящие гетероциклы включают, например (при нумерации от положения связи, приоритетно обозначенного 1), 1-пирролидинил, 2-пирролидинил, 2,4-имидазолидинил, 2,3-пиразолидинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 1-пиперазинил, 2-пиперазинил и 2,5-пиперазинил. Также рассматриваются морфолинильные группы, включающие 2-морфолинил и 3-морфолинил (пронумерованные с приоритетным обозначением кислорода положением 1). Замещенный гетероцикл также включает кольцевые системы, замещенные одной или более оксогруппами, такими как пиперидинил-N-оксид, морфолинил-N-оксид, 1-оксо-1-тиоморфолинил и 1,1-диоксо-1-тиоморфолинил.
При использовании в настоящем описании, "арилалкил" относится к алкильной группе, замещенной арильной группой. Пример арилалкильной группы включает бензильную, фенэтильную и нафтилметильную группы. В некоторых вариантах осуществления арилалкильные группы содержат от 7 до 20 или 7-11 атомов углерода. При использовании во фразе "арил-C1-4 алкил", термин "C1-4" относится к алкильной части группы и не описывает количество атомов в арильной части группы. Аналогично, при использовании во фразе "арил-C1-10 алкил", термин "C1-10" относится к алкильной части группы и не описывает количество атомов в арильной части группы.
При использовании в настоящем описании, "гетероциклилалкил" относится к алкилу, замещенному гетероциклилом. При использовании во фразе "гетероциклил-C1-10 алкил", термин "C1-10" относится к алкильной части группы и не описывает количество атомов в гетероциклильной части группы.
При использовании в настоящем описании, "циклоалкилалкил" относится к алкилу, замещенному циклоалкилом. При использовании во фразе "C3-10 циклоалкилалкил", термин "C3-10" относится к циклоалкильной части группы и не описывает количество атомов в алкильной части группы. При использовании во фразе "C3-7 циклоалкилалкил", термин "C3-7" относится к циклоалкильной части группы и не описывает количество атомов в алкильной части группы. При использовании во фразе "C3-8 циклоалкилалкил", термин "C3-8" относится к циклоалкильной части группы и не описывает количество атомов в алкильной части группы. При использовании во фразе "циклоалкил-C1-10 алкил", термин "C1-10" относится к алкильной части группы и не описывает количество атомов в циклоалкильной части группы.
При использовании в настоящем описании, "гетероарилалкил" относится к алкилу, замещенному гетероарилом. При использовании во фразе "гетероарил-C1-4 алкил", термин "C1-4" относится к алкильной части группы и не описывает количество атомов в гетероарильной части группы. Аналогично, при использовании во фразе "гетероарил-C1-10 алкил", термин "C1-10" относится к алкильной части группы и не описывает количество атомов в гетероарильной части группы.
Во избежание неопределенности ссылка, например, на замещение алкила, циклоалкила, гетероциклила, арила и/или гетероарила относится к замещению каждой из указанных групп индивидуально, а также к замещениям комбинаций указанных групп. Таким образом, если R1 является арилалкилом, арильная часть может быть не замещена или замещена по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6b, и алкильная часть может также быть не замещена или замещена по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a.
Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические или органические основания и минеральные или органические кислоты. Соли, полученные из неорганических оснований, могут быть выбраны, например, из солей алюминия, аммония, кальция, меди, железа (III), железа (II), лития, магния, марганца (III), марганца (II), калия, натрия и цинка. Кроме того, например, фармацевтически приемлемые соли, полученные из неорганических оснований, могут быть выбраны из солей аммония, кальция, магния, калия и натрия. Соли в твердой форме могут существовать в одной или более кристаллических структурах и могут также находиться в форме гидратов. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, могут быть выбраны, например, из солей первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и катионообменные смолы, такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилен-диамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этил-морфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, тетрагидрооксазин, пиперазин, пиперидин, полиаминные смолы, новокаин, пурины, теобромин, триэтиламин, триметиламин и трипропиламин, трометамин.
В случае, когда соединение, раскрытое в настоящей заявке, является основным, соли могут быть получены при использовании по меньшей мере одной фармацевтически приемлемой нетоксичной кислоты, выбранной из минеральных и органических кислот. Такая кислота может быть выбрана, например, из уксусной, бензолсульфоновой, бензойной, камфорсульфоновой, лимонной, этансульфоновой, фумаровой, глюконовой, глутаминовой, бромоводородной, соляной, изэтиновой, молочной, малеиновой, яблочной, миндальной, метансульфоновой, муциновой, азотной, памовой, пантотеновой, фосфорной, янтарной, серной, винной и п-толуолсульфоновой кислот. В некоторых вариантах осуществления такая кислота может быть выбрана, например, из лимонной, бромоводородной, соляной, малеиновой, фосфорной, серной, фумаровой и винной кислот.
Термины "совместное введение" или "комбинированное введение" или подобное, при использовании в настоящем описании, как подразумевается, охватывают введение выбранных терапевтических средств отдельному пациенту и, как предполагается, включают схемы лечения, в которых средства не обязательно вводят одним и тем же путем введения или в одно и то же время.
Термин "фармацевтическая комбинация", при использовании в настоящем описании, относится к продукту, полученному в результате смешивания или объединения действующих веществ, и включает фиксированные и нефиксированные комбинации действующих веществ.
Термин "фиксированная комбинация" означает, что оба действующих вещества, например, соединение формулы (I) и дополнительное средство, вводят пациенту одновременно в форме одной единицы или дозы.
Термин "нефиксированная комбинация" означает, что оба действующих вещества, например, соединение формулы (I) и дополнительное средство, вводят пациенту в виде отдельных единиц одновременно, параллельно или последовательно без каких-либо определенных временных рамок, где такое введение обеспечивает создание терапевтически эффективных уровней действующих веществ в организме пациента. Последнее также относится к смешанной терапии, например, введению трех или более действующих веществ.
Термин "терапевтически эффективное количество" означает количество рассматриваемого соединения, которое вызовет биологическую или медицинскую реакцию в клетке, ткани, органе, организме, животном или человеке, которая требуется исследователю, ветеринару, лечащему врачу или другому клиницисту.
Термин "введение" в отношении рассматриваемого соединения означает предоставление соединения согласно описанию и его пролекарств субъекту, нуждающемуся в лечении.
Предполагается, что термин "композиция" при использовании в настоящем описании охватывает продукт, включающий указанные компоненты в указанном количестве, а также любой продукт, который получают, прямо или косвенно, из комбинации указанных компонентов в указанном количестве. Такой термин в отношении фармацевтической композиции охватывает продукт, включающий действующее вещество(а), и инертное вещество(а), которое составляет носитель, а также любой продукт, который получают, прямо или косвенно, из комбинации, в результате образования комплекса или агрегата любых двух или более веществ, или в результате диссоциации одного или более веществ, или в результате других типов реакций или взаимодействий одного или более веществ.
Под "фармацевтически приемлемым" понимается совместимый с другими компонентами композиции и не опасный для реципиента.
Термин "защитная группа" или "Pg" относится к заместителю, который обычно может использоваться для блокирования или защиты определенной функциональной группы с возможностью реакции с другими функциональными группами на соединении. Например, "аминозащитная группа" является заместителем, присоединяемым к аминогруппе, который блокирует или защищает функциональную аминогруппу в соединении. Подходящие аминозащитные группы включают, без ограничения перечисленными, ацетил, трифторацетил, т-бутоксикарбонил (BOC), бензилоксикарбонил (CBZ) и 9-флуоренилметиленоксикарбонил (Fmoc). Аналогичным образом, "гидроксизащитная группа" относится к заместителю гидроксильной группы, который блокирует или защищает функциональную гидроксильную группу. Подходящие защитные группы включают, без ограничения перечисленными, ацетил и силил. "Карбоксизащитная группа" относится к заместителю карбоксильной группы, который блокирует или защищает функциональную карбоксильную группу. Обычные карбоксизащитные группы включают -CH2CH2SO2Ph, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил, 2-(п-толуолсульфонил)этил, 2-(п-нитрофенилсульфенил)этил, 2-(дифенилфосфино)-этил, нитроэтил и т.п. По поводу общего описания защитных групп и их применения, см. T.W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991.
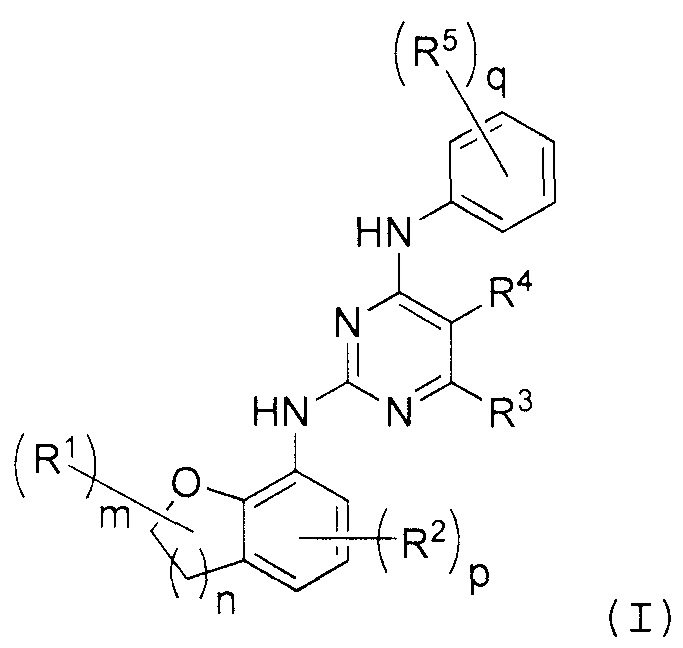
В одном варианте осуществления в настоящем описании раскрыто по меньшей мере одно соединение формулы (I):

и/или по меньшей мере одна его фармацевтически приемлемая соль, где
каждый R1 независимо выбран из:
водорода,
галогена,
гидроксила,
C1-10 алкила,
C3-10 циклоалкила,
C3-10 циклоалкил-алкила,
гетероциклила,
гетероциклилалкила,
арила,
арилалкила,
гетероарила и
гетероарилалкила,
где каждый алкил, циклоалкил и гетероциклил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, и где каждый арил и гетероарил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6b;
каждый R2 независимо выбран из:
водорода,
галогена,
гидроксила,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
C3-10 циклоалкила,
C3-10 циклоалкилалкила,
гетероциклила,
гетероциклилалкила,
гетероциклилкарбонила,
арила,
гетероарила,
арилалкила и
гетероарилалкила,
где каждый алкил, алкенил, алкинил, циклоалкил и гетероциклил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, и каждый арил и гетероарил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6b;
каждый R3 независимо выбран из:
водорода,
галогена,
-CN,
-NR7R8 и
C1-10 алкила;
где алкил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a;
каждый R4 независимо выбран из:
водорода,
галогена,
-CN,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила и
C3-10 циклоалкила;
где каждый C1-10 алкил, C2-10 алкенил, C2-10 алкинил и C3-10 циклоалкил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a;
или R3 и R4 вместе с атомами углерода, к которым они присоединены, образуют 5-6-членное кольцо, содержащее 0, 1, 2 или 3 гетероатома, независимо выбранных из кислорода, серы и азота, и необязательно замещены 1 - 2 группами R6b;
каждый R5 независимо выбран из:
водорода,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
C3-10 циклоалкила,
-OR8,
-NR7S(O)rR8,
-NO2,
галогена,
-S(O)rR7,
-SR8,
-S(O)2OR7,
-OS(O)2R8,
-S(O)rNR7R8,
-NR7R8,
-O(CR9R10)tNR7R8,
-C(O)R7,
-CO2R8,
-CO2(CR9R10)tCONR7R8,
-OC(O)R7,
-CN,
-C(O)NR7R8,
-NR7C(O)R8,
-OC(O)NR7R8,
-NR7C(O)OR8,
-NR7C(O)NR7R8,
-CR7(N-OR8),
-CHF2,
-CF3,
-OCHF2, и
-OCF3;
где каждый C1-10 алкил, C2-10 алкенил, C2-10 алкинил и C3-10 циклоалкил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a;
каждый R6a независимо выбран из:
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
C3-10 циклоалкила,
-OR8,
-NR7S(O)rR8,
-NO2,
галогена,
-S(O)rR7,
-SR8,
-S(O)2OR7,
-OS(O)2R8,
-S(O)rNR7R8,
-NR7R8,
-(CR9R10)tOR8,
-(CR9R10)tNR7R8,
-(CR9R10)tSR8,
-(CR9R10)tS(O)rR8,
-(CR9R10)tCO2R8,
-(CR9R10)tCONR7R8,
-(CR9R10)tNR7CO2R8,
-(CR9R10)tOCONR7R8,
-(CR9R10)tNR7CONR7R8,
-(CR9R10)tNR7SO2NR7R8,
-O(CR9R10)tNR7R8,
-C(O)R7,
-C(O)(CR9R10)tOR8,
-C(O)(CR9R10)tNR7R8,
-C(O)(CR9R10)tSR8,
-C(O)(CR9R10)tS(O)rR8,
-CO2R8,
-CO2(CR9R10)tCONR7R8,
-OC(O)R7,
-CN,
-C(O)NR7R8,
-NR7C(O)R8,
-OC(O)NR7R8,
-NR7C(O)OR8,
-NR7C(O)NR7R8,
-CR7 (N-OR8),
-CHF2,
-CF3,
-OCHF2 и
-OCF3;
каждый R6b независимо выбран из:
R6a,
арила,
арил-C1-4 алкила,
гетероарила и
гетероарилC1-4 алкила;
каждый R7 и каждый R8 независимо выбраны из:
водорода,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
циклоалкила,
циклоалкил-C1-10 алкила;
гетероциклила,
гетероциклил-C1-10 алкила,
арила,
гетероарила,
арил-C1-10 алкила и
гетероарил-C1-10 алкила;
где каждый алкил, алкенил, алкинил, циклоалкил и гетероциклил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, и каждый арил и гетероарил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6b; или
R7 и R8 вместе с атомом (ами), к которому они присоединены, образуют гетероциклическое 4-7 членное кольцо, содержащее 0, 1 или 2 дополнительных гетероатома, независимо выбранных из кислорода, серы и NR11,
каждый R7 и R8 может быть не замещен или замещен по атому углерода или азота по меньшей мере одним заместителем, например, одним, двумя или тремя заместителями, выбранными из R12;
каждый R9 и каждый R10 независимо выбраны из:
водорода,
C1-10 алкила,
C2-10 алкенила,
C2-10 алкинила,
циклоалкила,
циклоалкил-C1-10 алкила,
гетероциклила,
гетероциклил-C1-10 алкила,
арила,
гетероарила,
арил-C1-10 алкила и
гетероарил-C1-10 алкила; или
R9 и R10 вместе с углеродом, к которому они присоединены, образуют 3-7-членное кольцо, содержащее 0, 1 или 2 гетероатома, независимо выбранных из кислорода, серы и азота;
каждый R11 независимо выбран из:
водорода,
C1-10 алкила,
C3-10 циклоалкила,
C3-10 циклоалкил-C1-4 алкила,
гетероциклила,
гетероциклил-C1-4 алкила,
арила,
арил-C1-4 алкила,
гетероарила,
гетероарил-C1-4 алкила,
-S(O)rR7,
-C(O)R7,
-CO2R7,
-CO2(CR9R10)tCONR7R8, и
-C(O)NR7R8;
каждый R12 независимо выбран из:
галогена,
C1-10 алкила,
C3-10 циклоалкила,
C3-10 циклоалкилалкила,
гетероциклила,
гетероциклилалкила,
арила,
арил-C1-4 алкила,
гетероарила,
гетероарил-C1-4 алкила,
-OR7,
-NR7S(O)rR8,
-S(O)rR7,
-SR7,
-S(O)2OR7,
- OS(O)2R7,
-S(O)rNR7R8,
-NR7R8,
-O(CR9R10)tNR7R8,
-C(O)R7,
-CO2R8,
-CO2(CR9R10)tCONR7R8,
-OC(O)R7,
-CN,
-C(O)NR7R8,
-NR7C(O)R8,
-OC(O)NR7R8,
-NR7C(O)OR8,
-NR7C(O)NR7R8,
-CHF2,
-CF3,
-OCHF2 и
-OCF3;
каждое m независимо выбрано из 0, 1 и 2;
каждое n независимо выбрано из 1, 2 и 3;
каждое p независимо выбрано из 0, 1, 2 и 3;
каждое q независимо выбрано из 0, 1, 2 и 3;
каждое r независимо выбрано из 1 и 2;
каждое t независимо выбрано из 1, 2 и 3.
В некоторых вариантах осуществления каждый R1 независимо выбран из водорода и C1-10 алкила, где алкил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из гидроксила и C1-10 алкокси.
В некоторых вариантах осуществления R1 является водородом.
В некоторых вариантах осуществления каждый R1 независимо выбран из C1-10 алкила, где алкил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из гидроксила и C1-10 алкокси.
В некоторых вариантах осуществления R1 является метилом, гидроксиметилом или метоксиметилом.
В некоторых вариантах осуществления каждый R2 независимо выбран из C1-10 алкила, гетероциклилкарбонила и гетероциклила, где алкил и гетероциклил независимо не замещены или замещены по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, где R6a является таким, как описано выше.
В некоторых вариантах осуществления каждый R2 независимо выбран из C1-10 алкила и пиперидинила, которые не замещены или замещены по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, где R6a является таким, как описано выше.
В некоторых вариантах осуществления каждый R2 независимо выбран из метила и 4-пиперидинила, которые не замещены или замещены по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, где R6a является таким, как описано выше.
В некоторых вариантах осуществления каждый R2 независимо выбран из метила и 4-пиперидинила, где 4-пиперидинил не замещен или замещен по меньшей мере одним заместителем, например, одним, двумя, тремя или четырьмя заместителями, независимо выбранными из R6a, где R6a независимо выбран из C1-10 алкила, -C(O)R7, -S(O)rR7, -(CR9R10)tCO2R8, -C(O)(CR9R10)tNR7R8, -(CR9R10)tOR8, -(CR9R10)tCONR7R8, -(CR9R10)tS(O)rR8, -(CR9R10)tOR8, где R7, R8, R9, R10, t и r являются такими, как описано выше.
В некоторых вариантах осуществления R3 является водородом.
В некоторых вариантах осуществления каждый R4 независимо выбран из водорода, C1-10 алкила и галогена.
В некоторых вариантах осуществления каждый R4 независимо выбран из галогена.
В некоторых вариантах осуществления R4 является хлором.
В некоторых вариантах осуществления R3 и R4 вместе с атомами углерода, к которым они присоединены, образуют 5-членное кольцо, содержащее 2 атома азота, где 5-членное кольцо необязательно замещено 1 или 2 C1-10 алкилами.
В некоторых вариантах осуществления R3 и R4 вместе с атомами углерода, к которым они присоединены, образуют пиразоло.
В некоторых вариантах осуществления R5 является -S(O)rR7, где R7 и r являются такими, как описано выше.
В некоторых вариантах осуществления R5 является -S(O)2R7, где R7 выбран из C1-10 алкила.
В некоторых вариантах осуществления R5 является -S(O)2R7, где R7 является изопропилом.
В некоторых вариантах осуществления n равно 1.
В некоторых вариантах осуществления p равно 2.
В некоторых вариантах осуществления m равно 1.
В некоторых вариантах осуществления q равно 1.
Также предложено по меньшей мере одно соединение, выбранное из следующих:
N-4-(2-(изопропилсульфонил)фенил)-3-метил-N-6-(5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-1H-пиразоло[3,4-d]пиримидин-4,6-диамин;
N-4-(2-(изопропилсульфонил)фенил)-3-метил-N-6-(5-метил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-1H-пиразоло[3,4-d]пиримидин-4,6-диамин;
(R)-N-6-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензо-фуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин;
(R)-N-6-(2,5-диметил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин;
(S)-N-6-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин;
(S)-N-6-(2,5-диметил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин;
(7-(4-(2-(изопропилсульфонил)фениламино)-3-метил-1H-пиразоло[3,4-d]пиримидин-6-иламино)-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-2-ил)метанол;
N-4-(2-(изопропилсульфонил)фенил)-N-6-(2-(метоксиметил)-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин;
(R)-5-хлор-N-2-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)пири-мидин-2,4-диамин;
(R)-5-хлор-N-2-(2,5-диметил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)пирими-дин-2,4-диамин;
(S)-5-хлор-N-2-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)пирими-
дин-2,4-диамин;
(S)-5-хлор-N-2-(2,5-диметил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)пирими-дин-2,4-диамин;
5-хлор-N-4-(2-(изопропилсульфонил)фенил)-N-2-(5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)пиримидин-2,4-диамин;
5-хлор-N-4-(2-(изопропилсульфонил)фенил)-N-2-(5-метил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)пиримидин-2,4-диамин;
(S)-1-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)пиперидин-1-ил)этанон;
(R)-1-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)пиперидин-1-ил)этанон;
(S)-5-хлор-N-2-(2,5-диметил-4-(1-(метилсульфонил)пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фе-нил)пиримидин-2,4-диамин;
(R)-5-хлор-N-2-(2,5-диметил-4-(1-(метилсульфонил)пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фе-нил)пиримидин-2,4-диамин;
(S)-2-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)пиперидин-1-ил)уксусная кислота;
(R)-2-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)пиперидин-1-ил)уксусная кислота;
(S)-2-амино-1-(4-((S)-7-((5-хлор-4-((2-(изопропилсульфо-нил)фенил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидро-бензофуран-4-ил)пиперидин-1-ил)пропан-1-он;
(S)-2-амино-1-(4-((R)-7-((5-хлор-4-((2-(изопропилсульфо-нил)фенил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидро-бензофуран-4-ил)пиперидин-1-ил)пропан-1-он;
(R)-1-(4-((R)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)пропан-2-ол;
(S)-1-(4-((R)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)пропан-2-ол;
(S)-2-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)ацетамид;
(R)-2-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)ацетамид;
(S)-2-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-N,N-диметилацетамид;
(R)-2-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)пиперидин-1-ил)-N,N-диметилацетамид;
(S)-5-хлор-N-2-(2,5-диметил-4-(1-(2-(метилсульфонил)этил)пи-перидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропил-сульфонил)фенил)пиримидин-2,4-диамин;
(R)-5-хлор-N-2-(2,5-диметил-4-(1-(2-(метилсульфонил)этил)пи-перидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропил-сульфонил)фенил)пиримидин-2,4-диамин;
(S)-5-хлор-N-4-(2-(изопропилсульфонил)фенил)-N-2-(4-(1-(2-метоксиэтил)пиперидин-4-ил)-2,5-диметил-2,3-дигидробензофуран-7-ил)пиримидин-2,4-диамин;
(R)-5-хлор-N-4-(2-(изопропилсульфонил)фенил)-N-2-(4-(1-(2-метоксиэтил)пиперидин-4-ил)-2,5-диметил-2,3-дигидробензофуран-7-ил)пиримидин-2,4-диамин;
(R)-2-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)этанол;
(S)-2-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)этанол;
(R)-1-(4-((S)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)пропан-2-ол;
(S)-1-(4-((S)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)пропан-2-ол;
(R)-1-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-2-гидроксиэтанон;
(S)-1-(4-((R)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-2-гидроксипропан-1-он;
(R)-1-(4-((R)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-2-гидроксипропан-1-он;
(S)-метил-4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-карбоксилат;
(S)-этил-2-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)ацетат;
(S)-2-амино-1-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)этанон;
(S)-4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-карбоксамид;
(S)-1-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-2-(метиламино)этанон;
(S)-1-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-2-(диметиламино)этанон;
(S)-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)(пиперазин-1-ил)метанон;
(S)-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)(4-метилпиперазин-1-ил)метанон;
(S)-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)(морфолино)метанон;
(R)-1-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)пиперидин-1-ил)пропан-1-он;
(R)-1-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)пиперидин-1-ил)-2-метилпропан-1-он;
(R)-(4-(7-((5-хлор-4-((2-(изопропилсульфонил)фенил)ами-но)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензофуран-4-ил)пиперидин-1-ил)(циклопропил)метанон;
(R)-5-хлор-N-2-(4-(1-(этилсульфонил)пиперидин-4-ил)-2,5-диметил-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфо-нил)фенил)пиримидин-2,4-диамин;
(R)-5-хлор-N-4-(2-(изопропилсульфонил)фенил)-N-2-(4-(1-(изопропилсульфонил)пиперидин-4-ил)-2,5-диметил-2,3-дигидробензофуран-7-ил)пиримидин-2,4-диамин;
(R)-5-хлор-N-2-(4-(1-(циклопропилсульфонил)пиперидин-4-ил)-2,5-диметил-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфо-нил)фенил)пиримидин-2,4-диамин;
(R)-1-(4-((S)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-2-метоксипропан-1-он;
(R)-1-(4-((R)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-2-метоксипропан-1-он;
(S)-1-(4-((R)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-2-метоксипропан-1-он;
(S)-1-(4-((S)-7-((5-хлор-4-((2-(изопропилсульфонил)фе-нил)амино)пиримидин-2-ил)амино)-2,5-диметил-2,3-дигидробензо-фуран-4-ил)пиперидин-1-ил)-2-метоксипропан-1-он и их фармацевтически приемлемые соли.
Соединения, раскрытые в настоящей заявке, и их фармацевтически приемлемые соли демонстрируют ценные фармакологические свойства при тестировании in vitro в бесклеточных киназных анализах и в клеточных анализах, и поэтому могут применяться в качестве лекарственных средств.
В одном аспекте соединения формулы (I) могут ингибировать тирозинкиназную активность ALK и слитого белка NPM-ALK. Эта протеинтирозинкиназа образуется в результате слияния генов нуклеофосмина (NPM) и ALK, что делает протеинтирозинкиназную активность ALK лиганд-независимой. NPM-ALK играет важную роль в передаче сигналов во многих гемопоэтических и других клетках человека, приводя к возникновению гематологических и неопластических заболеваний, например, анапластической крупноклеточной лимфомы (ALCL) и неходжкинской лимфомы (NHL), в частности ALK+NHL или ALKом, воспалительных миофибробластных опухолей (IMT) и нейробластом (Duyster et al. 2001 Oncogene 20, 5623-5637). В дополнение к NPM-ALK при гематологических и неопластических заболеваниях человека были идентифицированы другие слитые гены, например, TPM3-ALK (слитый ген немышечного тропомиозина с ALK).
Ингибирование тирозинкиназной активности ALK может быть продемонстрировано с использованием известных методов, например, при использовании рекомбинантного киназного домена ALK по аналогии с VEGF-R киназным тестом, описанным в J. Wood et al. Cancer Res. 60, 2178-2189 (2000). Как правило, in vitro ферментные анализы с использованием протеинтирозинкиназы GST-ALK проводят в 96-луночных планшетах как анализы связывания на мембранах в 20 мМ Tris HCl, pH=7,5, 3 мМ MgCl2, 10 мМ MnCl2, 1 мМ DTT, 0,1 μКи/анализ (=30 л) [γ−33P]-АТФ, 2 M АТФ, 3 г/мл поли-(Glu,Tyr 4:1) Poly-EY (Сигма P-0275), 1% ДМСО, 25 нг фермента ALK. Тесты инкубируют в течение 10 минут при температуре окружающей среды. Реакции останавливают, добавляя 50 л 125 мМ ЭДТА и переносят реакционную смесь в планшет MAIP Multiscreen (Millipore, Bedford, Mass., USA), предварительно увлажненный метанолом и регидратированный в течение 5 минут H2O. После промывки (0,5% H3PO4) планшеты считывают в жидкостном сцинтилляционном счетчике. Значения IC50 вычисляют с помощью линейного регрессионного анализа процента ингибирования.
Соединения формулы (I) могут эффективно ингибировать рост мышиных клеток BaF3 (DSMZ Deutsche Sammiung von Mikroorganismen und Zellkulturen GmbH, Germany), оверэкспрессирующих человеческую NPM-ALK. Экспрессия NPM-ALK может быть достигнута путем трансфекции клеточной линии BaF3 вектором экспрессии pClneo™ (Promega Corp., Madison Wis., USA), кодирующим NPM-ALK, и последующего отбора клеток, устойчивых к G418. Не трансфицированные клетки BaF3 зависят от IL-3, необходимого для выживания клеток. Напротив, клетки BaF3, экспрессирующие NPM-ALK (в дальнейшем называемые BaF3-NPM-ALK), могут пролиферировать в отсутствие IL-3, потому что они получают пролиферативный сигнал посредством киназы NPM-ALK. Предполагаемые ингибиторы киназы NPM-ALK, таким образом, блокируют сигнал роста и могут приводить к антипролиферативной активности. Антипролиферативная активность предполагаемых ингибиторов киназы NPM-ALK, впрочем, может быть преодолена добавлением IL-3, который обеспечивает сигналы роста через NPM-ALK-независимый механизм. Также была описана аналогичная клеточная система с использованием киназы FLT3 (см. E Weisberg et al., Cancer Cell; 1, 433-443 (2002)).
Ингибиторная активность соединений изобретения может быть определена следующим образом. В общем, клетки BaF3-NPM-ALK (15000/лунка микротитровального планшета) переносят в 96-луночные микротитровальные планшеты. Тестируемые соединения, растворенные в диметилсульфоксиде (ДМСО), добавляют в серии концентраций (серии разведений) таким образом, что конечная концентрация ДМСО не превышает 1% (об/об). После добавления планшеты инкубируют в течение двух дней, в течение которых контрольные культуры без тестируемого соединения способны пройти два цикла клеточного деления. Рост клеток BaF3-NPM-ALK измеряют посредством окрашивания YOPRO™ [T Idziorek et al. J. Immunol. Methods; 185: 249-258 (1995)]: 25 л лизисного буфера, содержащего 20 мМ цитрата натрия, pH 4,0, 26,8 мМ хлорида натрия, 0,4% NP40, 20 мМ ЭДТА и 20 мМ, добавляют в каждую лунку. Лизис клеток завершается в течение 60 минут при комнатной температуре, и общее количество YOPRO™, связанного с ДНК, определяют путем измерения с использованием спектрофотометра для сканирования 96-луночных планшетов Cytofluor II (PerSeptive Biosystems) со следующими параметрами настройки: возбуждение (нм) 485/20 и эмиссия (нм) 530/25.
Значения IC50 могут быть определены с помощью компьютерной системы при использовании следующей фомулы: IC50=[(ABS тест − ABS старт)/(ABS контроль − ABS старт)]×100. (ABS=поглощение)
Значение IC50 в этих экспериментах приводят в качестве такой концентрации тестируемого соединения, которая приводит к количеству клеток, которое на 50% ниже, чем количество клеток, полученное при использовании контроля без ингибитора. Соединения согласно описанию, в свободной форме или в форме фармацевтически приемлемой соли, могут демонстрировать ценные фармакологические свойства, например, как показано в тестах in vitro, описанных в настоящей заявке. В целом, соединения согласно описанию имеют значения IC50 от меньше 1 нМ до 10 M. В некоторых примерах соединения согласно описанию имеют значения IC50 от меньше 1 нМ до 500 нМ. В других примерах соединения согласно описанию имеют значения IC50 от <1 нМ до 200 нМ.
Антипролиферативное действие соединений изобретения также может быть определено в линии клеток лимфомы человека KARPAS-299 (DSMZ Deutsche Sammiung von Mikroorganismen und Zellkulturen GmbH, Braunschweig, Germany, описанной в WG Dirks et al. Int. J. Cancer 100, 49-56 (2002)) с использованием такой же методики, описанной выше для клеточной линии BaF3-NPM-ALK. В некоторых вариантах осуществления соединения, раскрытые в настоящей заявке, могут демонстрировать ингибирующую активность с IC50 приблизительно в пределах от меньше 1 нМ до 1 M. Действие соединений изобретения на автофосфорилирование ALK может быть определено на линии клеток лимфомы человека KARPAS-299 посредством иммуноблоттинга, как описано в WG Dirks et al., Int. J. Cancer 100, 49-56 (2002).
В соответствии с вышеизложенным, в настоящем описании предложены:
(1) соединение, раскрытое в настоящей заявке, для применения в качестве лекарственного средства;
(2) соединение, раскрытое в настоящей заявке, для применения в качестве ингибитора ALK, например, для применения при любом из конкретных показаний, представленных выше;
(3) фармацевтическая композиция, например, для применения при любом из показаний, представленных выше, включающая по меньшей мере одно соединение, раскрытое в настоящей заявке, в качестве действующего вещества вместе с одним или более фармацевтически приемлемыми разбавителями или носителями;
(4) способ лечения любого конкретного показания, представленного выше, у субъекта, нуждающегося в этом, который включает введение эффективного количества по меньшей мере одного соединения, раскрытого в настоящей заявке, или по меньшей мере одной фармацевтической композиции, включающей его;
(5) применение соединения, раскрыло в настоящей заявке, для изготовления лекарственного средства для лечения или профилактики заболевания или состояния, при котором играет роль или задействована активация ALK;
(6) способ, как определено выше в (4), включающий совместное введение, например параллельно или последовательно, терапевтически эффективного количества соединения, раскрытого в настоящей заявке, и одного или более дополнительных лекарственных веществ, где указанное дополнительное лекарственное вещество применяется при любом из конкретных показаний, представленных выше;
(7) композиция, включающая терапевтически эффективное количество по меньшей мере одного соединения, раскрытого в настоящей заявке, и по меньшей мере одного дополнительного лекарственного вещества, где указанное дополнительное лекарственное вещество применяется при любом из конкретных показаний, представленных выше;
(8) применение соединения, раскрытого в настоящей заявке, для изготовления лекарственного средства для лечения или профилактики заболевания, которое отвечает на ингибирование киназы анапластической лимфомы;
(9) применение согласно (8), где заболевание, подвергаемое лечению, выбрано из анапластической крупноклеточной лимфомы, неходжкинских лимфом, воспалительных миофибробластных опухолей, нейробластом и неопластических заболеваний;
(10) применение согласно (8) или (9), где соединение является фармацевтически приемлемой солью любого из примеров, раскрытых в настоящей заявке;
(11) способ лечения заболевания, которое отвечает на ингибирование киназы анапластической лимфомы, такого как заболевание, выбранное из анапластической крупноклеточной лимфомы, неходжкинских лимфом, воспалительных миофибробластных опухолей, нейробластом и неопластических заболеваний, включающий введение эффективного количества по меньшей мере одного соединения, раскрытого в настоящей заявке, и/или его фармацевтически приемлемой соли. В некоторых примерах соединения согласно описанию могут применяться отдельно или в комбинации с химиотерапевтическим средством для лечения клеточного пролиферативного нарушения, включающего, без ограничения перечисленными, лимфому, остеогенную саркому, меланому или опухоль молочной железы, почки, предстательной железы, колоректальную опухоль, опухоль щитовидной железы, яичника, поджелудочной железы, нейронную, легочную, маточную или желудочно-кишечную опухоль.
Введение и фармацевтические композиции
В целом, соединения согласно описанию будут вводить в терапевтически эффективном количестве посредством любого из стандартных и приемлемых способов, известных в уровне техники, отдельно или в комбинации с одним или более терапевтическими средствами. Терапевтически эффективное количество может изменяться в широких пределах в зависимости от тяжести заболевания, возраста и относительного состояния здоровья субъекта, активности используемого соединения, а также других факторов, известных средним специалистам в данной области. Например, для лечения неопластических заболеваний и нарушений иммунной системы, необходимая дозировка также будет изменяться в зависимости от способа введения, конкретного состояния, подвергаемого лечению, и требуемого эффекта.
В целом, удовлетворительные результаты получают при системном введении в ежедневной дозировке от приблизительно 0,001 до приблизительно 100 мг/кг массы тела или, в частности, от приблизительно 0,03 до 2,5 мг/кг массы тела. Указанная ежедневная дозировка у более крупного млекопитающего, например человека, может находиться в пределах от приблизительно 0,5 мг до приблизительно 2000 мг или, более конкретно, от приблизительно 0,5 мг до приблизительно 100 мг, с удобным введением, например, в разделенных дозах, до четырех раз в день, или в форме пролонгированного действия. Подходящие единичные лекарственные формы для перорального введения содержат от приблизительно 1 до 50 мг действующего вещества.
Соединения согласно описанию можно вводить в качестве фармацевтических композиций любым обычным путем, например, энтерально, например, перорально, например, в форме таблеток или капсул; парентерально, например, в форме растворов или суспензий для инъекций; или наружно, например, в форме лосьонов, гелей, мазей или кремов, или в форме для назального введения или суппозиториев.
Фармацевтические композиции, включающие соединение настоящего описания в свободной форме или в форме фармацевтически приемлемой соли в сочетании по меньшей мере с одним фармацевтически приемлемым носителем или разбавителем, могут быть изготовлены обычным способом с применением процессов смешивания, гранулирования, нанесения покрытия, растворения или лиофилизации. Например, фармацевтические композиции, включающие соединение согласно описанию в сочетании по меньшей мере с одним фармацевтическим приемлемым носителем или разбавителем, могут быть изготовлены обычным способом путем смешивания с фармацевтически приемлемым носителем или разбавителем. Единичные лекарственные формы для перорального введения содержат, например, от приблизительно 0,1 мг до приблизительно 500 мг действующего вещества.
В одном варианте осуществления фармацевтические композиции представляют собой растворы действующего вещества, включая суспензии или дисперсии, такие как изотонические водные растворы. В случае лиофилизированных композиций, включающих действующее вещество отдельно или вместе с носителем, таким как маннит, дисперсия или суспензии могут быть приготовлены перед применением. Фармацевтические композиции могут быть стерилизованными и/или содержать вспомогательные вещества, такие как консерванты, стабилизаторы, смачивающие вещества или эмульгаторы, ускорители растворения, соли для регуляции осмотического давления и/или буферные вещества. Подходящие консерванты включают, без ограничения перечисленными, антиоксиданты, такие как аскорбиновую кислоту, или бактерицидные вещества, такие как сорбиновую кислоту или бензойную кислоту. Растворы или суспензии могут дополнительно включать загустители, включающие, без ограничения перечисленными, натрий карбоксиметилцеллюлозу, карбоксиметилцеллюлозу, декстран, поливинилпирролидон, желатин, или солюбилизаторы, например. Tween 80 (полиэтиленоксид(20)сорбитан моноолеат).
Суспензии в масле могут включать в качестве масляного компонента растительные, синтетические или полусинтетические масла, стандартные для инъекций. Примеры включают жидкие сложные эфиры жирных кислот, которые содержат в качестве кислотного компонента длинноцепочечную жирную кислоту с длиной цепи от 8 до 22 атомов углерода или, в некоторых вариантах осуществления, от 12 до 22 атомов углерода. Подходящие жидкие сложные эфиры жирных кислот включают, без ограничения перечисленными, лауриновую кислоту, тридекановую кислоту, миристиновую кислоту, пентадекановую кислоту, пальмитиновую кислоту, маргариновую кислоту, стеариновую кислоту, арахиновую кислоту, бегеновую кислоту или соответствующие ненасыщенные кислоты, например, олеиновую кислоту, элаидиновую кислоту, эруковую кислоту, брассидиновую кислоту и линолевую кислоту, и, в случае необходимости, могут содержать антиоксиданты, например витамин E, 3-каротин или 3,5-ди-трет-бутил-гидрокситолуол. Спиртовой компонент этих сложных эфиров жирных кислот может содержать шесть атомов углерода и может быть одноатомным или многоатомным, например одно-, двух- или трехатомным, спиртом. Подходящие спиртовые компоненты включают, без ограничения перечисленными, метанол, этанол, пропанол, бутанол или пентанол, или их изомеры; гликоль и глицерин.
Другие подходящие сложные эфиры жирных кислот включают, без ограничения перечисленными, этилолеат, изопропилмиристат, изопропилпальмитат, LABRAFIL® M 2375 (полиоксиэтиленглицерин), LABRAFIL® M 1944 CS (ненасыщенные полигликолизированные глицериды, полученные спиртовым гидролизом масла из косточек плодов абрикоса и содержащие глицериды и сложный эфир полиэтиленгликоля), LABRASOL™ (насыщенные полигликолизированные глицериды, полученные спиртовым гидролизом TCM и содержащие глицериды и сложный эфир полиэтиленгликоля; все производства от GaKefosse, France) и/или MIGLYOL® 812 (триглицерид насыщенных жирных кислот с длиной цепи C8-C12 производства Hüls AG, Germany), и растительные масла, такие как хлопковое масло, миндальное масло, оливковое масло, касторовое масло, кунжутное масло, соевое масло или масло арахиса.
Фармацевтические композиции для перорального введения могут быть получены, например, путем объединения действующего вещества с одним или более твердыми носителями и, в случае необходимости, гранулирования полученной смеси и обработки смеси или гранул посредством включения дополнительных вспомогательных веществ, с формированием таблеток или ядер таблеток.
Подходящие носители включают, без ограничения перечисленными, такие наполнители, как сахара, например, лактозу, сахарозу, маннит или сорбит, препараты целлюлозы и/или фосфаты кальция, например, фосфат трикальция или гидрофосфат кальция, а также связующие вещества, такие как крахмалы, например, кукурузный, пшеничный, рисовый или картофельный крахмал, метилцеллюлозу, гидроксипропилметилцеллюлозу, натрий карбоксиметилцеллюлозу и/или поливинилпирролидон, и/или, в случае необходимости, разрыхлители, такие как вышеуказанные крахмалы, карбоксиметилкрахмал, сшитый поливинилпирролидон, альгиновую кислоту или ее соль, такую как альгинат натрия. Дополнительные вспомогательные вещества включают вещества, повышающие текучесть, и смазывающие вещества, например, кремневую кислоту, тальк, стеариновую кислоту или ее соли, такие как стеарат магния или кальция, и/или полиэтиленгликоль, или их производные.
Ядра таблеток можно снабдить подходящими, необязательно кишечнорастворимыми, оболочками при использовании, помимо прочего, концентрированных растворов сахаров, которые могут содержать гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, или пленкообразующих растворов в подходящих органических растворителях или смесях растворителей, или, для получения кишечнорастворимых оболочек, растворов подходящих препаратов целлюлозы, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. Красители или пигменты могут быть добавлены в таблетки или оболочки таблеток, например, в целях идентификации или указания различных доз действующего вещества.
Фармацевтические композиции для перорального введения могут также включать твердые капсулы, содержащие желатин, или мягкие герметичные капсулы, содержащие желатин и пластификатор, такой как глицерин или сорбит. Твердые капсулы могут содержать действующее вещество в форме гранул, например, в смеси с наполнителями, такими как кукурузный крахмал, связующие вещества и/или скользящие вещества, такие как тальк или стеарат магния, и, необязательно, стабилизаторы. В мягких капсулах действующее вещество может быть растворено или суспендировано в подходящих жидких вспомогательных веществах, таких как нелетучие жидкие масла, вазелиновое масло или жидкие полиэтиленгликоли, или сложные эфиры жирных кислот и этилена или пропиленгликоля, к которым также могут быть добавлены стабилизаторы и детергенты, например, полиоксиэтиленсорбитан жирнокислотно-сложноэфирного типа.
Фармацевтические композиции, подходящие для ректального введения, представляют собой, например, суппозитории, включающие комбинацию действующего вещества и суппозиторной основы. Подходящими суппозиторными основами являются, например, природные или синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие алканолы.
Фармацевтические композиции, подходящие для парентерального введения, могут включать водные растворы действующего вещества в водорастворимой форме, например, водорастворимой соли, или водные суспензии для инъекций, которые содержат загустители, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран, и, в случае необходимости, стабилизаторы. Действующее вещество, необязательно вместе со вспомогательными веществами, может также быть в форме лиофилизата и может быть переведено в раствор перед парентеральным введением путем добавления подходящих растворителей. Растворы, такие, которые используются, например, для парентерального введения, могут также использоваться в качестве растворов для инфузий. Производство препаратов для инъекций обычно осуществляется в стерильных условиях, как в случае заполнения, например, ампул или флаконов, и укупорки емкостей.
Соединения согласно описанию могут применяться в виде отдельного действующего вещества или вместе с другими лекарственными средствами, применяемыми при неопластических заболеваниях или применяемыми в иммуномодулирующих схемах. Например, соединения согласно описанию могут применяться в соответствии с описанием в комбинации с фармацевтическими композициями, эффективными при различных заболеваниях, как описано выше, например, с циклофосфамидом, 5-фтороурацилом, флударабином, гемцитабином, цисплатином, карбоплатином, винкристином, винбластином, этопозидом, иринотеканом, паклитакселом, доцетакселом, ритуксаном, доксорубицином, гефитинибом или иматинибом; или также с циклоспоринами, рапамицинами, аскомицинами или их иммунодепрессивными аналогами, например, циклоспорином A, циклоспорином G, FK-506, сиролимусом или эверолимусом, кортикостероидами, например преднизоном, циклофосфамидом, азатиопреном, метотрексатом, солями золота, сульфасалазином, противомалярийными средствами, бреквинаром, лефлуномидом, мизорибином, микофеноловой кислотой, микофенолата мофетилом, 15-дезоксиспергуалином, иммунодепрессивными моноклональными антителами, например, моноклональными антителами к рецепторам лейкоцитов, например, MHC, CD2, CD3, CD4, CD7, CD25, CD28, CD40, CD45, CD58, CD80, CD86, CD152, CD137, CD154, ICOS, LFA-1, VLA-4, или их лигандами, или другими иммуномодулирующими соединениями, например, CTLA41g.
В описании также предложены фармацевтические комбинации, например, набор, включающий: a) первое средство, которое является соединением согласно описанию, как раскрыто в настоящей заявке, в свободной форме или в форме фармацевтически приемлемой соли, и b) по меньшей мере одно дополнительное средство. Набор может включать инструкции по применению.
ПРИМЕРЫ
Для синтеза по меньшей мере одного соединения формулы (I) и/или по меньшей мере одной его фармацевтически приемлемой соли могут быть разработаны различные способы. Репрезентативные способы синтеза по меньшей мере одного соединения формулы (I) и/или по меньшей мере одной его фармацевтически приемлемой соли представлены в разделе Примеры. Впрочем, следует отметить, что по меньшей мере одно соединение формулы (I) и/или по меньшей мере одна его фармацевтически приемлемая соль также могут быть синтезированы другими способами синтеза, которые могут разработать другие специалисты.
Будет очевидно, что некоторые соединения формулы (I) имеют атомы, связанные с другими атомами связями, которые придают соединению специфическую стереохимию (например, хиральные центры). Известно, что синтез по меньшей мере одного соединения формулы (I) и/или по меньшей мере одной его фармацевтически приемлемой соли может привести к получению смесей различных стереоизомеров (энантиомеры, диастереомеры). Если конкретная стереохимия не определена, перечисление соединений охватывает все различные возможные стереоизомеры.
По меньшей мере одно соединение формулы (I) может быть также получено в виде фармацевтически приемлемой соли присоединения кислоты, например, в результате реакции соответствующей формы свободного основания по меньшей мере одного соединения с фармацевтически приемлемой минеральной или органической кислотой. В альтернативе соответствующая фармацевтически приемлемая соль присоединения основания по меньшей мере одного соединения формулы (I) может быть получена, например, в результате реакции соответствующей формы свободной кислоты по меньшей мере одного соединения с фармацевтически приемлемым неорганическим или органическим основанием. Минеральные и органические кислоты и основания, подходящие для получения фармацевтически приемлемых солей соединений формулы (I), представлены в разделе определений настоящей заявки. В альтернативе солевые формы соединений формулы (I) могут быть получены при использовании солей исходных или промежуточных соединений.
Формы свободных кислот или свободных оснований соединений формулы (I) могут быть получены из соответствующей формы соли присоединения основания или соли присоединения кислоты. Например, соединение формулы (I) в форме соли присоединения кислоты может быть превращено в соответствующее свободное основание при обработке подходящим основанием (например, раствором гидроксида аммония, гидроксида натрия и т.п.). Соединение формулы (I) в форме соли присоединения основания может быть превращено в соответствующую свободную кислоту, например, при обработке подходящей кислотой (например, соляной кислотой и т.д.).
N-оксиды по меньшей мере одного соединения формулы (I) и/или по меньшей мере одной его фармацевтически приемлемой соли могут быть получены способами, известными средним специалистам в данной области. Например, N-оксиды могут быть получены при обработке неокисленной формы соединения формулы (I) окислителем (например, трифторпероксиуксусной кислотой, пероксималеиновой кислотой, пероксибензойной кислотой, пероксиуксусной кислотой, мета-хлорпероксибензойной кислотой или подобным) в подходящем инертном органическом растворителе (например, галогенированном углеводороде, таком как дихлорметан) при температуре от приблизительно 0 до 80°C. В альтернативе N-оксиды соединений формулы (I) могут быть получены из N-оксида подходящего исходного соединения.
Соединения формулы (I) в неокисленной форме могут быть получены из N-оксидов соединений формулы (I), например, при обработке восстановителем (например, серой, диоксидом серы, трифенилфосфином, борогидридом лития, борогидридом натрия, трихлоридом, трибромидом фосфора и т.п.) в подходящем инертном органическом растворителе (например, ацетонитриле, этаноле, водном диоксане и т.п.) при температуре от 0 до 80°C.
Защищенные производные соединений формулы (I) могут быть получены методами, известными средним специалистам в данной области. Подробное описание методик, применимых для создания защитных групп и их удаления, можно найти в T.W. Greene, Protecting Groups in Organic Synthesis, 3rd edition, John Wiley & Sons, Inc. 1999.
По меньшей мере одно соединение формулы (I) и/или по меньшей мере одна его фармацевтически приемлемая соль могут быть удобно получены в форме сольватов (например, гидратов). Гидраты по меньшей мере одного соединения формулы I и/или по меньшей мере одной его фармацевтически приемлемой соли могут быть удобно получены при перекристаллизации из водной смеси/смеси органических растворителей с использованием таких органических растворителей, как диоксан, тетрагидрофуран и/или метанол.
Соединения формулы (I) также могут быть получены в виде соответствующих индивидуальных стереоизомеров при взаимодействии рацемической смеси соединений с оптически активным разделяющим агентом, с образованием пары диастереоизомерных соединений, путем разделения диастереомеров и выделения оптически чистого энантиомера. Хотя разделение энантиомеров может быть выполнено при использовании ковалентных диастереомерных производных соединений, предпочтительными являются диссоциируемые комплексы (например, кристаллические диастереоизомерные соли). Диастереомеры обладают разными физическими свойствами (например, температурой плавления, температурой кипения, растворимостью, реакционная способностью и т.д.) и могут быть легко разделены при использовании таких различий. Диастереомеры могут быть разделены с помощью хроматографии или, например, методик отделения/разделения, основанных на различиях в растворимости. Оптически чистый энантиомер затем выделяют вместе с разделяющим агентом любыми практическими способами, которые не приведут к рацемизации. Более подробное описание методик, применяемых для разделения стереоизомеров соединений из их рацемической смеси, можно найти в Jean Jacques Andre Collet, Samuel H. Wilen, Enantiomers, Racemates and Resolutions, John Wiley & Sons, Inc. (1981).
При использовании в настоящем описании условные знаки и обозначения, используемые в этих процессах, схемах и примерах, соответствуют используемым в современной научной литературе, например, Journal of the American Chemical Society или Journal of Biological Chemistry. Стандартные однобуквенные или трехбуквенные сокращения обычно используются для обозначения аминокислотных остатков, которые, как предполагается, находятся в L-конфигурации, если не отмечено иное. Если не отмечено иное, все исходные соединения были получены от коммерческих поставщиков и использовались без дополнительной очистки. Например, следующие сокращения могут использоваться в примерах и по всему тексту описания: г (граммы); мг (миллиграммы); л (литры); мл (миллилитры); л (микролитры); psi (фунтов на квадратный дюйм); М (молярный); мМ (миллимолярный); в/в (внутривенный); Гц (Герц); МГц (мегагерц); моль (моли); ммоль (миллимоли); кт (комнатная температура); мин (минуты); ч (часы); Т.пл. (температура плавления); ТСХ (тонкослойная хроматография); Rt (время удержания); RP (обращенная фаза); MeOH (метанол); i-PrOH (изопропанол); ТЭА (триэтиламин); ТФУ (трифторуксусная кислота); ТФУА (трифторуксусный ангидрид); ТГФ (тетрагидрофуран); ДМСО (диметилсульфоксид); EtOAc (этилацетат); DME (1,2-диметоксиэтан); ДХМ (дихлорметан); DCE (дихлорэтан); ДМФА (N,N-диметилформамид); DMPU (N,N'-диметилпропиленмочевина); CDI (1,1-карбонилдиимидазол); IBCF (изобутилхлорформиат); HOAc (уксусная кислота); HOSu (N-гидроксисукцинимид); HOBT (1-гидроксибензотриазол); Et2O (диэтиловый эфир); EDCI (1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид); BOC (трет-бутилоксикарбонил); FMOC (9-флуоренилметоксикарбонил); DCC (дициклогексилкарбодиимид); CBZ (бензилоксикарбонил); Ac (ацетил); атм. (атмосфера); TMSE (2-(триметилсилил)этил); TMS (триметилсилил); TIPS (триизопропилсилил); TBS (т-бутилдиметилсилил); DMAP (4-диметиламинопиридин); Me (метил); OMe (метокси); Et (этил); tBu (трет-бутил); ВЭЖХ (высокоэффективная жидкостная хроматография); BOP (бис(2-оксо-3-оксазолидинил)фосфинхлорид); TBAF (тетра-н-бутиламмонийфторид); м-ХПБК (мета-хлорпероксибензойная кислота).
Ссылки на эфир или Et2O относятся к диэтиловому эфиру; рассол относится к насыщенному водному раствору NaCl. Если не указано иное, все температуры выражены в °C (градусах Цельсия). Все реакции проводили в инертной атмосфере при КТ, если не отмечено иное.
Спектры 1H-ЯМР регистрировали на Varian Mercury Plus 400. Химические сдвиги выражены в миллионных долях (м.д.). Константы взаимодействия указаны в герцах (Гц). Картины расщепления описывают кажущееся расщепление и обозначаются как s (синглет), d (дуплет), t (триплет), q (квартет), m (мультиплет) и br (широкий).
Масс-спектры (MS) низкого разрешения и данные чистоты соединений были получены на одноквадрупольной системе Shimadzu ЖХ/МС, оборудованной источником ионизации электрораспылением (ESI), УФ-детектором (220 и 254 нм) и испарительным детектором светорассеяния (ELSD). Тонкослойную хроматографию выполняли на 0,25 мм пластинах с силикагелем E. Merck (60F-254), с визуализацией УФ-излучением, 5% раствором фосфомолибденовой кислоты в этаноле, раствором нингидрина или а-анисового альдегида. Колоночную флеш-хроматографию выполняли на силикагеле (230-400 меш, Merck).
Схемы синтеза
По меньшей мере одно соединение формулы (I) и/или по меньшей мере одна его фармацевтически приемлемая соль могут быть синтезированы согласно множеству схем реакции. Некоторые иллюстративные схемы представлены ниже и в примерах. Другие схемы реакции могут быть с легкостью разработаны специалистами в данной области с учетом настоящего описания.
В реакциях, раскрытых ниже, может потребоваться защитить реакционноспособные функциональные группы, например, гидрокси, амино, имино, тио или карбоксильные группы, если они нужны в конечном продукте, чтобы избежать их нежелательного участия в реакциях. Обычные защитные группы могут использоваться в соответствии со стандартной практикой, например, см. T.W. Greene and P.G.M. Wuts in "Protective Groups in Organic Chemistry" John Wiley and Sons, 1991.
Способы синтеза для получения соединений в настоящем описании показаны на следующих Схемах и в Примерах. Исходные соединения коммерчески доступны или могут быть получены согласно методикам, известным в уровне техники, или как показано в настоящей заявке.
Получение промежуточных соединений
Промежуточное соединение A
4-Гидрокси-3-метил-6-меркаптопиразоло[3,4-d]пиримидин (A-1)
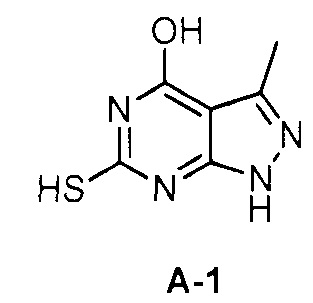
Этот реагент был получен согласно методу, описанному в литературе: J. Med. Chem. 1990, 33: 2174-2178.
4-Гидрокси-3-метил-6-метилмеркаптопиразоло[3,4-d]пиримидин (A-2)
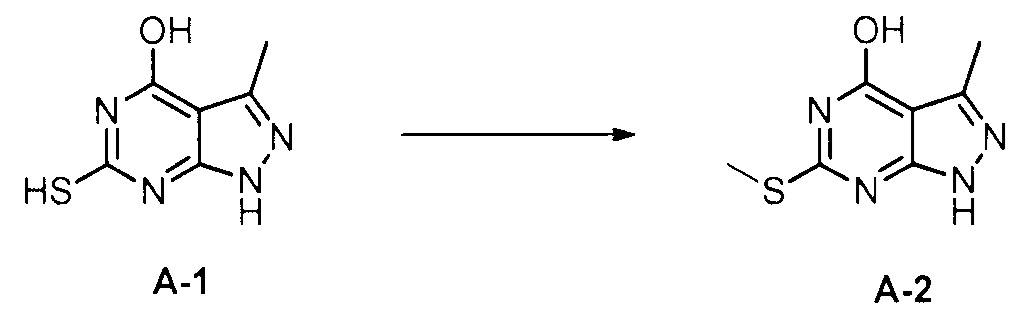
К смеси 4-гидрокси-6-меркапто-3-метилпиразоло[3,4-d]пирими-дина (А-1)(2,86 г, 11,8 ммоль) и NaOH (0,8 г, 20 ммоль) в воде (20 мл) при 5°C добавляли CH3I (2,0 г, 14,2 ммоль). После перемешивания при температуре окружающей среды в течение 30 минут, раствор подкисляли HOAc, получив в качестве неочищенного продукта соединение (a-2), указанное в заголовке, которое использовали в следующей стадии без дополнительной очистки. MS-ESI (m/z): 197,0 (M+H)+.
4-хлор-3-метил-6-метилмеркаптопиразоло[3,4-d]пиримидин (А-3)
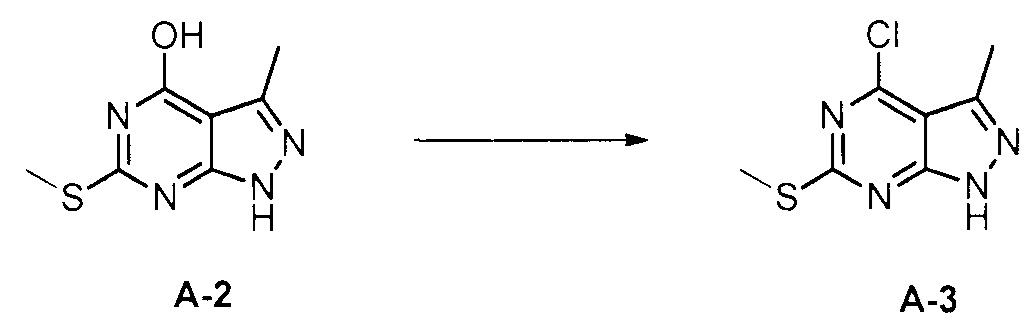
К смеси POCl3 (26 мл) и диметиланилина (2 мл) добавляли неочищенный 4-гидрокси-3-метил-6-метилмеркаптопиразоло[3,4-d]пиримидин (А-2) (1,46 г, 7,45 ммоль). Раствор нагревали до кипячения с обратным холодильником в течение 60 минут до полного растворения твердого вещества. Избыток POCl3 удаляли при пониженном давлении. Остаток вливали в воду со льдом при энергичном перемешивании, смесь перемешивали в течение 10 минут и экстрагировали водный раствор эфиром. Эфирный слой промывали холодной водой, сушили безводным Na2SO4 и выпаривали с получением указанного в заголовке соединения (a-3) (1,21 г, 5,63 ммоль). MS-ESI (m/z): 215,0 (M+H)+.
2-(изопропилтио)анилин (А-4)
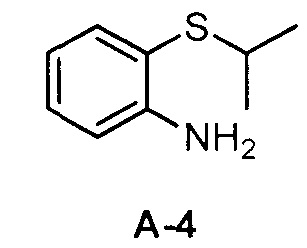
Этот реагент был получен согласно методу, описанному в литературе: J. Med. Chem. 2002, 45: 2229-2239.
N-(2-(изопропилтио)фенил)-3-метил-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-4-амин (A-5)
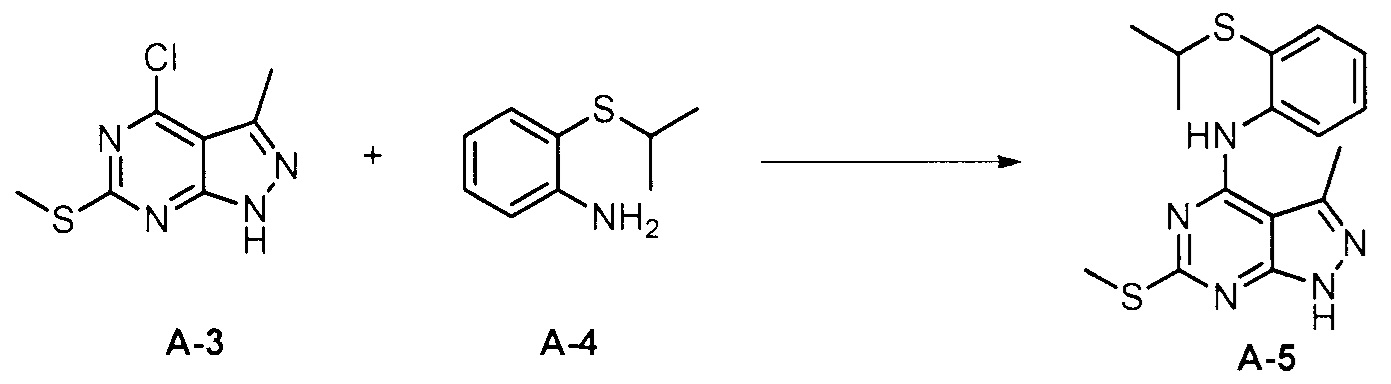
Смесь 4-хлор-3-метил-6-метилмеркаптопиразоло[3,4-d]пирими-дина (А-3) (1,21 г, 5,63 ммоль) и 2-(изопропилтио)анилина (А-4) (1,42 г, 8,50 ммоль) в изопропаноле (56 мл) перемешивали при кипячении с обратным холодильником в течение 3 ч. После охлаждения до температуры окружающей среды к смеси добавляли ТЭА (0,78 мл, 5,66 ммоль) и раствор снова нагревали до кипячения с обратным холодильником в течение 0,5 ч. После охлаждения до температуры окружающей среды смесь фильтровали, получив указанное в заголовке соединение (А-5) в виде белого твердого вещества (1,30 г, 3,77 ммоль). MS-ESI (m/z): 346 (M+H)+.
N-(2-(изопропилсульфонил)фенил)-3-метил-6-(метилсульфонил)-1H-пиразоло[3,4-d]пиримидин-4-амин (Промежуточное соединение A)
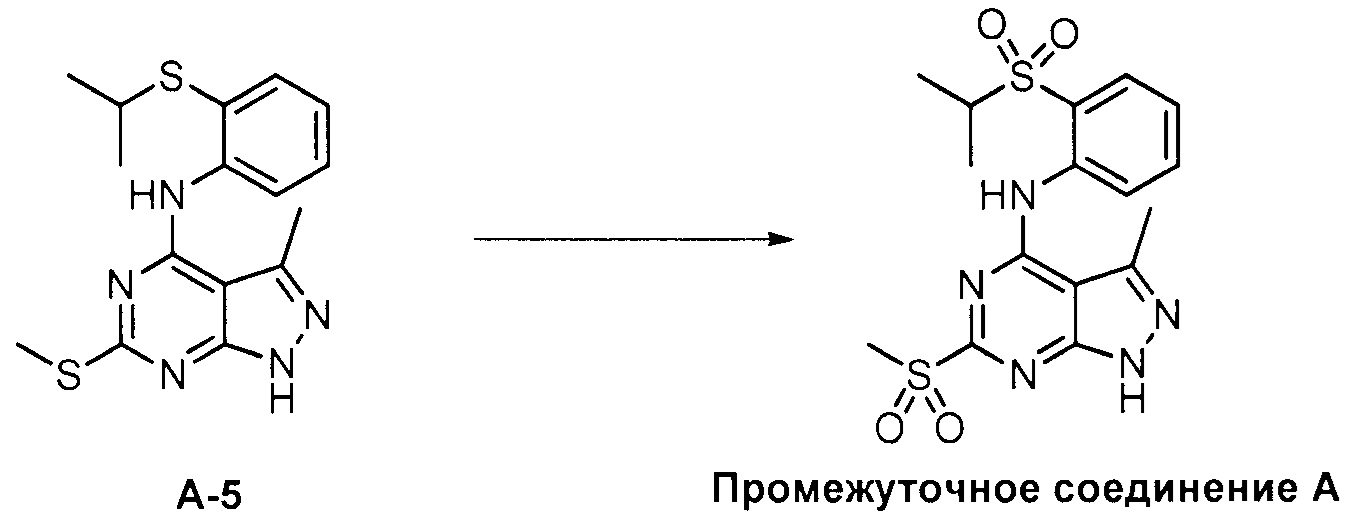
К раствору N-(2-(изопропилсульфонил)фенил)-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-4-амина (А-5) (1,3 г, 3,77 ммоль) в ДХМ (150 мл) добавляли м-ХПБК (5,6 г, 22,6 ммоль) при 0°C. Затем реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 4,5 ч, промывали насыщенным NaHSO3, рассолом, сушили Na2SO4 и выпаривали, получив указанное в заголовке соединение (Промежуточное соединение A) в виде твердого вещества. MS-ESI (m/z): 410 (M+H)+.
Промежуточное соединение B
2,5-дихлор-N-(2-(изопропилсульфонил)фенил)пиримидин-4-амин (B)
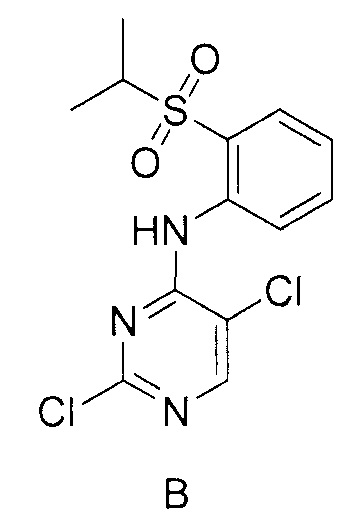
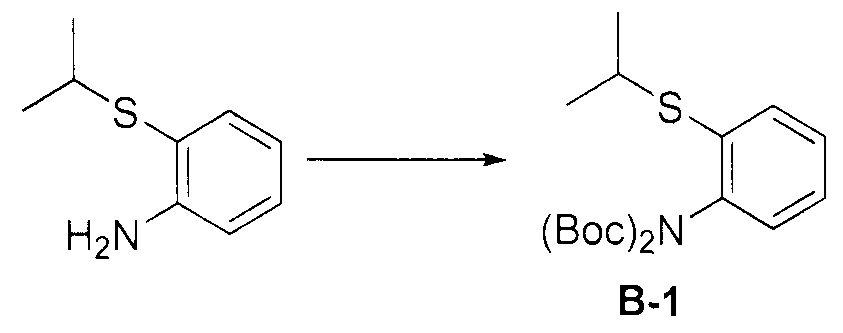
К смеси 2-(изопропилтио)анилина (23 г, 0,14 моля) в ацетонитриле (250 мл) при КТ добавляли DMAP (8,5 г, 70 ммоль) и (BOC)2O (150 г, 688 ммоль). После перемешивания при температуре окружающей среды в течение 12 ч, раствор выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (10:1), получив указанное в заголовке соединение (B-1).
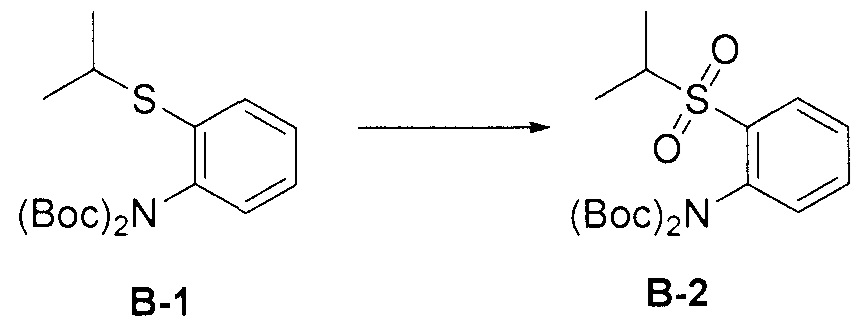
К смеси (B-1) (54 г, 0,14 моля) в ДХМ (500 мл) при 0°C добавляли м-ХПБК (101 г, 0,44 моля). После перемешивания при температуре окружающей среды в течение 12 ч, раствор промывали насыщенным NaHSO3, рассолом, сушили Na2SO4 и выпаривали с получением соединения (B-2) в виде твердого вещества.
2-(изопропилсульфонил)анилин (B-3)
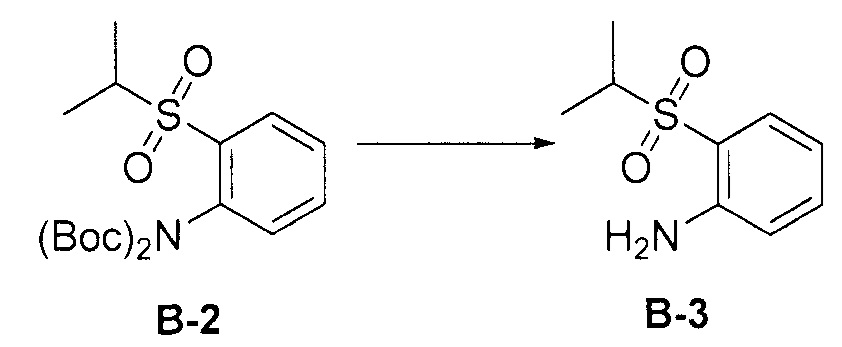
К смеси (B-2) (64 г, 0,32 моля) в ДХМ (500 мл) при 0°C добавляли ТФУ (60 мл, 1 моль). После перемешивания при температуре окружающей среды в течение 12 ч, раствор упаривали, разбавляли EtOAc, промывали насыщенным Na2CO3, рассолом, сушили Na2SO4 и выпаривали, получив соединение (B-3) в виде твердого вещества. MS-ESI (m/z): 200 (M+1)+.
2,5-дихлор-N-(2-(изопропилсульфонил)фенил)пиримидин-4-амин (B)
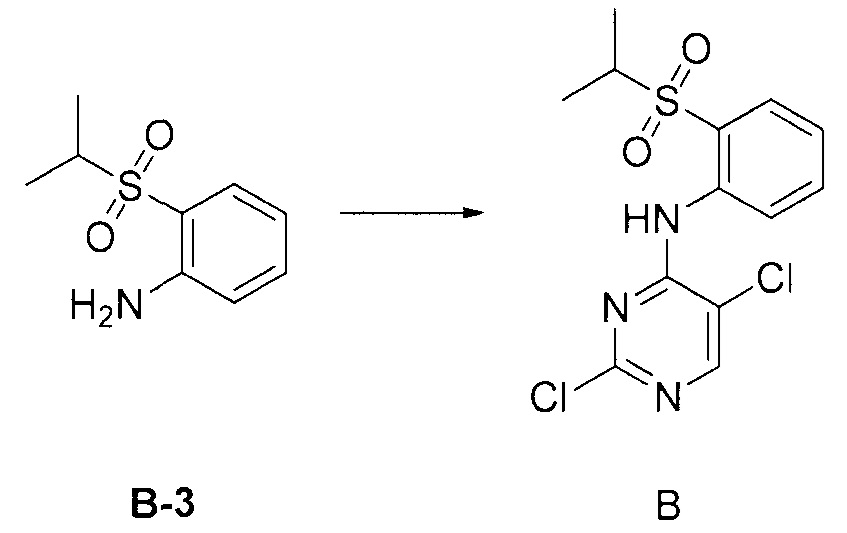
К смеси 2-(изопропилсульфонил)анилина (B-3) (32 г, 0,16 моля) в ДМФА (300 мл) при 0°C добавляли NaH (13 г, 0,32 моля). После перемешивания при 0°C в течение 0,5 часа, к смеси при 0°C по каплям добавляли 2,4,5-трихлорпиримидин (35 г, 0,13 моля). Раствор перемешивали в течение 12 ч при КТ, затем вливали в воду, экстрагировали EtOAc, промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (10:1 - 5:1), получив указанное в заголовке соединение (B) в виде желтого твердого вещества. MS-ESI (m/z): 346 (M+1)+.
Пример 1
N-4-(2-(изопропилсульфонил)фенил)-3-метил-N-6-(5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (1)
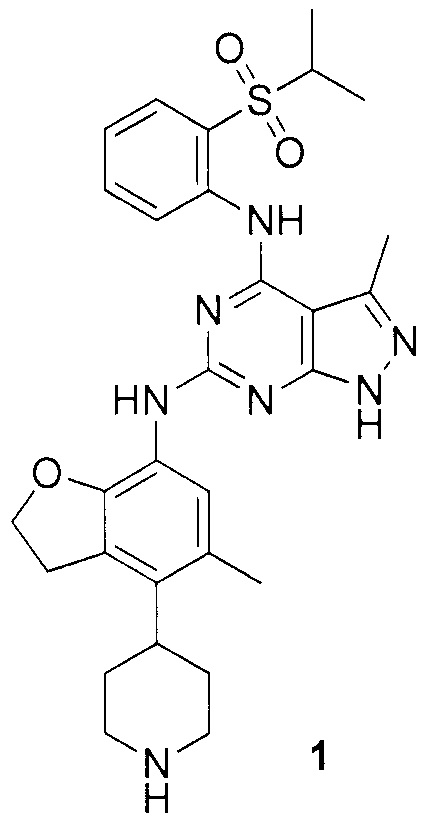
2-бром-1-(2-бромэтокси)-4-метилбензол (1a)
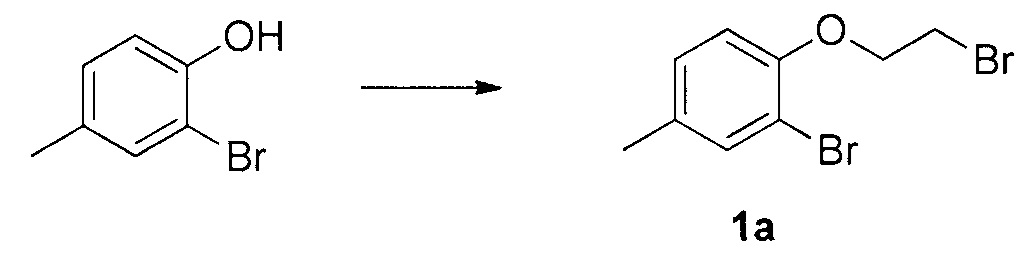
Смесь 2-бром-4-метилфенола (5,0 г, 26 ммоль), 1,2-дибромэтана (7,0 г, 37 ммоль) в воде (20 мл) и NaOH (1,1 г, 28 ммоль) перемешивали при 100°C в течение 24 ч. Смесь экстрагировали ДХМ (150 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (20:1), получив указанное в заголовке соединение (1a).
5-метил-2,3-дигидробензофуран (1b)
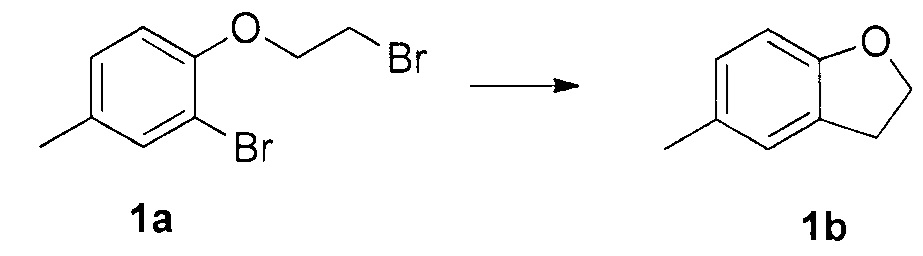
К раствору 2-бром-1-(2-бромэтокси)-4-метилбензола (1a) (1,0 г, 3,4 ммоль) в ТГФ (20 мл) при -78°C под N2 добавляли н-BuLi (2,5 М, 11 мл, 27 ммоль) и перемешивали полученную смесь при -78°C в течение 1 часа. В смесь вливали насыщенный NH4Cl (10 мл), экстрагировали EtOAc (150 мл), промывали рассолом, сушили и выпаривали, получив указанное в заголовке соединение (1b) в виде бесцветного масла.
5-метил-7-нитро-2,3-дигидробензофуран (1c)
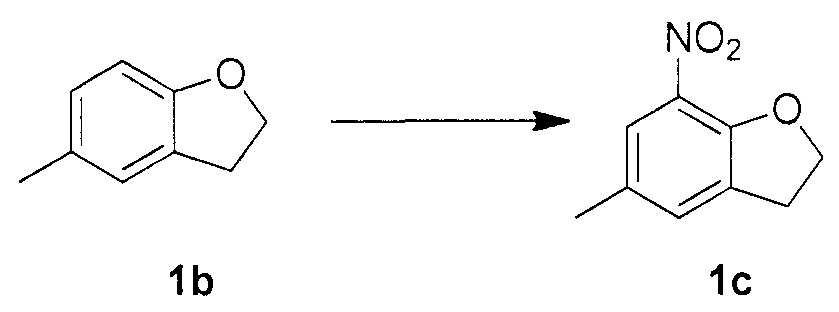
Смесь 5-метил-2,3-дигидробензофурана (1b) (2,7 г, 20 ммоль) в ТФУ (50 мл) охлаждали до 0°C и добавляли NaNO2 (2,5 г, 36 ммоль). Затем смесь нагревали до температуры окружающей среды и перемешивали в течение 12 ч. Смесь выпаривали, вливали воду (50 мл), экстрагировали EtOAc (150 мл), промывали рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (10:1), получив указанное в заголовке соединение (1c).
5-метил-2,3-дигидробензофуран-7-амин (1d)
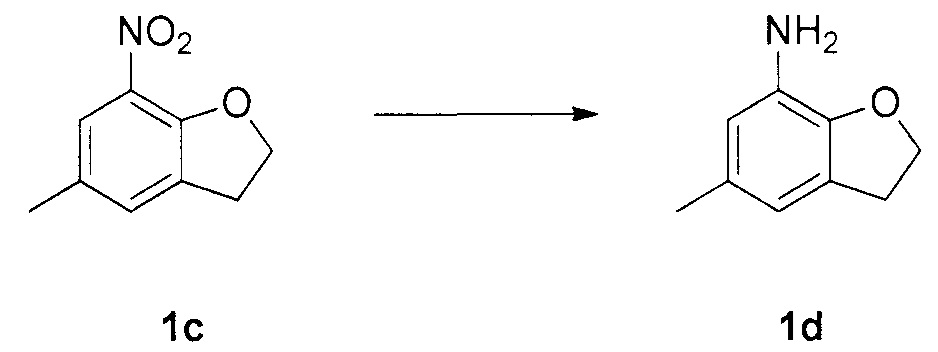
В смесь 5-метил-7-нитро-2,3-дигидробензофурана (1c) (0,30 г, 1,7 ммоль) и Pd/C (150 мг, 50%) в ТГФ (5 мл) вводили H2. Смесь перемешивали при температуре окружающей среды в течение 12 ч. Затем смесь фильтровали через целит и выпаливали, получив указанное в заголовке соединение (1d) в виде твердого вещества. MS-ESI (m/z): 150 (M+1)+.
4-бром-5-метил-2,3-дигидробензофуран-7-амин (1e)
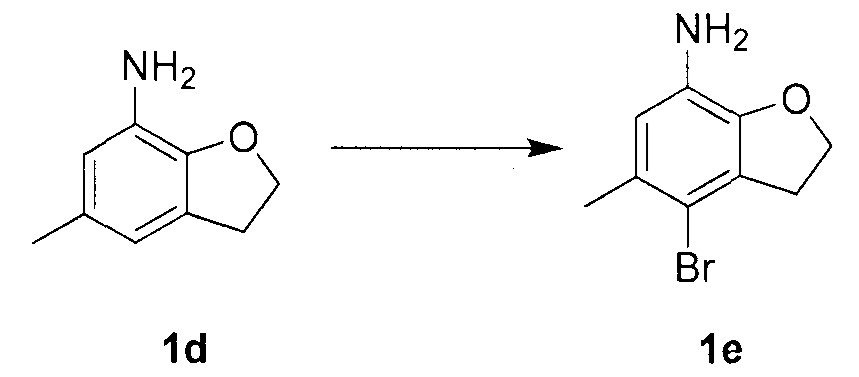
К смеси 5-метил-2,3-дигидробензофуран-7-амина (1d) (1,0 г, 6,7 ммоль) в ДМФА (21 мл) при 0°C добавляли NBS (1,19 г, 6,7 ммоль), смесь перемешивали при 0°C в течение 15 мин и экстрагировали EtOAc (150 мл), промывали насыщенным NaHSO3 (50 мл), водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (20:1), получив указанное в заголовке соединение (1e) в виде желтого твердого вещества. MS-ESI (m/z): 228 (M+1)+.
5-метил-4-(пиридин-4-ил)-2,3-дигидробензофуран-7-амин (1f)
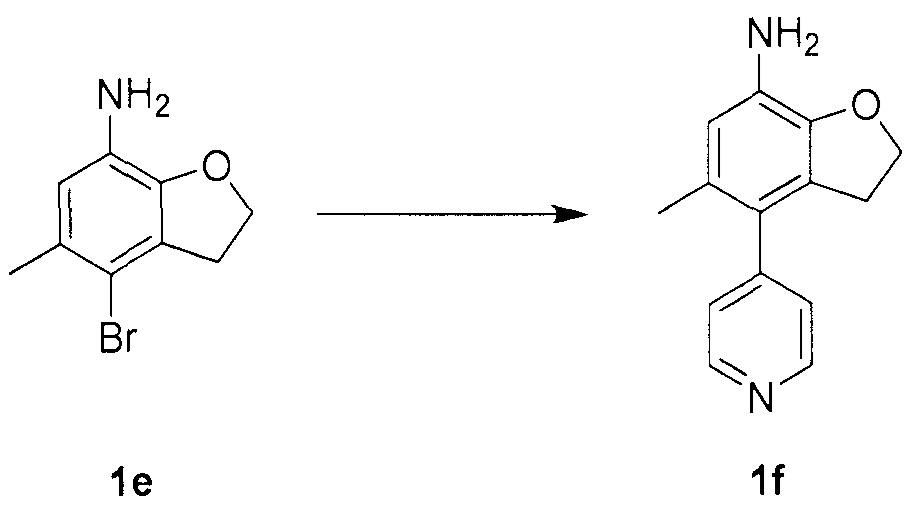
Смесь 4-бром-5-метил-2,3-дигидробензофуран-7-амина (1e) (0,80 г, 3,5 ммоль), пиридин-4-илбороновой кислоты (0,86 г, 7 ммоль), Cs2CO3 (2,84 г, 8,7 ммоль), Pd(PPh3)4 (0,40 г, 0,346 ммоль) и воды (7 мл) в ДМФА (35 мл) перемешивали при 135°C под N2 в течение 1 ч. Затем смесь охлаждали до температуры окружающей среды, вливали воду (50 мл), экстрагировали EtOAc (150 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (20:1 → 5:1 → 1:1), получив указанное в заголовке соединение (1f) в виде желтого твердого вещества. MS-ESI (m/z): 227 (M+1)+.
5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-амин (1g)
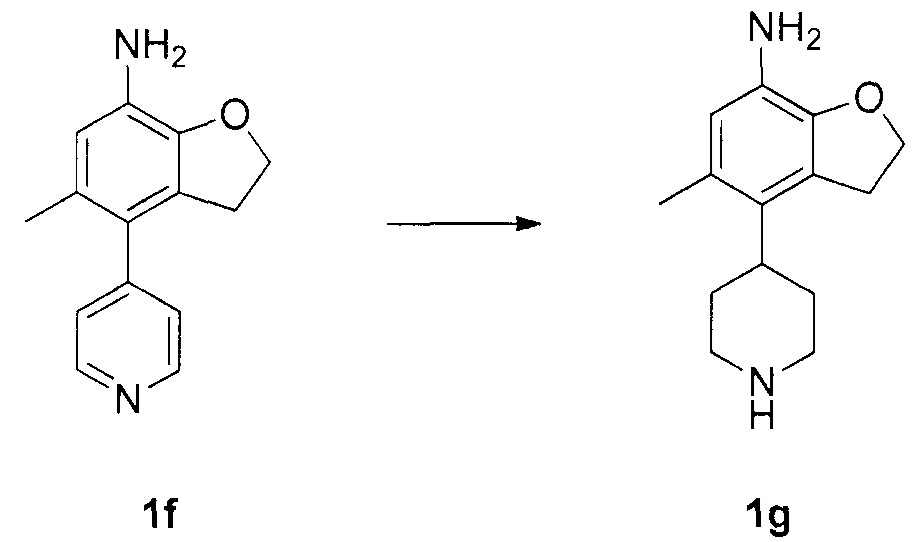
В смесь 5-метил-4-(пиридин-4-ил)-2,3-дигидробензофуран-7-амина (1f) (0,40 г, 1,8 ммоль), PtO2 (120 мг, 35%) и ТЭА (0,24 мл, 3,6 ммоль) в HOAc (30 мл) вводили H2 и перемешивали при температуре окружающей среды в течение 24 ч (88 psi (606,7 кПа)). Смесь фильтровали, упаривали, разбавляли EtOAc (50 мл). Затем добавляли раствор гидроксида аммония до pH=10 и экстрагировали EtOAc (150 мл), промывали водой, рассолом, сушили и выпаривали, получив указанное в заголовке соединение (1g) в виде желтого масла. MS-ESI (m/z): 233 (M+1)+.
N-4-(2-(изопропилсульфонил)фенил)-3-метил-N-6-(5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (1)
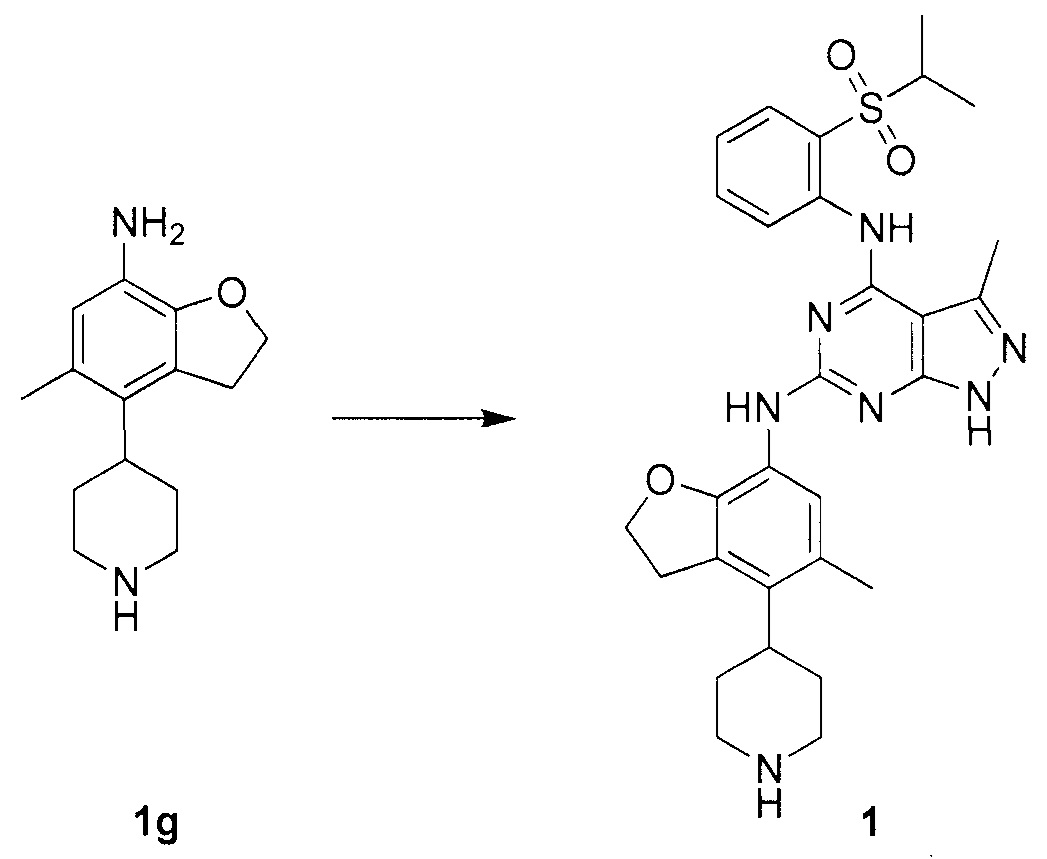
Смесь 5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-амина (1g) (25 мг, 0,017 ммоль), N-(2-(изопропилсульфонил)фенил)-3-метил-6-(метилсульфонил)-1H-пиразоло[3,4-d]пиримидин-4-амина (промежуточного соединения A) (53 мг, 0,12 ммоль) и p-TsOH (20 мг, 0,11 ммоль) в i-PrOH (0,5 мл) перемешивали в закрытой пробирке при 160°C в течение 5 ч. Смесь разбавляли EtOAc (20 мл). Затем добавляли раствор гидроксида аммония до pH=10 и экстрагировали EtOAc (60 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием ДХМ/MeOH (10:1), получив указанное в заголовке соединение (1) в виде желтого твердого вещества. MS-ESI (m/z): 562 (M+1)+.
Пример 2
N-4-(2-(изопропилсульфонил)фенил)-3-метил-N-6-(5-метил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (2)
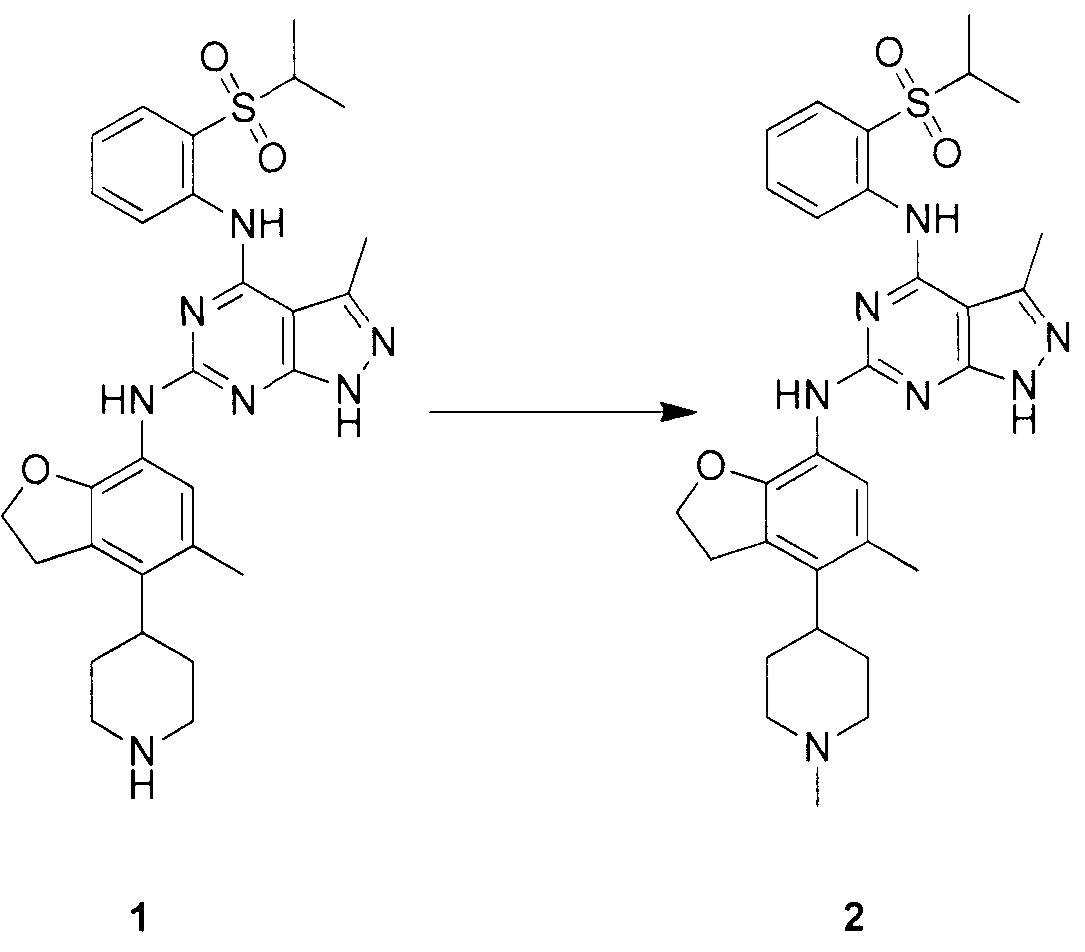
Смесь N-4-(2-(изопропилсульфонил)фенил)-3-метил-N-6-(5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-1H-пиразоло[3,4-d]пиримидин-4,6-диамина (1) (37 мг, 0,064 ммоль), формальдегида (5,5 л, 0,64 ммоль), HOAc (кат.) и NaBH3CN (10,3 мг, 0,16 ммоль) перемешивали при температуре окружающей среды в течение 0,5 ч. Смесь разбавляли NaHCO3 (10 мл) и EtOAc (20 мл), экстрагировали EtOAc (60 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием ДХМ/MeOH (10:1), получив указанное в заголовке соединение (2) в виде желтого твердого вещества. MS-ESI (m/z): 576 (M+1)+.
Пример 3
(R)-N-6-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (3)
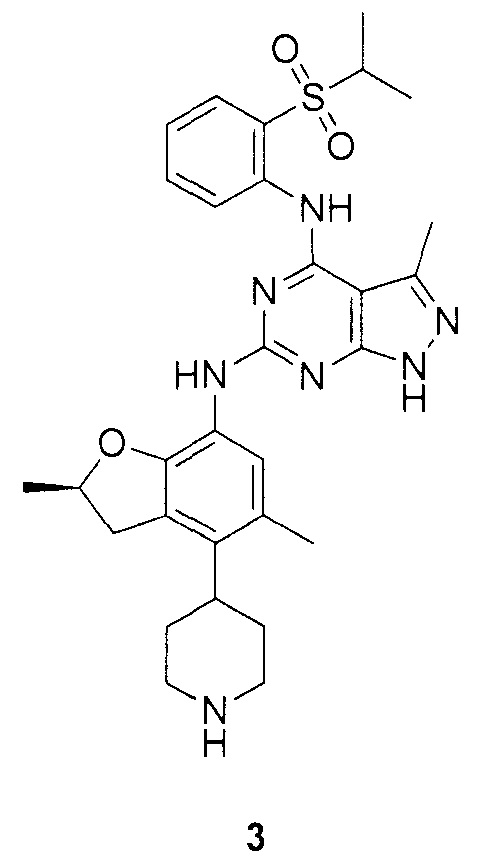
1-(бензилокси)-2-бром-4-метилбензол (3a)
К смеси 2-бром-4-метилфенола (5,0 г, 27 ммоль) и K2CO3 (7,4 г, 53 ммоль) в ДМФА (20 мл) добавляли бензилбромид (3,5 мл, 29 ммоль) при температуре окружающей среды. Смесь перемешивали при 70°C в течение 12 ч. Смесь вливали в воду (50 мл), экстрагировали EtOAc (150 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (10:1), получив указанное в заголовке соединение (3a).
(S)-1-(2-(бензилокси)-5-метилфенил)пропан-2-ол (3b)
К раствору 1-(бензилокси)-2-бром-4-метилбензола (3a) (1,0 г, 3,6 ммоль) в ТГФ (20 мл) при -78°C под атмосферой N2 добавляли н-BuLi (2,5 М, 1,6 мл, 3,9 ммоль), полученную смесь перемешивали в течение 30 минут и к смеси добавляли (S)-2-метилоксиран (0,38 мл, 5,4 ммоль) и BF3⋅Et2O (0,67 мл, 5,4 ммоль). Смесь перемешивали при -78°C в течение 1,5 ч и нагревали до температуры окружающей среды, вливали воду (10 мл), экстрагировали EtOAc (30 мл), промывали рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (10:1), получив указанное в заголовке соединение (3b).
(S)-2-(2-гидроксипропил)-4-метилфенол (3c)
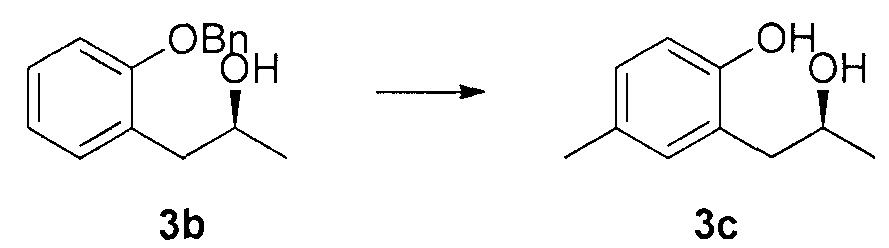
В смесь (S)-1-(2-(бензилокси)-5-метилфенил)-пропан-2-ола (3b) (0,50 г, 1,9 ммоль) и Pd/C (100 мг, 20%) в MeOH (10 мл) вводили H2 при температуре окружающей среды. Смесь перемешивали при температуре окружающей среды в течение 18 ч. Затем смесь фильровали через целит и выпаривали с получением указанного в заголовке соединения (3c).
(R)-2,5-диметил-2,3-дигидробензофуран (3d)
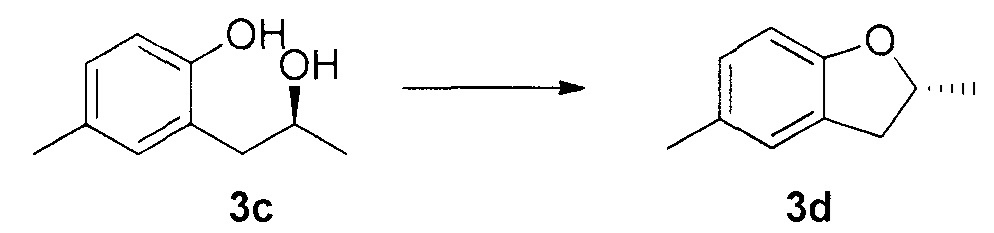
К смеси (S)-2-(2-гидроксипропил)-4-метилфенола (3c) (1,6 г, 8,4 ммоль) и трифенилфосфина (2,7 г, 10 ммоль) в ТГФ (60 мл) добавляли DIAD при температуре окружающей среды. Смесь выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (10:1), получив указанное в заголовке соединение (3d).
(R)-2,5-диметил-7-нитро-2,3-дигидробензофуран (3e)
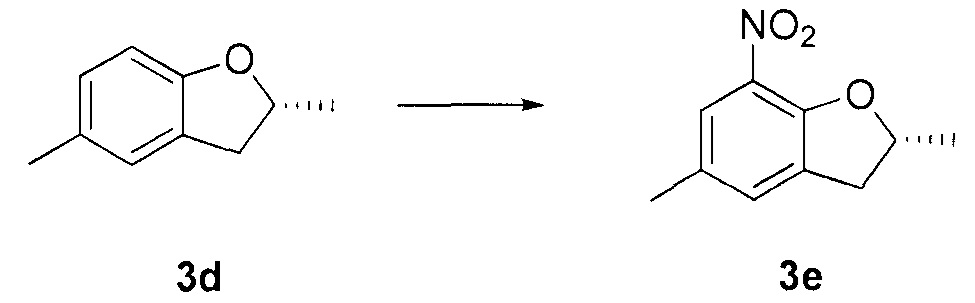
Смесь (R)-2,5-диметил-2,3-дигидробензофурана (3d) (2,0 г, 13 ммоль) в ТФУ (40 мл) охлаждали до 0 °C и добавляли NaNO2 (1,7 г, 23 ммоль). Затем смесь перемешивали при температуре окружающей среды в течение 12 ч. Смесь выпаривали, вливали воду (50 мл), экстрагировали EtOAc (150 мл), промывали рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (20:1), получив указанное в заголовке соединение (3e).
(R)-2,5-диметил-2,3-дигидробензофуран-7-амин (3f)
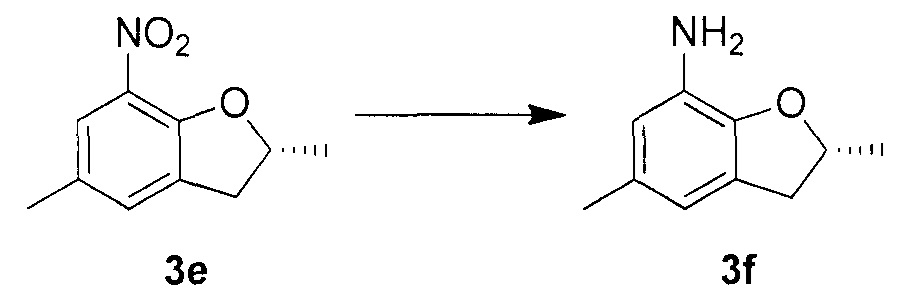
В смесь (R)-2,5-диметил-7-нитро-2,3-дигидробензофурана (3e) (0,84 г, 4,3 ммоль) и Pd/C (100 мг, 15%) в ТГФ (10 мл) вводили H2 при температуре окружающей среды. Затем смесь перемешивали при температуре окружающей среды в течение 12 ч. Смесь фильровали через целит и выпаривали с получением указанного в заголовке соединения (3f) в виде твердого вещества. MS-ESI (m/z): 164 (M+1)+.
(R)-4-бром-2,5-диметил-2,3-дигидробензофуран-7-амин (3g)
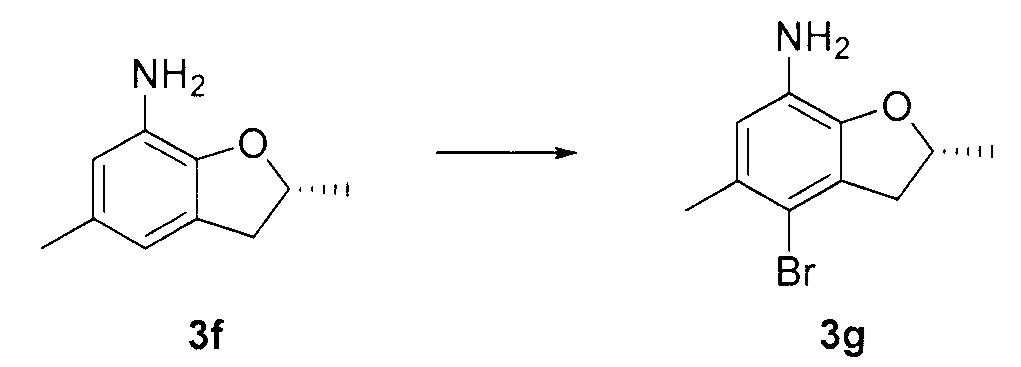
К смеси (R)-2,5-диметил-2,3-дигидробензофуран-7-амина (3f) (1,3 г, 7,9 ммоль) в ДМФА (16 мл) добавляли NBS (1,42 г, 7,9 ммоль) при 0°C. Смесь перемешивали в течение 15 минут при 0°C. Смесь экстрагировали EtOAc (150 мл), промывали NaHSO3 (50 мл), водой и рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (20:1), получив указанное в заголовке соединение (3g) в виде твердого вещества. MS-ESI (m/z): 242 (M+1)+.
(R)-2,5-диметил-4-(пиридин-4-ил)-2,3-дигидробензофуран-7-амин (3h)
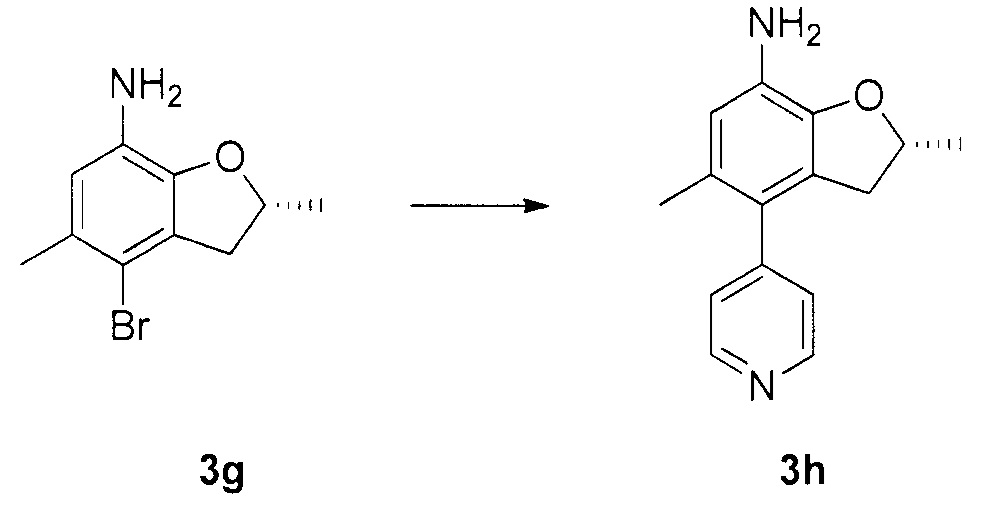
Смесь (R)-4-бром-2,5-диметил-2,3-дигидробензофуран-7-амина (3g) (1,0 г, 4,3 ммоль), пиридин-4-илбороновой кислоты (1,08 г, 8,77 ммоль), Cs2CO3 (3,56 г, 10,9 ммоль), Pd(PPh3)4 (0,506 г, 0,438 ммоль) и воды (9 мл) в ДМФА (44 мл) перемешивали при 135°C под N2 в течение 1 ч. Затем смесь охлаждали до температуры окружающей среды, вливали воду (50 мл), экстрагировали EtOAc (150 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (20:1 → 5:1 → 1:1), получив указанное в заголовке соединение (3h) в виде твердого вещества. MS-ESI (m/z): 241 (M+1)+.
(R)-2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-амин (3i)
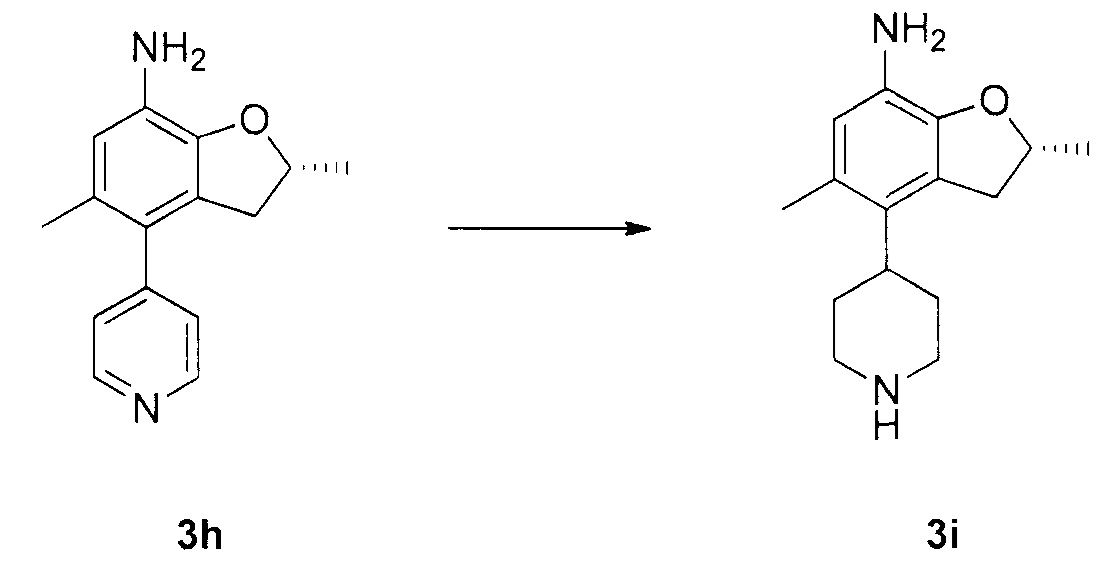
В смесь (R)-2,5-диметил-4-(пиридин-4-ил)-2,3-дигидробензо-фуран-7-амина (3h) (0,60 г, 2,4 ммоль), PtO2 (240 мг, 35%) и ТЭА (0,38 мл, 4,9 ммоль) в HOAc (40 мл) вводили H2 и перемешивали в течение 24 ч при температуре окружающей среды (88 psi (606,7 кПа)). Смесь фильтровали, выпаривали и разбавляли EtOAc (50 мл). Добавляли раствор гидроксида аммония до pH=10, затем экстрагировали EtOAc (150 мл), промывали водой, рассолом, сушили и выпаривали, получив указанное в заголовке соединение (3i) в виде желтого масла. MS-ESI (m/z): 247 (M+1)+.
(R)-N-6-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (3)
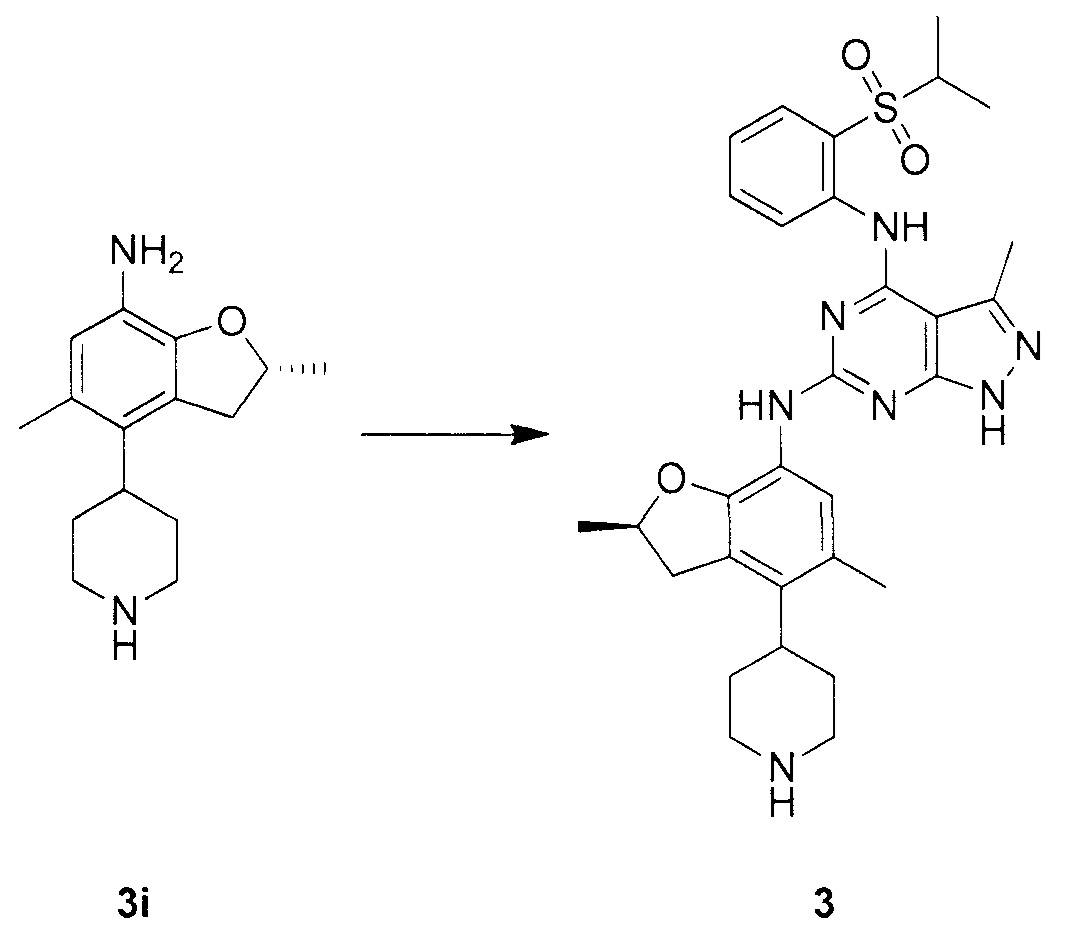
Смесь (R)-2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензо-фуран-7-амина (3i) (44 мг, 0,017 ммоль), N-(2-(изопропилсульфо-нил)фенил)-3-метил-6-(метилсульфонил)-1H-пиразоло[3,4-d]пирими-дин-4-амина (Промежуточное соединение A) (83 мг, 0,20 ммоль) и p-TsOH (32 мг, 0,17 ммоль) в i-PrOH (0,5 мл) перемешивали в закрытой пробирке при 160°C в течение 5 ч. Смесь разбавляли EtOAc (20 мл), добавляли гидроксид аммония до pH=10, экстрагировали EtOAc (60 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием ДХМ/MeOH (10:1), получив указанное в заголовке соединение (3) в виде желтого твердого вещества. MS-ESI (m/z): 576 (M+1)+.
Пример 4
(R)-N-6-(2,5-диметил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензо-фуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (4)
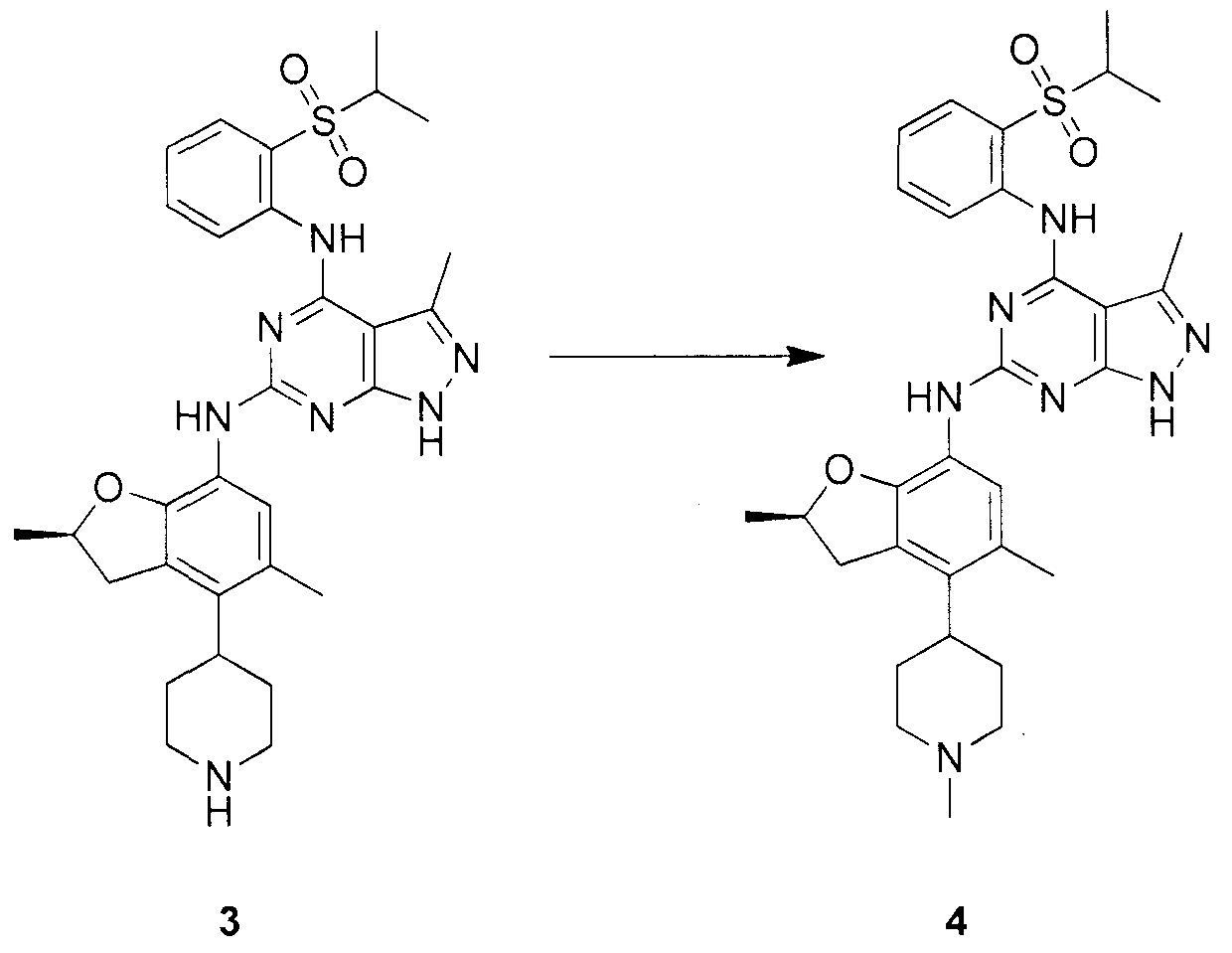
Смесь (R)-N-6-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидро-бензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамина (3) (37 мг, 0,064 ммоль), формальдегида (5,5 л, 0,64 ммоль), HOAc (кат.) и NaBH3CN (10,3 мг, 0,16 ммоль) перемешивали при температуре окружающей среды в течение 0,5 ч. Смесь разбавляли NaHCO3 (10 мл) и EtOAc (20 мл), экстрагировали EtOAc (60 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием ДХМ/MeOH (10:1), получив указанное в заголовке соединение (4) в виде твердого вещества. MS-ESI (m/z): 590 (M+1)+.
Пример 5
(S)-N-6-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (5)
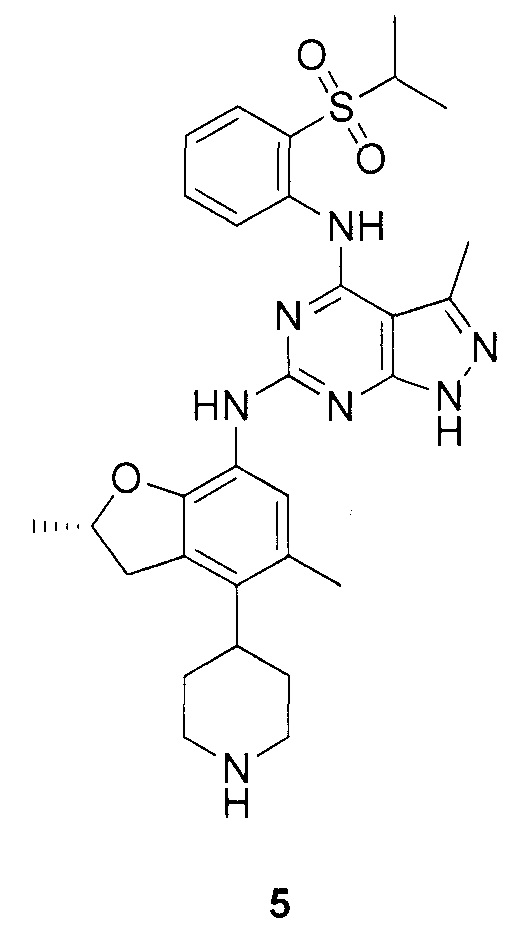
(R)-1-(2-(бензилокси)-5-метилфенил)пропан-2-ол (5a)
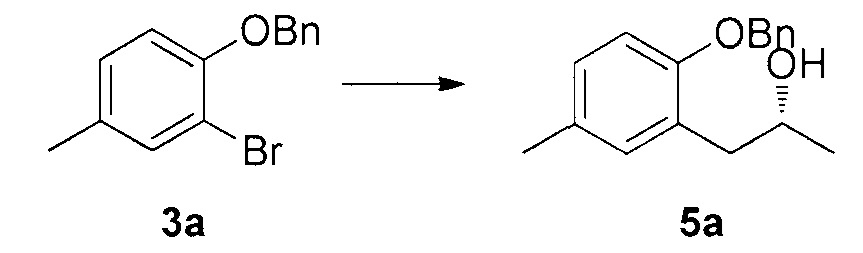
Указанное в заголовке соединение 5a было получено согласно способу получения соединения 3b Примера 3 путем замены (S)-2-метилоксирана (R)-2-метилоксираном.
(R)-2-(2-гидроксипропил)-4-метилфенол (5b)
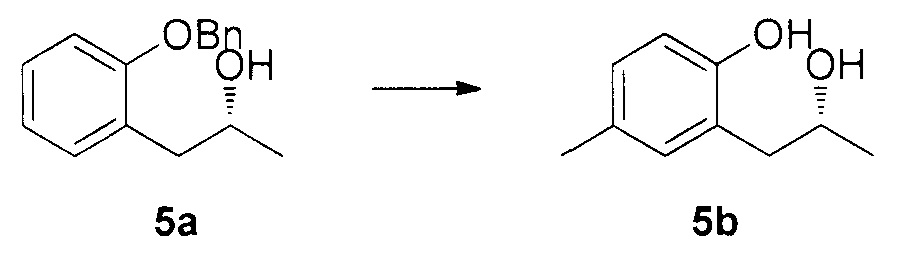
Указанное в заголовке соединение 5b было получено согласно способу получения соединения 3c Примера 3 путем замены соединения 3b соединением 5a.
(S)-2,5-диметил-2,3-дигидробензофуран (5c)
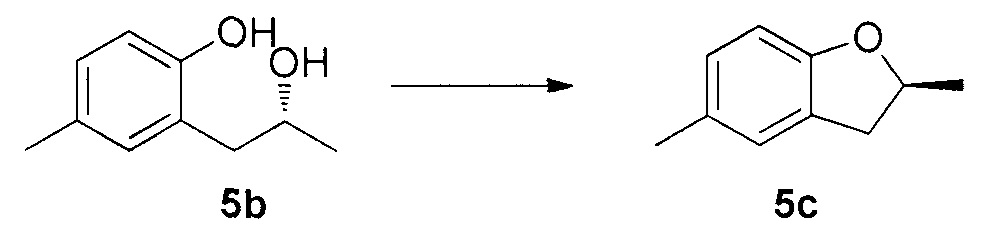
Указанное в заголовке соединение 5c было получено согласно способу получения соединения 3d из Примера 3 путем замены соединения 3c соединением 5b.
(S)-2,5-диметил-7-нитро-2,3-дигидробензофуран (5d)
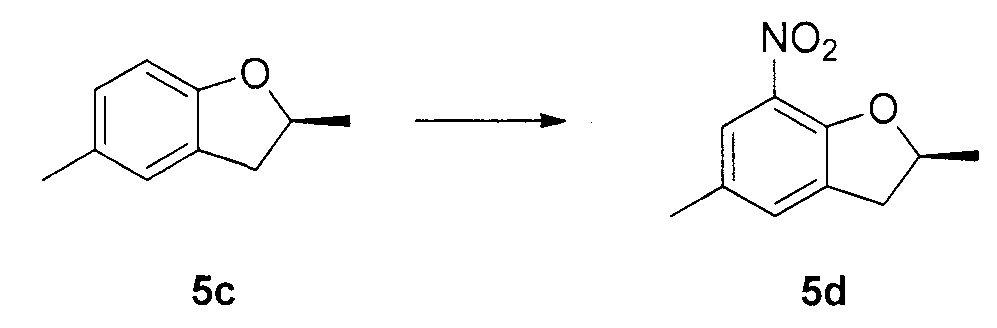
Указанное в заголовке соединение 5d было получено согласно способу получения соединения 3e Примера 3 путем замены соединения 3d соединением 5c.
(S)-2,5-диметил-2,3-дигидробензофуран-7-амин (5e)
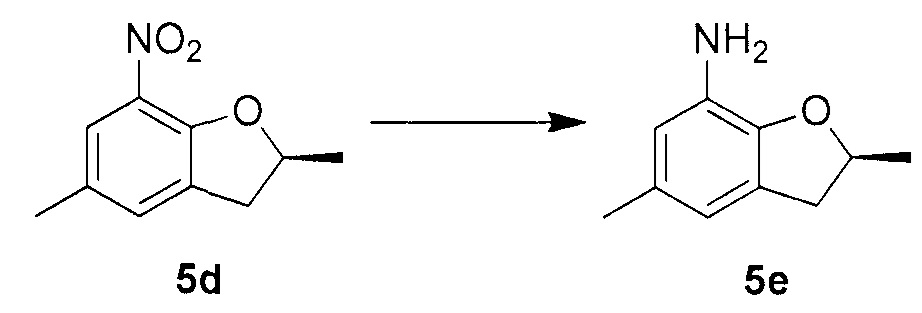
Указанное в заголовке соединение 5e было получено согласно способу получения соединения 3f Примера 3 путем замены соединения 3e соединением 5d. MS-ESI (m/z): 164 (M+1)+.
(S)-4-бром-2,5-диметил-2,3-дигидробензофуран-7-амин (5f)
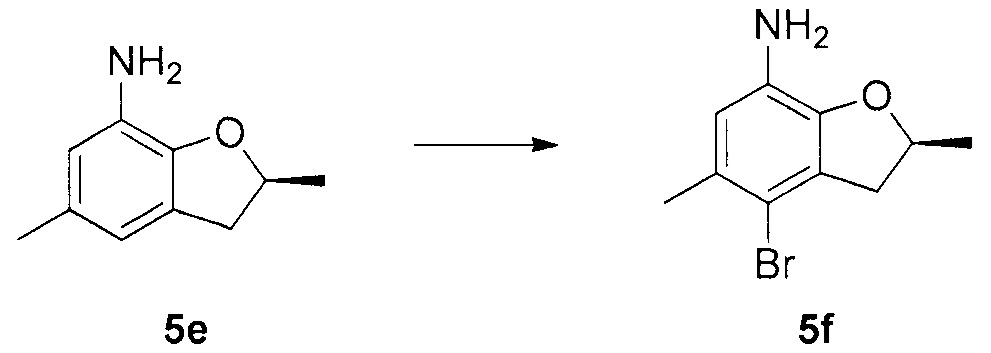
Указанное в заголовке соединение 5f было получено согласно способу получения соединения 3g Примера 3 путем замены соединения 3f соединением 5e. MS-ESI (m/z): 242 (M+1)+.
(S)-2,5-диметил-4-(пиридин-4-ил)-2,3-дигидробензофуран-7-амин (5 g)
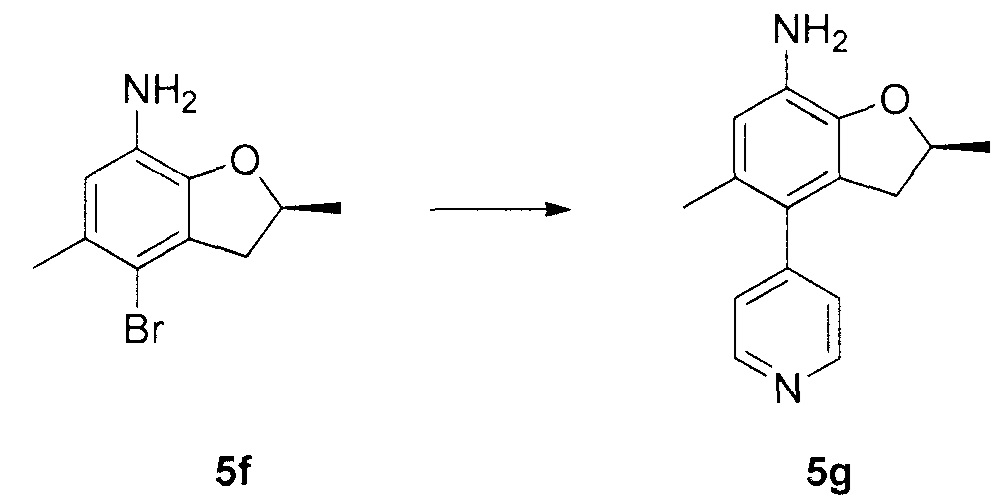
Указанное в заголовке соединение 5g было получено согласно способу получения соединения 3h Примера 3 путем замены соединения 3g соединением 5f. MS-ESI (m/z): 241 (M+1)+.
(S)-2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-амин (5h)
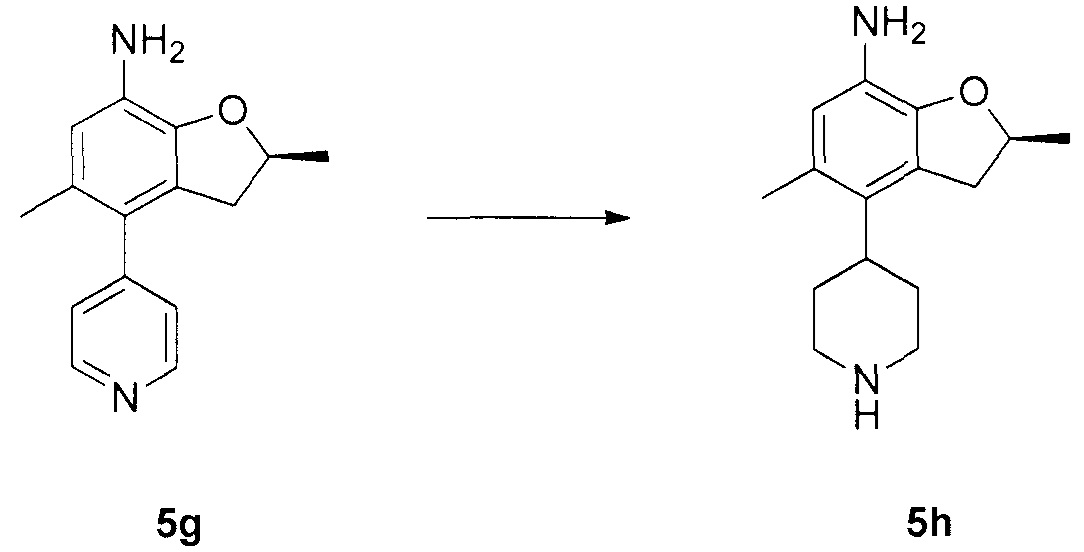
Указанное в заголовке соединение 5h было получено согласно способу получения соединения 3i Примера 3 путем замены соединения 3h соединением 5g. MS-ESI (m/z): 247 (M+1)+.
(S)-N-6-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (5)
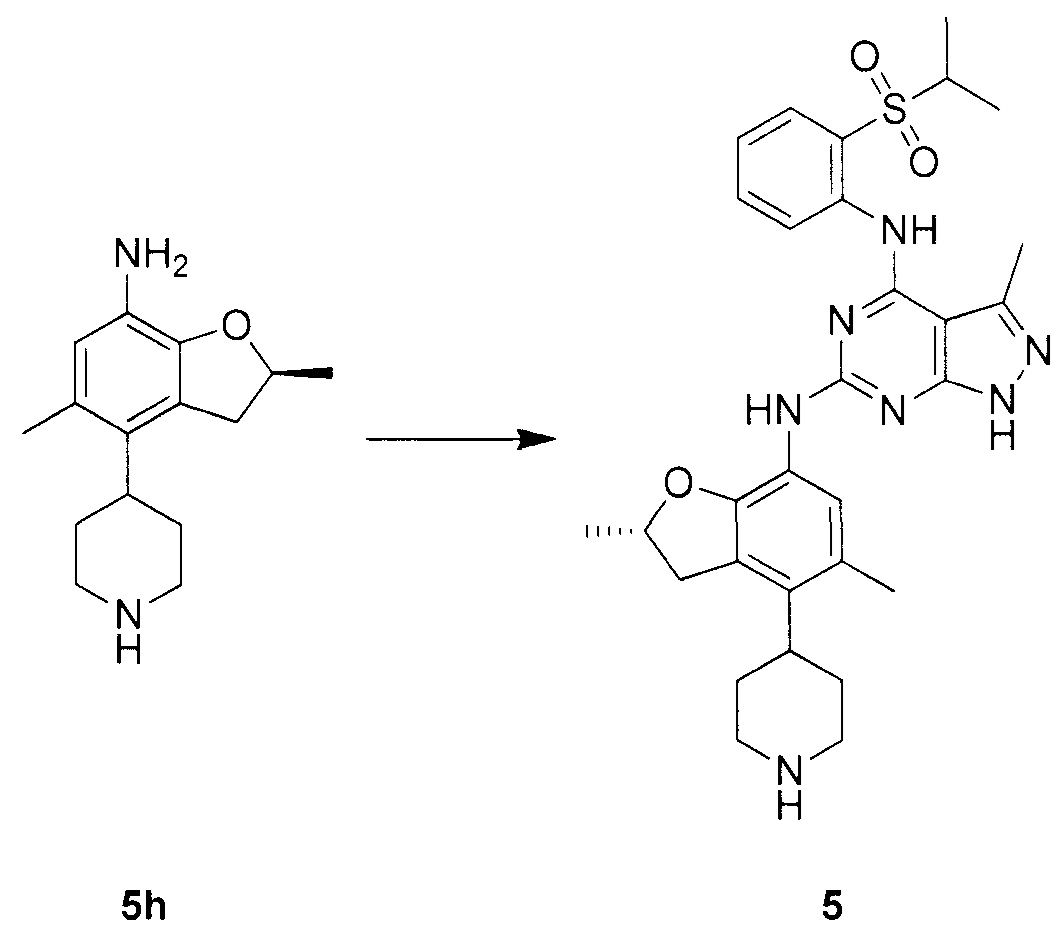
Указанное в заголовке соединение (5) было получено согласно способу получения соединения 3 из Примера 3 путем замены соединения 3i соединением 5h. MS-ESI (m/z): 576 (M+1)+.
Пример 6
(S)-N-6-(2,5-диметил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензо-фуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (6)
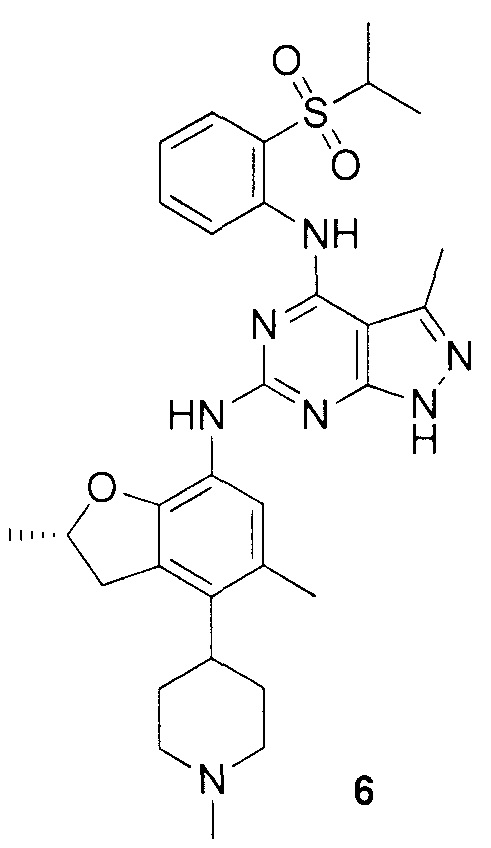
Получали согласно способу Примера 4, заменив (R)-N-6-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (3) (S)-N-6-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамином (5). Получили указанное в заголовке соединение (6). MS-ESI (m/z): 590 (M+1)+.
Пример 7
(7-(4-(2-(изопропилсульфонил)фениламино)-3-метил-1H-пиразоло[3,4-d]пиримидин-6-иламино)-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-2-ил)метанол (7)
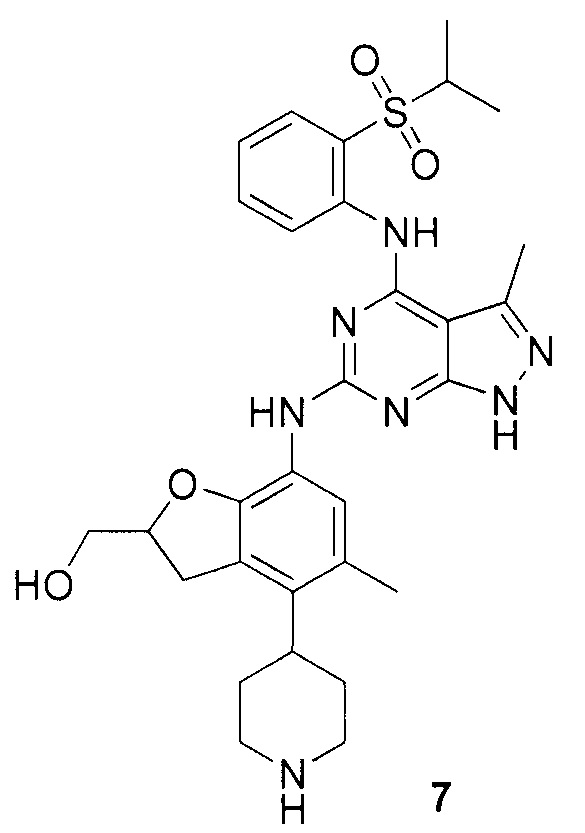
1-(аллилокси)-4-метил-2-нитробензол (7a)
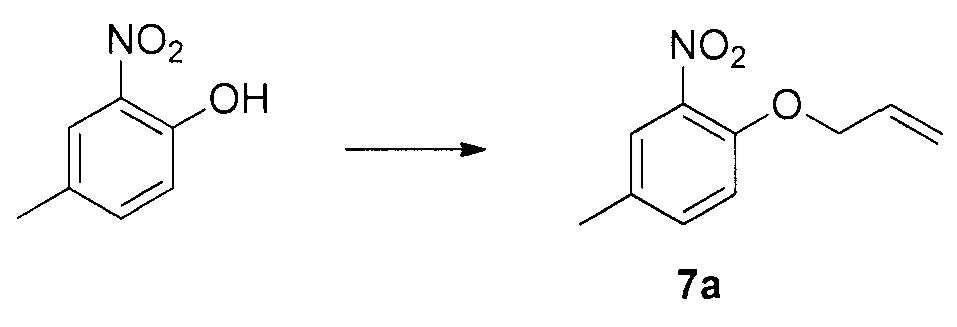
Смесь 4-метил-2-нитрофенола (5,0 г, 0,033 моля), 3-бромпроп-1-ена (4,2 г, 0,034 моля) и K2CO3 (4,6 г, 0,033 моля) в ацетоне (20 мл) перемешивали в течение 8 ч при температуре окружающей среды. Смесь вливали в воду (50 мл), экстрагировали EtOAc (90 мл), промывали рассолом, сушили и выпаривали с получением указанного в заголовке соединения (7a).
2-аллил-4-метил-6-нитрофенол (7b)
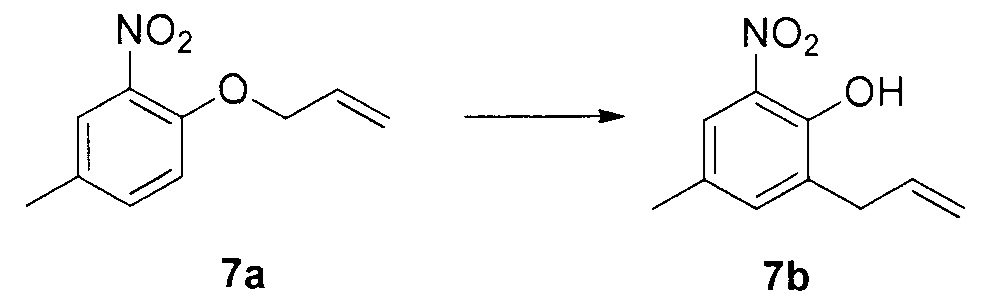
Соединение 1-(аллилокси)-4-метил-2-нитробензол (7a) (6,1 г, 0,032 моля) перемешивали в течение 5 ч при 200°C. Смесь очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (50:1), получив указанное в заголовке соединение (7b) в виде желтого масла.
(5-метил-7-нитро-2,3-дигидробензофуран-2-ил)метанол (7c)
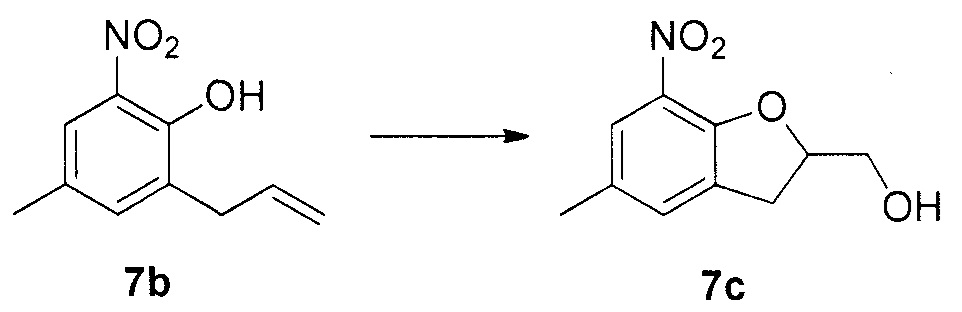
Смесь 2-аллил-4-метил-6-нитрофенола (7b) (0,50 г, 2,5 ммоль) и м-ХПБК (0,64 г, 2,5 ммоль) в CHCl3 (9 мл) перемешивали в течение 6 ч при 85°C. Смесь вливали в насыщенный NaHSO3 (20 мл), экстрагировали ДХМ (40 мл), промывали рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (10:1), получив указанное в заголовке соединение (7c) в виде твердого вещества. MS-ESI (m/z): 210 (M+1)+.
(7-амино-5-метил-2,3-дигидробензофуран-2-ил)метанол (7d)
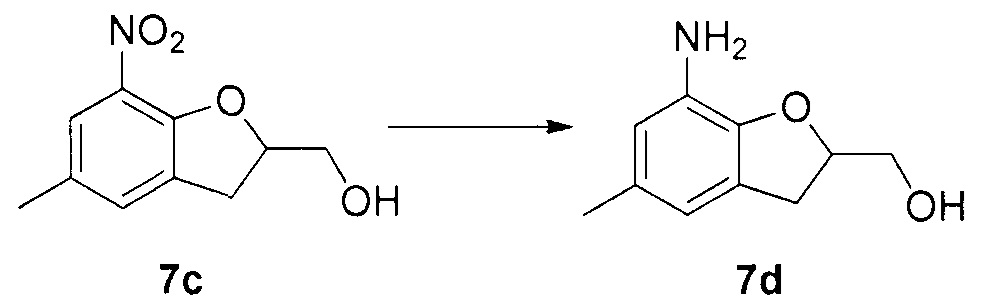
В смесь (5-метил-7-нитро-2,3-дигидробензофуран-2-ил)метанола (7c) (2,3 г, 0,011 моля) и Pd/C (230 мг, 10%) в ТГФ (30 мл) вводили H2 и перемешивали при температуре окружающей среды в течение 12 ч. Смесь фильровали через целит и выпаривали с получением указанного в заголовке соединения (7d) в виде твердого вещества. MS-ESI (m/z): 180 (M+1)+.
(7-амино-4-бром-5-метил-2,3-дигидробензофуран-2-ил)метанол (7e)
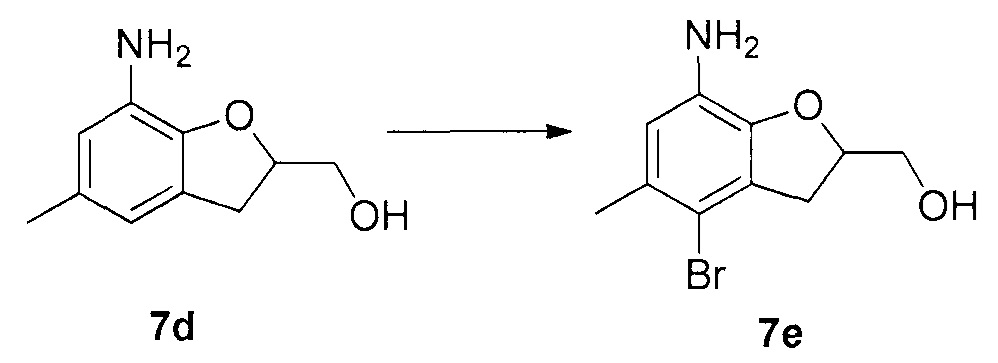
К смеси (7-амино-5-метил-2,3-дигидробензофуран-2-ил)метанола (7d) (0,80 г, 4,5 ммоль) в ДМФА (13 мл) при 0°C добавляли NBS (0,08 г, 4,5 ммоль), перемешивали при 0°C в течение 15 мин, после чего смесь экстрагировали EtOAc (150 мл), промывали NaHSO3 (50 мл), водой, рассолом, сушили и выпаривали, получив указанное в заголовке соединение (7e) в виде желтого твердого вещества. MS-ESI (m/z): 258 (M+1)+.
(7-амино-5-метил-4-(пиридин-4-ил)-2,3-дигидробензофуран-2-ил)метанол (7f)
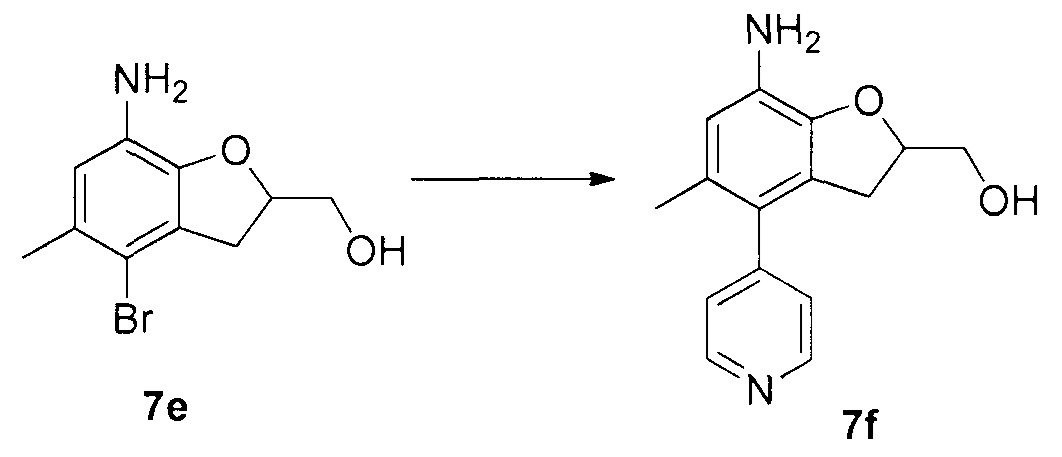
Смесь (7-амино-4-бром-5-метил-2,3-дигидробензофуран-2-ил)метанола (7e) (1,7 г, 6,6 ммоль), пиридин-4-илбороновой кислоты (1,6 г, 1,3 ммоль), Cs2CO3 (5,3 г, 16 ммоль), Pd(PPh3)4 (0,76 г, 0,66 ммоль) и воды (13 мл) в ДМФА (60 мл) перемешивали при 135°C под N2 в течение 1 ч. Затем смесь охлаждали до температуры окружающей среды, вливали воду (100 мл), экстрагировали EtOAc (150 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием в смеси гексанов/EtOAc (20:1 → 5:1 → 1:1), получив указанное в заголовке соединение (7f) в виде желтого твердого вещества. MS-ESI (m/z): 257 (M+1)+.
(7-амино-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-2-ил)метанол (7g)
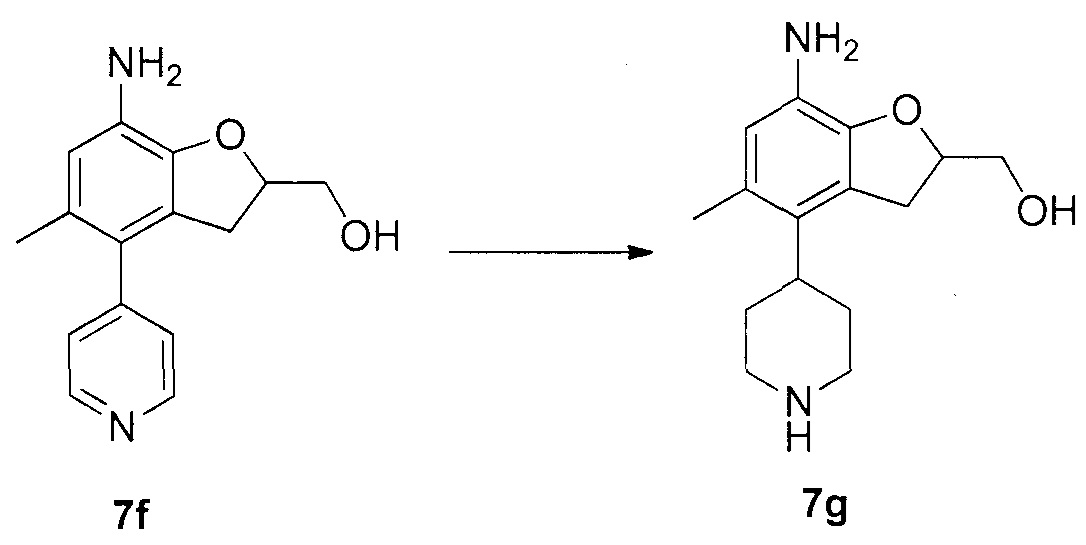
В смесь (7-амино-5-метил-4-(пиридин-4-ил)-2,3-дигидробензо-фуран-2-ил)метанола (7f) (0,10 г, 0,39 ммоль), PtO2 (50 мг, 50%) и ТЭА (0,061 мл, 0,78 ммоль) в HOAc (5 мл) вводили H2 и перемешивали при температуре окружающей среды в течение 24 ч (88 psi (606,7 кПа)). Смесь фильтровали, упаривали и разбавляли EtOAc (50 мл). Добавляли раствор гидроксида аммония до pH=10, экстрагировали EtOAc (150 мл), промывали водой, рассолом, сушили и выпаривали, получив указанное в заголовке соединение (7g) в виде желтого масла. MS-ESI (m/z): 262 (M+1)+.
(7-((4-((2-(изопропилсульфонил)фенил)амино)-3-метил-1H-пиразоло[3,4-d]пиримидин-6-ил)амино)-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-2-ил)метанол (7)
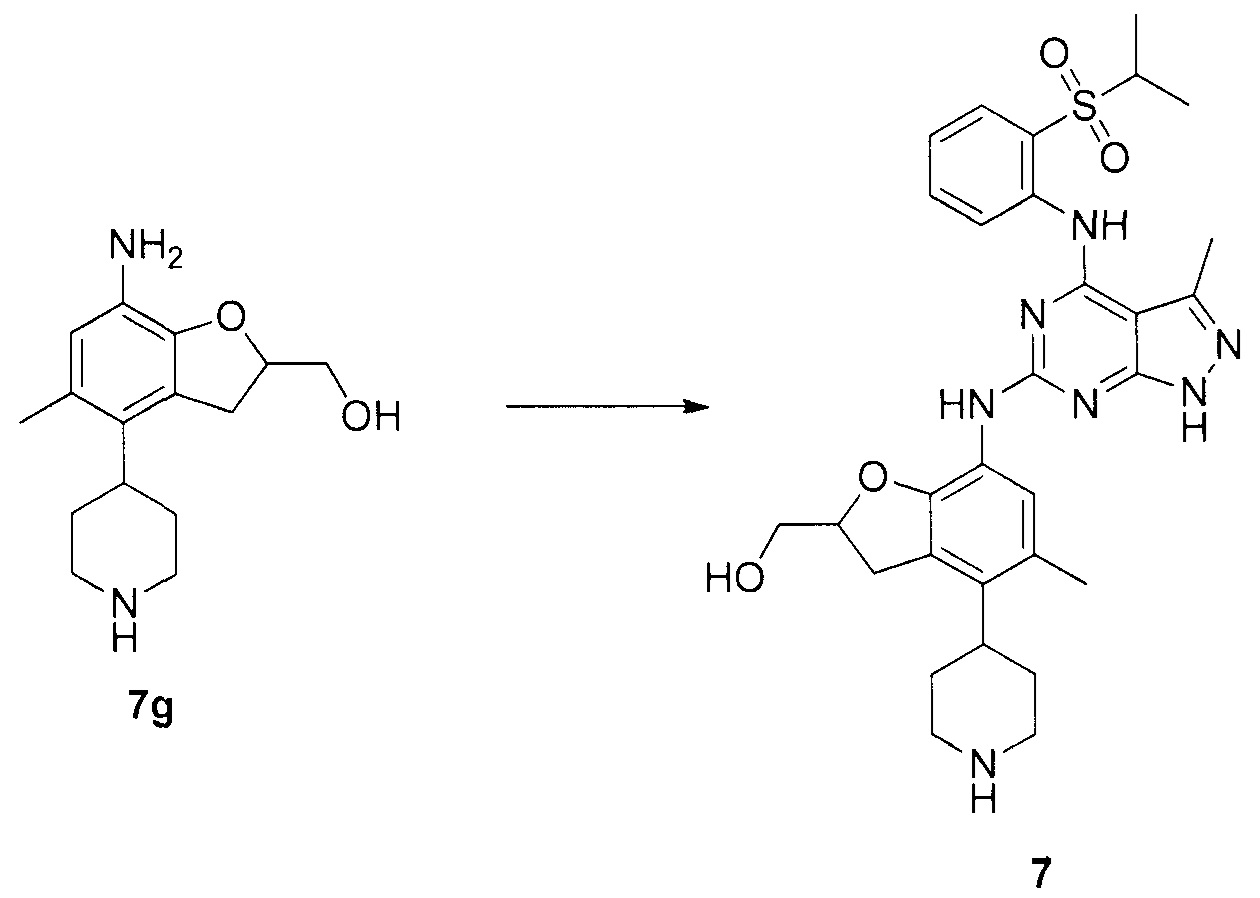
Смесь (7-амино-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензо-фуран-2-ил)метанола (7g) (40 мг, 0,15 ммоль), N-(2-(изопропил-сульфонил)фенил)-3-метил-6-(метилсульфонил)-1H-пиразоло[3,4-d]пиримидин-4-амина (Промежуточного соединения A) (75 мг, 0,18 ммоль) и p-TsOH (29 мг, 0,15 ммоль) в i-PrOH (0,5 мл) перемешивали в закрытой пробирке при 160°C в течение 5 ч. Смесь разбавляли EtOAc (20 мл), добавляли гидроксид аммония до pH =10, экстрагировали EtOAc (60 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием ДХМ/MeOH (10:1), получив указанное в заголовке соединение (7) в виде желтого твердого вещества. MS-ESI (m/z): 592 (M+1)+.
Пример 8
N-4-(2-(изопропилсульфонил)фенил)-N-6-(2-(метоксиметил)-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (8)
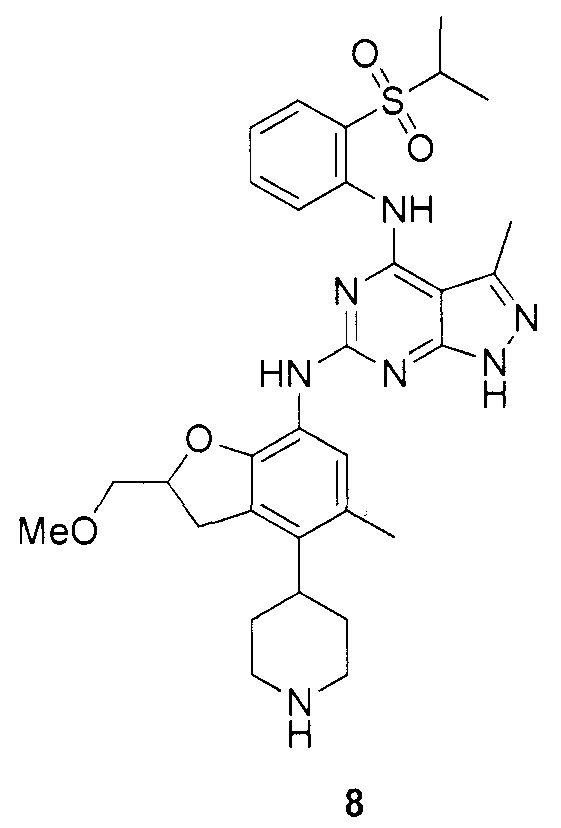
2-(метоксиметил)-5-метил-7-нитро-2,3-дигидробензофуран (8a)
Смесь (5-метил-7-нитро-2,3-дигидробензофуран-2-ил)метанола (0,70 г, 3,3 ммоль) в ТГФ охлаждали до 0°C. К смеси при 0°C добавляли NaH. Смесь перемешивали в течение 15 мин при 0°C. К смеси при 0°C по каплям добавляли MeI. Смесь перемешивали в течение 0,5 ч при 0°C. Смесь вливали в воду (20 мл), экстрагировали EtOAc (40 мл), промывали водой, рассолом, сушили и выпаривали, получив указанное в заголовке соединение (8a) в виде желтого масла. MS-ESI (m/z): 224 (M+1)+.
2-(метоксиметил)-5-метил-2,3-дигидробензофуран-7-амин (8b)
В смесь 2-(метоксиметил)-5-метил-7-нитро-2,3-дигидробензофу-рана (8a) (0,85 г, 3,8 ммоль) и Pd/C (90 мг, 10%) в ТГФ (10 мл) вводили H2 и перемешивали при температуре окружающей среды в течение 12 ч. Смесь фильровали через целит и выпаривали с получением указанного в заголовке соединения (8b) в виде масла. MS-ESI (m/z): 194 (M+1)+.
4-бром-2-(метоксиметил)-5-метил-2,3-дигидробензофуран-7-амин (8c)
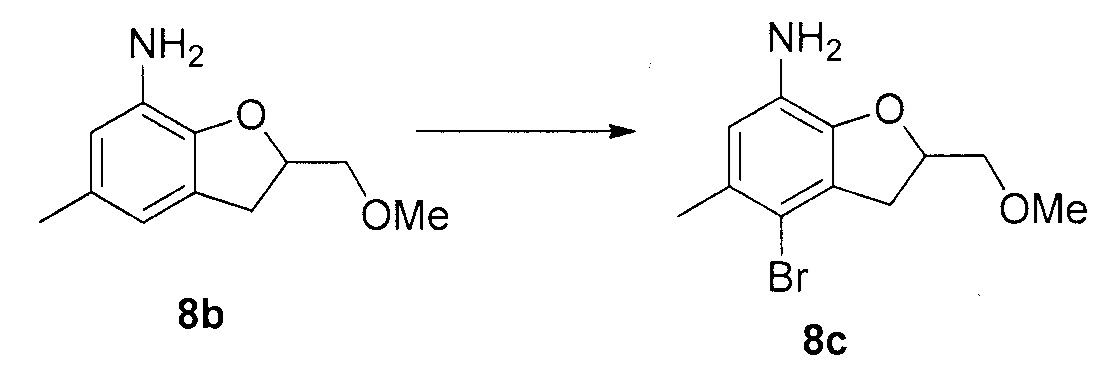
К смеси 2-(метоксиметил)-5-метил-2,3-дигидробензофуран-7-амина (8b) (0,60 г, 3,1 ммоль) в ДМФА (8 мл) при 0°C добавляли NBS (0,55 г, 3,1 ммоль). Смесь перемешивали при 0°C в течение 15 мин, после чего смесь экстрагировали EtOAc (40 мл), промывали NaHSO3 (20 мл), водой, рассолом, сушили и выпаривали с получением указанного в заголовке соединения (8c) в виде желтого масла. MS-ESI (m/z): 272 (M+1)+.
2-(метоксиметил)-5-метил-4-(пиридин-4-ил)-2,3-дигидробензофуран-7-амин (8d)
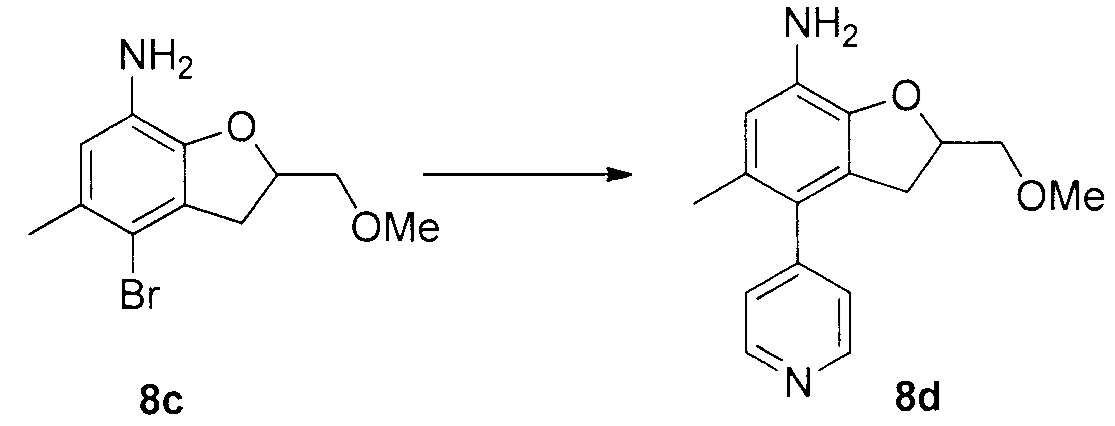
Смесь 4-бром-2-(метоксиметил)-5-метил-2,3-дигидробензофуран-7-амина (8c) (0,85 г, 3,1 ммоль), пиридин-4-илбороновой кислоты (0,76 г, 6,2 ммоль), Cs2CO3 (2,5 г, 7,8 ммоль), Pd(PPh3)4 (0,18 г, 0,16 ммоль) и воды (6 мл) в ДМФА (20 мл) перемешивали при 135°C под N2 в течение 1 ч. Смесь охлаждали до температуры окружающей среды, вливали в воду (50 мл), экстрагировали EtOAc (60 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием в смеси гексанов/EtOAc (20:1 → 5:1 → 1:1), получив указанное в заголовке соединение (8d) в виде желтого масла. MS-ESI (m/z): 271 (M+1)+.
2-(метоксиметил)-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофу-ран-7-амин (8e)
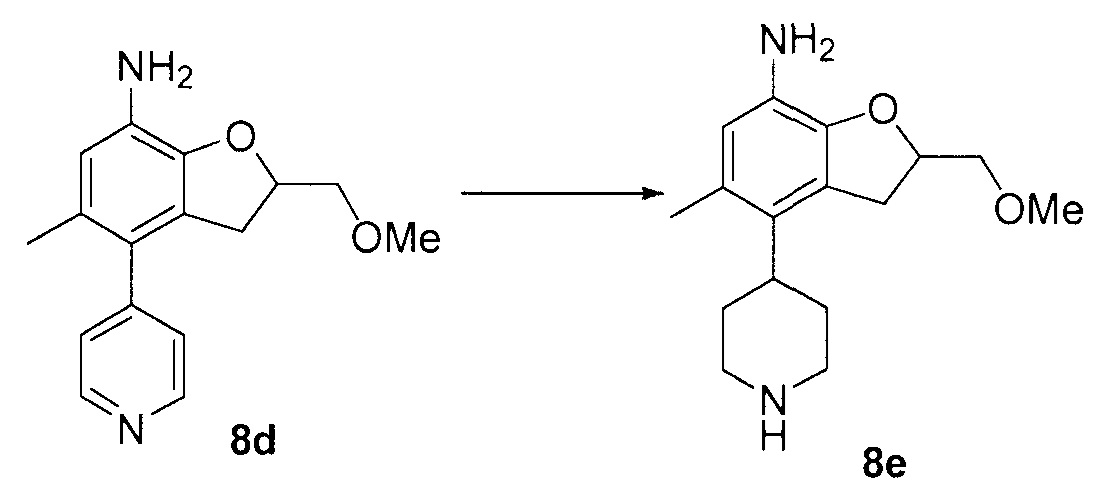
В смесь 2-(метоксиметил)-5-метил-4-(пиридин-4-ил)-2,3-дигидробензофуран-7-амина (8d) (0,57 г, 2,1 ммоль), PtO2 (300 мг, 50%) и ТЭА (0,323 мл, 4,20 ммоль) в HOAc (15 мл) вводили H2 и перемешивали при температуре окружающей среды в течение 24 ч (88 psi (606,7 кПа)). Смесь фильтровали, выпаривали, разбавляли EtOAc (50 мл) и добавляли раствор гидроксида аммония до pH = 10. Затем смесь экстрагировали EtOAc (150 мл), промывали водой, рассолом, сушили и выпаривали, получив указанное в заголовке соединение (8e) в виде желтого масла. MS-ESI (m/z): 277 (M+1)+.
N-4-(2-(изопропилсульфонил)фенил)-N-6-(2-(метоксиметил)-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-3-метил-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (8)
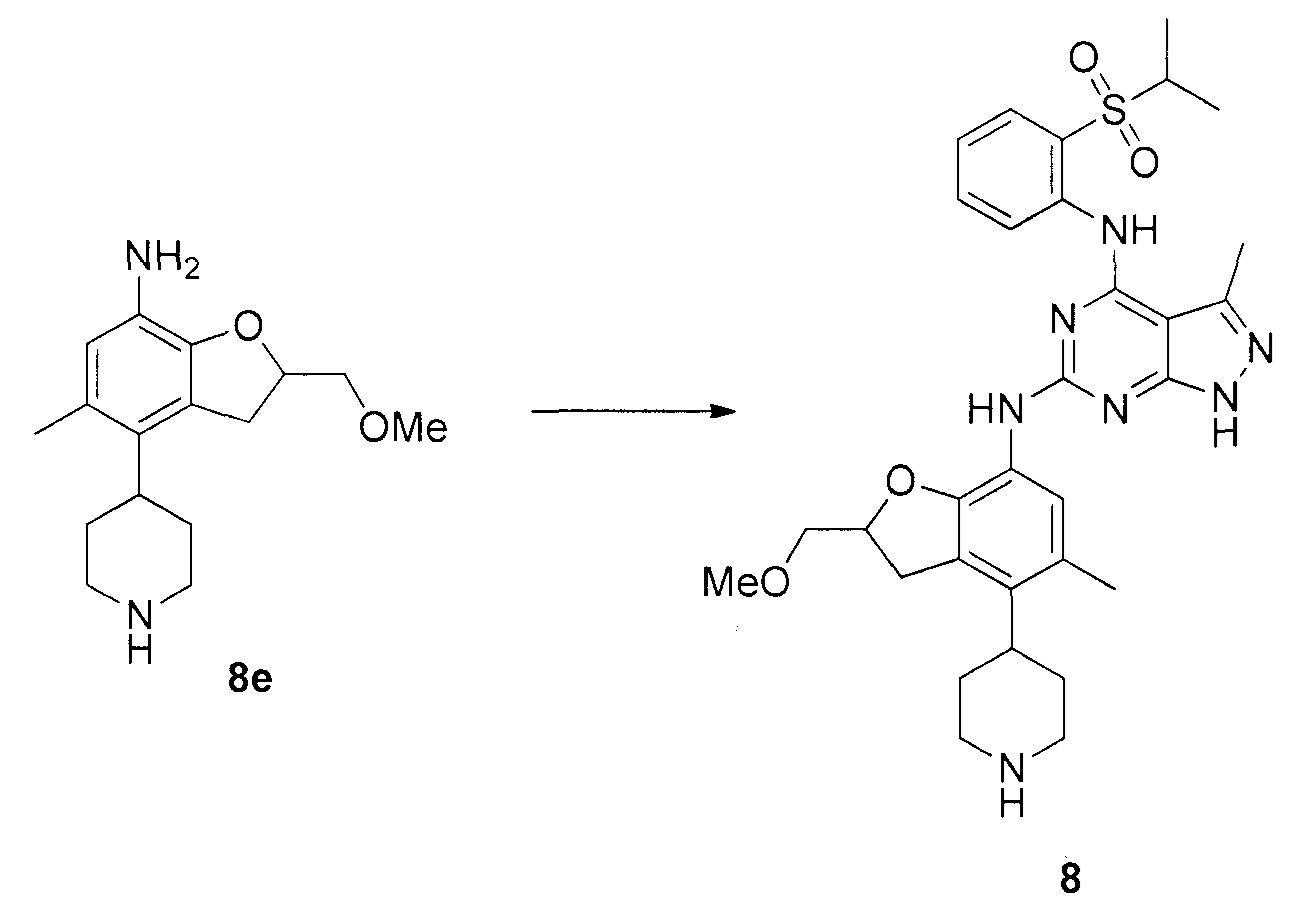
Смесь (7-амино-5-метил-4-(пиперидин-4-ил)-2,3-дигидробензо-фуран-2-ил)метанола (8e) (100 мг, 0,36 ммоль), N-(2-(изопропилсульфонил)фенил)-3-метил-6-(метилсульфонил)-1H-пиразоло[3,4-d]пиримидин-4-амина (Промежуточное соединение A) (163 мг, 0,400 ммоль) и p-TsOH (69 мг, 0,36 ммоль) в i-PrOH (0,5 мл) перемешивали в закрытой пробирке при 160°C в течение 5 ч. Смесь разбавляли ДХМ (20 мл), добавляли гидроксид аммония до pH=10, экстрагировали ДХМ (60 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием ДХМ/MeOH (10:1), получив указанное в заголовке соединение (8) в виде желтого твердого вещества. MS-ESI (m/z): 606 (M+1)+.
Пример 9
(R)-5-хлор-N-2-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидробензо-фуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)пиримидин-2,4-диамин (9)
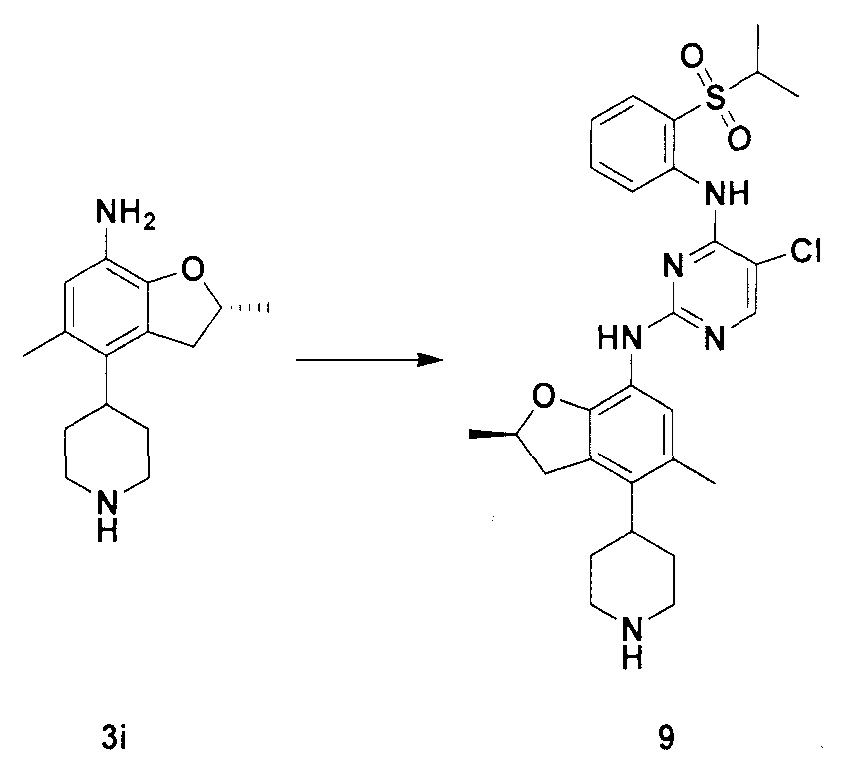
Смесь 3i (0,8 г, 3,5 ммоль), Промежуточного соединения B (1,32 г, 3,8 ммоль) и ТФУ (1,0 г, 8,8 ммоль) перемешивали в закрытой пробирке при 130°C в течение 5 ч. Смесь разбавляли EtOAc (20 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием ДХМ/MeOH (10:1), получив указанное в заголовке соединение (9) в виде коричневого твердого вещества. MS-ESI (m/z): 556 (M+1)+.
Пример 10
(R)-5-хлор-N-2-(2,5-диметил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)пири-мидин-2,4-диамин (10)
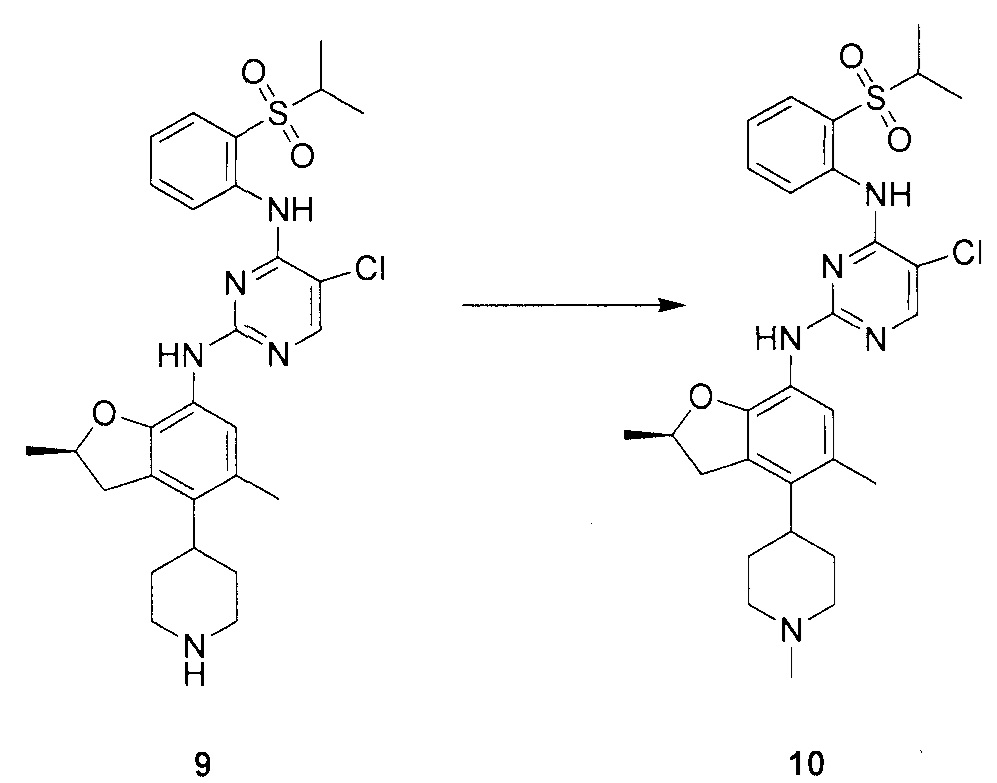
Смесь соединения 9 (210 мг, 0,38 ммоль), формальдегида (11,4 мг, 0,38 ммоль) и NaBH3CN (57,3 мг, 0,91 ммоль) перемешивали при температуре окружающей среды в течение 0,5 ч. Смесь разбавляли NaHCO3 (10 мл) и EtOAc (20 мл), экстрагировали EtOAc (60 мл), промывали водой, рассолом, сушили и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле элюированием ДХМ/MeOH (10:1), получив указанное в заголовке соединение (10) в виде желтого твердого вещества. MS-ESI (m/z): 570 (M+1)+.
Пример 11
(S)-5-хлор-N-2-(2,5-диметил-4-(пиперидин-4-ил)-2,3-дигидро-бензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)пиримидин-2,4-диамин (11)
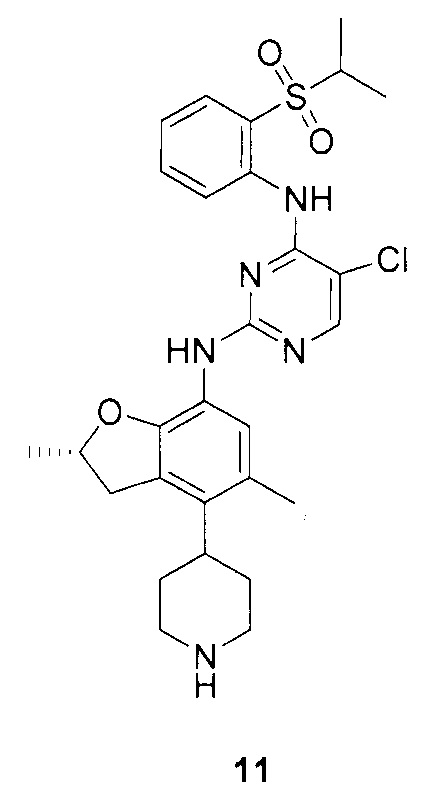
Получали согласно способу Примера 9, заменив соединение 3i соединением 5h. Было получено указанное в заголовке соединение (11). MS-ESI (m/z): 556 (M+1)+.
Пример 12
(S)-5-хлор-N-2-(2,5-диметил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)-N-4-(2-(изопропилсульфонил)фенил)пири-мидин-2,4-диамин (12)
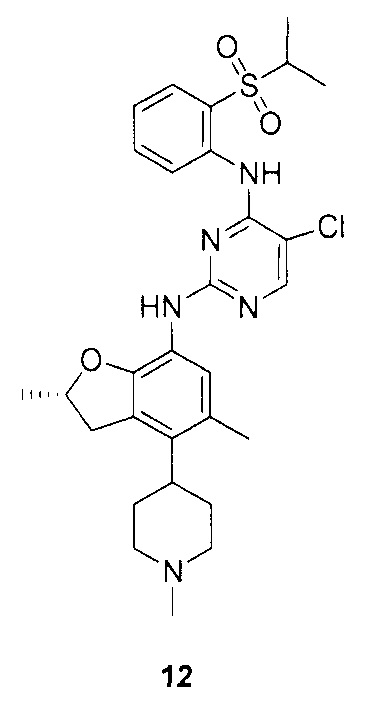
Получали согласно способу Примера 10, заменив соединение 9 соединением 11. Было получено указанное в заголовке соединение (12). MS-ESI (m/z): 570 (M+1)+.
Пример 13
5-хлор-N-4-(2-(изопропилсульфонил)фенил)-N-2-(5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-ил)пиримидин-2,4-диамин (13)
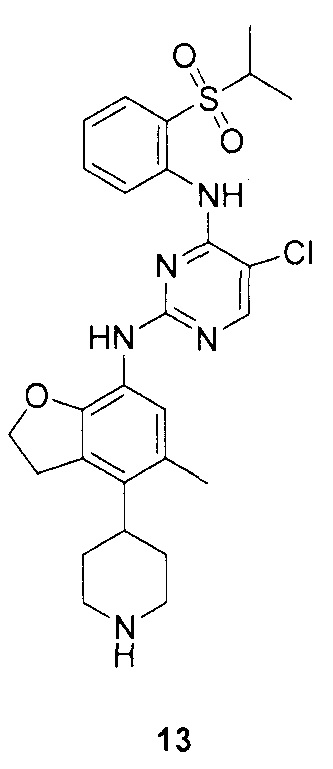
Получали согласно способу Примера 9, заменив соединение 3i 5-метил-4-(пиперидин-4-ил)-2,3-дигидробензофуран-7-амином (1g). Было получено указанное в заголовке соединение (13). MS-ESI (m/z): 542 (M+1)+.
Пример 14
5-хлор-N-4-(2-(изопропилсульфонил)фенил)-N-2-(5-метил-4-(1-метилпиперидин-4-ил)-2,3-дигидробензофуран-7-ил)пиримидин-2,4-диамин (14)
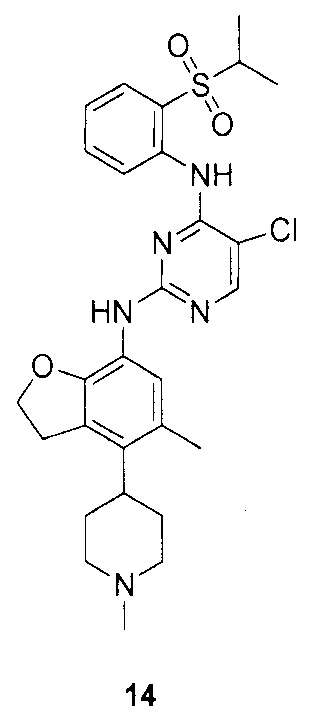
Получали согласно способу Примера 10, заменив соединение 9 соединением 13. Было получено указанное в заголовке соединение (14). MS-ESI (m/z): 556 (M+1)+.
Примеры 15-58
Примеры 15-58 (Таблица 1) были получены из соединения 9 или соединения 11 путем N-алкилирования, ацилирования или сульфонилирования, как показано на следующей схеме, используя условия, известные в уровне техники. Углерод, обозначеннй "*", имеет хиральность, как показано в химических структурах в Таблице 1.

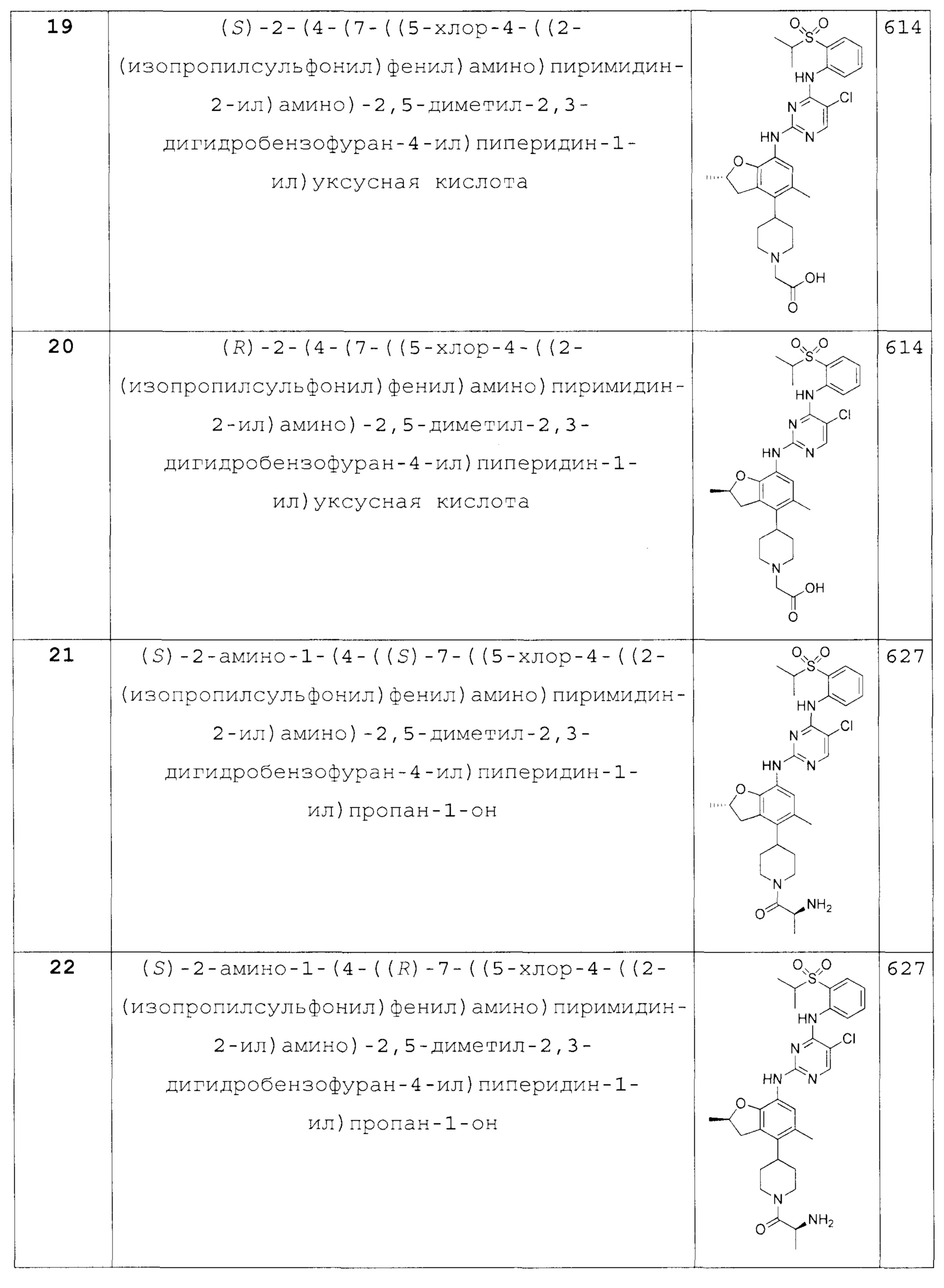
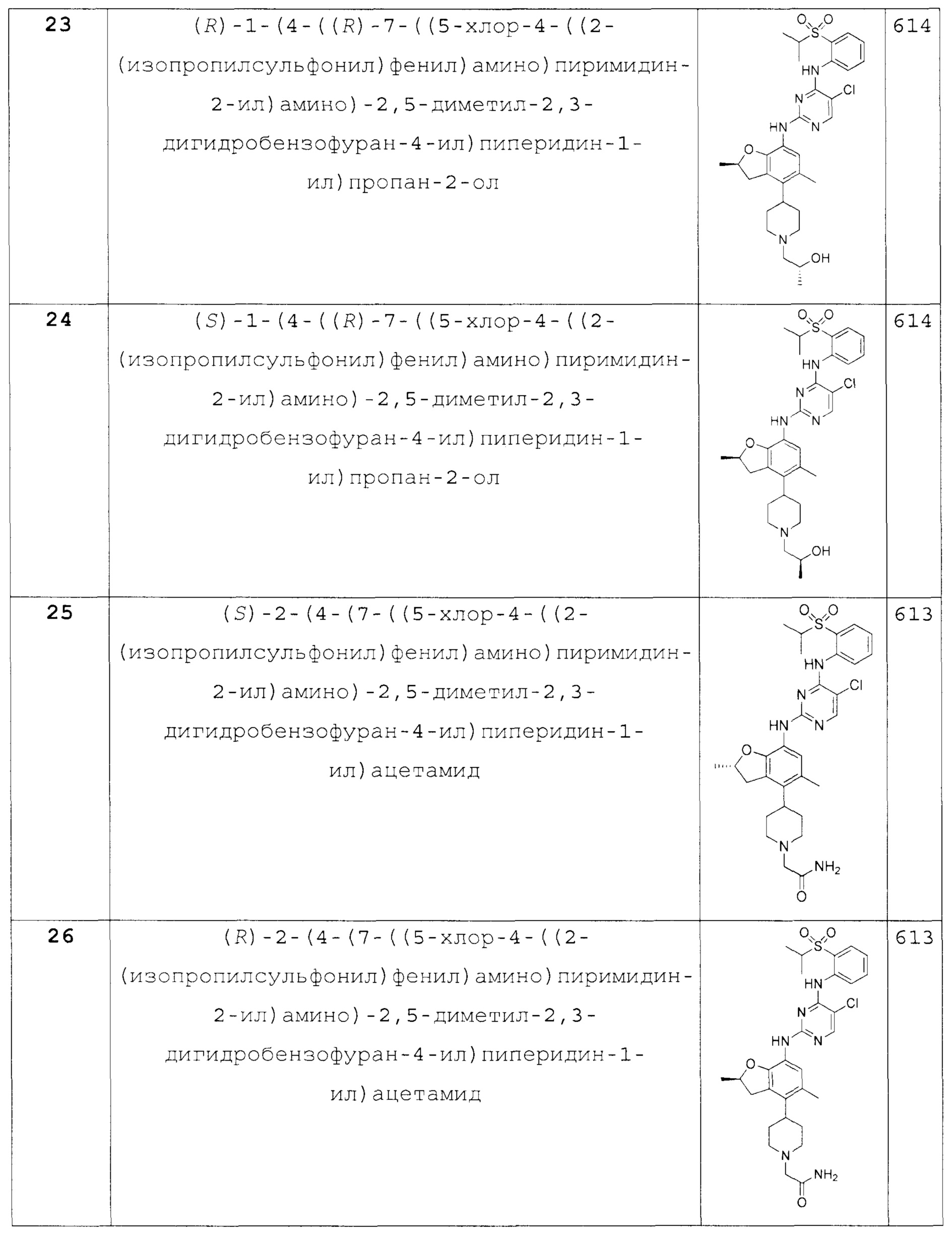
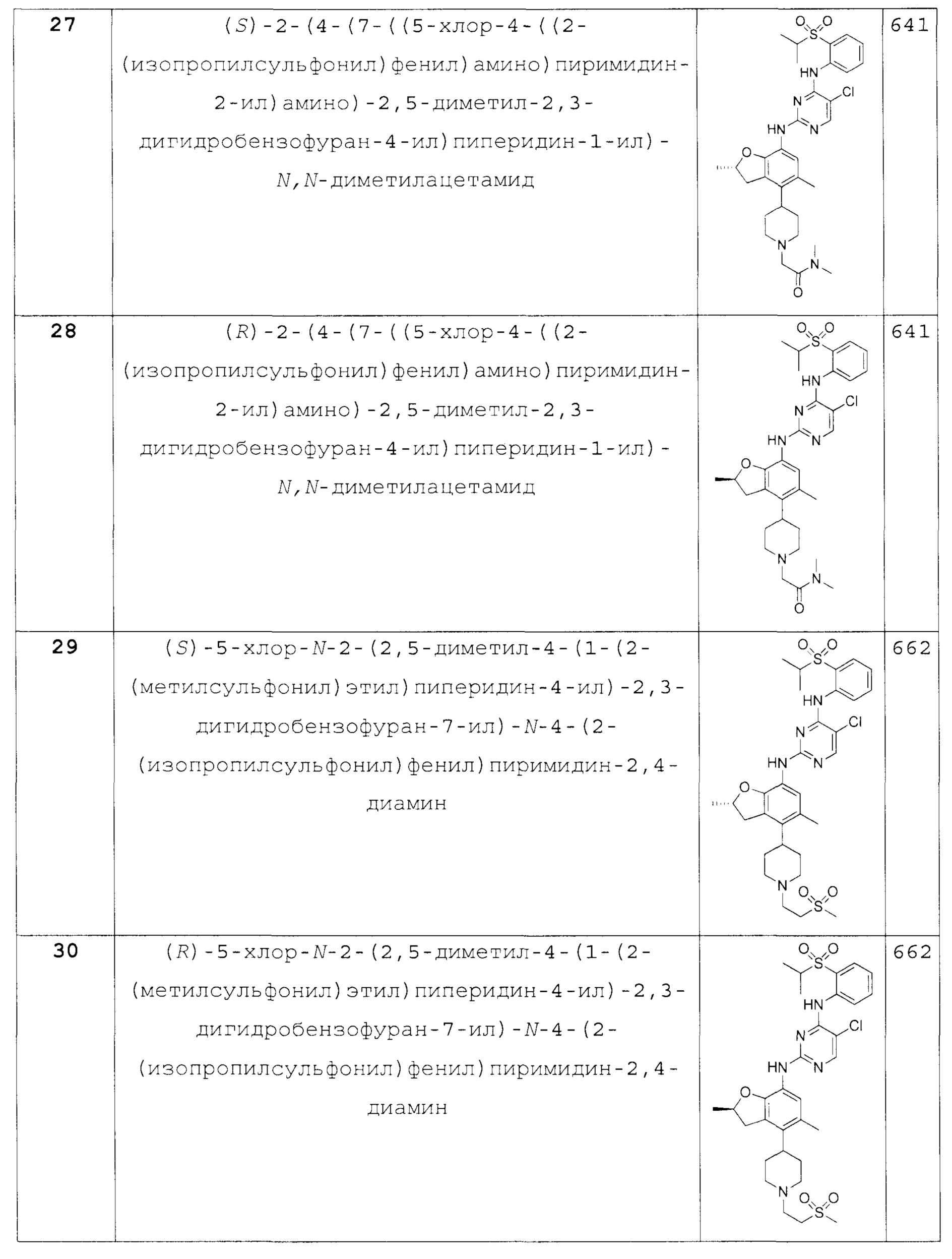
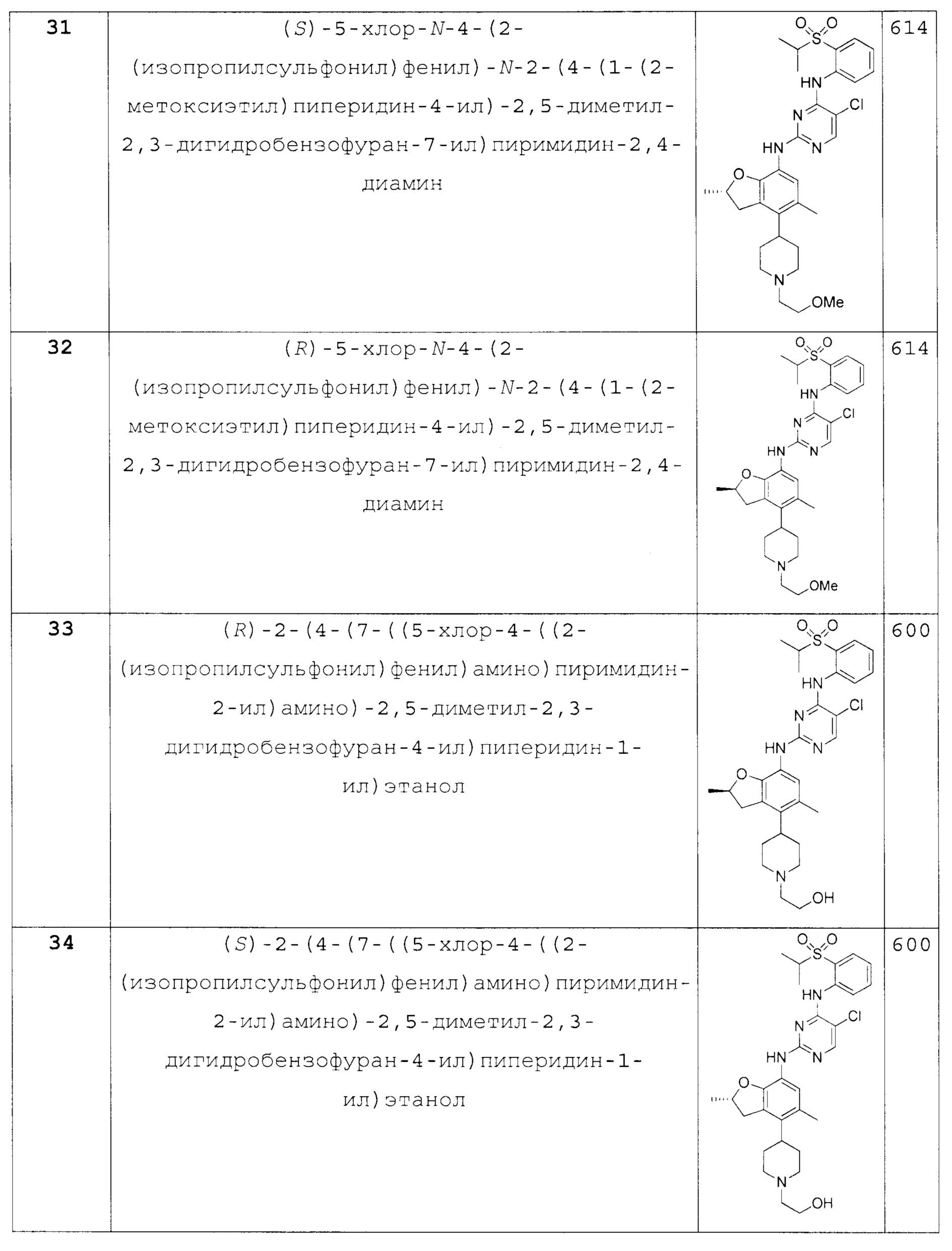
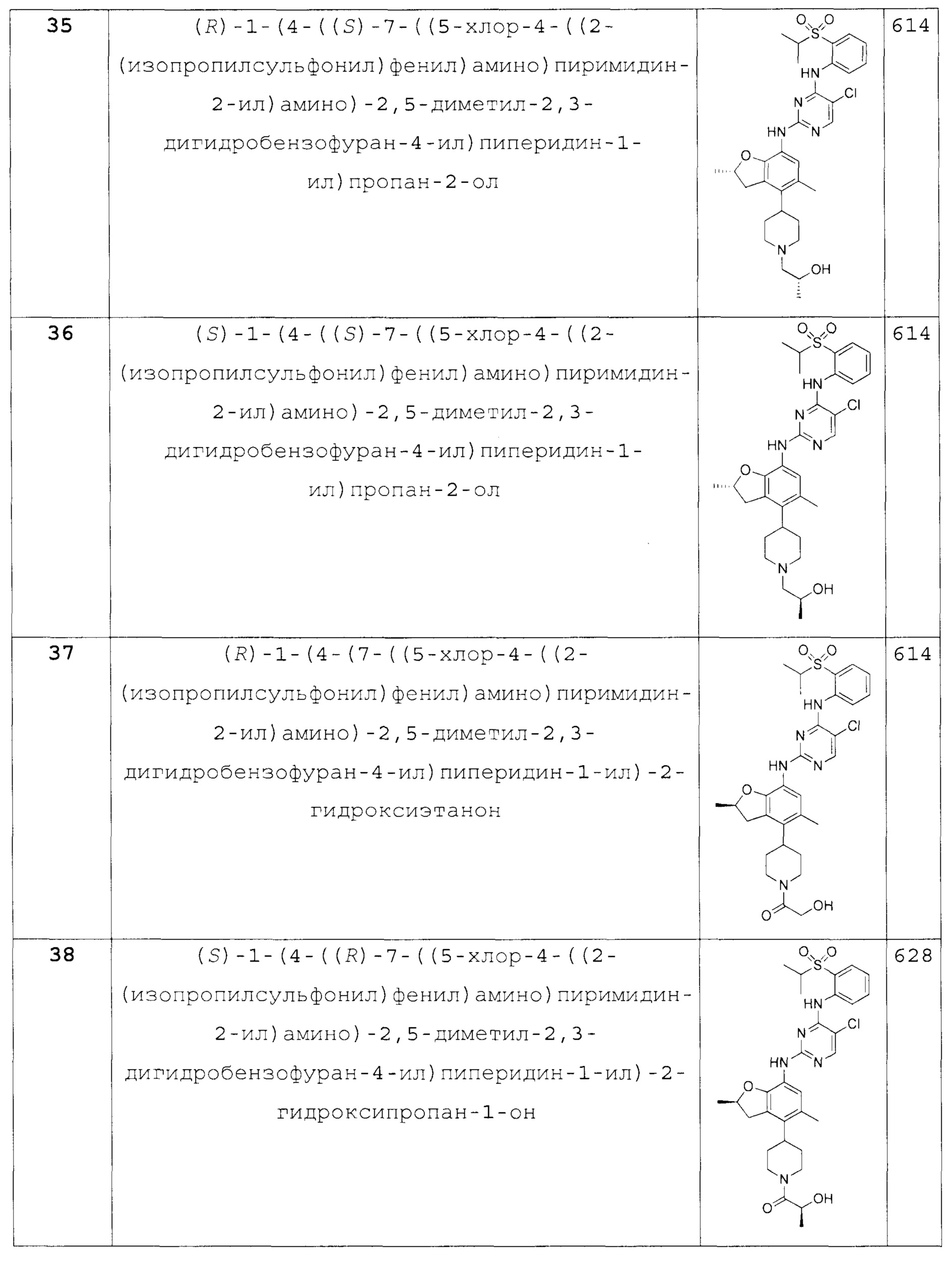
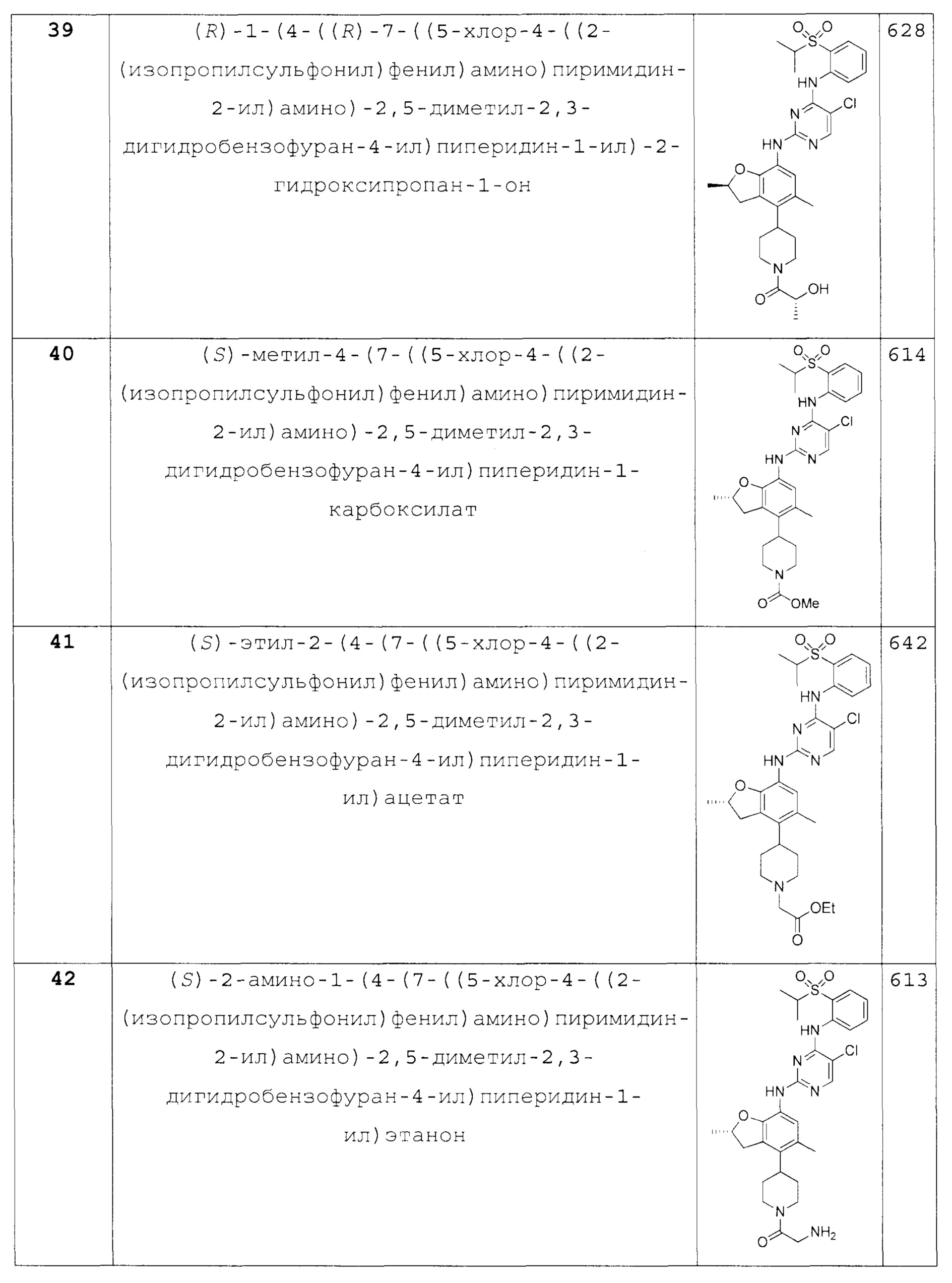
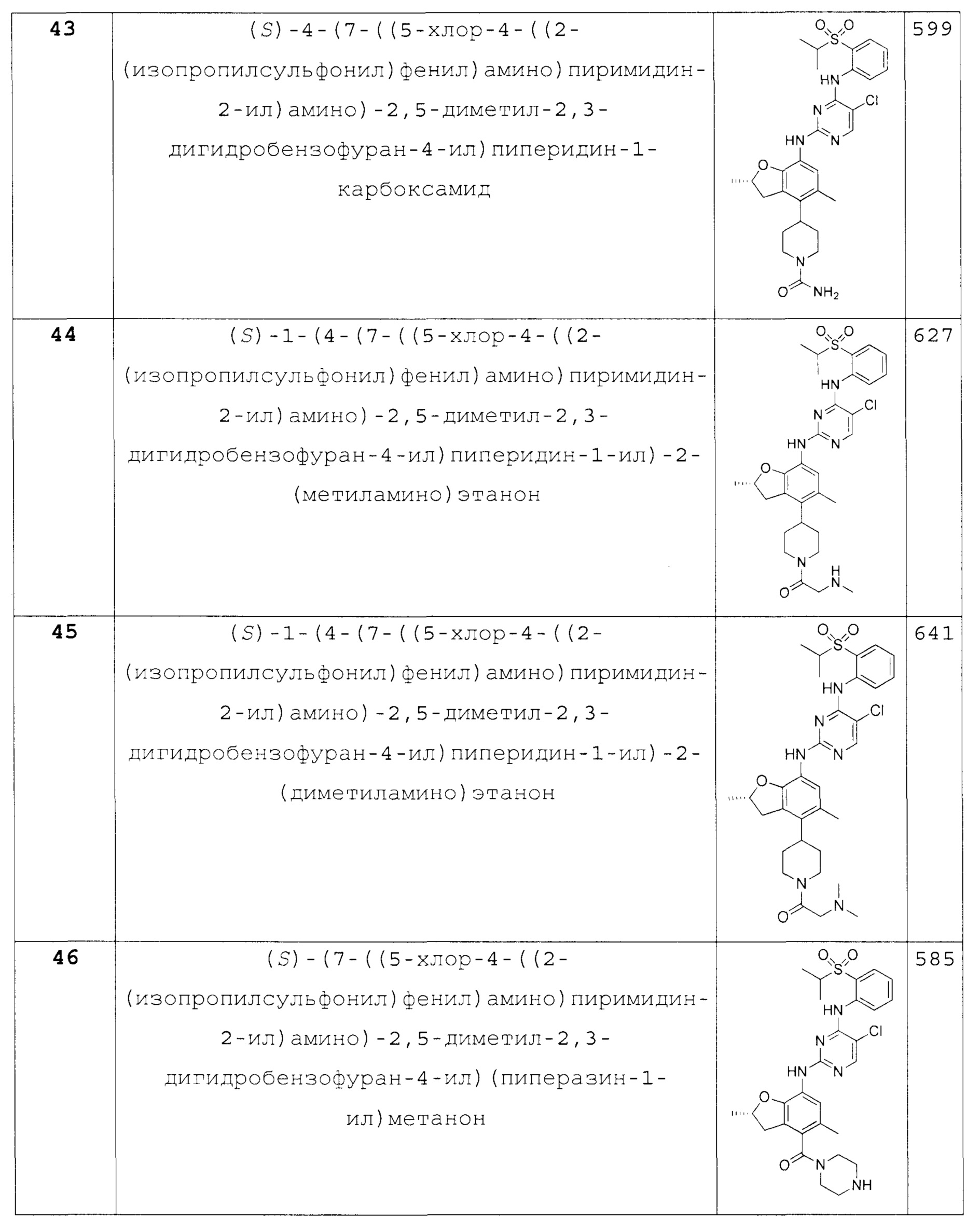
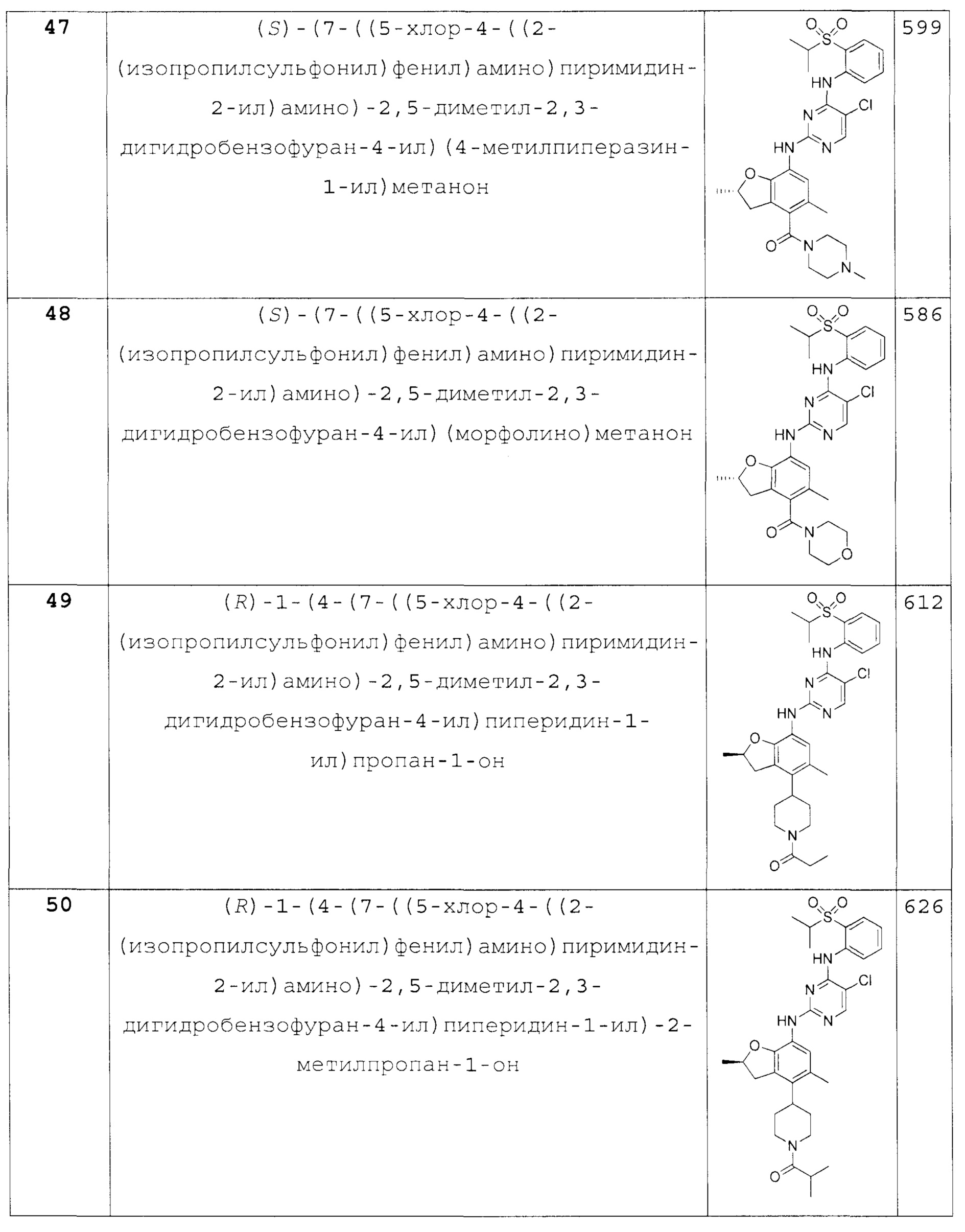
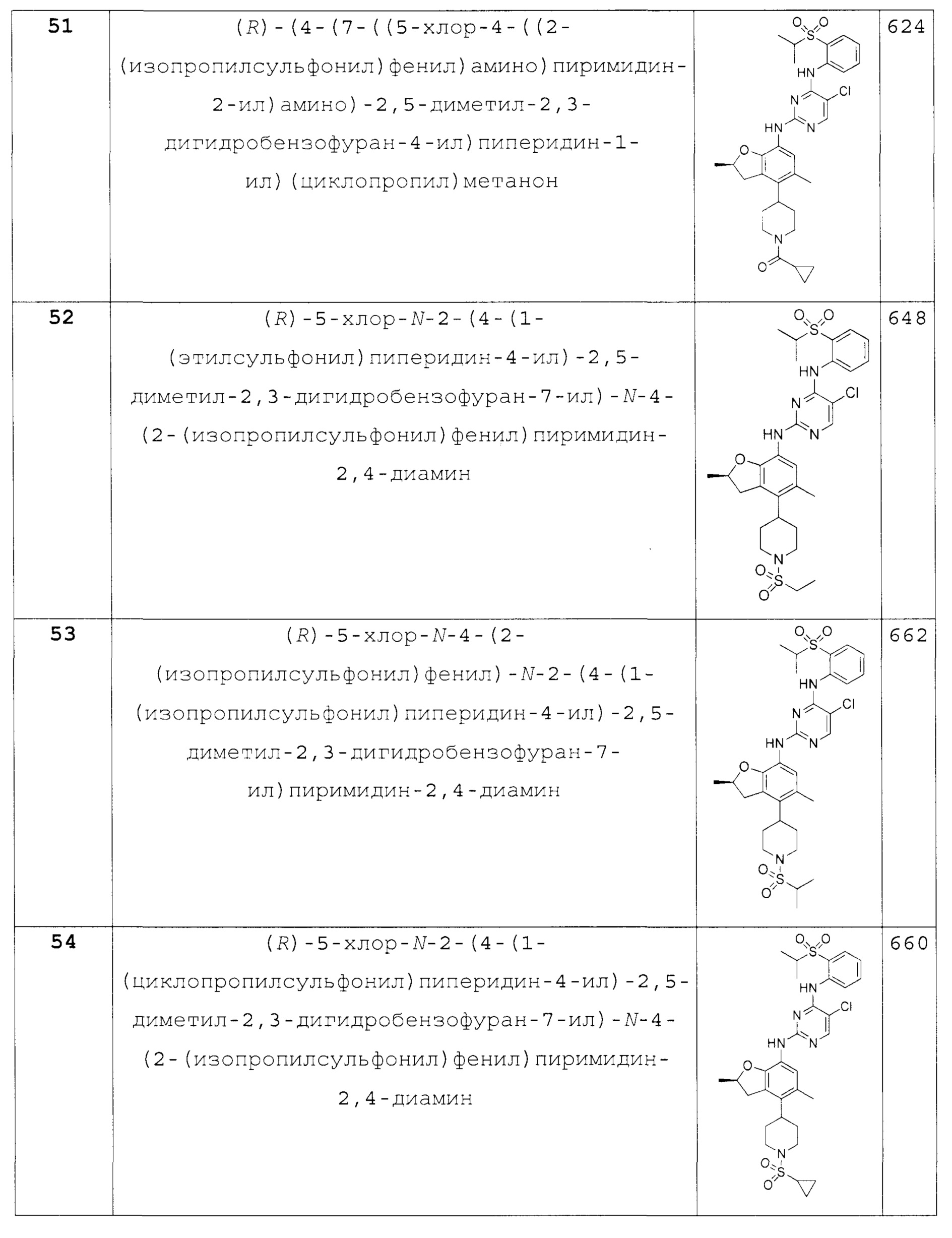
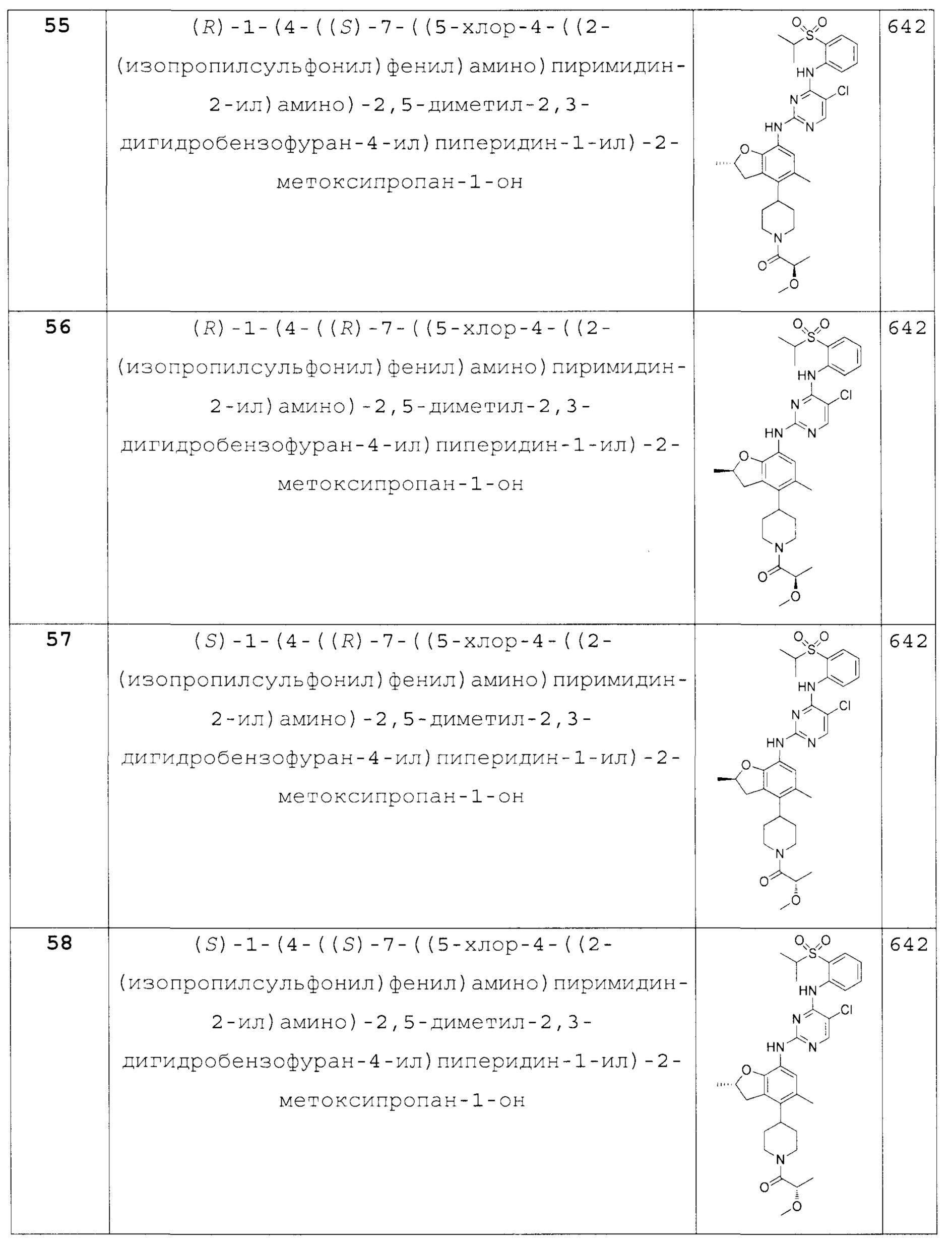
Биологическая активность
Ингибирующая активность в отношении пролиферации клеток
Клетки SU-DHL-1 сеяли в 96-луночные планшеты для культур тканей. На следующий день клетки обрабатывали различными концентрациями соединений и культивировали еще 72 ч. Затем определяли пролиферацию клеток, используя набор для анализа Cell Counting Kit-8 [(CCK-8), Dojindo]. Кратко, добавляли 10 л раствора CCK-8 в каждую лунку планшета. Инкубировали планшет в течение 1-4 ч в термостате. Измеряли оптическое поглощение при 450 нм с помощью спектрофотометра для микропланшетов (SpectraMAX 190, Molecular Devices). Процент ингибирования (%) вычисляли, используя следующее уравнение: [1-(A450 соединения/A450 контроля)]%×100. Значения IC50 вычисляли по кривой ингибирования с четырехпараметрическим соответствием.
Биологические данные для отдельных соединений
Некоторые соединения, полученные, как описано выше, анализировали согласно биологическим методикам, описанным в настоящей заявке. Результаты приведены в таблице 2.
|
|
|
Противоопухолевая активность in vivo
Самцов голых мышей (возрастом 6 недель) содержали в специальной беспатогенной комнате со световым циклом 12 часов света/темноты при 20-25°C и кормили обработанным в автоклаве кормом и водой без ограничения.
Клетки NCI-H2228 при плотности 5,1×106 в 200 л сначала вживляли п/к в правый бок каждой голой мыши, а затем позволяли вырасти до объема более 230 мм3, после чего мышей рандомизированно распределяли в контрольную группу и группы лечения (n=6 в группе лечения соединениями, n=12 в группе, получавшей растворитель). Контрольная группа получала только растворитель, а группы лечения получали соединение 4, LDK378 или кризотиниб в указанных дозах, внутрь, ежедневно, в течение 21 дня. Объемы опухоли у мышей в каждой группе измеряли два раза в неделю.
Результаты приведены в Таблице 3 и на Фигуре 1.
|