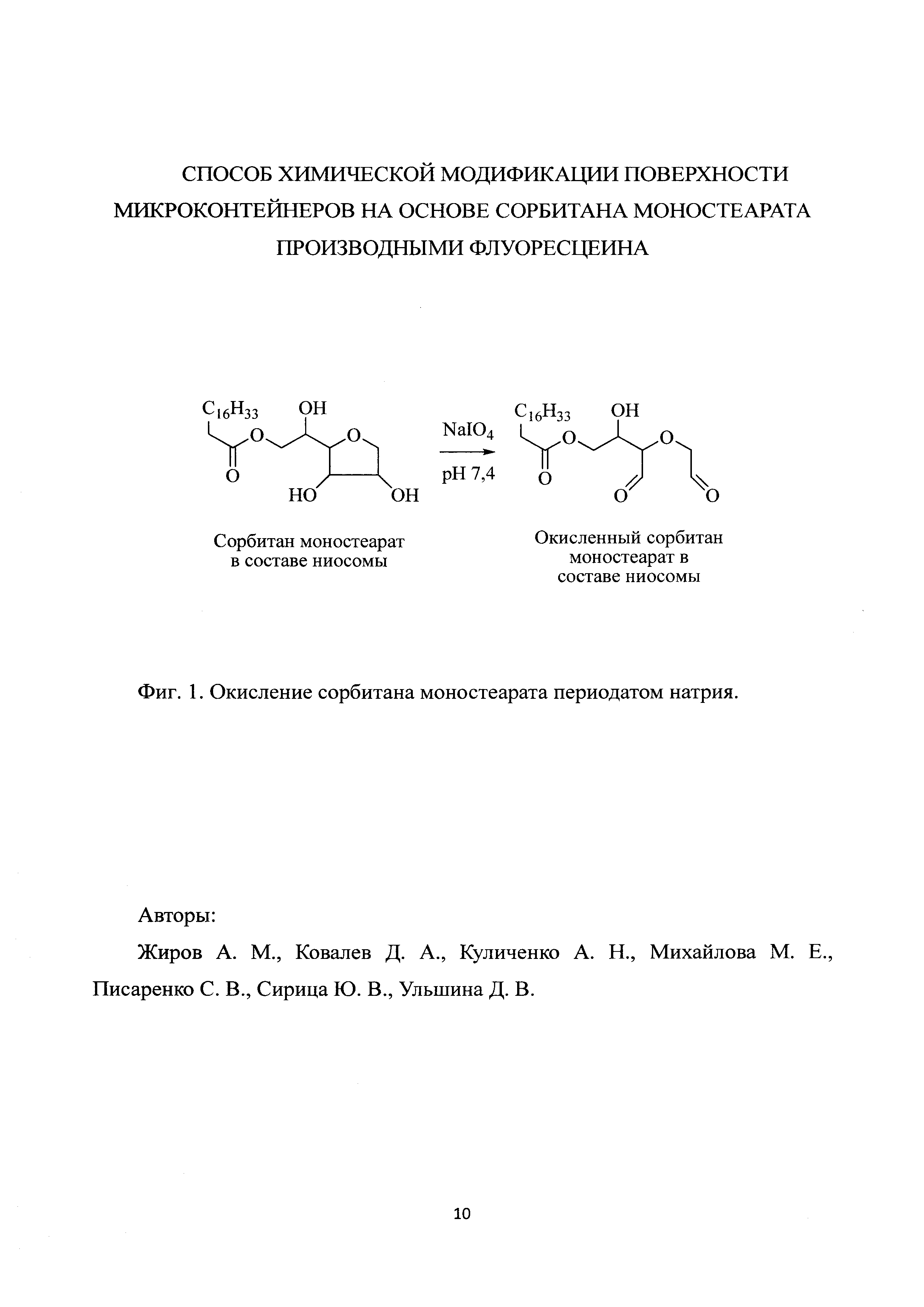
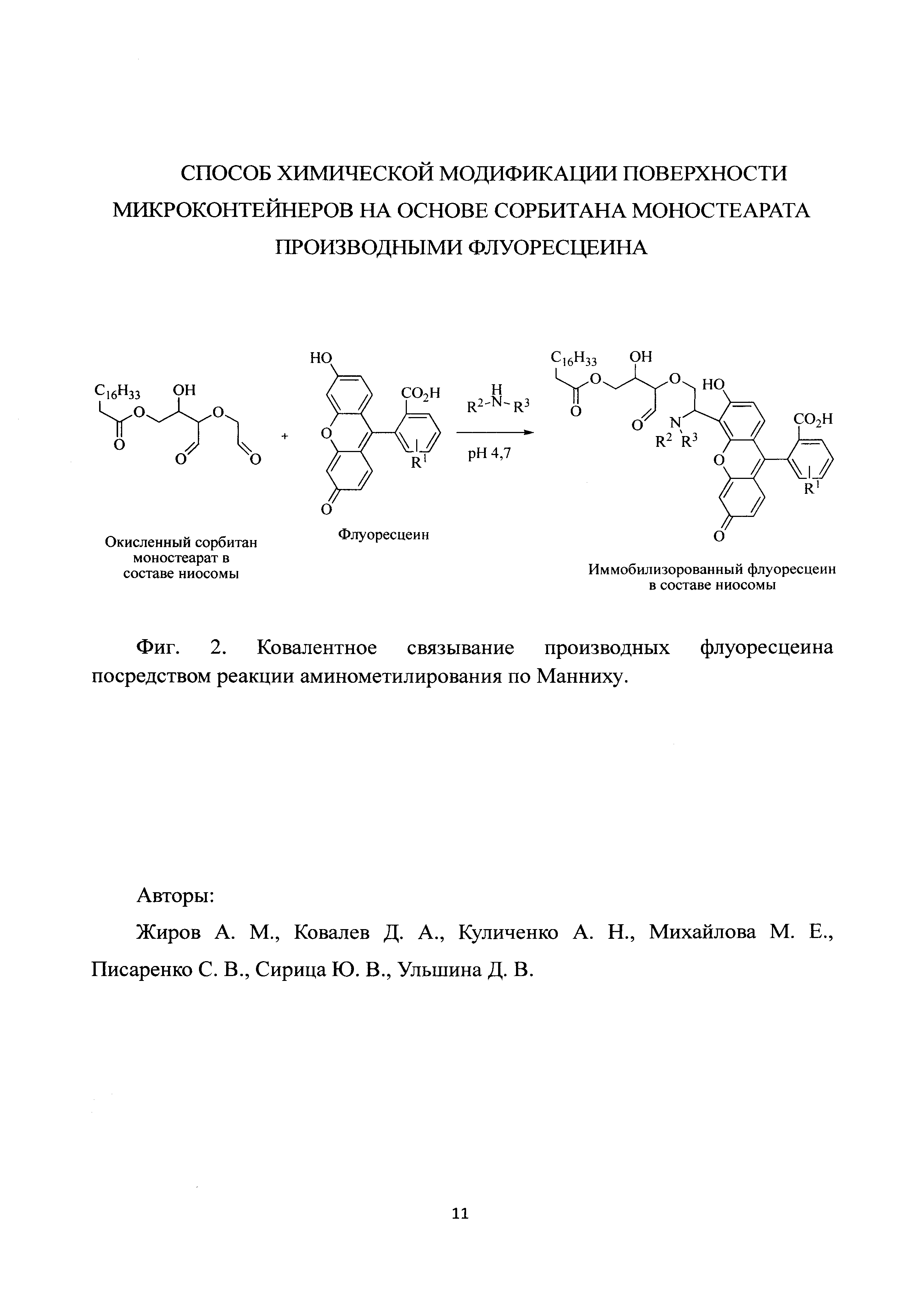
Результат интеллектуальной деятельности: СПОСОБ ХИМИЧЕСКОЙ МОДИФИКАЦИИ ПОВЕРХНОСТИ МИКРОКОНТЕЙНЕРОВ НА ОСНОВЕ СОРБИТАНА МОНОСТЕАРАТА ПРОИЗВОДНЫХ ФЛУОРЕСЦЕИНА
Вид РИД
Изобретение
Изобретение относится к биотехнологии и нанотехнологии, а именно к способу химической модификации поверхности ниосомальных микровезикул и может быть использовано для ковалентного модифицирования поверхности микро- и наночастиц производными флуоресцеина, открывает возможности для создания мультифункциональных наночастиц для диагностики и терапии различных заболеваний [1].
Создание микроконтейнеров для адресной доставки биологически активных веществ (БАВ) - одно из перспективных направлений современной биотехнологии и фармакологии. Такой подход позволяет существенно повысить эффективность применения лекарственных и биологически активных веществ. Особый интерес в качестве средства адресной доставки БАВ представляют микроконтейнеры на основе неионных поверхностно-активных веществ (ПАВ) - ниосомы. Широкое использование неионных ПАВ и липидов в конструировании подобных систем обусловлено их биосовместимостью, способностью к биодеградации, низкой токсичностью. Применение ниосомальных лекарственных форм, в том числе позволяет снизить степень их биологической инактивации, повысить биодоступность при введении per os [2], а также обеспечить пролонгированное действие лекарственной субстанции [3].
Важным этапом оценки эффективности систем направленного транспорта является изучение тропности соответствующих микроконтейнеров к клеткам ткани-мишени. В целях обеспечения возможности детекции микрочастиц в образцах органа или ткани, как правило, в состав включают радиоизотопную или флуоресцентную метку [4].
Методы количественного анализа, основанные на измерении флуоресцентного сигнала, отличаются чувствительностью, специфичностью, безопасностью и удобством применения. Однако в случае экспериментальных работ с ниосомальными дисперсиями, содержащими микрокапсулированные производные флуоресцеина или другие низкомолекулярные полярные вещества, существует ряд ограничений, препятствующих их обнаружению с помощью оптических методов. В частности, концентрация включенного в ниосомы флуорофора значительно изменяется вследствие относительно высокой интенсивности диффузии красителя из носителя, что приводит к искажению данных при исследовании динамики распределения и тропности ниосом в организме биопробных животных. Один из путей повышения эффективности связывания флуоресцентных веществ с ниосомами - химическая модификация поверхности микрочастиц за счет образования ковалентной связи между молекулой красителя и структурообразующим компонентом микрочастицы [5].
Известен способ иммобилизации моноклональных антител и других соединений на поверхности ниосом. Метод реализуется за счет взаимодействия цианурхлорида с Tween 61, в ходе которого происходит образование активного реакционного центра. Активированный таким образом Tween 61 вводится в состав ниосомальной дисперсии на этапе получения микровезикул. Последующая иммобилизация антител на поверхности ниосом происходит путем образования химической связи с остатком цианурхлорида, входящего в состав активированного Tween 61. Основными недостатками этого способа являются высокая токсичность цианурхлорида и неселективность используемой реакции. Указанный метод неприменим для модификации ниосом производными флуоресцеина или иными соединениями, не содержащими аминогруппы [6].
Наиболее близким к заявляемому изобретению является методика ковалентной модификации компонентов липосом аминосодержащими соединениями посредством периодатного окисления поверхностных диольных функциональных групп с последующей иммобилизацией целевого фрагмента реакцией восстановительного аминирования боргидридом или цианборгидридом натрия. Основным недостатком описанного метода является то, что иммобилизации могут подвергаться только молекулы, содержащие аминогруппы, т.е. метод не применим для ковалентного связывания большинства типов известных флуорофоров. Кроме того, препаративное получение микрочастиц, модифицированных указанным методом, следует охарактеризовать как экономически неэффективное, учитывая высокую стоимость восстанавливающих реагентов [7].
Целью изобретения является разработка способа химической модификации поверхности микроконтейнеров на основе сорбитана моностеарата производными флуоресцеина.
Технический результат предлагаемого изобретения достигается путем использования для иммобилизации целевых молекул на поверхности ниосом, активированных периодатом, реакции аминометилирования (реакции Манниха) [8]. Оптимизация условий проведения аминометилирования позволяет получать ниосомальные микровезикулы с иммобилизированными молекулами производных флуоресцеина с высокой эффективностью модификации поверхности.
Основу способа составляет периодатное окисление внешнего слоя липидной мембраны ниосом, в ходе которой происходит окисление виц-диольного фрагмента сорбитана моностеарата с образованием на поверхности микрочастицы альдегидных групп (фиг. 1), и последующее хемоселективное взаимодействие образующейся in situ из альдегидной и аминогрупп иминиевой соли с активным С-Н фрагментом производных флуоресцеина (фиг. 2).
Заявляемый способ обладает следующими отличительными от прототипа признаками:
- Химическая модификация поверхности микрочастиц происходит реакцией аминометилирования, а не восстановительного аминирования;
- Отсутствие вредных побочных продуктов в ходе реакции.
Оптимизация температуры и времени процесса химической модификации поверхности ниосом обеспечивает получение стандартизованных ниосомальных дисперсий с иммобилизованными соединениями с высокой эффективностью. Применение в качестве реакционной среды водных растворов позволяет эффективно проводить модификацию компонентов ниосом в мягких условиях, не изменяя физико-химические параметры липидного бислоя и морфологию ниосомальных микрочастиц.
Способ осуществляется следующим образом.
Препарат ниосом, полученный методом обращенно-фазовой отгонки [9], с использованием сорбитана моностеарата, холестерина и дицетилфосфата в массовом соотношением 9,62:9,62:1 разбавляют 0,01 М фосфатно-солевым буфером (рН 7,4) до концентрации 5 мг/мл. Затем в дисперсию ниосом вносят 0,3 М раствор периодата натрия (0,4 мл на 1 мл дисперсии ниосом) и выдерживают 2 ч при температуре (20±5)°С в защищенном от света месте. Далее для остановки реакции окисления и удаления избытка периодата натрия в реакционную смесь добавляют глицерин (25% объема внесенного 0,3 М периодата натрия). Активированные ниосомы для очистки и смены буферного раствора подвергают диализу против 50 объемов 0,01 М ацетатного буфера (рН 4,7) при температуре (20±5)°С. Оптимальное время диализа 24 ч с трехкратной сменой буфера каждые 8 ч. К 1 мл раствора активированных ниосом добавляют 0,05 объема 0,1 М раствора амина и 0,1 объема 0,02 М раствора производного флуоресцеина. Смесь выдерживают 48 ч при 40°С в отсутствие света. Раствор переносят в диализный мешок и диализируют 24 ч при (20±5)°С в 50 мл 0,01 М фосфатно-солевого буфера (рН 7,4) с его трехкратной сменой каждые 8 ч.
Определение концентрации производного флуоресцеина в образце препарата после диализа ниосом.
К аликвоте исследуемого образца ниосомальной дисперсии объемом 100 мкл добавляют 400 мкл изопропилового спирта и интенсивно перемешивают в течение 2 минут. Раствор фильтруют через фильтр с размером пор 0,22 мкм и используют для анализа содержания флуоресцирующего компонента.
Количественный анализ на содержание флуоресцентной метки проводят методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на приборе Ultimate 3000 («Dionex», США) с использованием флуориметрического детектора. Проводят не менее пяти измерений для каждого раствора. Параллельно проводят измерение концентраций калибровочных растворов флуоресцеина и карбоксифлуоресцеина (растворы, содержащие 0,01; 0,05; 0,1; 0,5; 2; 5; 10 ммоль производного флуоресцеина в воде), не менее пяти измерений для каждого раствора.
Эффективность иммобилизации флуоресцентной метки рассчитывают по формуле:
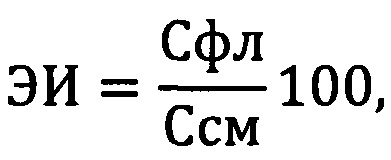
где ЭИ - эффективность иммобилизации флуоресцентной метки, в %;
Сфл - концентрация флуоресцентной метки в препарате, в ммоль/мл;
Ссм - концентрация сорбитана моностеарата в препарате, в ммоль/мл.
В результате проведенных исследований разработан способ получения ниосомальных дисперсий, химически модифицированных производными флуоресцеина.
Возможность практического применения заявленного способа подтверждается примерами его конкретного выполнения с использованием совокупности заявляемых признаков.
Пример 1.
К 1 мл раствора ниосом (5 мг/мл) в 0,01 М фосфатно-солевом буфере (рН 7,4) вносили 0,4 мл 0,3 М периодата натрия и выдерживали 2 ч при (20±5)°С в защищенном от света месте. Затем в реакционную смесь вносили 0,1 мл глицерина и диализировали 24 ч при (20±5)°С в 50 мл 0,01 М натрий ацетатного буфера (рН 4,7) с трехкратной его сменой каждые 8 ч. К 1 мл раствора активированных ниосом добавляли 0,05 мл 0,1 М диэтаноламина и 0,1 мл 0,02 М флуоресцеина. Смесь выдерживали 48 ч при 40°С в отсутствие света. Раствор переносили в диализный мешок и диализировали 24 ч при (20±5)°С в 50 мл 0,01 М фосфатно-солевого буфера (рН 7,4) с трехкратной сменой буфера каждые 8 ч. Эффективность ковалентного связывания флуоресцина составила (70±5) %.
Пример 2.
Отличается от примера 1 тем, что в качестве С-Н активного соединения использовали 5(6)-карбоксифлуоресцин. Эффективность ковалентного связывания 5(6)-карбоксифлуоресцина составила (71±4) %.
Пример 3.
Отличается от примера 1 тем, что вместо диэтаноламина использовали аминоуксусную кислоту. Эффективность ковалентного связывания флуоресцеина составила (64±6) %.
Пример 4.
Отличается от примера 1 тем, что вместо диэтаноламина и флуоресцеина использовали соответственно аминоуксусную кислоту и 5(6)-карбоксифлуоресцин. Эффективность ковалентного связывания 5(6)-карбоксифлуоресцина составила (69±3) %.
Пример 5.
Отличается от примера 1 тем, что вместо диэтаноламина использовали β-аланин. Эффективность ковалентного связывания флуоресцеина составила (60±4) %.
Пример 6.
Отличается от примера 1 тем, что вместо диэтаноламина и флуоресцеина использовали соответственно β-аланин 5(6)-карбоксифлуоресцин. Эффективность ковалентного связывания 5(6)-карбоксифлуоресцина составила (61±5) %.
Таким образом, была разработана методика ковалентного связывания флуоресцеина и 5(6)-карбоксифлуоресцина на поверхности ниосомальных микрочастиц на основе Span 60 с использованием реакции аминометилирования.
Используемая литература
1. Murthy, S.K. Nanoparticles in modern medicine: State of the art and future challenges / S.K. Murthy // Int. J. Nanomedicine. - 2007. - Vol. 2. - P. 129-141.
2. Jain, C.P. Preparation and characterization of niosomes containing rifampicin for lung targeting / C.P. Jain, S.P. Vyas // J. Microencap. - 1995. - Vol. 12. - P. 401-407.
3. Куличенко, A.H. Сравнительное изучение фармакокинетики офлоксацина в свободной и ниосомальной форме в эксперименте на белых мышах при введении per os / A.H. Куличенко, M.E. Михайлова, Д.А. Ковалёв, С.В. Писаренко, Ю.В. Сирица, Л.В. Ляпустина // Вестник РАМН. - 2014. - №1-2. - С. 80-84.
4. Licha, К. Optical imaging in drug discovery and diagnostic applications / K. Licha, С. Olbrich // Adv. Drug Deliv. Rev. - 2005. - Vol. 57. - P. 1087-1108.
5. Klymchenko, A.S. Highly lipophilic fluorescent dyes in nano-emulsions: Towards bright non-leaking nano-droplets / A.S. Klymchenko, E. Roger, N. Anton, H. Anton, I. Shulov, J. Vermot, Y. Mely, T.F. Vandamme // RSC Advances. - 2012. - Vol. 2. - P. 11876-11886.
6. Hood, E. Immuno-targeting of nonionic surfactant vesicles to inflammation / E. Hood, M. Gonzalez, A. Plaas, J. Strom, M. Van Auker // International Journal of Pharmaceutics. - 2007. - Vol. 339. - P. 222-230.
7. Heath, T.D. Covalent attachment of immunoglobulins to liposomes via glycosphingolipids / T.D. Heath, B.A. Macher, D. Papahadjopoulos // Biochimica et Biophysica Acta. - 1981. - Vol. 640. - P. 66-81.
8. Mannich, C. Ueber ein kondensationsprodukt aus formaldehyd, ammoniak und antipyrin / C. Mannich,  // Archiv der Pharmazie. - 1921. - Vol. 250. - P. 647-667.
// Archiv der Pharmazie. - 1921. - Vol. 250. - P. 647-667.
9. Ковалев, Д.А. Конструирование и характеристика ниосомных микровезикул для инкапсулирования офлоксацина на основе сорбитана моностеарата / Д.А. Ковалев, С.В. Писаренко, М.А. Ашихмина, А.Н. Куличенко // Биотехнология. - 2012. - №6. - С. 23-30.
Способ химической модификации поверхности микроконтейнеров на основе сорбитана моностеарата, основанный на хемоселективном взаимодействии в кислой среде аминогруппы и флуоресцеина с альдегидной группой, образованной в ходе периодатного окисления диольного фрагмента сорбитана моностеарата, отличающийся тем, что дисперсию ниосом (5 мг/мл) в 0,01 М фосфатно-солевом буфере (рН 7,4) смешивают с 0,3 М раствором периодата натрия в соотношении 1:0,4 (по объему) и выдерживают при температуре (20±5)°С в течение 2 ч без доступа света, затем добавляют 0,1 объема глицерина и удаляют избыток периодата натрия путем диализа против 50 объемов 0,01 М ацетатного буфера (рН 4,7) в течение 24 ч, к полученной дисперсии добавляют 0,05 объема 0,1 М раствора диэтаноламина, аминоуксусной кислоты или β-аланина и 0,1 объема 0,02 М раствора флуоресцеина или 5(6)-карбоксифлуоресцина, смесь выдерживают 48 ч при 40°С в отсутствие света, после чего дисперсию очищают путем диализа против 0,01 М фосфатно-солевого буфера (рН 7,4) в течение 24 ч при температуре (20±5)°С.