Фармацевтическая композиция N-[5-[2-(3,5-диметоксифенил)этил]-2H-пиразол-3-ил]-4-[(3R,5S)-3,5-диметилпиперазин-1-ил]бензамида
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к химии фармацевтического средства/композиции. Понятно, что данное изобретение, в общем, относится к композициям соединений, которые содержат повышенную процентную загрузку активного ингредиента. В качестве предпочтительного аспекта здесь предложены композиции N-[5-[2-(3,5-диметоксифенил)этил]-2H-пиразол-3-ил]-4-[(3R,5S)-3,5-диметилпиперазин-1-ил]бензамида (соединение I), которые демонстрируют удовлетворительные технологичность, стабильность и растворение in vitro. Данные композиции являются полезными для лечения рака.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
При изготовлении фармацевтических композиций для перорального введения может быть желательным, чтобы лекарственное средство быстро растворялось вскоре после введения. Однако известно, что определенные физико-химические свойства лекарственного средства, такие как размер частиц, смачиваемость или растворимость, могут приводить к фармацевтической композиции, которая демонстрирует неудовлетворительное и/или изменчивое растворение, или к композиции, которая демонстрирует неудовлетворительную и/или изменчивую биодоступность. Такие композиции могут не подходить для применения пациентами.
Соединение I (ниже) раскрыто в международной патентной заявке WO 2008/075068.
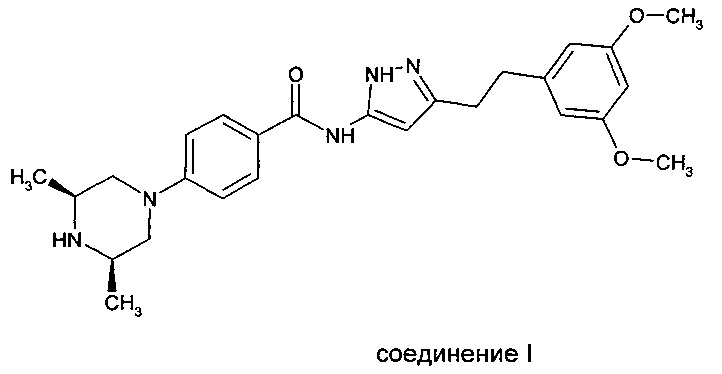
для применения в лечении рака.
Javaid et al (J. Pharm. Sci. 61 (9) 1972 pp. 1370-1373) исследовали эффект разных классов забуферивающих агентов на растворение аспирина из композиций в виде таблеток. Соединение I в настоящее время находится в клинических исследованиях для лечения рака, в частности раковых заболеваний легкого, молочной железы, желудка и мочевого пузыря. Дозирование в настоящее время осуществляют с использованием доставляемых перорально таблеток с содержанием активного вещества в таблетке 20 и 100 мг. Данные таблетки демонстрируют удовлетворительное растворение в интервале физиологических значений рН. Однако способ изготовления, используемый для клинических партий, не может осуществляться в коммерческом масштабе из-за высокой частоты пленкообразования, которую нельзя исправить с использованием традиционных способов. Следовательно, желательно получать новые фармацевтические композиции соединения I, в которых, по меньшей мере частично, преодолеваются вышеуказанные проблемы.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение, в общем, направлено на композиции соединений с улучшенной технологичностью, в частности на композиции, которые содержат щелочной шипучий эксципиент, и которые демонстрируют удовлетворительное растворение в интервале физиологических значений рН.
Соединение формулы (I) (известное далее как «формула (I)») показано ниже:
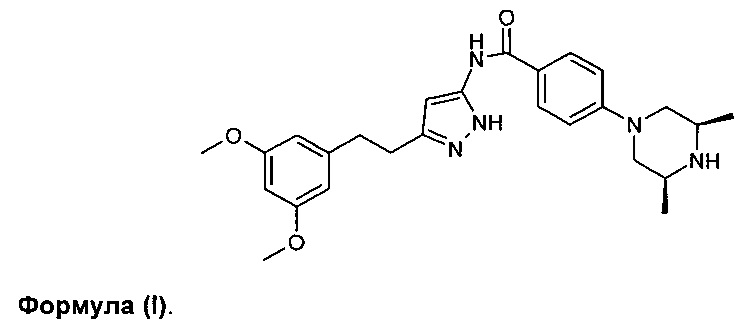
Соединение формулы (I) представляет собой основание и демонстрирует рН-зависимую растворимость, имея растворимость в имитированном желудочном соке (рН 1,2) приблизительно 5 мг/мл («малорастворимое» при использовании определения, данного в Фармакопее Соединенных Штатов / Национальном формуляре, UPS35-NF30), которая уменьшается в кишечной жидкости, стимулируемой голоданием (рН 6,5) до приблизительно 0,25 мг/мл («очень малорастворимое» по определению USP (Фармакопея Соединенных Штатов)). Кроме того, авторы изобретения наблюдали то, что соединение формулы (I) может образовать вязкое вещество при низком рН, что имеет эффект уменьшения скорости, с которой растворяется данное лекарственное средство. Для того чтобы добиться приемлемой скорости и степени растворения в интервале физиологических значений рН, более ранние клинические композиции изготовляли с использованием условий, разработанных для того, чтобы получать мелкие гранулы, которые, при прессовании в форму таблетки, быстро диспергировались бы при введении. Несмотря на то, что данный подход действительно приводит к улучшению эффективности растворения, во время изготовления сталкивались с проблемами «пленкообразования». Кроме того, наблюдали, что применение традиционных смазывающих веществ, таких как стеарат магния и стеарилфумарат натрия, приводило к химической деградации, включающей образование примесей и/или комплексообразование.
Неожиданно обнаружили, что щелочные шипучие эксципиенты были эффективными в улучшении как скорости, так и степени растворения при низком рН, несмотря на снижение растворимости при щелочных условиях, и в уменьшении интенсивности проблем «пленкообразования». Дополнительным неожиданным открытием было то, что применение альтернативного смазывающего вещества, глицерилдибегената, было эффективным в уменьшении интенсивности химической деградации.
В частности, данное изобретение направлено, по меньшей мере частично, на неожиданный результат, заключающийся в том, что применение щелочного шипучего эксципиента с соединением формулы (I) в композиции обеспечивает изготовление таблеток с улучшенной технологичностью и/или удовлетворительным растворением в интервале физиологических значений рН; и, по меньшей мере частично, на неожиданный результат, заключающийся в том, что альтернативное смазывающее вещество обеспечивает изготовление таблеток с улучшенной стабильностью.
В другом аспекте согласно данному изобретению предложено применение щелочного шипучего эксципиента с соединением формулы (I) в композиции, обеспечивающее изготовление таблеток с улучшенной технологичностью и/или удовлетворительным растворением в интервале физиологических значений рН.
В еще одном аспекте согласно данному изобретению предложено применение карбоната магния с соединением формулы (I) в композиции, обеспечивающее изготовление таблеток с улучшенной технологичностью и/или удовлетворительным растворением в интервале физиологических значений рН.
В еще одном аспекте согласно данному изобретению предложено применение карбоната кальция с соединением формулы (I) в композиции, обеспечивающее изготовление таблеток с улучшенной технологичностью и/или удовлетворительным растворением в интервале физиологических значений рН.
В еще одном аспекте согласно данному изобретению предложено применение бикарбоната натрия с соединением формулы (I) в композиции, обеспечивающее изготовление таблеток с улучшенной технологичностью и/или удовлетворительным растворением в интервале физиологических значений рН.
В другом аспекте согласно данному изобретению предложено применение альтернативного смазывающего вещества с соединением формулы (I) в композиции, обеспечивающее изготовление таблеток с улучшенной стабильностью.
В еще одном аспекте согласно данному изобретению предложено применение глицерилдибегената с соединением формулы (I) в композиции, обеспечивающее изготовление таблеток с улучшенной стабильностью.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая больше чем 10% масс./масс. соединения формулы (I) и количество щелочного шипучего эксципиента, достаточное для обеспечения удовлетворительного растворения in vitro; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена фармацевтическая композиция в стандартной лекарственной форме, содержащей от 10 мг до 200 мг соединения формулы (I) (например 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг или 200 мг), и количество щелочного шипучего эксципиента, достаточное для обеспечения удовлетворительного растворения in vitro; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент. Во избежание сомнений, каждое из предыдущих целых чисел представляет собой отдельный и независимый аспект данного изобретения.
В другом аспекте изобретения стандартная лекарственная форма данной фармацевтической композиции содержит от примерно 10 мг до примерно 160 мг соединения формулы (I).
В другом аспекте изобретения стандартная лекарственная форма данной фармацевтической композиции содержит от примерно 10 мг до примерно 140 мг соединения формулы (I).
В еще одном аспекте стандартная лекарственная форма данной фармацевтической композиции содержит от примерно 10 мг до примерно 130 мг соединения формулы (I).
В еще одном аспекте стандартная лекарственная форма данной фармацевтической композиции содержит от примерно 15 мг до примерно 110 мг соединения формулы (I).
В конкретном аспекте изобретения стандартная лекарственная форма данной фармацевтической композиции содержит 20 мг плюс/минус 1 мг соединения формулы (I).
В другом конкретном аспекте изобретения стандартная лекарственная форма данной фармацевтической композиции содержит 80 мг плюс/минус 4 мг соединения формулы (I).
В другом конкретном аспекте изобретения стандартная лекарственная форма данной фармацевтической композиции содержит 100 мг плюс/минус 5 мг соединения формулы (I).
В другом конкретном аспекте изобретения стандартная лекарственная форма данной фармацевтической композиции содержит 160 мг плюс/минус 8 мг соединения формулы (I).
В другом конкретном аспекте изобретения стандартная лекарственная форма данной фармацевтической композиции содержит 200 мг плюс/минус 10 мг соединения формулы (I).
В другом аспекте изобретения фармацевтическая композиция содержит от 10% масс./масс. до 60% масс./масс. соединения формулы (I).
В другом аспекте фармацевтическая композиция содержит от 15% масс./масс. до 50% масс./масс. соединения формулы (I).
В еще одном аспекте фармацевтическая композиция содержит от 15% масс./масс. до 45% масс./масс. соединения формулы (I).
В еще одном аспекте фармацевтическая композиция содержит от 15% масс./масс. до 40% масс./масс. соединения формулы (I).
В еще одном аспекте фармацевтическая композиция содержит от 15% масс./масс. до 25% масс./масс. соединения формулы (I).
В другом аспекте изобретения фармацевтическая композиция содержит примерно 20% масс./масс. соединения формулы (I).
В конкретном аспекте изобретения фармацевтическая композиция содержит 21,33 плюс/минус 5% масс./масс. соединения формулы (I).
В другом аспекте фармацевтическая композиция содержит от 20,26% масс./масс. до 22,40% масс./масс. соединения формулы (I).
В еще одном аспекте изобретения фармацевтическая композиция содержит от 1% масс./масс. до 50% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте изобретения фармацевтическая композиция содержит от 1% масс./масс. до 40% масс./масс. щелочного шипучего эксципиента.
В другом аспекте фармацевтическая композиция содержит от 10% масс./масс. до 30% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте фармацевтическая композиция содержит примерно 20% масс./масс. щелочного шипучего эксципиента.
В другом аспекте фармацевтическая композиция содержит от 15% масс./масс. до 20% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте изобретения фармацевтическая композиция содержит меньшее чем или равное 6% масс./масс. количество традиционного смазывающего вещества.
В качестве альтернативы, применение альтернативного смазывающего вещества может улучшать стабильность.
В еще одном аспекте изобретения фармацевтическая композиция содержит меньшее чем или равное 5% масс./масс. количество альтернативного смазывающего вещества.
В еще одном аспекте изобретения фармацевтическая композиция содержит меньшее чем или равное 4% масс./масс. количество альтернативного смазывающего вещества.
В другом аспекте фармацевтическая композиция содержит меньшее чем или равное 3% масс./масс. количество альтернативного смазывающего вещества.
В еще одном аспекте изобретения фармацевтическая композиция содержит от 0,25% масс./масс. до 8% масс./масс. альтернативного смазывающего вещества.
В еще одном аспекте изобретения фармацевтическая композиция содержит от 0,5% масс./масс. до 5% масс./масс. альтернативного смазывающего вещества.
В еще одном аспекте изобретения фармацевтическая композиция содержит от 1% масс./масс. до 4% масс./масс. альтернативного смазывающего вещества.
В еще одном аспекте изобретения фармацевтическая композиция содержит от 2,5% масс./масс. до 3,5% масс./масс. альтернативного смазывающего вещества.
В другом аспекте фармацевтическая композиция содержит примерно 3% масс./масс. альтернативного смазывающего вещества.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая больше чем 10% масс./масс. соединения формулы (I) и меньшее чем или равное 50% масс./масс. количество щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая больше чем 15% масс./масс. соединения формулы (I) и меньшее чем или равное 40% масс./масс. количество щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая больше чем 15% масс./масс. соединения формулы (I) и меньшее чем или равное 30% масс./масс. количество щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая больше чем 15% масс./масс. соединения формулы (I) и меньшее чем или равное 20% масс./масс. количество щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая от 10% масс./масс. до 50% масс./масс. соединения формулы (I) и от 1% масс./масс. до 50% масс./масс. щелочного шипучего эксципиента; и возможно дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая от 15% масс./масс. до 35% масс./масс. соединения формулы (I) и от 10% до 40% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% масс./масс. до 25% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая примерно 20% масс./масс. соединения формулы (I) и примерно 20% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена стандартная лекарственная форма, содержащая от 15% масс./масс. до 45% масс./масс. соединения формулы (I) и от 10% до 40% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где данная стандартная лекарственная форма содержит от 10 до 200 мг соединения формулы (I).
В другом аспекте изобретения предложена стандартная лекарственная форма, содержащая от 15% масс./масс. до 40% масс./масс. соединения формулы (I) и от 10% масс./масс. до 40% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где данная стандартная лекарственная форма содержит от 10 до 200 мг соединения формулы (I).
В другом аспекте изобретения предложена стандартная лекарственная форма, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% до 25% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где данная стандартная лекарственная форма содержит 20 мг соединения формулы (I).
В другом аспекте изобретения предложена стандартная лекарственная форма, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% до 25% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где данная стандартная лекарственная форма содержит 80 мг соединения формулы (I).
В другом аспекте изобретения предложена стандартная лекарственная форма, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% до 25% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где данная стандартная лекарственная форма содержит 160 мг соединения формулы (I).
В другом аспекте изобретения возможные ингредиенты, которые можно добавлять в фармацевтическую композицию, включают один или более чем один из следующих:
а) наполнители;
б) связующие агенты;
в) смазывающие вещества и
г) разрыхлители.
Когда добавляют возможные ингредиенты для составления остатка фармацевтической композиции, данный остаток возможно может включать одно или более чем одно из следующих:
а) наполнители, содержание которых, при их использовании, варьирует, например, от примерно 10 до примерно 75 процентов по массе (например от примерно 15 до примерно 70 процентов от массы) остатка сухой композиции;
б) связующие агенты, содержание которых, при их использовании, варьирует, например, от примерно 2 до примерно 8 процентов по массе остатка сухой композиции;
в) смазывающие вещества, содержание которых, при их использовании, варьирует от примерно 0,25 до 5 процентов по массе остатка сухой композиции; и
г) разрыхлители, содержание которых, при их использовании, варьирует от примерно 0,5 до 10,0 процентов по массе (например примерно 5 процентов от массы) остатка сухой композиции.
В другом аспекте изобретения фармацевтическая композиция дополнительно содержит один или более чем один дополнительный ингредиент, независимо выбранный, например, из следующих:
а) наполнители, такие как маннит (например Pearlitol 50с, Peralitol 120с или Pearlitol 160с) или микрокристаллические целлюлозы (например МСС Avicel РН 101, Emcocel 90М и т.д.);
б) связующие агенты, такие как Plasdone K29/32, повидон, микрокристаллические целлюлозы или Kollidon K30;
в) смазывающие вещества, такие как глицерилдибегенат; и
г) разрыхлители, такие как натрия крахмала гликолят, например ExploTab или Glycolys LV.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I), от 15% масс./масс. до 25% масс./масс. щелочного шипучего эксципиента, от 2,5% масс./масс. до 3,5% масс./масс. альтернативного смазывающего вещества, и дополнительно содержащая от 40% масс./масс. до 60% масс/масс наполнителя, от 1% масс./масс. до 3% масс./масс. связующего вещества и от 5% масс./масс. до 9% масс./масс. разрыхлителя.
В другом аспекте изобретения предложена таблетка, содержащая больше чем 10% масс./масс. соединения формулы (I) и количество щелочного шипучего эксципиента, достаточное для обеспечения удовлетворительного растворения in vitro; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена таблетка, содержащая от 10 мг до 200 мг соединения формулы (I) (например 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг или 200 мг) и количество щелочного шипучего эксципиента, достаточное для обеспечения удовлетворительного растворения in vitro; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент. Во избежание сомнений, каждое из предыдущих целых чисел представляет собой отдельный и независимый аспект данного изобретения.
В другом аспекте изобретения таблетка содержит от примерно 10 мг до примерно 160 мг соединения формулы (I).
В другом аспекте изобретения таблетка содержит от примерно 10 мг до примерно 140 мг соединения формулы (I).
В еще одном аспекте таблетка содержит от примерно 10 мг до примерно 130 мг соединения формулы (I).
В еще одном аспекте таблетка содержит от примерно 15 мг до примерно 110 мг соединения формулы (I).
В конкретном аспекте изобретения таблетка содержит 20 мг плюс/минус 1 мг соединения формулы (I).
В другом конкретном аспекте изобретения таблетка содержит 80 мг плюс/минус 4 мг соединения формулы (I).
В другом конкретном аспекте изобретения таблетка содержит 100 мг плюс/минус 5 мг соединения формулы (I).
В другом конкретном аспекте изобретения таблетка содержит 160 мг плюс/минус 8 мг соединения формулы (I).
В другом конкретном аспекте изобретения таблетка содержит 200 мг плюс/минус 10 мг соединения формулы (I).
В еще одном аспекте изобретения таблетка содержит от 1% масс./масс. до 50% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте изобретения таблетка содержит от 1% масс./масс. до 40% масс./масс. щелочного шипучего эксципиента.
В другом аспекте таблетка содержит от 10% масс./масс. до 30% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте таблетка содержит примерно 20% масс./масс. щелочного шипучего эксципиента.
В конкретном аспекте изобретения таблетка содержит 21,33% плюс/минус 5% масс./масс. соединения формулы (I).
В другом аспекте таблетка содержит от 20,26% масс./масс. до 22,40% масс./масс. соединения формулы (I).
В еще одном аспекте таблетка содержит от примерно 15% масс./масс. до примерно 25% масс./масс. соединения формулы (I).
В еще одном аспекте изобретения таблетка содержит меньшее чем или равное 50% масс./масс. количество щелочного шипучего эксципиента.
В другом аспекте таблетка содержит меньшее чем или равное 40% масс./масс. количество щелочного шипучего эксципиента.
В другом аспекте таблетка содержит меньшее чем или равное 30% масс./масс. количество щелочного шипучего эксципиента.
В еще одном аспекте таблетка содержит меньшее чем или равное 20% масс./масс. количество щелочного шипучего эксципиента.
В другом аспекте изобретения таблетка содержит меньшее чем или равное 6% масс./масс. количество традиционного смазывающего вещества.
В качестве альтернативы, применение альтернативного смазывающего вещества может улучшать стабильность.
В еще одном аспекте изобретения таблетка содержит меньшее чем или равное 5% масс./масс. количество альтернативного смазывающего вещества.
В еще одном аспекте изобретения таблетка содержит меньшее чем или равное 4% масс./масс. количество альтернативного смазывающего вещества.
В другом аспекте таблетка содержит меньшее чем или равное 3% масс./масс. количество альтернативного смазывающего вещества.
В еще одном аспекте изобретения таблетка содержит от 0,25% масс./масс. до 8% масс./масс. альтернативного смазывающего вещества.
В еще одном аспекте изобретения таблетка содержит от 0,5% масс./масс. до 5% масс./масс. альтернативного смазывающего вещества.
В еще одном аспекте изобретения таблетка содержит от 1% масс./масс. до 4% масс./масс. альтернативного смазывающего вещества.
В еще одном аспекте изобретения таблетка содержит от 2,5% масс./масс. до 3,5% масс./масс. альтернативного смазывающего вещества.
В другом аспекте таблетка содержит примерно 3% масс./масс. альтернативного смазывающего вещества.
В другом аспекте изобретения предложена таблетка, содержащая от 10% масс./масс. до 50% масс./масс. соединения формулы (I) и от 1% масс./масс. до 50% масс./масс. щелочного шипучего эксципиента; и возможно дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена таблетка, содержащая от 15% масс./масс. до 35% масс./масс. соединения формулы (I) и от 10% до 40% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена таблетка, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% масс./масс. до 25% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена таблетка, содержащая примерно 20% масс./масс. соединения формулы (I) и примерно 20% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена таблетка, содержащая от 15% масс./масс. до 45% масс./масс. соединения формулы (I) и от 10% до 40% масс./масс. щелочного шипучего эксципиента, и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где таблетка содержит от 10 до 200 мг соединения формулы (I).
В другом аспекте изобретения предложена таблетка, содержащая от 15% масс./масс. до 40% масс./масс. соединения формулы (I) и от 10% до 40% масс./масс. щелочного шипучего эксципиента и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где таблетка содержит от 10 до 200 мг соединения формулы (I).
В другом аспекте изобретения предложена таблетка, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% до 25% масс./масс. щелочного шипучего эксципиента, и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где таблетка содержит 20 мг соединения формулы (I).
В другом аспекте изобретения предложена таблетка, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% до 25% масс./масс. щелочного шипучего эксципиента, и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где таблетка содержит 80 мг соединения формулы (I).
В другом аспекте изобретения предложена таблетка, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% до 25% масс./масс. щелочного шипучего эксципиента, и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент, где таблетка содержит 160 мг соединения формулы (I).
Лекарственные формы по данному изобретению могут включать один или более чем один фармацевтически приемлемый эксципиент, который может быть выбран, например, из адъювантов, носителей, связующих веществ, смазывающих веществ, разбавителей, стабилизаторов, забуферивающих агентов, эмульгаторов, агентов, регулирующих вязкость, поверхностно-активных веществ, корригентов или красителей. Будет понятно, что индивидуальный эксципиент может быть многофункциональным. Примеры фармацевтически приемлемых эксципиентов описаны в Handbook of Pharmaceutical Excipients (Пятое издание, 2005, под редакцией Ray С. Rowe, Paul J. Sheskey и Sian C. Owen, опубликованной the American Pharmaceutical Association и the Pharmaceutical Press). Как будет понятно специалистам в данной области, самый подходящий способ введения активных ингредиентов зависит от ряда факторов.
Будет понятно, что вводимая согласно настоящему изобретению терапевтическая доза каждого активного ингредиента будет варьировать, в зависимости от конкретного используемого активного ингредиента, способа, которым подлежит вводить активный ингредиент, и состояния или расстройства, подлежащего лечению.
В другом аспекте изобретения возможные ингредиенты, которые можно добавлять для составления остатка таблетки, включают один или более чем один из следующих:
а) наполнители, содержание которых, при их использовании, варьирует, например, от примерно 10 до примерно 75 процентов от массы (например от примерно 15 до примерно 70 процентов от массы) остатка композиции в виде таблетки;
б) связующие агенты, содержание которых, при их использовании, варьирует, например, от примерно 2 до примерно 8 процентов от массы остатка композиции в виде таблетки;
в) смазывающие вещества, содержание которых, при их использовании, варьирует от примерно 0,25 до 3,5 процентов от массы остатка композиции в виде таблетки; и
г) разрыхлители, содержание которых, при их использовании, варьирует от примерно 0,5 до 10,0 процентов от массы (например примерно 5 процентов от массы) остатка композиции в виде таблетки.
В другом аспекте изобретения таблетка дополнительно содержит один или более чем один дополнительный ингредиент, независимо выбранный из, например, следующих:
а) наполнители, такие как маннит (например Pearlitol 50с, Peralitol 120с или Pearlitol 160с) или микрокристаллические целлюлозы (например МСС Avicel РН 101, Emcocel 90М и т.д.);
б) связующие агенты, такие как Plasdone K29/32, повидон, микрокристаллические целлюлозы или Kollidon K30;
в) смазывающие вещества, такие как глицерилдибегенат;
г) разрыхлители, такие как натрия крахмала гликолят, например ExploTab или Glycolys LV.
В другом аспекте изобретения таблетка возможно дополнительно содержит подходящее покрытие, например пленочное покрытие. Покрытие можно использовать для обеспечения защиты против, например, проникновения влаги или деградации светом, для окрашивания композиции или модификации или контроля высвобождения соединения формулы (I) из композиции.
В еще одном аспекте изобретения фармацевтическая композиция содержит следующие компоненты по массе:
|
В еще одном аспекте изобретения фармацевтическая композиция содержит следующие компоненты (% масс./масс.):
Композиции А и Б (% масс./масс.)
|
В еще одном аспекте изобретение включает таблетку, образованную в результате прессования композиции А и/или композиции Б в форму таблетки.
В другом аспекте изобретения предложен способ получения фармацевтической композиции, который включает следующие стадии:
Стадия А включает смешивание соединения формулы (I) со щелочным шипучим эксципиентом возможно в присутствии одного или более чем одного фармацевтически приемлемого ингредиента. В другом аспекте стадию А проводят в присутствии одного или более чем одного дополнительного наполнителя (такого как маннит) и возможно в присутствии одного или более чем одного фармацевтически приемлемого ингредиента. В еще одном аспекте стадию А проводят в присутствии одного или более чем одного дополнительного наполнителя (такого как маннит) и возможно в присутствии одного или более чем одного связующего агента, и/или одного или более чем одного разрыхлителя.
Стадия Б включает добавление очищенной воды и/или раствора связующего вещества в порошковую смесь со стадии А, приведенную выше, и смешивание с образованием гранул и, возможно, пропускание через сетчатый фильтр для разрушения агломератов. В другом аспекте в порошковую смесь добавляют примерно от 10% до 45% по массе очищенной воды.
Стадия В включает сушку гранул, полученных на стадии Б, пока не достигается LOD (потеря при высушивании) меньше, чем 10% (например меньше чем 5%), с получением высушенных гранул.
Стадия Г возможно включает размалывание высушенных гранул со стадии В.
Стадия Д возможно включает смешивание размолотых гранул со стадии Г со щелочным шипучим эксципиентом.
В другом аспекте изобретения предложен способ получения фармацевтической композиции, который (способ влажного гранулирования) включает:
а) смешивание соединения формулы (I) с шипучим агентом, одним или более чем одним дополнительным наполнителем (таким как маннит) и возможно в присутствии одного или более чем одного связующего агента, и/или одного или более чем одного разрыхлителя, и/или одного или более чем одного другого эксципиента;
б) добавление в порошковую смесь а) примерно от 10% до 45% по массе очищенной воды и/или раствора связующего вещества и смешивание с образованием увеличенных гранул, и, возможно, пропускание через сетчатый фильтр для разрушения больших агломератов; и
в) сушку увеличенных гранул, полученных в б) выше, пока не достигается LOD меньшая, чем 10% (например меньшая чем 5%), с получением высушенных гранул.
В качестве альтернативы, в другом аспекте изобретения предложен способ получения фармацевтической композиции, который включает следующие стадии:
Стадия А - смешивание соединения формулы (I), возможно со щелочным шипучим эксципиентом, возможно в присутствии одного или более чем одного фармацевтически приемлемого ингредиента. В другом аспекте стадию А проводят в присутствии одного или более чем одного дополнительного наполнителя (такого как маннит) и возможно в присутствии одного или более чем одного фармацевтически приемлемого ингредиента. В еще одном аспекте стадию А проводят в присутствии одного или более чем одного дополнительного наполнителя (такого как маннит) и возможно в присутствии одного или более чем одного связующего агента и/или одного или более чем одного разрыхлителя.
Стадия Б включает добавление очищенной воды и/или раствора связующего вещества в порошковую смесь со стадии А, приведенную выше, и смешивание с образованием гранул и возможно пропускание через сетчатый фильтр для разрушения агломератов. Типично в порошковую смесь добавляют примерно от 10% до 45% по массе очищенной воды и/или раствора связующего агента.
Стадия В включает сушку гранул, полученных на стадии Б, пока не достигается LOD, меньшая чем 10% (например меньшая чем 5%), с получением высушенных гранул.
Стадия Г включает размалывание высушенных гранул со стадии В с получением размолотых гранул.
Стадия Д включает смешивание размолотых гранул со стадии Г с эффективным количеством щелочного шипучего эксципиента.
В другом аспекте изобретения предложен способ получения фармацевтической композиции, который (способ влажного гранулирования) включает:
а) смешивание соединения формулы (I) с одним или более чем одним дополнительным наполнителем (таким как маннит) и возможно в присутствии одного или более чем одного связующего агента и/или одного или более чем одного разрыхлителя, и/или одного или более чем одного другого эксципиента;
б) добавление в порошковую смесь а) примерно от 10% до 45% по массе очищенной воды и/или раствора связующего вещества и смешивание с образованием гранул, и возможно пропускание через сетчатый фильтр для разрушения агломератов;
в) сушку гранул, полученных в б) выше, пока не достигается LOD, меньшая чем 10% (например меньшая чем 5%), с получением высушенных гранул;
г) размалывание высушенных гранул, полученных в в) с получением размолотых гранул; и
д) смешивание размолотых гранул из г) с щелочным шипучим эксципиентом.
В других его аспектах, относящихся к способу, данное изобретение дополнительно включает размалывание высушенных гранул. В одном аспекте высушенные гранулы размалывают так, что примерно 90 процентов по массе имеют размер частиц от примерно 25 мкм до примерно 3500 мкм в диаметре.
В еще одном аспекте высушенные размолотые гранулы смешивают с традиционным и/или альтернативным смазывающим веществом, и затем образующуюся фармацевтическую композицию таблетируют. Традиционные и альтернативные смазывающие вещества включают глицерилдибегенат, натрия стеарилфумарат, магния стеарат, коллоидный диоксид кремния и тальк.
В другом аспекте изобретения альтернативное смазывающее вещество (такое как глицерилдибегенат) можно добавлять к сухим гранулам до размалывания, и затем образующуюся фармацевтическую композицию размалывают и таблетируют.
В другом аспекте в данном изобретении предложена композиция, полученная влажным гранулированием, содержащая от 10% масс./масс. до 60% масс./масс. формулы (I) и количество щелочного шипучего эксципиента, достаточное для обеспечения удовлетворительного растворения in vitro; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения композиция, полученная влажным гранулированием, содержит от 15% масс./масс. до 50% масс./масс. соединения формулы (I).
В другом аспекте композиция, полученная влажным гранулированием, содержит от 15% масс./масс. до 40% масс./масс. соединения формулы (I).
В другом аспекте композиция, полученная влажным гранулированием, содержит от 15% масс./масс. до 25% масс./масс. соединения формулы (I).
В другом аспекте изобретения композиция, полученная влажным гранулированием, содержит примерно 20% масс./масс. соединения формулы (I).
В конкретном аспекте изобретения композиция, полученная влажным гранулированием, содержит 21,33% плюс/минус 5% масс./масс. соединения формулы (I).
В другом аспекте композиция, полученная влажным гранулированием, содержит от 20,26% масс./масс. до 22,40% масс./масс. соединения формулы (I).
В еще одном аспекте изобретения композиция, полученная влажным гранулированием, содержит от 1% масс./масс. до 50% масс./масс. щелочного шипучего эксципиента.
В другом аспекте композиция, полученная влажным гранулированием, содержит от 1% масс./масс. до 40% масс./масс. щелочного шипучего эксципиента.
В другом аспекте композиция, полученная влажным гранулированием, содержит от 10% масс./масс. до 30% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте композиция, полученная влажным гранулированием, содержит от 15% масс./масс. до 25% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте композиция, полученная влажным гранулированием, содержит примерно 20% масс./масс. щелочного шипучего эксципиента.
В другом аспекте изобретения предложена композиция, полученная влажным гранулированием, содержащая от 10% масс./масс. до 50% масс./масс. соединения формулы (I) и от 1% масс./масс. до 50% масс./масс. шипучего агента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена композиция, полученная влажным гранулированием, содержащая от 10% масс./масс. до 45% масс./масс. соединения формулы (I) и от 10% масс./масс. до 45% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена композиция, полученная влажным гранулированием, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% до 25% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена композиция, полученная влажным гранулированием, содержащая примерно 20% масс./масс. соединения формулы (I) и примерно 20% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения композиция, полученная влажным гранулированием, содержит соединение формулы (I), воду, щелочной шипучий эксципиент, дополнительный(ые) наполнитель(и), связующий(ие) агент(ы) и разрыхлитель(и).
В другом аспекте согласно данному изобретению предложена таблетка, полученная прессованием композиции, полученной влажным гранулированием.
В другом аспекте изобретения предложен дополнительный способ получения фармацевтической композиции, как определено выше, который включает пропускание смеси со стадии А, описанной выше, через пресс с получением сухих гранул (стадия Г).
В другом аспекте настоящего изобретения предложен способ изготовления фармацевтической композиции, который (способ вальцевания) включает:
(а) смешивание соединения формулы (I) со щелочным шипучим эксципиентом, одним или более чем одним дополнительным наполнителем (таким как маннит) и возможно в присутствии одного или более чем одного связующего агента, и/или одного или более чем одного разрыхлителя, и/или одного или более чем одного другого эксципиента;
(б) пропускание смеси (а), описанной выше, через пресс с получением сухих гранул.
В других его аспектах, относящихся к способу, данное изобретение дополнительно включает размалывание высушенных гранул. В одном аспекте высушенные гранулы размалывают так, что примерно 90 процентов по массе имеют размер частиц от примерно 25 мкм до примерно 3500 мкм в диаметре.
В еще одном аспекте высушенные размолотые гранулы смешивают со смазывающим веществом, и затем образующуюся фармацевтическую композицию таблетируют. Подходящие смазывающие вещества включают глицерилдибегенат, стеарилфумарат натрия, стеарат магния, коллоидный диоксид кремния и тальк.
В еще одном аспекте настоящего изобретения предложен способ изготовления фармацевтической композиции, который (способ вальцевания) включает:
(а) смешивание соединения формулы (I) со щелочным шипучим эксципиентом, одним или более чем одним дополнительным наполнителем (таким как маннит) и возможно в присутствии одного или более чем одного связующего агента и/или одного или более чем одного разрыхлителя, и/или одного или более чем одного другого эксципиента;
(б) пропускание смеси (а), описанной выше, через пресс с получением сухих гранул.
В других его аспектах, относящихся к способу, данное изобретение дополнительно включает размалывание высушенных гранул. В одном аспекте высушенные гранулы размалывают так, что примерно 90 процентов по массе имеют размер частиц от примерно 25 мкм до примерно 3500 мкм в диаметре.
В еще одном аспекте настоящего изобретения предложен способ изготовления фармацевтической композиции, который (способ вальцевания) включает:
(а) смешивание соединения формулы (I) возможно со щелочным шипучим эксципиентом, одним или более чем одним дополнительным наполнителем (таким как маннит) и возможно в присутствии одного или более чем одного связующего агента и/или одного или более чем одного разрыхлителя, и/или одного или более чем одного другого эксципиента;
(б) пропускание смеси (а), описанной выше, через пресс с получением сухих гранул.
Высушенные, размолотые гранулы затем смешивают с щелочным шипучим эксципиентом.
В еще одном аспекте высушенные, размолотые гранулы смешивают со смазывающим веществом, и затем образующуюся фармацевтическую композицию таблетируют. Подходящие смазывающие вещества включают глицерилдибегенат, стеарилфумарат натрия, стеарат магния, коллоидный диоксид кремния и тальк.
В альтернативном аспекте изобретения смазывающее вещество (такое как глицерилдибегенат) можно добавлять к сухим гранулам до размалывания, и затем образующуюся фармацевтическую композицию размалывают и затем таблетируют.
В другом аспекте в данном изобретении предложена композиция, полученная вальцеванием, содержащая больше чем 10% масс./масс. соединения формулы (I) и количество щелочного шипучего эксципиента, достаточное для обеспечения удовлетворительного растворения in vitro; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения композиция, полученная вальцеванием, содержит от 10% масс./масс. до 60% масс./масс. соединения формулы (I).
В другом аспекте композиция, полученная вальцеванием, содержит от 15% масс./масс. до 50% масс./масс. соединения формулы (I).
В другом аспекте композиция, полученная вальцеванием, содержит от 15% масс./масс. до 45% масс./масс. соединения формулы (I).
В еще одном аспекте композиция, полученная вальцеванием, содержит от 15% масс./масс. до 40% масс./масс. соединения формулы (I).
В еще одном аспекте композиция, полученная вальцеванием, содержит от 15% масс./масс. до 25% масс./масс. соединения формулы (I).
В другом аспекте изобретения композиция, полученная вальцеванием, содержит примерно 20% масс./масс. соединения формулы (I).
В конкретном аспекте изобретения композиция, полученная вальцеванием, содержит 21,33% плюс/минус 5% масс./масс. соединения формулы (I).
В другом аспекте композиция, полученная вальцеванием, содержит от 20,26% масс./масс. до 22,40% масс./масс. соединения формулы (I).
В еще одном аспекте изобретения композиция, полученная вальцеванием, содержит от 1% масс./масс. до 50% масс./масс. щелочного шипучего эксципиента.
В другом аспекте композиция, полученная вальцеванием, содержит от 1% масс./масс. до 40% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте композиция, полученная вальцеванием, содержит от 10% масс./масс. до 30% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте композиция, полученная вальцеванием, содержит от 15% масс./масс. до 25% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте композиция, полученная вальцеванием, содержит примерно 20% масс./масс. щелочного шипучего эксципиента.
В другом аспекте изобретения предложена композиция, полученная вальцеванием, содержащая от 15% масс./масс. до 45% масс./масс. соединения формулы (I) и от 10% масс./масс. до 40% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена композиция, полученная вальцеванием, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% масс./масс. до 25% масс./масс. щелочного шипучего эксципиента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения композиция, полученная вальцеванием, содержит соединение формулы (I), щелочной шипучий эксципиент, дополнительный(ые) наполнитель(и), связующий(ие) агент(ы) и разрыхлитель(и).
В другом аспекте в данном изобретении предложена таблетка, полученная прессованием композиции, полученной вальцеванием.
В другом аспекте изобретения предложен способ изготовления фармацевтической композиции, который (способ прямого прессования) включает:
(а) смешивание соединения формулы (I) со щелочным шипучим эксципиентом, одним или более чем одним дополнительным наполнителем (таким как маннит) и возможно в присутствии одного или более чем одного связующего агента и/или одного или более чем одного разрыхлителя, и/или одного или более чем одного смазывающего вещества, и/или одного или более чем одного другого эксципиента;
(б) прессование смеси (а), описанной выше.
В другом аспекте изобретения композиция, полученная прямым прессованием, содержит соединение формулы (I), щелочной шипучий эксципиент, дополнительный(ые) наполнитель(и), связующий(ие) агент(ы), смазывающее(ие) вещество(а) и разрыхлитель(и).
В другом аспекте в данном изобретении предложена таблетка, полученная непосредственно путем прессования смеси (а), описанной выше.
В другом аспекте в данном изобретении предложена композиция, полученная прямым прессованием, содержащая больше чем 10% масс./масс. формулы (I) и количество щелочного шипучего эксципиента, достаточное для обеспечения удовлетворительного растворения in vitro; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения композиция, полученная прямым прессованием, содержит от 10% масс./масс. до 60% масс./масс. соединения формулы (I).
В другом аспекте композиция, полученная прямым прессованием, содержит от 10% масс./масс. до 50% масс./масс. соединения формулы (I).
В еще одном аспекте композиция, полученная прямым прессованием, содержит от 15% масс./масс. до 40% масс./масс. соединения формулы (I).
В еще одном аспекте композиция, полученная прямым прессованием, содержит от 15% масс./масс. до 25% масс./масс. соединения формулы (I).
В другом аспекте изобретения композиция, полученная прямым прессованием, содержит примерно 20% масс./масс. соединения формулы (I).
В конкретном аспекте изобретения композиция, полученная прямым прессованием, содержит 21,33% плюс/минус 5% масс./масс. соединения формулы (I).
В другом аспекте композиция, полученная прямым прессованием, содержит от 20,26% масс./масс. до 22,40% масс./масс. соединения формулы (I).
В еще одном аспекте изобретения композиция, полученная прямым прессованием, содержит от 1% масс./масс. до 50% масс./масс. щелочного шипучего эксципиента.
В другом аспекте композиция, полученная прямым прессованием, содержит от 1% масс./масс. до 40% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте композиция, полученная прямым прессованием, содержит от 10% до 30% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте композиция, полученная прямым прессованием, содержит от 15% до 25% масс./масс. щелочного шипучего эксципиента.
В еще одном аспекте композиция, полученная прямым прессованием, содержит примерно 20% масс./масс. щелочного шипучего эксципиента.
В другом аспекте изобретения предложена композиция, полученная прямым прессованием, содержащая от 10% масс./масс. до 50% масс./масс. соединения формулы (I) и от 1% масс./масс. до 50% масс./масс. шипучего агента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена композиция, полученная прямым прессованием, содержащая от 15% масс./масс. до 45% масс./масс. соединения формулы (I) и от 10% масс./масс. до 40% масс./масс. шипучего агента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
В другом аспекте изобретения предложена композиция, полученная прямым прессованием, содержащая от 15% масс./масс. до 25% масс./масс. соединения формулы (I) и от 15% масс./масс. до 25% масс./масс. шипучего агента; и дополнительно содержащая один или более чем один фармацевтически приемлемый ингредиент.
Фармацевтическая композиция и/или таблетка, и/или композиция, полученная влажным гранулированием, и/или композиция, полученная вальцеванием, и/или композиция, полученная прямым прессованием, может дополнительно включать и возможно включает краситель, при условии, что он одобрен и сертифицирован FDA (Управление по контролю качества пищевых продуктов и лекарственных средств США). Например, типичные красители включают красный очаровательный, кислый фуксин D, напталон красный В, пищевой оранжевый 8, эозин Y, филоксин В, эритрозин, природный красный 4, кармин, красный оксид железа, желтый оксид железа, черный оксид железа, диоксид титана и тому подобное.
В фармацевтическую композицию и/или таблетку, и/или композицию, полученную влажным гранулированием, и/или композицию, полученную вальцеванием, и/или композицию, полученную прямым прессованием, или в наружное ядро таблетки также можно добавлять подсластители для того, чтобы создавать или усиливать сладкий вкус. Данному эффекту могут способствовать сахаридные наполнители и связующие вещества, например маннит, лактоза и тому подобное. Например, можно использовать цикламаты, сахарин, аспартам, ацесульфам К (Mukherjee (1997) Food Chem. Toxicol. 35: 1177-1179) или тому подобное (Rolls (1991) Am. J. Clin. Nutr. 53: 872-878). Подсластители, отличные от Сахаров, имеют преимущество уменьшения общего объема фармацевтической композиции и/или таблетки (ядра таблетки и/или покрытия) и/или композиции, полученной влажным гранулированием, и/или композиции, полученной вальцеванием, и/или композиции, полученной прямым прессованием, не оказывая влияния на физические свойства таблетки.
Фармацевтическая композиция и/или таблетка, и/или композиция, полученная влажным гранулированием, и/или композиция, полученная вальцеванием, и/или композиция, полученная прямым прессованием, могут быть дополнительно покрыты и возможно покрыты с использованием традиционного дражировочного котла. Пленочное покрытие может быть нанесено путем напыления водной суспензии ингредиентов покрытия на ядра таблеток.
Определения
Термин «шипучий эксципиент» в том виде, как он здесь используется, относится к любому фармацевтически приемлемому веществу, которое выделяет газ в ответ на стимул, например, выделение диоксида углерода при подкислении. Примером шипучего эксципиента является карбонат, например карбонат металла (такой как карбонат натрия, карбонат калия, карбонат магния, карбонат кальция или карбонат алюминия) или органический карбонат (такой как динатрия глицина карбонат, диметилкарбонат или этиленкарбонат). Другим примером шипучего эксципиента является бикарбонат, например бикарбонат металла (такой как гидрокарбонат натрия или гидрокарбонат калия).
Термин «щелочной» в том виде, как он здесь используется, относится к веществу, которое индуцирует увеличение рН при добавлении в водную систему. Термин «щелочной эксципиент» относится к любому фармацевтически приемлемому веществу, которое является щелочным, например к неорганическому основанию, такому как динатрия гидрофосфат или гидроксид натрия.
Щелочной шипучий эксципиент представляет собой фармацевтически приемлемое вещество, имеющее как шипучую активность, так и щелочные свойства, например гидрокарбонат натрия, гидрокарбонат калия, карбонат магния и карбонат натрия. Во избежание сомнений, каждый из щелочных шипучих эксципиентов, на которые дана ссылка выше, представляет собой отдельный и независимый аспект изобретения. В одном конкретном аспекте изобретения щелочной шипучий эксципиент выбран из карбоната металла или бикарбоната металла. В другом конкретном аспекте изобретения щелочной шипучий эксципиент выбран из карбоната магния, гидрокарбоната натрия, гидрокарбоната калия или карбоната натрия. В другом конкретном аспекте изобретения щелочной шипучий эксципиент представляет собой карбонат магния.
Термин «связующий агент» в том виде, как он здесь используется, относится к фармацевтически приемлемому соединению или композиции, добавленной в композицию для поддержания активного фармацевтического ингредиента и неактивных ингредиентов вместе в когезивной смеси. Сухие связующие вещества, используемые для прямого прессования, должны демонстрировать когезивные и адгезивные силы, так что частицы слипаются при прессовании. Связующие вещества, используемые для влажного гранулирования, являются гидрофильными и растворимыми в воде и обычно растворяются в воде с образованием влажной массы, которую затем гранулируют. Примеры подходящих связующих агентов включают повидон, пласдон K29/32, пласдон S-630, гидропропилцеллюлозу, метилцеллюлозу, поливинилпирролидон, стеарат алюминия, гидроксипропилметилцеллюлозу и тому подобное, но не ограничиваются ими. Для таких связующих агентов возможно дополнительное действие в качестве водоудерживающих агентов (например повидон).
Термин «наполнитель» в том виде, как он здесь используется, относится к любому фармацевтически приемлемому веществу или композиции, добавляемым в композицию для увеличения объема. Подходящие наполнители включают маннит, лактозу, микрокристаллическую целлюлозу, силикатированную микрокристаллическую целлюлозу и дикальция фосфат, но не ограничиваются ими.
Термин «смазывающее вещество» в том виде, как он здесь используется, относится к любому фармацевтически приемлемому агенту, который уменьшает поверхностное трение, смазывает поверхность гранулы, уменьшает тенденцию к образованию статического электричества и/или уменьшает истираемость гранул. Таким образом, смазывающие вещества могут служить в качестве агентов против образования агломератов. Традиционные смазывающие вещества включают стеариновую кислоту и родственные соединения, такие как стеарат магния и стеарилфумарат натрия. Альтернативные смазывающие вещества включают глицерилдибегенат, коллоидный диоксид кремния, тальк, другие гидрогенизированные растительные масла или триглицериды. Примеры подходящих альтернативных смазывающих веществ включают глицерилдибегенат, но не ограничиваются им.
Термин «разрыхлитель» в том виде, как он здесь используется, относится к веществам, добавляемым в композицию для того, чтобы помогать ее разъединению (дезинтеграции) и высвобождению лекарственных средств. Примеры разрыхлителей включают несахаридные водорастворимые полимеры, такие как поперечно сшитый повидин, но не ограничиваются ими. Другие разрыхлители, которые также можно использовать, включают, например, кроскармеллозу натрия, натрия крахмала гликолят и тому подобное, см., например, Khattab (1992) J. Pharm. Pharmacol. 45: 687-691.
Термин «сушка» и «высушенный» относится к способу, посредством которого уменьшается содержание воды в композиции до желательного уровня.
Термины «прессование», «формование» и «прессовка» относятся к способу приложения к композиции (порошку или гранулам) сжимающей силы, как в штампе, с образованием таблетки. Термины «спрессованная таблетка» и «прессованная таблетка» означают любую таблетку, образованную посредством такого способа.
Термин «пленкообразование» относится к адгезии вещества к поверхностям таблетировочного пуансона. Если допускается скопление на поверхностях пуансона достаточного количества вещества, тогда, наряду с другими дефектами, массы таблеток могут снижаться ниже приемлемых границ. (Journal of Pharmaceutical Sciences, Vol. 93(2), 2004).
Термин «таблетка» используется в его обычном контексте и относится к твердой композиции, полученной прессованием и/или формованием смеси композиций в удобную форму для проглатывания или внесения в любую полость организма.
«Содержание активного вещества таблетки» в том виде, как оно здесь используется, рассчитывают на основе количества соединения I.
«Процент загрузки» в том виде, как он здесь используется, рассчитывают со ссылкой на процентное содержание соединения I по массе.
Термин «низкий рН» относится к измеренному рН, составляющему меньше чем 5, как, например, меньше чем 3, например от 0 до 3.
Термин «удовлетворительное растворение in vitro» относится к проценту растворения, большему чем или равному 70% в пределах 30 минут в подходящей среде для растворения при 37°С плюс/минус 0,5°С при измерении с использованием общей методики Фармакопеи Соединенных Штатов (аппарат 2).
Термин «стабильная композиция» относится к композиции, которая, после хранения в течение 4 недель при повышенной температуре и влажности, таких как 40°С и относительная влажность 75%, демонстрирует поглощение воды меньше чем 10%, как, например, меньше чем 5%, например от 0 до 5%; и/или химическую деградацию меньше чем 3%, как, например, меньше чем 2,5%, например от 0 до 2,5%; и/или которая демонстрирует удовлетворительное растворение in vitro.
Термин «технологичность» означает степень, в которой продукт можно изготовлять с относительной легкостью с минимальными затратами и максимальной надежностью.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показан график процентной доли растворения десяти альтернативных композиций в форме таблетки с использованием буфера на основе соляной кислоты/хлорида натрия, рН 1,3.
На Фиг. 2 показан график процентной доли растворения дополнительных девятнадцати альтернативных композиций в форме таблетки с использованием буфера на основе соляной кислоты/хлорида натрия, рН 1,3.
На Фиг. 3 показан график процентной доли растворения пяти альтернативных композиций в форме таблетки, в которых варьировало содержание смазывающего вещества, с использованием фосфатного буфера, рН 6,8.
На Фиг. 4 показан график процентной доли растворения десяти альтернативных композиций в форме таблетки, в которых варьировало содержание соединения формулы (I), карбоната магния и смазывающего вещества, с использованием буфера на основе соляной кислоты/хлорида натрия, рН 1,3.
На Фиг. 5 показан график процентной доли растворения десяти альтернативных композиций в форме таблетки, в которых варьировало содержание соединения формулы (I), карбоната магния и смазывающего вещества, с использованием фосфатного буфера, рН 6,8.
ПРИМЕРЫ
Данное изобретение будет понятнее посредством ссылки на следующие примеры, которые предназначены для того, чтобы быть исключительно иллюстративными в отношении изобретения. Настоящее изобретение не ограничивается объемом приведенных в качестве примеров аспектов, которые подразумеваются лишь как иллюстрации одиночных аспектов изобретения. Из приведенного выше описания и сопровождающих графических материалов специалистам в данной области будут очевидны различные модификации изобретения, помимо описанных здесь модификаций. Такие модификации попадают в пределы объема приложенной формулы изобретения.
В приведенных ниже примерах, а также во всей данной заявке следующие сокращения имеют следующие значения. Термины, если они не определены, имеют их общепринятые значения.
|
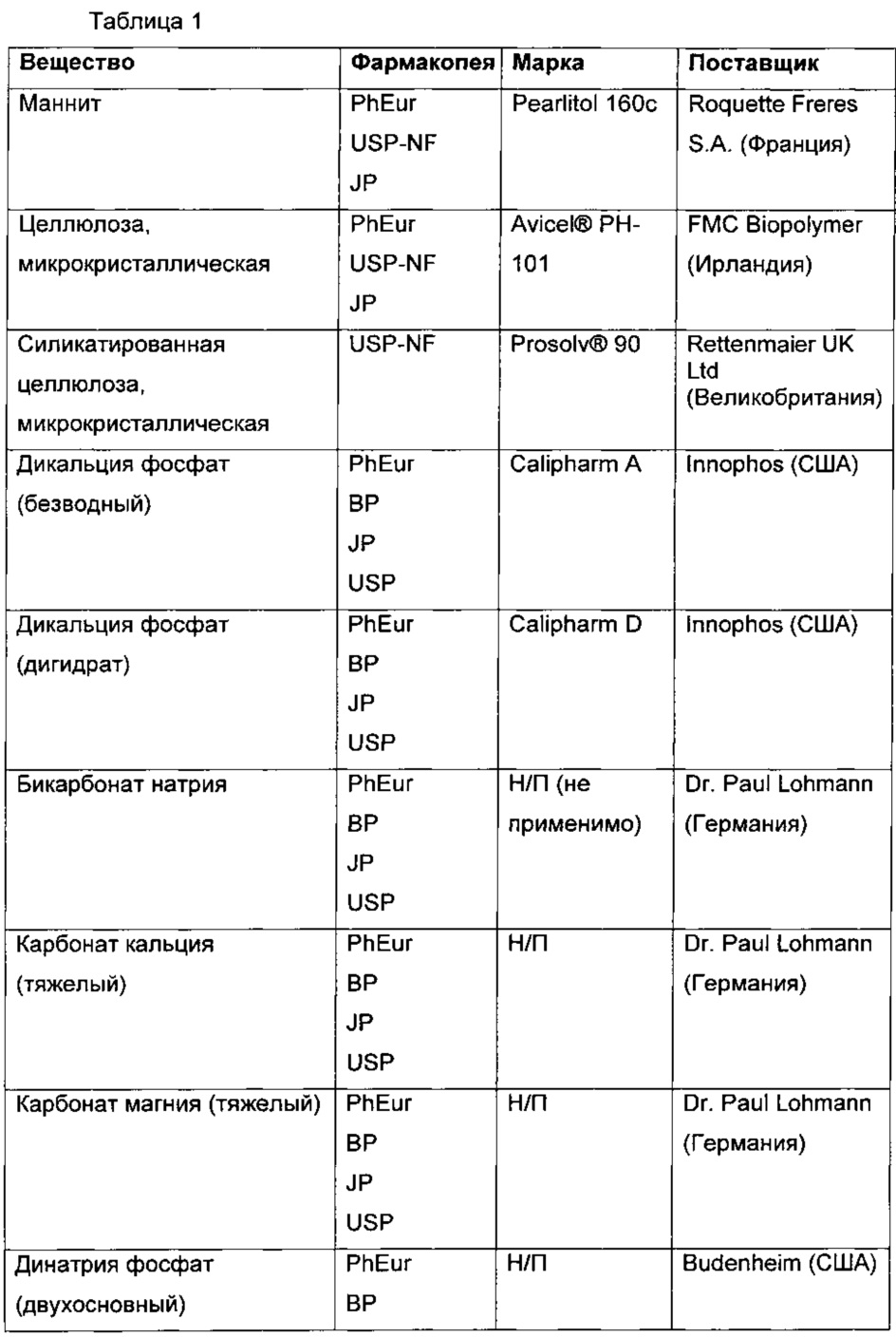
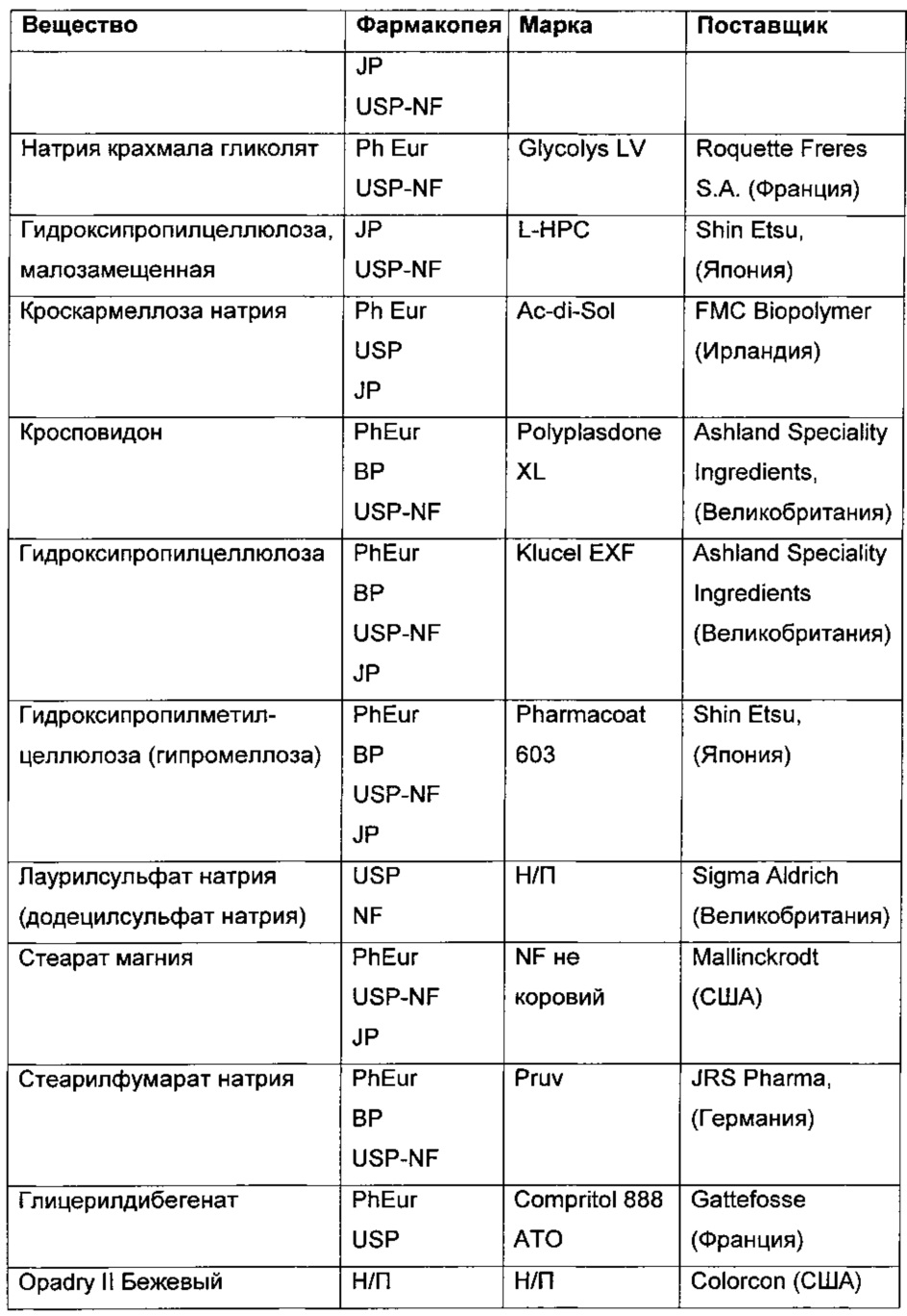
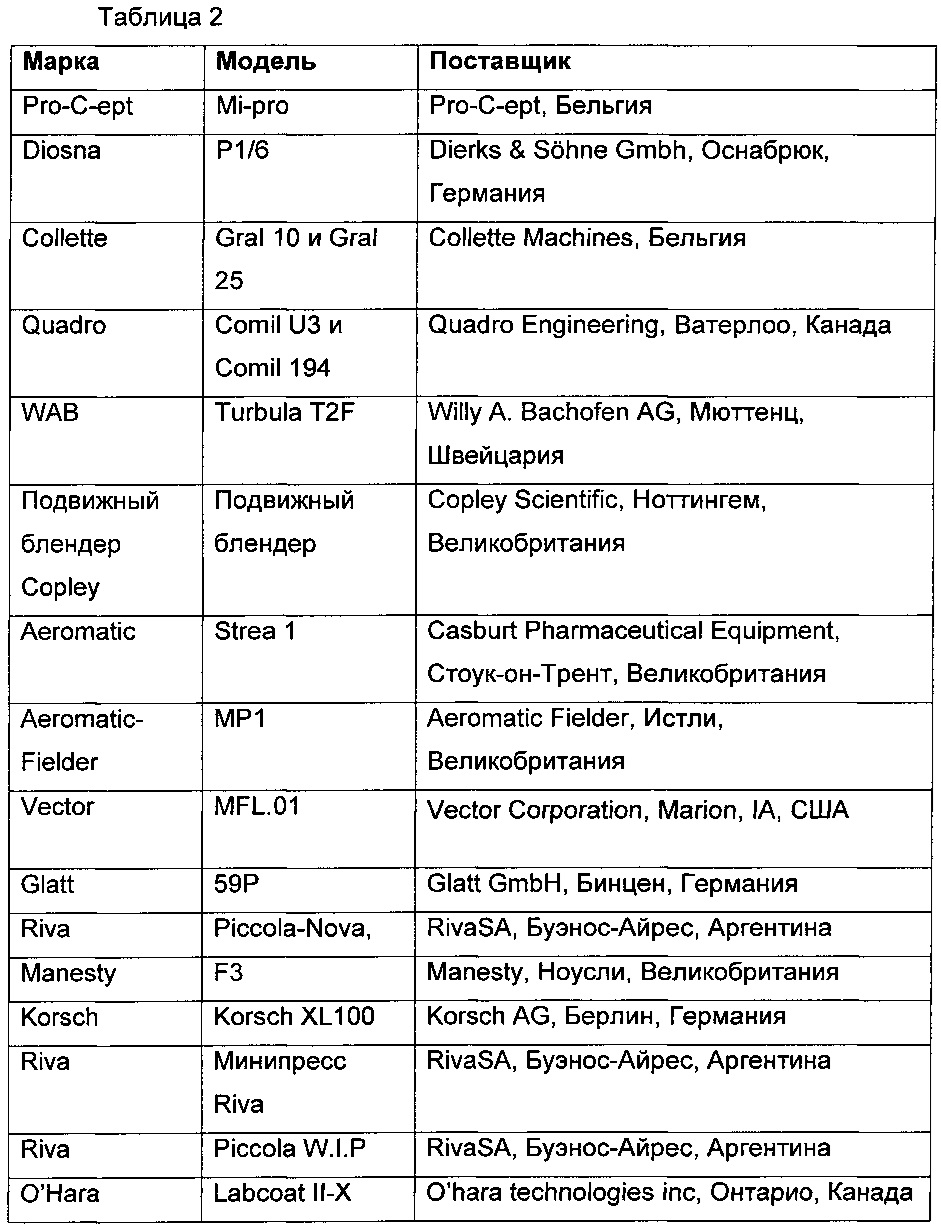
В Таблице 1, приведенной ниже, показаны использованные вещества, фармакопейный статус, марка и поставщик.
В Таблице 2, приведенной ниже, показано используемое оборудование, модель и поставщик.
Пример 1: оценка эффективности растворения десяти альтернативных форм таблеток
Обнаружили, что реология соединения формулы (I) может изменяться при определенных условиях. В частности, при низком рН и высокой концентрации (оба условия должны удовлетворяться одновременно) соединение формулы (I) может превращаться из кристаллического порошка в высоковязкое вещество. Теоретически данные условия будут удовлетворяться в микросреде матрицы таблетки либо при использовании способа растворения при низком рН (например рН 1,3), либо в желудке. Относительная площадь поверхности соединения формулы (I) уменьшается при образовании вязкого вещества, и это ассоциировано с пониженной скоростью солюбилизации соединения формулы (I). Это можно наблюдать в виде пониженной скорости растворения с использованием способа низкого рН.
На основе этого фундаментального понимания имеются два гипотетических механизма для того, чтобы избежать реологического превращения; во-первых, не позволить соединению формулы (I) солюбилизироваться в среде с низким рН (гипотеза I); во-вторых, если дисперсии в среде с низким рН нельзя избежать, быстро диспергировать соединение формулы (I) перед тем, как сможет произойти превращение (гипотеза II). Гипотеза II зависит от концентрации соединения формулы (I) в матрице таблетки, так как более высокие концентрации соединения формулы (I) уменьшают вероятность быстрого диспергирования.
Из композиции, полученной влажным гранулированием, получали десять разных таблеток-прототипов с использованием способов, хорошо известных специалистам в данной области. Композиция каждой из этих таблеток изложена в Таблице 3.

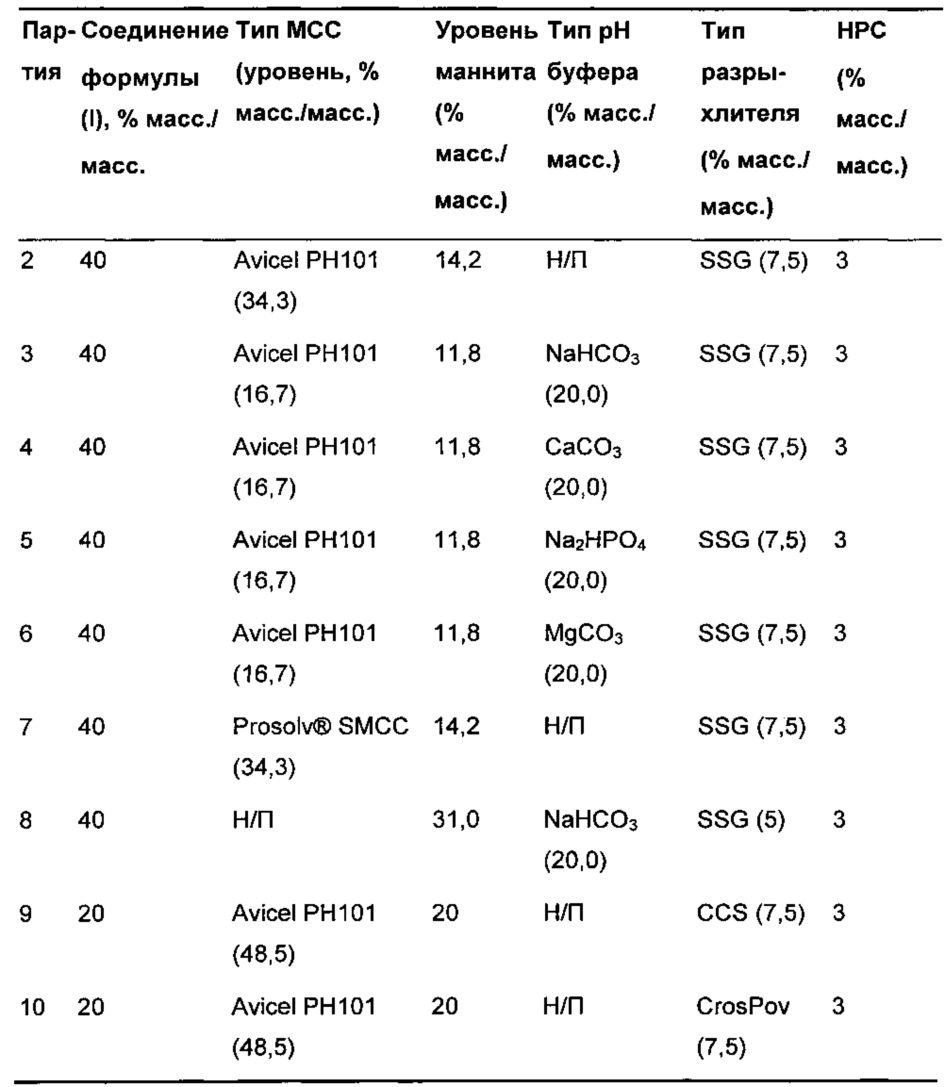
Партия 1 сопоставима с композицией фазы 1 клинического исследования и представляет собой позитивный контроль. Партия 2 представляет собой негативный контроль, так как она содержит высокую концентрацию соединения формулы (I) и не имеет подщелачивающего агента. Партия 5 тестирует гипотезу I (подщелачивающим агентом является Na2HPO4). Партии 7, 9 и 10 тестируют гипотезу II (нет подщелачивающего агента, но разные разрыхлители). Партии 3, 4, 6 и 8 тестируют и гипотезу I, и II (они содержат карбонатные/бикарбонатные подщелачивающие агенты, которые и увеличивают рН микросреды, и высвобождают диоксид углерода в кислых условиях; высвобождение диоксида углерода может помогать диспергировать соединение формулы (I)).
Соединение формулы (I) и эксципиенты (за исключением смазывающего вещества), описанные в Таблице 1 (общий размер партии приблизительно 250 г), загружали в миксер-гранулятор (Diosna, 1-литровый резервуар, Р1/6) и смешивали. К порошкам добавляли очищенную воду с дополнительным перемешиванием, пока не формировалась подходящая влажная масса. Образующиеся гранулы сушили до подходящего содержания влаги (меньше или равно 2% масс./масс. LOD), используя сушилку с псевдоожиженным слоем (Vector, MFL.01) с температурой воздуха на входе 65°С. Высушенные гранулы размалывали с использованием решетки подходящего размера (1 мм, Quadro Comil U3).
Затем добавляли SSF к гранулам (Таблица 4), которые затем перемешивали (WAB turbula) в течение 10 мин при 55 об./мин перед прессованием в ядра таблеток с использованием традиционного таблетировочного оборудования (таблетировочный пресс Manesty F3).


Концентрацию SSF в композициях увеличивали после партии 2 для обеспечения приемлемой технологичности на протяжении прессования. Теоретически это снизило бы адгезию вещества с таблетировочными пуансонами и пресс-формами (Pharmaceutical Powder Compaction Technology, под редакцией Goran Alderborn и Christer Nystrom, Informa Healthcare, New York, 2008). Однако увеличивающийся уровень смазывающего вещества также типично уменьшает скорость растворения из-за гидрофобной природы смазывающего вещества.
Дополнительные условия способа приведены в Таблице 5.
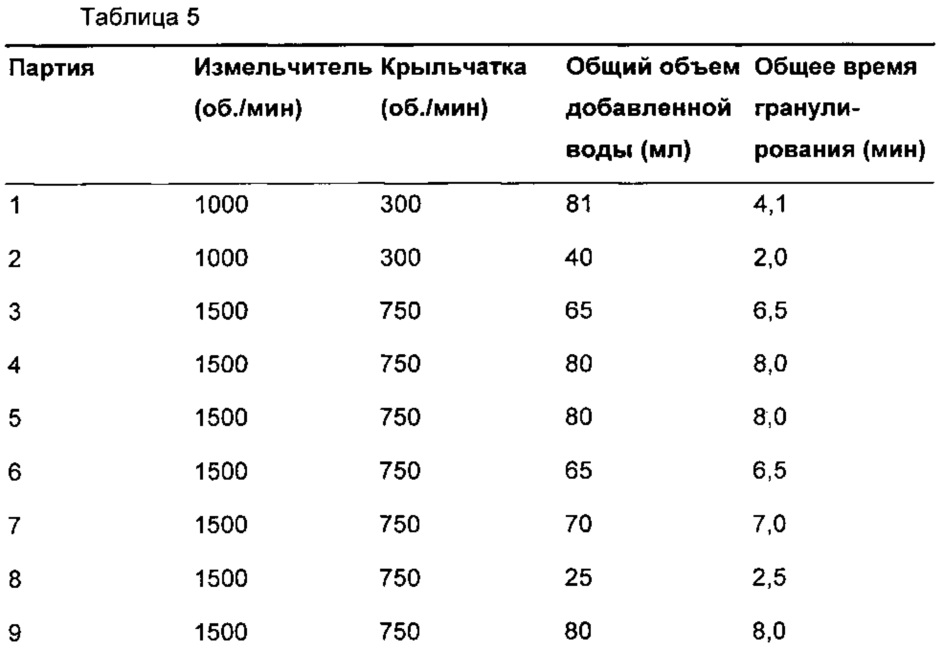
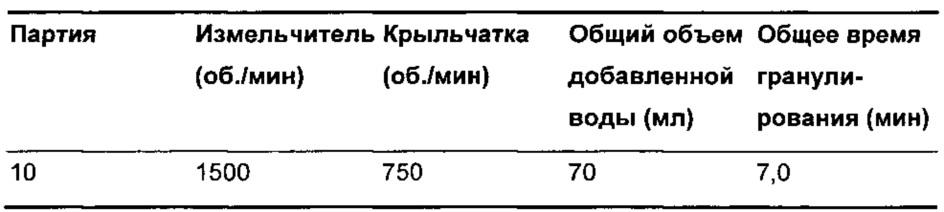
Скорости крыльчатки и измельчителя увеличивали после партии 2 для обеспечения приемлемой технологичности на протяжении прессования. Теоретически увеличение данных характеристик способа увеличивает плотность гранул (Powder Technology, 117, рр 3-39, 2001), что способствует сыпучести гранул и уменьшает пленкообразование на пуансоне. Однако увеличение плотности гранул также типично уменьшает скорость растворения.
Аналогичным образом, увеличение общего объема добавленной воды (Powder Technology, 88, рр 15-20, 1996) и времени гранулирования (увеличение плотности гранул представляет собой кинетический процесс) также вероятно увеличит плотность гранул и, таким образом, снизит скорость растворения.
Растворение определяли согласно общей методике Фармакопеи Соединенных Штатов с использованием аппарата 2 с раствором, забуференным соляной кислотой и хлоридом натрия, рН 1,3, при 37°С плюс/минус 0,5°С и скорости мешалки 50 об./мин. В 15, 30 и 60 минут растворяющие среды отбирали и концентрацию соединения формулы (I) в растворе определяли посредством УФ спектроскопии при длине волны 311 нм против раствора внешнего стандарта. Профили растворения показаны на Фиг. 1, данные по растворению представлены в Таблице 6.
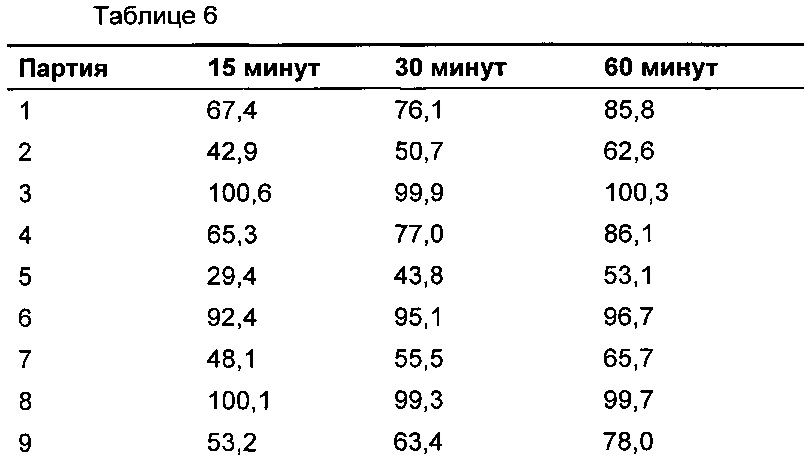

Пример 2: оценка десяти альтернативных форм таблетки в отношении пленкообразования на таблетировочном пуансоне
Из композиции, полученной влажным гранулированием, готовили десять разных таблеток-прототипов с использованием способов, хорошо известных специалистам в данной области. Композиция и способ изготовления каждой из данных таблеток описаны в Примере 1.
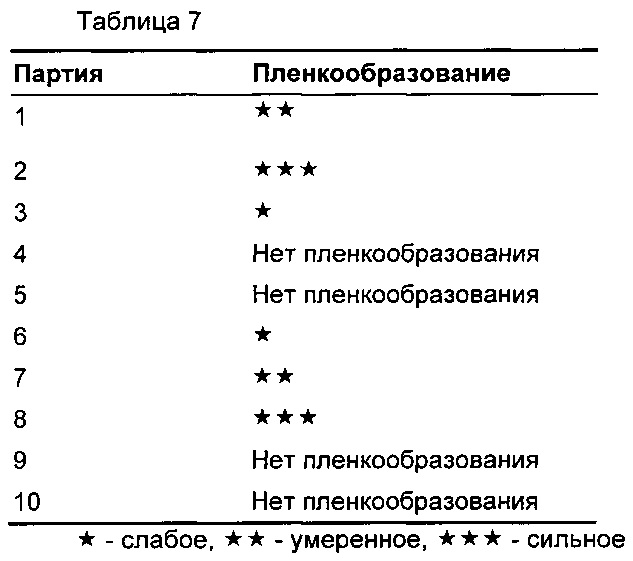
Адгезия вещества к поверхностям таблетировочного пуансона (описанная ниже как «пленкообразование») представляет собой хорошо известный недостаток процесса таблетирования (Journal of Pharmaceutical Sciences, Vol. 93(2), 2004). Степень пленкообразования оценивали для каждой композиции визуально и приводили в Таблице 7.
Пример 3: оценка десяти альтернативных форм таблетки в отношении поглощения воды таблеткой
Из композиции, полученной влажным гранулированием, готовили десять разных таблеток-прототипов с использованием способов, хорошо известных специалистам в данной области. Композиция и способ изготовления каждой из данных композиций таблетки описаны в Примере 1.
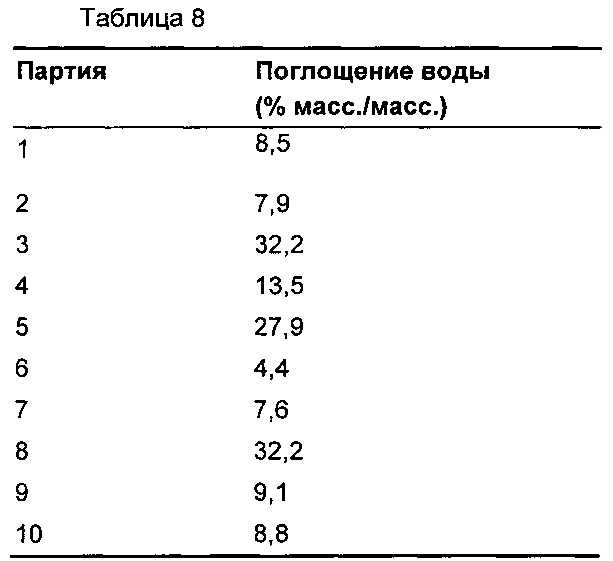
Для каждой композиции измеряли степень поглощения воды (см. Таблицу 8). Таблетки подвергали воздействию контролируемых условий (40°С и относительная влажность 75%) в течение одного месяца.
Пример 4: оценка эффективности растворения дополнительных девятнадцати альтернативных форм таблеток
Партию 6 (Примеры 1, 2 и 3) выбирали для дальнейшей разработки, так как, в отличие от других композиций, она демонстрировала заметное улучшение растворения при рН 1,3 (Фиг. 1), улучшение в отношении пленкообразования на пуансоне (Таблица 7) и малое поглощение воды (Таблица 8).
Из композиции, полученной влажным гранулированием, готовили дополнительные девятнадцать различных таблеток-прототипов с использованием способов, хорошо известных специалистам в данной области. Композиция каждой из данных таблеток является качественно аналогичной партии 6. Количественные композиции изложены в Таблице 9.
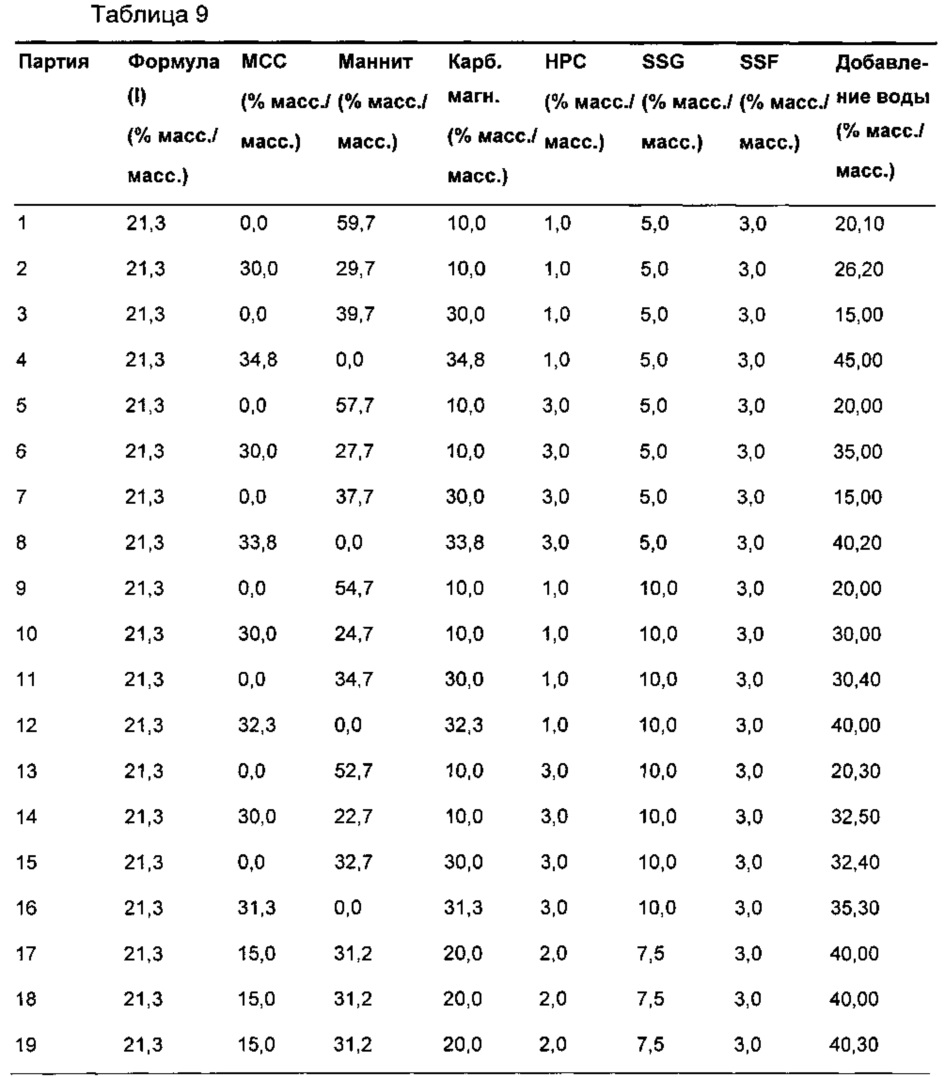
Соединение формулы (I) и эксципиенты, описанные в Таблице 9 (общий размер партии приблизительно 1,5 кг), загружали в миксер-гранулятор (Colette Gral 10) и смешивали. К порошкам добавляли очищенную воду (в интервале от 15% масс./масс. до 45% масс./масс. как изложено в Таблице 9) с дополнительным перемешиванием, пока не формировалась подходящая влажная масса (в интервале от приблизительно 3 до 14 мин), при 420 об./мин. Образующиеся гранулы сушили до подходящего содержания влаги (меньше или равно 2% LOD) с использованием сушилки с псевдоожиженным слоем (Aeromatic Strea 1) с температурой воздуха на входе 80°С. Высушенные гранулы размалывали с использованием решетки подходящего размера (1,4 мм, Quadro Comil U3). Затем добавляли к гранулам SSF, затем их смешивали (Copley, подвижный блендер с 7,5-литровым барабаном) в течение 5 мин при 25 об./мин перед прессованием в ядра таблеток с использованием традиционного таблетировочного оборудования (Korch XL100).
Растворение определяли согласно общей методике Фармакопеи Соединенных Штатов с использованием аппарата 2 с раствором, забуференным соляной кислотой и хлоридом натрия, рН 1,3, при 37°С плюс/минус 0,5°С и скорости мешалки 50 об./мин. В 15, 30 и 60 минут растворяющие среды отбирали, и концентрацию соединения формулы (I) в растворе определяли посредством УФ спектроскопии при длине волны 311 нм против раствора внешнего стандарта. Профили растворения показаны на Фиг. 2, данные по растворению представлены в Таблице 10.


Пример 5: оценка химической стабильности шестнадцати альтернативных форм таблетки
Из композиции, полученной влажным гранулированием, готовили шестнадцать различных таблеток-прототипов с использованием способов, хорошо известных специалистам в данной области. Композиция и способ изготовления каждой из этих таблеток описаны в Таблице 11.
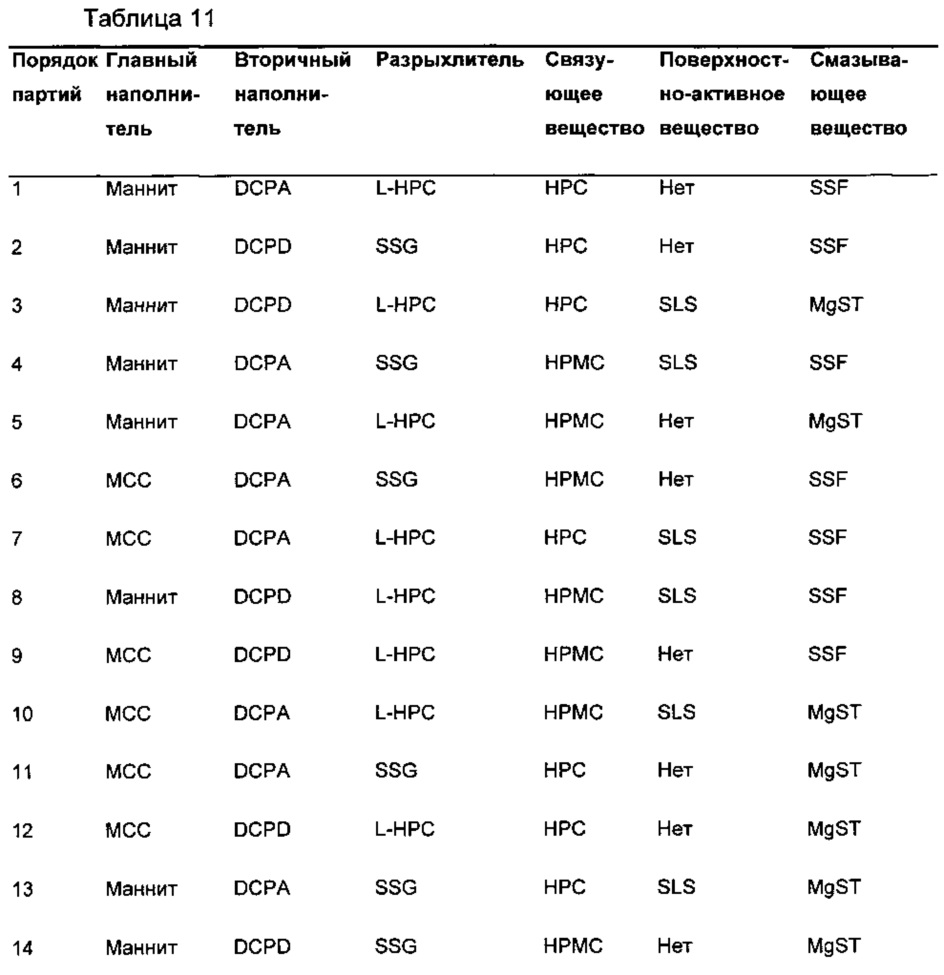
Соединение формулы (I) и эксципиенты (за исключением смазывающего вещества), описанные в Таблице 11 (общий размер партии приблизительно 50 г), загружали в миксер-гранулятор (Mi-Pro, 500 мл резервуар) и смешивали. Добавляли к порошкам очищенную воду (приблизительно 10 мл/мин) с дальнейшим перемешиванием, пока не формировалась подходящая влажная масса. Образующиеся гранулы высушивали до подходящего содержания влаги (меньше или равно 2% LOD) с использованием сушилки с псевдоожиженным слоем (Vector, MFI.01). Высушенные гранулы размалывали с использованием решетки подходящего размера (1 мм, Quadro Comil U3). Затем добавляли к гранулам смазывающее вещество, затем их смешивали (WAB turbula) в течение 4 мин при 24 об./мин перед прессованием в ядра таблеток с использованием традиционного таблетировочного оборудования (таблетировочный пресс Manesty F3).
Общие примеси измеряли путем инъецирования полученного образца и стандартных растворов в систему ЖХ (жидкостная хроматография), выбранную для обеспечения отделения соединения формулы (I) от органических примесей и эксципиентов. Хроматографические ответы, обусловленные соединением формулы (I) и органическими примесями, измеряли на УФ детекторе при длине волны 245 нм. Ответ, обусловленный соединением формулы (I), присутствующим в образце, сравнивали с ответом стандарта, и рассчитывали его содержание. Уровень органических примесей рассчитывали как % масс./масс. Предполагался эквивалентный ответ между соединением формулы (I) и органическими примесями.
Образцы хранили при контролируемых условиях - 60°С и относительной влажности 80% в течение четырех недель. После анализа образцы с SSF в их составе содержали 0,99 плюс/минус 0,36% (среднее плюс/минус стандартное отклонение, %), и образцы с MgSt в их составе содержали 1,93 плюс/минус 1,34% (среднее плюс/минус стандартное отклонение, %).
Пример 6: оценка эффективности растворения при варьировании концентрации SSF и включении альтернативного смазывающего вещества
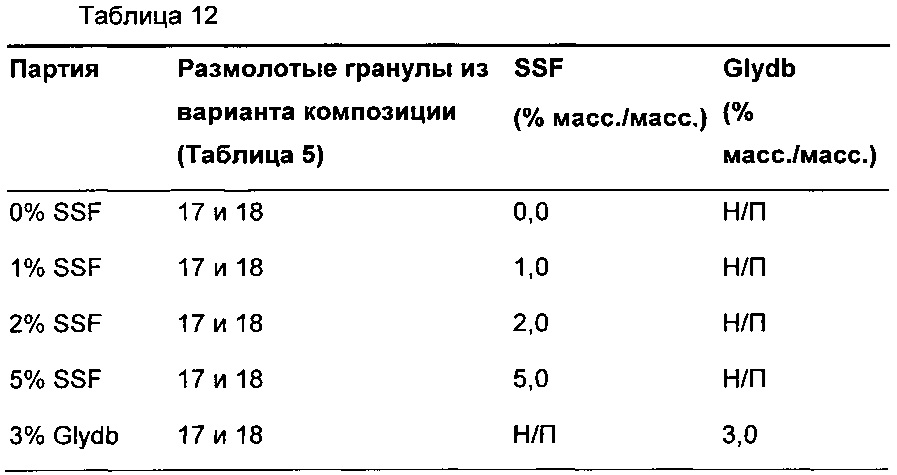
Для каждой из композиций-прототипов, представленных в Примере 4, в растворе фосфатного буфера, рН 6,8, не достигалась полная степень высвобождения. Исследовали эффект смазывающего вещества и получали пять различных таблеток-прототипов способом влажного гранулирования с использованием способов, хорошо известных специалистам в данной области. Композиция каждой из этих таблеток описана в Таблице 12.
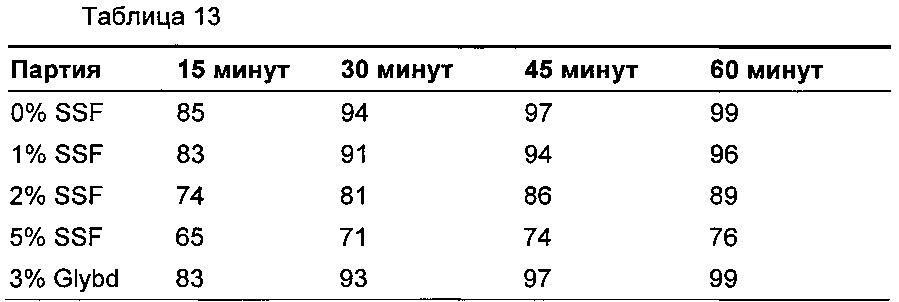
Размолотые гранулы без смазывающего вещества из вариантов прототипов 17 и 18 (эквивалентные композиции), представленных в примере 4 (Таблица 9), объединяли с подходящим количеством смазывающего вещества, представленного в Таблице 12, и смешивали (WAB turbula) в течение 5 мин при 25 об./мин перед прессованием в ядра таблеток с использованием традиционного таблетировочного оборудования (минипресс RIVA). Растворение определяли согласно общей методике Фармакопеи Соединенных Штатов с использованием аппарата 2 с раствором фосфатного буфера, рН 6,8, при 37°С плюс/минус 0,5°С и скорости мешалки 75 об./мин. В 15, 30, 45 и 60 минут отбирали растворяющие среды, и концентрацию соединения формулы (I) в растворе определяли посредством УФ спектроскопии при длине волны 298 нм против раствора внешнего стандарта. Результаты растворения показаны на Фиг. 3, и данные по растворению представлены в Таблице 13.
Пример 7: оценка таблеток соединения формулы (I), полученных с различными смазывающими веществами
Три различных таблетки-прототипа получали из композиции, полученной влажным гранулированием, с использованием способов, хорошо известных специалистам в данной области. Композиция каждой из этих таблеток (включая ряд смазывающих веществ, т.е. MgSt, SSF и Glydb) описана ниже.
Фармацевтическая композиция содержит следующие компоненты (% масс/масс):
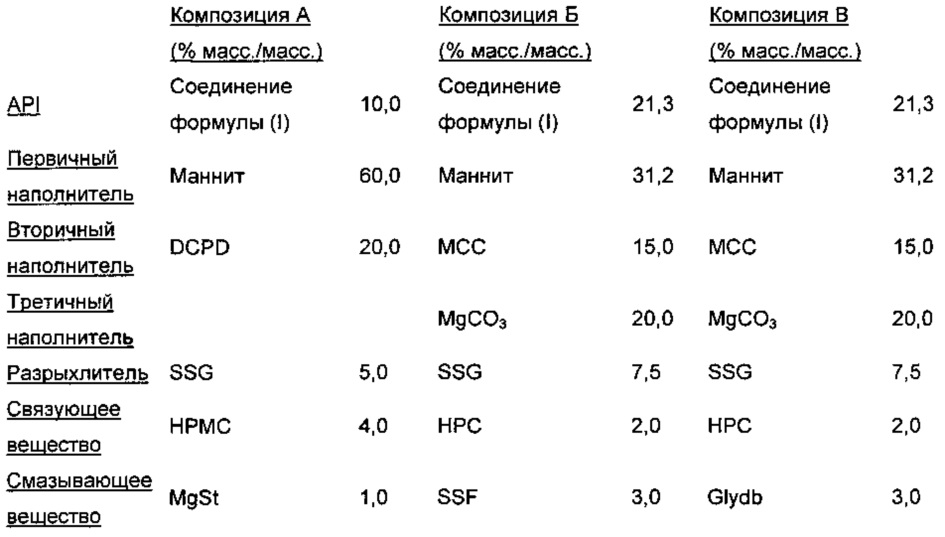
Способы изготовления для композиций А, Б и В приведены в Примере 5, Примере 4 и Примере 6 соответственно.
Осуществили оценку эффективности растворения таблетки (Таблица 14). Растворение определяли согласно общей методике Фармакопеи Соединенных Штатов с использованием аппарата 2 с раствором фосфатного буфера, рН 6,8, при 37°С плюс/минус 0,5°С и скорости мешалки 50 об./мин. В 15, 30 и 60 минут растворяющие среды отбирали, и концентрацию соединения формулы (I) в растворе определяли посредством УФ спектроскопии при длине волны 298 нм против раствора внешнего стандарта.

Композицию В выбрали для дальнейшего исследования, так как, в отличие от других композиций, она (1) не содержала MgSt, который в среднем давал больше примесей, чем SSF (Пример 5); (2) не содержала SSF, включение которого может влиять на степень высвобождения при растворении (Фиг. 3); и (3) демонстрировала приемлемую эффективность растворения во всем физиологически релевантном интервале рН (Таблица 15).

Пример 8: оценка эффективности растворения десяти альтернативных композиций таблетки
Десять альтернативных таблеток-прототипов получали в результате влажного гранулирования с использованием способов, хорошо известных специалистам в данной области. Композиция каждой из этих таблеток является качественно сходной с композицией В (Пример 7). Количественные составы изложены в Таблице 16.
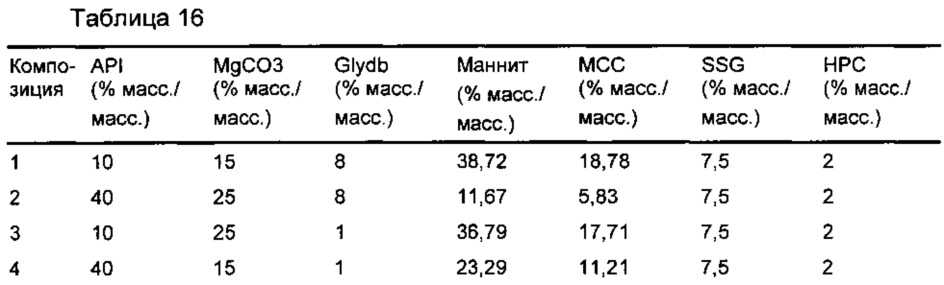

Соединение формулы (I) и эксципиенты (за исключением смазывающего вещества), описанные в Таблице 16 (общий размер партии приблизительно 250 г) загружали в миксер-гранулятор (Diosna, 1-литровый резервуар, Р1/6) и смешивали. К порошкам добавляли очищенную воду (приблизительно 10 мл/мин) с дальнейшим перемешиванием, пока не формировалась подходящая влажная масса. Образующиеся гранулы сушили до подходящего содержания влаги (меньше или равно 2% масс./масс. LOD) с использованием сушилки с псевдоожиженным слоем (Aeromatic Strea 1). Высушенные гранулы размалывали с использованием решетки подходящего размера (1,4 мм, Quadra Comil U3). Затем добавляли к гранулам смазывающее вещество, затем их смешивали (WAB turbula) в течение 10 мин при 55 об./мин. Гранулы затем прессовали в ядра таблеток (каждое ядро нормировали до 80 мг соединения формулы 1) с использованием традиционного таблетировочного оборудования (таблетировочный пресс Riva Piccola (W.I.Р.) при нормированном давлении 100 МПа.
Осуществляли оценку эффективности растворения таблетки (Таблица 17 и 18). Растворение определяли согласно общей методике Фармакопеи Соединенных Штатов с использованием аппарата 2 с раствором фосфата, рН 6,8, и раствором соляной кислоты и хлорида натрия, рН 1,3, при 37°С плюс/минус 0,5°С и скорости мешалки 50 об./мин. В 15, 30 и 60 минут отбирали растворяющие среды и определяли концентрацию соединения формулы (I) в растворе посредством УФ спектроскопии при длине волны 311 нм (для раствора с рН 1,3) или 298 нм (для раствора с рН 6,8) против раствора внешнего стандарта. Результаты по растворению показаны в Таблице 17/на Фиг. 4 (рН 1,3) и в Таблице 18/на Фиг. 5 (рН 6,8).

Пример 9: оценка пленкообразования на таблетировочном пуансоне десяти альтернативных композиций таблетки
Десять альтернативных таблеток-прототипов получали из композиции, полученной влажным гранулированием, с использованием способов, хорошо известных специалистам в данной области. Состав и способ изготовления каждой из данных таблеток описаны в Примере 8.
Адгезия вещества к поверхностям таблетировочного пуансона (описанная ниже как «пленкообразование») представляет собой хорошо известный изъян процесса таблетирования (Journal of Pharmaceutical Sciences, Vol. 93(2), 2004). Степень пленкообразования была оценена для каждой композиции визуально и приведена в Таблице 19.

Для композиций с 3-8% масс./масс. Glydb не наблюдали пленкообразования на пуансоне. Для композиций, содержащих 1% масс./масс. Glydb, при применяемых условиях способа наблюдали уровни пленкообразования на пуансоне от умеренных до сильных.
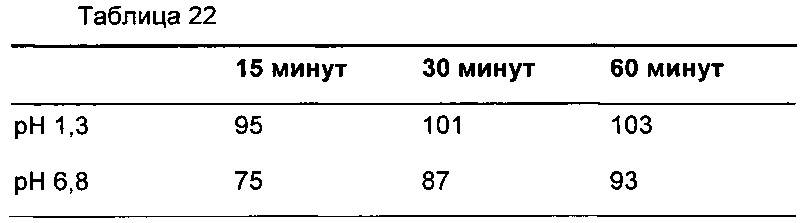
Пример 11: оценка растворения альтернативной композиции таблетки
Получали одну альтернативную композицию таблетки в результате влажного гранулирования с использованием способов, хорошо известных специалистам в данной области. Композиция ядра таблетки является количественно аналогичной композиции В (Пример 7), и для улучшения внешнего вида таблетки наносили пленочную оболочку с использованием традиционного способа покрытия пленкой. Количественный состав композиции ядра таблетки представлен в Таблице 20.

Пленочное покрытие наносили с использованием патентованной смеси эксципиентов покрытия - Opadry II Бежевый, поставляемой Colorcon.
Соединение формулы (I) и эксципиенты (за исключением смазывающего вещества), описанные в Таблице 20 (общий размер партии приблизительно 5 кг) загружали в миксер-гранулятор (Gral 25) и смешивали. К порошкам добавляли очищенную воду (приблизительно 166 мл/мин) с дальнейшим перемешиванием, пока не формировалась подходящая влажная масса. Образующиеся гранулы сушили до подходящего содержания влаги (меньше или равно 2% масс./масс. LOD) с использованием сушилки с псевдоожиженным слоем (Glatt 59Р). Высушенные гранулы размалывали с использованием решетки подходящего размера (1,4 мм, Quadro Comil U3). Затем добавляли к гранулам смазывающее вещество, затем их смешивали (подвижный блендер Copley, контейнер 7,5 л) в течение 5 мин при 25 об./мин. Гранулы затем прессовали в ядра таблеток с использованием традиционного таблетировочного оборудования (таблетировочный пресс Riva Piccola-Nova) с достижением намеченной массы после прессования - 375 мг. Ядра таблеток покрывали пленочным покрытием с использованием традиционного дражировочного оборудования (O'Hara Labcoat II-Х) с достижением увеличения массы таблетки 3% масс./масс.
Осуществляли оценку эффективности растворения таблетки (Таблица 22). Растворение определяли согласно общей методике Фармакопеи Соединенных Штатов с использованием аппарата 2 как с раствором фосфата, рН 6,8, так и с раствором соляной кислоты и хлорида натрия, рН 1,3, при 37°С плюс/минус 0,5°С и скорости мешалки 50 об./мин. В 15, 30 и 60 минут отбирали растворяющие среды и концентрацию соединения формулы (I) в растворе определяли посредством УФ спектроскопии при длине волны 311 нм (для раствора с рН 1,3) или 298 нм (для раствора с рН 6,8) против раствора внешнего стандарта.
![Фармацевтическая композиция N-[5-[2-(3,5-диметоксифенил)этил]-2H-пиразол-3-ил]-4-[(3R,5S)-3,5-диметилпиперазин-1-ил]бензамида](https://fips.edrid.ru/images/rid/3f/6e/71/e08a2e954e9128fcfe39282236362056.jpg)
![Фармацевтическая композиция N-[5-[2-(3,5-диметоксифенил)этил]-2H-пиразол-3-ил]-4-[(3R,5S)-3,5-диметилпиперазин-1-ил]бензамида](https://fips.edrid.ru/images/rid/3f/6e/71/8889b9c24ad98a66a68801fd0603a617.jpg)
![Фармацевтическая композиция N-[5-[2-(3,5-диметоксифенил)этил]-2H-пиразол-3-ил]-4-[(3R,5S)-3,5-диметилпиперазин-1-ил]бензамида](https://fips.edrid.ru/images/rid/3f/6e/71/9b9b1285436ef2d2cba21aae00d6d73c.jpg)
![Фармацевтическая композиция N-[5-[2-(3,5-диметоксифенил)этил]-2H-пиразол-3-ил]-4-[(3R,5S)-3,5-диметилпиперазин-1-ил]бензамида](https://fips.edrid.ru/images/rid/3f/6e/71/f38b6af377b1f56e4ca83e8c386aea11.jpg)
![Фармацевтическая композиция N-[5-[2-(3,5-диметоксифенил)этил]-2H-пиразол-3-ил]-4-[(3R,5S)-3,5-диметилпиперазин-1-ил]бензамида](https://fips.edrid.ru/images/rid/3f/6e/71/9d8ca9de0334bbb5b114bf3b03f44fdc.jpg)
![Фармацевтическая композиция N-[5-[2-(3,5-диметоксифенил)этил]-2H-пиразол-3-ил]-4-[(3R,5S)-3,5-диметилпиперазин-1-ил]бензамида](https://fips.edrid.ru/images/rid/3f/6e/71/5b363ae704cbc104c75310f736c57471.jpg)

