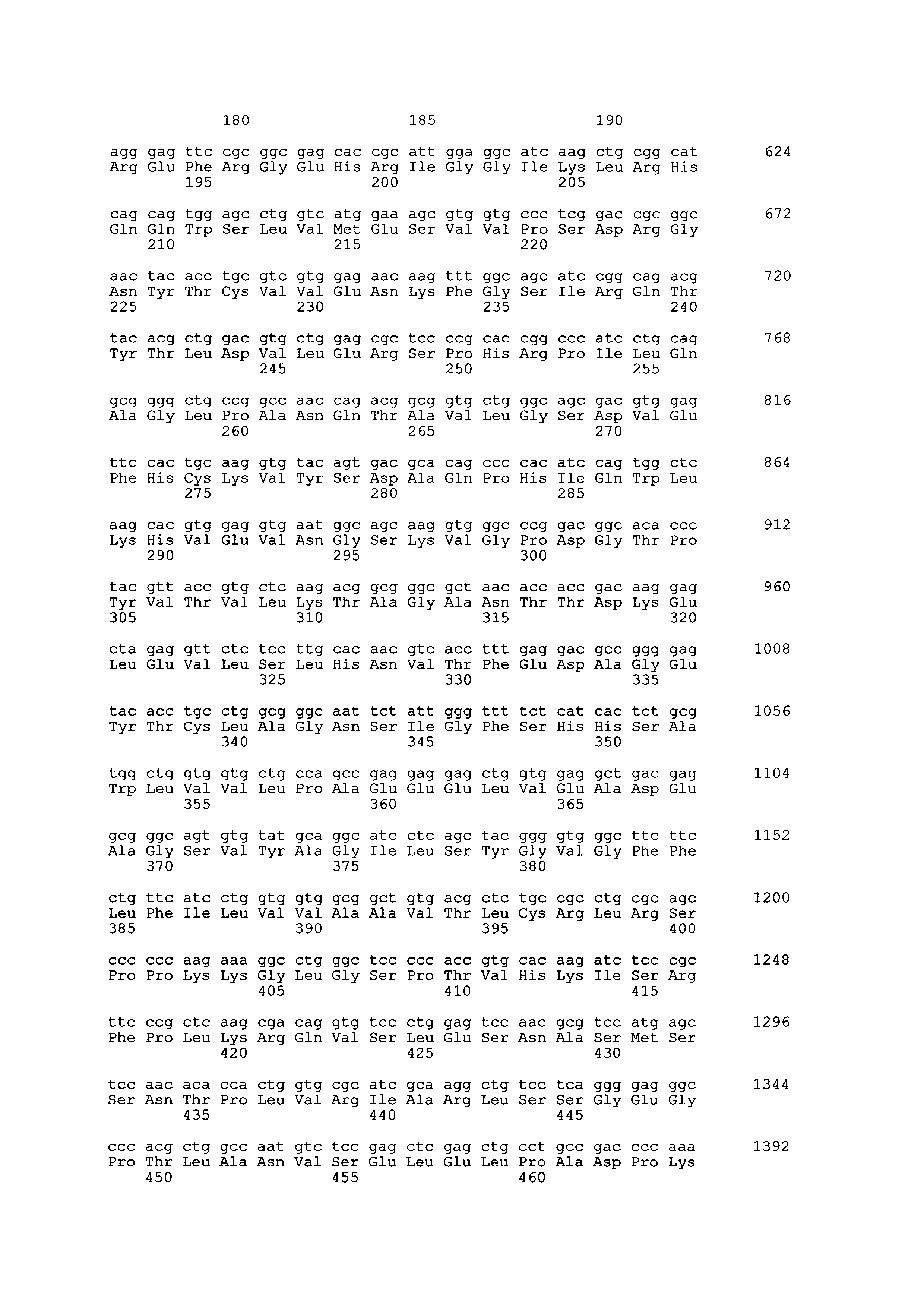Результат интеллектуальной деятельности: FGFR3 ГИБРИДНЫЙ ГЕН И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ, НАЦЕЛЕННЫЙ НА НЕГО
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым гибридным полипептидам, которые экспрессируются в атипичных клетках, таких как раковые клетки; полинуклеотидам, кодирующим полипептиды; векторам, содержащим полинуклеотиды; клеткам, содержащим векторы; их антителам и фрагментам, которые специфически связываются с полипептидами; олигонуклеотидным праймерам, которые гибридизуются с полинуклеотидами; олигонуклеотидам, которые отщепляют полинуклеотиды; фармацевтическим композициям, содержащим антитела или олигонуклеотиды; способам и наборам для обнаружения полинуклеотидов или гибридных полипептидов; способам тестирования предрасположенности к злокачественному новообразованию, подвержен ли субъект злокачественному новообразованию, или прогрессирует ли злокачественное новообразование, базируясь на присутствии или отсутствии полинуклеотидов или гибридных полипептидов; способам отбора пациентов со злокачественными новообразованиями, к которым применим ингибитор FGFR; фармацевтическим композициям для лечения злокачественного новообразования, где соединения, имеющие FGFR ингибирующую активность, или их фармацевтически приемлемые соли используют для введения пациентам, экспрессирующим гибридные полипептиды или несущим полинуклеотиды; способам лечения или предотвращения злокачественного новообразования, которые включают стадию введения эффективного количества соединений, имеющих FGFR ингибирующую активность, или их фармацевтически приемлемых солей пациентам, экспрессирующим гибридные полипептиды или несущим полинуклеотиды; применению соединений, имеющих FGFR ингибирующую активность или их фармацевтически приемлемых солей для получения фармацевтических композиций для лечения злокачественного новообразования для введения пациентам, экспрессирующим гибридные полипептиды или несущим полинуклеотиды; соединениям, имеющим FGFR ингибирующую активность или их фармацевтически приемлемым солям для применения для лечения или предотвращения пациентов, экспрессирующих гибридные полипептиды или несущих полинуклеотиды; а также к способам идентификации FGFR ингибиторов, и др.
Уровень техники
Злокачественное новообразование может развиваться в любом органе или ткани, и является трудноизлечимым и летальным. Очевидно, что злокачественное новообразование представляет собой чрезвычайно неблагоприятное заболевание. Последние статистические данные свидетельствуют о том, что у одной из каждых двух особей диагностируется злокачественное новообразование в течение жизни, и один из четырех мужчин и одна из шести женщин умирает от злокачественного новообразования. Таким образом, злокачественное новообразование остается чрезвычайно тяжелым заболеванием.
До настоящего времени, было разработано много противораковых средств и они назначались многим пациентам со злокачественными новообразованиями, и достигали определенных терапевтических эффектов. Тем не менее, хорошо известно, что противораковые средства также вызывают серьезные побочные действия. В то же время, в течение длительного времени было известно, что существуют индивидуальные отличия ответной реакции на противораковые средства, то есть, терапевтические эффекты и побочные эффекты, хотя до сих пор причина остается невыясненной.
Последние достижения науки и технологии, в особенности, быстрое прогрессирование фармакогеномики (PGx), предоставило нам возможности понять различные заболевания, включая злокачественное новообразование (такие как злокачественное новообразование, диабет, и гипертония) на молекулярном уровне. Было показано, что среди пациентов, проявляющих сходные симптомы, наблюдаются случаи, когда генетический полиморфизм (включая мутацию генов) задействован в различные наблюдаемые индивидуальные отличия, например, отличия в абсорбции, распределении, метаболизме, и экскреции вводимых лекарственных средств, а также отличия в ответе в участках действия, отличия в патологических состояниях, и отличия в восприимчивости к заболеванию.
Это дает основания предполагать, что у пациентов, которые уже поражены злокачественным новообразованием, терапевтические эффекты могут быть усилены и побочные эффекты могут быть уменьшены, например, путем анализа генетической информации пациентов заблаговременно перед введением противораковых средств, и отбора средства для введения и определения схемы приема на основе присутствия или отсутствия специфических генетических полиморфизмов.
Подобным образом, для здоровых лиц также, геномная информации индивидуума может анализироваться с использованием фармакогеномики для предсказания предрасположенности особи к заболеванию (вероятность быть пораженным заболеванием), а также способности реагировать на лекарственные средства, на основании присутствия или отсутствия специфических генетических полиморфизмов.
Этот новый тип терапевтического способа, в котором используются специфические генетические полиморфизмы, идентифицированные таким образом, или мутантные полипептиды, возникающие вследствие таких полиморфизмов в качестве биомаркера, относятся к так называемой индивидуализированной медицине, приспособляемой медицине, персонализированной медицине, или специализированной медицине, и он утвержден для клинических разработок фармацевтических продуктов и лечебной практики в различных странах.
Сходным образом, агенты, которые нацеливают специфические генетические полиморфизмы, идентифицированные, как описано выше, или мутантные полипептиды, возникающие вследствие таких полиморфизмов, обозначаются как молекулярно нацеливающие лекарственные средства, и их разработка осуществляется активно.
Рецепторы факторов роста фибробластов (FGFR) представляют собой киназы, принадлежащие к семейству рецепторных тирозинкиназ. FGFR1, FGFR2, FGFR3, и FGFR4 составляют семейство FGFR. Лиганд представляет собой фактор роста фибробластов (FGF), и 22 типа структурно сходных белков составляют семейство.
Сигналы, которые передаются посредством FGFR, переправляются на MAPK путь или PI3K/AKT путь. Было описано, что при злокачественном новообразовании, передача сигнала задействована в клеточный рост, ангиогенез, миграцию клеток, инвазию, метастазирование, и др.; и FGFR активирован в результате сверхэкспрессии, гиперамплификации генов, мутации, или транслокации (Непатентный документ 1). Например, известно, что для FGFR3, генетическая транслокация наблюдается при множественной миеломе (Непатентный документ 2); мутация генов наблюдается при раке мочевого пузыря (Непатентный документ 3); и сверхэкспрессия наблюдается при раке яичников, немелкоклеточном раке легких, и печеночно-клеточном раке.
Данные, описанные выше, свидетельствуют о взаимосвязи между FGFR и злокачественным новообразованием. Следовательно, было осуществлены попытки разработать соединения с FGFR ингибирующей активностью в качестве противораковых средств (Непатентные документы 4 и 5).
Несмотря на то, что совсем недавно было описано, что генетическая транслокация, которая предполагает наличие гибридного полипептида FGFR3 и трансформирующего кислотного биспирального белка 3 (ТАСС3) или гибридного полипептида FGFR1 и ТАСС1 была обнаружена в очень незначительном числе случаев мультиформной глиобластомы головного мозга (GBM) (три из 97 образцов, 3,1%) (Непатентный документ 6),взаимосвязь между гибридными полипептидами FGFR и другими белками и другими типами злокачественных новообразований остается невыясненной.
Документы предшествующего уровня техники
[Непатентные документы]
[Непатентный документ 1] Cytokine & Growth Factor Reviews, 2005, 16: 139-149
[Непатентный документ 2] Blood, 2003, 101: 4569-4575
[Непатентный документ 3] Nature Genetics, 1999 Sep., 23(1): 18-20
[Непатентный документ 4] Cancer Research, 2012, 72: 2045-2056
[Непатентный документ 5] J. Med. Chem., 2011, 54: 7066-7083
[Непатентный документ 6] Science, Vol. 337, Issue 6099, 7 September 2012: 1231-1235
Сущность изобретения
[Задачи, на решение которых нацелено изобретение]
Учитывая вышеизложенные обстоятельства, настоящее изобретение направлено на идентификацию и обеспечение молекул, специфических к раковым клеткам, которые можно использовать в качестве биомаркера для предоставления возможности персонализировать медицину для лечения рака на основании ингибитора FGFR, и молекулы, специфические к раковым клеткам, которые пригодны для разработки молекулярно нацеленных лекарственных средств, нацеленных на FGFR, а также на обеспечение различных материалов и методов для использования в персонализированной медицине и разработку молекулярно нацеленных лекарственных средств, которые используют такие молекулы в качестве биомаркера или молекулярной мишени.
[Способы решения проблем]
Как было указано выше, предполагают взаимосвязь между FGFR и злокачественным новообразованием; тем не менее, взаимосвязи между гибридными белками FGFR с другими белками и различными типами злокачественных новообразований остается нераскрытыми.
Для решения вышеописанной задачи, изобретатели настоящего изобретения провели целенаправленные исследования относительно экспрессии, гиперамплификации, мутации, транслокации, и т.д. для генов, кодирующих FGFR, в различных раковых клетках. В результате этого, изобретателями настоящего изобретения были открыты в разнообразных клетках рака мочевого пузыря и клетках рака легких, новые гены гибридных полипептидов между геном FGFR3 полипептида и другими полипептидными генами, в особенности, гены гибридных полипептидов между геном FGFR3 полипептида и геном BAIAP2L1 полипептида, и гены гибридных полипептидов между геном FGFR3 полипептида и геном ТАСС3 полипептида. Таким образом, изобретатели настоящего изобретения раскрыли настоящее изобретение.
Специфически, настоящее изобретение относится к:
новым гибридным полипептидам, которые экспрессируются в атипичных клетках, таких как раковые клетки,
полинуклеотидам, кодирующим полипептиды,
векторам, содержащим полинуклеотиды,
клеткам, содержащим векторы,
их антителам и фрагментам, которые специфически связываются с полипептидами,
олигонуклеотидным праймерам, которые гибридизуются с полинуклеотидами,
олигонуклеотидам, которые отщепляют полинуклеотиды,
фармацевтическим композициям, содержащим антитела или олигонуклеотиды,
способам и наборам для определения гибридных полипептидов или полинуклеотидов,
способам тестирования предрасположенности к злокачественному новообразованию, подвержен ли субъект злокачественному новообразованию, или прогрессирует ли злокачественное новообразование, базируясь на присутствии или отсутствии гибридных полипептидов или полинуклеотидов,
способам отбора пациентов со злокачественными новообразованиями, к которым применим ингибитор FGFR,
фармацевтическим композициям для лечения злокачественного новообразования, которые отличаются тем, что их используют для введения пациентам,
экспрессирующим гибридные полипептиды или несущим полинуклеотиды,
способам идентификации FGFR ингибиторов, и т.д., как описано ниже:
[1] гибридный полипептид, который содержит FGFR3 полипептид и BAIAP2L1 полипептид или ТАСС3 полипептид:
где FGFR3 полипептид представляет собой цельный полипептид или часть полипептида дикого типа, состоящий из аминокислотной последовательности SEQ ID NO: 6 или 7, или цельный полипептид или часть мутантного полипептида с одной или несколькими аминокислотными заменами, делециями, или инсерциями в полипептиде дикого типа;
BAIAP2L1 полипептид представляет собой цельный полипептид или часть полипептида дикого типа, состоящий из аминокислотной последовательности SEQ ID NO: 8, или цельный полипептид или часть мутантного полипептида с одной или несколькими аминокислотными заменами, делециями, или инсерциями в полипептиде дикого типа; и
ТАСС3 полипептид представляет собой цельный полипептид или часть полипептида дикого типа, состоящий из аминокислотной последовательности SEQ ID NO: 9, или цельный полипептид или часть мутантного полипептида с одной или несколькими аминокислотными заменами, делециями, или инсерциями в полипептиде дикого типа;
[2] гибридный полипептид согласно [1], как описано выше, где FGFR3 полипептид представляет собой полипептид дикого типа, состоящий из аминокислотной последовательности SEQ ID NO: 6 или 7;
[3] гибридный полипептид согласно [1] или [2], как описано выше, где гибридный полипептид содержит FGFR3 полипептид и BAIAP2L1 полипептид;
[4] гибридный полипептид согласно [3], как описано выше, где гибридный полипептид состоит из аминокислотной последовательности SEQ ID NO: 32 или 38;
[5] гибридный полипептид согласно [1] или [2], как описано выше, где гибридный полипептид содержит FGFR3 полипептид и ТАСС3 полипептид;
[6] гибридный полипептид согласно [5], как описано выше, где гибридный полипептид состоит из аминокислотной последовательности SEQ ID NO: 28, 30, 34, или 36;
[7] гибридный полипептид согласно любому из [1]-[5], как описано выше, где гибридный полипептид имеет происхождение из рака мочевого пузыря или рака легкого;
[8] полинуклеотид, кодирующий гибридный полипептид согласно любому из [1]-[7], как описано выше;
[9] полинуклеотид согласно [8], как описано выше, который содержит полинуклеотидную последовательность SEQ ID NO: 14, 15, или 16;
[10] полинуклеотид согласно [9], как описано выше, который содержит полинуклеотидную последовательность SEQ ID NO: 27, 29, 31, 33, 35, или 37;
[11] вектор, содержащий полинуклеотид согласно любому из [8]-[10], как описано выше;
[12] рекомбинантная клетка, которая содержит вектор согласно [11], как описано выше;
[13] антитело или его антиген-связывающий фрагмент, который специфически связывается с гибридным полипептидом согласно любому из [1]-[7], как описано выше;
[14] пара олигонуклеотидных праймеров, состоящая из смыслового и антисмыслового праймеров, каждый гибридизируется с полинуклеотидом, кодирующим гибридный полипептид согласно любому из [1]-[7], как описано выше, для обнаружения или амплификации полинуклеотида;
[15] олигонуклеотид, который связывается с мРНК полинуклеотида, кодирующего гибридный полипептид согласно любому из [1]-[7], как описано выше, и имеет активность ингибировать трансляцию мРНК полинуклеотида в белок;
[16] олигонуклеотид согласно [15], как описано выше, представляющий собой миРНК, которая расщепляет мРНК полипептида;
[17] фармацевтическая композиция, которая содержит антитело или его антиген-связывающий фрагмент согласно [13], как описано выше;
[18] фармацевтическая композиция, которая содержит олигонуклеотид согласно [15] или [16], как описано выше;
[19] способ обнаружения гибридного полипептида, содержащего FGFR3 полипептид и BAIAP2L1 полипептид или ТАСС3 полипептид, который включает стадию обнаружения гибридного полипептида в образце, выделенном от субъекта, путем применения антитела или его антиген-связывающего фрагмента, связывающегося с гибридным полипептидом согласно любому из [1]-[7], как описано выше;
[20] способ обнаружения полинуклеотида, кодирующего гибридный полипептид, содержащий FGFR3 полипептид и BAIAP2L1 полипептид или ТАСС3 полипептид, который включает стадию обнаружения полинуклеотида, кодирующего гибридный полипептид в образце, выделенном от субъекта, путем применения пары олигонуклеотидных праймеров, состоящей из смыслового и антисмыслового праймеров, каждый гибридизируется с полинуклеотидом, кодирующим гибридный полипептид согласно любому из [1]-[7], как описано выше, для обнаружения или амплификации полинуклеотида;
[21] набор для обнаружения полинуклеотида, кодирующего гибридный полипептид, содержащий FGFR3 полипептид и BAIAP2L1 полипептид или ТАСС3 полипептид, который содержит пару олигонуклеотидных праймеров, состоящую из смыслового и антисмыслового праймеров, каждый гибридизируется с полинуклеотидом, кодирующим гибридный полипептид согласно любому из [1]-[7], как описано выше, для обнаружения или амплификации полинуклеотида;
[22] набор для обнаружения гибридного полипептида, содержащего FGFR3 полипептид и BAIAP2L1 полипептид или ТАСС3 полипептид, который содержит антитело или его антиген-связывающий фрагмент, связывающийся с гибридным полипептидом согласно любому из [1]-[7], как описано выше;
[23] способ тестирования предрасположенности к злокачественному новообразованию у субъекта, подвержен ли субъект злокачественному новообразованию, или прогрессирует ли у субъекта злокачественное новообразование, путем определения присутствия или отсутствия гибридного полипептида согласно любому из [1]-[7], как описано выше, в образце, выделенном от субъекта, где способ основывается на критерии, что у субъекта более вероятно развитие злокачественного новообразования, поражение злокачественным новообразованием, или прогрессирование злокачественного новообразования, если обнаруживается гибридный полипептид;
[24] способ тестирования предрасположенности к злокачественному новообразованию у субъекта, подвержен ли субъект злокачественному новообразованию, или прогрессирует ли у субъекта злокачественное новообразование, путем определения присутствия или отсутствия полинуклеотида, кодирующего гибридный полипептид согласно любому из [1]-[7], как описано выше, в образце, выделенном от субъекта, где способ основывается на критерии, что у субъекта более вероятно развитие злокачественного новообразования, поражение злокачественным новообразованием, или прогрессирование злокачественного новообразования, если обнаруживается полинуклеотид, кодирующий гибридный полипептид;
[25] способ согласно [23] или [24], как описано выше, где злокачественное новообразование представляет собой рак мочевого пузыря, опухоль головного мозга, плоскоклеточный рак головы и шеи, рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, меланому кожи, рак пищевода, рак желудка, или рак печени;
[26] способ отбора пациента, которому подходит противораковое средство, содержащее соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемую соль, который включает стадии:
(а) определение присутствия или отсутствия гибридного полипептида согласно любому из [1]-[7], как описано выше, в образце, выделенном от субъекта; и
(б) отбор пациента, для которого подтверждено наличие гибридного полипептида, как пациента, которому подходит противораковое средство;
[27] способ отбора пациента, которому подходит противораковое средство, содержащее соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемую соль, который включает стадии:
(а) определение присутствия или отсутствия полинуклеотида, кодирующего гибридный полипептид согласно любому из [1]-[7], как описано выше, в образце, выделенном от субъекта; и
(б) отбор пациента, для которого подтверждено наличие полинуклеотида, кодирующего гибридный полипептид, как пациента, которому подходит противораковое средство;
[28] способ согласно [26] или [27], как описано выше, где злокачественное новообразование представляет собой рак мочевого пузыря, опухоль головного мозга, плоскоклеточный рак головы и шеи, рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, меланому кожи, рак пищевода, рак желудка, или рак печени;
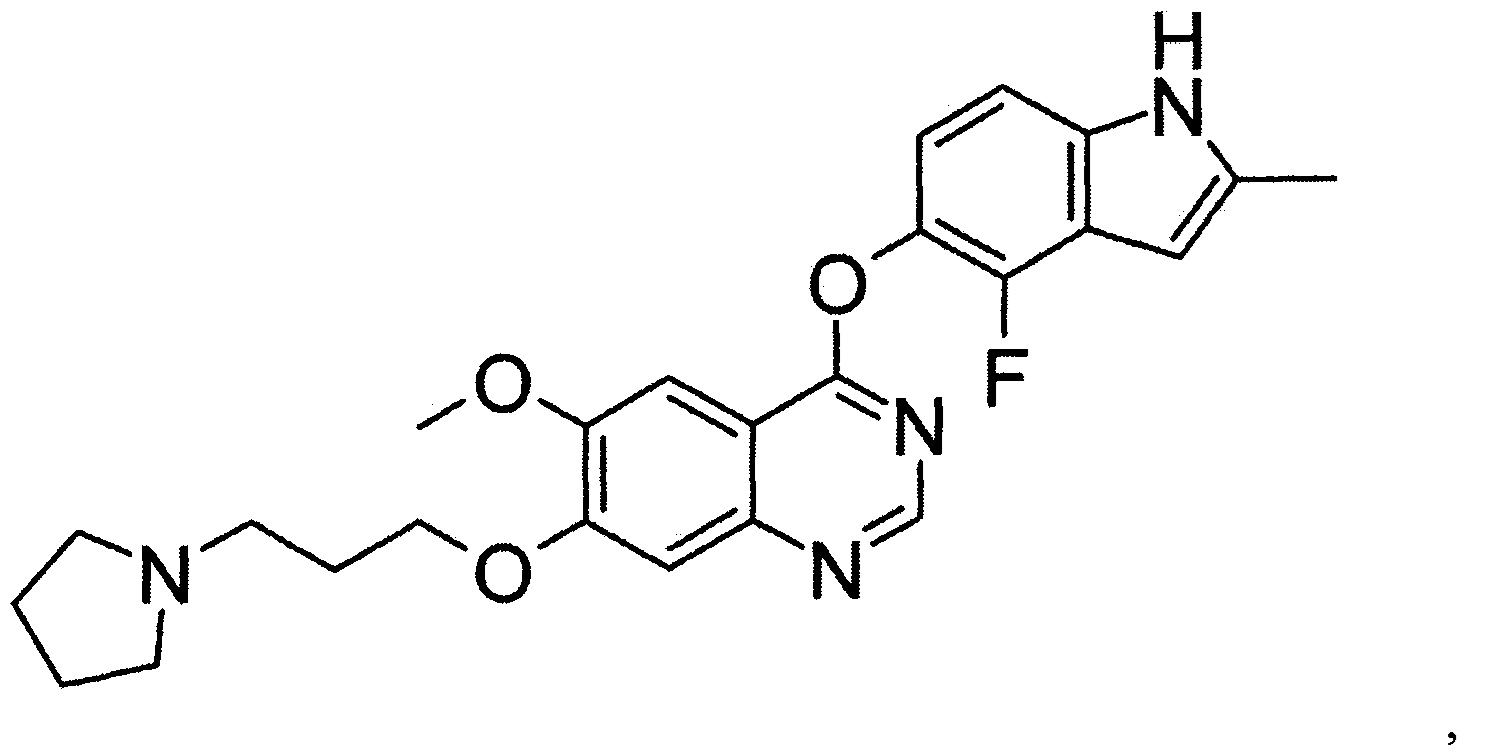
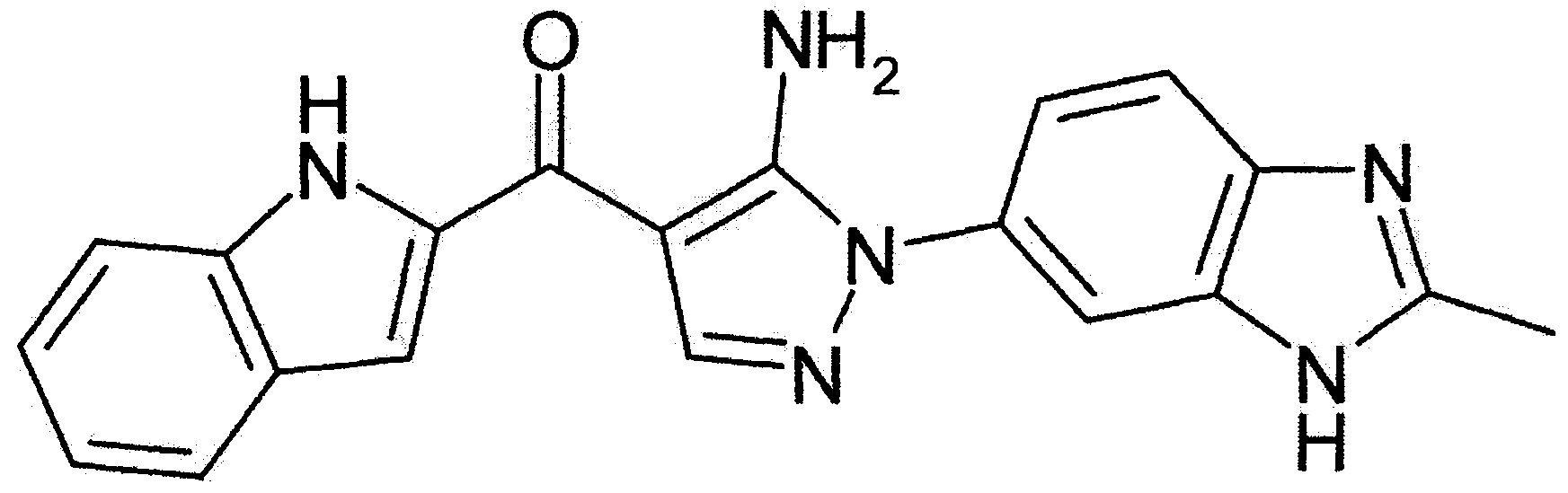
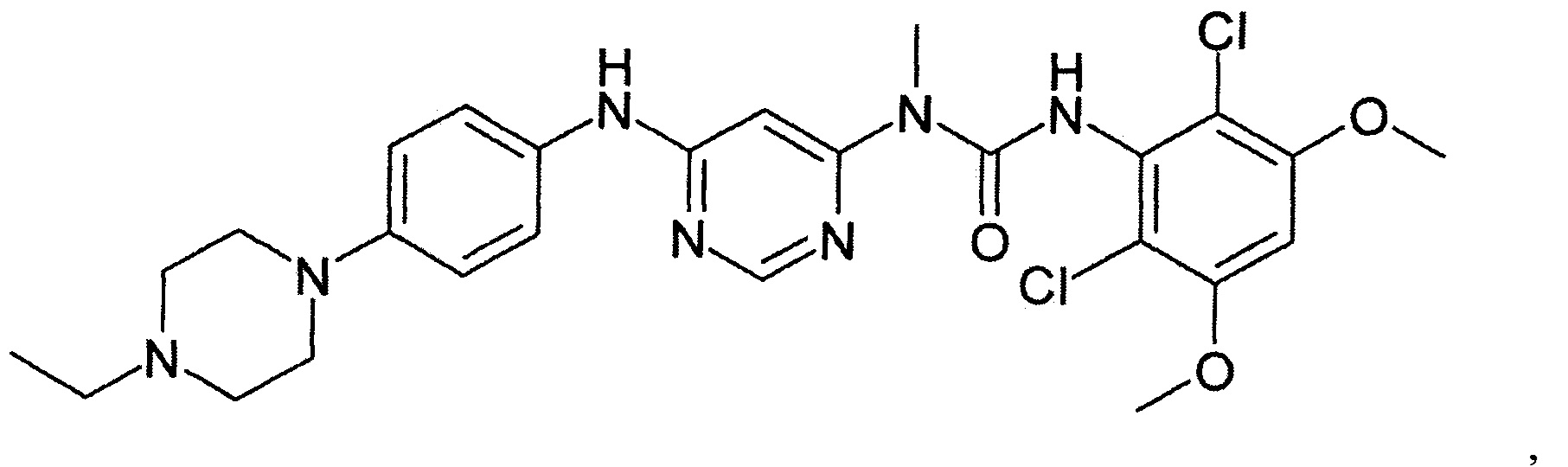
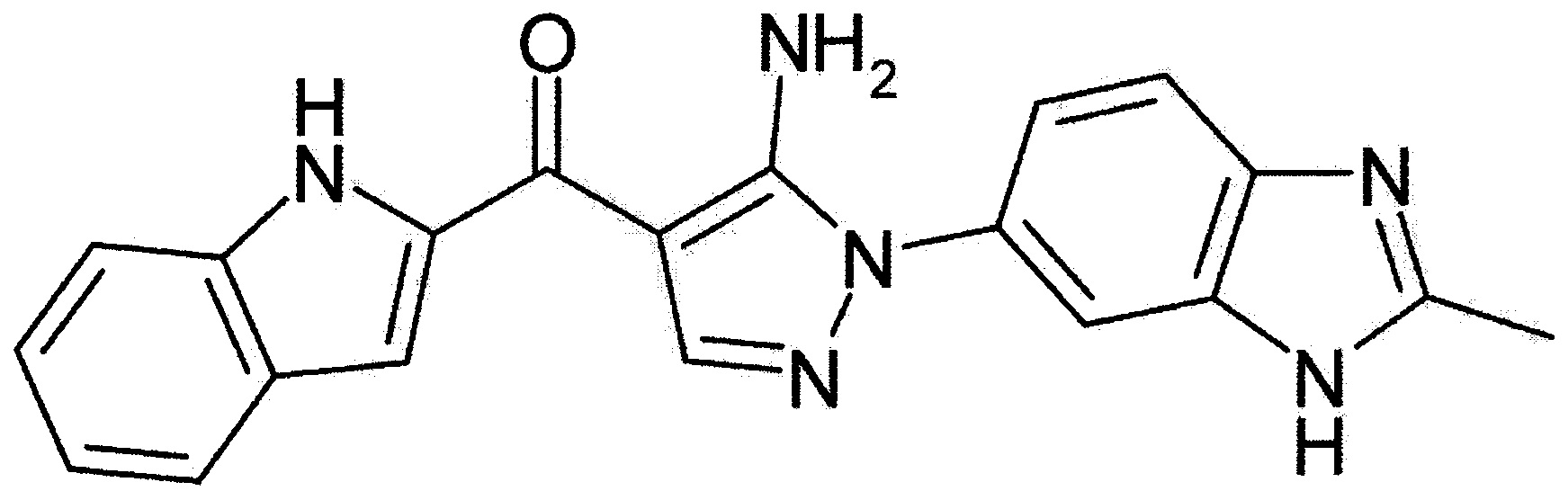
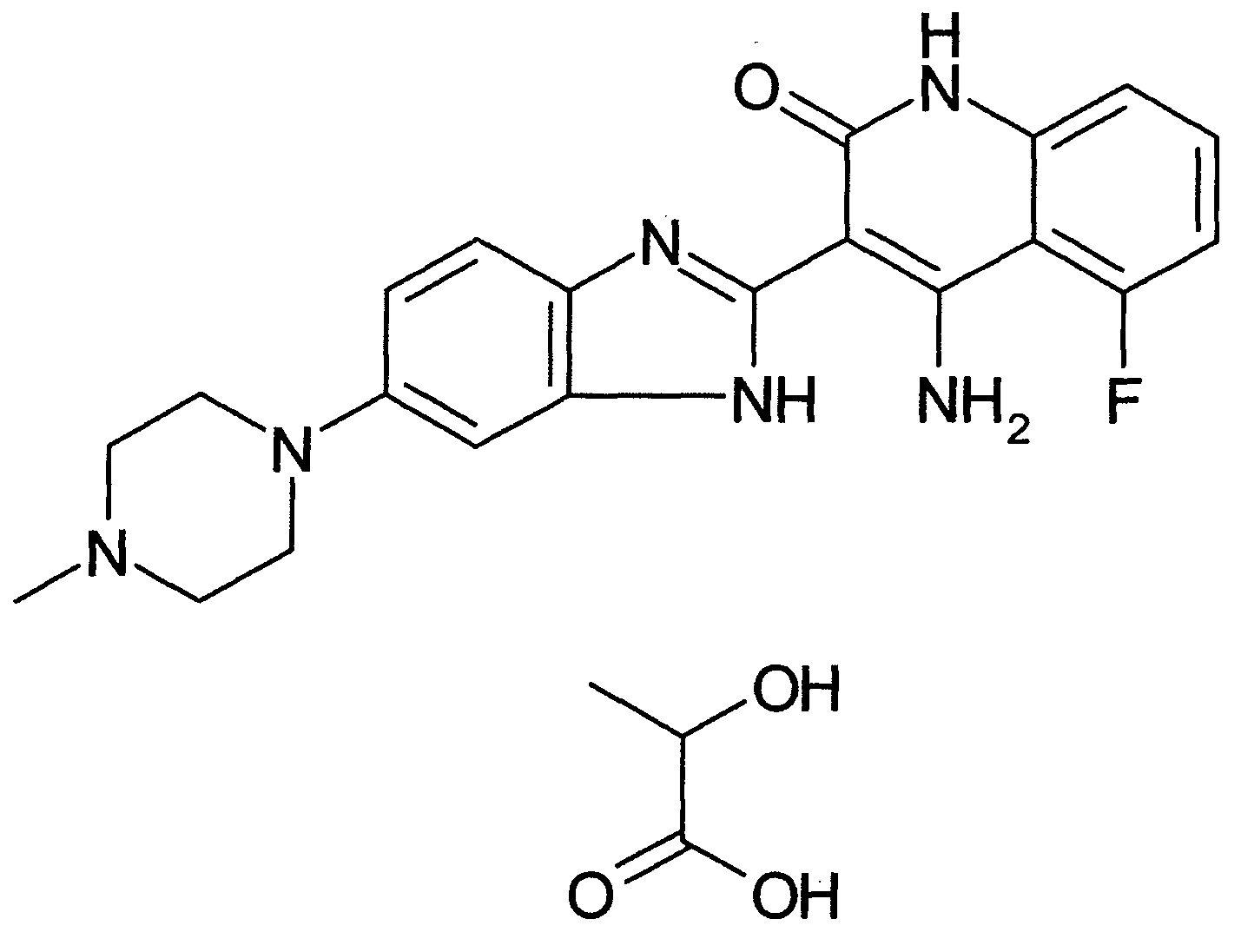
[29] способ согласно любому из [26]-[28], как описано выше, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой любое из соединений или его фармацевтически приемлемую соль, представленных далее:
[Соединение 1]
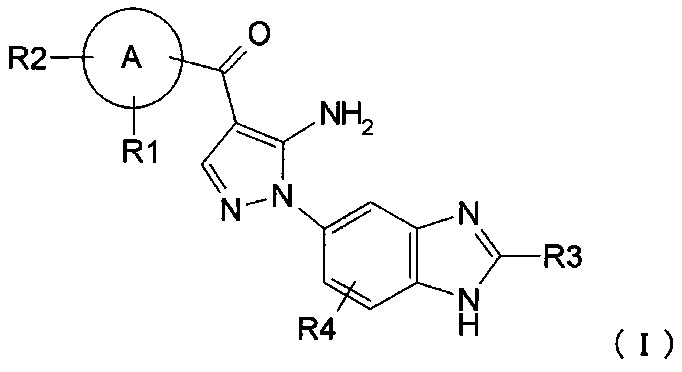
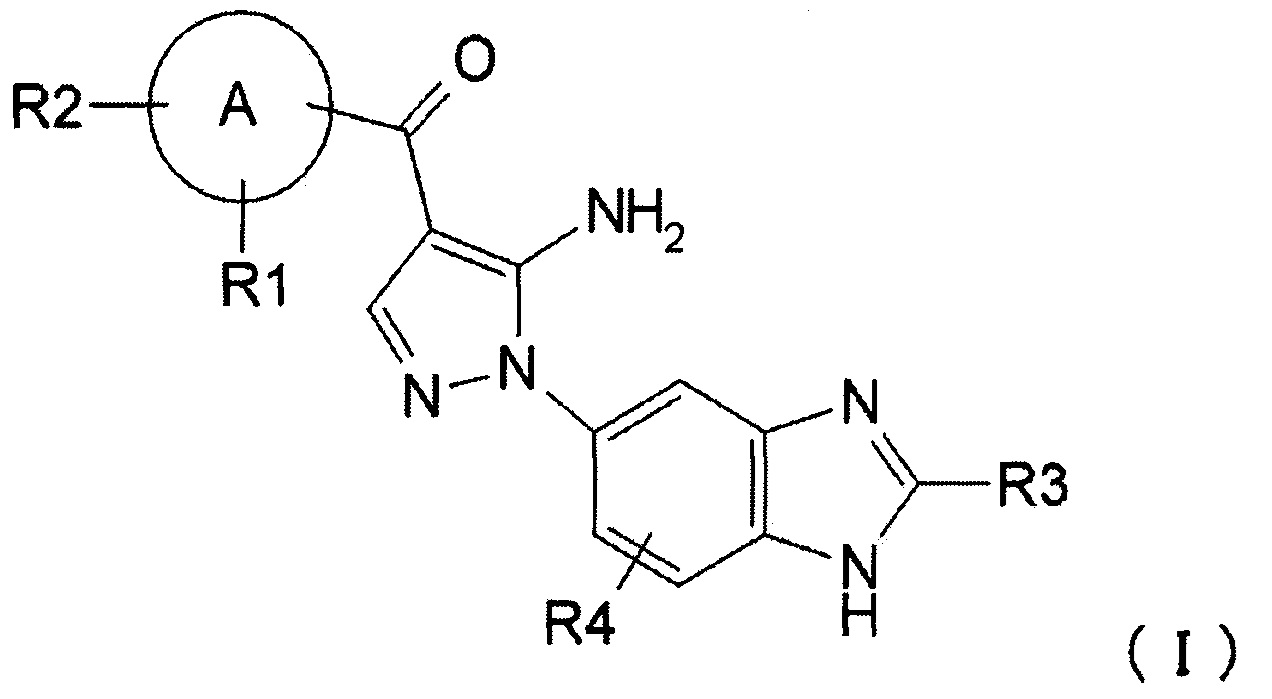
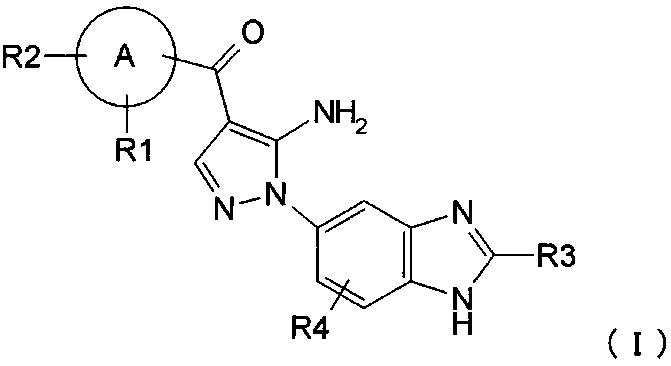
где R1, R2, R3 и R4 каждый независимо представляет собой группу, перечисленную ниже:
R1 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
R2 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, С2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3; или
R1 и R2, вместе с атомом, который с ними связан, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, где гетероциклил или гетероарил необязательно замещен галогеном;
R3 представляет собой водород, C1-5 алкил, C6-10 арил С1-6 алкил или C1-4 галоалкил;
R4 представляет собой водород, галоген, C1-3 алкил, C1-4 галоалкил, гидрокси, циано, нитро, C1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
А представляет собой 5-10-членное гетероарильное кольцо или C6-10 арильное кольцо;
R5 представляет собой C1-5 алкил, С3-7 циклоалкил, С3-7 циклоалкил C1-3 алкил, С2-6 алкенил, С2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, С1-3 алкокси C1-4 алкокси C1-4 алкил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, C6-10 арил, C6-10 арил С1-3 алкил или 3-10-членный гетероциклил C1-3 алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, 5-ти - 10-ти членный гетероарил C1-3 алкил, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил или C1-6 тригидрокси алкил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R6 и R7, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, С2-6 алкенил, С2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C6-10 арил C1-3 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил С1-3 алкил, C1-6 моногидрокси алкил, С1-6 дигидрокси алкил, C1-6 тригидрокси алкил, 3-10-членный гетероциклил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил или циано(С1-3 алкил); или альтернативно R6 и R7, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
n представляет собой 1-3;
R8 и R9, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил или галоген; или альтернативно R8 и R9, вместе с атомом углерода, с которым они связаны, образуют циклоалифатическое кольцо;
Z1 представляет собой водород, NR10R11, -ОН, или 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R10 и R11, которые могут быть одинаковыми или разными, каждый представляет собой С1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, циано(С1-3 алкил) или С1-3 алкилсульфонил C1-4 алкил; или альтернативно R10 и R11, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R12 и R13, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, 3-10-членное циклоалифатическое кольцо, 5-10-членный гетероарил, или 3-10-членный гетероциклил; или альтернативно R12 и R13, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R14 представляет собой С1-4 алкил, С2-6 алкенил, C2-6 алкинил, С1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R15 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R16 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R17 представляет собой водород или C1-4 алкил;
R18 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R19 представляет собой водород, C1-4 алкил, C3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R20 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил или 3-10-членный гетероциклил;
R21 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R22 представляет собой водород, C1-4 алкил, или C1-4 галоалкил;
R23 представляет собой водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R24 представляет собой водород, C1-4 алкил, или C1-4 галоалкил;
R25 представляет собой С1-4 алкил, C3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R26 и R27, которые могут быть одинаковыми или разными, каждый представляет собой водород, С1-4 алкил, C2-6 алкенил, С2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R26 и R27, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R28 и R29, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, С2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил С1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R28 и R29, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R30 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R31 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R32 представляет собой C1-4 алкил или C6-10 арил;
<группа Р>
галоген, C1-4 алкил, C1-4 галоалкил, -ОН, С1-3 алкокси, С1-3 галоалкокси, 3-10-членный гетероциклиламино, -SO2R16, -CN, -NO2, и 3-10-членный гетероциклил;
<группа Q>
галоген, С1-4 алкил, C1-4 галоалкил, -ОН, С1-3 алкокси, C1-6 моногидрокси алкил, С1-6 дигидрокси алкил, С1-6 тригидрокси алкил, 3-10-членный гетероциклил амин, -SO2R16, -CN, -NO2, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом.
[Соединение 2]
[Соединение 3]
[Соединение 4]
[Соединение 5]
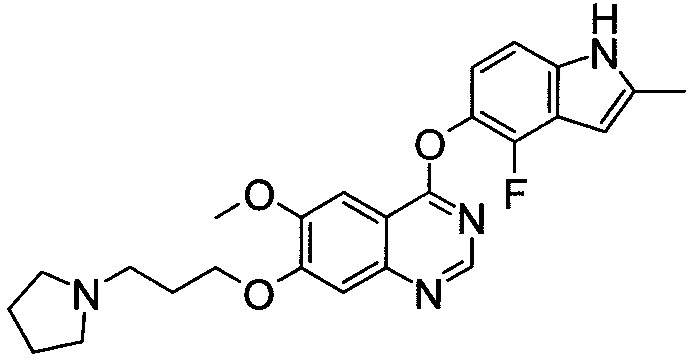 ;
;
или
[Соединение 6]
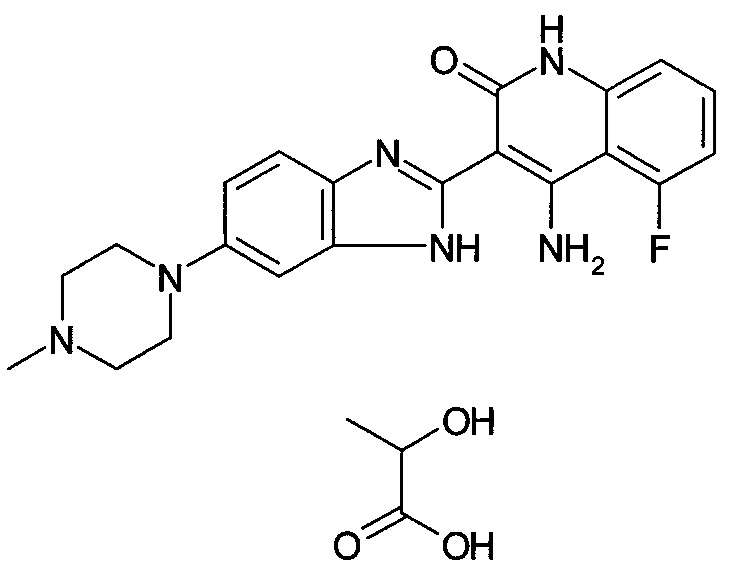 ;
;
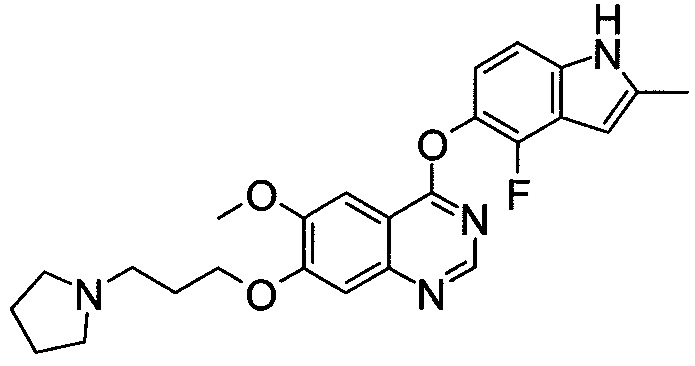
[30] способ согласно [29], как описано выше, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой соединение формулы (I), где А представляет собой индол, и R3 и R4 оба представляют собой водород, или его фармацевтически приемлемую соль;
[31] фармацевтическая композиция для лечения злокачественного новообразования, который содержит соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемую соль и используют таким образом, что соединение или его фармацевтически приемлемую соль вводят пациенту, который экспрессирует гибридный полипептид согласно любому из [1]-[7], как описано выше, или имеет полинуклеотид, который кодирует гибридный полипептид;
[32] фармацевтическая композиция согласно [31], как описано выше, для лечения злокачественного новообразования, где пациента отбирают с помощью способа согласно любому из [26]-[30], как описано выше;
[33] фармацевтическая композиция согласно [31] или [32], как описано выше, для лечения злокачественного новообразования, где злокачественное новообразование представляет собой рак мочевого пузыря, опухоль головного мозга, плоскоклеточный рак головы и шеи, рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, меланому кожи, рак пищевода, рак желудка или рак печени;
[34] фармацевтическая композиция согласно [31] или [32], как описано выше, для лечения злокачественного новообразования, где злокачественное новообразование представляет собой рак мочевого пузыря;
[35] фармацевтическая композиция согласно [34], как описано выше, для лечения злокачественного новообразования, где рак мочевого пузыря классифицирован как стадия 3 или последующая в соответствии с TNM классификацией;
[36] фармацевтическая композиция согласно любому из [31]-[35] для лечения злокачественного новообразования, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой любое из соединений или его фармацевтически приемлемую соль, представленных далее:
[Соединение 1]
где R1, R2, R3 и R4 каждый независимо представляет собой группу, перечисленную ниже:
R1 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, С1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
R2 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, С2-6 алкенил, С2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3; или
R1 и R2, вместе с атомом, который с ними связан, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, где гетероциклил или гетероарил необязательно замещен галогеном;
R3 представляет собой водород, C1-5 алкил, C6-10 арил C1-6 алкил, или C1-4 галоалкил;
R4 представляет собой водород, галоген, С1-3 алкил, C1-4 галоалкил, гидрокси, циано, нитро, C1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31, или -Si(R32)3;
А представляет собой 5-10-членное гетероарильное кольцо или C6-10 арильное кольцо;
R5 представляет собой C1-5 алкил, С3-7 циклоалкил, С3-7 циклоалкил С1-3 алкил, С2-6 алкенил, С2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, С1-3 алкокси C1-4 алкокси C1-4 алкил, C1-4 аминоалкил, C1-4 алкиламино С1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, C6-10 арил, C6-10 арил С1-3 алкил, или 3-10-членный гетероциклил С1-3 алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, 5-10-членный гетероарил С1-3 алкил, C1-6 моногидрокси алкил, С1-6 дигидрокси алкил, или C1-6 тригидрокси алкил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R6 и R7, которые могут быть одинаковыми или разными, каждый представляет собой водород, С1-4 алкил, С2-6 алкенил, C2-6 алкинил, С1-4 галоалкил, С1-3 алкокси C1-4 алкил, C6-10 арил С1-3 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил C1-3 алкил, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил, С1-6 тригидрокси алкил, 3-10-членный гетероциклил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(С1-4 алкил)амино C1-4 алкил, или циано(С1-3 алкил); или альтернативно R6 и R7, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
n представляет собой 1-3;
R8 и R9, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил или галоген; или альтернативно R8 и R9, вместе с атомом углерода, с которым они связаны, образуют циклоалифатическое кольцо;
Z1 представляет собой водород, NR10R11, -ОН, или 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R10 и R11, которые могут быть одинаковыми или разными, каждый представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, циано(С1-3 алкил), или С1-3 алкилсульфонил C1-4 алкил; или альтернативно R10 и R11, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R12 и R13, которые могут быть одинаковыми или разными, каждый представляет собой водород, С1-4 алкил, C2-6 алкенил, C2-6 алкинил, С1-4 галоалкил, С1-3 алкокси С1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил С1-4 алкил, 3-10-членное циклоалифатическое кольцо, 5-10-членный гетероарил, или 3-10-членный гетероциклил; или альтернативно R12 и R13, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R14 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R15 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R16 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, С1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R17 представляет собой водород или C1-4 алкил;
R18 представляет собой С1-4 алкил, C2-6 алкенил, C2-6 алкинил, С1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R19 представляет собой водород, С1-4 алкил, C3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R20 представляет собой С1-4 алкил, C3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R21 представляет собой С1-4 алкил, С3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R22 представляет собой водород, С1-4 алкил, или С1-4 галоалкил;
R23 представляет собой водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5--10-членный гетероарил, или 3-10-членный гетероциклил;
R24 представляет собой водород, С1-4 алкил, или С1-4 галоалкил;
R25 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R26 и R27, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил С1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил С1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R26 и R27, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R28 и R29, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил С1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил С1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R28 и R29, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R30 представляет собой C1-4 алкил, С3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R31 представляет собой С1-4 алкил, C3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R32 представляет собой C1-4 алкил или C6-10 арил;
<группа Р>
галоген, С1-4 алкил, С1-4 галоалкил, -ОН, С1-3 алкокси, С1-3 галоалкокси, 3-10-членный гетероциклиламино, -SO2R16, -CN, -NO2, и 3-10-членный гетероциклил;
<группа Q>
галоген, С1-4 алкил, С1-4 галоалкил, -ОН, С1-3 алкокси, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил, С1-6 тригидрокси алкил, 3-10-членный гетероциклил амин, -SO2R16, -CN, -NO2, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом.
[Соединение 2]
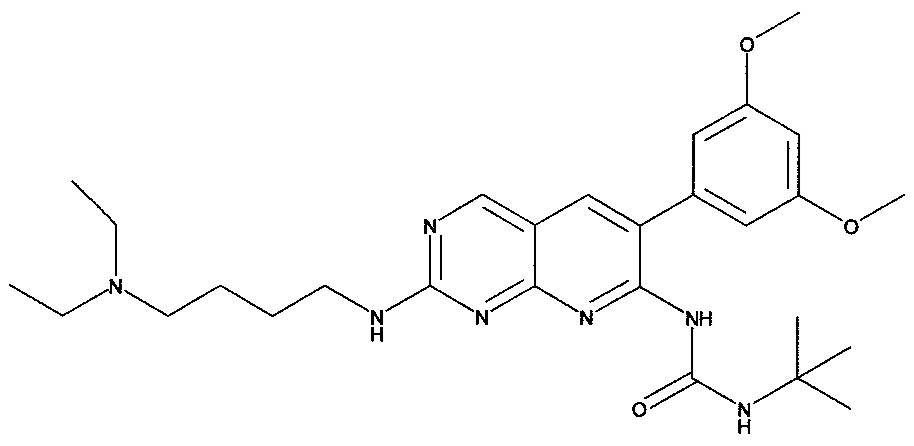
[Соединение 3]
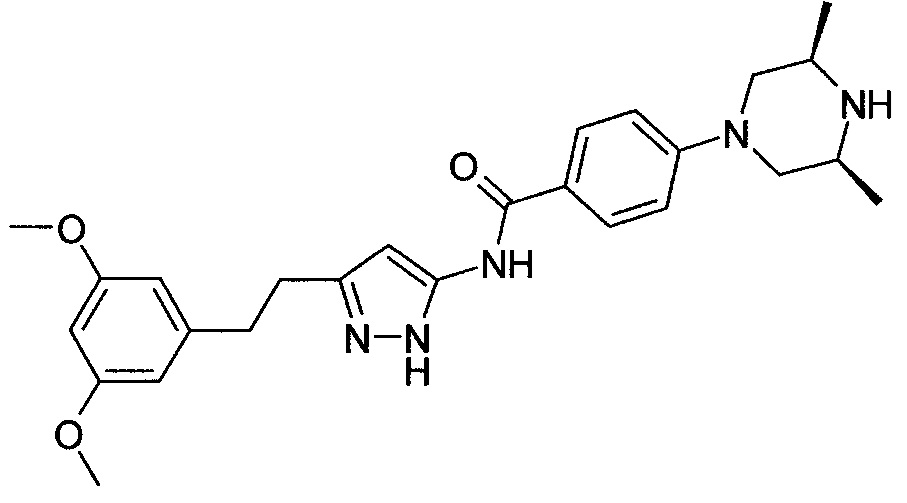
[Соединение 4]
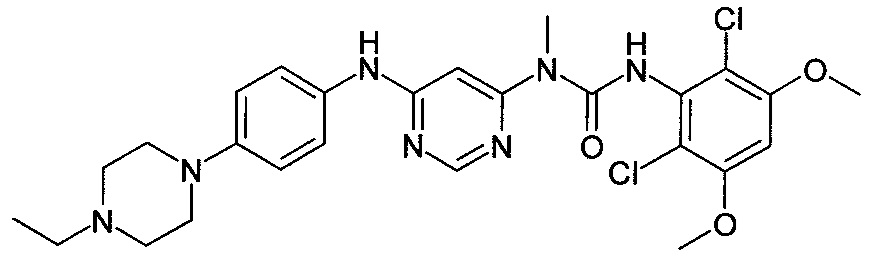
[Соединение 5]
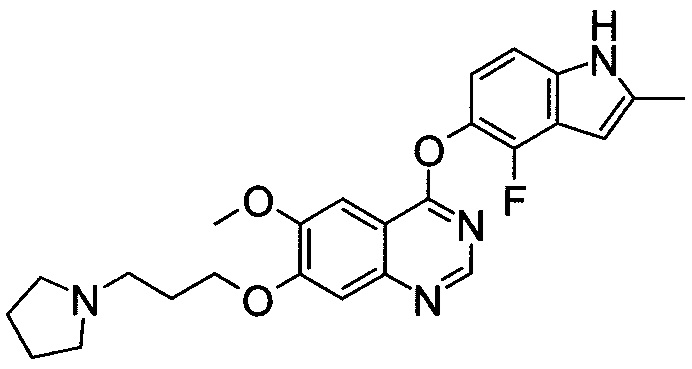 ,
,
или
[Соединение 6]
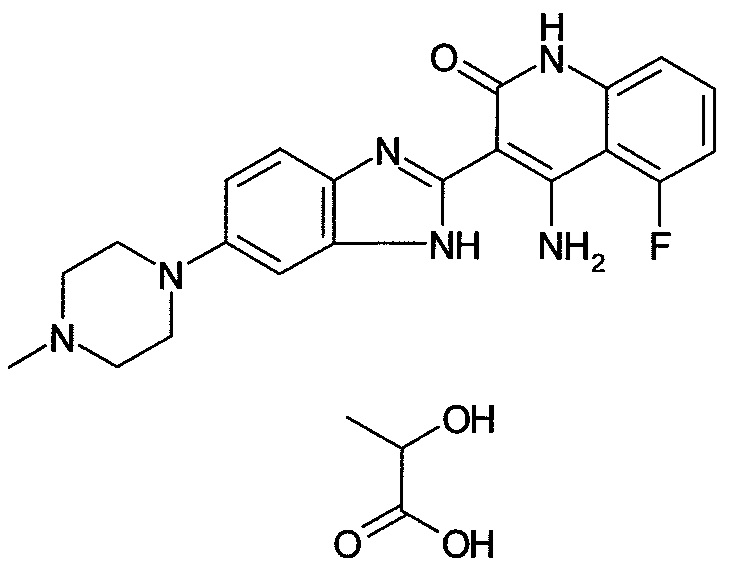 ;
;
[37] фармацевтическая композиция согласно [36], как описано выше, для лечения злокачественного новообразования, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой соединение формулы (I), где А представляет собой индол, и R3 и R4 оба представляют собой водород, или его фармацевтически приемлемую соль;
[38] способ лечения или предотвращения злокачественного новообразования, который включает стадию введения эффективного количества соединения, имеющего FGFR ингибирующую активность, или его фармацевтически приемлемой соли пациенту со злокачественным новообразованием, экспрессирующим гибридный полипептид согласно любому из [1]-[7], как описано выше, или несущим полинуклеотид, кодирующий гибридный полипептид;
[39] способ согласно [38], как описано выше, где пациента отбирают с помощью способа согласно любому из [26]-[30], как описано выше;
[40] способ согласно [38] или [39], как описано выше, где злокачественное новообразование представляет собой рак мочевого пузыря, опухоль головного мозга, плоскоклеточный рак головы и шеи, рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, меланому кожи, рак пищевода, рак желудка, или рак печени;
[41] способ согласно [38] или [39], как описано выше, где злокачественное новообразование представляет собой рак мочевого пузыря;
[42] способ согласно [41], как описано выше, где рак мочевого пузыря классифицирован как стадия 3 или последующая в соответствии с TNM классификацией;
[43] способ согласно любому из [38]-[42], как описано выше, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой любое из соединений или его фармацевтически приемлемую соль, представленных далее:
[Соединение 1]
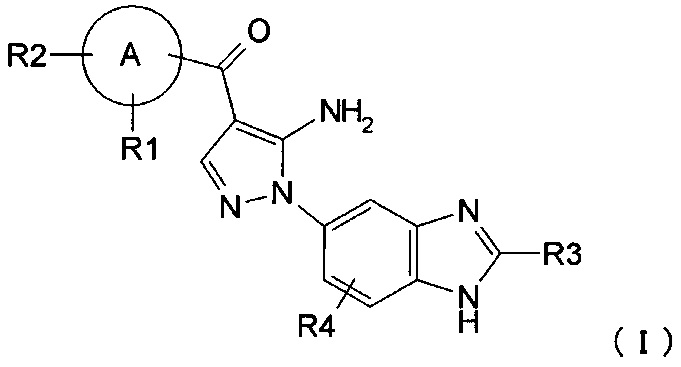
где R1, R2, R3, и R4 каждый независимо представляет собой группу, перечисленную ниже:
R1 представляет собой водород, гидрокси, галоген, циано, нитро, С1-4 галоалкил, С1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил С1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
R2 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3; или
R1 и R2, вместе с атомом, который с ними связан, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, где гетероциклил или гетероарил необязательно замещен галогеном;
R3 представляет собой водород, С1-5 алкил, C6-10 арил С1-6 алкил, или C1-4 галоалкил;
R4 представляет собой водород, галоген, C1-3 алкил, C1-4 галоалкил, гидрокси, циано, нитро, С1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
А представляет собой 5-10-членное гетероарильное кольцо или C6-10 арильное кольцо;
R5 представляет собой C1-5 алкил, С3-7 циклоалкил, С3-7 циклоалкил C1-3 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, С1-3 алкокси C1-4 алкокси C1-4 алкил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(С1-4 алкил)амино C1-4 алкил, C6-10 арил, C6-10 арил С1-3 алкил, или 3-10-членный гетероциклил C1-3 алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, 5-10-членный гетероарил С1-3 алкил, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил, или C1-6 тригидрокси алкил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R6 и R7, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, C6-10 арил C1-3 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил С1-3 алкил, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил, С1-6 тригидрокси алкил, 3-10-членный гетероциклил, С1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(С1-4 алкил)амино C1-4 алкил, или циано(С1-3 алкил); или альтернативно R6 и R7, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
n представляет собой 1-3;
R8 и R9, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, или галоген; или альтернативно R8 и R9, вместе с атомом углерода, с которым они связаны, образуют циклоалифатическое кольцо;
Z1 представляет собой водород, NR10R11, -ОН, или 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R10 и R11, которые могут быть одинаковыми или разными, каждый представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, циано(С1-3 алкил), или C1-3 алкилсульфонил C1-4 алкил; или альтернативно R10 и R11, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R12 и R13, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил С1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил С1-4 алкил, 3-10-членное циклоалифатическое кольцо, 5-10-членный гетероарил, или 3-10-членный гетероциклил; или альтернативно R12 и R13, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R14 представляет собой С1-4 алкил, C2-6 алкенил, C2-6 алкинил, С1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R15 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R16 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, С1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R17 представляет собой водород или C1-4 алкил;
R18 представляет собой C1-4 алкил, C2-6 алкенил, С2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R19 представляет собой водород, С1-4 алкил, C3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R20 представляет собой С1-4 алкил, С3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R21 представляет собой С1-4 алкил, С3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R22 представляет собой водород, C1-4 алкил, или C1-4 галоалкил;
R23 представляет собой водород, С1-4 алкил, C3-7 циклоалкил, С1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R24 представляет собой водород, С1-4 алкил, или С1-4 галоалкил;
R25 представляет собой С1-4 алкил, С3-7 циклоалкил, С1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R26 и R27, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R26 и R27, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R28 и R29, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R28 и R29, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R30 представляет собой C1-4 алкил, С3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R31 представляет собой С1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R32 представляет собой C1-4 алкил или C6-10 арил;
<группа Р>
галоген, С1-4 алкил, С1-4 галоалкил, -ОН, С1-3 алкокси, С1-3 галоалкокси, 3-10-членный гетероциклиламино, -SO2R16, -CN, -NO2 и 3-10-членный гетероциклил;
<группа Q>
галоген, С1-4 алкил, С1-4 галоалкил, -ОН, С1-3 алкокси, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил, С1-6 тригидрокси алкил, 3-10-членный гетероциклил амин, -SO2R16, -CN, -NO2, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом.
[Соединение 2]
[Соединение 3]
[Соединение 4]
[Соединение 5]
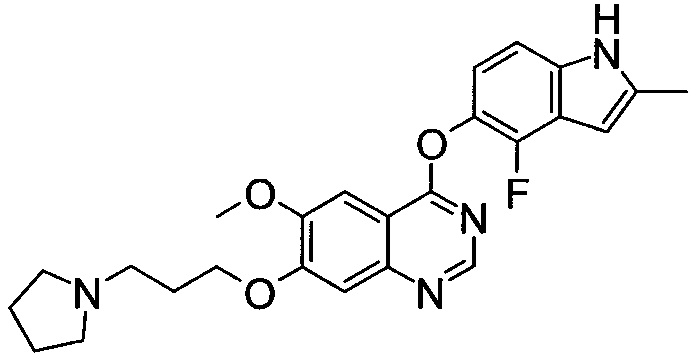 ;
;
или
[Соединение 6]
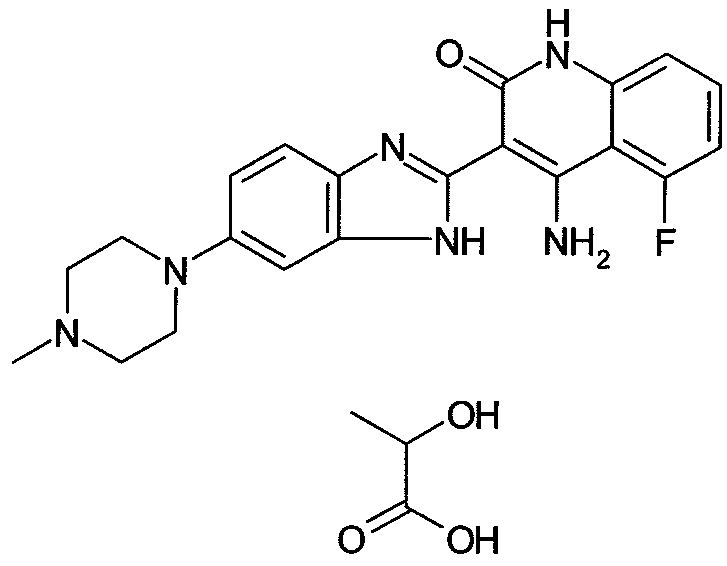 ;
;
[44] способ согласно [43], как описано выше, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой соединение формулы (I), где А представляет собой индол, и R3 и R4 оба представляют собой водород, или его фармацевтически приемлемую соль;
[45] применение соединения, имеющего FGFR ингибирующую активность, или его фармацевтически приемлемой соли для приготовления фармацевтической композиции для лечения злокачественного новообразования для введения пациенту, экспрессирующему гибридный полипептид согласно любому из [1]-[7], как описано выше, или несущему полинуклеотид, кодирующий гибридный полипептид;
[46] применение согласно [45], как описано выше, где пациента отбирают с помощью способа согласно любому из [26]-[30], как описано выше;
[47] применение согласно [45] или [46], как описано выше, где злокачественное новообразование представляет собой рак мочевого пузыря, опухоль головного мозга, плоскоклеточный рак головы и шеи, рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, меланому кожи, рак пищевода, рак желудка, или рак печени;
[48] применение согласно [45] или [46], как описано выше, где злокачественное новообразование представляет собой рак мочевого пузыря;
[49] применение согласно [48], как описано выше, где рак мочевого пузыря классифицирован как стадия 3 или последующая в соответствии с TNM классификацией;
[50] применение согласно любому из [45]-[49], как описано выше, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой любое из соединений или его фармацевтически приемлемую соль, представленных далее:
[Соединение 1]
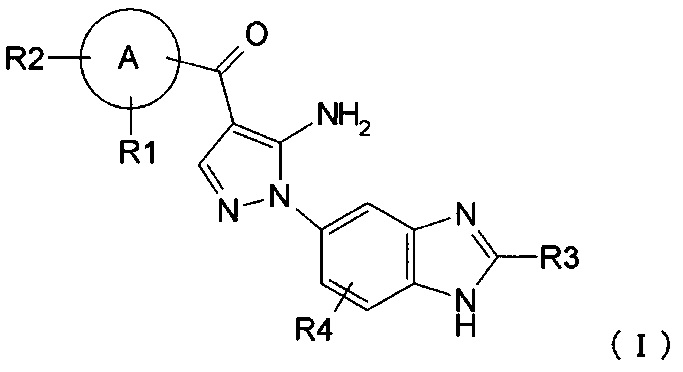
где R1, R2, R3, и R4 каждый независимо представляет собой группу, перечисленную ниже:
R1 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
R2 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, С2-6 алкенил, C2-6 алкинил, С3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3; или
R1 и R2, вместе с атомом, который с ними связан, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, где гетероциклил или гетероарил необязательно замещен галогеном;
R3 представляет собой водород, C1-5 алкил, C6-10 арил C1-6 алкил, или C1-4 галоалкил;
R4 представляет собой водород, галоген, C1-3 алкил, C1-4 галоалкил, гидрокси, циано, нитро, C1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
А представляет собой 5-10-членное гетероарильное кольцо или C6-10 арильное кольцо;
R5 представляет собой C1-5 алкил, C3-7 циклоалкил, C3-7 циклоалкил C1-3 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C1-3 алкокси C1-4 алкокси С1-4 алкил, C1-4 аминоалкил, C1-4 алкиламино С1-4 алкил, ди(С1-4 алкил)амино С1-4 алкил, C6-10 арил, C6-10 арил C1-3 алкил, или 3-10-членный гетероциклил C1-3 алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, 5-10-членный гетероарил C1-3 алкил, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил, или C1-6 тригидрокси алкил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R6 и R7, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, С6-10 арил C1-3 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, C1-6 моногидрокси алкил, C1-6 дигидрокси алкил, C1-6 тригидрокси алкил, 3-10-членный гетероциклил, С1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(С1-4 алкил)амино C1-4 алкил, или циано(C1-3 алкил); или альтернативно R6 и R7, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
n представляет собой 1-3;
R8 и R9, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, или галоген; или альтернативно R8 и R9, вместе с атомом углерода, с которым они связаны, образуют циклоалифатическое кольцо;
Z1 представляет собой водород, NR10R11, -ОН, или -10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R10 и R11, которые могут быть одинаковыми или разными, каждый представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, циано(C1-3 алкил), или С1-3 алкилсульфонил C1-4 алкил; или альтернативно R10 и R11, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R12 и R13, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси С1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, 3-10-членное циклоалифатическое кольцо, 5-10-членный гетероарил, или 3-10-членный гетероциклил; или альтернативно R12 и R13, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R14 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R15 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R16 представляет собой C1-4 алкил, С2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R17 представляет собой водород или C1-4 алкил;
R18 представляет собой C1-4 алкил, C2-6 алкенил, С2-6 алкинил, С1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R19 представляет собой водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R20 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R21 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R22 представляет собой водород, C1-4 алкил, или C1-4 галоалкил;
R23 представляет собой водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R24 представляет собой водород, C1-4 алкил, или C1-4 галоалкил;
R25 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R26 и R27, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, С2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R26 и R27, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R28 и R29, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-3 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R28 и R29, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R30 представляет собой C1-4 алкил, С3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R31 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R32 представляет собой C1-4 алкил или C6-10 арил;
<группа Р>
галоген, C1-4 алкил, C1-4 галоалкил, -ОН, C1-3 алкокси, C1-3 галоалкокси, 3-10-членный гетероциклиламино, -SO2R16, -CN, -NO2, и 3-10-членный гетероциклил;
<группа Q>
галоген, C1-4 алкил, C1-4 галоалкил, -ОН, C1-3 алкокси, C1-6 моногидрокси алкил, C1-6 дигидрокси алкил, C1-6 тригидрокси алкил, 3-10-членный гетероциклил амин, -SO2R16, -CN, -NO2, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом.
[Соединение 2]
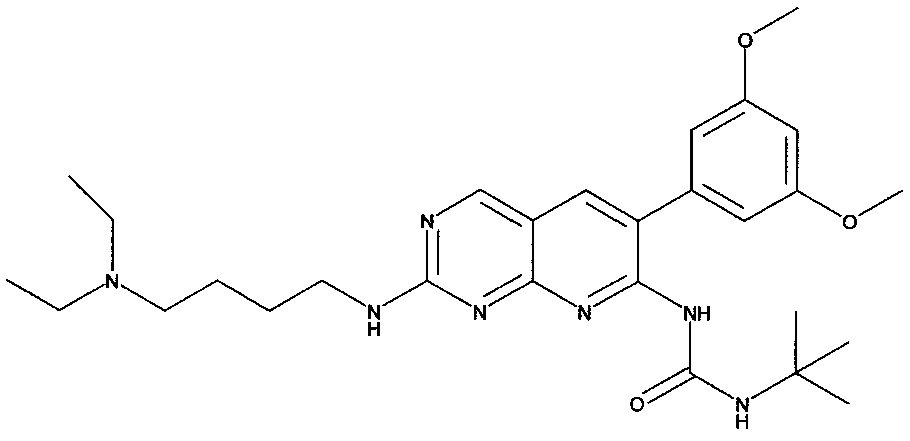
[Соединение 3]
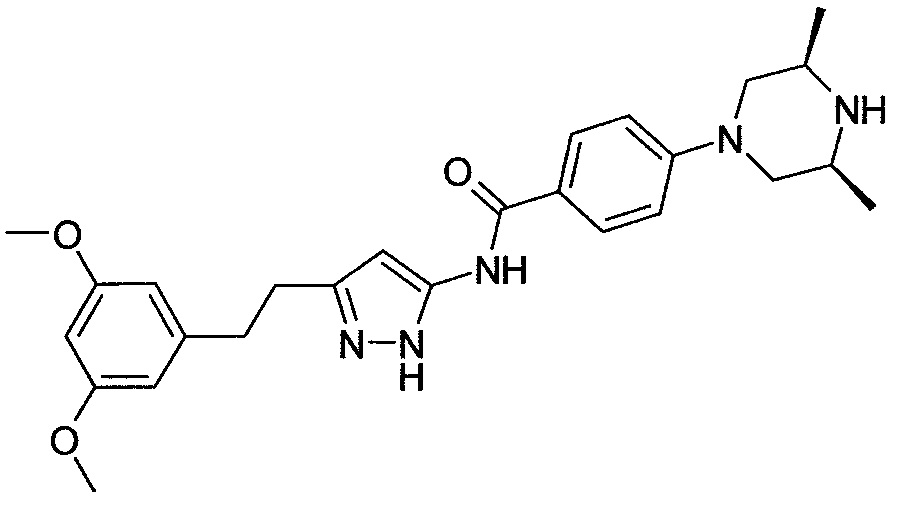
[Соединение 4]
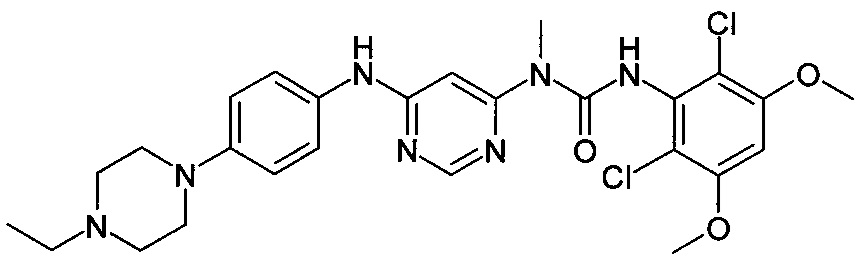
[Соединение 5]
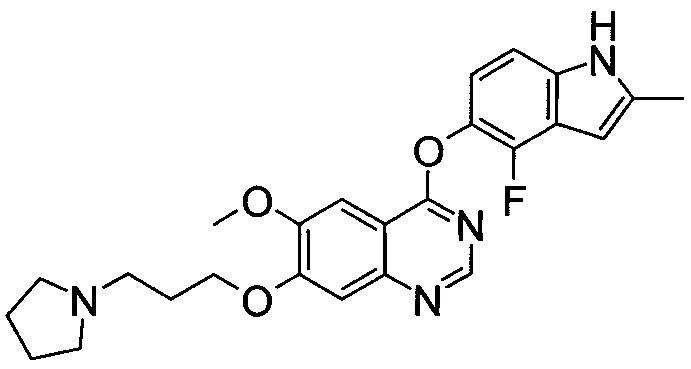 ;
;
или
[Соединение 6];
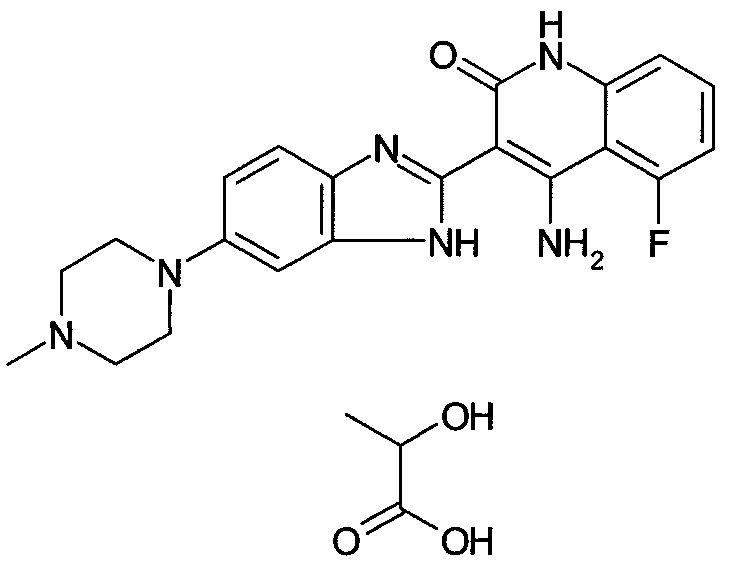
[51] применение согласно [50], как описано выше, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой соединение формулы (I), где А представляет собой индол, и R3 и R4 оба представляют собой водород, или его фармацевтически приемлемую соль;
[52] соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль для терапевтического или профилактического применения у пациента со злокачественным новообразованием, экспрессирующим гибридный полипептид согласно любому из [1]-[7], как описано выше, или несущим полинуклеотид, кодирующий гибридный полипептид;
[53] соединение или его фармацевтически приемлемая соль согласно [52], как описано выше, где пациента отбирают с помощью способа согласно любому из [26]-[30], как описано выше;
[54] соединение или его фармацевтически приемлемая соль согласно [52] или [53], как описано выше, где злокачественное новообразование представляет собой рак мочевого пузыря, опухоль головного мозга, плоскоклеточный рак головы и шеи, рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, меланому кожи, рак пищевода, рак желудка, или рак печени;
[55] соединение или его фармацевтически приемлемая соль согласно [52] или [53], как описано выше, где злокачественное новообразование представляет собой рак мочевого пузыря;
[56] соединение или его фармацевтически приемлемая соль согласно [55], как описано выше, где рак мочевого пузыря классифицирован как стадия 3 или последующая в соответствии с TNM классификацией;
[57] соединение или его фармацевтически приемлемая соль согласно любому из [52]-[56], как описано выше, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой любое из соединений или его фармацевтически приемлемую соль, представленных далее:
[Соединение 1]
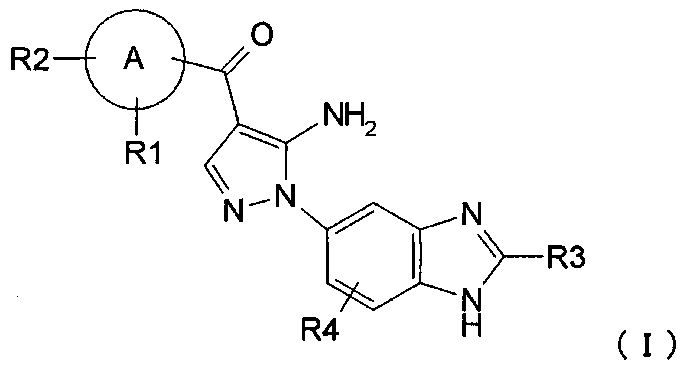
где R1, R2, R3 и R4 каждый независимо представляет собой группу, перечисленную ниже:
R1 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
R2 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, C6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3; или
R1 и R2, вместе с атомом, который с ними связан, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, где гетероциклил или гетероарил необязательно замещен галогеном;
R3 представляет собой водород, C1-5 алкил, C6-10 арил C1-6 алкил, или C1-4 галоалкил;
R4 представляет собой водород, галоген, C1-3 алкил, C1-4 галоалкил, гидрокси, циано, нитро, C1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
А представляет собой 5-10-членное гетероарильное кольцо или C6-10 арильное кольцо;
R5 представляет собой C1-5 алкил, С3-7 циклоалкил, С3-7 циклоалкил C1-3 алкил, С2-6 алкенил, С2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C1-3 алкокси C1-4 алкокси C1-4 алкил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, C6-10 арил, C6-10 арил C1-3 алкил, или 3-10-членный гетероциклил C1-3 алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, 5-10-членный гетероарил C1-3 алкил, C1-6 моногидрокси алкил, C1-6 дигидрокси алкил, или C1-6 тригидрокси алкил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R6 и R7, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, С2-6 алкенил, С2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, C6-10 арил C1-3 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, C1-6 моногидрокси алкил, C1-6 дигидрокси алкил, C1-6 тригидрокси алкил, 3-10-членный гетероциклил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, или циано(C1-3 алкил); или альтернативно R6 и R7, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
n представляет собой 1-3;
R8 и R9, которые могут быть одинаковыми или разными, каждый представляет собой водород, С1-4 алкил, или галоген; или альтернативно R8 и R9, вместе с атомом углерода, с которым они связаны, образуют циклоалифатическое кольцо;
Z1 представляет собой водород, NR10R11, -ОН, или 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R10 и R11, которые могут быть одинаковыми или разными, каждый представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкокси C1-4 алкил, циано(C1-3 алкил), или C1-3 алкилсульфонил C1-4 алкил; или альтернативно R10 и R11, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R12 и R13, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, 3-10-членное циклоалифатическое кольцо, 5-10-членный гетероарил, или 3-10-членный гетероциклил; или альтернативно R12 и R13, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R14 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, С1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R15 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R16 представляет собой C1-4 алкил, С2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R17 представляет собой водород или C1-4 алкил;
R18 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R19 представляет собой водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R20 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R21 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R22 представляет собой водород, C1-4 алкил, или C1-4 галоалкил;
R23 представляет собой водород, C1-4 алкил, С3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R24 представляет собой водород, C1-4 алкил, или C1-4 галоалкил;
R25 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R26 и R27, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R26 и R27, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R28 и R29, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, C1-3 алкоксил C1-4 алкил, C6-10 арил, 5-10-членный гетероарил, 3-х - 10-ти членный гетероциклил, C6-10 арил C1-4 алкил, 3-10-членный гетероциклил C1-3 алкил, 5-10-членный гетероарил C1-3 алкил, циано(C1-3 алкил), C1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R28 и R29, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R30 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R31 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, C6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил;
R32 представляет собой C1-4 алкил или C6-10 арил;
<группа Р>
галоген, C1-4 алкил, C1-4 галоалкил, -ОН, C1-3 алкокси, C1-3 галоалкокси, 3-10-членный гетероциклиламино, -SO2R16, -CN, -NO2, и 3-10-членный гетероциклил;
<группа Q>
галоген, C1-4 алкил, C1-4 галоалкил, -ОН, C1-3 алкокси, C1-6 моногидрокси алкил, C1-6 дигидрокси алкил, C1-6 тригидрокси алкил, 3-10-членный гетероциклил амин, -SO2R16, -CN, -NO2, С3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом.
[Соединение 2]
[Соединение 3]
[Соединение 4]
[Соединение 5]
 ;
;
или
[Соединение 6];
[58] соединение или его фармацевтически приемлемая соль согласно [57], как описано выше, где соединение, имеющее FGFR ингибирующую активность, или его фармацевтически приемлемая соль представляет собой соединение формулы (I), где А представляет собой индол, и R3 и R4 оба представляют собой водород, или его фармацевтически приемлемую соль;
[59] способ идентификации соединения, имеющего FGFR ингибирующую активность, который включает стадии:
(а) культивирование клетки, которая экспрессирует гибридный полипептид согласно любому из [1]-[7], как описано выше, в присутствии или отсутствии тестируемого соединения и определение уровня клеточной пролиферации;
(б) сравнение уровня пролиферации культивируемой клетки между присутствием и отсутствием тестируемого соединения; и
(в) оценивание, что тестируемое соединение имеет FGFR ингибирующую активность, если уровень пролиферации клетки, культивируемой в присутствии тестируемого соединения более низкий, чем клетки, культивируемой при отсутствии тестируемого соединения;
[60] способ идентификации соединения, имеющего FGFR ингибирующую активность, который включает стадии:
(а) введение тестируемого соединения млекопитающему, отличающемуся от человека, которому была трансплантирована клетка, экспрессирующая гибридный полипептид согласно любому из [1]-[7], как описано выше, и определение уровня пролиферации клетки;
(б) сравнение уровня клеточной пролиферации, определенной на стадии (а), с уровнем, который был определен с использованием млекопитающего, отличающегося от человека, которому была трансплантирована клетка, но не вводили тестируемое соединение; и
(в) оценивание, что тестируемое соединение имеет FGFR ингибирующую активность, если уровень клеточной пролиферации, определенной на стадии (а), более низкий, чем определенный с использованием млекопитающего, отличающегося от человека, которому была трансплантирована клетка, но не вводили тестируемое соединение;
[61] способ согласно [59] или [60], как описано выше, где клетка представляет собой раковую клетку; и
[62] способ согласно [61], как описано выше, где раковая клетка представляет собой клетку рака мочевого пузыря, опухолевую клетку головного мозга, клетку плоскоклеточного рака головы и шеи, клетку рака легкого, клетку аденокарциномы легкого, клетку плоскоклеточного рака легкого клетку меланомы кожи, клетку рака пищевода, клетку рака желудка, или клетку рака печени.
[Результаты изобретения]
Гибридные полипептиды согласно настоящему изобретению, содержащие FGFR3 полипептид и другой полипептид, экспрессируются специфически в различных типах раковых клеток, включая клетки рака мочевого пузыря. Пролиферация клеток, экспрессирующих такие гибридные полипептиды, существенно ингибируется соединениями, имеющими FGFR ингибирующую активность. Таким образом, применение гибридного полипептида согласно настоящему изобретению в качестве биомаркера для терапии злокачественного новообразования на основе ингибитора FGFR дает возможность специалисту оценить применимость и схему применения FGFR ингибитора для индивидуальных пациентов, и дает возможность специалисту избежать побочных эффектов и контролировать схему лечения для получения наилучшего терапевтического эффекта в терапии на основе ингибитора FGFR. Это предоставляет возможность персонализировать медицину.
Дополнительно, применение гибридных полипептидов согласно настоящему изобретению в качестве мишени для разработки противораковых терапевтических средств, нацеленных на FGFR, то есть, молекулярно нацеленных лекарственных средств, предоставляет возможность обеспечивать FGFR ингибиторы с высокими уровнями специфичности и противоопухолевой активностью по отношению к целевым раковым клеткам, а также противораковые терапевтические средства, содержащие ингибиторы.
FGFR ингибиторы, полученные, как описано выше, имеют высокую специфичность по отношению к целевым раковым клеткам и становится возможным обеспечивать противораковые терапевтические средства с большей противоопухолевой активностью и меньшими побочными действиями.
Более того, гибридные полипептиды согласно настоящему изобретению имеют близкую корреляцию с различными типами злокачественных новообразований, и, следовательно, можно тестировать вероятность развития злокачественного новообразования (предрасположенность к злокачественному новообразованию) у субъекта, подвержен ли субъект злокачественному новообразованию, или прогрессирует ли у субъекта злокачественное новообразование, путем определения, будут ли образцы от субъекта, не ограничиваясь только пациентами со злокачественным новообразованием, а также включая здоровых особей, содержать гибридный полипептид согласно настоящему изобретению или полинуклеотид, кодирующий гибридный полипептид.
Дополнительно, гибридные полипептиды согласно настоящему изобретению имеют близкую корреляцию с различными типами злокачественных новообразований. Следовательно, путем идентификации тестируемого соединения, подавляющего пролиферацию клеток (таких как раковые клетки), которые экспрессируют гибридные полипептиды согласно настоящему изобретению, становится возможным обеспечивать FGFR ингибиторы с высокой FGFR специфичностью, и это можно осуществить путем сравнения уровня клеточной пролиферации между присутствием и отсутствием тестируемого соединения.
Краткое описание фигур
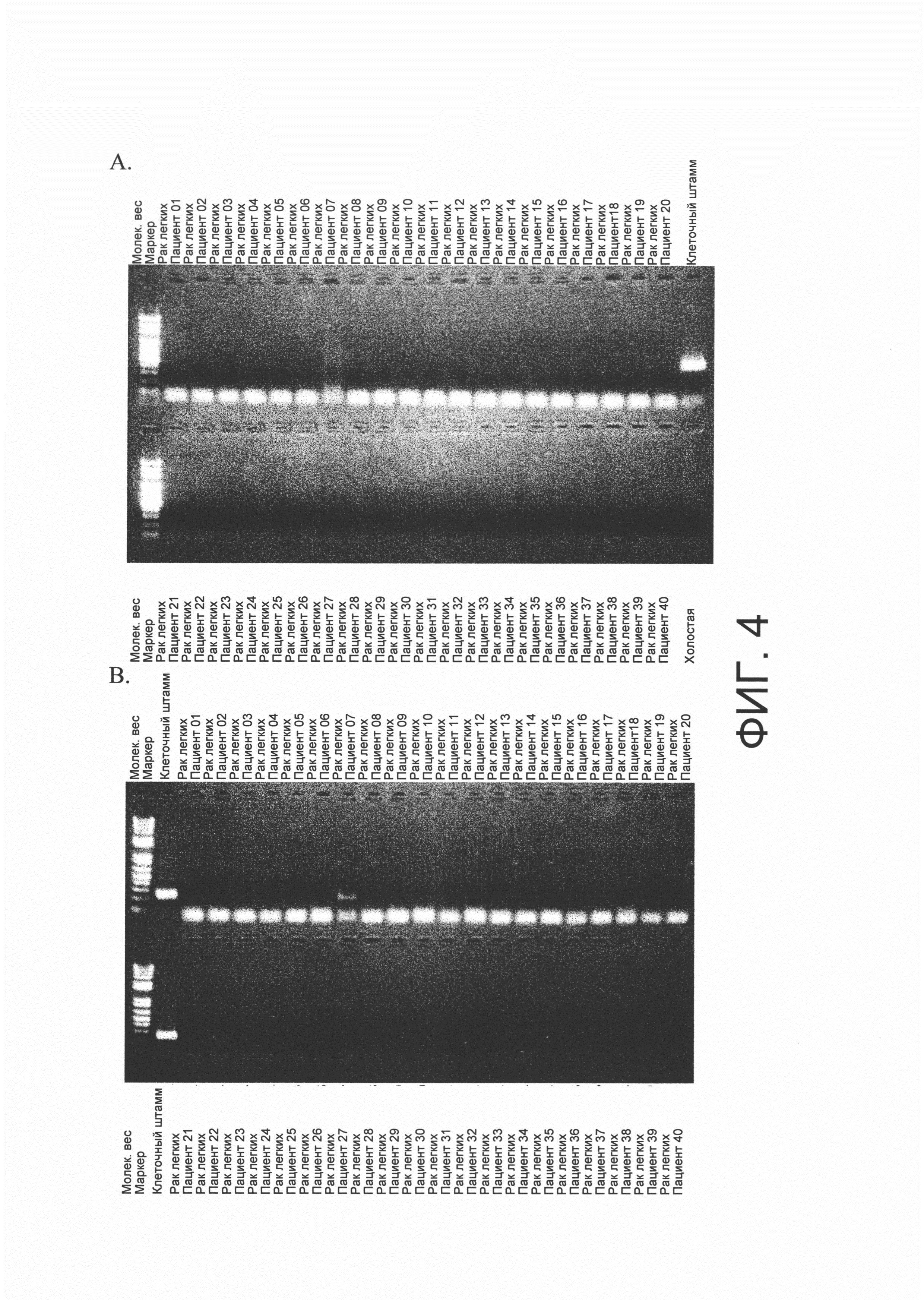
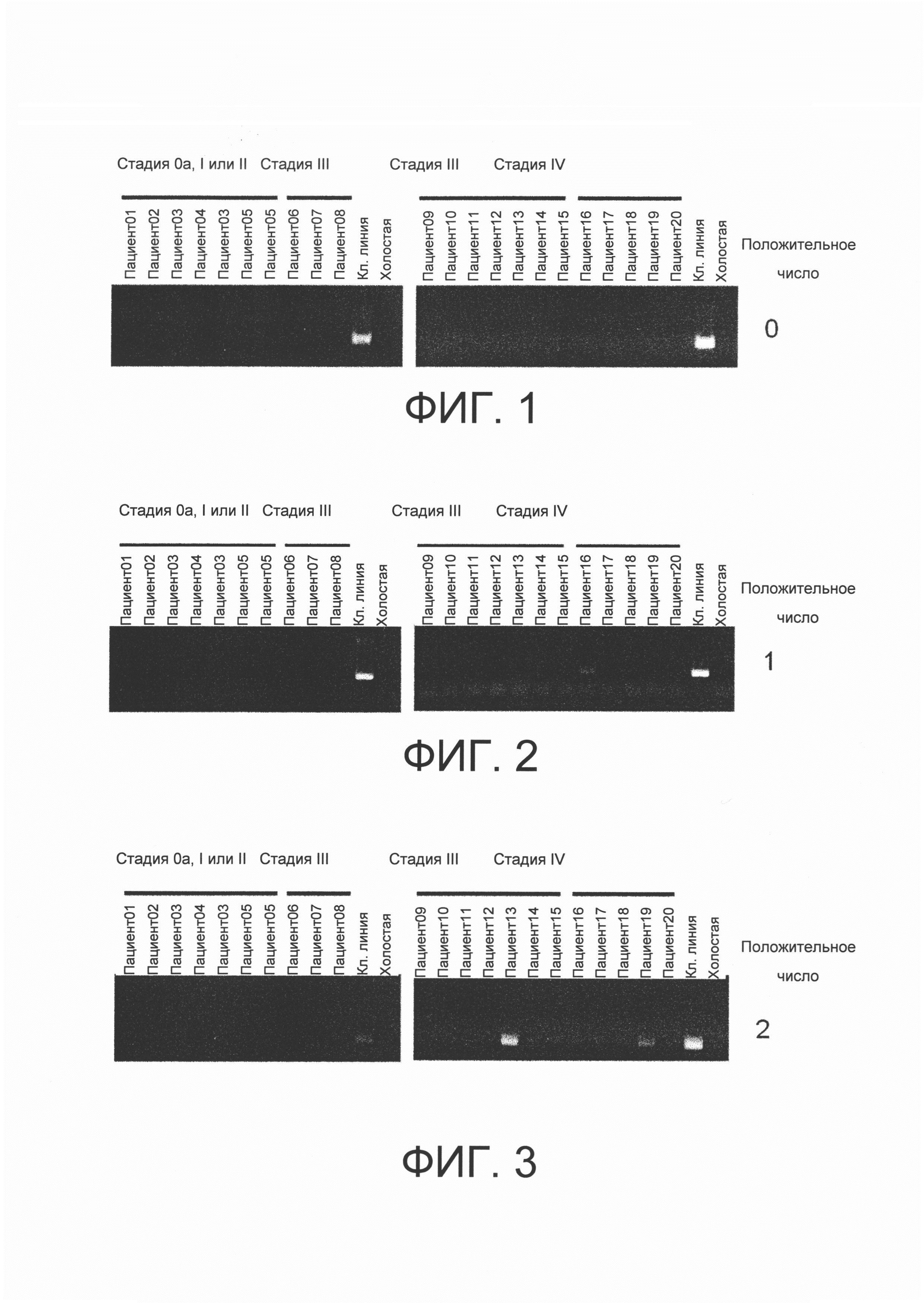
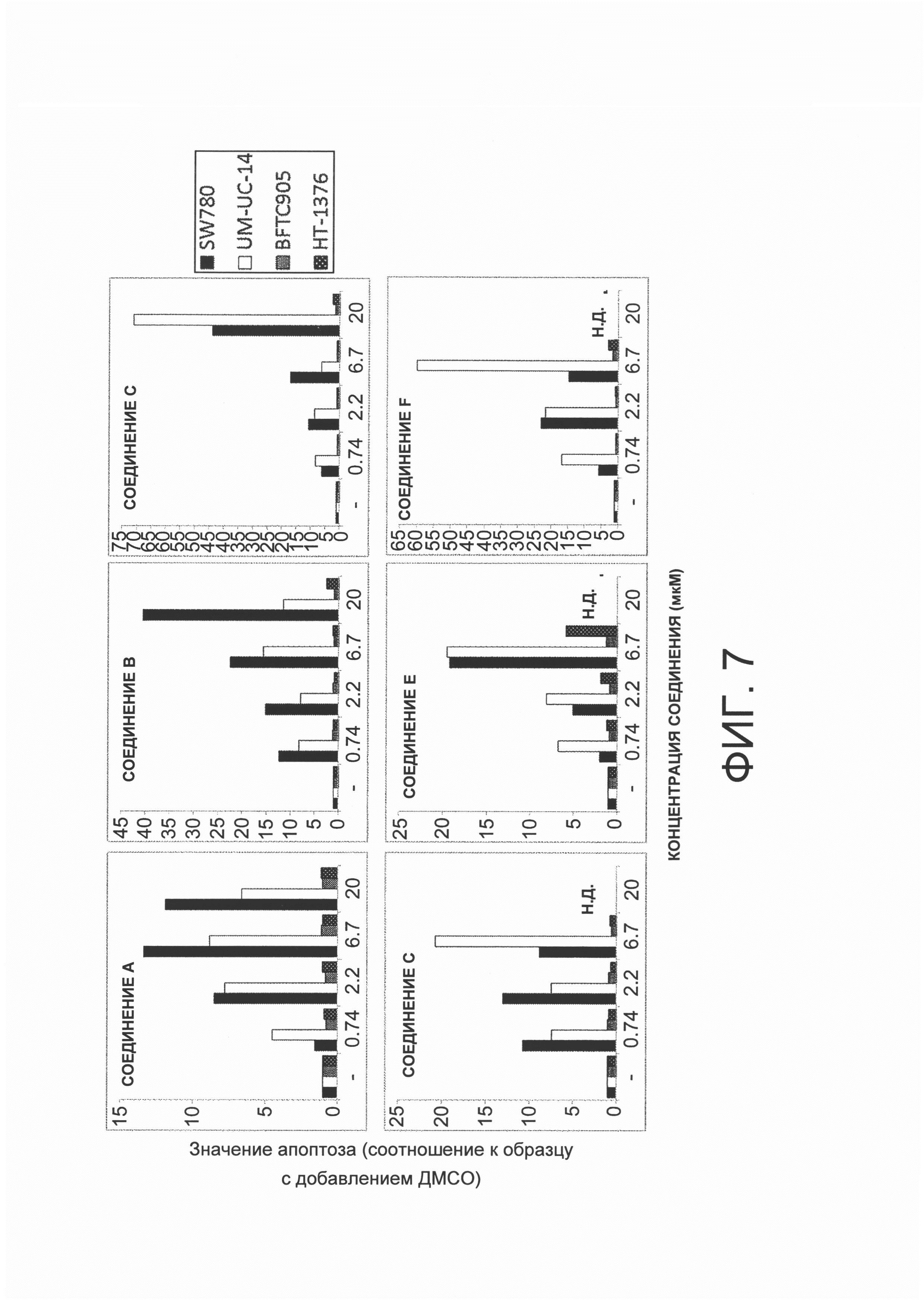
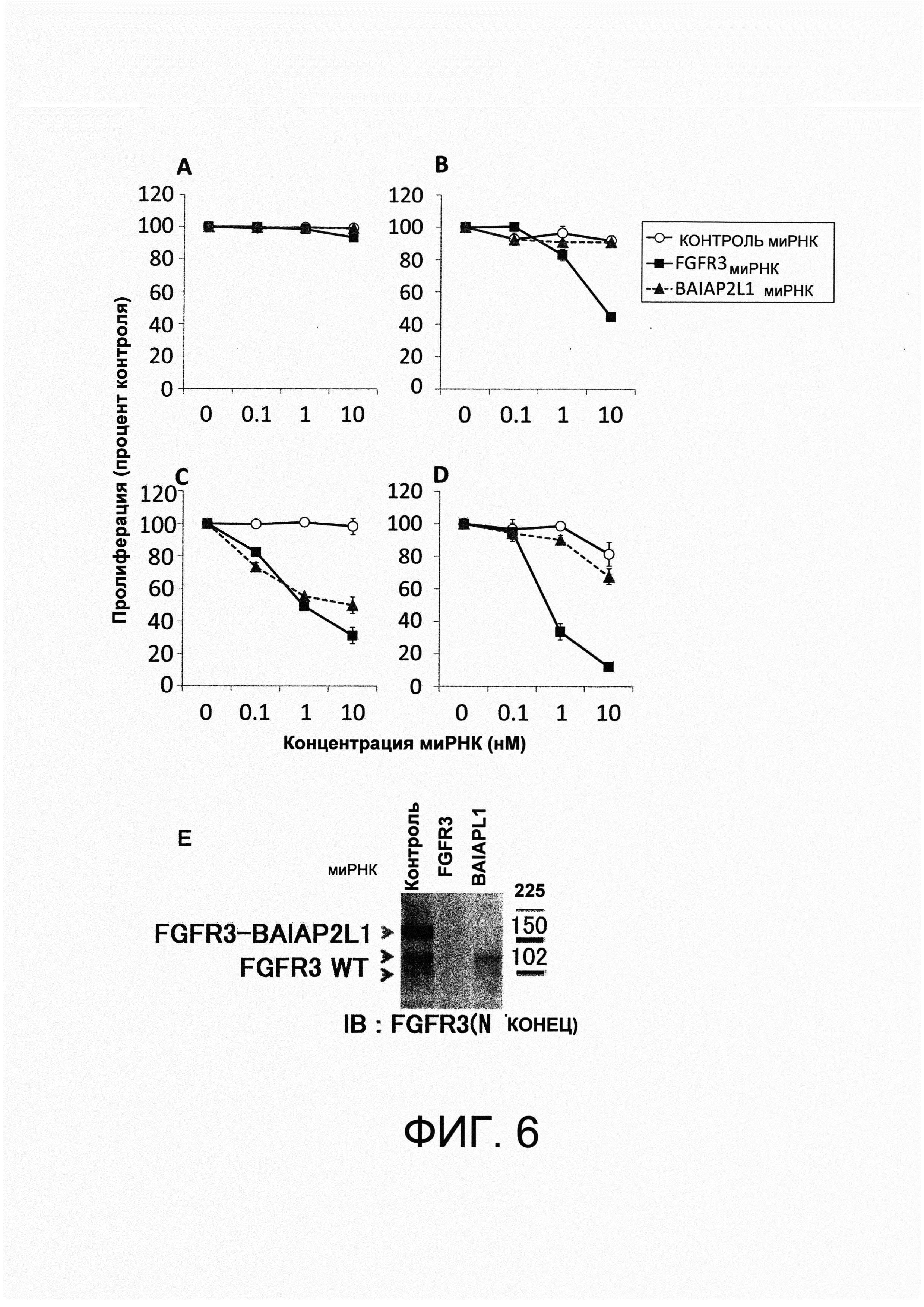
На фигуре 1 представлена фотография, показывающая результаты амплификации полинуклеотида v1, кодирующего FGFR3-TACC3 гибридный полипептид, по результатам тестирования с помощью полимеразной цепной реакции (ПЦР), используя кДНК, имеющую происхождению из образцов рака мочевого пузыря, собранных от пациентов с раком мочевого пузыря (20 пациентов) и кДНК, синтезированную из RT112/84 РНК.
На фигуре 2 представлена фотография, показывающая результаты амплификации полинуклеотида v2, кодирующего FGFR3-ТАСС3 гибридный полипептид, по результатам тестирования с помощью полимеразной цепной реакции (ПЦР), используя кДНК, имеющую происхождению из образцов рака мочевого пузыря, собранных от пациентов с раком мочевого пузыря (20 пациентов) и кДНК, синтезированную из RT4 РНК.
На фигуре 3 представлена фотография, показывающая результаты амплификации полинуклеотида, кодирующего FGFR3-BAIAP2L1 полипептид, по результатам тестирования с помощью полимеразной цепной реакции (ПЦР), используя кДНК, имеющую происхождению из образцов рака мочевого пузыря, собранных от пациентов с раком мочевого пузыря (20 пациентов) и кДНК, синтезированную из SW780 РНК.
На фигуре 4 представлена фотография, показывающая результаты амплификации полинуклеотида, кодирующего FGFR3-BAIAP2L1 полипептид, по результатам тестирования с помощью полимеразной цепной реакции (ПЦР), используя кДНК, имеющую происхождение из образцов рака легкого, собранных от пациентов с раком легкого (40 пациентов) и кДНК, синтезированную из SW780 РНК.
Вид А показывает результаты тестирования с использованием пары олигонуклеотидных праймеров (SEQ ID NOs: 3 и 4).
Крайние слева полосы наверху и внизу гелей показывают результаты для молекулярновесовых маркеров.
Вид В показывает результаты тестирования с использованием пары олигонуклеотидных праймеров (SEQ ID NOs: 17 и 18).
Крайние слева полосы на верху и внизу гелей показывают результаты для молекулярновесовых маркеров.
На фигуре 5 представлена фотография, показывающая результаты обнаружения полинуклеотида, кодирующего FGFR3-BAIAP2L1 полипептид, в различных типах клеточных линий рака мочевого пузыря, тестируемого с помощью FISH анализа.
Вид А1 представляет результат тестирования клеточной линии RT112/84, используя расщепленный сигнальный зонд.
Вид А2 представляет результат тестирования клеточной линии SW780, используя расщепленный сигнальный зонд.
Вид В1 представляет результат тестирования клеточной линии RT112/84, используя гибридизированный сигнальный зонд.
Вид В2 представляет результат тестирования клеточной линии SW780, используя гибридизированный сигнальный зонд.
На фигуре 6 представлены результаты тестирования присутствия или отсутствия FGFR3 зависимости при пролиферации различных клеточных линий рака мочевого пузыря, используя миРНК к FGFR3 или BAIAP2L1.
Вид А представлен результат теста, используя клеточную линию BFTC-905.
Вид В представлен результат теста, используя клеточную линию UM-UC-14.
Вид С представлен результат теста, используя клеточную линию RT4.
Вид D представлен результат теста, используя клеточную линию SW780.
На фигуре 7 представлены результаты тестирования эффекта FGFR ингибиторов на индуцирование апоптоза в различных раковых клетках, экспрессирующих FGFR3-BAIAP2L1 гибридный полипептид.
На фигуре 8 представлены результаты исследования способности FGFR3-BAIAP2L1 гибридного полипептида трансформировать нормальные клетки путем тестирования клеток в монослойной культуре.
На верхней фигуре показан результат для клеток дикого типа, экспрессирующих FGFR3, в монослойной культуре.
На нижней фигуре показан результат для клеток, экспрессирующих FGFR3-BAIAP2L1 гибридный полипептид, в монослойной культуре.
На фигуре 9 представлены результаты исследования трансформирующей способности и опухолеродной способности FGFR3-BAIAP2L1 гибридного полипептида в нормальных клетках путем тестирования клеток в шаровидной культуре.
В верхнем ряду фотографий представлены результаты культивированных необработанных родительских клеток.
В среднем ряду фотографий представлены результаты культивированных клеток дикого типа, экспрессирующих FGFR3.
В нижнем ряду фотографий представлены результаты культивированных клеток, экспрессирующих FGFR3-BAIAP2L1 гибридный полипептид.
На фигуре 10 представлены фотографии, иллюстрирующие результаты исследования способности FGFR3-BAIAP2L1 гибридного полипептида трансформировать нормальные клетки и способствования BAIAP2L1 трансформирующей способности, путем осуществления тестов, используя аутофосфорилирующую способность FGFR3 качестве индикатора.
На фигуре 11 представлен результат исследования способности FGFR3-BAIAP2L1 гибридного полипептида трансформировать нормальные клетки и способствования BAIAP2L1 трансформирующей способности, путем осуществления тестов, используя независимую от каркаса клеточную пролиферацию в качестве индикатора.
На фигуре 12 представлены результаты исследования опухолеродной способности FGFR3-BAIAP2L1 гибридного полипептида in vivo путем осуществления тестов, используя безтимусных мышей. В направлении слева направо, показаны состояния через 15 дней после инокуляции подкожно в паховую область безтимусных мышей, клеток дикого типа, экспрессирующих FGFR3, клеток дикого типа, экспрессирующих BAIAP2L1, клеток, экспрессирующих FGFR3-BAIAP2L1 гибридный полипептид, и клеток, экспрессирующих гибридный полипептид FGFR3 и BAR-домен-дефектный BAIAP2L1, соответственно.
На фигуре 13 представлен результат исследования ингибирующего эффекта на рост опухоли FGFR ингибитора на образование опухоли in vivo посредством FGFR3-BAIAP2L1 гибридного полипептида, используя для тестирования безтимусных мышей.
Способы осуществления изобретения
Настоящее изобретение проиллюстрировано в [1]-[62], как описано выше, и обеспечивает новые гибридные полипептиды, которые экспрессируются в атипичных клетках, таких как раковые клетки; полинуклеотиды, кодирующие полипептиды; векторы, содержащие полинуклеотиды; клетки, содержащие векторы; их антитела и фрагменты, которые специфически связываются с полипептидами; олигонуклеотидные праймеры, которые гибридизуются с полинуклеотидами; олигонуклеотиды, которые отщепляют полинуклеотиды; фармацевтические композиции, содержащие антитела или олигонуклеотиды; способы и наборы для обнаружения полинуклеотидов или гибридных полипептидов; способы тестирования предрасположенности к злокачественному новообразованию, подвержен ли субъект злокачественному новообразованию, или прогрессирует ли злокачественное новообразование, базируясь на присутствии или отсутствии полинуклеотидов или гибридных полипептидов; способы отбора пациентов со злокачественными новообразованиями, к которым применим ингибитор FGFR; фармацевтические композиции для лечения злокачественного новообразования, которые характеризуются их применением для введения пациентам, экспрессирующим гибридные полипептиды или несущим полинуклеотиды; способы лечения или предотвращения злокачественного новообразования, которые включают стадию введения эффективного количества соединений, имеющих FGFR ингибирующую активность или их фармацевтически приемлемых солей пациентам, экспрессирующим гибридные полипептиды или несущим полинуклеотиды; применение соединений, имеющих FGFR ингибирующую активность или их фармацевтически приемлемых солей для получения фармацевтических композиций для лечения злокачественного новообразования для введения пациентам, экспрессирующим гибридные полипептиды или несущим полинуклеотиды; и соединения, имеющие FGFR ингибирующую активность или их фармацевтически приемлемые соли для применения для лечения или предотвращения для пациентов, экспрессирующих гибридные полипептиды или несущих полинуклеотиды.
В настоящем изобретении, "FGFR" относится к любому FGFR, принадлежащему к FGFR семейству, содержащему FGFR1, FGFR2, FGFR3, и FGFR4, которые представляют собой рецепторы фактора роста фибробластов (FGFR), относящиеся к семейству рецепторной тирозинкиназы (Cytokine & Growth Factor Reviews, 2005, 16: 139-149). FGFR согласно настоящему изобретению может быть любого происхождения, и предпочтительно представляют собой FGFR, имеющие происхождения от млекопитающих (люди, мыши, крысы, морские свинки, кролики, овцы, обезьяны, козы, ослы, крупный рогатый скот, кони, свиньи, и др.), более предпочтительно FGFR человека, и еще более предпочтительно FGFR3 человека, содержащий аминокислотную последовательность SEQ ID NO: 6 или 7 (кДНК последовательности, SEQ ID NOs: 10 и 11, соответственно / учетные номера GenBank NM 001163213.1 и NM_000142.4, соответственно). Локус гена FGFR3 человека представляет собой 4р16.3.
В настоящем изобретении, "FGFR3 человека" относится к FGFR3 полипептиду человека дикого типа, содержащему аминокислотную последовательность SEQ ID NO: 6 или 7, или мутантному полипептиду с замещением, делецией или инсерцией одной или более аминокислот (предпочтительно от одной до десяти аминокислот, и более предпочтительно от одной до пяти аминокислот) в полипептиде дикого типа.
Мутантный полипептид также включает полипептиды, имеющие 70% или более высокую гомологию, предпочтительно 80% или более высокую гомологию, более предпочтительно 90% или более высокую гомологию, и еще более предпочтительно 95% или более высокую гомологию к аминокислотной последовательности полипептида дикого типа.
В настоящем изобретении, "BAIAP2L1" относится к белку 1, подобному белку 2, ассоциированному с ингибитором 1 ангиогенеза в головном мозге (BAIAP2L1; также обозначается как "субстрат рецепторной тирозинкиназы инсулина " (IRTKS)) (Journal of Cell Science, 2007, 120: 1663-1672). BAIAP2L1 согласно настоящему изобретению может быть любого происхождения, и предпочтительно представляет собой BAIAP2L1 млекопитающего, более предпочтительно BAIAP2L1 человека, и еще более предпочтительно BAIAP2L1 человека, содержащий аминокислотную последовательность SEQ ID NO: 8 (кДНК последовательность, SEQ ID NO: 12 / учетный номер GenBankNM_018842.4). Локус гена BAIAP2L1 человека представляет собой 7q22.1, и он расположен на хромосоме, отличающейся от хромосомы, которая несет FGFR3 ген.
В настоящем изобретении, "BAIAP2L1 человека" относится к полипептиду BAIAP2L1 человека дикого типа, содержащему аминокислотную последовательность SEQ ID NO: 8, или мутантному полипептиду с замещением, делецией или инсерцией одной или более аминокислот (предпочтительно от одной до десяти аминокислот, и более предпочтительно от одной до пяти аминокислот) в полипептиде дикого типа.
Мутантный полипептид также включает полипептиды, имеющие 70% или более высокую гомологию, предпочтительно 80% или более высокую гомологию, более предпочтительно 90% или более высокую гомологию, и еще более предпочтительно 95% или более высокую гомологию к аминокислотной последовательности полипептида дикого типа.
В настоящем изобретении, "ТАСС3" относится к трансформирующему кислотному биспиральному белку 3 (ТАСС3) (Genomics. 1999 Jun 1; 58(2): 165-70). ТАСС3 согласно настоящему изобретению может быть любого происхождения, и предпочтительно представляет собой ТАСС3, более предпочтительно ТАСС3 человека, и еще более предпочтительно ТАСС3 человека, содержащий аминокислотную последовательность SEQ ID NO: 9 (кДНК последовательность, SEQ ID NO: 13 / Учетный номер GenBankNM_006342.2). Локус гена ТАСС3 человека представляет собой 4р16.3, и он расположен против хода транскрипции FGFR3 гена та той же самой хромосоме.
В настоящем изобретении," ТАСС3 человека" относится к полипептиду ТАСС3 человека дикого типа, содержащему аминокислотную последовательность SEQ ID NO: 9, или мутантному полипептиду с замещением, делецией или инсерцией одной или более аминокислот (предпочтительно от одной до десяти аминокислот, и более предпочтительно от одной до пяти аминокислот) в полипептиде дикого типа.
Мутантный полипептид также включает полипептиды, имеющие 70% или более высокую гомологию, предпочтительно 80% или более высокую гомологию, более предпочтительно 90% или более высокую гомологию, и еще более предпочтительно 95% или более высокую гомологию к аминокислотной последовательности полипептида дикого типа.
Идентичность аминокислотной последовательности (или нуклеотидной последовательности) может быть определена, используя алгоритм BLAST согласно Karlin и Altschul (Proc. Natl. Acad. Sci. USA (1993) 90, 5873-7). На основании этого алгоритма были разработаны такие программы, как BLASTN и BLASTX (Altschul и др. J. Mol. Biol. (1990) 215, 403-10). Для анализа нуклеотидных последовательностей в соответствии с BLASTN на основании BLAST, устанавливают параметры, например, счет = 100 и длина слова = 12. С другой стороны, параметры, используемые для анализа аминокислотных последовательностей с помощью BLASTX на основании BLAST, включают, например, счет = 50 и длина слова = 3. Для каждой программы используют параметры по умолчанию, если используют программы BLAST и Gapped BLAST. В данной области техники известны специфические методики для таких анализов (можно привести ссылку на информацию на веб-сейте National Center for Biotechnology Information (NCBI), Basic Local Alignment Search Tool (BLAST)).
В настоящем изобретении, "гибридный полипептид" относится к полипептиду, в котором целый или часть полипептида FGFR3 дикого типа или мутантного полипептида, как описано выше, гибридизировано с целым или частью полипептида ТАСС3 дикого типа или мутантного полипептида, как описано выше, или полипептиду, в котором целый или часть полипептида FGFR3 дикого типа или мутантного полипептида, как описано выше, гибридизировано с целым или частью дикого типа или мутантного BAIA2P2L1, как описано выше.
Кроме того, гибридные полипептиды согласно настоящему изобретению включают гибридные полипептиды, в которых гибридизированный участок, образованный между целым или частью каждого из двух типов полипептидов, содержит аминокислотную последовательность, кодируемую частью интронной последовательности в геномной ДНК (включая экзоны и интроны), кодирующей FGFR3 полипептид дикого типа или мутантный FGFR3 полипептид.
Примеры таких гибридных полипептидов включают полипептиды, содержащие аминокислотные последовательности SEQ ID NOs: 30 и 36. Аминокислотная последовательность положений 761-793 и аминокислотная последовательность положений 759-791 кодируются участками интронной последовательности гена FGFR3, соответственно (положения в полинуклеотидной последовательности 2,281-2,379 в SEQ ID NO: 29, и положения в полинуклеотидной последовательности 2,275-2,373 в SEQ ID NO: 35, соответственно).
В настоящей заявке, "часть полипептида" относится к полипептиду, состоящему из случайной частичной последовательности из полноразмерной аминокислотной последовательности полипептида дикого типа или мутантного полипептида.
Примеры специфических вариантов осуществления включают гибридный полипептид FGFR3 и ТАСС3, содержащий аминокислотную последовательность SEQ ID NO: 28, гибридный полипептид FGFR3 и ТАСС3, содержащий аминокислотную последовательность SEQ ID NO: 30, гибридный полипептид FGFR3 и BAIAP2L1, содержащий аминокислотную последовательность SEQ ID NO: 32, гибридный полипептид FGFR3 и ТАСС3, содержащий аминокислотную последовательность SEQ ID NO: 34, гибридный полипептид FGFR3 и ТАСС3, содержащий аминокислотную последовательность SEQ ID NO: 36, и гибридный полипептид FGFR3 и BAIAP2L1, содержащий аминокислотную последовательность SEQ ID NO: 38.
Как описано выше, гибридные полипептиды, содержащие аминокислотные последовательности SEQ ID NOs: 30 и 36, содержат в их гибридизированном участке аминокислотную последовательность, кодируемую частью интронной последовательности FGFR3 гена.
Полинуклеотиды согласно настоящему изобретению включают полинуклеотиды, кодирующие гибридный полипептид согласно настоящему изобретению, как описано выше, включающие любые полинуклеотиды, которые могут кодировать гибридный полипептид согласно настоящему изобретению. Полинуклеотиды включают геномные ДНК и кДНК. Геномные ДНК включают экзоны и интроны. Кроме того, кДНК могут включать нуклеотидные последовательности, имеющие происхождение из части интронной последовательности, которая кодирует аминокислотную последовательность.
Полинуклеотиды также включают вырожденные полинуклеотиды, сформированные с любых кодонов, до тех пор, пока кодоны кодируют те же самые аминокислоты.
Полинуклеотиды согласно настоящему изобретению также включают полинуклеотиды, кодирующие гибридные полипептиды, имеющие происхождения из млекопитающих. В предпочтительном варианте осуществления изобретения, полинуклеотиды согласно настоящему изобретению включают полинуклеотиды, кодирующие гибридные полипептиды, имеющие происхождения от людей.
В специфическом варианте осуществления изобретения, полинуклеотиды согласно настоящему изобретению представляют собой полинуклеотиды, кодирующие гибридный полипептид, в котором целый или часть FGFR3 полипептида дикого типа (SEQ ID NO: 6 или 7) или мутантного FGFR3 полипептида гибридизировано с целым или частью ТАСС3 полипептида дикого типа (SEQ ID NO: 9) или мутантного ТАСС3 полипептида, как описано выше, или гибридный полипептид, в котором целый или часть полипептида дикого типа или мутантного FGFR3 полипептида гибридизировано с целым или частью BAIA2P2L1 полипептида дикого типа (SEQ ID NO: 8) или мутантным BAIA2P2L1 полипептидом, как описано выше.
Примеры более специфических вариантов осуществления включают полинуклеотид, содержащий нуклеотидную последовательность, соответствующую сайту соединения двух полипептидов в гибридном полипептиде SEQ ID NOs: 14, 15, или 16.
Примеры еще более специфических вариантов осуществления включают полинуклеотид, содержащий последовательность нуклеиновых кислот SEQ ID NO: 27, которая кодирует гибридный полипептид FGFR3 и ТАСС3, содержащий аминокислотную последовательность SEQ ID NO: 28, полинуклеотид, содержащий последовательность нуклеиновых кислот SEQ ID NO: 29, которая кодирует гибридный полипептид FGFR3 и ТАСС3, содержащий аминокислотную последовательность SEQ ID NO: 30, полинуклеотид, содержащий последовательность нуклеиновых кислот SEQ ID NO: 31, которая кодирует гибридный полипептид FGFR3 и BAIAP2L1, содержащий аминокислотную последовательность SEQ ID NO: 32, полинуклеотид, содержащий последовательность нуклеиновых кислот SEQ ID NO: 33, которая кодирует гибридный полипептид FGFR3 и ТАСС3, содержащий аминокислотную последовательность SEQ ID NO: 34, полинуклеотид, содержащий последовательность нуклеиновых кислот SEQ ID NO: 35, которая кодирует гибридный полипептид FGFR3 и ТАСС3, содержащий аминокислотную последовательность SEQ ID NO: 36, и полинуклеотид, содержащий последовательность нуклеиновых кислот SEQ ID NO: 37, которая кодирует гибридный полипептид FGFR3 и BAIAP2L1, содержащий аминокислотную последовательность SEQ ID NO: 38.
Как описано выше, полинуклеотидная последовательность в положениях 2281-2379 SEQ ID NO: 29 представляет собой последовательность нуклеиновых кислот, имеющую происхождение из интрона FGFR3 гена, и кодирует аминокислотную последовательность в положениях 761-793 в полипептиде, содержащем аминокислотную последовательность SEQ ID NO: 30.
Подобным образом, полинуклеотидная последовательность в положениях 2275-2373 SEQ ID NO: 35 представляет собой последовательность нуклеиновых кислот, имеющую происхождение из интрона FGFR3 гена, и кодирует аминокислотную последовательность в положениях 759-791 в полипептиде, содержащем аминокислотную последовательность SEQ ID NO: 36.
Полинуклеотиды согласно настоящему изобретению могут быть получены с помощью любых методов. Полинуклеотиды согласно настоящему изобретению включают, например, все комплементарные ДНК (кДНК), приготовленные из мРНК, ДНК, приготовленные геномной ДНК, ДНК, полученные с помощью химического синтеза, ДНК, полученные путем ПЦР амплификации РНК или ДНК в качестве матрицы, и ДНК, сконструированные путем подходящего комбинирования этих методов.
Полинуклеотиды, кодирующие гибридные полипептиды согласно настоящему изобретению, могут быть получены с помощью общеизвестных методов путем клонирования кДНК из мРНК, кодирующей гибридный полипептид согласно настоящему изобретению или выделения геномной ДНК и подвергания ее сплайсинговой обработке, или путем химического синтеза.
Например, в способе, в котором клонируют кДНК из мРНК, кодирующей гибридный полипептид согласно настоящему изобретению, сначала, приготавливают мРНК, кодирующей гибридный полипептид согласно настоящему изобретению, из произвольно выбранных тканей или клеток, экспрессирующих и продуцирующих гибридный полипептид согласно настоящему изобретению в соответствии с общепринятыми методами. Это можно осуществлять, например, путем приготовления суммарной РНК, используя такой способ, как гуанидин-тиоцианатный метод, метод с горячим фенолом, или AGPC метод, и обрабатывания суммарной РНК с помощью аффинной хроматографии, используя олиго (dT) целлюлозу, поли U-сефарозу, или др.
После этого, осуществляют синтез цепей кДНК с использованием приготовленной мРНК в качестве матрицы с помощью известного метода, с использованием, например, обратной транскриптазы (Mol. Cell. Biol., Vol. 2, р. 161, 1982; Mol. Cell. Biol., Vol. 3, p. 280, 1983; Gene, Vol. 25, p. 263, 1983). кДНК превращают в двухцепочечную кДНК, и вставляют в плазмидный вектор, фаговый вектор, космидный вектор, или т.п. Для приготовления библиотеки кДНК, полученный вектор трансформируют в Е.coli, или трансфектируют в Е.coli после упаковки in vitro.
Настоящее изобретение также относится к векторам (рекомбинантным векторам), несущим вышеописанный полинуклеотид, кодирующий гибридный полипептид согласно настоящему изобретению.
Векторы согласно настоящему изобретению предпочтительно не ограничиваются, если только они могут реплицироваться и поддерживаться или самовоспроизводиться в различных прокариотических и/или эукариотических клетках в качестве хозяина. Векторы согласно настоящему изобретению включают плазмидные векторы и фаговые векторы.
Клонирующие векторы включают, например, pUC19, λgt10, и λgt11. Если выделенные клетки-хозяева способны экспрессировать гибридный полипептид согласно настоящему изобретению, то предпочтительно вектор представляет собой вектор, который имеет промотор, предоставляющий возможность экспрессии полинуклеотида согласно настоящему изобретению.
Рекомбинантные векторы согласно настоящему изобретению могут быть получены с помощью общепринятых методов, просто путем лигирования полинуклеотида, кодирующего гибридный полипептид согласно настоящему изобретению, с рекомбинантным вектором, доступным в данной области техники (плазмидная ДНК и бактериофаговая ДНК).
Рекомбинантные векторы для применения в настоящем изобретении включают, например, плазмиды, имеющие происхождение из Е.coli (pBR322, pBR325, pUC12, pUC13, pUC19, и др.), плазмиды, имеющие происхождение из дрожжей (pSH19, pSH15, и др.), и плазмиды, имеющие происхождение из Bacillus subtilis (pUB110, рТР5, рС194, и др.).
Примерами фагов являются бактериофаги, такие как λ фаг, и вирусы животных или насекомых (pVL1393, Invitrogen), такие как ретровирус, вирус коровьей оспы, вирус ядерного полиэдроза, и лентивирус.
Экспрессионные векторы применяются для получения гибридного полипептида согласно настоящему изобретению путем экспрессии полинуклеотида, кодирующего гибридный полипептид согласно настоящему изобретению. Экспрессионные векторы предпочтительно не ограничиваются, при условии, что они имеют функцию продуцировать гибридные полипептиды согласно настоящему изобретению путем экспрессии полинуклеотидов, кодирующих полипептиды, в различных прокариотических и/или эукариотических клетках в качестве хозяина.
Такие экспрессионные векторы включают, например, pMAL С2, pEF-BOS (Nucleic Acid Research, Vol. 18, 1990, p. 5322) и pME18S (Jikken Igaku Bessatsu (Experimental Medicine: SUPPLEMENT), "Idenshi Kougaku Handbook (Handbook of Genetic Engineering)" (1992)).
Альтернативно, гибридные полипептиды согласно настоящему изобретению могут быть получены в виде гибридных белков с другими белками. Например, при получении в виде гибридного белка с глутатион S-трансферазой (GST), кДНК, кодирующая гибридный полипептид согласно настоящему изобретению, может быть субклонирована, например, в плазмиде pGEX4T1 (Pharmacia). Е.coli DH5α трансформируют полученной плазмидой, и трансформанты культивируют для получения гибридного белка.
Альтернативно, гибридные полипептиды согласно настоящему изобретению могут быть получены в виде слияний с гемагглютинином гриппа (НА), константной областью иммуноглобулина, β-галактозидазой, мальтозо-связывающим белком (МВР), или др. Кроме того, гибридные полипептиды согласно настоящему изобретению могут быть получены в виде слияний с известными пептидами, например, FLAG (Норр, Т.P. et al., BioTechnology (1988) 6, 1204-1210), 6х His, состоящим из 6 остатков гистидина (His), 10х His, гемагглютинином гриппа (НА), фрагментами с-myc человека, фрагментами VSV-GP, фрагментами p18HIV, Т7-меткой, HSV-меткой, Е-меткой, фрагментами SV40T антигена, lck меткой, фрагментами α-тубулина, В-меткой, фрагментами С белка, Stag, StrepTag, и HaloTag.
При использовании бактерии, в частности Е coli., в качестве клетки-хозяина, векторы согласно настоящему изобретению предпочтительно содержат по меньшей мере участок промотор-оператор, старт-кодон, полинуклеотид, кодирующий гибридный полипептид согласно настоящему изобретению, стоп-кодон, терминирующий участок, и репликон.
Если в качестве хозяина используют дрожжи, клетки животных, или клетки насекомых, то экспрессионные векторы предпочтительно содержат промотор, старт-кодон, полинуклеотид, кодирующий гибридный полипептид согласно настоящему изобретению, и стоп-кодон.
Векторы также могут содержать ДНК, кодирующий сигнальный пептид, энхансерную последовательность, 5' и 3' нетранслируемые участки, кодирующие белок согласно настоящему изобретению, границы сплайсинга, сайты полиаденилирования, участок селективного маркера, репликон, и др.
Кроме того, векторы могут содержать маркерные гены (гены для генов амплификации, гены устойчивости к лекарственным средствам, и др.), которые предоставляют возможность отбора трансформированных хозяев или хозяев с амплифицированными генами.
Маркерные гены включают, например, ген дигидрофолатредуктазы (DHFR), ген тимидинкиназы, ген резистентности к неомицину, ген глутамат синтазы, ген аденозин деаминазы, ген оринитин декарбокислазы, ген гигромицин-В-фосфотрансферазы, и ген аспартат транскарбамилазы.
Участок промотор-оператор для экспрессии гибридного полипептида согласно настоящему изобретению в бактерии содержит промотор, оператор, и последовательность Шайна-Дальгарно (SD) (например, AAGG).
Например, если хозяин из рода Escherichia, то он содержит, например, Trp промотор, lac промотор, recA промотор, λPL промотор, lpp промотор, tac промотор, или т.п.
Примерами промотора для экспрессии гибридного полипептида согласно настоящему изобретению в дрожжах являются РН05 промотор, PGK промотор, GAP промотор, ADH промотор и др.
Если хозяином является Bacillus, то примерами являются SL01 промотор, SP02 промотор, penP промотор, и др.
Если хозяином является эукариотическая клетка, такая как клетка млекопитающего, то примерами являются промотор, имеющий происхождение из SV40, ретровирусный промотор, промотор теплового шока, и др.; и предпочтительными являются SV40 и ретровирус. Тем не менее, промотор не ограничивается вышеуказанными примерами. Дополнительно, для экспрессии эффективным является применение энхансера.
Предпочтительный инициирующий кодон представляет собой, например, метиониновый кодон (ATG). Обычно используемый терминирующий кодон (например, TAG, ТАА, TGA) иллюстрируется в качестве терминирующего кодона. В качестве терминирующего участка обычно используются природные или синтетические терминаторы.
Репликон относится к ДНК, способной реплицировать цельную ДНК последовательность в клетках-хозяевах, и включают естественную плазмиду, искусственно модифицированную плазмиду (ДНК фрагмент, приготовленный из естественной плазмиды), синтетическую плазмиду, и др. Примерами предпочтительных плазмид для Е.coli являются pBR322 или ее искусственные производные (ДНК фрагмент, полученный путем обработки pBR322 с подходящими рестрикционными ферментами), для дрожжей являются 2 μ плазмида дрожжей или хромосомная ДНК дрожжей, и pRSVneo АТСС 37198, и для клеток млекопитающих являются плазмида pSV2dhfr АТСС 37145, плазмида pdBPV-MMTneo АТСС 37224, плазмида pSV2neo АТСС 37149, и др.
Также можно использовать энхансерную последовательность, сайт полиаденилирования, и сайт сращивания, которые обычно используют в данной области, такие как те, которые имеют происхождение из SV40.
Экспрессионный вектор согласно настоящему изобретению может быть приготовлен путем непрерывного и кругового связывания по меньшей мере вышеуказанного промотора, инициирующего кодона, полинуклеотида, кодирующего гибридного полипептида согласно настоящему изобретению, терминирующего кодона, и терминирующего участка, с соответствующим репликоном. Если это является желательным, то можно использовать подходящие ДНК фрагменты (например, линкеры, рестрикционные сайты, и др.), с помощью общепринятого метода, такого как расщепление рестрикционным ферментом или лигирование с применением Т4 ДНК лигазы.
Настоящее изобретение также относится к рекомбинантным клеткам, трансформированным вышеуказанными векторами согласно настоящему изобретению, и рекомбинантные клетки согласно настоящему изобретению могут быть получены путем интродуцирования экспрессионного вектора, указанного выше, в клетки-хозяева.
Клетки-хозяева, используемые в настоящем изобретении, предпочтительно не ограничиваются, при условии, что они совместимы с экспрессионным вектором, указанным выше, и могут быть трансформированы. Их примеры включают различные клетки, такие как клетки дикого типа или искусственно созданные рекомбинантные клетки, общепринято используемые в данной области техники настоящего изобретения (например, бактерия (роды Escherichia и Bacillus), дрожжи (род Saccharomyces, род Pichia, и др.), клетки животных, или клетки насекомых).
Предпочтительными являются клетки Е.coli или животные клетки. Специфическими примерами являются Е.coli (DH5α, TB1, НВ101, и др.), клетки, имеющие происхождение от мышей (СОР, L, С127, Sp2/0, NS-1, NIH3T3, и др.), клетки, имеющие происхождение от крыс (PC12, PC12h), клетки, имеющие происхождение от хомячков (BHK, СНО, и др.), клетки, имеющие происхождение от обезьян (COS1, COS3, COS7, CV1, Velo, и др.), и клетки, имеющие происхождение от людей (Hela, диплоидные клетки, имеющие происхождение из фибробластов, миеломные клетки, и HepG2, и др.).
Экспрессионный вектор может быть интродуцирован (трансформирован (трансфектирован)) в клетки-хозяева в соответствии с общепринятыми методами.
[если хозяином является Е.coli, Bacillus subtilis, или др.]: Proc. Natl. Acad. Sci. USA, Vol. 69, p. 2110 (1972); Mol. Gen. Genet., Vol. 168, p. 111 (1979); J. Mol. Biol., Vol. 56, p. 209 (1971);
[если хозяином является Saccharomyces cerevisiae]: Proc. Natl. Acad. Sci. USA, Vol. 75, p. 1927 (1978); J. Bacteriol., Vol. 153, p. 163 (1983);
[если хозяином является животная клетка]: Virology, Vol. 52, p. 456 (1973);
[если хозяином является клетка насекомых]: Mol. Cell. Biol., Vol. 3, pp. 2156-2165 (1983).
Гибридные полипептиды согласно настоящему изобретению могут быть получены путем культивирования трансформированных рекомбинантных клеток (далее в настоящем изобретении, термин также относится к тельцам включения), содержащих экспрессионный вектор, приготовленный, как описано выше, в питательных средах в соответствии с общепринятыми методами.
Гибридные полипептиды согласно настоящему изобретению могут быть получены путем культивирования вышеописанных рекомбинантных клеток, в частности клеток животных, и предоставляя возможность им секретироваться в культуральные супернатанты.
Полученную культуру фильтруют или центрифугируют для получения культурального фильтрата (супернатанта). Гибридные полипептиды согласно настоящему изобретению очищают и выделяют из культурального фильтрата с помощью общепринятых методов, обычно используемых для очистки и выделения природных или синтетических белков. Примерами метода выделения и очистки являются методы, в которых используется растворимость, такие как высаливание, и методы осаждения растворителя; методы, в которых используется различие в молекулярном весе, такие как диализ, ультрафильтрация, гель-фильтрация, и электрофорез в натрий додецил сульфат - полиакриламидном геле; методы, в которых используется заряд, такие как ионообменная хроматография и хроматография на гидроксилапатите; методы, в которых используется специфическая афинность, такие как афинная колоночная хроматография; методы, в которых используется различие в гидрофобности, такие как высокоэффективная жидкостная хроматография с обращенной фазой; и методы, в которых используется различие в изоэлектрической точке, такие как изоэлектрическое фокусирование.
В то же время, если гибридный полипептид согласно настоящему изобретению находится в периплазме или цитоплазме культивируемых рекомбинантных клеток (таких как Е.coli), то клетки собирают с помощью общепринятых методов, таких как фильтрация и центрифугирование культуры, и после этого суспендируют в подходящем буфере. После этого клеточную стенку и/или клеточную мембрану разрушают с помощью таких методов, как обработка ультразвуком, лизоцимом, и криодеструкцией, получают мембранную фракцию, содержащую белок согласно настоящему изобретению, используя такие методы, как центрифугирование и фильтрация. Мембранную фракцию солюбилизируют с детергентом, таким как Triton-X100, получая неочищенный раствор. После этого, белок согласно настоящему изобретению может быть выделен и очищен от неочищенного раствора, используя общепринятые методы, такие как те, которые упомянуты выше.
Настоящее изобретение также относится к произвольным олигонуклеотиды, которые гибридизируются с полинуклеотидами (кДНК и геномные ДНК), кодирующими вышеописанные гибридные полипептиды согласно настоящему изобретению.
Олигонуклеотиды согласно настоящему изобретению имеют нуклеотидные последовательности, которые комплементарны к произвольным частичным нуклеотидным последовательностям кДНК и геномных ДНК, и которые пригодны в качестве пары олигонуклеотидных праймеров, состоящей из смыслового и антисмыслового праймеров в полимеразной цепной реакции (ПЦР). Цельная нуклеотидная последовательность полинуклеотида, кодирующая гибридный полипептид согласно настоящему изобретению или произвольная часть полинуклеотидной последовательности может быть амплифицирована с помощью ПЦР используя пару олигонуклеотидных праймеров.
Олигонуклеотидные праймеры согласно настоящему изобретению включают олигонуклеотиды любой длины, которые комплементарны к полинуклеотидной последовательности полинуклеотида согласно настоящему изобретению. Олигонуклеотидные праймеры согласно настоящему изобретению предпочтительно включают те, которые имеют последовательность из по меньшей мере 12 последовательных нуклеотидов, более предпочтительно 12-50 нуклеотидов, и еще более предпочтительно 12-20 нуклеотидов.
Олигонуклеотиды согласно настоящему изобретению также пригодны в качестве зонда при процессировании ДНК или РНК гибридизации. При использовании в качестве зонда, ДНК включают частичную нуклеотидную последовательность из 20 или более последовательных нуклеотидов, предпочтительно частичную нуклеотидную последовательность из 50 или более последовательных нуклеотидов, более предпочтительно частичную нуклеотидную последовательность из 100 или более последовательных нуклеотидов, еще более предпочтительно частичную нуклеотидную последовательность из 200 или более последовательных нуклеотидов, и еще более предпочтительно частичную нуклеотидную последовательность из 300 или более последовательных нуклеотидов, которые гибридизируются с полинуклеотидом согласно настоящему изобретению.
Настоящее изобретение также относится к олигонуклеотидам, которые связываются с мРНК полинуклеотидами, кодирующими гибридные полипептиды согласно настоящему изобретению и имеют активность ингибировать трансляцию мРНК в белки. Является особенно предпочтительным, что олигонуклеотиды включают миРНК, которые отщепляют мРНК путем связывания с мРНК полинуклеотидов, кодирующих гибридные полипептиды согласно настоящему изобретению.
Олигонуклеотиды относятся к олигонуклеотидам, которые связываются с мРНК, кодирующими гибридные полипептиды согласно настоящему изобретению, и таким образом ингибируют их экспрессию и включают, например, антисмысловые олигонуклеотиды, рибозимы, и малые интерферирующие РНК (миРНК). Они связываются с мРНК и затем ингибируют их трансляцию в белки.
Антисмысловой олигонуклеотид относится к олигонуклеотиду, который специфически гибридизируется с геномной ДНК и/или мРНК, и ингибирует их экспрессию белков путем ингибирования транскрипции и/или трансляции.
Связывание целевого полинуклеотида (мРНК, и др.) может быть результатом обычной комплементарности пары оснований. Альтернативно, если антисмысловой олигонуклеотид связывается, например, с ДНК дуплексом, то связывание может быть результатом специфического взаимодействия в больших бороздках в двойной спирали. Целевые участки для антисмыслового олигонуклеотида включают 5' конец мРНК, например, 5' нетранслируемые последовательности вплоть до или включая AUG стартовый кодон, и 3' нетранслируемые последовательности мРНК, а также последовательности кодирующих областей.
Если используется в качестве антисмыслового олигонуклеотид согласно настоящему изобретению, то антисмысловые олигонуклеотиды включают частичные нуклеотидные последовательности из 5-100 последовательных нуклеотидов, предпочтительно частичные нуклеотидные последовательности из 5-70 последовательных нуклеотидов, более предпочтительно частичные нуклеотидные последовательности из 5-50 последовательных нуклеотидов, и еще более предпочтительно частичные нуклеотидные последовательности из 5-30 последовательных нуклеотидов.
Кроме того, антисмысловые олигонуклеотиды согласно настоящему изобретению могут быть частично модифицированы путем химической модификации для пролонгирования из периода полураспада в крови (для их стабилизации) или для увеличения их проницаемости через внутриклеточную мембрану при введении пациентам, или для усиления их устойчивости к разложения или абсорбции в пищеварительных органах при пероральном введении. Такая химическая модификация включает, например, химическую модификацию фосфатной связи, рибозы, нуклеинового основания, сахарного компонента в олигонуклеотидах, и 3' и/или 5' концов олигонуклеотидов.
Модификация фосфатных связей включает, например, превращение одной или нескольких связей в фосфодиэфирные связи (D-олиго), фосфоротиоатные связи, фосфородитиоатные связи (S-олиго), метил фосфонат (МР-олиго), фосфороамидатные связи, не-фосфатные связи и метил фосфонотиоатные связи, и их комбинации. Модификация рибозы включает, например, превращение 2'-фторрибозы или 2'-O-метилрибозы. Модификация нуклеинового основания включает, например, превращение в 5-пропинилурацил или 2-аминоаденин.
Рибозим относится к олигонуклеотидам, имеющим каталитическую активность расщепления мРНК. В целом, рибозимы имеют эндонуклеазную, лигазную, или полимеразную активность. Рибозимы включают различные типы трансактивирующих рибозимов, например, рибозимы типа головки молотка и шпильковые рибозимы.
миРНК относится к двухцепочечным олигонуклеотидам, способным осуществлять интерференцию РНК (например, Bass, 2001, Nature, 411, 428-429; Elbashir et al, 2001, Nature, 411, 494-498).
миРНК расщепляют мРНК в зависимости от специфической последовательности, и в результате этого ингибируют трансляцию мРНК в белок. миРНК включает двухцепочечные РНК, которые имеют 20-25 пар оснований и содержат последовательность, комплементарную последовательности целевого полинуклеотида. миРНК согласно настоящему изобретению также включают олигонуклеотиды, содержащие химически модифицированные нуклеотиды и не-нуклеотиды.
Настоящее изобретение также относится к антителам, которые связываются с вышеописанным гибридным полипептидом согласно настоящему изобретению, и их антиген-связывающим фрагментам.
Антитела согласно настоящему изобретению не ограничиваются их происхождением, формой, функцией и т.д. Антитела согласно настоящему изобретению могут представлять собой любые антитела, моноклональные или поликлональные антитела. Тем не менее, предпочтительные антитела согласно настоящему изобретению представляют собой моноклональные антитела. Антитела согласно настоящему изобретению могут представлять собой антитела, которые имеют происхождение из любого животного, такие как человеческие антитела, мышиные антитела, и крысиные антитела. Антитела согласно настоящему изобретению также могут представлять собой рекомбинантные антитела, такие как химерные антитела и гуманизированные антитела. Предпочтительные антитела согласно настоящему изобретению включают химерные антитела, человеческие антитела, и гуманизированные антитела.
Гуманизированные антитела согласно настоящему изобретению могут быть получены с помощью методов, хорошо известных специалисту в данной области техники. Вариабельный участок антитела обычно состоит из трех гипервариабельных участков (CDR), формирующие сандвич-структуру с четырьмя каркасными участками (FR). CDR практически определяет связывающую специфичность антитела. Аминокислотные последовательности CDR очень сильно отличаются. С другой стороны, аминокислотные последовательности, которые составляют FR, часто проявляют высокую гомологию между антителами, имеющими различные связывающие специфичности. Следовательно, это свидетельствует о том, что в целом связывающая специфичность антитела может быть трансплантирована на другое антитело путем пересадки CDR.
Гуманизированные антитела также относятся к реконструированным антителам человека, и их приготавливают путем переноса CDR антитела, имеющего происхождение от млекопитающего, отличающегося от человека, такого как мышь, на гипервариабельные участки антитела человека. Также известны общие техники генетической рекомбинации (см. опубликованную заявку на европейский патент №125023 и WO 96/02576).
Специфически, например, если CDR имеют происхождение из мышиного антитела, то ДНК последовательность конструируется таким образом, чтобы CDR мышиного антитела связывались с каркасными участками (FR) антитела человека, и оно синтезировалось с помощью ПЦР, используя, в качестве праймеров, несколько олигонуклеотидов, которые имеют участки, перекрывающие концы обеих CDR и FR (см. способ, описанный в WO 98/13388). После этого полученную ДНК лигируют с ДНК, кодирующую константную область антитела человека, вставляют в экспрессионный вектор, и интродуцируют в хозяина для продуцирования антитела (см. опубликованную заявку на европейский патент № ЕР 239400 и опубликованную международную патентную заявку № WO 96/02576).
Каркасные участки антитела человека для связывания с CDR выбирают таким образом, чтобы гипервариабельные участки образовывали благоприятный антиген-связывающий участок. При необходимости, аминокислоты в каркасном участке в вариабельном участке антитела могут быть замещены, удалены, добавлены, и/или вставлены таким образом, что гипервариабельные участки реконструированного антитела человека образуют надлежащий антиген-связывающий сайт. Например, мутации могут быть введены в аминокислотную последовательность FR путем применения ПЦР метода, используемого для прививания CDR мыши на FR человека. Специфически, мутации могут быть осуществлены в части полинуклеотидных последовательностей праймеров, которые ренатурируют с FR. Мутации включают в FR, синтезированные с использованием таких праймеров. Мутантные FR последовательности, имеющие желательные свойства, могут быть отобраны путем оценки и определения антиген-связывающей активности аминокислоты, замещенной в мутантном антителе, с помощью способа, как описано выше, и (Sato, K. et al., Cancer Res. (1993) 53, 851-856).
В целом, константные области из антитела человека используют для таких областей гуманизированных антител.
Отсутствуют особые ограничения для константных областей антител человека для использования в настоящем изобретении; и например, при использовании константной области тяжелой цепи, она может представлять собой IgG1 константную область человека, IgG2 константную область человека, IgG3 константную область человека, IgG4 константную область человека, или IgM, IgA, IgE, или IgD константную область человека. Альтернативно, при использовании константной области легкой цепи, она может представлять собой константную область κ цепи человека или константную область λ цепи человека. Кроме того, константные области, имеющие происхождение из антитела человека, могут иметь встречающуюся в природе последовательность или могут представлять собой константную область, имеющую последовательность с модификацией (замещением, делецией, добавлением, и/или инсерцией) одной или более аминокислот во встречающейся в природе последовательности.
Кроме того, после приготовления гуманизированного антитела, аминокислоты в вариабельном участке (например, CDR и FR) и константной области гуманизированного антитела могут быть удалены, добавлены, вставлены, и/или замещены другими аминокислотами. Гуманизированные антитела согласно настоящему изобретению также включают такие гуманизированные антитела с аминокислотными замещениями и др.
Происхождение CDR гуманизированного антитела особенно не ограничено, и может иметь происхождение из любого животного. Например, возможно использоваться последовательности мышиных антител, крысиных антител, кроличьих антител, верблюжьих антител, и др. Предпочтительными являются CDR последовательности мышиных антител.
При введении человеку для терапии, используются гуманизированные антитела поскольку их иммуногенность в организме человека уменьшена.
Химерные антитела содержат, например, константные области тяжелой и легкой цепи антитела человека, и вариабельные участки тяжелой и легкой цепи антитела млекопитающего, отличающегося от человека, такого как мышь. Химерные антитела могут быть приготовлены с помощью известных методов. Например, антитела могут быть получены путем клонирования гена антитела из гибридом, инсерции его в подходящий вектор, и интродуцирования конструкции в хозяев (см. например, Carl, А.K. Borrebaeck, James, W. Larrick, THERAPEUTIC MONOCLONAL ANTIBODIES, опубликованную в Великобритании MACMILLAN PUBLISHERS LTD, 1990). Специфически, кДНК вариабельных участков антитела (V участков) синтезируется из гибридомной мРНК, используя обратную транскриптазу. После получения ДНК, кодирующей V области антитела, представляющего интерес, их связывают с ДНК, кодирующей константные области (С области) желательного антитела человека. Полученные конструкции вставляют в экспрессионные векторы. Альтернативно, ДНК, кодирующая V области антитела, может быть вставлена в экспрессионный вектор, содержащий ДНК, кодирующую С области антитела человека. ДНК вставляют в экспрессионный вектор таким образом, что они экспрессируются под контролем участков, регулирующих экспрессию, например, энхансеры и промоторы. На следующем этапе, клетки-хозяева могут быть трансформированы с помощью экспрессионного вектора для предоставления возможности экспрессии химерных антител.
Антитела человека могут быть получены, используя методы, хорошо известные специалисту в данной области техники. Например, желательные антитела человека с антиген-связывающей активностью могут быть получены путем сенсибилизации лимфоцитов человека с помощью антигена, представляющего интерес, или клеток, экспрессирующих антиген, представляющий интерес in vitro; и слияния сенсибилизированных лимфоциты с миеломными клетками человека, такими как U266 (см. опубликованная заявка на патент Японии Kokoku № (JP-B) Н01-59878 (прошедшая экспертизу, утвержденная заявка на патент Японии, опубликованная для оппозиции)). Альтернативно, желательное антитело человека также может быть получено путем иммунизации трансгенного животного, имеющего полный репертуар генов антитела человека с желательным антигеном (см. опубликованные международные патентные заявки №№ WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO 96/34096, и WO 96/33735).
Альтернативно, В клетки, экспрессирующие антитела, которые имеют антиген-связывающую активность, выделяют из пула лимфоцитов человека путем проточной цитометрии, клеточной матрицы, или др. Гены антитела из выбранных В клеток можно подвергать анализу, и можно определять ДНК последовательности антитела человека, которое связывается в антигеном (Jin, А. et al., Nature Medicine (2009) 15, 1088-92; Scheid, J.F. et al., Nature (2009) 458, 636-640; Wrammert, J. et al., Nature (2008) 453, 667-672; Tiller, T. et al., Journal of Immunological Methods (2008) 329, 112-124). Когда раскрывают ДНК последовательности антиген-связывающего антитела, то можно приготавливать антитела человека путем конструирования подходящих экспрессионных векторов, несущих последовательности. Такие методы известны, и WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438, и WO 95/15388 можно использовать в качестве ссылок.
Кроме того, известные техники для получения антител человека путем пэннинга с фаговой библиотекой антитела человека. Например, вариабельный участок антитела человека экспрессируется в виде одноцепочечного антитела (scFv) на поверхности фага, используя метод фагового дисплея, и можно отбирать фаги, которые связываются с антигеном. Путем анализирования генов выбранных фагов, можно определить ДНК последовательности, кодирующие вариабельные участки антитела человека, связывающиеся с антигеном. Если идентифицируют ДНК последовательности scFvs, связывающиеся с антигеном, то можно конструировать соответствующие экспрессионные векторы, содержащие эти последовательности для получения антител человека. Такие методы хорошо известны. Можно привести ссылки на WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438, WO 95/15388, и др.
Антитела согласно настоящему изобретению включают не только двухвалентные антитела, как представлено с помощью IgG, но также моновалентные антитела, мультивалентные антитела, как представлено с помощью IgM. Дополнительно, антитела согласно настоящему изобретению также включают биспецифические антитела, способные связываться с различными антигенами.
Антитела согласно настоящему изобретению включают не только цельные молекулы антител, но также и любые антиген-связывающие фрагменты, такие как низкомолекулярные антитела.
Антитела согласно настоящему изобретению также включают модифицированные антитела, которые связываются с цитотоксическими веществами. Антитела согласно настоящему изобретению также включают антитела с измененными сахарными цепями сахарные цепи.
Низкомолекулярные антитела (мини-тела), включенные в антиген-связывающие фрагменты согласно настоящему изобретению, представляют собой антитела, содержащие фрагмент антитела, в котором отсутствует часть цельного антитела (например, цельного IgG, и др.). Мини-тела предпочтительно не ограничиваются, если только они имеют активность связываться с гибридным полипептидом согласно настоящему изобретению.
Мини-тела согласно настоящему изобретению особенно не ограничены, при условии, что они содержат часть цельного антитела. Тем не менее, предпочтительно, что мини-тела содержат антиген-связывающий домен. В целом, антиген-связывающий домен представляет собой CDR антитела, и предпочтительно представляет собой шесть CDR антитела. Таким образом, предпочтительные антиген-связывающие домены включают, например, шесть CDR антитела и вариабельные участки антитела (вариабельные участки тяжелой цепи и/или легкой цепи).
Мини-тела согласно настоящему изобретению предпочтительно имеют меньший молекулярный вес, чем цельные антитела. Тем не менее, мини-тела могут образовывать мультимеры, например, димеры, тримеры, или тетрамеры, и таким образом, их молекулярный вес может быть больше, чем молекулярный вес цельных антител.
Другие специфические примеры фрагментов антиген-связывающих молекул включают, например, Fab, Fab', F(ab')2, и Fv. В то же время, специфические примеры низкомолекулярных антител включают, например, Fab, Fab', F(ab')2, Fv, scFv (одноцепочечные Fv), диатела, и sc(Fv)2 (одноцепочечные (Fv)2).
Мультимеры (например, димеры, тримеры, тетрамеры, и полимеры) этих антител также включены в низкомолекулярные антитела согласно настоящему изобретению.
Антиген-связывающие фрагменты могут быть получены, например, путем обработки антител ферментами для получения фрагментов антител. Известные ферменты для получения фрагментов антител включают, например, папаин, пепсин, и плазмин. Альтернативно, может быть сконструирован ген, кодирующий такой фрагмент антитела, интродуцирован в экспрессионный вектор, и экспрессирован в подходящих клетках-хозяевах (см., например, Со, M.S. et al., J. Immunol. (1994) 152, 2968-2976; Better, M. & Horwitz, A.H. Methods in Enzymology (1989) 178, 476-496; Plueckthun, A. & Skerra, A. Methods in Enzymology (1989) 178, 476-496; Lamoyi, E., Methods in Enzymology (1989) 121, 652-663; Rousseaux, J. et al., Methods in Enzymology (1989) 121, 663-669; Bird, R.E. et al., TIBTECH (1991) 9, 132-137).
Расщепляющие ферменты расщепляют в специфическом сайте во фрагменте антитела, получая фрагменты антител специфической структуры, представленной ниже. Можно использовать методы генетической инженерии для таких фрагментов антител, полученных с помощью ферментов, для удаления произвольной порции антитела.
Фрагменты антител, полученные с помощью вышеописанных расщепляющих ферментов, являются следующими:
Расщепление папаином: F(ab)2 или Fab
Расщепление пепсином: F(ab')2 или Fab'
Расщепление плазмином: Facb
Мини-тела согласно настоящему изобретению включают фрагменты антител, в которых отсутствует произвольный участок, до тех пор, пока они имеют активность связываться с гибридным полипептидом согласно настоящему изобретению.
"Диатело" относится к двухвалентному фрагменту антитела, сконструированному путем слияния генов (Holliger Р et al., Рrос. Natl. Acad. Sci. USA 90: 6444-6448 (1993); ЕР 404,097; WO 93/11161, и др.). Диатела представляют собой димеры, состоящие из двух полипептидных цепей. В каждой из полипептидных цепей, образующих димер, VL и VH обычно связаны с помощью линкера в одной цепи. В целом, линкер представляет собой диатело, достаточно короткое, для того, чтобы VL и VH не могли связываться друг с другом. Специфически, количество аминокислотных остатков, образующих линкер составляет, например, около пяти остатков. Таким образом, VL и VH, кодируемые на одном и том же полипептиде, не могут образовывать фрагмент одноцепочечного вариабельного участка, и будут образовывать димер с другим фрагментом одноцепочечного вариабельного участка. В результате этого, диатело имеет два антиген-связывающих сайта.
scFv антитела представляют собой одноцепочечные полипептиды, полученные путем связывания вариабельного участка тяжелой цепи ([VH]) с вариабельным участком легкой цепи ([VL]) с помощью линкера или др. (Huston, J.S. et al, Proc. Natl. Acad. Sci. U.S.A. (1988) 85, 5879-5883; Plickthun "The Pharmacology of Monoclonal Antibodies" Vol. 113, eds., Resenburg and Moore, Springer Verlag, New York, pp. 269-315, (1994)). V область Н-цепи и V область L-цепи scFv могут иметь происхождение из любого антитела, описанного в настоящей заявке. Пептидный линкер для связывания V областей предпочтительно не ограничен. Например, в качестве линкера можно использовать произвольный одноцепочечный пептид, содержащий приблизительно от трех до 25 остатков. Специфически, представляется возможным использовать пептидные линкеры или другие, описанные ниже.
V области обоих цепей могут быть связаны, например, с помощью ПЦР, как описано выше. Для связывания V области с помощью ПЦР, сначала, в качестве матрицы используют ДНК из ДНК ниже, которая кодирует полную или желательную частичную аминокислотную последовательность:
ДНК последовательность, кодирующая Н цепь или V область Н-цепи антитела, и
ДНК последовательность, кодирующая L цепь или V область L-цепи антитела.
ДНК, кодирующие Н-цепь и L-цепь, амплифицируют с помощью ПЦР, используя пару праймеров, имеющих последовательности, соответствующие последовательностям на обоих концах ДНК, подлежащей амплификации. После этого, приготавливают ДНК, кодирующую часть пептидного линкера. ДНК, кодирующая пептидный линкер, также может быть синтезирована с помощью ПЦР. В этом момент, нуклеотидные последовательности, которые могут быть лигированы с амплифицированными продуктами V областей, синтезированными раздельно, добавляют к 5' концу используемых праймеров. После этого осуществляют ПЦР, используя каждую ДНК [ДНК V области Н цепи] - [ДНК пептидного линкера] - [ДНК V участка L цепи], и сборки ПЦР праймеров.
Сборка ПЦР праймеров состоит в комбинировании праймера, который аннелирован к 5' концу [ДНК V области Н цепи] и праймера, который аннелирован к 3' концу [ДНК V области L цепи]. Другими словами, сборка ПЦР праймеров представляет собой набор праймеров, которые можно использовать для амплификации ДНК, кодирующей полноразмерную последовательность scFv, которую необходимо синтезировать. В то же время, нуклеотидные последовательности, которые могут быть лигированы с ДНК V-области, добавляют к [ДНК пептидного линкера]. Таким образом, эти ДНК связаны вместе и после этого в конечном итоге генерируют цельную scFv в виде амплифицированного продукта путем сборки ПЦР праймеров. После того, как генерируют ДНК, кодирующую scFv, могут быть получены экспрессионные векторы, несущие эти ДНК, и рекомбинантные клетки, трансформированные этими экспрессионными векторами, с помощью общепринятых методов. Кроме того, scFv могут быть получены путем культивирования полученных рекомбинантных клеток для экспрессии ДНК, кодирующей scFv.
Порядок, в котором вариабельные области тяжелой цепи и легкой цепи связывают вместе, предпочтительно не ограничен, и они могут быть размещены в любом порядке. Примеры расположения перечислены ниже.
[VH] линкер [VL]
[VL] линкер [VH]
sc(Fv)2 представляет собой одноцепочечное низкомолекулярное антитело, получаемое путем связывания двух VH и двух VL, используя линкеры и др. (Hudson et al., J Immunol. Methods 1999; 231: 177-189). Например, sc(Fv)2 могут быть получены путем связывания scFvs посредством линкера.
Предпочтительными являются антитела, в которых два VH и два VL расположены в порядке VH, VL, VH, и VL ([VH] линкер [VL] линкер [VH] линкер [VL]) с N конца одноцепочечного полипептида. Тем не менее, порядок двух VH и двух VL не ограничивается этим расположением, и они могут быть расположены в любом порядке. Примеры расположения представлены ниже:
[VL] линкер [VH] линкер [VH] линкер [VL]
[VH] линкер [VL] линкер [VL] линкер [VH]
[VH] линкер [VH] линкер [VL] линкер [VL]
[VL] линкер [VL] линкер [VH] линкер [VH]
[VL] линкер [VH] линкер [VL] линкер [VH]
Аминокислотная последовательность вариабельного участка тяжелой цепи или вариабельного участка легкой цепи в низкомолекулярном антителе может содержать замещение, делецию, добавление, и/или вставку. Кроме того, в вариабельном участке тяжелой цепи и вариабельном участке легкой цепи также могут отсутствовать некоторые части или могут быть добавлены с другими полипептидами, при условии, что они имеют способность связывать антиген, если они связаны вместе. Альтернативно, вариабельные участки могут быть химеризированы или гуманизированы.
В настоящем изобретении, линкеры, которые связывают вариабельные участки антитела, включают произвольные пептидные линкеры, которые могут быть интродуцированы, используя генетическую инженерию, или синтетические линкеры, такие как описанные в Protein Engineering, 9(3), 299-305, 1996.
Предпочтительные линкеры в настоящем изобретении представляют собой пептидные линкеры. Длина пептидных линкеров предпочтительно не ограничена, и квалифицированные специалисты в данной области техники подходяще могут выбрать длину в зависимости от поставленной цели. Типическая длина составляет от одной до 100 аминокислот, предпочтительно от 3 до 50 аминокислот, более предпочтительно от 5 до 30 аминокислот, и особенно предпочтительно от 12 до 18 аминокислот (например, 15 аминокислот).
Аминокислотные последовательности таких пептидных линкеров включают, например:
Ser;
Gly⋅Ser;
Gly⋅Gly⋅Ser;
Ser⋅Gly⋅Gly;
Gly⋅Gly⋅Gly⋅Ser (SEQ ID NO: 19);
Ser⋅Gly⋅Gly⋅Gly (SEQ ID NO: 20);
Gly⋅Gly⋅Gly⋅Gly⋅Ser (SEQ ID NO: 21);
Ser⋅Gly⋅Gly⋅Gly⋅Gly (SEQ ID NO: 22);
Gly⋅Gly⋅Gly⋅Gly⋅Gly⋅Ser (SEQ ID NO: 23);
Ser⋅Gly⋅Gly⋅Gly⋅Gly⋅Gly (SEQ ID NO: 24);
Gly⋅Gly⋅Gly⋅Gly⋅Gly⋅Gly⋅Ser (SEQ ID NO: 25);
Ser⋅Gly⋅Gly⋅Gly⋅Gly⋅Gly⋅Gly (SEQ ID NO: 26);
(Gly⋅Gly⋅Gly⋅Gly⋅Ser (SEQ ID NO: 21))n; и
(Ser⋅Gly⋅Gly⋅Gly⋅Gly (SEQ ID NO: 22))n,
где n представляет собой целое число 1 или больше.
Аминокислотная последовательность пептидного линкера может быть подходяще выбрана квалифицированным специалистом в данной области техники зависимости от поставленной цели. Например, вышеуказанное "n", которое определяется как длина пептидного линкера, обычно составляет 1-5, предпочтительно 1-3, и более предпочтительно 1 или 2.
Синтетические линкеры (химические перекрестно-сшивающие агенты) включают перекрестно-сшивающие агенты, которые обычно используются для перекрестного сшивания пептидов, например, N-гидрокси сукцинимид (NHS), дисукцинимидил суберат (DSS), бис(сульфосукцинимидил) суберат (BS3), дитиобис(сукцинимидил пропионат) (DSP), дитиобис(сульфосукцинимидил пропионат) (DTSSP), этилен гликоль бис(сукцинимидил сукцинат) (EGS), этилен гликоль бис(сульфосукцинимидил сукцинат) (сульфо-EGS), дисукцинимидил тартрат (DST), дисульфосукцинимидил тартрат (сульфо-DST), бис[2-(сукцинимидоксикарбонилокси)этил] сульфон (BSOCOES), и бис[2-(сульфосукцинимидоксикарбонилокси)этил] сульфон (сульфо-BSOCOES). Эти перекрестно-сшивающие агенты коммерчески доступны.
Если связаны четыре вариабельных участка антитела, то обычно требуется три линкера. Такие множественные линкеры могут быть одинаковыми или разными.
Антитела согласно настоящему изобретению включают антитела, в которых один или несколько аминокислотных остатков добавлены к аминокислотной последовательности антитела согласно настоящему изобретению. Кроме того, гибридные белки, которые получают при слиянии между одним из вышеописанных антител и вторым пептидом или протеином включены в настоящем изобретении. Гибридные белки могут быть приготовлены путем лигирования полинуклеотида, кодирующего антитело согласно настоящему изобретению, с полинуклеотидом, кодирующим второй пептид или полипептид в рамке, инсерции ее в экспрессионный вектор, и экспрессирования слитой конструкции в хозяине. Для этой цели доступные несколько техник, известные специалисту в данной области техники. Партнерский пептид или полипептид для гибридизации с антителом согласно настоящему изобретению может представлять собой известный пептид, например, FLAG (Норр, Т.P. et al., BioTechnology 6, 1204-1210 (1988)), 6х His, состоящий из шести His (гистидин) остатков, 10х His, гемагглютинин гриппа (НА), фрагмент с-myc человека, VSV-GP фрагмент, p18HIV фрагмент, T7-tag, HSV-tag, E-tag, фрагмент антигена SV40 Т, lck tag, фрагмент α-тубулина, B-tag, фрагмент С белка, Stag, StrepTag, HaloTag. Другие партнерские полипептиды для слияния с антителами согласно настоящему изобретению включают, например, GST (глутатион-S-трансфераза), НА (гемагглютинин гриппа), константную область иммуноглобулина, β-галактозидаза, и МВР (мальтозо-связывающий белок). Полинуклеотид, кодирующий один из этих коммерчески доступных пептидов или полипептидов, может быть слит с полинуклеотидом, кодирующим антитело согласно настоящему изобретению. Гибридный полипептид может быть приготовлен путем экспрессирования гибридной конструкции.
Кроме того, антитела согласно настоящему изобретению могут представлять собой конъюгированные антитела, которые связаны с любыми различными молекулами, включая полимерные вещества, такие как полиэтилен гликоль (PEG) и гиалуроновая кислота, радиоактивные вещества, флуоресцентные вещества, люминесцентные вещества, ферменты, и токсины. Такие конъюгированные антитела могут быть получены путем химической модификации полученных антител. Способы модификации антител установлены в данной области техники (например, US 5057313 и US 5156840). "Антитела" согласно настоящему изобретению также включают такие конъюгированные антитела.
Кроме того, антитела, используемые в настоящем изобретении, могут представлять собой биспецифические антитела. Биспецифическое антитело относится к антителу, которое имеет вариабельные участки, распознающие различные эпитопы в одной и той же молекуле антитела. В настоящем изобретении, биспецифические антитела может распознавать различные эпитопы на молекуле гибридного полипептида согласно настоящему изобретению, или распознавать гибридный полипептид согласно настоящему изобретению с одним антиген-связывающим сайтом и отличающееся вещество с другим антиген-связывающим сайтом.
Способы получения биспецифических антител известны. Биспецифические антитела могут быть получены, например, путем связывания двух антител, которые распознают различные антигены. Антитела, которые связывают вместе, могут иметь половину молекул, каждая из которых содержит Н цепь и L цепь, или четверть молекулы, состоящую только из одной Н цепи. Альтернативно, гибридомы, продуцирующие различные моноклональные антитела, можно сливать для получения гибридизированной клетки, продуцирующей биспецифическое антитело. Кроме того, биспецифические антитела могут быть получены с помощью техник генетической инженерии.
Антитела согласно настоящему изобретению могут отличаться по аминокислотной последовательности, молекулярному весу, изоэлектрической точке, наличию/отсутствию сахарных целей, и конформации, в зависимости от клетки или хозяина, продуцирующего антитело, или способа очистки, как описано ниже. Тем не менее, полученное антитело включено в настоящем изобретении, при условии, что оно функционально эквивалентно антителу согласно настоящему изобретению. Например, если антитело согласно настоящему изобретению экспрессируется в прокариотических клетках, например Е.coli, то метиониновый остаток добавляется к N концу аминокислотной последовательности оригинального антитела. Такие антитела включены в настоящем изобретении.
Антитела согласно настоящему изобретению могут представлять собой антитела с измененными сахарными цепями. Способы модификации сахарных цепей антитела известны специалистам в данной области техники, и включают, например, способы для улучшения ADCC путем модификации гликозилирования антитела, способы для подгонки ADCC путем присутствия или отсутствия фукозы в сахарных цепях антитела, способы для получения антител, имеющих сахарные цепи, которые не содержат α-1,6 коровую фукозу путем продукции антител в YB2/0 клетках, и способы для добавления сахарных цепей, имеющих биссекторные GlcNAc (WO 99/54342; WO 00/61739; WO 02/31140; WO 02/79255, и др.).
Антитела согласно настоящему изобретению могут быть получены с помощью известных методов, используя в качестве иммуногена гибридный полипептид согласно настоящему изобретению (имеющий происхождение из млекопитающих, таких как люди и мыши) или его фрагмент. Специфически, млекопитающих, отличающихся от человека, иммунизируют с помощью известного метода иммунизации, используя сенсибилизирующий антиген, желательный антиген или клетки, экспрессирующие желательный антиген. Иммунные клетки, приготовленные из иммунизированных млекопитающих, сливают с известными родительскими клетками с помощью общего метода слияния клеток. Полученные клетки, продуцирующие моноклональные антитела (гибридомы), сортируют с помощью общих методов скрининга, и моноклональные антитела приготавливают путем культивирования клеток.
Млекопитающие, отличающиеся от человека, подвергаемые иммунизации, включают, например, животные, такие как мыши, крысы, кролики, овцы, обезьяны, козы, ослы, коровы, кони, и свиньи. Антиген может быть получен с использованием полинуклеотида, кодирующего гибридный полипептид согласно настоящему изобретению, в соответствии с известными методами, например, с помощью методом с использованием бакуловируса (например, WO 98/46777) или др.
Гибридомы могут быть получены, например, в соответствии со способом Milstein et al. (Kohler, G. и Milstein, С., Methods Enzymol. (1981) 73: 3-46) или др. Если иммуногенность антигена является низкой, то иммунизацию можно осуществлять после связывания антигена с макромолекулой, имеющей иммуногенность, такой как альбумин.
В варианте осуществления, антитела, которые связываются с гибридными полипептидами согласно настоящему изобретению, включают моноклональные антитела, которые связываются с гибридными полипептидами согласно настоящему изобретению. Иммуногены для приготовления моноклональных антител, имеющих способность связываться с гибридным полипептидом согласно настоящему изобретению, особенно не ограничены, при условии, что могут быть получены антитела, имеющие способность связываться с гибридным полипептидом согласно настоящему изобретению. Представляется возможным использовать иммуноген, например, гибридный полипептид дикого типа или фрагмент его пептида, или полипептид, полученный путем добавления искусственной мутации в гибридный полипептид дикого типа.
В то же время, активность антитела связываться с гибридным полипептидом согласно настоящему изобретению может быть оценена с помощью методов, известных квалифицированным специалистам в данной области техники.
В то же время, моноклональные антитела также могут быть получены путем ДНК иммунизации. ДНК иммунизация представляет собой способ, в котором вектор ДНК, сконструированный таким образом, что ген, кодирующий антигенный белок, может экспрессироваться в животном, подвергаемом иммунизации, вводят животному, и иммуноген экспрессируется в организме животного для обеспечения иммуностимуляции. По сравнению с общепринятыми методами иммунизации на основе введения белковых антигенов, полагают, что ДНК иммунизация будет иметь следующие преимущества:
- она представляет возможность иммуностимуляции, при этом сохраняя структуру мембранного белка; и
- не необходимости очистки иммуногена.
Для получения моноклональных антител путем ДНК иммунизации, сначала, полинуклеотид, кодирующий гибридный полипептид согласно настоящему изобретению, вводят животному, подвергаемому иммунизации. Полинуклеотид, кодирующий гибридный полипептид согласно настоящему изобретению, может быть синтезирован в соответствии с вышеописанным методом с помощью известных техник, таких как ПЦР. Полученный ДНК (полинуклеотид) вставляют в подходящий экспрессионный вектор и после этого вводят животному, подвергаемому иммунизации. Экспрессионный вектор включает любые векторы, как описано выше (например, коммерчески доступные экспрессионные векторы, такие как pcDNA3.1). Векторы могут быть введены в живой организм с помощью обычно используемых методов. Например, ДНК иммунизацию можно осуществлять, например, путем применения генной пушки для инъецирования частиц золота, иммобилизованных с экспрессионным вектором, в клетки. Предпочтительный способ получения моноклональных антител состоит в осуществлении бустерной иммунизации с клетками, экспрессирующими гибридный полипептид согласно настоящему изобретению после ДНК иммунизации.
После иммунизации млекопитающего, как описано выше, и подтверждения повышения уровня желательного антитела в сыворотке крови, иммунные клетки собирают от млекопитающего и подвергают клеточному слиянию. Предпочтительными иммунными клетками являются, в частности, клетки селезенки.
Миеломные клетки млекопитающих используют для слияния с вышеописанными иммунными клетками. Является предпочтительным, что миеломные клетки имеют подходящие селективные маркеры для скрининга. Селективный маркер относится к фенотипу, который предоставляет возможность (или не предоставляет возможность) выживания в специфических условиях культивирования. Известные селективные маркеры включают недостаточность гипоксантин-гуанин-фосфорибозилтрансферазы (далее в настоящей заявке сокращается как "HGPRT недостаточность") и недостаточность тимидин киназы (далее в настоящей заявке сокращается как "TK недостаточность"). HGPRT- или TK-дефектные клетки проявляют гипоксантин-аминоптерин-тимидин чувствительность (далее в настоящей заявке сокращается как "HAT чувствительность"). В HAT селекционной среде, НАТ-чувствительные клетки не могут синтезировать ДНК и, следовательно, будут погибать. Однако при слиянии с нормальными клетками, они могут продолжать синтезировать ДНК посредством «реутилизационного» пути нормальных клеток и, таким образом, могут расти даже в HAT селекционной среде.
HGPRT- или TK-дефектные клетки могут быть отобраны, используя среду, содержащую 6-тиоогуанин, 8-азагуанин (далее в настоящей заявке сокращается как "8AG") или 5'-бромдезоксиуридин. В то время как нормальные клетки погибают вследствие инкорпорации этих пиримидиновых аналогов в ДНК, клетки, в которых отсутствуют эти ферменты, могут выживать в селекционной среде, поскольку они не могут инкорпорировать эти пиримидиновые аналоги. Другой селективный маркер, называемый G418 резистентность, придает резистентность к 2-дезоксистрептаминовым антибиотикам (аналоги гентамицина) благодаря гену резистентности к неомицину. Известны различные миеломные клетки, подходящие для слияния клеток.
Клеточное слияние между иммунными клетками и миеломными клетками можно осуществлять в соответствии с известными методами, например, согласно способу Kohler и Milstein et al. (Kohler. G. и Milstein, С., Methods Enzymol. (1981) 73, 3-46).
Более специфически, слияние клеток можно осуществлять, например, в общепринятой культуральной среде в присутствии агента, способствующего слиянию клеток. Агент, способствующий слиянию, включает, например, полиэтилен гликоль (PEG) и вирус Сендай (HVJ). При необходимости, также можно добавлять вспомогательный агент, такой как диметил сульфоксид, для улучшения эффективности слияния.
Иммунные клетки и миеломные клетки можно использовать в произвольно определенном соотношении. Например, соотношение иммунных клеток к миеломным клеткам предпочтительно составляет 1-10. Культуральные среды, используемые для слияния клеток, включают, например, среды, которые являются подходящими для клеточного роста миеломных клеточных линий, такие как RPMI1640 и MEM, и другие общепринятые культуральные среды, используемые для этого типа клеточной культуры. Дополнительно, культуральные среды также могут быть дополнены сывороточным компонентом, таким как фетальная телячья сыворотка (FCS).
Заранее определенные количества иммунных клеток и миеломных клеток смешивают тщательно в культуральной середе, и затем смешивают с раствором PEG, предварительно нагретым приблизительно до 37°С для получения слитых клеток (гибридом). В способе слияния клеток, например, PEG со средним молекулярным весом около 1,000-6,000 можно добавлять к клеткам типично в концентрации от 30% до 60% (мас./об.). После этого, последовательное добавление соответствующей культуральной среды, перечисленной выше, и удаление супернатанта путем центрифугирования повторяют для удаления агента для слияния клеток и других компонентов, которые являются неблагоприятными для роста гибридом.
Полученные гибридомы можно подвергать скринингу с использованием селекционной среды в соответствии с селективным маркером, который содержат миеломные клетки, используемые в клеточном слиянии. Например, HGPRT- или TK-дефектные клетки можно подвергать скринингу путем их культивирования в HAT среде (среде, содержащей гипоксантин, аминоптерин, и тимидин). Специфически, если в слиянии клеток используют НАТ-чувствительные миеломные клетки, то клетки, успешно слитые с нормальными клетками, могут селективно расти в HAT среде. Клеточную культуру с использованием вышеописанной HAT среды продолжают в течение достаточного периода времени для предоставления возможности умереть всем клеткам, за исключением желательных гибридом (неслитые клетки). Специфически, в целом, желательные гибридомы могут быть отобраны путем культивирования клеток в течение периода от нескольких дней до нескольких недель. После этого можно осуществлять скрининг и единичное клонирование гибридом, которые продуцируют представляющее интерес антитело, используя общепринятые методы серийных разведений.
Скрининг и единичное клонирование представляющего интерес антитела подходяще можно осуществлять с помощью известных методов скрининга, основанных на реакции антиген-антитело. Например, антиген связывается с носителем, таким как шарики, сделанные из полистирола или т.п., и коммерчески доступные микротитровальные планшеты на 96 лунок, и после этого подвергают реакции с культуральным супернатантом гибридомы. На следующем этапе, носитель промывают и затем подвергают реакции с меченым ферментом вторичным антителом или т.п. Если культуральный супернатант содержит представляющее интерес антитело, реагирующее с сенсибилизирующим антигеном, то вторичное антитело связывается с носителем посредством этого антитела. В завершение, обнаруживают вторичное антитело, связанное с носителем, для определения того, содержит ли культуральный супернатант представляющее интерес антитело. Гибридомы, продуцирующие желательное антитело, способное связываться с антигеном, можно клонировать с помощью метода серийных разведении или т.п.
Дополнительно к вышеописанному методу для приготовления гибридом посредством иммунизации нечеловеческого антитела с антигеном, представляющие интерес антитела также могут быть получены путем сенсибилизации лимфоцитов человека с помощью антигена. Специфически, сначала, лимфоциты человека сенсибилизируют с гибридным полипептидом согласно настоящему изобретению in vitro. После этого, сенсибилизированные лимфоциты сливают с подходящим партнером для слияния. Например, миеломные клетки, имеющие происхождение от человека, со способностью постоянно делиться можно использовать в качестве партнера для слияния (см. JP-B (Kokoku) Н01-59878). Антитела, полученные с помощью этого метода, представляют собой антитела человека, имеющие способность связываться с гибридным полипептидом согласно настоящему изобретению.
Полинуклеотидная последовательность, кодирующая антитело, связывающееся с гибридным полипептидом согласно настоящему изобретению, полученным с помощью вышеописанных способов или подобных, и ее аминокислотная последовательность, могут быть получены с помощью методов, известных квалифицированным специалистам в данной области техники.
На основе полученной последовательности антитела, связывающегося с гибридным полипептидом согласно настоящему изобретению, может быть приготовлено антитело, связывающееся с гибридным полипептидом согласно настоящему изобретению с помощью методик генетической рекомбинации, известных специалисту в данной области техники. Специфически, полинуклеотид, кодирующий антитело, может быть сконструирован на основе последовательности антитела, которое распознает гибридные полипептиды согласно настоящему изобретению, вставлен в экспрессионный вектор, и затем экспрессироваться в подходящих клетках-хозяевах (см., например, Со, М.S. et al., J. Immunol. (1994) 152, 2968-2976; Better, M. и Horwitz, A.H., Methods Enzymol. (1989) 178, 476-496; Pluckthun, А. и Skerra, A., Methods Enzymol. (1989) 178, 497-515; Lamoyi, E., Methods Enzymol. (1986) 121, 652-663; Rousseaux, J. et al., Methods Enzymol. (1986) 121, 663-669; Bird, R.E. и Walker, B.W., Trends Biotechnol. (1991) 9, 132-137).
Векторы включают M13 векторы, pUC векторы, pBR322, pBluescript, и pCR-Script. Альтернативно, для субклонирования и вырезания кДНК, векторы включают, например, pGEM-T, pDIRECT, и рТ7, дополнительно к векторам, описанным выше. Экспрессионные векторы особенно пригодны при использовании векторов для получения антител согласно настоящему изобретению. Например, для экспрессии в Е.coli такие как JM109, DH5α, НВ101, и XL1-Blue, экспрессионные векторы не только имеют вышеописанные характеристики, которые предоставляют возможность вектору амплифицироваться в Е.coli, но также должны нести промотор, который предоставляет возможность эффективно экспрессироваться в Е.coli, например, lacZ промотор (Ward et al., Nature (1989) 341, 544-546; FASEB J. (1992) 6, 2422-2427), araB промотор (Better et al., Science (1988) 240, 1041-1043), T7 промотор или др. Такие векторы включают pGEX-5X-1 (Pharmacia), "QIAexpress system" (Qiagen), pEGFP, или pET (в этом случае, хозяин предпочтительно представляет собой BL21, который экспрессирует Т7 РНК полимеразу) дополнительно к векторам, описанным выше.
Векторы могут содержать последовательности для секреции антитела. В качестве сигнальной последовательности для секреции антитела, можно использовать pelB сигнальную последовательность (Lei, S.P. et al J. Bacteriol. (1987) 169, 4379), если белок секретируется в периплазму Е.coli. Вектор можно интродуцировать в клетки-хозяева, например, с помощью хлорида кальция или методов электропорации.
Дополнительно к векторам для Е.coli, векторы для продуцирования антител согласно настоящему изобретению включают, например, экспрессионные векторы млекопитающих (например, pcDNA3 (Invitrogen), pEF-BOS (Nucleic Acids. Res. 1990, 18(17), p5322), pEF, и pCDM8), экспрессионные векторы, имеющие происхождение из клеток насекомых (например, "Bac-to-BAC бакуловирусная экспрессионная система" (Gibco-BRL) и pBacPAK8), экспрессионные векторы, имеющие происхождение из растений (например, рМН1 и рМН2), экспрессионные векторы, имеющие происхождение из вирусов животных (например, pHSV, pMV, и pAdexLcw), ретровирусные экспрессионные векторы (например, pZIPneo), экспрессионные векторы дрожжей (например, "Pichia Expression Kit" (Invitrogen), pNV11, и SP-Q01), и экспрессионные векторы Bacillus subtilis (например, pPL608 и pKTH50).
Для экспрессии в клетках животных, таких как СНО, COS, и NIH3T3 клетки, векторы должны иметь промотор, необходимый для экспрессии в клетках, например, SV40 промотор (Mulligan et al., Nature (1979) 277, 108), MMLV-LTR промотор, EF1α промотор (Mizushima et al., Nucleic Acids Res. (1990) 18, 5322), и CMV промотор, и более предпочтительно они имеют ген для отбора трансформированных клеток (например, ген резистентности к лекарственным средствам, который предоставляет возможности оценки с использованием агента (неомицин, G418, или др)). Векторы с такими характеристиками включают, например, рМАМ, pDR2, pBK-RSV, pBK-CMV, pOPRSV, и рОР13,.
Дополнительно, можно использовать следующий метод для стабильной экспрессии гена и амплификации гена в клетках: СНО клетки, дефицитные по пути синтеза нуклеиновой кислоты, интродуцируют с вектором (например, pSV2-dhfr ("Molecular Cloning 2nd edition", Cold Spring Harbor Laboratory Press, 1989)), который несет DHFR ген, который компенсирует дефицит, и вектор амплифицируют, используя метотрексат (МТХ). Альтернативно, можно использовать следующий метод для временной экспрессии гена: COS клетки с геном, экспрессирующим SV40 Т антиген на их хромосоме, трансформируют с помощью вектора (pcD и др.) с SV40 точкой начала репликации. Также можно использовать точки начала репликации, имеющие происхождение с вируса полиомы, аденовируса, вируса папилломы крупного рогатого скота (BPV), и других. Для амплификации числа копий гена в клетках-хозяевах, экспрессионные векторы дополнительно могут нести селективные маркеры, такие как ген аминогликозид трансфераза (АРН), ген тимидин киназы (TK), ген ксантин-гуанин фосфорибозилтрансферазы (Ecogpt) Е.coli, и ген дигидрофолатредуктазы (dhfr).
Антитела согласно настоящему изобретению, полученные с помощью способов, описанных выше, могут быть выделены из содержимого клеток-хозяев или снаружи клеток (среда, или др.), и очищены до гомогенности. Антитела могут быть выделены и очищены с помощью методов, которые общепризнанно используются для выделения и очистки антител, и тип метода не ограничивается. Например, антитела могут быть выделены и очищены путем подходящего селектирования и комбинирования колоночной хроматографии, фильтрации, ультрафильтрации, высаливания, осаждения растворителя, экстрагирования растворителя, перегонки, иммунопреципитации, электрофореза в SDS-полиакриламидном геле, изоэлектрофокусирования, диализа, перекристаллизации, и др.
Хроматографии включают, например, аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, хроматографию с обращенной фазой, и адсорбционную хроматографию (Strategies for Protein Purification и Characterization: A Laboratory Course Manual. Ed Daniel R. Marshak et al., Cold Spring Harbor Laboratory Press, 1996). Хроматографические методы, описанные выше, можно осуществлять, используя жидкостную хроматографию, например, ВЭЖХ и FPLC (жидкостную хроматографию быстрого разрешения). Колонки, которые можно использовать для аффинной хроматографии, включают колонки белка А и колонки белка G. Колонки, использующие белок А, включают, например, Hyper D, POROS, и Sepharose FF (GE Amersham Biosciences). Настоящее изобретение включает антитела, которые в высокой степени очищены, используя эти методы очистки.
Способность связываться с гибридном полипептидом согласно настоящему изобретению полученных антител можно определить с помощью методов, известных квалифицированным специалистам в данной области техники. Способы определения антиген-связывающей активности антитела включают, например, ELISA (твердофазный иммуноферментный анализ), EIA (иммуноферментный анализ), RIA (радиоиммунологический анализ), и метод флуоресценции антитела. Например, при использовании иммуноферментного анализа, образцы, содержащие антитело, такие как очищенные антитела и культуральные супернатанты клеток, продуцирующих антитела, добавляют к планшетам, покрытым антигеном. Добавляют вторичное антитело, меченное с помощью фермента, такого как щелочная фосфатаза и планшеты инкубируют. После промывки, добавляют субстрат фермента, такой как n-нитрофенил фосфат, и измеряют абсорбцию для оценки антиген-связывающей активности.
В настоящем изобретении, "злокачественное новообразование" в целом относится к злокачественной опухоли, которая может быть метастатической или неметастатической, например, неограничивающими примерами злокачественного новообразования, которые развиваются из эпителиальных тканей, такие как желудочно-кишечный тракт и кожа, включают опухоль головного мозга, рак кожи, рак головы и шеи, рак пищевода, рак легкого, рак желудка, рак двенадцатиперстной кишки, рак молочной железы, рак предстательной железы, рак шейки матки, рак тела матки, рак поджелудочной железы, рак печени, рак ободочной и прямой кишки, рак ободочной кишки, рак мочевого пузыря, и рак яичников. Кроме того, неограничивающие примеры саркомы, которые развиваются из неэпителиальных тканей (строма), таких как мышцы, включают остеосаркому, хондросаркому, рабдомиосаркому, лейомиосаркому, липосаркому, и ангиосаркому. Кроме того, неограничивающие примеры гематологических злокачественных опухолей, имеющих происхождение из гематопоэтических органов, включают злокачественную лимфому, включая лимфому Ходжкина и неходжкинскую лимфому, лейкозы, включая острый миелоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфолейкоз, и хронический лимфолейкоз, и множественную миелому.
В настоящем изобретении, злокачественное новообразование включает любую впервые развившуюся опухоль патологической ткани (неоплазму). В настоящем изобретении, неоплазма приводит к образованию опухоли, которая характеризуется частичной неоваскуляризацией. Неоплазма может быть доброкачественной, например, ангиома, глиома, и тератома, или злокачественной, например, рак, саркома, глиальная опухоль, астроцитома, нейробластома и ретинобластома.
В настоящем изобретении, предпочтительные примеры злокачественных новообразований включают рак мочевого пузыря, опухоль головного мозга, плоскоклеточный рак головы и шеи, рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, меланому кожи, рак пищевода, рак желудка, и рак печени.
В настоящем изобретении, "раковая ткань" относится к ткани, содержащей по меньшей мере одну раковую клетку. Например, в качестве раковых тканей, содержащих раковые клетки и кровеносные сосуды, раковая ткань относится к клеткам все типов, которые способствуют образованию опухолевой массы, содержащей раковые клетки и эндотелиальные клетки. В данном случае, опухолевая масса относится к очагу опухолевой ткани. Термин "опухоль" в целом используется по отношению к доброкачественной или злокачественной неоплазме.
Настоящее изобретение относится к фармацевтическим композициям, содержащим вышеописанное антитело или его антиген-связывающий фрагмент, или олигонуклеотиды согласно настоящему изобретению.
В настоящем изобретении, фармацевтическая композиция в целом относится к фармацевтическому агенту для лечения, предотвращения, или исследования/диагностирования заболеваний.
Фармацевтические композиции согласно настоящему изобретению могут быть приготовлены в виде лекарственных средств с помощью методов, известных квалифицированным специалистам в данной области техники. Например, они могут использоваться парентерально, в форме для инъекций стерильных растворов или суспензий, включая воду или другую фармацевтически приемлемую жидкость. Например, такие композиции могут быть приготовлены путем смешивания в единичной дозированной форме, по требованию общепринятой утвержденной практики приготовления лекарственных средств, путем подходящего комбинирования фармакологически приемлемых носителей или сред, специфически стерильной воды, физиологического солевого раствора, растительного масла, эмульгатора, суспензии, поверхностно-активного вещества, стабилизатора, ароматизатора, наполнителя, носителя, консерванта, связующего, или др. Количество активного компонента в таких препаратах корректируют таким образом, чтобы можно было получить подходящее количество в специфическом диапазоне.
Стерильные композиции для инъекций могут быть приготовлены в соответствии с общей практикой приготовления лекарственных средств, используя наполнители, такие как дистиллированная вода для инъекций. Водные растворы для инъекций включают, например, физиологический солевой раствор, и изотонические растворы, содержащие глюкозу или другие адъюванты (например, D-сорбит, D-манноза, D-маннит, и хлорид натрия). Их можно использовать с подходящими солюбилизаторами, например, спиртом (этанол, и др.), полиспиртом (пропилен гликоль, полиэтилен гликоль, и др.), и неионными детергентами (Polysorbate 80™, НСО-50, и др.).
Масла включают кунжутное масло и соевое масло. Бензил бензоат и/или бензиловый спирт можно использовать в комбинации в качестве солюбилизаторов. Также представляется возможным сочетать буферы (например, фосфатный буфер и натрий ацетатный буфер), успокаивающие средства (например, прокаин гидрохлорид), стабилизаторы (например, бензиловый спирт и фенол), и/или антиоксиданты. Подходящие ампулы заполняют приготовленными препаратами для инъекций.
Фармацевтические композиции согласно настоящему изобретению предпочтительно вводят парентерально. Например, композиции вводят в инъекционной форме, или в форме для трансназального введения, транспульмонального введения, или трансдермального введения. Например, их можно вводить системно или локально путем внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, подкожной инъекции, или др.
Способы введения подходяще могут быть выбраны с учетом возраста пациента и симптомов. Доза фармацевтической композиции, содержащей антиген-связывающую молекулу, может составлять, например, от 0,0001 мг до 1000 мг/кг для каждого введения. Альтернативно, доза может составлять, например, 0,001-100000 мг на пациента. Тем не менее, настоящее изобретение не ограничивается цифровыми значениями, как описано выше. Дозировка и способ введения изменяются в соответствии с весом пациента, возрастом, симптомами и др. Квалифицированный специалист в данной области техники может установить подходящую дозировку и способ введения, принимая во внимание факторы, описанные выше.
Аминокислоты в аминокислотных последовательностях, описанных в настоящей заявке, могут быть модифицированы после трансляции (например, модификация N-концевого глутамина в пироглутаминовую кислоту путь пироглутамилирования хорошо известно квалифицированному специалисту в данной области техники). Очевидно, такие посттрансляционно модифицированные аминокислоты также включены в аминокислотные последовательности согласно настоящему изобретению.
Настоящее изобретение также относится к способам обнаружения вышеописанного гибридного полипептида согласно настоящему изобретению или полинуклеотида, кодирующего гибридный полипептид в образцах от субъектов (включая пациентов со злокачественным новообразованием и здоровых лиц).
Присутствие или отсутствие гибридного полипептида согласно настоящему изобретению в образце от субъекта можно тестировать и определять, например, используя реакцию антиген-антитело, которую осуществляют путем контактирования вышеописанного антитела или его антиген-связывающего фрагмента, связывающегося с гибридным полипептидом согласно настоящему изобретению, с образцом (опухолевая ткань, нормальная ткань, и различные виды жидкостей организма, содержащие раковые или нормальные клетки (кровь, сыворотка, моча, слюна, перитонеальный выпот, плевральный выпот, и др.)), собранным от субъекта (пациент со злокачественным новообразованием, лица, которые могут быть поражены злокачественным новообразованием, лица с риском развития злокачественного новообразования, или здоровые особи; однако это не ограничивается людьми).
Антиген (то есть, гибридный полипептид согласно настоящему изобретению) в реакции антиген-антитело можно определить, например, с помощью общепринятого иммуноанализа.
В настоящем изобретении, иммуноанализ относится к способу обнаружения гибридного полипептида согласно настоящему изобретению в образце (опухолевая ткань, нормальная ткань, и различные виды жидкостей организма, содержащие раковые или нормальные клетки (кровь, сыворотка, моча, слюна, перитонеальный выпот, плевральный выпот, и др.)) на основании механизма реакции между антигеном (то есть, гибридным полипептидом согласно настоящему изобретению) и антителом, которое связывается с антигеном или его антиген-связывающим фрагментом. Любой иммуноанализ включен в настоящем изобретении, при условии, что он представляет собой способ, который может определить гибридные полипептиды согласно настоящему изобретению.
Для иммуноанализа в настоящем изобретении, например, можно применяться принципы различных методов, такие как описаны в "Kouso Men-eki Sokutei Hou (Enzyme immunoassay)" (3rd Ed., eds., Eiji Ishikawa et al., Igakushoin, 1987). Специфически, эти различные методы можно осуществлять с использованием одного или нескольких антител, которые связываются с представляющим интерес антигеном для захвата (ловушки) антигена для обнаружения в образце.
Применимые принципы предпочтительно включают, например, твердофазные методы с единичной системой антител, жидкофазные методы с двойной системой антител, твердофазные методы с двойной системой антител, сэндвич-методы, и методы в одном сосуде, как описано в JP-B (Kokoku) Н02-39747. В то же время, анализы на основе реакции антиген-антитело также включают метод иммуноанализа с ферментным усилением (EMIT), иммуноферментный анализ с образованием "метаболических каналов", иммуноферментный анализ с модулятором (EMMIA), иммуноанализ с ингибитором фермента, количественный иммуноферментный анализ, иммуноанализ с ферментным усилением, и иммуноферментный анализ со связыванием близкорасположенных эпитопов.
В настоящем изобретении, представляет возможным выбирать и использовать любой подходящий принцип иммуноанализа, такие как описанные выше, в зависимости от задачи теста.
Иммуноанализы согласно настоящему изобретению также включают сэндвич-методы, используя антитело, меченное биотином или ферментом, и многолуночные микротитровальные планшеты, имеющие много лунок, включая микропланшет на 96 лунок, а также методы в одном сосуде, используя шарики и антитела, меченные биотином или ферментом, таким как пероксидаза.
Как описано выше, антитела, которые связываются с гибридным полипептидом согласно настоящему изобретению или его антиген-связывающим фрагментом, которые используют в иммуноанализах согласно настоящему изобретению, могут быть мечены с помощью маркирующего вещества, которое может обеспечивать обнаруживаемый сигнал само или при взаимодействии с другими веществами.
Такие маркирующие вещества включают, например, ферменты, флуоресцентные вещества, хемилюминесцентные вещества, биотин, авидин, и радиоактивные изотопы. Более специфически, вещества включают ферменты, такие как пероксидаза {например, пероксидаза хрена), щелочная фосфатаза, β-D-галактозидаза, глюкозооксидаза, глюкозо-6-фосфат дигидрогеназа, алкоголь дигидрогеназа, малат дигидрогеназа, пенициллиназа, каталаза, апоглюкозооксидаза, уреаза, люцифераза, и ацетилхолинэстераза; флуоресцентные вещества, такие как флуоресцин изотиоцианат, фикобилипротеин, хелаты редкоземельных металлов, дансил хлорид, и тетраметилродамин изотиоцианат; радиоактивные изотопы, такие как 3Н, 14С, 125I, и 131I; биотин; авидин; и хемилюминесцентные вещества.
Такие радиоактивные изотопы и флуоресцентные вещества сами могут обеспечивать обнаруживаемый сигнал.
В то же время, ферменты, хемилюминесцентные вещества, биотин, и авидин сами не могут обеспечивать какой-либо обнаруживаемый сигнал, но обеспечивают обнаруживаемый сигнал при взаимодействии с одним или несколькими различными веществами.
Например, при использовании фермента, необходим по меньшей мере субстрат. Используют различные субстраты в соответствии с типов способа анализа ферментативной активности (колориметрический анализ, флуоресцентный анализ, биолюминесцентный анализ, хемилюминесцентный анализ и др.). Например, перекись водорода используют в качестве субстрата для пероксидазы. В то же время, биотин в целом реагирует по меньшей мере с авидином или авидином, модифицированным ферментом, но не ограничиваясь только ими. При необходимости, также представляется возможным использовать различные хромогенные вещества в соответствии с субстратами.
Присутствие или отсутствие полинуклеотида, кодирующего гибридный полипептид согласно настоящему изобретению в образце от субъекта можно тестировать и определять, например, в соответствии с общепринятыми методами, используя различные олигонуклеотиды (пара олигонуклеотидных праймеров, олигонуклеотидные зонды, и др.) согласно настоящему изобретению, как описано выше, и мРНК, кДНК, приготовленные с использованием мРНК в качестве матрицы, геномную ДНК, или др. в образце (опухолевая ткань, нормальная ткань, и различные виды жидкостей организма, содержащие раковые или нормальные клетки (кровь, сыворотка, моча, слюна, перитонеальный выпот, плевральный выпот, и др.)) собранном от субъекта (пациент со злокачественным новообразованием, лица, которые могут быть поражены злокачественным новообразованием, лица с риском развития злокачественного новообразования, или здоровые особи; однако это не ограничивается людьми) с помощью различных методов анализа генов. Такие методы анализа генов включают, например, нозерн-блоттинг, полимеразную цепную реакцию (ПЦР), саузерн-блоттинг, лигазную цепную реакцию (LCR), амплификацию с замещением цепей (SDA), амплификацию, основанную на последовательности нуклеиновых кислот (NASBA), амплификацию нуклеиновых кислот, инициированную изотермически и химерным праймером (ICAN), изотермическую амплификацию с формированием петель (LAMP), ТМА способ (Gen-Probe's ТМА система), микроматричный анализ, и метод секвенирования следующего поколения.
В этих анализах, олигонуклеотиды согласно настоящему изобретению гибридизируют с полинуклеотидом, кодирующим гибридный полипептид согласно настоящему изобретению, имеющим происхождение из образца. Желательные строгие условия для такой гибридизации включают, например, условия 6 М мочевина, 0,4% SDS, 0,5х SSC, и 37°С; и условия гибридизации для эквивалентной строгости. В зависимости от поставленной задачи, представляется возможным использовать более строгие условия, например, 6 М мочевина, 0,4% SDS, и 0,1х SSC, и 42°С.
Настоящее изобретение также относится к наборам для обнаружения вышеописанного гибридного полипептида согласно настоящему изобретению или полинуклеотида, кодирующего гибридный полипептид в образцах от пациентов, как описано выше, (включая пациентов со злокачественными новообразованиями и здоровые особи).
Специфически, наборы для обнаружения согласно настоящему изобретению могут содержать вышеописанное антитело или его антиген-связывающий фрагмент, связывающееся с гибридным полипептидом согласно настоящему изобретению (включая антитела или их антиген-связывающие фрагменты, меченные с помощью различных вышеописанных маркерных веществ). В зависимости от задачи каждого иммуноанализа, описанного выше, наборы также могут содержать различные обнаруживающие реагенты (ферменты, субстраты, и др.) и инструкции.
Специфически, наборы для обнаружения согласно настоящему изобретению могут содержать различные олигонуклеотиды согласно настоящему изобретению, как описано выше, (пара олигонуклеотидных праймеров, олигонуклеотидные зонды, и др.), которые гибридизируются с мРНК, имеющей происхождение с полинуклеотида, кодирующего вышеописанный гибридный полипептид согласно настоящему изобретению, кДНК, приготовленной с использованием мРНК в качестве матрицы, или геномной ДНК. В соответствии с задачей каждого анализа генов, наборы также могут содержать различные реагенты (ферменты, другие олигонуклеотиды, нуклеиновую кислоту, реакционный буфер, и др.) и инструкции.
Настоящее изобретение также относится к способам тестирования предрасположенности к злокачественному новообразованию у субъекта, подвержен ли субъект злокачественному новообразованию, или прогрессирует ли у субъекта злокачественное новообразование, на основе присутствия или отсутствия гибридного полипептида согласно настоящему изобретению или полинуклеотида, кодирующего гибридный полипептид в образце, выделенном от субъекта.
Специфически, способы согласно настоящему изобретению включают способы тестирования предрасположенности к злокачественному новообразованию у субъекта, подвержен ли субъект злокачественному новообразованию, или прогрессирует ли у субъекта злокачественное новообразование, путем тестирования/определения присутствия или отсутствия гибридного полипептида согласно настоящему изобретению в образце (опухолевая ткань, нормальная ткань, и различные виды жидкостей организма, содержащие раковые или нормальные клетки (кровь, сыворотка, моча, слюна, и др.)), собранном от субъекта (пациент со злокачественным новообразованием, лица, которые могут быть поражены злокачественным новообразованием, лица с риском развития злокачественного новообразования, или здоровые особи; однако это не ограничивается людьми), используя вышеописанные способы и наборы для обнаружения гибридного полипептида согласно настоящему изобретению, где способ основывается на критерии, что у субъекта более вероятно развитие злокачественного новообразования, поражение злокачественным новообразованием, или прогрессирование злокачественного новообразования, если обнаруживается гибридный полипептид.
Дополнительно, способы согласно настоящему изобретению включают способы тестирования предрасположенности к злокачественному новообразованию у субъекта, подвержен ли субъект злокачественному новообразованию, или прогрессирует ли у субъекта злокачественное новообразование, путем тестирования/определения присутствия или отсутствия полинуклеотида, кодирующего гибридный полипептид согласно настоящему изобретению в образце (опухолевая ткань, нормальная ткань, и различные виды жидкостей организма, содержащие раковые или нормальные клетки (кровь, сыворотка, моча, слюна, и др.)), собранном от субъекта (пациент со злокачественным новообразованием, лица, которые могут быть поражены злокачественным новообразованием, лица с риском развития злокачественного новообразования, или здоровые особи; однако это не ограничивается людьми), используя вышеописанные способы и наборы для обнаружения полинуклеотида, кодирующего гибридный полипептид согласно настоящему изобретению, где способ основывается на критерии, что у субъекта более вероятно развитие злокачественного новообразования, поражение злокачественным новообразованием, или прогрессирование злокачественного новообразования, если обнаруживается полинуклеотид, кодирующий гибридный полипептид.
Настоящее изобретение также относится к способам отбора пациента, которому будут назначать противораковое средство (как описано ниже), содержащее соединение, имеющее FGFR ингибирующую активность, на основе присутствия или отсутствия гибридного полипептида согласно настоящему изобретению или полинуклеотида, кодирующего гибридный полипептид в образце, выделенном от субъекта.
Специфически, способы согласно настоящему изобретению включают способы такого тестирования/определения присутствия или отсутствия гибридного полипептида согласно настоящему изобретению в образце (опухолевая ткань, нормальная ткань, и различные виды жидкостей организма, содержащие раковые или нормальные клетки (кровь, сыворотка, моча, слюна, и др.)), собранном от субъекта (пациент со злокачественным новообразованием или лица, которые могут быть поражены злокачественным новообразованием; однако это не ограничивается людьми), используя вышеописанные способы и наборы для обнаружения гибридного полипептида согласно настоящему изобретению, и отбора субъекта в качестве пациента, которому будут назначать противораковое средство (как описано ниже), содержащее соединение, имеющее FGFR ингибирующую активность, если обнаруживают гибридный полипептид согласно настоящему изобретению.
Способы согласно настоящему изобретению дополнительно включают способы такого тестирования/определения присутствия или отсутствия полинуклеотида, кодирующего гибридный полипептид согласно настоящему изобретению в образце (опухолевая ткань, нормальная ткань, и различные виды жидкостей организма, содержащие раковые или нормальные клетки (кровь, сыворотка, моча, слюна, и др.)) собранном от субъекта (пациент со злокачественным новообразованием или лица, которые могут быть поражены злокачественным новообразованием; однако это не ограничивается людьми), используя вышеописанные способы и наборы для обнаружения полинуклеотида, кодирующего гибридный полипептид согласно настоящему изобретению, и отбора субъекта в качестве пациента, которому будут назначать противораковое средство (как описано ниже), содержащее соединение, имеющее FGFR ингибирующую активность, если обнаруживают полинуклеотид, кодирующий гибридный полипептид согласно настоящему изобретению.
В настоящем изобретении, "FGFR ингибитор" и "соединение, имеющее FGFR ингибирующую активность" используются взаимозаменяемо, и относится к соединению, имеющему активность ингибировать активность вышеуказанного FGFR, специфически, одного или нескольких произвольных FGFR, относящихся к семейству FGFR, включающему FGFR1, FGFR2, FGFR3, и FGFR4, которые представляют собой рецепторы фактора роста фибробластов (FGFR), относящиеся к семейству рецепторной тирозинкиназы. Предпочтительно, они относятся к соединению, имеющему активность ингибировать активность FGFR человека, и более предпочтительно соединению, имеющему активность ингибировать активность FGFR3 человека, содержащего аминокислотную последовательность SEQ ID NO: 6 или 7 (кДНК последовательности, SEQ ID NOs: 10 и 11 соответственно/регистрационные номер GenBank №№ NM_001163213.1 и NM_000142.4 соответственно).
Любые FGFR ингибиторы включены в FGFR ингибиторы согласно настоящему изобретению при условии, что соединения имеют активность ингибировать FGFR активность.
Специфически, FGFR ингибиторы согласно настоящему изобретению включают любые соединения, антитела, лекарственные средства на основе нуклеиновых кислот (миРНК, антисмысловые нуклеиновые кислоты, рибозимы, и др.), имеющие механизм действия:
(1) ингибирование активности FGFR киназы;
(2) ингибирование димеризации между FGFR, ТАСС3, и BAIAP2L1;
(3) ингибирование передачи сигналов, опосредуемой FGFR (МАРK путь передачи сигналов и PI3K/AKT путь передачи сигналов) (например, МЕK ингибиторы, RAF ингибиторы, ERK ингибиторы, PI3K ингибиторы, mTOR ингибиторы, АKТ ингибиторы, PDK ингибиторы, S6K ингибиторы, и др.); или
(4) ингибирование экспрессии FGFR (например, миРНК, HSP90 ингибиторы, и др.).
Антитела, имеющие активность ингибировать FGFR активность, которые включены в качестве FGFR ингибиторов согласно настоящему изобретению, содержат антитела, идентифицируемые согласно следующим кодовым названиям: RG7444, FP-1039, AV370, и PRO-001.
Низкомолекулярные соединения, имеющие активность ингибировать FGFR активность, которые включены в качестве FGFR ингибиторов согласно настоящему изобретению, включают, например:
(1) соединения, описанные в следующем патентном документе и непатентных документах: Cancer Research, 2012, 72: 2045-2056; J. Med. Chem., 2011, 54: 7066-7083; международная публикация WO 2011/016528;
(2) соединения, идентифицируемые по следующим родовым названиями или кодовым названиям: AZD-4547 (соединение С в таблице 2-1, описанной ниже), BGJ-398 (соединение D в таблице 2-2, описанной ниже), LY-2874455, цедираниб (AZD2171; соединение Е в таблице 2-2, описанной ниже), PD173074 (соединение B в таблице 2-1, описанной ниже), регорафениб, понатиниб, орантиниб, нинтеданиб, мазитиниб, ленватиниб, довитиниб (TKI258; соединение F в таблице 2-2, описанной ниже), бриваниб, воласертиб, голватиниб, ENMD-2076, Е-3810, XL-999, XL-228, ARQ087, Тивозаниб, мотезаниб, и регорафениб; и
(3) соединения, представленные ниже; тем не менее, FGFR ингибиторы ими не ограничиваются:
[Соединение 1]
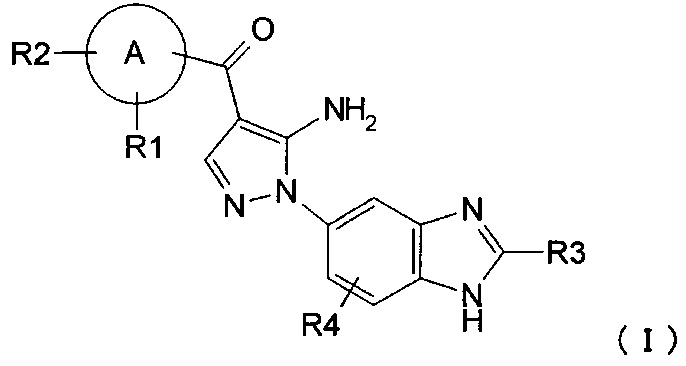
где R1, R2, R3 и R4 каждый независимо представляет собой группу, перечисленную ниже:
R1 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, С6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
R2 представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, С1-6 алкил, C2-6 алкенил, C2-6 алкинил, С3-7 циклоалкил, С6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3; или
R1 и R2, вместе с атомом, который с ними связан, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, где гетероциклил или гетероарил необязательно замещен галогеном;
R3 представляет собой водород, С1-5 алкил, С6-10 арил С1-6 алкил или C1-4 галоалкил;
R4 представляет собой водород, галоген, С1-3 алкил, C1-4 галоалкил, гидрокси, циано, нитро, C1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3;
А представляет собой 5-10-членное гетероарильное кольцо или С6-10 арильное кольцо;
R5 представляет собой С1-5 алкил, C3-7 циклоалкил, C3-7 циклоалкил С1-3 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, С1-3 алкокси C1-4 алкокси C1-4 алкил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, С6-10 арил, С6-10 арил С1-3 алкил, или 3-10-членный гетероциклил Сьз алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, 5-10-членный гетероарил С1-3 алкил, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил или С1-6 тригидрокси алкил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R6 и R7, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, С6-10 арил С1-3 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил, С1-6 тригидрокси алкил, 3-10-членный гетероциклил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, или циано(С1-3 алкил); или альтернативно R6 и R7, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
n представляет собой 1-3;
R8 и R9, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, или галоген; или альтернативно R8 и R9, вместе с атомом углерода, с которым они связаны, образуют циклоалифатическое кольцо;
Z1 представляет собой водород, NR10R11, -ОН, или 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R10 и R11, которые могут быть одинаковыми или разными, каждый представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, циано(С1-3 алкил), или С1-3 алкилсульфонил C1-4 алкил; или альтернативно R10 и R11, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R12 и R13, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, С6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, С6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, 3-10-членное циклоалифатическое кольцо, 5-10-членный гетероарил, или 3-10-членный гетероциклил; или альтернативно R12 и R13, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R14 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R15 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R16 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R17 представляет собой водород или C1-4 алкил;
R18 представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R19 представляет собой водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q;
R20 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил или 3-10-членный гетероциклил;
R21 представляет собой C1-4 алкил, С3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил или 3-10-членный гетероциклил;
R22 представляет собой водород, C1-4 алкил или C1-4 галоалкил;
R23 представляет собой водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил или 3-10-членный гетероциклил;
R24 представляет собой водород, C1-4 алкил или C1-4 галоалкил;
R25 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил или 3-10-членный гетероциклил;
R26 и R27, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкоксил C1-4 алкил, С6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, С6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-х - 10-ти членное циклоалифатическое кольцо; или альтернативно R26 и R27, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R28 и R29, которые могут быть одинаковыми или разными, каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкоксил C1-4 алкил, С6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, С6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-10-членное циклоалифатическое кольцо; или альтернативно R28 и R29, вместе с атомом азота, с которым они связаны, образуют 3-10-членный гетероциклил или 5-10-членный гетероарил;
R30 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил или 3-10-членный гетероциклил;
R31 представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил или 3-10-членный гетероциклил;
R32 представляет собой C1-4 алкил или С6-10 арил;
<группа Р>
галоген, C1-4 алкил, C1-4 галоалкил, -ОН, С1-3 алкокси, С1-3 галоалкокси, 3-10-членный гетероциклиламино, -SO2R16, -CN, -NO2, и 3-10-членный гетероциклил;
<группа Q>
галоген, C1-4 алкил, C1-4 галоалкил, -ОН, С1-3 алкокси, С1-6 моногидрокси алкил, С1-6 дигидрокси алкил, С1-6 тригидрокси алкил, 3-10-членный гетероциклил амин, -SO2R16, -CN, -NO2, С3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом.
[Соединение 2]
[Соединение 3]
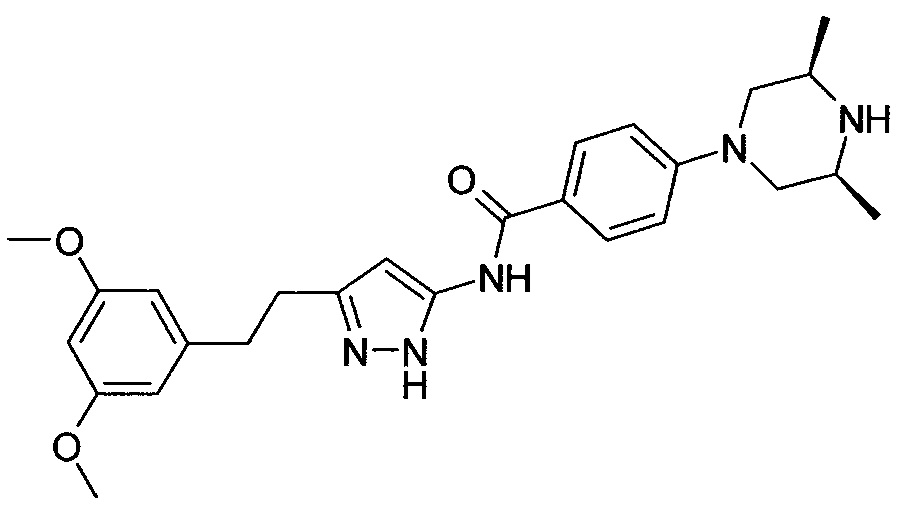
[Соединение 4]
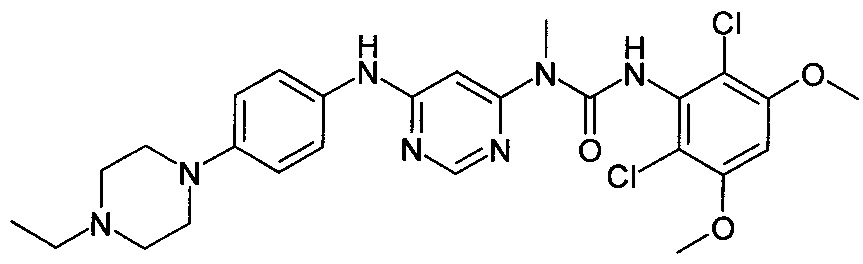
[Соединение 5]
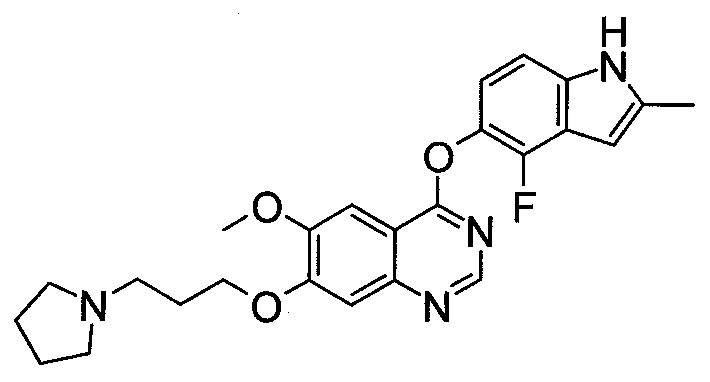 ;
;
или
[Соединение 6].
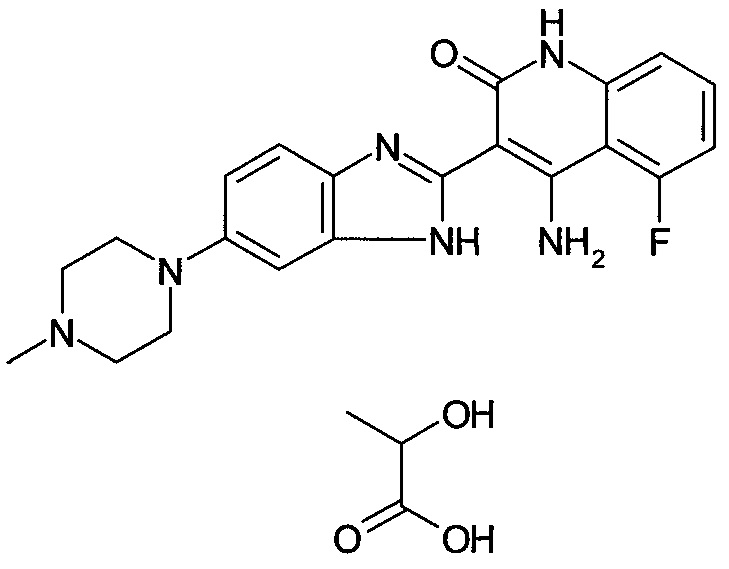
В настоящей заявке, "алкил" относится к моновалетной группе, имеющей происхождение из алифатического углеводорода путем удаления произвольного атом водорода. Он не содержит гетероатома или ненасыщенной углерод-углеродной связи в скелете, и имеет поднабор структур гидрокарбильной или углеводородной группы, которые содержат атомы водорода и углерода. Алкильная группа включает линейные и разветвленные структуры. Предпочтительные алкильные группы включают алкильные группы с одним - шестью атомами углерода (C1-6; далее в настоящей заявке, "Cp-q" обозначает, что количество атомов углерода составляет от р до q), С1-5 алкильные группы, C1-4 алкильные группы, и С1-3 алкильные группы.
Специфически, алкил включает, например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу, 2,3-диметилпропильную группу, 3,3-диметилбутильную группу, и гексильную группу.
В настоящей заявке, "алкенил" относится к моновалентной углеводородной группе, имеющей по меньшей мере одну двойную связь (два смежных SP2 атома углерода), и включает группы линейной и разветвленной форм. В зависимости от конфигурации двойной связи и заместителей (если они присутствуют), геометрия двойной связи может быть напротив (entgegen) (Е) или вместе (zusammen) (Z), или цис или транс конфигурация. Предпочтительные алкенильные группы включают С2-6 алкенильные группы.
Специфически, алкенил включает, например, винильную группу, аллильную группу, 1-пропенильную группу, 2-пропенильную группу, 1-бутенильную группу, 2-бутенил группа (включая цис и транс), 3-бутенильную группу, пентенильную группу, и гексенильную группу.
В настоящей заявке, "алкинил" относится к моновалентной углеводородной группе, имеющей по меньшей мере одну тройную связь (два смежных SP атома углерода), и включает группы линейной и разветвленной форм. Предпочтительные алкинильные группы включают С2-6 алкинильные группы.
Специфически, алкинил включает, например, этинильную группу, 1-пропинильную группу, пропаргильную группу, 3-бутинильную группу, пентинильную группу, и гексинильную группу.
Алкенил и алкинил могут иметь каждый одну, две или больше двойных связей или тройных связей.
В настоящей заявке, "циклоалкил" относится к насыщенной или частично насыщенной циклической моновалетной алифатической углеводородной группе, и включает моноциклические группы, бицикло кольца, и спиро кольца. Предпочтительный циклоалкил включает C3-7 циклоалкильные группы. Специфически, циклоалкильная группа включает, например, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, и циклогептильную группу.
В настоящей заявке, "циклоалкилалкил" относится к группу, в которой произвольный атом водорода "алкила", определенного выше, замещен "циклоалкилом", определенным выше. Предпочтительные циклоалкилалкильные группы включают C3-7 циклоалкилС1-3 алкил, и специфически включают, например, циклопропилметильная группа и циклопропилэтильную группу.
В настоящей заявке, "гетеро атом" относится к атому азота (N), атому кислорода (О), или атому серы (S).
В настоящей заявке, "галоген" относится к атому фтора, атому хлора, атому брома, или атому йода.
В настоящей заявке, "галоалкил" относится к группе, в которой предпочтительно от одного до девяти, более предпочтительно от одного до пяти идентичных или различных "атомов галогена", определенных выше, связаны с "алкилом", определенным выше.
Специфически, галоалкил включает, например, хлорметильную группу, дихлорметильную группу, трихлорметильную группу, фторметильную группу, дифторметильную группу, перфторалкильную группу (такую как трифторметильная группа и -CF2CF3) и 2,2,2-трифторэтильную группу.
В настоящей заявке, "алкокси" относится к окси группе, связанной с "алкилом", определенным выше. Предпочтительные алкокси включает C1-4 алкокси группы и С1-3 алкокси группы. Специфически, алкокси включает, например, метокси группу, этокси группу, 1-пропокси группу, 2-пропокси группу, н-бутокси группу, изо-бутокси группу, втор-бутокси группу, и трет-бутокси группу.
В настоящей заявке, "галоалкокси" относится к группе, в которой предпочтительно от одного до девяти, более предпочтительно от одного до пяти идентичных или различных атомов галогена, определенных выше, связаны с "алкокси", как определено выше.
Специфически, галоалкокси включает, например, хлорметокси группу, трихлорметокси группу, и трифторметокси группу.
В настоящей заявке, "арил" относится к моновалентному ароматическому углеродному кольцу, арил предпочтительно включает С6-10 арил. Специфически, арил включает, например, фенильную группу и нафтильную группу (например, 1-нафтильную группу и 2-нафтильную группу).
В настоящей заявке, "алициклическое кольцо" относится к моновалентному не-ароматическому углеродному кольцу. Алициклическое кольцо может иметь ненасыщенные связи в своем кольце, и может представлять собой моноциклическую группу, имеющую два или больше колец. Атомы углерода, составляющие кольцо, могут быть окислены с образованием карбонила. Количество атомов, составляющее алициклическое кольцо, предпочтительно находится в интервале от трех до десяти (3-10-членное алифатическое кольцо). Алициклическое кольцо включает, например, циклоалкильные кольца, циклоалкенильные кольца, и циклоалкинильные кольца.
В настоящей заявке, "гетероарил" относится к моновалентной ароматической гетероциклической группе, в которой атомы, составляющие кольцо, включают предпочтительно один - пять гетероатомов. Гетероарил может быть частично насыщенным, и может представлять собой моноциклическое или конденсированное кольцо (например, бициклический гетероарил, конденсированный с бензольным кольцом или моноциклическое гетероарильное кольцо). Количество атомов, составляющих кольцо, предпочтительно находится в диапазоне от пяти до десяти (5-10-членный гетероарил).
Специфически, гетероарил включает, например, фурильную группу, тиенильную группу, пирролильную группу, имидазолильную группу, пиразолильную группу, тиазолильную группу, изотиазолильную группу, оксазолильную группу, изооксазолильную группу, оксадиазолильную группу, тиадиазолильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиримидильную группу, пиридазинильную группу, пиразинильную группу, триазинильную группу, бензофуранильную группу, бензотиенильную группу, бензотиадиазолильную группу, бензотиазолильную группу, бензоксазолильную группу, бензоксадиазолильную группу, бензоимидазолильную группу, индолильную группу, изоиндолильную группу, азаиндолильную группу, индазолильную группу, хинолильную группу, изохинолильную группу, циннолинильную группу, хиназолинильную группу, хиноксалинильную группу, бензодиоксолильную группу, индолидинильную группу, и имидазопиридильную группу.
В настоящей заявке, "гетероциклил" относится к неароматической моновалентной гетероциклической группе, в которой атомы, составляющие кольцо, включают предпочтительно один-пять гетероатомов. Гетероциклил может содержать двойные или тройные связи в своем кольце. Атомы углерода могут быть окислены, образуя карбонил. Кольцо может быть моноциклическим или конденсированным кольцом. Количество атомов, составляющих кольцо, предпочтительно находится в диапазоне от трех до десяти (3-10-членный гетероциклил).
Специфически, гетероциклил включает, например, оксетанильную группу, дигидрофурильную группу, тетрагидрофурильную группу, дигидропиранильную группу, тетрагидропиранильную группу, тетрагидропиридильную группу, морфолинильную группу, тиоморфолинильную группу, пирролидинильную группу, пиперидинильную группу, пиперазинильную группу, пиразолидинильную группу, имидазолинильную группу, имидазолидинильную группу, оксазолидинильную группу, изооксазолидинильную группу, тиазолидинильную группу, изотиазолидинильную группу, тиадиазолидинильную группу, азетидинильную группу, оксазолидоновую группу, бензодиоксанильную группу, бензоксазолильную группу, диоксоланильную группу, и диоксанильную группу.
В настоящей заявке, "арилалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "арилом", определенным выше. Арилалкил предпочтительно включает С6-10 арил C1-4 алкил и С6-10 арил С1-3 алкил. Специфически, арилалкил включает, например, бензильную группу, фенетильную группу, и нафтилметильную группу.
В настоящей заявке, "гетероарилалкил" относится к группе, в которой произвольный атом водорода в алкиле, определенном выше, замещен "гетероарилом", определенным выше. Гетероарилалкил предпочтительно включает 5-10-членный гетероарил С1-3 алкил. Специфически, гетероарилалкил включает, например, пирролилметильную группу, имидазолилметильную группу, тиенилметильную группу, пиридилметильную группу, пиримидилметильную группу, хинолилметильную группу, и пиридилэтильную группу.
В настоящей заявке, "гетероциклилалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "гетероциклилом", определенным выше. Гетероциклилалкил предпочтительно включает 3-10-членный гетероциклил С1-3 алкил. Специфически, гетероциклилалкил включает, например, морфолинилметильную группу, морфолинилэтильную группу, тиоморфолинилметильную группу, пирролидинилметильную группу, пиперидинилметильную группу, пиперазинилметильную группу, пиперазинилэтильную группу, и оксетанилметильную группу.
В настоящей заявке, "моногидроксиалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен гидроксильной группой. Моногидроксиалкил предпочтительно включает С1-6 моногидроксиалкил и С2-6 моногидроксиалкил. Специфически, моногидроксиалкил включает, например, гидроксиметильную группу, 1-гидроксиэтильную группу, и 2-гидроксиэтильную группу.
В настоящей заявке, "дигидроксиалкил" относится к группе, в которой два произвольных атома водорода в "алкиле", определенном выше, замещены двумя гидроксильными группами. Дигидроксиалкил предпочтительно включает С1-6 дигидроксиалкил и С2-6 дигидроксиалкил. Специфически, дигидроксиалкил включает, например, 1,2-дигидроксиэтильную группу, 1,2-дигидроксипропильную группу, и 1,3-дигидроксипропильную группу.
В настоящей заявке, "тригидроксиалкил" относится к группе, в которой три произвольных атома водорода в "алкиле", определенном выше, замещены тремя гидроксильными группами. Тригидроксиалкил предпочтительно включает С1-6 тригидроксиалкил и C2-6 тригидроксиалкил.
В настоящей заявке, "алкоксиалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "алкокси", определенным выше. Алкоксиалкил предпочтительно включает С1-3 алкокси C1-4 алкил и С1-3 алкокси С2-4 алкил. Специфически, алкоксиалкил включает, например, метоксиэтил.
В настоящей заявке, "алкоксиалкоксиалкил" относится к группе, в которой произвольный атом водорода в терминальном алкиле "алкоксиалкила", определенного выше, замещен "алкокси", определенным выше. Алкоксиалкоксиалкил предпочтительно включает С1-3 алкокси C1-4 алкокси C1-4 алкил и С1-3 алкокси С2-4 алкокси С2-4 алкил.
В настоящей заявке, "аминоалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен амино группой. Аминоалкильная группа предпочтительно включает C1-4 аминоалкил и С2-4 аминоалкил.
В настоящей заявке, "алкиламино" относится к аминогруппе, связанной с "алкилом", определенным выше. Алкиламино предпочтительно включает C1-4 алкиламино.
В настоящей заявке, "диалкиламино" относится к аминогруппе, связанной с двумя "алкилами", определенными выше. Две алкильные группы могут быть одинаковыми или различными. Диалкиламино предпочтительно включает ди(C1-4 алкил)амино.
В настоящей заявке, "алкиламиноалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "алкиламино", определенным выше. Алкиламиноалкил предпочтительно включает C1-4 алкиламино C1-4 алкил и C1-4 алкиламино С2-4 алкил.
В настоящей заявке, "диалкиламиноалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "диалкиламино", определенным выше. Диалкиламиноалкил предпочтительно включает ди(C1-4 алкил)амино C1-4 алкил и ди(C1-4 алкил)амино С2-4 алкил.
В настоящей заявке, "гетероциклиламино" относится к аминогруппе, связанной с "гетероциклилом", определенным выше. Гетероциклиламино предпочтительно включает 3-10-членный гетероциклиламино.
В настоящей заявке, "цианоалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен циано группой. Цианоалкил предпочтительно включает циано(С1-3 алкил).
В настоящей заявке, "алкилсульфонил" относится к сульфонильной группе, связанной с "алкилом", определенным выше (то есть алкил-SO2-). Алкилсульфонил предпочтительно включает С1-3 алкилсульфонил. Специфически, алкилсульфонил включает метилсульфонил, этилсульфонил, н-пропилсульфонил, и изо-пропилсульфонил.
В настоящей заявке, "алкилсульфонилалкил" относится к группе, в которой произвольный атом водорода в "алкиле", определенном выше, замещен "алкилсульфонилом", определенным выше. Алкилсульфонилалкил предпочтительно включает С1-3 алкилсульфонил C1-4 алкил и С1-3 алкилсульфонил С2-4 алкил.
Предпочтительно, соединения, представленные формулой (I), указанной выше, являются следующими:
R1, указанный выше, предпочтительно представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, С1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-7 циклоалкил, С6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3.
R1, указанный выше, более предпочтительно представляет собой водород, гидрокси, галоген, циано, C1-4 галоалкил, С1-6 алкил, С2-6 алкинил, C3-7 циклоалкил, С6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SO2R16, -NR17SO2R18, COOH, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. Специфически, вышеуказанный 5-10-членный гетероарил особенно предпочтительно представляет собой имидазолильную группу, тиенильную группу, пиридильную группу, пиридазинильную группу, или пиразолильную группу. Вышеуказанный 3-10-членный гетероциклил особенно предпочтительно представляет собой морфолинильную группу, тетрагидропиридильную группу, или пиперидинильную группу.
R2, указанный выше, предпочтительно представляет собой водород, гидрокси, галоген, циано, нитро, C1-4 галоалкил, С1-6 алкил, С2-6 алкенил, С2-6 алкинил, С3-7 циклоалкил, С6-10 арил C1-4 алкил, -OR5, -NR6R7, -(CR8R9)nZ1, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, -NR17SO2R18, COOH, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30, -SO3R31 или -Si(R32)3.
R2, указанный выше, более предпочтительно представляет собой водород, галоген, C1-4 галоалкил, С1-6 алкил, -OR5, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. Специфически, этот 5-10-членный гетероарил особенно предпочтительно представляет собой пиридильную группу.
R1 и R2, указанные выше, предпочтительно могут вместе с атомами, к которым они присоединены, образовывать 3-10-членный гетероциклил или 5-10-членный гетероарил. Гетероциклил или гетероарил может иметь атом галогена в качестве заместителя. Специфически, 3-10-членный гетероциклил, образованный вместе с атомами, к которым присоединены R1 и R2, особенно предпочтительно представляет собой диоксоланильную группу или диоксанильную группу.
R3, указанный выше, предпочтительно представляет собой водород, С1-5 алкил, С6-10 арил С1-6 алкил, или C1-4 галоалкил, более предпочтительно водород, C1-4 алкил, С6-10 арил C1-4 алкил, или C1-3перфторалкил и особенно предпочтительно C1 алкил.
R4, указанный выше, предпочтительно представляет собой водород, галоген, С1-3 алкил, C1-4 галоалкил, гидрокси, циано, нитро, C1-4 алкокси, -(CH2)nZ1, -NR6R7, -OR5, -C(O)NR12R13, -SR14, -SOR15, -SO2R16, NR17SO2R18, COOH, -COR19, -COOR20, -OC(O)R21, -NR22C(O)R23, -NR24C(S)R25, -C(S)NR26R27, -SO2NR28R29, -OSO2R30-SO3R31 или -Si(R32)3.
R4, указанный выше, более предпочтительно представляет собой водород, галоген, С1-3 алкил, С1-3 перфторалкил, циано, метансульфонил, гидроксил, алкокси, или амино, и особенно предпочтительно водород или галоген.
Кольцо А, указанное выше, предпочтительно представляет собой 5-10-членное гетероарильное кольцо или С6-10 арильное кольцо, более предпочтительно бензол, индол, азаиндол, бензофуран, бензотиофен, бензотиазол, хинолин или пиррол и особенно предпочтительно индол или пиррол.
R5, указанный выше, предпочтительно представляет собой С1-5 алкил, С3-7 циклоалкил, С3-7 циклоалкил С1-3 алкил, С2-6 алкенил, С2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, C1-4 алкокси C1-4 алкокси C1-4 алкил, C1-4 амино алкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, С6-10 арил, С6-10 арил С1-3 алкил, или 3-10-членный гетероциклил С1-3 алкил, 3-10-членный гетероциклил, 5-10-членный гетероарил, или 5-10-членный гетероарил С1-3 алкил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, С1-6 моногидроксиалкил, С1-6 дигидроксиалкил, или С1-6 тригидроксиалкил.
R5, указанный выше, более предпочтительно представляет собой С1-5 алкил, C3-7 циклоалкил С1-3 алкил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, С6-10 арил, С6-10 арил С1-3 алкил, или 3-10-членный гетероциклил С1-3 алкил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. Специфически, вышеуказанный 3-10-членный гетероциклилалкил особенно предпочтительно представляет собой пиперазинилэтильную группу, оксетанилметильную группу, или морфолинилэтильную группу. Вышеуказанный 3-10-членный гетероциклил особенно предпочтительно представляет собой оксетанильную группу или тетрагидропиранильную группу.
R6 и R7, указанные выше, могут быть одинаковыми или различными, и каждый предпочтительно представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси С2-4 алкил, С6-10 арил С1-3 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, С1-6 моногидроксиалкил, С1-6 дигидроксиалкил, С1-6 тригидроксиалкил, 3-10-членный гетероциклил, C1-4 аминоалкил, C1-4 алкиламино C1-4 алкил, ди(C1-4 алкил)амино C1-4 алкил, или циано(С1-3 алкил).
R6 и R7, указанные выше, более предпочтительно каждый независимо представляют собой водород, С1-3 алкокси C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, или С1-6 дигидроксиалкил. Специфически, 3-10-членный гетероциклилалкил особенно предпочтительно представляет собой морфолинилэтильную группу, и 5-10-членный гетероарилалкил особенно предпочтительно представляет собой пиридилэтильную группу.
Альтернативно, R6 и R7, указанные выше, предпочтительно могут вместе с атомами азота, к которым они присоединены, образовывать 3-10-членный гетероциклил или 5-10-членный гетероарил.
"n", указанный выше, представляет собой целое число 1-3.
Предпочтительно n равно 1.
R8 и R9, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый представляет собой водород, C1-4 алкил, или галоген, и более предпочтительно водород.
Альтернативно, R8 и R9, указанные выше, предпочтительно могут вместе с атомами углерода, к которым они присоединены, образовывать алициклическое кольцо.
Z1, указанный выше, предпочтительно представляет собой водород, NR10R11, -ОН, или 3-10-членный гетероциклил или 5-10-членный гетероарил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, более предпочтительно NR10R11 или -ОН, или 3-10-членный гетероциклил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. Специфически, вышеуказанный 3-10-членный гетероциклил особенно предпочтительно представляет собой пирролидинильную группу, пиперазинильную группу, пиперидинильную группу, или морфолинильную группу.
R10 и R11, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый предпочтительно представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, циано(С1-3 алкил), или С1-3 алкилсульфонил C1-4 алкил, более предпочтительно C1-4 алкил, C2-6 алкинил, или С1-3 алкокси С2-4 алкил.
Альтернативно, R10 и R11, указанные выше, предпочтительно могут вместе с атомами азота, к которым они присоединены, образовывать 3-10-членный гетероциклил или 5-10-членный гетероарил.
R12 и R13, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, С6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, С6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-10-членное алициклическое кольцо, более предпочтительно водород, C1-4 алкил, или C1-4 галоалкил.
Альтернативно, R12 и R13, указанные выше, предпочтительно могут образовывать вместе с атомами азота, к которым они присоединены, 3-10-членный гетероциклил или 5-10-членный гетероарил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и особенно предпочтительно 3-10-членный гетероциклилалкил. Специфически, пиперазинильная группа, морфолинильная группа, пирролидинильная группа, и пиперидинильная группа являются более предпочтительными.
R14, указанный выше, предпочтительно представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и более предпочтительно представляет собой C1-4 алкил или C1-4 галоалкил.
R15, указанный выше, предпочтительно представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q.
R16, указанный выше, предпочтительно представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и более предпочтительно представляет собой C1-4 алкил.
R17, указанный выше, предпочтительно представляет собой водород или C1-4 алкил, и более предпочтительно водород.
R18, указанный выше, предпочтительно представляет собой C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С6-10 арил, который необязательно замещен одной или несколькими группами, независимо выбранными из группы Р, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и более предпочтительно представляет собой C1-4 алкил.
R19, указанный выше, предпочтительно представляет собой водород, C1-4 алкил, С3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q, и более предпочтительно представляет собой водород, или 5-10-членный гетероарил или 3-10-членный гетероциклил, каждый из которых необязательно замещен одной или несколькими группами, независимо выбранными из группы Q. Специфически, этот 3-10-членный гетероциклил более предпочтительно представляет собой пиперазинильную группу, морфолинильную группу, пирролидинильную группу, или пиперидинильную группу.
R20, указанный выше, предпочтительно представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R21, указанный выше, предпочтительно представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R22, указанный выше, предпочтительно представляет собой водород, C1-4 алкил, или C1-4 галоалкил.
R23, указанный выше, предпочтительно представляет собой водород, C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R24, указанный выше, предпочтительно представляет собой водород, C1-4 алкил, или C1-4 галоалкил.
R25, указанный выше, предпочтительно представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R26 и R27, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, С6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, С6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-10-членное алициклическое кольцо.
Альтернативно, R26 и R27, указанные выше, предпочтительно могут вместе с атомами азота, к которым они присоединены, образовывать 3-10-членный гетероциклил или 5-10-членный гетероарил.
R28 и R29, указанные выше, предпочтительно могут быть одинаковыми или разными, и каждый представляет собой водород, C1-4 алкил, C2-6 алкенил, C2-6 алкинил, C1-4 галоалкил, С1-3 алкокси C1-4 алкил, С6-10 арил, 5-10-членный гетероарил, 3-10-членный гетероциклил, С6-10 арил C1-4 алкил, 3-10-членный гетероциклил С1-3 алкил, 5-10-членный гетероарил С1-3 алкил, циано(С1-3 алкил), С1-3 алкилсульфонил C1-4 алкил, или 3-10-членное алициклическое кольцо.
Альтернативно, R28 и R29, указанные выше, предпочтительно могут образовывать вместе с атомами азота, к которым они присоединены, 3-10-членный гетероциклил или 5-10-членный гетероарил.
R30, указанный выше, предпочтительно представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R31, указанный выше, предпочтительно представляет собой C1-4 алкил, C3-7 циклоалкил, C1-4 галоалкил, С6-10 арил, 5-10-членный гетероарил, или 3-10-членный гетероциклил.
R32, указанный выше, предпочтительно представляет собой C1-4 алкил, или С6-10 арил.
Предпочтительные заместители, включенные в группу Р, определенную выше, представляют собой галоген, C1-4 алкил, C1-4 галоалкил, -ОН, C1-3 алкокси, C1-3 галоалкокси, 3-10-членный гетероциклиламино, -SO2R, -CN, -NO2, и 3-10-членный гетероциклил; и более предпочтительно галоген, C1-4 галоалкил, C1-3 алкокси, C1-3 галоалкокси, и 3-10-членный гетероциклил. Специфически, этот 3-10-членный гетероциклил особенно предпочтительно представляет собой морфолинильную группу.
Предпочтительные заместители, включенные в группу Q, определенную выше, представляют собой галоген, C1-4 алкил, C1-4 галоалкил, -ОН, C1-3 алкокси, C1-6 моногидроксиалкил, C1-6 дигидроксиалкил, C1-6 тригидроксиалкил, 3-10-членный гетероциклиламино, -SO2R, -CN, -NO2, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом; и более предпочтительно галоген, C1-4 алкил, C1-4 галоалкил, -ОН, C1-3 алкокси, C1-6 моногидроксиалкил, -SO2R16, C3-7 циклоалкил, -COR19, и 3-10-членный гетероциклил, который необязательно замещен C1-4 алкилом. Специфически, этот 3-10-членный гетероциклил более предпочтительно представляет собой пиперазинильную группу, пиперидинильную группу, или морфолинильную группу.
Специфические примеры соединений включают:
(1) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(2) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пирролидин-1-илметил-1Н-индол-2-ил)-метанон;
(3) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-гидрокси-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(4) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-пирроло[3,2-с]пиридин-2-ил)-метанон;
(5) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиперазин-1-илметил-1Н-индол-2-ил)-метанон;
(6) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-морфолин-4-ил-этокси)-1Н-индол-2-ил]-метанон;
(7) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(тетрагидро-пиран-4-илокси)-1Н-индол-2-ил]-метанон;
(8) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-хлор-1Н-индол-2-ил)-метанон;
(9) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бром-1Н-индол-2-ил)-метанон;
(10) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-йод-1Н-индол-2-ил)-метанон;
(11) 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-5-карбонитрил;
(12) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бром-5-фтор-1Н-индол-2-ил)-метанон;
(13) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-этинил-1Н-индол-2-ил)-метанон;
(14) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-фтор-фенил)-1Н-индол-2-ил]-метанон;
(15) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-фтор-фенил)-1Н-индол-2-ил]-метанон;
(16) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-фтор-фенил)-1Н-индол-2-ил]-метанон;
(17) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-хлор-фенил)-1Н-индол-2-ил]-метанон;
(18) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-хлор-фенил)-1Н-индол-2-ил]-метанон;
(19) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-хлор-фенил)-1Н-индол-2-ил]-метанон;
(20) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(21) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(22) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(23) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-бром-1Н-индол-2-ил)-метанон;
(24) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-фтор-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(25) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метил-1Н-индол-2-ил)-метанон;
(26) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4,4-дифтор-пиперидин-1-карбонил)-1Н-индол-2-ил]-метанон;
(27) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3-дифтор-пиперидин-1-карбонил)-1Н-индол-2-ил]-метанон;
(28) (2,2,2-трифтор-этил)-амид 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-5-карбоновой кислоты;
(29) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-трифторметил-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(30) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-трифторметил-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(31) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-хлор-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(32) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-метил-пиридин-2-ил)-1Н-индол-2-ил]метанон;
(33) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-хлор-4-фтор-фенил)-1Н-индол-2-ил]-метанон;
(34) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-трифторметил-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(35) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-трифторметил-пиридин-2-ил)-1Н-индол-2-ил]метанон;
(36) [5-амино-1-(6-фтор-2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(37) 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-6-карбоновая кислота;
(38) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-гидроксиметил-1Н-индол-2-ил)-метанон;
(39) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-{6-[2-(4-метил-пиперазин-1-ил)-этокси]-1Н-индол-2-ил}-метанон;
(40) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-метил-оксетан-3-илметокси)-1Н-индол-2-ил]-метанон;
(41) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-фтор-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(42) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-{[бис(2-метокси-этил)-амино]-метил}-1Н-индол-2-ил)-метанон;
(43) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-{6-[(метил-проп-2-инил-амино)-метил]-1Н-индол-2-ил}-метанон;
(44) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3,3-дифтор-пирролидин-1-илметил)-1Н-индол-2-ил]-метанон;
(45) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2,5-диметил-пирролидин-1-илметил)-1Н-индол-2-ил]-метанон;
(46) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3,3-дифтор-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(47) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-((S)-3-метил-морфолин-4-илметил)-1Н-индол-2-ил]-метанон;
(48) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бром-1Н-индол-2-ил)-метанон;
(49) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-йод-1Н-индол-2-ил)-метанон;
(50) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-пирроло[3,2-b]пиридин-2-ил)-метанон;
(51) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бром-6-трифторметил-1Н-индол-2-ил)-метанон;
(52) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-йод-1Н-индол-2-ил)-метанон;
(53) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-метил-1Н-индол-2-ил)-метанон;
(54) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-изопропил-1Н-индол-2-ил)-метанон;
(55) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2-фтор-фенил)-1Н-индол-2-ил]-метанон;
(56) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бензил-1Н-индол-2-ил)-метанон;
(57) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(58) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3-фторфенил)-1Н-индол-2-ил]-метанон;
(59) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(60) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-этинил-1Н-индол-2-ил)-метанон;
(61) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5Н-[1,3]диоксоло[4,5-f]индол-6-ил)-метанон;
(62) [5-амино-1-(7-фтор-2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(63) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-трифторметил-фенил)-1Н-индол-2-ил]-метанон;
(64) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бутокси-1Н-индол-2-ил)-метанон;
(65) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-метил-пиперидин-4-ил)-1Н-индол-2-ил]метанон;
(66) N-{2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-6-ил}-метансульфонамид;
(67) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-морфолин-4-ил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(68) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бутил-1Н-индол-2-ил)-метанон;
(69) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(1-метил-1Н-пиразол-4-ил)-1Н-индол-2-ил]-метанон;
(70) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-метокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(71) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-метокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(72) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-циклопропил-1Н-индол-2-ил)-метанон;
(73) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-метокси-фенил)-1Н-индол-2-ил]-метанон;
(74) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фенил-1Н-индол-2-ил)-метанон;
(75) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-метансульфонил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(76) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-изопропил-1Н-индол-2-ил)-метанон;
(77) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиридин-2-ил-1Н-индол-2-ил)-метанон;
(78) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-циклопропил-1Н-индол-2-ил)-метанон;
(79) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиридазин-3-ил-1Н-индол-2-ил)-метанон;
(80) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-изопропокси-1Н-индол-2-ил)-метанон;
(81) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2-метокси-этокси)-1Н-индол-2-ил]-метанон;
(82) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-циклопропилметокси-1Н-индол-2-ил)-метанон;
(83) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(2,2-дифтор-5Н-[1,3]диоксоло[4,5-f]индол-6-ил)-метанон;
(84) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-хлор-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(85) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-фтор-пиридин-2-ил)-1Н-индол-2-ил]-метанон;
(86) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-морфолин-4-ил-пиридазин-3-ил)-1Н-индол-2-ил]-метанон;
(87) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-хлор-6-циклопропилметокси-1Н-индол-2-ил)-метанон;
(88) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2,4-дифтор-фенил)-1Н-индол-2-ил]-метанон;
(89) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиридазин-4-ил-1Н-индол-2-ил)-метанон;
(90) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(3-фтор-1Н-индол-2-ил)-метанон;
(91) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-изопропил-пиперидин-4-ил)-6-трифторметил-1Н-индол-2-ил]-метанон;
(92) 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-6-карбонитрил;
(93) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1,2,3,6-тетрагидро-пиридин-4-ил)-1Н-индол-2-ил]-метанон;
(94) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пиперидин-4-ил-1Н-индол-2-ил)-метанон;
(95) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-((R)-3-фтор-пирролидин-1-илметил)-1Н-индол-2-ил]-метанон;
(96) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фтор-5-пиперидин-4-ил-1Н-индол-2-ил)-метанон;
(97) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-фтор-5-(1-метил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(98) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-изопропил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(99) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-фтор-5-(1-изопропил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(100) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиридин-3-ил-1Н-индол-2-ил)-метанон;
(101) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(6-морфолин-4-ил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(102) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пиридин-3-ил-1Н-индол-2-ил)-метанон;
(103) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(6-пиперазин-1-ил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(104) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(6-гидрокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(105) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-фтор-5-(4-метил-пиперазин-1-илметил)-1Н-индол-2-ил]-метанон;
(106) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фтор-5-пирролидин-1-илметил-1Н-индол-2-ил)-метанон;
(107) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(1-метил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(108) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-морфолин-4-ил-фенил)-1Н-индол-2-ил]-метанон;
(109) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3,4,5,6-тетрагидро-2Н-[1,2']бипиридин-5'-ил)-1Н-индол-2-ил]-метанон;
(110) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-пиперазин-1-ил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(111) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(6-метокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(112) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-((S)-3-метил-морфолин-4-илметил)-1Н-индол-2-ил]-метанон;
(113) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-((R)-3-фтор-пирролидин-1-илметил)-1Н-индол-2-ил]-метанон;
(114) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2,5-диметил-пирролидин-1-илметил)-1Н-индол-2-ил]-метанон;
(115) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3-фтор-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(116) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3-дифтор-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(117) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-{6-[2-(4-метил-пиперазин-1-ил)пиридин-4-ил]-1Н-индол-2-ил}-метанон;
(118) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-пиридин-4-ил-1Н-индол-2-ил)-метанон;
(119) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-фторпиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(120) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4,4-дифтор-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(121) [5-амино-1-(2-дифторметил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-метил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(122) [5-амино-1-(2-дифторметил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(123) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3-дифтор-пирролидин-1-илметил)-1Н-индол-2-ил]-метанон;
(124) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-циклопентил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(125) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(1-циклогексил-пиперидин-4-ил)-1Н-индол-2-ил]-метанон;
(126) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-бром-1Н-пиррол-2-ил)-метанон;
(127) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-пиррол-2-ил)-метанон;
(128) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-фенил-1Н-пиррол-2-ил)-метанон;
(129) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(3-хлор-фенил)-1Н-пиррол-2-ил]-метанон;
(130) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(4-фтор-фенил)-1Н-пиррол-2-ил]-метанон;
(131) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(3-фтор-фенил)-1Н-пиррол-2-ил]-метанон;
(132) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-морфолин-4-илметил-1Н-индол-2-ил)-метанон;
(133) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2-морфолин-4-ил-этиламино)-1Н-индол-2-ил]-метанон;
(134) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-метил-пиперазин-1-карбонил)-1Н-индол-2-ил]-метанон;
(135) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-морфолин-4-ил-этиламино)-1Н-индол-2-ил]-метанон;
(136) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(пиперазин-1-карбонил)-1Н-индол-2-ил]-метанон;
(137) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2-метокси-этиламино)-1Н-индол-2-ил]-метанон;
(138) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2-гидрокси-1-гидроксиметил-этиламино)-1Н-индол-2-ил]-метанон;
(139) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2-пиридин-4-ил-этиламино)-1Н-индол-2-ил]-метанон;
(140) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-метокси-этиламино)-1Н-индол-2-ил]-метанон;
(141) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-морфолин-4-ил-1Н-индол-2-ил)-метанон;
(142) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-морфолин-4-ил-1Н-индол-2-ил)-метанон;
(143) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-морфолин-4-илметил-1Н-индол-2-ил)-метанон;
(144) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-морфолин-4-илметил-1Н-индол-2-ил)-метанон;
(145) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(морфолин-4-карбонил)-1Н-индол-2-ил]-метанон;
(146) [5-амино-1-(2-изопропил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(147) [5-амино-1-(2-пропил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(148) [5-амино-1-(1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(149) [5-амино-1-(2-трифторметил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(150) [5-амино-1-(2-этил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)-метанон;
(151) [5-амино-1-(2-бензил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-2-ил)метанон;
(152) 1-(4-{2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-5-илметил}-пиперазин-1-ил)-этанон;
(153) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-метансульфонил-пиперазин-1-илметил)-1Н-индол-2-ил]-метанон;
(154) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пиперазин-1-илметил-1Н-индол-2-ил)-метанон;
(155) 1-(4-{2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-6-илметил}-пиперазин-1-ил)-этанон;
(156) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-метил-пиперазин-1-илметил)-1Н-индол-2-ил]-метанон;
(157) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(4-метил-пиперазин-1-илметил)-1Н-индол-2-ил]-метанон;
(158) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-пирролидин-1-илметил-1Н-индол-2-ил)-метанон;
(159) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-фтор-1Н-индол-2-ил)-метанон;
(160) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фтор-1Н-индол-2-ил)-метанон;
(161) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фтор-1Н-индол-2-ил)-метанон;
(162) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-пирроло[2,3-b]пиридин-2-ил)-метанон;
(163) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фтор-6-морфолин-4-илметил-1Н-индол-2-ил)-метанон;
(164) 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-5-карбоновая кислота;
(165) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-метокси-1Н-индол-2-ил)-метанон;
(166) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,6-диметокси-1Н-индол-2-ил)-метанон;
(167) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-метокси-1Н-индол-2-ил)-метанон;
(168) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метокси-1Н-индол-2-ил)-метанон;
(169) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,6-диметил-1Н-индол-2-ил)-метанон;
(170) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трет-бутил-1Н-индол-2-ил)-метанон;
(171) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-изопропил-1Н-индол-2-ил)-метанон;
(172) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бензилокси-1Н-индол-2-ил)-метанон;
(173) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-бензилокси-1Н-индол-2-ил)-метанон;
(174) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5,6-диметокси-1Н-индол-2-ил)-метанон;
(175) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-трет-бутил-1Н-индол-2-ил)-метанон;
(176) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фтор-4-трифторметил-1Н-индол-2-ил)-метанон;
(177) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фенокси-1Н-индол-2-ил)-метанон;
(178) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метилсульфанил-1Н-индол-2-ил)-метанон;
(179) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-трет-бутил-1Н-индол-2-ил)-метанон;
(180) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-метил-1Н-индол-2-ил)-метанон;
(181) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-этил-1Н-индол-2-ил)-метанон;
(182) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-фтор-6-трифторметил-1Н-индол-2-ил)-метанон;
(183) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-фтор-5-метокси-1Н-индол-2-ил)-метанон;
(184) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-хлор-5-метокси-1Н-индол-2-ил)-метанон;
(185) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-хлор-6-метокси-1Н-индол-2-ил)-метанон;
(186) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-изопропокси-1Н-индол-2-ил)-метанон;
(187) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бензилокси-1Н-индол-2-ил)-метанон;
(188) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-изопропокси-1Н-индол-2-ил)-метанон;
(189) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(2,3-дигидро-6Н-[1,4]диоксино[2,3-f]индол-7-ил)-метанон;
(190) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,6-ди-трет-бутил-1Н-индол-2-ил)-метанон;
(191) 2-[5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-карбонил]-1Н-индол-4-карбонитрил;
(192) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-имидазол-1-ил-1Н-индол-2-ил)-метанон;
(193) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трифторметилсульфанил-1Н-индол-2-ил)-метанон;
(194) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-метилсульфанил-1Н-индол-2-ил)-метанон;
(195) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-метансульфонил-1Н-индол-2-ил)-метанон;
(196) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4,4-дифтор-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(197) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-фтор-пиперидин-1-илметил)-1Н-индол-2-ил]-метанон;
(198) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(оксетан-3-илокси)-1Н-индол-2-ил]-метанон;
(199) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-гидрокси-1Н-индол-2-ил)-метанон;
(200) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-метансульфонил-1Н-индол-2-ил)-метанон;
(201) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дибром-1Н-пиррол-2-ил)-метанон;
(202) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дифенил-1Н-пиррол-2-ил)-метанон; и
(203) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дипиридин-3-ил-1Н-пиррол-2-ил)-метанон.
(204) [5-амино-1-(2-метил-3Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-хлор-1Н-индол-2-ил)-метанон;
(205) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-хлор-1Н-индол-2-ил)-метанон;
(206) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-3-ил)-метанон;
(207) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(1Н-индол-6-ил)-метанон;
(208) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бром-6-фтор-1Н-индол-2-ил)-метанон;
(209) [5-амино-1-(2-этил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-бром-6-фтор-1Н-индол-2-ил)-метанон;
(210) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трифторметил-1Н-индол-2-ил)-метанон;
(211) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трифторметокси-1Н-индол-2-ил)-метанон;
(212) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,6-дихлор-1Н-индол-2-ил)-метанон;
(213) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бром-4-фтор-1Н-индол-2-ил)-метанон;
(214) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-трифторметокси-1Н-индол-2-ил)-метанон;
(215) [5-амино-1-(2-этил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трифторметокси-1Н-индол-2-ил)-метанон;
(216) [5-амино-1-(2-этил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5-трифторметил-1Н-индол-2-ил)-метанон;
(217) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(5,6-дихлор-1Н-индол-2-ил)-метанон;
(218) [5-амино-1-(2-этил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-бром-5-фтор-1Н-индол-2-ил)-метанон;
(219) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,5-дихлор-1Н-индол-2-ил)-метанон;
(220) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4,6-дифтор-1Н-индол-2-ил)-метанон;
(221) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-хлор-пиридин-4-ил)-1Н-индол-2-ил]-метанон;
(222) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(6-метил-пиридине-3-ил)-1Н-индол-2-ил]-метанон;
(223) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-фтор-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(224) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-трифторметил-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(225) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-хлор-2-метокси-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(226) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(5-хлор-пиридин-3-ил)-1Н-индол-2-ил]-метанон;
(227) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-тиофен-3-ил-1Н-индол-2-ил)-метанон;
(228) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(4-хлорпиридин-3-ил)-1Н-индол-2-ил]-метанон;
(229) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(6-тиофен-2-ил-1Н-индол-2-ил)-метанон;
(230) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(3-фтор-пиридин-4-ил)-1Н-индол-2-ил]-метанон;
(231) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[6-(2-трифторметил-пиридин-4-ил)-1Н-индол-2-ил]-метанон;
(232) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3-дифтор-пирролидин-1-карбонил)-1Н-индол-2-ил]-метанон;
(233) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(2,6-диметил-морфолин-4-карбонил)-1Н-индол-2-ил]-метанон;
(234) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-([1,4']бипиперидинил-1'-карбонил)-1Н-индол-2-ил]-метанон;
(235) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-{5-[4-(2,2,2-трифтор-этил)-пиперазин-1-карбонил]-1Н-индол-2-ил}-метанон;
(236) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-{5-[4-(2-гидрокси-этил)-пиперазин-1-карбонил]-1Н-индол-2-ил}-метанон;
(237) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-(3,3,4,4-tetraфтор-пирролидин-1-карбонил)-1Н-индол-2-ил]-метанон;
(238) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-((R)-3-фтор-пирролидин-1-карбонил)-1Н-индол-2-ил]-метанон;
(239) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[5-((S)-3-фторо-пирролидин-1-карбонил)-1Н-индол-2-ил]-метанон;
(240) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(4-метокси-фенил)-1Н-пиррол-2-ил]-метанон;
(241) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(3-метокси-фенил)-1Н-пиррол-2-ил]-метанон;
(242) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4,5-бис-(3-фтор-фенил)-1Н-пиррол-2-ил]-метанон;
(243) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4,5-бис-(4-метокси-фенил)-1Н-пиррол-2-ил]-метанон;
(244) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(2,4-дифтор-фенил)-1Н-пиррол-2-ил]-метанон;
(245) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4-(4-трифторметокси-фенил)-1Н-пиррол-2-ил]-метанон;
(246) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-[4,5-бис-(3-метокси-фенил)-1Н-пиррол-2-ил]-метанон;
(247) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-бензофуран-2-ил-метанон;
(248) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-бензо[b]тиофен-2-ил-метанон;
(249) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-бензотиазол-2-ил-метанон;
(250) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(4-фтор-фенил)-метанон;
(251) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-(3-хлор-фенил)-метанон;
(252) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-хинолин-3-ил-метанон;
(253) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-хинолин-7-ил-метанон; и
(254) [5-амино-1-(2-метил-1Н-бензимидазол-5-ил)-1Н-пиразол-4-ил]-хинолин-6-ил-метанон.
Более специфические примеры включают соединения, в которых А представляет собой индол и R3 и R4 оба представляют собой водород в формуле (I), как описано выше, и соединения, представленные в таблицах 1 и 2 в примерах, описанных далее, могут быть включены в качестве примеров.
Вышеописанные соединения могут быть получены в соответствии со способом получения, описанным в международной публикации WO 2011/016528.
В настоящем изобретении, соединения, имеющие FGFR ингибирующую активность, как описано выше, включают не только свободные формы, но также и их фармацевтически приемлемые соли.
Такие "соли" включают, например, соли неорганических кислот, органические соли, соли неорганических оснований, соли органических оснований, и соли кислотных или щелочных аминокислот.
Предпочтительные соли неорганических кислот включают, например, гидрохлорид, гидробромид, сульфат, нитрат, и фосфат. Предпочтительные органические соли включают, например, ацетат, сукцинат, фумарат, малеат, тартрат, цитрат, лактат, малат, стеарат, бензоат, метансульфонат, и п-толуолсульфонат. Особенно предпочтительной солью в настоящем изобретении является малат.
Предпочтительные соли неорганических оснований включают, например, соли щелочных металлов, такие как натриевые соли и калиевые соли; соли щелочно-земельных металлов, такие как кальциевые соли и магниевые соли; соли алюминия; и соли аммония. Предпочтительные соли органических оснований включают, например, соли диэтиламина, соли диэтаноламина, соли меглумина, и соли N,N-дибензилэтилендиамина.
Предпочтительные соли кислотных аминокислот включают, например, аспартат и глутамат. Предпочтительные соли щелочных аминокислот включают, например, соли аргинина, соли лизина, и соли орнитина.
В настоящем изобретении, соединения, имеющие FGFR ингибирующую активность, также включают их гидраты. Кроме того, в настоящем изобретении, соединения, имеющие FGFR ингибирующую активность, могут абсорбировать несколько типов сольвентов с образованием сольватов. Такие сольваты также охватываются.
Дополнительно, соединения, имеющие FGFR ингибирующую активность, в настоящем изобретении включают все возможные структурные изомеры (геометрические изомеры, оптические изомеры, стереоизомеры, таутомеры, и др.), и смеси изомеров.
Соединения, имеющие FGFR ингибирующую активность, в настоящем изобретении также включают любой их кристаллический полиморфизм.
В настоящем изобретении, соединения, имеющие FGFR ингибирующую активность, также включают их пролекарства. "Пролекарство" относится к производным соединений согласно настоящему изобретению, которые имеют химически или метаболически распадающуюся группу, и при введении в живой организм, возвращается в исходные соединения и проявляет исходную лекарственную эффективность. Пролекарства включают нековалентные комплексы и соли.
В настоящем изобретении, соединения, имеющие FGFR ингибирующую активность, включают те соединения, в которых один или несколько атомов в молекуле были заменены изотопами. В настоящей заявке, "изотоп" относится к атому, который имеет такой же атомный номер (число протонов), но отличается массовым числом (суммой протонов и нейтронов). Целевые атомы для замены изотопом в соединениях согласно настоящему изобретению включают, например, атом водорода, атом углерода, атом азота, атом кислорода, атом фосфора, атом серы, атом фтора, и атом хлора. Их изотопы включают 2Н, 3Н, 13С, 14С, 15N, 17О, 18O, 31P, 32Р, 35S, 18F, и 36Cl. В особенности, радиоактивные изотопы, такие как 3Н и 14С, которые испускают излучение и разлагаются, пригодны для исследований распределения в тканях in vivo или таких исследований для лекарственных средств или соединений. Стабильные изотопы не разлагаются, и, следовательно, их количество крайне редко изменяется; и поскольку отсутствует эмиссия радиации, то стабильные изотопы могут использоваться безопасно. Соединения согласно настоящему изобретению можно превращать в замещенные изотопом соединения в соответствии с общепринятыми методами путем замены реагентов, используемых в синтезе, на реагенты, содержащие соответствующие изотопы.
В настоящей заявке, "противораковое средство" или "фармацевтическая композиция для лечения злокачественного новообразования", которое(ая) содержит FGFR ингибитор, используются взаимозаменяемо, и относится к композиции для лечения рака, которая содержит вышеописанное соединение, имеющее FGFR ингибирующую активность, и фармацевтически приемлемые носители.
Соединения, имеющие FGFR ингибирующую активность согласно настоящему изобретению, могут быть приготовлены в виде таблеток, порошков, мелких гранул, гранул, покрытых таблеток, капсул, сиропов, пастилок, лекарственных форм для ингаляции, суппозиториев, инъекционных растворов, мазей, глазных мазей, глазных капель, капель для носа, ушных капель, горячих компрессов, лосьонов, и т.п. с помощью стандартных методов. Для приготовления препарата можно использовать обычные наполнители, связующие вещества, смазывающие вещества, красители, вкусовые вещества, и при необходимости, стабилизаторы, эмульгаторы, вещества, способствующие всасыванию, поверхностно-активные вещества, средства для регулирования уровня рН, консерванты, антиоксиданты, и т.п.. Соединения настоящего изобретения вводят в препарат путем объединения компонентов, которые обычно используют в качестве веществ для фармацевтический препаратов, используя обычные методы.
Например, для приготовления пероральных препаратов, соединения настоящего изобретения или их фармакологически приемлемые соли объединяют с наполнителями, и при необходимости, связующими веществами, дезинтегрирующими средствами, смазывающими веществами, красителями, вкусовыми веществами, и т.п.; и затем смеси переводят в порошки, мелкие гранулы, гранулы, таблетки, покрытые таблетки, капсулы, и т.п. с помощью стандартных методов.
Компоненты включают, например, животные и растительные масла, такие как соевое масло, говяжье сало, и синтетические глицериды; углеводороды, такие как жидкий парафин, сквалан, и твердый парафин; сложные эфиры масел, такие как октилдодецилмиристат и изопропилмиристат; высшие спирты, такие как цетостеариловый спирт и бегениловый спирт; силиконовые смолы; силиконовые масла; поверхностно-активные вещества, такие как полиоксиэтиленовые сложные эфиры жирной кислоты, сорбитановые сложные эфиры жирной кислоты, глицериновые сложные эфиры жирной кислоты, полиоксиэтиленсорбитановые сложные эфиры жирной кислоты, полиоксиэтиленовые производные гидрированных касторовых масел, и блок-сополимеры полиоксиэтилен/полиоксипропилена; водорастворимые полимеры, такие как гидроксиэтилцеллюлоза, полиакриловые кислоты, карбоксивиниловые полимеры, полиэтиленгликоль, поливинилпирролидон, и метилцеллюлоза; низшие спирты, такие как этанол и изопропанол; полиспирты, такие как глицерин, пропиленгликоль, дипропиленгликоль, и сорбит; сахариды, такие как глюкоза и сахароза; неорганические порошки, такие как кремниевый ангидрид, алюмосиликат магния, и алюмосиликат; и очищенная вода.
Наполнители включают, например, лактозу, кукурузный крахмал, сахарозу, глюкозу, маннит, сорбит, кристаллическую целлюлозу, и диоксид кремния.
Связующие вещества включают, например, поливиниловый спирт, поливиниловый простой эфир, метилцеллюлозу, этилцеллюлозу, гуммиарабик, трагакант, желатин, шеллак, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, поливинилпирролидон, блок-сополимер полипропиленгликоль/полиоксиэтилена, и меглумин.
Дезинтегрирующие средства включают, например, крахмал, агар, желатиновый порошок, кристаллическую целлюлозу, карбонат кальция, бикарбонат натрия, цитрат кальция, декстран, пектин, и карбоксиметилцеллюлозу кальция.
Смазывающие вещества включают, например, стеарат магния, тальк, полиэтиленгликоль, диоксид кремния, и отвержденное растительное масло.
Используют красители, одобренные для применения в качестве добавок для лекарственных средств. Используемые вкусовые вещества включают, например, какао-порошок, ментол, ароматические порошки, масло перечной мяты, борнеол, и порошок корицы.
Несомненно, эти таблетки и гранулы могут быть покрыты сахаром, или, при необходимости, другим подходящим покрытием. Альтернативно, когда приготовляют жидкие препараты, такие как сиропы и инъекционные растворы, соединения настоящего изобретения или их фармакологически приемлемые соли объединяют со средствами для регулирования уровня рН, солюбилизаторами, агентами для придания изотоничности, или подобными средствами, и при необходимости, солюбилизирующими средствами, стабилизаторами, и подобными средствами, и затем приготовляют препарат, используя обычные методы.
Способы приготовления наружных препаратов не ограничены, и они могут быть приготовлены с помощью стандартных методов. Различные вещества, обычные для лекарственных средств, препаратов общего воздействия, косметических средств и т.п. могут быть использованы в качестве основных веществ для их изготовления. В особенности, примеры используемых в качестве основы веществ включают животные и растительные масла, минеральные масла, сложноэфирные масла, воск, высшие спирты, жирные кислоты, силиконовые масла, поверхностно-активные вещества, фосфолипиды, спирты, полиспирты, водорастворимые полимеры, глинистые минералы, и очищенную воду. Кроме того, при необходимости, возможно добавление средств для регулирования уровня рН, антиоксидантов, хелатирующих агентов, консервантов, красителей, вкусовых веществ, и т.п. Однако, основные вещества для наружных препаратов настоящего изобретения не ограничены перечисленным.
Кроме того, при необходимости, препараты можно объединять с компонентами, которые проявляют активность индуцирования дифференцировки, или компонентами, такими как улучшающие кровообращение средства, антибактериальные средства, противовоспалительные средства, клеточные активаторы, витамины, аминокислоты, смачивающие средства, кератолитические средства. Вышеописанные основные вещества могут быть добавлены в количестве, которое обеспечивает концентрацию, типично выбираемую при изготовлении наружных препаратов.
Противораковые средства (гранулированные фармацевтические композиции для лечения злокачественного новообразования) для введения соединения, имеющего FGFR ингибирующую активность, в настоящем изобретении предпочтительно не ограничены в их дозированной форме; и агенты могут вводиться перорально или парентерально с помощью часто используемых методов. Они могут быть приготовлены и вводиться, например, в виде таблеток, порошков, гранул, капсул, сиропов, пастилок, средств для ингаляции, суппозиториев, составов для инъекций, мазей, глазных мазей, глазных капель, капель в нос, ушных капель, припарок, лосьонов и др.
В настоящем изобретении, дозировка FGFR ингибитора, содержащегося в противораковом средстве или фармацевтической композиции для лечения злокачественного новообразования, подходяще может быть выбрана в соответствии с тяжестью симптомов, возрастом, полом, весом, дозированной формой, типом соли, специфическим типом заболевания, и др.
Дозировки значительно изменяются в зависимости от типа заболевания пациента, тяжести симптомов, возраста, пола, чувствительности агента, и др. Типично, агент вводится взрослом один раз или несколько раз в сутки в суточной дозе приблизительно от 0,03 до 1000 мг, предпочтительно 0,1-500 мг, и более предпочтительно 0,1-100 мг. Агенты или композиции согласно настоящему изобретению вводят один раз или несколько раз в сутки. Если используют инъекцию, то суточная доза обычно составляет приблизительно от 1 мкг/кг до 3000 мкг/кг, и предпочтительно приблизительно от 3 мкг/кг до 1000 мкг/кг.
Настоящее изобретение также относится к фармацевтическим композициям для лечения злокачественного новообразования, которые содержат вышеописанное соединение, имеющее FGFR ингибирующую активность, и характеризуются их применением для введения пациентам, экспрессирующим гибридный полипептид согласно настоящему изобретению или несущим полинуклеотид, кодирующий гибридный полипептид.
Настоящее изобретение дополнительно относится к способам лечения или предотвращения злокачественного новообразования, которые включают введение эффективного количества вышеуказанных соединений, имеющих FGFR ингибирующую активность, или их фармацевтически приемлемые соли пациентам, экспрессирующим гибридные полипептиды или несущим полинуклеотиды; применению соединений, имеющих FGFR ингибирующую активность или их фармацевтически приемлемых солей для получения фармацевтических композиций для лечения злокачественного новообразования для введения пациентам, экспрессирующим гибридные полипептиды или несущим полинуклеотиды; соединениям, имеющим FGFR ингибирующую активность, или их фармацевтически приемлемые соли для применения для лечения или предотвращения для пациентов, экспрессирующих гибридные полипептиды или несущих полинуклеотиды; и др.
Специфически, применение фармацевтических композиций для лечения злокачественного новообразования характеризуется тем, что тестируют, экспрессирует ли пациент гибридный полипептид или несет полинуклеотид, кодирующий гибридный полипептид, используя гибридный полипептид согласно настоящему изобретению в качестве биомаркера, перед тем, как пациенту будут вводить вышеописанное противораковое средство, содержащее FGFR ингибитор, и противораковое средство, содержащее FGFR ингибитор, вводят пациенту только в том случае, если пациент экспрессирует гибридный полипептид или несет полинуклеотид, кодирующий гибридный полипептид. Это дает возможность специалисту избежать побочных эффектов при терапиям, используя агент и контролируя терапевтическое состояние, для получения наилучшего терапевтического эффекта, таким образом предоставляя возможность персонализировать медицину.
В настоящем изобретении, специфически в случае рака мочевого пузыря, обнаружено, что гибридные гены согласно настоящему изобретению достоверно экспрессируются, если рак мочевого пузыря прогрессирует до стадии 3 или последующих согласно классификации стадий.
Классификация стадий рака мочевого пузыря специфически осуществляется согласно TNM классификации. TNM классификация состоит из Т фактора (заглавная буква опухоли), указывающего на степень опухоли, N фактора (заглавная буква лимфатических узлов), указывающего на присутствие или отсутствие метастазов опухоли в лимфатических узлах, и М фактора (заглавная буква метастаз), указывающая на присутствие или отсутствие удаленных метастаз, отличающихся от метастаз в лимфатических узлах. Согласно такой классификации, злокачественные новообразования, в которых опухоль инфильтрирована в субэпителиальную соединительную ткань, классифицируются как стадия 1, те злокачественные новообразования, в которых опухоль инфильтрирована в мышечную оболочку, классифицируются как стадия 2, те злокачественные новообразования, в которых опухоль инфильтрирована в жировую ткань, окружающую мочевой пузырь, те злокачественные новообразования, в которых опухоль инфильтрирована в любую одну интерстициальную ткань предстательной железы, матки, или влагалища, классифицируются как стадия 3, и те злокачественные новообразования, в которых опухоль инфильтрирована либо в стенку таза или брюшную стенку, или те, которые проявляются метастазирование в лимфатические узлы или удаленное метастазирование, классифицируются как стадия 4.
Экспрессирует ли пациент гибридный полипептид согласно настоящему изобретению или несет полинуклеотид, кодирующий гибридный полипептид, можно тестировать с использованием способов согласно настоящему изобретению, как описано выше.
Настоящее изобретение также относится к способам идентификации соединений, имеющих FGFR ингибирующую активность.
Специфически, способы идентификации соединений, имеющих FGFR ингибирующую активность, в настоящем изобретении включают способы, включающие стадии:
(а) культивирование клеток, которые экспрессируют вышеописанный гибридный полипептид согласно настоящему изобретению в присутствии или отсутствии тестируемого соединения и определение уровня клеточной пролиферации;
(б) сравнение уровня пролиферации культивированной клетки между присутствием и отсутствием тестируемого соединения; и
(в) оценивание, что тестируемое соединение имеет FGFR ингибирующую активность, если уровень пролиферации клетки, культивируемой в присутствии тестируемого соединения более низкий, чем клетки, культивируемой при отсутствии тестируемого соединения.
Клетки, используемые для вышеописанного способа, могут представлять собой живые клетки, устойчивые клеточные линии, или рекомбинантные клетки, при условии, что они экспрессируют гибридный полипептид согласно настоящему изобретению. Такие рекомбинантные клетки включают те, которые интродуцированы с вышеописанным вектором, несущим полинуклеотид, кодирующий гибридный полипептид согласно настоящему изобретению.
В то же время, живые клетки включают клетки, собранные от пациентов со злокачественным новообразованием. Устойчивые клеточные линии включают раковые клеточные линии, сформированные с раковых клеток, собранных от пациентов со злокачественным новообразованием.
В настоящем изобретении, злокачественное новообразование включает любое злокачественное новообразование, как описано выше.
Способы идентификации соединений, имеющих FGFR ингибирующую активность, в настоящем изобретении также включают способы, включающие стадии:
(а) введение тестируемого соединения млекопитающему, отличающемуся от человека, которому трансплантированы клетки, экспрессирующие вышеописанный гибридный полипептид согласно настоящему изобретению и определение уровня пролиферации клеток;
(б) сравнение уровня клеточной пролиферации, определенной на стадии (а), с уровнем, который был определен с использованием млекопитающего, отличающегося от человека, которому трансплантировали клетки, но не вводили тестируемое соединение; и
(в) оценивание, что тестируемое соединение имеет FGFR ингибирующую активность, если уровень клеточной пролиферации, определенной на стадии (а), более низкий, чем определенный с использованием млекопитающего, отличающегося от человека, которому трансплантировали клетки, но не вводили тестируемое соединение.
Клетки, используемые для вышеописанного способа, могут представлять собой живые клетки, устойчивые клеточные линии, или рекомбинантные клетки, при условии, что они экспрессируют гибридный полипептид согласно настоящему изобретению. Такие рекомбинантные клетки включают те, которые интродуцированы с вышеописанным вектором, несущим полинуклеотид, кодирующий гибридный полипептид согласно настоящему изобретению.
В то же время, живые клетки включают клетки, собранные от пациентов со злокачественным новообразованием. Устойчивые клеточные линии включают раковые клеточные линии, сформированные с раковых клеток, собранных от пациентов со злокачественным новообразованием.
В настоящем изобретении, злокачественное новообразование включает любое злокачественное новообразование, как описано выше.
В способах согласно настоящему изобретению, уровень пролиферации клеток можно тестировать в соответствии с общепринятыми методами, например, путем колориметрических методов, в которых измеряют ферментативную активность восстановления красителя (МТТ, ХТТ, MTS, WST, и др.) в формазановый краситель (пурпур).
Если вышеописанные клетки представляют собой раковые клетки, то уровень пролиферации клеток также может быть определен путем измерения объема или веса опухоли, образованной в результате клеточной пролиферации.
В настоящем изобретении, способы идентификации соединений, имеющих FGFR ингибирующую активность, также включают варианты осуществления с использованием анализов репортерных генов.
Репортерные гены включают широко используемые гены, кодирующие произвольные флуоресцентные белки, например, зеленый флуоресцентный белок (GFP), имеющий происхождение из Aequorea coerulescens, люциферазу, имеющую происхождение из Renilla reniformis или др., флуоресцентные белки коралловых рифов (RCFPs), имеющие происхождение из рифообразующих кораллов, флуоресцентные белки фруктов, и их варианты.
В настоящем изобретении, анализ репортерных генов можно осуществлять, например, как описано ниже.
Рекомбинантные клетки приготавливают путем трансформации клеток, которые обычно используют для продуцирования рекомбинантных белков, с помощью экспрессионного вектора, в который встроен полинуклеотид, кодирующий гибридный полипептид согласно настоящему изобретению, и ген, кодирующий репортерный белок, таким образом, что ген, кодирующий репортерный белок, транскрибируется в мРНК в зависимости от сигнала, который транскрибирует полинуклеотид, кодирующий гибридный полипептид, в мРНК. Тестируемое соединение подвергают контакту с полученными трансформированными клетками. Тот факт, оказывает ли влияние соединение на экспрессию гибридного полипептида, непосредственно анализируют путем определения уровня экспрессии гибридного полипептида, который зависит от активности соединения, путем измерения интенсивности флуоресценции, испускаемой репортерным белком, одновременно экспрессируемым с гибридным полипептидом (например, US Patent No. 5,436,128; US Patent No. 5,401,629).
Идентификацию соединений с помощью вышеописанного анализа можно осуществлять вручную; тем не менее, также можно осуществлять легкий и простой так называемый " скрининг высокой производительности", используя автоматизированные роботы (Soshiki Baiyou Kougaku (The Tissue Culture Engineering), Vol. 23, No. 13, p. 521-524; US Patent No. 5,670,113).
В настоящей заявке ниже, настоящее изобретение специфически описывается с использованием Примеров, но они не должны рассматриваться как ограничивающие изобретение.
Если специально не указано иначе, то каждую стадию анализа можно осуществлять в соответствии с известными методами.
В то же время, при использовании коммерчески доступных реагентов, наборов, или др., анализы можно осуществлять в соответствии с инструкциями производителей, включенными в коммерчески доступные продукты.
Все документы известного уровня техники, процитированные в настоящей заявке, включены в нее полностью в качестве ссылки.
[Пример 1]
Экспрессия гибридных полипептидов между FGFR3 и другими полипептидами в различных раковых клетках
(1) РНК анализ
РНК экстрагировали с помощью miRNeasy Mini Kit (QIAGEN) из каждой из четырех клеточных линий человека, экспрессирующих FGFR3, имеющих происхождения из рака мочевого пузыря, RT112/84 (доступные от Европейской коллекции клеточных культур (ЕСАСС); № каталога 85061106), RT4 (доступные от Американской коллекции типовых культур ((АТСС); № каталога НТВ-2), SW780 (доступные от АТСС; № каталога CRL-2169), и BFTC-905 (доступные от Немецкой коллекции микроорганизмов и клеточных культур (DSMZ); № каталога АСС 361). Последовательности определяли, используя считывания спаренных концов (считываемая длина: 2×75 п.о) системы HiSeq™ Sequencing system (Illumina).
Определенные нуклеотидные последовательности картировали на Refseq транскрипты путем ссылки на существующий метод (Maher et al., PNAS, July 28, 2009, 106(30): 12353-12358) для поиска кандидатных гибридных генов путем разыскивания пар нуклеотидных последовательностей, которые картировали на различные гены. Кроме того, идентифицировали гибридизированные участки, используя нуклеотидные последовательности, которые не картировали на какой-либо Refseq транскрипт, в котором одни партнер пары картирован на другом партнера в кандидатном гибридном гене.
В результате этого, были идентифицированы полинуклеотиды, кодирующие гибридный полипептид FGFR3 и ТАСС3, гибридный полипептид FGFR3 и ТАСС3, и гибридный полипептид FGFR3 и BAIAP2L1, из трех типов клеточных линий рака мочевого пузыря: RT112/84, RT4, и SW780. Это указывает на то, что гибридные полипептиды экспрессируются в этих клеточных линиях. В то же время, полинуклеотид, кодирующий FGFR3 полипептид дикого типа, подтвержден в BFTC-905 клетках.
(2) кДНК анализ
кДНК синтезировали путем обратной транскрипции, используя набор для обратной транскрипции, Transcriptor Universal cDNA Master (Roche), в соответствии с инструкцией производителя, приложенной к набору. РНК, используемые в Примере 1(1), которые экстрагировали из трех типов клеток, которые предположительно экспрессируют гибридный полипептид FGFR3 и ТАСС3 или гибридный полипептид FGFR3 и BAIAP2L1, каждую использовали в качестве матрицы.
Осуществляли ПЦР (35 циклов по 15 секунд при 94°С, 30 секунд при 55°С, и одну минуту при 68°С), используя каждую из приготовленных кДНК в качестве матрицы с ДНК полимеразой KOD-Plus-Ver. 2 (Toyobo), и пару олигонуклеотидных праймеров (набор 1), имеющую полинуклеотидные последовательности SEQ ID NO: 1 (F3fu-F3: gtgcacaacctcgactactacaag) и SEQ ID NO: 2 (RT112-R3: gtaatcctccacgcacttcttc), пару олигонуклеотидных праймеров (набор 2), имеющую полинуклеотидные последовательности SEQ ID NO: 1 (F3fu-F3: gtgcacaacctcgactactacaag) и SEQ ID NO: 5 (RT4-R3: gggtgtcactcttctgtctaagga), или пару олигонуклеотидных праймеров (набор 3), имеющую полинуклеотидные последовательности SEQ ID NO: 3 (F3fu-F2) tgtttgaccgagtctacactcacc) и SEQ ID NO: 4 (SW780-R2: gacatgtcccagttcagttgac). После этого, осуществляли электрофорез.
Результаты свидетельствуют о том, что с набором праймеров 1, наблюдали полосу приблизительно 670 п.о. только когда кДНК, синтезированную из RT112/84 РНК, использовали в качестве матрицы. При амплификации с набором праймеров 2, наблюдали полосу приблизительно 610 п.о. только когда кДНК, синтезированную из RT4 РНК, использовали в качестве матрицы. При амплификации с набором праймеров 3, наблюдали полосу приблизительно 450 п.о. только когда кДНК, синтезированную из SW780 РНК, использовали в качестве матрицы.
Секвенирование осуществляли с помощью метода секвенирования Sanger с BigDye™ Terminator v3.1 Cycle Sequencing Kit (Life Technologies), используя каждый ПЦР продукт в качестве матрицы для определения полинуклеотидной последовательности (SEQ ID NO: 14) гибридизированного участка в гибридизированном полинуклеотиде FGFR3 и ТАСС3 (FGFR3-TACC3 полинуклеотид v1), экспрессируемом в RT112/84, полинуклеотидную последовательность (SEQ ID NO: 15) гибридизированного участка в гибридизированном полинуклеотиде FGFR3 и ТАСС3 (FGFR3-ТАСС3 полинуклеотид v2), экспрессируемом в RT4, и полинуклеотидную последовательность (SEQ ID NO: 16) гибридизированного участка в гибридизированном полинуклеотиде FGFR3 и BAIAP2L1 (FGFR3-BAIAP2L1 полинуклеотид), экспрессируемом в SW780.
На основании информации, полученной, как описано выше, определяли полинуклеотидные последовательности кДНК, кодирующие каждый гибридный полипептид (полноразмерные) с помощью общепринятого метода.
Полинуклеотидная последовательность кДНК, кодирующая гибридный полипептид (полноразмерный) FGFR3 и ТАСС3, экспрессируемый в RT112/84, и ее аминокислотная последовательность представлены в SEQ ID NOs: 27 и 28, соответственно.
Полинуклеотидная последовательность кДНК, кодирующая гибридный полипептид (полноразмерный) FGFR3 и ТАСС3, экспрессируемый в RT4 и ее аминокислотная последовательность представлены в SEQ ID NOs: 29 и 30, соответственно.
Результаты анализа полинуклеотидной последовательности кДНК свидетельствуют о том, что полинуклеотидная последовательность в положениях 2281-2379 SEQ ID NO: 29 представляет собой имеющую происхождение из интрона последовательность нуклеиновых кислот гена, кодирующего FGFR3, и кодирует аминокислотную последовательность в положениях 761- 793 SEQ ID NO: 30.
Полинуклеотидная последовательность кДНК, кодирующая гибридный полипептид (полноразмерный) FGFR3 и BAIAP2L1, экспрессируемая в SW780, и ее аминокислотная последовательность представлены в SEQ ID NOs: 31 и 32, соответственно.
Как описано выше, несмотря на то, что существует два типа полипептидов FGFR3 дикого типа человека, которые содержат аминокислотные последовательности SEQ ID NOs: 6 и 7, соответственно, N-концевые FGFR3-производные части в этих гибридных полипептидах представляют собой те части FGFR3 дикого типа, который имеет аминокислотную последовательность SEQ ID NO: 6.
На основании результатов этих тестирований, полагают, два типа гибридных полипептидов ТАСС3 и другого FGFR3 дикого типа, который имеет аминокислотную последовательность SEQ ID NO: 7, и гибридный полипептид BAIAP2L1 и другого FGFR3 дикого типа, который имеет аминокислотную последовательность SEQ ID NO: 7 экспрессируются в различных типах раковых клеток, имеющих происхождение от человека.
Полинуклеотидная последовательность кДНК, кодирующая гибридный полипептид (полноразмерный) ТАСС3 и FGFR3 дикого типа, который имеет аминокислотную последовательность SEQ ID NO: 7, и ее аминокислотная последовательность представлены в SEQ ID NOs: 33 и 34, соответственно.
Полинуклеотидная последовательность кДНК, кодирующая другой гибридный полипептид (полноразмерный) ТАСС3 и FGFR3 дикого типа, который имеет аминокислотную последовательность SEQ ID NO: 7, и ее аминокислотная последовательность представлены в SEQ ID NOs: 35 и 36, соответственно.
В данном случае, полинуклеотидная последовательность в положениях 2275-2373 кДНК нуклеотидной последовательности SEQ ID NO: 35 представляет собой последовательность нуклеиновых кислот, имеющую происхождение из интрона гена, кодирующего FGFR3, и кодирует аминокислотная последовательность в положениях 759-791 SEQ ID NO: 36.
Полинуклеотидная последовательность кДНК, кодирующая другой гибридный полипептид (полноразмерный) BAIAP2L1 и FGFR3 дикого типа, который имеет аминокислотную последовательность SEQ ID NO: 7, и ее аминокислотная последовательность представлены в SEQ ID NOs: 37 и 38, соответственно.
Кроме того, присутствие FGFR3-ТАСС3 гибридизированного полинуклеотида подозревают при плоскоклеточном раке головы и шеи, аденокарциноме легкого, и плоскоклеточном раке легкого, в то время как присутствие FGFR3-BAIAP2L1 гибридизированного полинуклеотида подозревают при плоскоклеточном раке головы и шеи, плоскоклеточном раке легкого, и меланоме кожи.
[Пример 2]
Анализ различных FGFR ингибиторов относительно их активностей ингибировать активность киназы FGFR1, FGFR2, и FGFR3, и ингибировать пролиферацию клеток клеточных линий, экспрессирующих FGFR3-TACC3 гибридный полипептид
1. Анализ различных FGFR ингибиторов относительно их активностей ингибировать активность киназы FGFR1, FGFR2, и FGFR3 (in vitro) (1) Ингибирующая активность по отношению к FGFR1 ферменту
FGFR1 ингибирующие активности соединений, перечисленных в таблицах 1-1 - 1-5 определяли на основании их активности ингибировать фосфорилирование биотинилированного пептида (EGPWLEEEEEAYGWMDF; SEQ ID NO: 39) с помощью фермента FGFR1 человека (Carna Biosciences, cat 08-133). Фосфорилированный биотинилированный пептид обнаруживали с помощью флуориметрии с разрешением во времени, используя анти-фосфотирозиновое антитело, связанное с криптатом европия, и стрептавидин, связанный с производным аллофикоцианина, XL665. Полумаксимальную ингибирующую концентрацию (IC50) рассчитывали на основании скорости ингибирования по отношению к контрольной группе, которая не получала тестируемого вещества.
Результат тестирования для каждого соединения представлен в таблицах 1-1 - 1-5.
(2) Ингибирующая активность по отношению к FGFR2 ферменту
FGFR2 ингибирующие активности соединений, перечисленных в таблицах 1-1 - 1-5 определяли на основании их активности ингибировать фосфорилирование биотинилированного пептида (EGPWLEEEEEAYGWMDF; SEQ ID NO: 39) с помощью фермента FGFR2 человека, используя бакуловирусную экспрессионную систему. Фосфорилированный биотинилированный пептид обнаруживали с помощью флуориметрии с разрешением во времени используя анти-фосфотирозиновое антитело, связанное с криптатом европия, и стрептавидин, связанный с производным аллофикоцианина, XL665. Полумаксимальную ингибирующую концентрацию (IC50) рассчитывали на основании скорости ингибирования по отношению к контрольной группе, которая не получала тестируемого вещества.
Результат тестирования для каждого соединения представлен в таблицах 1-1 - 1-5.
(3) Ингибирующая активность по отношению к FGFR3 ферменту
FGFR3 ингибирующие активности соединений, перечисленных в таблицах 1-1 - 1-5 определяли на основании их активности ингибировать фосфорилирование биотинилированного пептида (EGPWLEEEEEAYGWMDF; SEQ ID NO: 39) с помощью фермента FGFR3 человека (Carna Biosciences, cat 08-135). Фосфорилированный биотинилированный пептид обнаруживали с помощью флуориметрии с разрешением во времени используя анти-фосфотирозиновое антитело, связанное с криптатом европия, и стрептавидин, связанный с производным аллофикоцианина, XL665. Полумаксимальную ингибирующую концентрацию (IC50) рассчитывали на основании скорости ингибирования по отношению к контрольной группе, которая не получала тестируемого вещества.
Результат тестирования для каждого соединения представлен в таблицах 1-1 - 1-5.
(4) Ингибирующая активность FGFR ингибиторов на пролиферацию клеток клеточных линий (in vitro)
Клетки клеточной линии RT-4, имеющей происхождение из рака мочевого пузыря, которые экспрессируют FGFR3-ТАСС3 гибридный полипептид, и клетки клеточной линии НСТ116, имеющей происхождение из рака ободочной кишки, которые не экспрессируют FGFR3 гибридный полипептид, высевали в планшеты на 96 лунок, и культивировали в течение четырех дней в присутствии ДМСО (использовали в качестве контроля) или каждое из соединений, перечисленных в таблицах 1-1 - 1-5 в 2-х кратных серийных разведениях (18 стадий) при минимальной концентрации 50 мкМ. Через четыре дня, определяли уровень пролиферации клеток, используя WST-8 (DOJINDO LABORATORIES).
Ингибирующую активность каждого соединения на пролиферацию клеток каждой клеточной линии рассчитывали в соответствии с:
(1-Т/С)×100(%),
где Т представляет собой абсорбцию при 450 нМ в лунках, где клетки инкубировали в присутствии соединения при различных концентрациях, и С представляет собой абсорбцию при 450 нМ в лунках, где клетки инкубировали в присутствии ДМСО. IC50 рассчитывали, используя метод наименьших квадратов.
Как представлено в таблицах 1-1 - 1-5, полученные результаты свидетельствуют о том, что концентрация, ингибирующая пролиферацию клеток на 50% (IC50), для клеток, экспрессирующих гибридный полипептид, достоверно более низкая, чем для клеток, которые не экспрессируют гибридный полипептид.

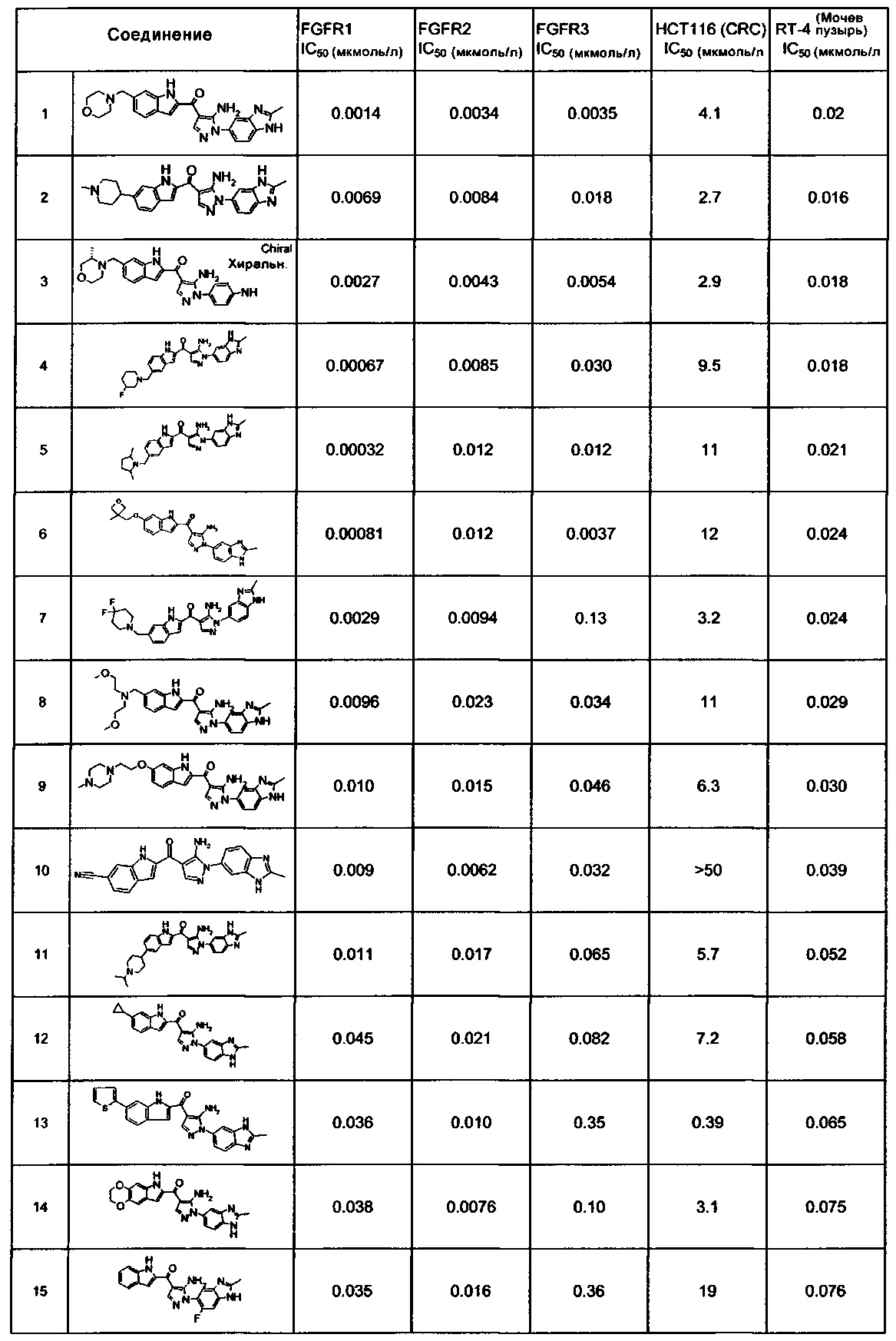

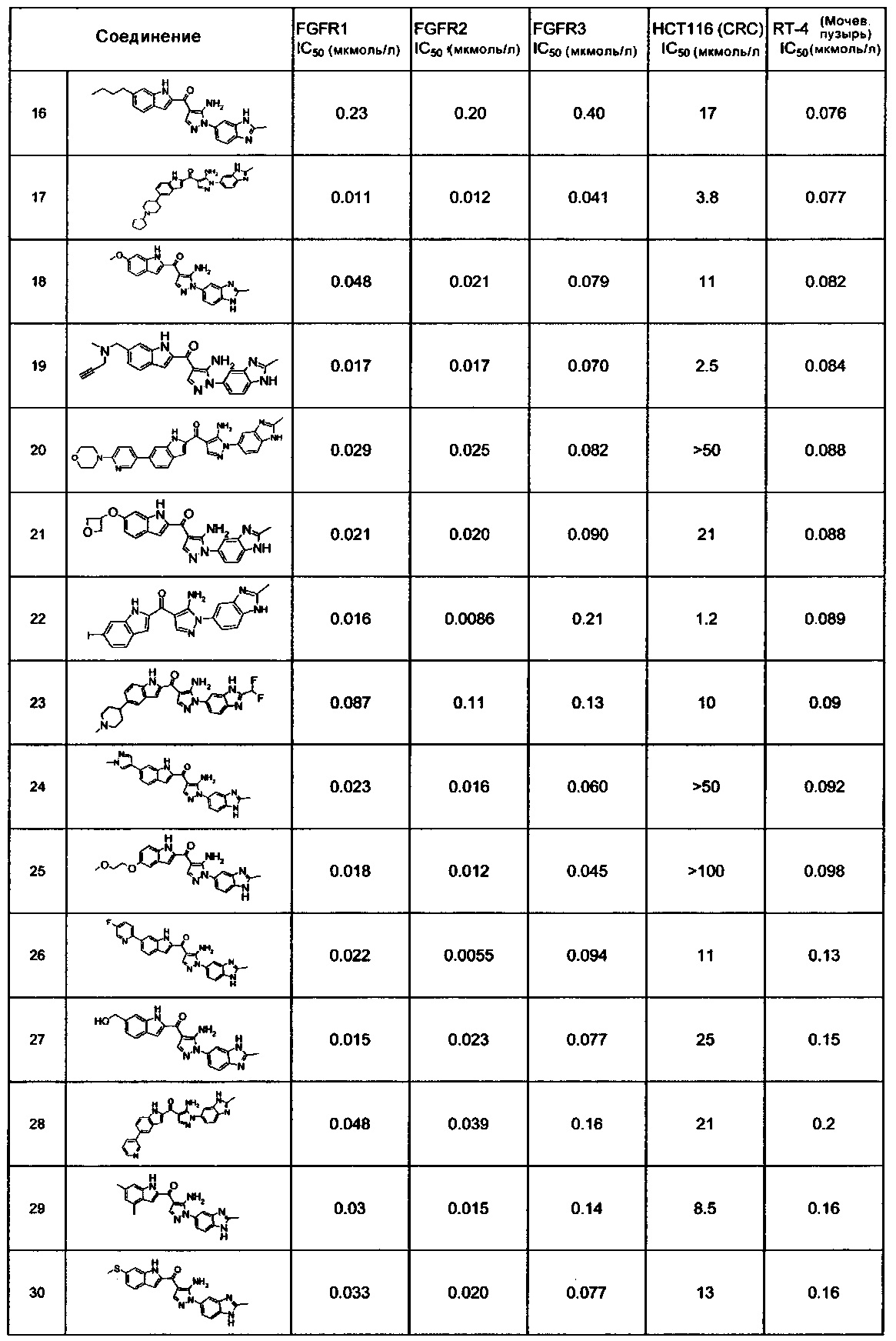
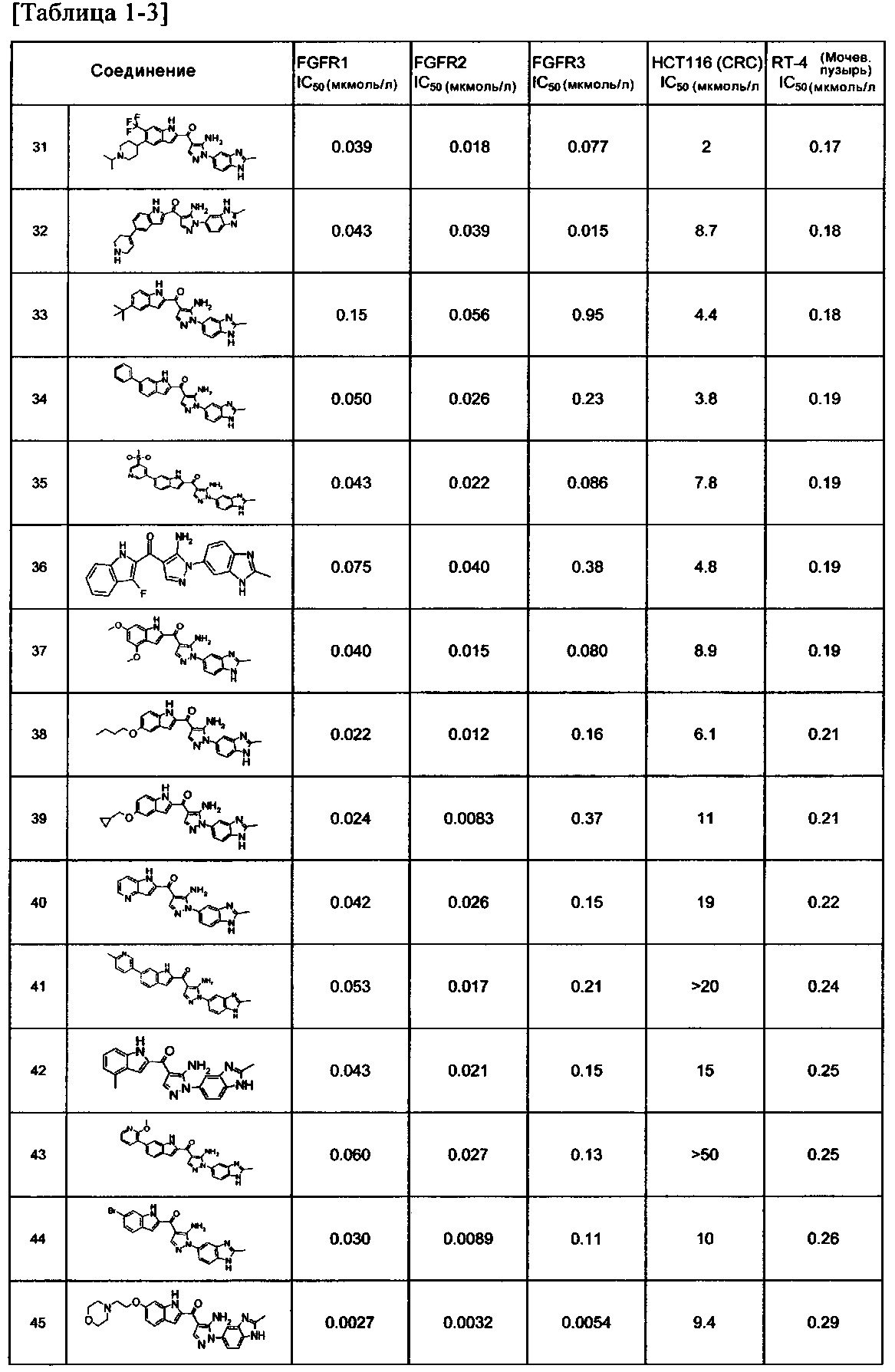
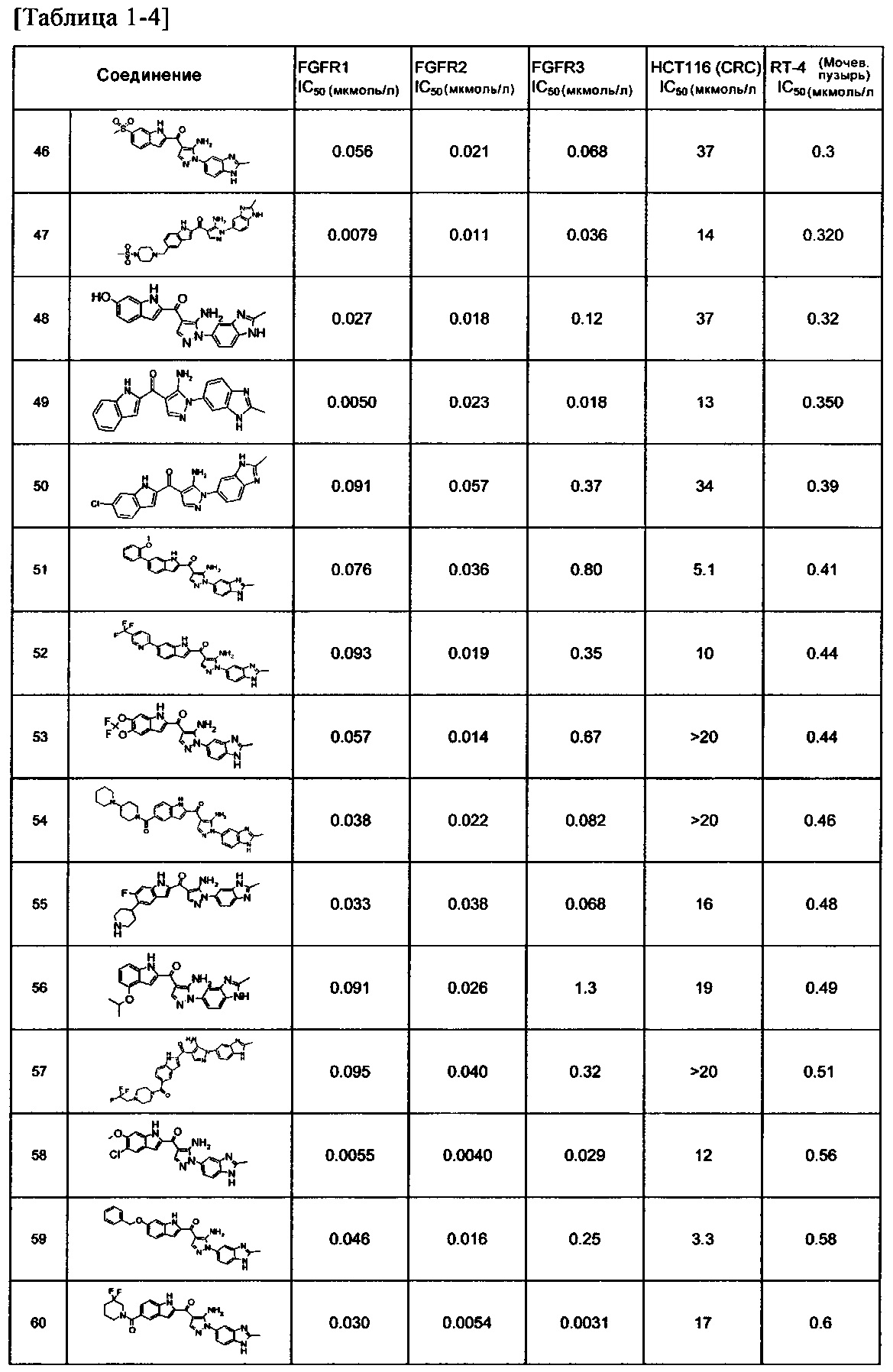
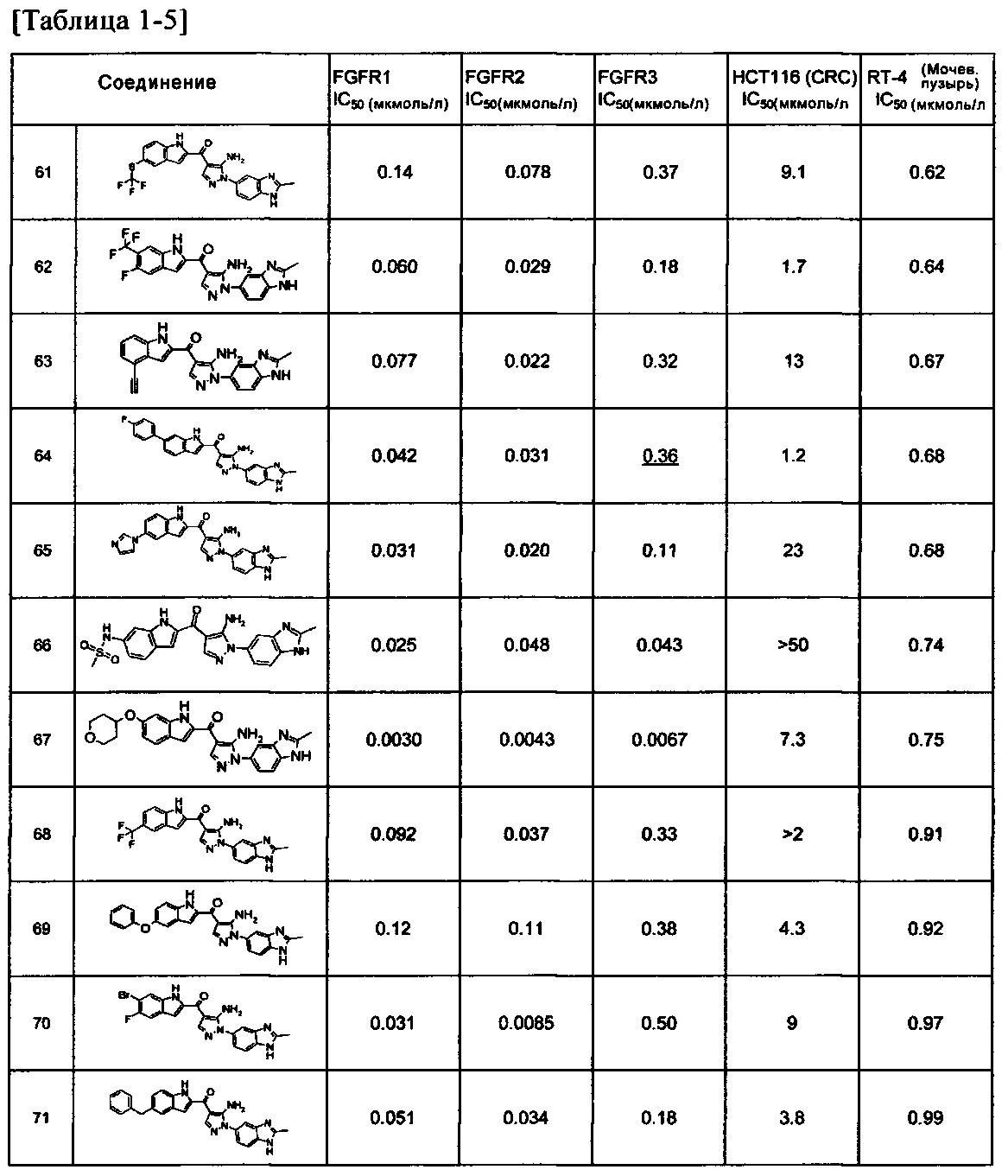
[Пример 3]
Анализ FGFR ингибиторов относительно их ингибирующей активности на пролиферацию клеток различных клеточных линий, экспрессирующих FGFR3-ТАСС3 гибридный полипептид или FGFR3-BAIAP2L1 гибридный полипептид (1) Ингибирующая активность FGFR ингибиторов на пролиферацию клеток различных клеточных линий (in vitro)
Шесть соединений А-F (Таблицы 2-1 и 2-2), которые являются веществами, подавляющими киназную активность FGFR, оценивали относительно их влияния на пролиферацию клеток в общей сложности шести типов клеточных линий, имеющих происхождение из рака мочевого пузыря человека: три типа клеточных линий, экспрессирующих FGFR3-TACC3 или FGFR3-BAIAP2L1 гибридный полипептид: RT112/84 (доступные от ЕСАСС; № каталога 85061106), RT4 (доступные от АТСС; № каталога НТВ-2), и SW780 (доступные от АТСС; № каталога CRL-2169); клеточная линия BFTC-905 (доступные от DSMZ; № каталога АСС 361), которая экспрессируют FGFR полипептид дикого типа, но не экспрессирует гибридные полипептиды; клеточная линия UM-UC-14 (доступные от ЕСАСС; № каталога 08090509), которая экспрессирует FGFR полипептид мутированного типа, но не экспрессирует гибридные полипептиды; и клеточная линия НТ-1376 (доступные от АТСС; № каталога CRL-1472), которая не экспрессирует FGFR3.
Клетки, высеянные в планшеты на 96 лунок (RT112/84, BFTC-905, и UM-UC-14: 3.0Е+03 клеток/лунку; SW780, RT4, и НТ-1376: 5.0Е+03 клеток/лунку) культивировали в течение четырех дней в присутствии ДМСО (использовали в качестве контроля) или каждое соединение в трехкратных серийных разведениях (9 стадий) при максимальной концентрации 20 мкМ. Через четыре дня, определяли уровень пролиферации клеток, используя 8 (DOJINDO LABORATORIES).
Ингибирующую активность каждого соединения на пролиферацию клеток каждой клеточной линии рассчитывали в соответствии с:
(1-Т/С)×100(%),
где Т представляет собой абсорбцию при 450 нМ в лунках, где клетки инкубировали в присутствии соединения при различных концентрациях, и С представляет собой абсорбцию при 450 нМ в лунках где клетки инкубировали в присутствии ДМСО. IC50 рассчитывали, используя метод наименьших квадратов.
Как представлено в таблице 3, полученные результаты свидетельствуют о том, что концентрация, ингибирующая пролиферацию клеток 50% (IC50) для клеток, экспрессирующих гибридные полипептиды, достоверно более низкая, чем для клеток, которые не экспрессируют гибридные полипептиды.
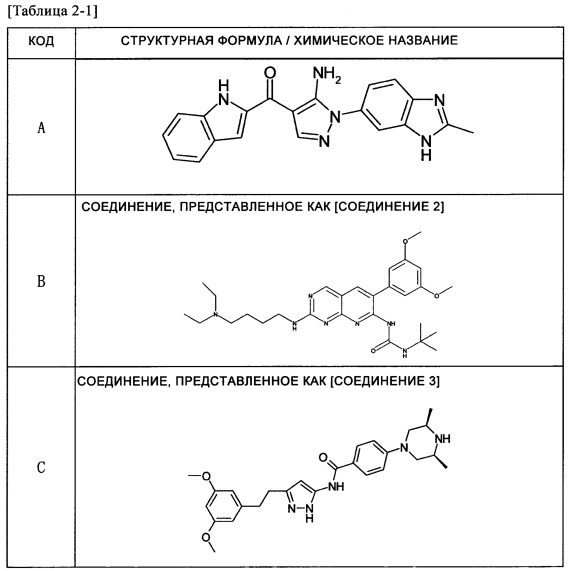
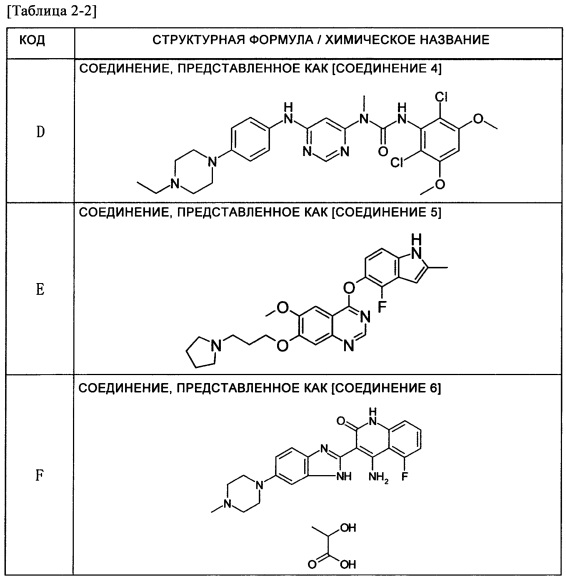
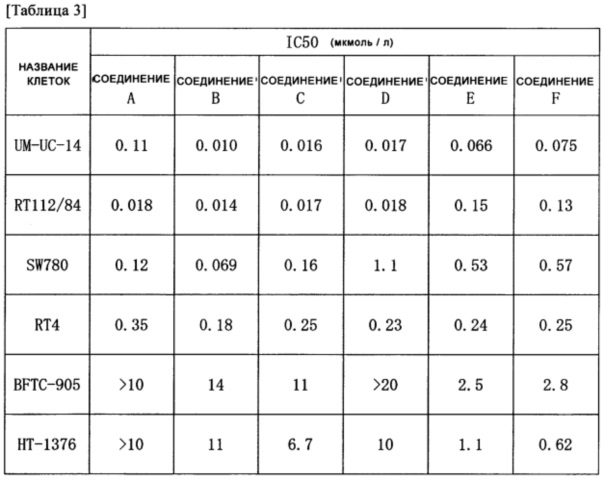
(2) Ингибирующая активность FGFR ингибиторов на пролиферацию клеток по отношению к клеткам, экспрессирующим FGFR3-TACC3 гибридный полипептид (in vivo)
Противоопухолевый эффект оценивали, используя мышей, несущих злокачественное новообразование, полученных путем трансплантации клеток клеточной линии RT112/84 (ЕСАСС) рака мочевого пузыря человека подкожно в паховую область BALB/c безтимусным мышам (Charles River Japan, Inc.).
Безтимусные мыши подвергали карантину приблизительно в течение одной недели перед использованием, и подкожно трансплантировали приблизительно 1×107 RT112/84 клеток в паховую область. Когда размер опухоли достигал около 200 мм3, мышей использовали в экспериментах.
Соединение А суспендировали в растворе, содержащем 10% ДМСО, 10% Cremophor EL, 15% PEG400, и 15% HPCD, и перорально вводили мышам в дозе 20 мл/кг один раз в сутки.
Противоопухолевый эффект определяли путем сравнения роста опухоли в течение И дней после первого дня введения (День 10, если первый день введения устанавливали как День 0) по сравнением с ростом в контрольной группе.
Ингибирующий эффект на рост опухоли (TGI)=(1-[Средний уровень роста опухоли леченной группы]/[Средний уровень роста опухоли контрольной группы])×100(%)
Результаты представлены в таблице 4.
FGFR ингибиторы проявляют заметный достоверный ингибирующий эффект на рост опухоли у мышей, несущих опухолевые клетки, которые экспрессируют FGFR3-TACC3 гибридный полипептид в зависимости от концентрации.
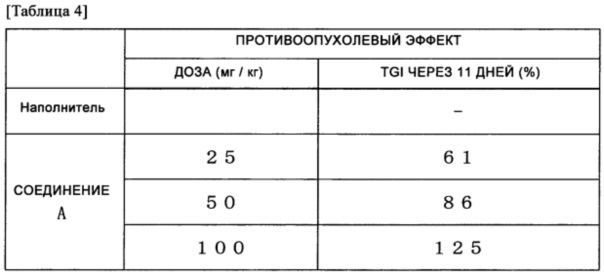
[Пример 4]
Обнаружение полинуклеотидов, кодирующих FGFR3-TACC3 или FGFR3-BAIAP2L1 гибридный полипептид в клинических препаратах
(1) Обнаружение полинуклеотида v1, который кодирует FGFR3-ТАСС3 гибридный полипептид
Для обнаружения кДНК полинуклеотида v1, кодирующего FGFR3-ТАСС3 гибридный полипептид в клинических пробах, осуществляли ПЦР (42 циклов по 10 секунд при 98°С, 15 секунд при 60°С, и одну минуту при 68°С) с Tks Gflex™ ДНК Полимеразой (Takara bio) используя, в качестве праймеров, олигонуклеотиды, имеющие полинуклеотидные последовательности SEQ ID NOs: 1 и 2, и в качестве субстрата, кДНК (Origene), имеющую происхождение из образцов рака мочевого пузыря, собранных от пациентов с раком мочевого пузыря (20 пациентов) или кДНК, синтезированную из RT112/84 (ЕСАСС) РНК. Каждый из амплифицированных образцов подвергали электрофорезу совместно с маркированной по размеру ДНК (Invitrogen).
Как представлено на фигуре 1, полученные результаты указывают на то, что кДНК фрагментов полинуклеотида v1, кодирующего FGFR3-TACC3 гибридный полипептид, не обнаружены в клинических образцах.
(2) Обнаружение полинуклеотида v2, который кодирует FGFR3-TACC3 гибридный полипептид
Для обнаружения кДНК полинуклеотида v2, кодирующего FGFR3-ТАСС3 гибридный полипептид в клинических пробах, осуществляли ПЦР (42 циклов по 10 секунд при 98°С, 15 секунд при 60°С, и одну минуту при 68°С) с Tks Gflex™ ДНК Полимеразом (Takara bio) используя в качестве праймеров, олигонуклеотиды, имеющие полинуклеотидные последовательности SEQ ID NOs: 1 и 5, и в качестве субстрата, кДНК (Origene), имеющую происхождение из образцов рака мочевого пузыря, собранных от пациентов с раком мочевого пузыря (20 пациентов) или кДНК, синтезированную из RT4 (АТСС) РНК. Каждый из амплифицированных образцов подвергали электрофорезу совместно с маркированной по размеру ДНК (Invitrogen).
Как представлено на фигуре 2, полученные результаты указывают на то, что кДНК фрагмента полинуклеотида v2, кодирующего FGFR3-TACC3 гибридный полипептид, был обнаружен в единичном случае.
Представленные выше результаты указывают на то, что способ, описанный выше, предоставляет возможность обнаружения полинуклеотида v2, кодирующего FGFR3-TACC3 гибридный полипептид в образцах, имеющих происхождение из клинических проб рака мочевого пузыря, и таким образом предоставляет возможность отбора пациентов, которые являются положительными по полинуклеотиду v2, кодирующему FGFR3-TACC3 гибридный полипептид.
(3) Обнаружение полинуклеотида, кодирующего FGFR3-BAIAP2L1 гибридный полипептид
Для обнаружения кДНК для FGFR3-BAIAP2L1 полинуклеотида в клинических пробах, осуществляли ПЦР (42 циклов по 10 секунд при 98°С, 15 секунд при 60°С, и одну минуту при 68°С) с Tks Gflex™ ДНК Полимеразой (Takara bio) используя, в качестве праймеров, олигонуклеотиды, имеющие полинуклеотидные последовательности SEQ ID NOs: 3 и 4, и, в качестве субстрата, кДНК (Origene), имеющую происхождение из образцов рака мочевого пузыря, собранных от пациентов с раком мочевого пузыря (20 пациентов) или кДНК, синтезированную из SW780 (АТСС) РНК. Каждый из амплифицированных образцов подвергали электрофорезу совместно с маркированной по размеру ДНК (Invitrogen).
Как представлено на фигуре 3, полученные результаты указывают на то, что кДНК фрагмент FGFR3-BAIAP2L1 гибридного полинуклеотида обнаружен всего в двух случаях.
Представленные выше результаты указывают на то, что способ, описанный выше, предоставляет возможность обнаружения полинуклеотида, кодирующего FGFR3-BAIAP2L1 гибридный полипептид в образцах, имеющих происхождение из клинических проб рака мочевого пузыря, и таким образом предоставляет возможность отбора пациентов, которые являются положительными по полинуклеотиду, кодирующему FGFR3-BAIAP2L1 гибридный полипептид.
[Пример 5]
Обнаружение полинуклеотидов, кодирующих FGFR3-BAIAP2L1 гибридный полипептид и FGFR3-TACC3 гибридный полипептид в клинических препаратах различных типов злокачественных новообразований
(1) Обнаружение полинуклеотида, кодирующего FGFR3-BAIAP2L1 гибридный полипептид в клинических препаратах рака легкого (рак не мочевого пузыря) (Тест 1)
Для обнаружения кДНК для FGFR3-BAIAP2L1 полинуклеотид из клинических препаратов рак не-мочевого пузыря, осуществляли ПЦР (42 циклов по 98°С в течение 10 секунд, 60°С в течение 15 секунд, и 68°С в течение одной минуты) с Tks Gflex(tm) ДНК Полимеразой (TAKARA BIO INC.), используя пару олигонуклеотидных праймеров, имеющих полинуклеотидные последовательности SEQ ID NO: 3 (F3fu-F2: tgtttgaccgagtctacactcacc) и SEQ ID NO: 4 (SW780-R2: gacatgtcccagttcagttgac), и, в качестве субстрата, 40 образцов кДНК, имеющих происхождение из клинических препаратов рака легкого (OriGene) и кДНК, синтезированную из SW780 РНК. Амплифицированные образцы подвергали электрофорезу совместно с маркированной по размеру ДНК (Invitrogen).
Как представлено на фигуре 4А, полученные результаты указывают на то, что кДНК фрагмента полинуклеотида, кодирующего FGFR3-BAIAP2L1 гибридный полипептид, была обнаружена всего в одном случае.
Кроме того, для подтверждения воспроизводимости, осуществляли ПЦР (42 циклов по 98°С в течение 10 секунд, 60°С в течение 15 секунд, и 68°С в течение одной минуты) с Tks Gflex(tm) ДНК Полимеразой (TAKARA BIO INC.), используя пару олигонуклеотидных праймеров, имеющих полинуклеотидные последовательности SEQ ID NO: 17 (F3fu-Fl: caactgcacacacgacctgta) и SEQ ID NO: 18 (SW780-R1: ccatcgtagtaggcttttcctg), и, в качестве субстрата, кДНК, имеющую происхождение из одних и тех же клинических препаратов рака легкого и кДНК, синтезированную из SW780 РНК. Амплифицированные образцы подвергали электрофорезу совместно с маркированной по размеру ДНК (Invitrogen).
Как показано на фигуре 4В, полученные результаты указывают на то, что кДНК фрагмента полинуклеотида, кодирующего FGFR3-BAIAP2L1 гибридный полипептид был обнаружен всего в одном случае. Представленные выше результаты указывают на то, что способ, описанный выше, предоставляет возможность обнаружения полинуклеотида, кодирующего FGFR3-BAIAP2L1 гибридный полипептид в кДНК, имеющих происхождение из клинических препаратов рака не-мочевого пузыря с различными типами праймеров, и таким образом предоставляет возможность отбора пациентов, которые являются положительными по полинуклеотиду, кодирующему FGFR3-BAIAP2L1 гибридный полипептид.
(2) Обнаружение полинуклеотидов, кодирующих FGFR3-BAIAP2L1 гибридные полипептиды в клинических препаратах рака легкого (non-рак мочевого пузыря) (Тест 2)
Осуществляли ПЦР (35 циклов по 98°С в течение 10 секунд, 60°С в течение 15 секунд, и 68°С в течение одной минуты) с Tks Gflex™ ДНК Полимеразой (TAKARA BIO INC.), используя пару олигонуклеотидных праймеров (набор 3), имеющих полинуклеотидные последовательности SEQ ID NO: 3 (F3fu-F2: tgtttgaccgagtctacactcacc) и SEQ ID NO: 4 (SW780-R2: gacatgtcccagttcagttgac), и, в качестве субстрата, 83 образцов кДНК, имеющих происхождение из клинических препаратов рака легкого (OriGene). Присутствие или отсутствие ДНК амплификации подтверждали для каждого образца путем электрофорез в агарозном геле. Полосы ДНК, имеющие представляющий интерес размер, обнаруживали в двух образцах, и было определено с помощью анализа ДНК последовательности (метод Sanger), то они представляют собой кДНК фрагмента последовательностей, имеющих происхождение из FGFR3-BAIAP2L1 гибридного полинуклеотида. Следовательно, подтверждали, что FGFR3-BAIAP2L1 гибридный полинуклеотид существует в кДНК, имеющих происхождение из клинических образцов злокачественных новообразований.
(3) Обнаружение полинуклеотидов, кодирующих FGFR3-ТАСС3 гибридные полипептиды в клинических препаратах рака легкого, рак пищевода, рак желудка, и рак печени (все рак не мочевого пузыря)
Осуществляли ПЦР (35 циклов по 98°С в течение 10 секунд, 60°С в течение 15 секунд, и 68°С в течение одной минуты) с Tks Gflex™ ДНК Полимеразой (TAKARA BIO INC.), используя пару олигонуклеотидных праймеров (набор 1), имеющих полинуклеотидные последовательности SEQ ID NO: 1 (F3fu-F3: gtgcacaacctcgactactacaag) и SEQ ID NO: 2 (RT112-R3: gtaatcctccacgcacttcttc), и, в качестве субстрата, 83 образцов кДНК, имеющих происхождение из клинических препаратов рака легкого (OriGene), 18 образцов кДНК, имеющих происхождение из клинических препаратов рака пищевода (OriGene), пять образцов кДНК, имеющих происхождение из клинических препаратов рака желудка (OriGene), и пять образцов кДНК, имеющих происхождение из клинических препаратов рака печени (OriGene). Присутствие или отсутствие ДНК амплификации подтверждали для каждого образца путем электрофорез в агарозном геле. Полосы ДНК, имеющие представляющий интерес размер, обнаруживали в образцах из двух случаев рака легкого, двух случаев рака пищевода, одного случая рака желудка, и одного случая рака печени; и было определено с помощью анализа ДНК последовательности (метод Sanger), что они представляют собой кДНК фрагмента последовательностей, имеющих происхождение из FGFR3-TACC3 гибридных полинуклеотидов. Таким образом, подтверждено, что FGFR3-TACC3 гибридные полинуклеотиды существуют в кДНК, имеющих происхождение из клинических препаратов различных типов злокачественных новообразований.
(4) Обнаружение полинуклеотидов, кодирующих FGFR3-BAIAP2L1 гибридные полипептиды в клеточных линиях рака мочевого пузыря, используя метод FISH
Для обнаружения FGFR3-BAIAP2L1 гибридных генов в клеточных линиях рака мочевого пузыря, используя метод флуоресцентной гибридизации in situ (FISH), осуществляли эксперимент, используя следующие двузондовые наборы и зафиксированные формалином и залитые парафином (FFPE) образцы клеточных линий рака мочевого пузыря RT112/84 и SW780.
FISH анализ осуществляли с использованием FGFR3 Split Dual Color FISH Probe (набор расщепленных сигнальных зондов, GSP Lab., Inc.) для обнаружения транслокации части FGFR3 гена на хромосоме человека 4 на другую хромосому, и с использованием FGFR3 и BAIAP2L1 FISH Probe (набор слитых сигнальных зондов, GSP Lab., Inc.) для обнаружения интеграции FGFR3 гена на хромосоме человека 4 и BAIAP2L1 гена на хромосоме человека 7 в ту же самую хромосому.
Как представлено на фигуре 5, результаты подтвердили, что, в FFPE образцах, приготовленных из SW780, сигналы двух цветов обнаруживали раздельно с помощью FISH анализа с расщепленным сигнальным зондом (А2 на фигуре 5), и слившийся сигнал двух цветов были обнаружен с помощью FISH анализа с набором слитых сигнальных зондов (В2 на фигуре 5). Таким образом, вышеуказанный метод указывают на то, что разделение FGFR3 гена и слияние FGFR3 и BAIAP2L1 генов может быть обнаружено с помощью FISH метода.
[Пример 6]
Оценка различных клеточных линий, которые экспрессируют FGFR3-ТАСС3 гибридный полипептид или FGFR3-BAIAP2L1 гибридный полипептид
(1) Оценка FGFR3 - зависимости различных клеточных линий
миРНК к FGFR3 или BAIAP2L1 добавляли всего к четырем типам клеток: клеточные линии RT4 и SW780, имеющие происхождение из рака мочевого пузыря человека, которые экспрессируют FGFR3-ТАСС3 гибридный полипептид или FGFR3-BAIAP2L1 гибридный полипептид; клеточная линия UM-UC-14, которая экспрессирует мутантный FGFR3 полипептид, но не экспрессирует гибридные полипептиды; и клеточная линия BFTC-905, которая экспрессирует FGFR3 полипептид дикого типа, но не экспрессирует гибридные полипептиды, и анализировали влияние каждого типа миРНК на пролиферацию клеток.
ON-TARGETplus siRNA Reagents (Thermo Fisher Scientific) использовали для миРНК.
Клетки, высеянные в планшеты на 96 лунок (UM-UC-14 и BFTC-905: 1.5Е+03 клеток/лунку; и SW780 и RT4: 2.5Е+03 клеток/лунку) культивировали в течение семи дней в присутствии каждой миРНК или холостой миРНК (использовали в качестве контроля) в десятикратных серийный разведениях (3 стадий) при максимальной концентрации 10 нМ. Клеточную пролиферацию через семь дней оценивали путем люминесцентного анализа жизнеспособности клеток CellTiter-Glo™ (Promega).
Как представлено на фигуре 6, полученные результаты указывают на то, что пролиферирующая активность клеток, которые экспрессируют FGFR3 полипептид дикого типа, но не экспрессируют гибридные полипептиды, не ингибируется миРНК к каждому из FGFR3 и BAIAP2L1. С другой стороны, пролиферирующая активность клеточной линии, которая экспрессирует мутантный FGFR3 полипептид, но не экспрессирует гибридные полипептиды, и пролиферирующая активность клеток, которые экспрессируют FGFR3-ТАСС3 гибридный полипептид, ингибируется только миРНК к FGFR3. С другой стороны, подтверждено, что пролиферация клеток, экспрессирующих FGFR3-BAIAP2L1 гибридный полипептид, ингибируется любой из миРНК по отношению к каждому из FGFR3 и BAIAP2L1.
(2) Оценка индукции апоптоза с помощью FGFR ингибитора по отношению к раковым клеткам, которые экспрессируют FGFR3-BAIAP2L1 гибридный полипептид
Каждое из шести соединений А-F (Таблицы 2-1 и 2-2), которые представляют собой вещества, подавляющие киназную активность FGFR, добавляли всего к четырех типам клеток: клеточная линия SW780, имеющая происхождение из рака мочевого пузыря человека, которая экспрессирует FGFR3-BAIAP2L1 гибридный полипептид; клеточная линия BFTC-905, которая экспрессирует FGFR полипептид дикого типа, но не экспрессирует гибридные полипептиды; клеточная линия UM-UC-14, которая экспрессирует мутантный FGFR3 полипептид, но не экспрессирует гибридные полипептиды; и клеточная линия НТ-1376, которая не экспрессирует FGFR3 для оценки будет ли индуцироваться апоптоз.
Клетки, высеянные в планшеты PrimeSurface™ 96U (Sumitomo Bakelite Co. Ltd.) (UM-UC-14 и BFTC-905: 3.0E+03 клеток/лунку; и SW780 и НТ-1376: 5.0Е+03 клеток/лунку) культивировали в течение четырех дней в присутствии ДМСО (использовали в качестве контроля) или каждое соединение в трехкратных серийных разведениях (4 стадий) при максимальной концентрации 20 мкМ. Клеточную пролиферацию и каспазную активность через четыре дня оценивали с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo™ (Promega) Caspase-Glo™ 3/7 (Promega), соответственно. Сумму каспазной активности в одиночной лунке, измеренной с помощью Caspase-Glo™ 3/7, разделяли на относительное количество жизнеспособных клеток в одиночной лунке, рассчитанное из значения CellTiter-Glo™, для расчета уровня апоптоза. Индукцию апоптоза в каждой клетке оценивали путем деления уровня апоптоза на уровень апоптоза для каждой клетки, рассчитанный для условий с добавлением ДМСО.
Как представлено на фигуре 7, результаты подтверждают, что в то время как апоптоз не индуцируется с помощью ингибитора в клетках, не реагирующих на FGFR ингибитор, апоптоз не индуцируется с помощью FGFR ингибитора в клетках, реагирующих на FGFR ингибитор.
(3) Ингибирующая активность FGFR ингибиторов на клеточную пролиферацию in vivo по отношению к клеткам, экспрессирующим FGFR3-BAIAP2L1 гибридный полипептид
Противоопухолевый эффект оценивали с использованием мышей, несущих злокачественное новообразование, путем трансплантирования клеток клеточной линии SW780 (АТСС) рака мочевого пузыря человека подкожно в паховую область BALB/c безтимусным мышам (Charles River Japan, Inc.). Безтимусные мыши выдерживали на карантине приблизительно в течение одной недели перед использованием, и им подкожно трансплантировали 5×106 SW780 клеток в паховую область. Когда размер опухоли достигал приблизительно 200 мм3, мышей использовали в экспериментах. Соединение А суспендировали в растворе, содержащем 10% ДМСО, 10% Cremophor EL, 15% PEG400, и 15% HPCD, и перорально вводили мышам в дозе 20 мл/кг один раз в сутки. Противоопухолевый эффект определяли путем сравнения роста опухоли в течение 11 дней после первого дня введения (День 10, если первый день введения устанавливали как День 0) с ростом в контрольной группе. Ингибирующий эффект на рост опухоли (TGI)=(1-[Средний уровень роста опухоли леченной группы]/[Средний уровень роста опухоли контрольной группы])×100(%)
Результаты представлены в таблице 5.
FGFR ингибиторы проявляют заметный достоверный ингибирующий эффект на рост опухоли у мышей, несущих опухолевые клетки, которые экспрессируют FGFR3-BAIAP2L1 гибридный полипептид в зависимости от концентрации.

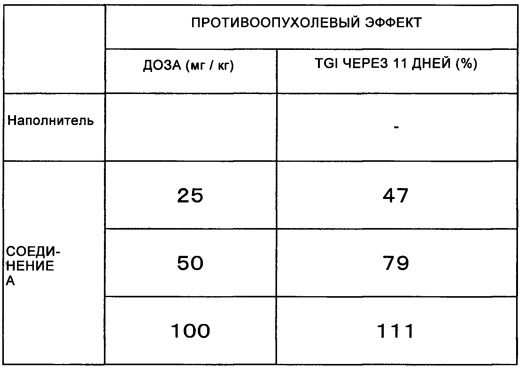
[Пример 7]
Исследование трансформирующей способности и опухолеродной способности FGFR3-BAIAP2L1 гибридных полипептидов
(1) Оценка трансформирующей способности FGFR3-BAIAP2L1 гибридного полипептида
кДНК (SEQ ID NO: 10), кодирующую FGFR3 (SEQ ID NO: 6), и кДНК (SEQ ID NO: 31), кодирующую FGFR3-BAIAP2L1 (SEQ ID NO: 32), каждую субклонировали в лентивирусном экспрессионном вектором pReceiver-Lv156 (GeneCopoeia); и лентивирус для каждого полипептида продуцировали, используя Lenti-Pac™ систему для упаковки лентивируса (GeneCopoeia).
Клетки RAT-2, имеющие происхождение из эмбрионов крыс, инфицировали каждым лентивирусом, и клетки культивировали в условии с селективным маркером пуромицином для установления RAT-2 клеток, которые стабильно экспрессируют FGFR3 полипептид или FGFR3-BAIAP2L1 гибридный полипептид. Как представлено на фигуре 8, морфологические изменения адаптированных клеток, стабильно экспрессирующих FGFR3-BAIAP2L1 гибридный полипептид, наблюдали в монослойной культуре.
Необработанные RAT-2 клетки (родительские клетки), RAT-2 клетки, стабильно экспрессирующие FGFR3 полипептид, или RAT-2 клетки, стабильно экспрессирующие FGFR3-BAIAP2L1 гибридный полипептид, высевали при плотности 2,0×103 клеток/лунку в планшете PrimeSurface™ 96U (Sumitomo Bakelite Co. Ltd.) культивировали в течение 14 дней. Как представлено на фигуре 9, когда через 14 дней наблюдали и фотографировали, было обнаружено, что независимая от каркаса клеточная пролиферация усилена только в RAT-2 клетках, стабильно экспрессирующих FGFR3-BAIAP2L1 гибридный полипептид.
На основании результатов, подтверждали, что FGFR3-BAIAP2L1 гибридный полипептид имеет трансформирующую способность в нормальных клетках.
(2) Оценка трансформирующей способности FGFR3-BAIAP2L1 гибридного полипептида, в котором отсутствует участок, способствующий димеризации
кДНК, кодирующую FGFR3-BAIAP2L1 ΔBAR, в котором отсутствует BAR домен, представляющий собой участок, способствующий димеризации BAIAP2L1 полипептида (аминокислотная последовательность: SEQ ID NO: 8 / последовательность нуклеиновых кислот: SEQ ID NO: 12), продуцировали с помощью способа сайт-направленного мутагенеза, используя метод ПЦР. кДНК, кодирующие каждый из FGFR3 (такие же, как указано выше), FGFR3-BAIAP2L1 (такие же, как указано выше), и FGFR3-BAIAP2L1 ΔBAR субклонировали в pCXND3 вектор (KAKETSUKEN) для продукции векторов для экспрессии каждого из полипептидов.
pCXND3 вектор (носитель) или вектор для экспрессии каждого полипептида интродуцировали в эмбриональные клетки почки человека 293, используя FuGENE™ HD Transfection Reagent (Promega). Через один день, клетки собирали в виде клеточных лизатов, используя буфер для лизиса клеток (Cell Signaling Technology). Как представлено на фигуре 10, если каждый клеточный лизат анализировали с помощью вестерн-блоттинга, используя антитело к фосфо-FGF рецептору (Tyr653/654) (Cell Signaling Technology) или анти-FGFR3 антитело (Santa Cruz), то подтверждали, что FGFR фосфорилирование, которое усилено на FGFR3-BAIAP2L1 гибридном полипептиде, ослаблено на FGFR3-BAIAP2L1 ΔBAR гибридном полипептиде, с отсутствующим BAR доменом, который представляет собой участок, способствующий димеризации BAIAP2L1 полипептида.
Кроме того, с помощью способа, аналогичного описанному в исследовании выше (1), RAT-2 клетки, которые стабильно экспрессируют BAIAP2L1 полипептид (такие же, как указано выше) или FGFR3-BAIAP2L1 ΔBAR гибридный полипептид (такие же, как указано выше), устанавливали, используя лентивирусы.
Необработанные RAT-2 клетки (родительские клетки), RAT-2 клетки, стабильно экспрессирующие FGFR3 полипептид, RAT-2 клетки, стабильно экспрессирующие BAIAP2L1 полипептид, RAT-2 клетки, стабильно экспрессирующие FGFR3-BAIAP2L1 гибридный полипептид, или RAT-2 клетки, стабильно экспрессирующие FGFR3-BAIAP2L1 ΔBAR гибридный полипептид, высеивали при плотности 2,0×103 клеток/лунку в планшете PrimeSurface™ 96U (Sumitomo Bakelite Co. Ltd.), и культивировали в течение 14 дней. Через 14 дней определяли количество клеток с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo™ (Promega). Как представлено на фигуре 11, наблюдали, что RAT-2 клетки, стабильно экспрессирующие BAIAP2L1 полипептид, не имеют способности независимой от каркаса клеточной пролиферации, и способность независимой от каркаса клеточная пролиферация, наблюдаемая в RAT-2 клетках, стабильно экспрессирующих FGFR3-BAIAP2L1 гибридный полипептид, была утрачена в RAT-2 клетках, стабильно экспрессирующих FGFR3-BAIAP2L1 ΔBAR гибридный полипептид.
Таким образом, было подтверждено, что трансформирующая способность FGFR3-BAIAP2L1 гибридного полипептида на нормальных клетках вызывается усиленным транс-аутофосфорилированием FGFR3 полипептида благодаря участку, способствующему димеризации, в BAIAP2L1 полипептиде.
(3) Оценка опухолеродной способности FGFR3-BAIAP2L1 гибридного полипептида, и активность подавлять распространение опухоли для FGFR ингибитора
RAT-2 клетки, которые стабильно экспрессируют FGFR3 полипептид, BAIAP2L1 полипептид, FGFR3-BAIAP2L1 гибридный полипептид, или FGFR3-BAIAP2L1 BAR гибридный полипептид, адаптированные в вышеописанных экспериментах (1) и (2), инокулировали подкожно в паховую область BALB/c безтимусныи мышам (Charles River Laboratories Japan) в количестве 4,8-5,4×106 клеток, и за мышами наблюдали в течение 15 дней. Как представлено на фигуре 12, распространение опухоли подтверждали у мышей, которым инокулировали RAT-2 клетки, стабильно экспрессирующие FGFR3-BAIAP2L1 гибридный полипептид.
Кроме того, RAT-2 клетки, которые стабильно экспрессируют FGFR3-BAIAP2L1, инокулировали безтимусным мышам в количестве 5,04×106 клеток. Через семь дней после пересадки клеток, перорально вводили FGFR ингибитор соединение А (такой же, как описано выше), суспендированных в растворе, содержащем 10% ДМСО, 10% Cremophor EL, 15% PEG400, и 15% HPCD, один раз в сутки мышам в концентрации 20 мл/кг. Как представлено на фигуре 13, наблюдали, что распространение опухоли, усиленное FGFR3-BAIAP2L1 гибридным полипептидам, было существенно подавлено FGFR ингибитором в зависимости от концентрации.
Было подтверждено, что FGFR3-BAIAP2L1 гибридный полипептид обладает чрезвычайно сильной опухолеродной способностью, и его опухолеродная способность подавляется FGFR ингибитором.
Промышленная применимость
Гибридные полипептиды, содержащие FGFR3 полипептид и другой полипептид согласно настоящему изобретению, экспрессируются специфически в различных типах раковых клеток, включая клетки рака мочевого пузыря. Пролиферация клеток, экспрессирующих такие гибридные полипептиды, существенно ингибируется соединениями, имеющими FGFR ингибирующую активность. Таким образом, применение гибридного полипептида согласно настоящему изобретению в качестве биомаркера для терапии злокачественного новообразования на основе ингибитора FGFR предоставляет возможность оценить каждого пациента относительно применимости или схемы применения FGFR ингибитора, и предоставляет возможность избежать побочных эффектов и контролировать схему терапии для получения наилучшего терапевтического эффекта при терапии на основе ингибитора FGFR. Следовательно, это предоставляет возможность персонализировать медицину.
Дополнительно, применение гибридных полипептидов согласно настоящему изобретению в качестве мишени для разработки противораковых терапевтических средств, которые нацелены на FGFR, то есть, молекулярно нацеленных терапевтических средств, предоставляет возможность обеспечивать FGFR ингибиторы с более высоким уровнем специфичности и противоопухолевой активности для целевых раковых клеток, а также противораковые терапевтические средства, содержащие ингибиторы.
FGFR ингибиторы, полученные, как описано выше, обладают высокой специфичностью к целевым раковым клеткам, и, следовательно, становиться возможным обеспечивать противораковые терапевтические средства с большей противоопухолевой активностью, но с меньшими побочными эффектами.
Кроме того, гибридные полипептиды согласно настоящему изобретению имеют близкую корреляцию с различными типами злокачественных новообразований, и, следовательно, можно тестировать предрасположенность к злокачественному новообразованию (чувствительность к злокачественному новообразованию) у субъектов, будут ли субъекты поражены злокачественным новообразованием, или будет ли злокачественное новообразование прогрессировать у субъектов, путем определения присутствия или отсутствия гибридного полипептида согласно настоящему изобретению или полинуклеотида, кодирующего гибридный полипептид в образцах от пациентов, которые включают не только пациентов со злокачественным новообразованием, но также и здоровых особей.
Дополнительно, гибридные полипептиды согласно настоящему изобретению имеют близкую корреляцию с различными типами злокачественных новообразований, и, следовательно, могут быть обеспечены FGFR ингибиторы с высокой специфичностью к FGFR путем идентификации тестируемого соединения, которое ингибирует пролиферацию клеток (таких как раковые клетки), экспрессирующих гибридные полипептиды согласно настоящему изобретению, путем сравнения уровня клеточной пролиферации между присутствием и отсутствием тестируемого соединения.