Результат интеллектуальной деятельности: Штамм Bacillus amyloliquefaciens, обладающий антибактериальной и фунгистатической активностью, и микробиологический препарат на его основе против болезни растения, вызываемой фитопатогенным микроорганизмом
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к сельскому хозяйству, более точно - к агрохимии и биологической защите растений, в частности, к выделенным бактериальным штаммам Bacillus amyloliquefaciens Аб8б и Аб60, а также применению микробиологического препарата на основе таких штаммов для борьбы с болезнями сельскохозяйственных культур, таких как овощные и зерновые культуры, вызываемыми фитопатогенными бактериями и грибами.
Описание предшествующего уровня техники
Повышение урожайности сельскохозяйственных культур и сохранение урожая - есть одна из наиболее важных задач в сельском хозяйстве, на решение которой ежегодно тратятся значительные ресурсы. В частности, значительное внимание уделяется защите овощных и зерновых культур, таких как, например, картофель и пшеница от болезней, вызываемых фитопатогенными микроорганизмами. Например, среди болезней картофеля наиболее часто встречаются бактериозы, которые распространены повсеместно на территории России и уносят от 10 до 25% урожая. В некоторых районах страны во влажные годы потери урожая могут достигать 50%. К числу наиболее распространенных и вредоносных бактериальных болезней картофеля относятся черная ножка, также известная как гниль корневой шейки сеянцев (Фиг. 1А), и мягкая, или мокрая гниль (Фиг. 1Б), симптомы которых проявляются на растениях в период вегетации и на клубнях при хранении. Эти болезни вызывают три самостоятельных, но близкородственных вида пектолитических бактерий семейства Enterobacteriaceae, такие как принадлежащие к подвиду Pectobacterium carotovorum subsp. carotovorum, виду Pectobacterium atrosepticum и роду Dickeyа (Игнатов A.H.,
Распространение возбудителей опасных бактериозов растений в Российской Федерации, Защита картофеля, 2014, 2:53-57).
Недавно в России была выявлена ранее не встречавшаяся болезнь тепличного огурца - бородатость корней, также называемая как «корневой мат» (root mat), «косматый корень», «бородатый корень» и т.п., возбудителем которой, как было установлено, является бактерия Agrobacterium spp. биовар 1 (Ходыкина М.В. и др., Новая бактериальная болезнь тепличного огурца, Гавриш, 2014, 3:24-29). Фитопатогенные бактерии, проникнув в растение и перенеся в его клетки фрагмент Т-ДНК (pRi ДНК), вызывают чрезмерное разрастание корневой системы огурца (Фиг. 2), при этом падает урожайность, ухудшается товарный вид плодов, растения быстрее нормы увядают и отмирают.
Известны болезни зерновых культур, такие как, например, Мучнистая роса пшеницы, вызываемая грибом Erysiphe graminis; альтернариоз (гриб Altemaria spp.) и фузариоз (гриб Fusarium spp.) пшеницы, а также черный бактериоз озимой пшеницы, вызываемый бактериями рода Xanthomonas spp.
Сельскохозяйственные предприятия на территории России, занимающиеся выращиванием овощных и зерновых культур, применяют различные разрешенные способы борьбы с фитопатогенами. Тем не менее, не все они дают желаемый результат: не стимулируют пассивный иммунитет растений, не повышают вовсе или в требуемой степени всхожесть семян и рост растений и/или их биомассу, урожайность, товарный вид плодов. Широко распространено применение пестицидов, однако они имеют существенные недостатки, например: токсичность как для сельскохозяйственных культур, так и для окружающей среды, вызывают ожог листьев, необходимость постоянно проводить поиск новых препаратов, так как уже после 3-4 обработок возможно появление устойчивых к пестицидам штаммов фитопатогенов, отрицательное субъективное восприятие потребителями. Фитопатогенные бактерии способны приобретать устойчивость к антибиотикам при их применении в качестве антибактериальных препаратов.
В связи с этим особое внимание уделяется биологическому способу защиты сельскохозяйственных растений, заключающемуся в том, что вместо пестицидов используют препараты на основе живых штаммов бактерий-антагонистов и продуктов их метаболизма. Использование бактерий-антагонистов для борьбы с бактериальными болезнями известно с 80-90-х годов, но их применение, в частности, против пектолитических бактерий изучено мало. Известно, что под влиянием бактерий-антагонистов фитопатогенные микроорганизмы вытесняются из прикорневой зоны (ризосферы) сельскохозяйственных растений, вследствие чего пагубное влияние фитопатогенных микроорганизмов значительно снижается или растения вовсе не подвергаются заражению. Подавление или полное уничтожение болезнетворных форм происходит под влиянием веществ, выделяемых бактериями-антагонистами. Антибиотические вещества оказывают свое бактерицидное действие в тканях растений, но в почве эти вещества утрачивают свои свойства (Вердеревский Д.Д., Иммунитет растений к паразитарным болезням. // Гос. изд-во сельхоз. лит-ры, 1959, 372 с.).
Известны способы защиты сельскохозяйственных растений от фитопатогенных микроорганизмов с использованием биопрепаратов, содержащих бактерии-антагонисты. Например, известно средство повышения продуктивности растений и их защиты от болезней, вызываемых фитопатогенными бактериями и грибами, содержащее штамм Bacillus amyloliquefaciens subsp. plantarum BS89 с титром бактерий 104-109 клеток/мл (патент РФ №2599416 С1). Установлено, что указанный штамм проявляет антагонистические свойства в отношении возбудителей болезней сельскохозяйственных культур, в частности, пшеницы озимой и яровой - против мучнистой росы (Erysiphe graminis), бурой ржавчины (Puccinia recondita), фузариозной корневой гнили (Fusarium culmorum), базального бактериоза (Pseudomonas syringae); картофеля - против фитофтороза (Phytophtora infestans), ризоктониоза (Rhizoctonia solani), фузариозного увядания (Fusarium oxysporum). Однако не было показано, что штамм Bacillus amyloliquefaciens subsp. plantarum BS89 активен против бактерий родов Pectobacterium, Dickeya и Agrobacterium, также не известно его влияние на фитопатогенные микроорганизмы, вызывающие болезни растений семейства тыквенные (Cucurbitaceae).
Также известен биопрепарат для стимуляции роста и защиты растений от бактериальных и грибных болезней, повышения урожайности и почвенного плодородия, содержащий биомассу из вегетативных клеток и спор бактерий вида Bacillus amyloliquefaciens (ВКПМ В-11008) с титром вегетативных клеток и спор 1,24-1,30×1010 KOE/мл и содержанием спор 94% от общего количества KOE (патент РФ №2478290 С2). Применение биопрепарата ограничено зерновыми культурами.
Также известен биологический препарат для защиты зерновых растений от болезней, вызываемых фитопатогенными грибами, содержащий в виде активного начала культуральную жидкость штамма Bacillus amyloliquefaciens (ВКПМ В-11475) с титром 2-3×109 KOE/мл (патент РФ №2528058 С1).
Известна композиция, содержащая штаммы Bacillus amyloliquefaciens ВОТ SPO (DSMZ 29231) и STB / 01 (DSMZ 29232), для подавления, в частности, бактерии вида Ralstonia solanacearum, поражающей растения семейства пасленовые (Solanaceae), такие как, например, картофель, томат, баклажан (публикация заявки РСТ WO 2016046155 А1). Рабочая концентрация штаммов ВОТ SPO и STB / 01 в тепличном опыте с томатом была 2×1010-2×1014 KOE/мл при концентрации патогенной Ralstonia solanacearum 2×106 KOE/мл. Указанная композиция и входящие в ее состав штаммы ВОТ SPO и STB / 01 проявляли антагонистические свойства также в отношении бактерии подвида Pectobacterium carotovorum subsp. carotovorum.
Известны штаммы Bacillus amyloliquefaciens RTI301 и RTI472, содержащие кластер генов биосинтеза лантипептида, проявляющего свойства лантибиотика, и композиции на их основе для улучшения роста растений и защиты их от инфекций (публикации заявок РСТ WO 2016109395 А1 и WO 2016109396 А1). Антагонистическая активность штаммов RTI301 и RTI472 против бактериальных и грибных фитопатогенов была подтверждена опытным путем, включая фитопатогены Alternaria solani и Fusarium graminearum, поражающие пшеницу (парша), Ralstonia solenacearum, Xanthomonas и Botrytis cinerea, поражающие томаты (пятнистость, коричнево-серая плесень), Sclerotinia sclerotiorum, поражающую фасоль (белая плесень), и фитопатогены, вызывающие мучнистую росу огурцов. Заявленная концентрация штаммов в композициях составляет 1×108-1×1012 КОЕ/мл. Влияние штаммов RTI301 и RTI472 на подавление бактерий родов Pectobacterium, Dickeya и Agrobacterium и грибов родов Erysiphe и Pseudoperonospora (оомицет) в опубликованных патентных заявках опытным путем не изучалось.
Однако, отсутствуют данные, которые описывали бы бактериальные штаммы Bacillus amyloliquefaciens Аб8б и Аб60 и микробиологический препарат на их основе, обладающие ярко выраженной антибактериальной и фунгистатической активностью, которые могут применяться для борьбы с различными болезнями, вызываемыми фитопатогенными бактериями и грибами, относящимися, в частности, к родам Pectobacterium, Dickeya, Agrobacterium, Erysiphe и Pseudoperonospora, поражающие овощные и зерновые культуры.
Раскрытие сущности изобретения
Задачей настоящего изобретения является разработка микробиологического препарата на основе одного или нескольких бактериальных штаммов для борьбы с фитопатогенными бактериями и грибами, вызывающими болезни сельскохозяйственных культур, в частности, овощных и зерновых культур. Как следствие, другой задачей изобретения является разработка микробиологического препарата на основе одного или нескольких штаммов бактерий-антагонистов, применение которого способно улучшить всхожесть семенного материала сельскохозяйственных культур, питание и рост растений, повысить биомассу растений и их продуктивность, благоприятно влиять на сохранность семенного материала и урожая. Предоставление микробиологического препарата на основе бактериальных штаммов позволяет расширить арсенал технических средств, которые могут применяться для борьбы с фитопатогенами сельскохозяйственных овощных и зерновых культур. В частности, предоставляемый согласно изобретению препарат позволяет расширить арсенал технических средств, которые могут быть использованы для защиты от фитопатогенных бактерий и грибов, например, растений семейства пасленовые (Solanaceae), тыквенные (Cucurbitaceae) и зерновые (Роасеае). Указанные задачи были решены благодаря тому, что были выделены из природного источника и определены штаммы Bacillus amyloliquefaciens (В. amyloliquefaciens) Аб8б и В. amyloliquefaciens Аб60, которые, как было найдено, обладают антибактериальной и фунгистатической активностью в отношении фитопатогенных бактерий и грибов, вызывающих болезни растений семейства пасленовые, тыквенные и зерновые, в частности, картофеля, огурца и пшеницы, соответственно.
Таким образом, одним из аспектов настоящего изобретения является предоставление штамма Bacillus amyloliquefaciens Аб60, депонированного в ВКПМ под номером В-12791, обладающего антибактериальной и фунгистатической активностью.
Другим аспектом настоящего изобретения является предоставление штамма Bacillus amyloliquefaciens Аб8б, депонированного в ВКПМ под номером В-12792, обладающего антибактериальной и фунгистатической активностью.
Другим аспектом настоящего изобретения является предоставление микробиологического препарата, содержащего штамм Bacillus amyloliquefaciens Aб8б, депонированный в ВКПМ под номером В-12792, против болезни растения, вызываемой фитопато генным микроорганизмом.
Также аспект настоящего изобретения - предоставление вышеописанного микробиологического препарата, отличающегося тем, что фитопатогенный микроорганизм есть бактерия или гриб.
Также аспект настоящего изобретения - предоставление вышеописанного микробиологического препарата, отличающегося тем, что титр указанного штамма, по меньшей мере, 1×104 КОЕ/мл.
Также аспект настоящего изобретения - предоставление вышеописанного микробиологического препарата, отличающегося тем, что титр указанного штамма от 1×104 КОЕ/мл до 1,5×109 КОЕ/мл.
Также аспект настоящего изобретения - предоставление вышеописанного микробиологического препарата, отличающегося тем, что титр указанного штамма от 1×104 КОЕ/мл до 1×107 КОЕ/мл.
Также аспект настоящего изобретения - предоставление вышеописанного микробиологического препарата, отличающегося тем, что указанный препарат также содержит штамм Bacillus amyloliquefaciens Аб60, депонированный в ВКПМ под номером В-12791.
Также аспект настоящего изобретения - предоставление вышеописанного микробиологического препарата, отличающегося тем, что титр указанного штамма Bacillus amyloliquefaciens Аб60, по меньшей мере, 1×104 КОЕ/мл.
Также аспект настоящего изобретения - предоставление вышеописанного микробиологического препарата, отличающегося тем, что указанное выше растение принадлежит к семейству пасленовые (Solanaceae), тыквенные (Cucurbitaceae) или зерновые (Роасеае).
Также аспект настоящего изобретения - предоставление вышеописанного микробиологического препарата, отличающегося тем, что растение есть картофель 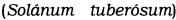 , томат
, томат 
 , огурец (Cucumis sativus) или пшеница (Triticum).
, огурец (Cucumis sativus) или пшеница (Triticum).
Краткое описание Фигур
Фигура 1 показывает растение картофеля, пораженное болезнью «черная ножка» (место поражения указано стрелкой), которая вызвана бактерией рода Dickeya (А) и мягкой гнилью, которая вызвана бактерией подвида Pectobacterium carotovorum subsp.carotovorum (Б).
Фигура 2 показывает растение тепличного огурца, пораженного болезнью «корневой мат».
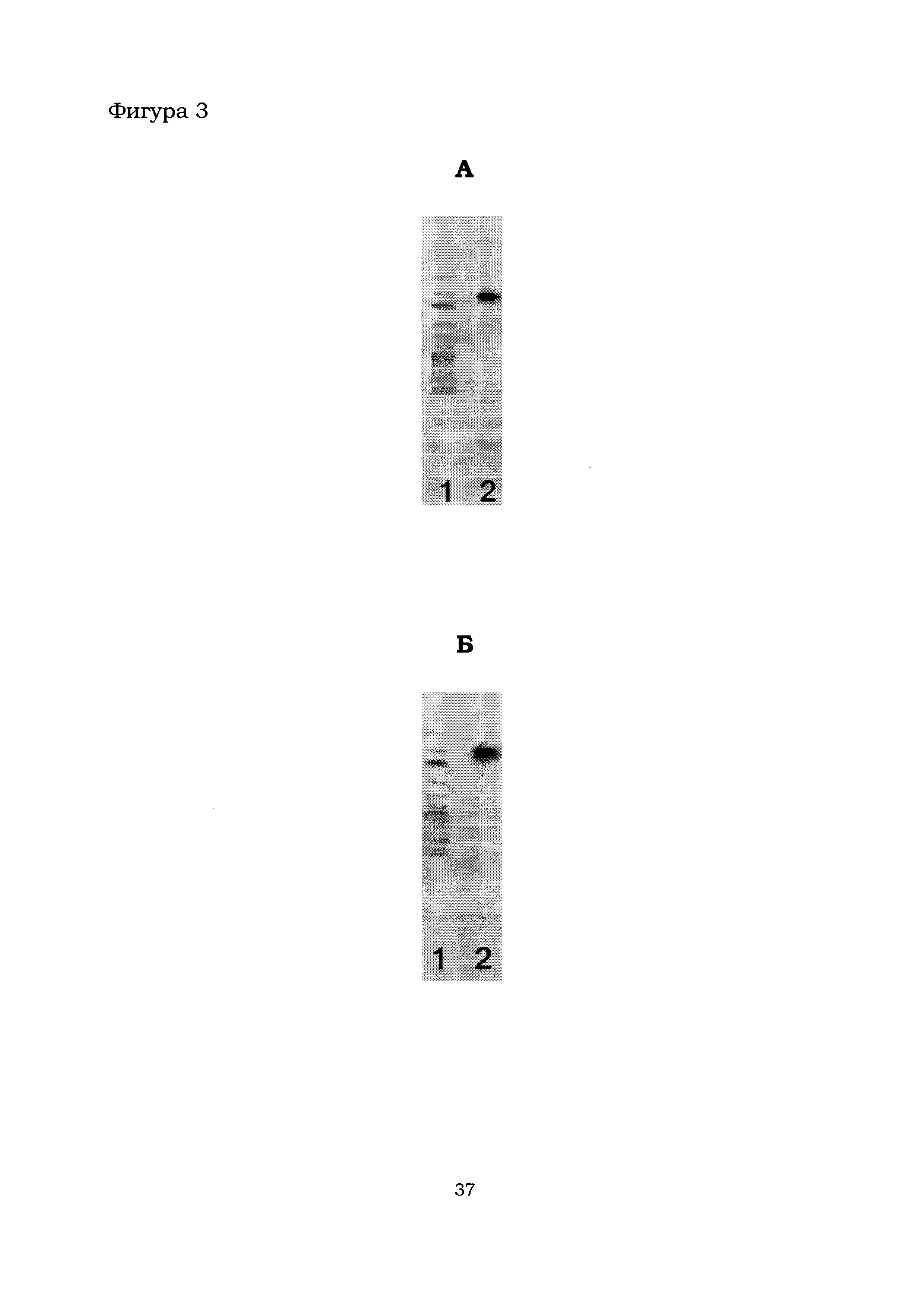
Фигура 3 показывает результаты ПЦР-анализа 16S рДНК штамма В. amyloliquefaciens Аб8б (А) и В. amyloliquefaciens Аб60 (Б). Дорожки: 1 - маркер длин ДНК (1 kb DNA, GeneRuler), снизу-вверх: 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500 и 250 п. н.; 2 - реакционная смесь, содержащая ДНК-фрагмент длиной 747 п. н., полученный с помощью ПЦР с использованием видоспецифичных праймеров Р6 и Р7.
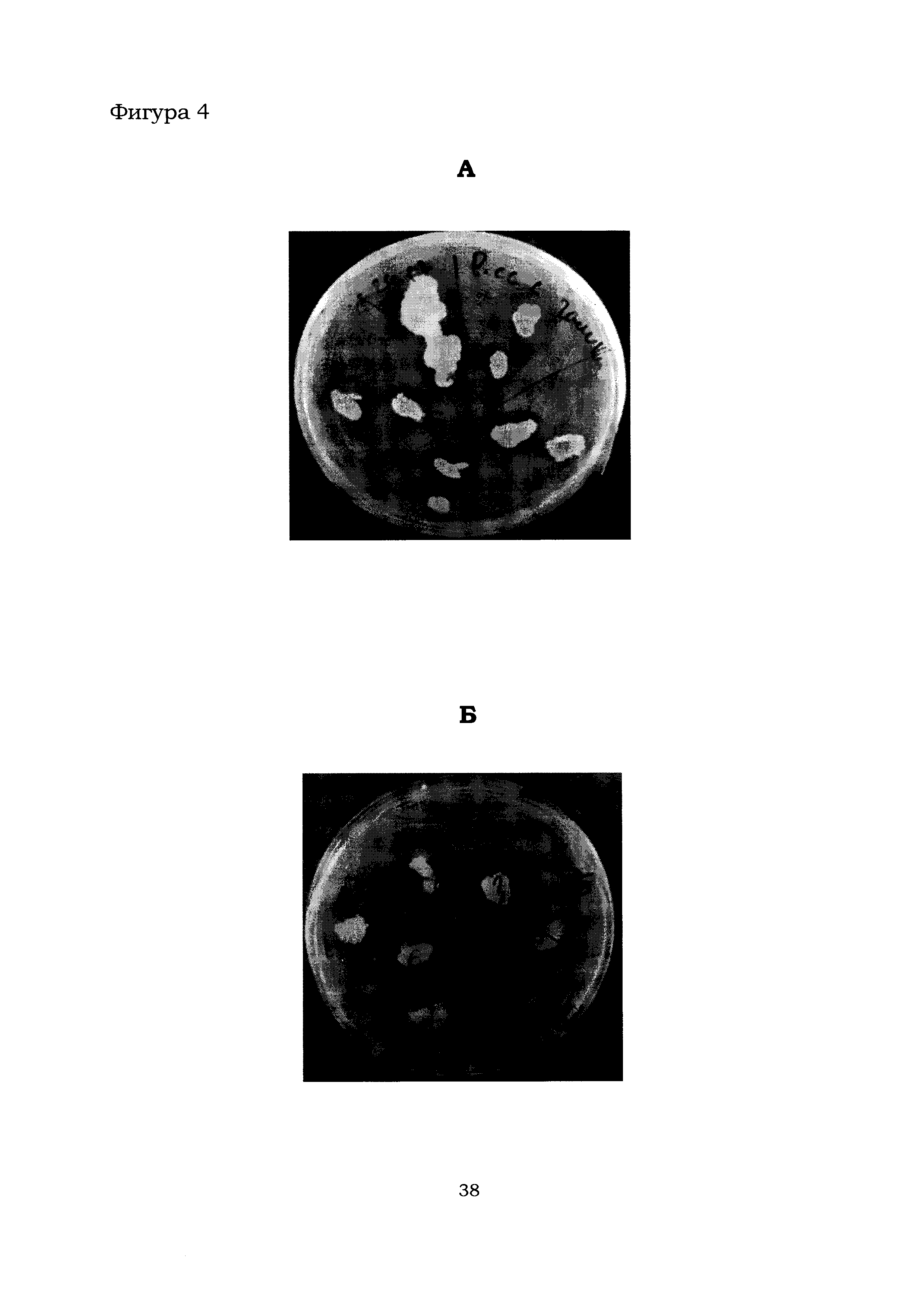
Фигура 4 показывает результаты изучения антагонистической активности штаммов В. amyloliquefaciens Аб60 и Аб60 в отношении бактерий подвида Pectobacterium carotovorum subsp. carotovorum (А) и вида Pectobacterium atrosepticum (Б).
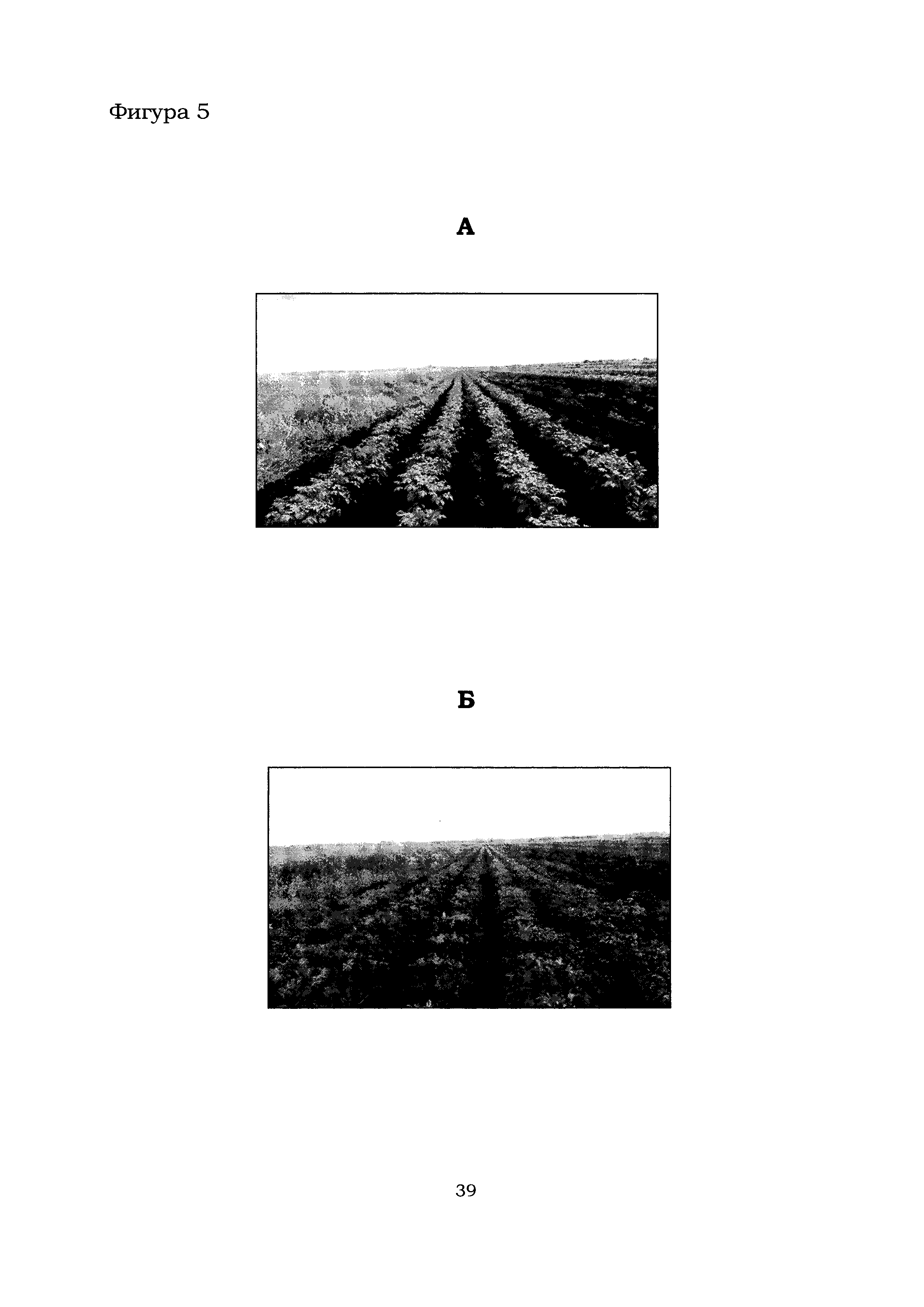
Фигура 5 показывает общий вид контрольной (А) и тестовой (Б) делянок растений картофеля в с. Горшково.
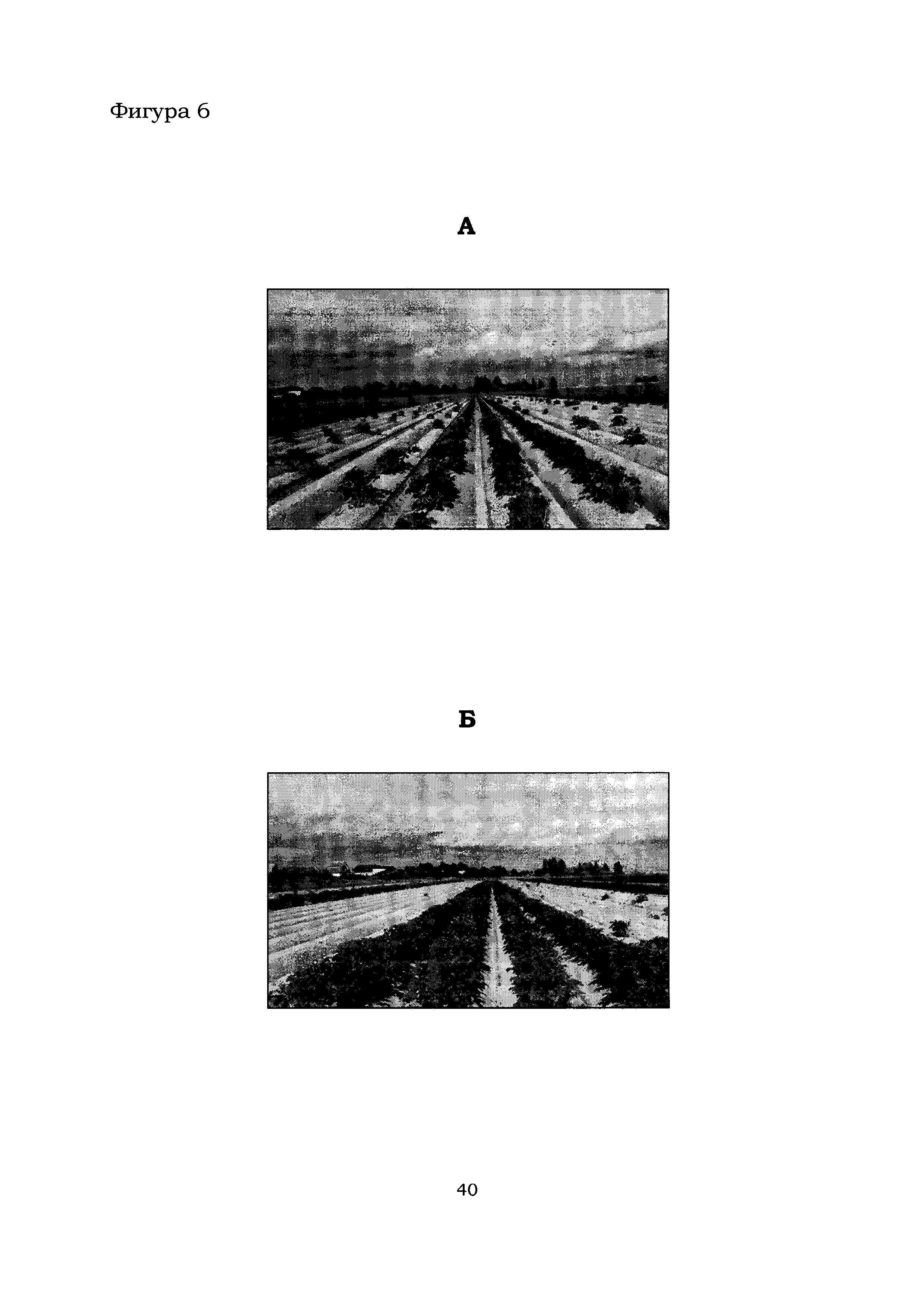
Фигура 6 показывает общий вид контрольной (А) и тестовой (Б) делянок растений картофеля в с. Рогачево.
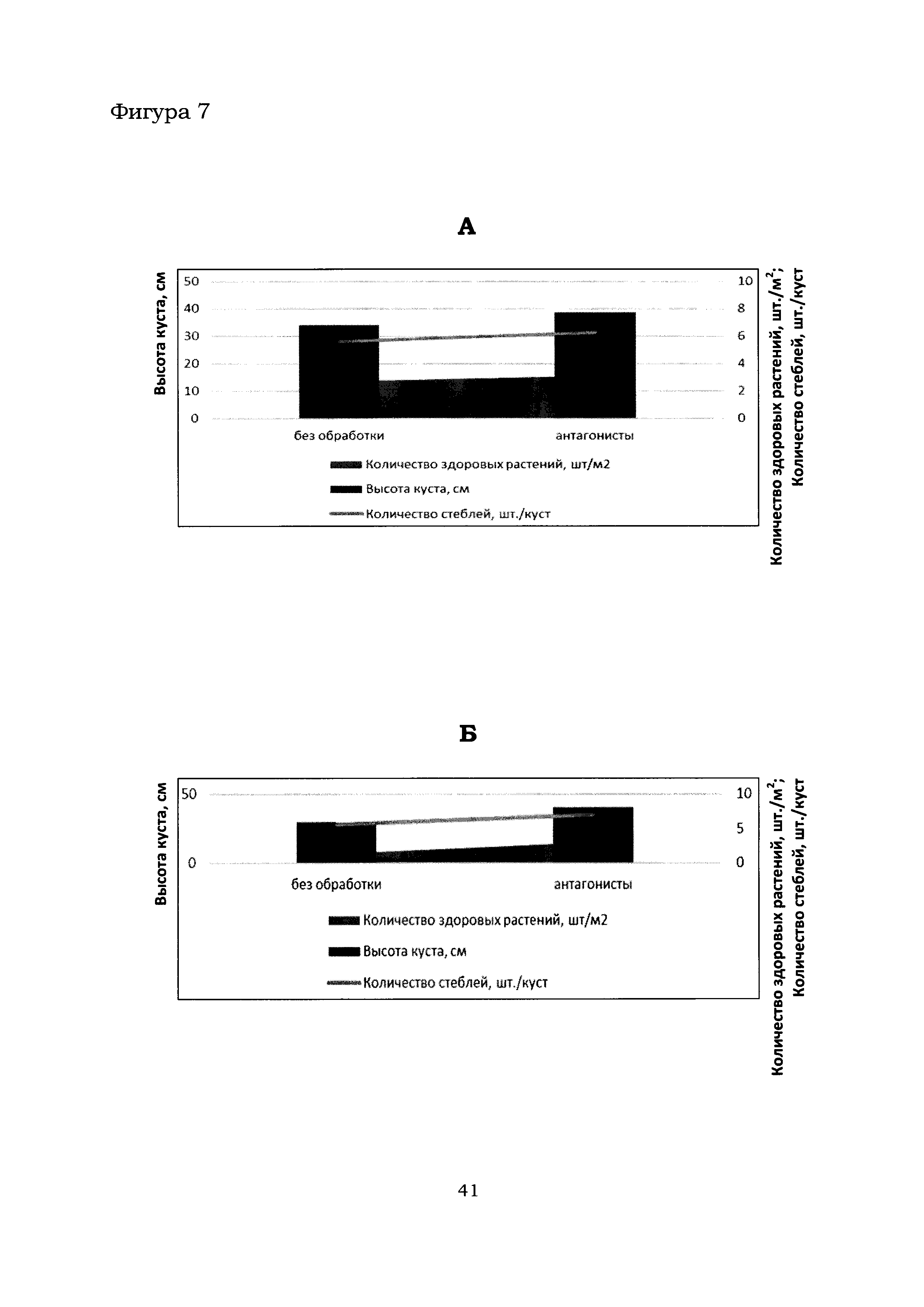
Фигура 7 показывает результаты обработки растений картофеля микробиологическим препаратом в с. Горшково (А) и с. Рогачево (Б).
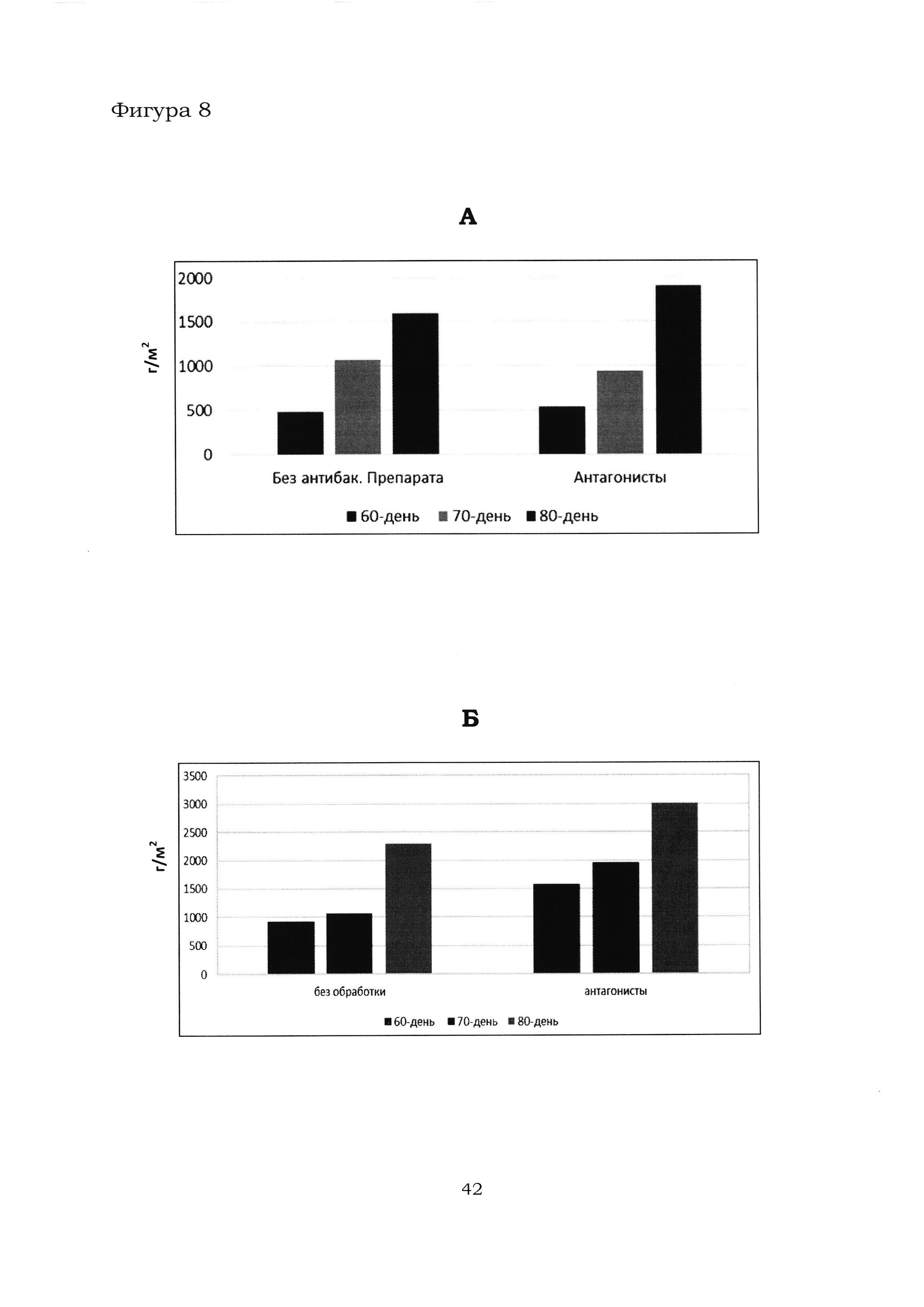
Фигура 8 показывает динамику накопления урожая растениями картофеля на делянках в с. Горшково (А) и с. Рогачево (Б).
Описание способов осуществления изобретения
Настоящее изобретение более подробно будет описано ниже с приведением не ограничивающих настоящее изобретение Примеров.
Штаммы В. amyloliquefaciens Аб8б и Аб60 выделены в 2015 году из растений озимой пшеницы (Triticum aestivum L.), выращенной в Московской области в природных условиях. Как показано в нижеследующих Примерах, полученные бактериальные штаммы Аб8б и Аб60 проявляют антагонистические свойства, т.е. выступают как бактерии-антагонисты в отношении фитопатогенных бактерий, относящихся, например, к роду Pectobacterium, в частности, подвидам Pectobacterium carotovorum subsp.carotovorum и Pectobacterium carotovorum subsp. brasiliensis, видам Pectobacterium atrosepticum и Pectobacterium wasabiae, роду Dickeya, в частности, виду Dickeya solani, и роду Agrobacterium, в частности, виду Agrobacterium rhizogenes, а также грибов, относящихся, например, к роду Erysiphe, в частности, виду Erysiphe cichoracearum, роду Pseudoperonospora, в частности, виду Pseudoperonospora cubensis, и роду Sclerotinia, в частности, виду Sclerotinia sclerotiorum. Ввиду того, что штаммы бактерий могут проявлять антагонистические свойства в отношении различных семейств, родов и видов фитопатогенных бактерий и грибов (см. например, RU 2528058 C1, WO 2016109395 А1 и WO 2016109396 А1), для специалиста в данной области техники очевидно, что штаммы В. amyloliquefaciens Аб8б и Аб60 могут быть антагонистами не только в отношении вышеуказанных фитопатогенных бактерий и грибов, относящихся к родам Pectobacterium, Dickeya, Agrobacterium, Erysiphe, Pseudoperonospora и Sclerotinia, но других фитопатогенных бактерий и грибов, таких как, например, относящихся к родам Pseudomonas, Fusarium и др. Следовательно, микробиологический препарат согласно изобретению, содержащее, по меньшей мере, штамм В. amyloliquefaciens Аб8б, может применяться не только в отношении фитопатогенных микроорганизмов, для которых антагонистический эффект подтвержден опытным путем в нижеследующих Примерах, но также и в отношении других бактериальных и грибных фитопатогенов, относящихся, например, к родам Pseudomonas, Fusarium, Rhizoctonia, Alternaria, Aspergillus и др. Наличие или отсутствие антагонистической активности штаммов В. amyloliquefaciens Аб8б и Аб60, а также степень такой активности можно определить, используя известные специалисту в данной области техники способы определения антибактериальной и фунгистатической активности штаммов бактерий-антагонистов. Например, антибактериальную активность тестируемого штамма можно определить, оценивая степень подавления им роста фитопатогенного штамма в среде, содержащей тестируемый и фитопатогенный штамм, как описано, в частности, в Примерах или патенте РФ №RU 2528058 С1. Фунгистатическую активность тестируемого штамма можно определить, например, in vitro, используя метод двойных (встречных) культур или «агаровых блоков», высевая мицелий фитопатогенного гриба и тестируемый штамм бактерии-антагониста на чашку Петри с питательной средой (Ваксман З.А. Антагонизм микробов и антибиотические вещества. М.: Гос. изд-во иностр. лит., 1947. - 391 с.; Егоров Н.С. Выделение микробов-антагонистов и биологические методы учета их антибиотической активности. М.: Изд-во Моск. ун-та, 1957. - 78 с.).
Известно, что один и тот же вид фитопатогенного микроорганизма может вызывать болезнь у сельскохозяйственных культур, принадлежащих к различным семействам, родам, видам и подвидам. Например, бактерия подвида Pectobacterium carotovorum subsp. carotovorum, относящаяся к пектолитическим бактериям ввиду ее свойства гидролизовать пектин между клеточными стенками растений, вызывает болезнь мягкую гниль, поражающую растения семейства пасленовые (Solanaceae), к которому относятся, в частности, картофель  , томат
, томат  , баклажан
, баклажан  melongena); семейства зонтичные (Apiaceae), к которому относится, в частности, морковь посевная (Daucus carota subsp.sativus); семейства тыквенные (семейство Cucurbitaceae), к которому относятся, в частности, огурец (Cucumis sativus), тыква обыкновенная (Cucurbita реро) и кабачок (Cucurbita реро subsp. реро); семейства луковые (подсемейство Alliaceae), к которому относится, в частности, лук (Allium); и др. Также известно, что, например, бактерия вида Agrobacterium rhizogenes (Rhizobium rhizogenes), способная встраивать собственную Т-ДНК в геном растения, вызывает ветвистость корней у многих двудольных растений, в частности, огурца и томата, относящихся к различным семействам (Ходыкина М.В. и др., 2014), а бактерия вида Pseudomonas syringae pv. lachrymans вызывает угловатую пятнистость огурца, кабачка и тыквы (Игнатов А.Н., 2014). Следовательно, микробиологический препарат согласно изобретению, содержащий по меньше мере штамм В. amyloliquefaciens Аб8б, может применяться не только для сельскохозяйственных культур, положительный эффект для которых подтвержден опытным путем в нижеследующих Примерах, включая растения картофеля, огурца и пшеницы озимой (Triticum aestivum L.), но также и для других культур, относящихся к семействам пасленовые, тыквенные и зерновые. Данное разъяснение касается также штамма В. amyloliquefaciens Аб60, который входит в состав микробиологического препарата согласно изобретению, и комбинации штаммов В. amyloliquefaciens Аб8б и В. amyloliquefaciens Аб60. Ввиду того, что штаммы В. amyloliquefaciens Аб8б и Аб60 обладают антагонистической активностью в отношении многих фитопатогенных бактерий и грибов, допустимо, что микробиологический препарат может применяться не только для растений семейств пасленовые, тыквенные и зерновые, но и для растений других таксонов, таких как, например, семейство зонтичные и маревые (Amaranthaceae), подсемейство луковые, и др.
melongena); семейства зонтичные (Apiaceae), к которому относится, в частности, морковь посевная (Daucus carota subsp.sativus); семейства тыквенные (семейство Cucurbitaceae), к которому относятся, в частности, огурец (Cucumis sativus), тыква обыкновенная (Cucurbita реро) и кабачок (Cucurbita реро subsp. реро); семейства луковые (подсемейство Alliaceae), к которому относится, в частности, лук (Allium); и др. Также известно, что, например, бактерия вида Agrobacterium rhizogenes (Rhizobium rhizogenes), способная встраивать собственную Т-ДНК в геном растения, вызывает ветвистость корней у многих двудольных растений, в частности, огурца и томата, относящихся к различным семействам (Ходыкина М.В. и др., 2014), а бактерия вида Pseudomonas syringae pv. lachrymans вызывает угловатую пятнистость огурца, кабачка и тыквы (Игнатов А.Н., 2014). Следовательно, микробиологический препарат согласно изобретению, содержащий по меньше мере штамм В. amyloliquefaciens Аб8б, может применяться не только для сельскохозяйственных культур, положительный эффект для которых подтвержден опытным путем в нижеследующих Примерах, включая растения картофеля, огурца и пшеницы озимой (Triticum aestivum L.), но также и для других культур, относящихся к семействам пасленовые, тыквенные и зерновые. Данное разъяснение касается также штамма В. amyloliquefaciens Аб60, который входит в состав микробиологического препарата согласно изобретению, и комбинации штаммов В. amyloliquefaciens Аб8б и В. amyloliquefaciens Аб60. Ввиду того, что штаммы В. amyloliquefaciens Аб8б и Аб60 обладают антагонистической активностью в отношении многих фитопатогенных бактерий и грибов, допустимо, что микробиологический препарат может применяться не только для растений семейств пасленовые, тыквенные и зерновые, но и для растений других таксонов, таких как, например, семейство зонтичные и маревые (Amaranthaceae), подсемейство луковые, и др.
Микробиологический препарат согласно изобретению содержит, по меньшей мере, штамм В. amyloliquefaciens Аб8б, который может присутствовать в составе препарата в виде живых бактериальных клеток или спор, или их комбинации в различном соотношении. Концентрация штамма выбирается такой, чтобы он был способен проявлять антагонистическую активность в отношении фитопатогенного микроорганизма, являющегося возбудителем болезни, развитие которой подавляют. Фраза «антагонистическая активность» штамма В. amyloliquefaciens Аб8б, штамма В. amyloliquefaciens Аб60, их смеси или композиции, содержащей, по меньшей мере, один из указанных штаммов или оба штамма, например, микробиологический препарат как здесь описано, применяемая в отношении фитопатогенного микроорганизма, являющегося возбудителем болезни, развитие которой подавляют, может означать способность штамма В. amyloliquefaciens Аб8б, штамма В. amyloliquefaciens Аб60, их смеси или композиции, содержащей, по меньшей мере, один из указанных штаммов или оба штамма, ингибировать рост и/или размножение такого фитопатогенного микроорганизма. Фраза «антагонистическая активность» штамма В. amyloliquefaciens Аб8б, штамма В. amyloliquefaciens Аб60, их смеси или композиции, содержащей, по меньшей мере, один из указанных штаммов или оба штамма, также может означать способность штамма В. amyloliquefaciens Аб8б, штамма В. amyloliquefaciens Аб60, их смеси или композиции, содержащей, по меньшей мере, один из указанных штаммов или оба штамма, ингибировать рост и/или размножение фитопатогенного микроорганизма, так что развитие болезни, вызываемой этим фитопатогенным микроорганизмом, невозможно вовсе или замедлено по сравнению со случаем, когда указанные штаммы или их смесь или композиция не применяются.
Антагонистическая активность считается как наличествующая, т.е. присущая штамму В. amyloliquefaciens Аб8б или Аб60, их смеси или композиции, содержащей, по меньшей мере, один из указанных штаммов или оба штамма, если возможно ингибирование роста и/или размножения фитопатогенного микроорганизма в условиях применения указанных одного или обоих штаммов, или их смеси или композиции, содержащей, по меньшей мере, один из указанных штаммов или оба штамма. В условиях применения одного или нескольких штаммов В. amyloliquefaciens Аб8б и Аб60 ингибирование возможно в степени большей, чем по сравнению с условиями, в которых один или оба таких штамма не применяются. То есть, ингибирование в условиях применения одного или нескольких штаммов В. amyloliquefaciens Аб8б и Аб60 возможно в степени, по меньшей мере, 5%, по меньшей мере, 10%, по меньшей мере, 20%, по меньшей мере, 40%, по меньшей мере, 80% или, по меньшей мере, 100% по сравнению с условиями, в которых один или оба указанных штамма не применяются. Например, штамм В. amyloliquefaciens Аб8б может считаться как обладающий антагонистической активностью, если такой штамм или композиция, содержащая такой штамм, например, микробиологический препарат согласно изобретению, способен(на) ингибировать рост и/или размножение фитопатогенного микроорганизма, в отношении которого устанавливается антагонистическая активность, в степени, достаточной для определения антибактериальной активности тестируемого штамма Аб8б, которая может быть больше нуля, например, 5% и более как указано выше.
Микробиологический препарат согласно изобретению помимо штамма В. amyloliquefaciens Аб8б также может содержать компоненты, необходимые для поддержания его жизнеспособности, такие как, например, вода, дрожжевой экстракт, соли и микроэлементы. Состав таких компонентов и их соотношение могут варьироваться в зависимости от условий ферментации, в которых штамм Аб8б культивируется (выращивается) до получения требуемого титра, и они могут быть те, что приведены в нижеследующих Примерах. Кроме того, микробиологический препарат помимо штамма В. amyloliquefaciens Аб8б также может содержать штамм В. amyloliquefaciens Аб60. Следовательно, состав и соотношение компонентов в микробиологическом препарате также может зависеть от состава ферментационной среды, используемой для культивирования штамма Аб60. Соотношение компонентов в микробиологическом препарате, содержащем штаммы Аб8б и Аб60, определяется, в частности, титром каждого штамма, как разъяснено ниже.
Концентрация живых бактериальных клеток и спор штамма В. amyloliquefaciens Аб8б, штамма В. amyloliquefaciens Аб60 или их смеси в микробиологическом препарате (так называемый «титр») может быть выражена в колоний-образующих единицах (КОЕ), и такая концентрация может быть, по меньшей мере, 1×104 живых клеток и спор на 1 мл препарата. Например, титр может быть 1×104-1×107 живых клеток и спор на 1 мл препарата, готового к применению. Для удобства приготовления концентрированного раствора микробиологического препарата согласно изобретению титр может быть поддержан на уровне 1×109-1,5×109 живых клеток и спор на 1 мл концентрированного раствора препарата. Титр штаммов подбирают в зависимости, например, от вида сельскохозяйственной культуры, вида обрабатываемого материала (например, семена, клубни, растения и их части), фазы развития растения, степени заражения материала фитопатогенным микроорганизмом, вида фитопатогенного микроорганизма, состава почвы, погодных условий и т.д. Штаммы В. amyloliquefaciens Аб8б и Аб60 могут быть взяты с требуемым титром по отдельности или таким образом, чтобы получить требуемый суммарный титр с различным соотношением штаммов. Например, в случае применения препарата, содержащего штаммы Аб8б и Аб60, доля титра штамма Аб8б может быть не менее 50% от общего титра обоих штаммов. Например, доля титра штамма Аб8б может быть не менее 67% от общего титра штаммов Аб8б и Аб60. Допустимо, что микробиологический препарат может содержать живые клетки штаммов Аб8б и/или Аб60, или споры таких штаммов, или смесь живых клеток и спор в различном соотношении. Например, в случае применения препарата, содержащего штамм Аб8б или Аб60, или смесь таких штаммов, титр живых клеток штамма или обоих штаммов может быть не менее 1×104 КОЕ/мл от общего титра живых клеток и спор. Например, титр живых клеток может быть 1×107 КОЕ/мл от общего титра живых клеток и спор.
Микробиологический препарат можно применять как таковой, то есть, например, такой, как указано выше, или в смеси с одним или несколькими другими компонентами (так называемый «баковый раствор»), такими как, например, один или несколько различных видов веществ, включая, но не ограничиваясь этим, гербицид, инсектицид, нематицид, термитицид, бактерицид, фунгицид, репеллент и т.д., полученные химическим и/или биологическим способом или выделенные из природных источников. Антибиотик и гербицид есть отдельные примеры пестицидов, которые могут применяться в смеси с микробиологическим препаратом согласно изобретению.
Микробиологический препарат можно применять в виде раствора, например, культуральной жидкости, суспензии или порошка, содержащего штамм В. amyloliquefaciens Аб8б и/или Аб60. Форма внесения препарата зависит от вида обрабатываемой сельскохозяйственной культуры, обрабатываемого материала (например, семена, клубни, растения и их части), части растения, фазы развития растения, времени года внесения препарата и т.д., что понятно для специалиста в данной области техники. Например, микробиологический препарат можно применять в виде водного раствора одного или обоих штаммов, содержащего при необходимости другие компоненты. Такой водный раствор можно использовать для обработки почвы и клубней картофеля в момент высевания, или для обработки семян, например, пшеницы перед высевом, или для обработки листьев, например, огурца в период роста растений и/или созревания плодов. Кроме того, возможна обработка микробиологическим препаратом урожая (плодов, клубней, семян) перед закладкой его на хранение или при транспортировке. Способы внесения микробиологического препарата обычные, и к ним относятся например, опрыскивание или внесение под корень, которые могут быть выполнены с применением стандартной сельскохозяйственной техники или устройств.
Примеры
Пример 1. Выделение и идентификация штаммов В. amyloliquefaciens Аб8б и Аб0б.
1.1. Выделение штаммов.
Штаммы фитопатогенных пектолитических бактерий выделяли из промытых водой пораженных клубней картофеля, затем высевали на селективную среду CVP ( V. et al., Two new effective semiselective crystal violet pectate media for isolation of Pectobacterium and Dickeya, Plant Pathology, 2012, 61:339-345; HiMedia Laboratories, Crystal Violet Pectate Medium, кат. №M1392, http://www.himedialabs.com/td/m1392.pdf). Штаммы проверяли с помощью полимеразной цепной реакции (ПЦР) в реальном времени (Bio Rad, США), используя олигонуклеотидные праймеры на бактерии подвида Pectobacterium carotovorum subsp. carotovorum и видов Pectobacterium atrosepticum, Dickeya subsp. dianthicola и Dickeya solani, и методику из каталога MBI Fermentas (1998/1999, с. 146-157).
V. et al., Two new effective semiselective crystal violet pectate media for isolation of Pectobacterium and Dickeya, Plant Pathology, 2012, 61:339-345; HiMedia Laboratories, Crystal Violet Pectate Medium, кат. №M1392, http://www.himedialabs.com/td/m1392.pdf). Штаммы проверяли с помощью полимеразной цепной реакции (ПЦР) в реальном времени (Bio Rad, США), используя олигонуклеотидные праймеры на бактерии подвида Pectobacterium carotovorum subsp. carotovorum и видов Pectobacterium atrosepticum, Dickeya subsp. dianthicola и Dickeya solani, и методику из каталога MBI Fermentas (1998/1999, с. 146-157).
Штаммы (В. amyloliquefaciens Аб8б и Аб0б) были выделены в 2015 году из растений озимой пшеницы, выращенной в Московской области в природных условиях. Выделенные штаммы хранили в стерильной воде при комнатной температуре или при -80°C. Перед опытами культуру клеток оживляли на агаризованной питательной среде YDC и высевали на агаризованную среду LB (Sambrook, J. and Russell, D.W. "Molecular Cloning: A Laboratory Manual", 3rd ed., Cold Spring Harbor Laboratory Press (2001).
Состав среды YDC (на 1 л воды), рН 7,0:
- дрожжевой экстракт (10,0 г),
- глюкоза (20,0 г),
- CaCO3 (20,0 г),
- агар (20,0 г).
Среду YDC стерилизовали автоклавированием при 0,5 атм. избыточного давления в течение 30 мин.
1.2. Идентификация штаммов.
Штаммы В. amyloliquefaciens Аб8б и Аб0б идентифицировали до вида.
Штаммы рассевали до отдельных колоний на среде LB при 29°C. ДНК выделяли известным способом выделения бактериальной ДНК (PCR Protocols. A Guide to methods and applications, ed. Innis M.A., Gelfand D.H., Sninsky J.J., White T.J., 1989). Для наработки 16S рДНК (16S рибосомная ДНК) использовали «прямой» праймер P1 (SEQ ID NO: 1) и «обратные» праймеры Р2 (SEQ ID NO: 2) и Р3 (SEQ ID NO: 3), и выделенную ДНК в качестве матрицы. Условия проведения ПЦР были следующие: 95°C - 3 мин.; 95°C - 30 сек., 57°C - 30 сек., 72°C - 1 мин. 30 сек. (35 циклов); 72°C - 5 мин. ПЦР повторяли не менее двух раз. Полученную ДНК очищали методом электрофореза в агарозном геле (1,0%) при напряженности электрического поля 5 В/см в буфере ТАЕ (состав на 1 л, 50-ти кратный ТАЕ: Трис-основный (242 г), ледяная уксусная кислота (57 мл), ЭДТА (14,6 г), рН 8,0).
Состав среды LB (на 1 л воды), pH 7,2:
- дрожжевой экстракт (5,0 г),
- агар (15,0 г),
- триптон (10 г),
- NaCl (10 г).
Среду LB стерилизовали автоклавированием при 0,5 атм. избыточного давления в течение 30 мин.
На основании выделенной 16S рДНК была синтезирована 16S рРНК (Всероссийская коллекция промышленных микроорганизмов (ВКПМ); Российская Федерация, 117545 Москва, 1-й Дорожный проезд, д. 1, Федеральное Государственное Бюджетное Учреждение «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» (ФГБУ «ГосНИИгенетика») Минобрнауки России), нуклеотидную последовательность которой определяли на автоматическом секвенаторе (Illumina, Inc., США). Для анализа последовательностей использовали специализированные компьютерные программы (BioEdit, http://www.mbio.ncsu.edu/bioedit/bioedit.html; MEGA, http://www.megasoftware.net), предназначенные для определения родства микроорганизмов и построения филогенетических деревьев (Pavlicek A. et al., Free-Tree-freeware program for construction of phylogenetic trees on the basis of distance data and bootstrap\jackknife analysis of tree robustness. Application in the RAPD analysis of genus Frenkelia, Folia Biol. (Praha), 1999 45(3):97-99). В результате секвенирования вариабельных участков 16S рРНК штаммов В. amyloliquefaciens Аб8б и Аб60 были получены нуклеотидные последовательности 16S рРНК штаммов Аб8б и Аб60. Нуклеотидные последовательности 16S рДНК, соответствующие нуклеотидным последовательностям 16S рРНК штаммов В. amyloliquefaciens Аб8б и Аб60, представлены как SEQ ID NO: 4 и SEQ ID NO: 5, соответственно. В последовательностях SEQ ID NOs: 4 и 5 нуклеотид, обозначенный как «m», означает аденин или цитозин, «y» означает тимин или цитозин, «s» означает гуанин или цитозин.
1.2.1. Анализ вариабельных участков 16S рРНК штамма В. amyloliquefaciens Аб8б.
Анализ результатов секвенирования с использованием баз данных GenBank (https://www.ncbi.nlm.nih.gov/genbank/) и RDP-II (Ribosomal Database Project II, https://rdp.cme.msu.edu/) показал, что исследуемый штамм Аб8б принадлежит к систематическим группам Bacteria, Firmicutes, Bacillales, Bacillaceae, Bacillus.
Нуклеотидная последовательность 16S рРНК штамма Аб8б была выровнена с соответствующими последовательностями ближайших видов бактерий, доступными из базы данных GenBank. Последовательности обрабатывали при помощи компьютерных программ BioEdit и MEGA. Полученные результаты показали, что 16S рРНК штамма Аб8б гомологична 16S рРНК бактерий Bacillus subtilis (DSM10, AJ276351), Bacillus mojavensis (IFO15718, AB021191), Bacillus subtilis (NRRL B-23049, AF074970), Bacillus amyloliquefaciens (NBRC 15535, AB255669), Bacillus siamensis (PD-A10, GQ281299) и Bacillus subtilis (DSM 22148, HE582781). 16S рРНК выделенного штамма Аб8б имела гомологию 99% с 16S рРНК некоторых видов бактерий рода Bacillus. Критерием отнесения штамма к тому или иному виду считали гомологию не менее 97%. По этому критерию исследуемый штамм Аб8б был отнесен к нескольким видам бактерий рода Bacillus.
Для более точной идентификации исследуемого штамма Аб8б использовали метод ПЦР с видоспецифичными праймерами Р4-Р17 как указано в Таблице 1. Условия проведения ПЦР были следующие: 94°C - 5 мин.; 94°C - 40 сек., температура «отжига» праймеров, t (Таблица 1) - 30 сек., 72°C - 20 сек. (30 циклов); 72°C - 5 мин. Полученные ДНК очищали методом электрофореза в агарозном геле как указано выше. При использовании праймеров Р6 и Р7 (Таблица 1), специфичных к Bacillus amyloliquefaciens, в результате ПЦР был получен ДНК-фрагмент длиной 747 п.н. (Фиг. 3А). При использовании других праймеров из Таблицы 1 ДНК-фрагменты получены не были. Таким образом, исследуемый штамм Аб8б был отнесен к виду Bacillus amyloliquefaciens. Штамм Bacillus amyloliquefaciens Аб8б депонирован 03 апреля 2017 г. во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под инвентарным номером В-12792 (Российская Федерация, 117545 Москва, 1-й Дорожный проезд, д. 1, ФГБУ «ГосНИИгенетика» Минобрнауки России).
1.2.2. Анализ вариабельных участков 16S рРНК штамма В. amyloliquefaciens Аб60.
Анализ результатов секвенирования с использованием баз данных (Пример 1.2.1) показал, что исследуемый штамм Аб60 принадлежит к систематическим группам Bacteria, Firmicutes, Bacillales, Bacillaceae, Bacillus.
Нуклеотидная последовательность 16S рРНК штамма Аб60 была выровнена и результаты обработаны, как указано выше в Примере 1.2.1. Полученные результаты показали, что 16S рРНК штамма Аб60 гомологична 16S рРНК бактерий Bacillus subtilis (DSM10, AJ276351), Bacillus mojavensis (IF015718, AB021191), Bacillus subtilis (NRRL B-23049, AF074970), Bacillus siamensis (PD-A10, GQ281299), Bacillus amyloliquefaciens (DSM7, FN597644) и Bacillus subtilis (DSM 22148, HE582781). 16S pPHK выделенного штамма Аб60 имела гомологию 99% с 16S рРНК некоторых видов бактерий рода Bacillus. Критерием отнесения штамма к тому или иному виду считали гомологию не менее 97%. По этому критерию исследуемый штамм Аб60 был отнесен к нескольким видам бактерий рода Bacillus.
Для более точной идентификации исследуемого штамма Аб60 использовали метод ПЦР с видоспецифичными праймерами Р4-Р17 как указано в Таблице 1. ПЦР проводили и ДНК очищали, как указано в Примере 1.2.1. При использовании праймеров Р6 и Р7 (Таблица 1), специфичных к Bacillus amyloliquefaciens, в результате ПЦР был получен ДНК-фрагмент длиной 747 п.н. (Фиг. 3Б). При использовании других праймеров из Таблицы 1 ДНК-фрагменты получены не были. Таким образом, исследуемый штамм Аб60 был отнесен к виду Bacillus amyloliquefaciens. Штамм Bacillus amyloliquefaciens Аб60 депонирован 03 апреля 2017 г. во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под инвентарным номером В-12791 (Российская Федерация, 117545 Москва, 1-й Дорожный проезд, д. 1, ФГБУ «ГосНИИгенетика» Минобрнауки России).
Пример 2. Изучение антагонистической активности штаммов В. amyloliquefaciens Аб8б и Аб60 in vitro.
Активность штаммов-антагонистов изучали in vitro методом лунок или бляшек.
2.1. Метод лунок.
На чашках Петри в среде NBY стерильным пробковым сверлом просекали четыре лунки диаметром 5 мм каждая, при помощи пипетки наносили 100 мкл суспензии фитопатогена, шпателем Дригальского делали «газон», затем производили посев исследуемого штамма Аб8б или Аб60, внося в лунки при помощи пипетки 100 мкл культуральной жидкости. Каждый штамм вносили в концентрации 1×108 колоний-образующих единиц (KOE) на 1 мл. Чашки инкубировали при 29°C в течение 3-5 дней. Опыт проводи в 4-х кратной повторности. Диаметр зоны ингибирования роста измеряли в расстоянии (мм) от края лунки, также оценивали бактериостатическую активность (б.а.) и рост поверх «газона» (р.п.г.). Оценку проводили в сравнении с контролем (вода).
Состав среды NBY (на 1 л воды), pH 7,0:
- питательный бульон (8,0 г),
- дрожжевой экстракт (2,0 г),
- K2HPO4 (2,0 г),
- KH2PO4 (0,5 г),
- MgSO4 (0,246 г),
- глюкоза (2,5 г),
- агар (16,0 г).
Среду NBY стерилизовали автоклавированием при 0,5 атм. избыточного давления в течение 30 мин.
2.2. Метод бляшек.
На чашках Петри на среду NBY при помощи пипетки наносили 100 мкл культуральной жидкости, содержащей целевую бактерию, шпателем Дригальского делали «газон» и бактериологической петлей наносили чистую бактериальную культуру в виде бляшек. Чашки инкубировали при 29°C в течение 3-5 дней. Опыт проводили в 4-х кратной повторности. Диаметр зоны ингибирования роста измеряли в расстоянии (мм) от края лунки, также оценивали бактериостатическую активность (б.а.) и рост поверх «газона» (р.п.г.). Оценку проводили в сравнении с контролем (вода). Перед закладкой эксперимента штаммы В. amyloliquefaciens Аб8б и Аб60 раздельно культивировали на твердой питательной среде NBY при температуре 29°C в течение 2-3 суток.
В качестве фитопатогенных бактерий использовали Pectobacterium carotovorum subsp. carotovorum, Pectobacterium carotovorum subsp. brasiliensis, Pectobacterium atrosepticum, Pectobacterium wasabiae, Dickeya solani и Dickeya subsp. dianthicola (Таблица 2) из коллекции фитопатогенов ООО «Исследовательский Центр «ФитоИнженерия» (Российская Федерация, 141880 Московская область, Дмитровский район, с. Рогачево, ул. Московская, строение 58). Указанные бактерии также могут быть получены из Американской коллекции типовых культур, Манассас, штат Виргиния, Соединенные Штаты Америки (АТСС, American Type Culture Collection, Manassas, Virginia, U.S.A.; веб-сайт: www.lgcstandards-atcc.org), немецкой коллекции микроорганизмов и клеточных культур, Брауншвейг, Германия (Leibniz-Institut DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH;  7B, 38124 Braunschweig, Germany; веб-сайт: www.dsmz.de) или выделены из природных источников с использованием известных методов, например: Pectobacterium carotovorum subsp.carotovorum (АТСС 15713), Pectobacterium carotovorum subsp.brasiliensis (De Boer S.H. et al., Phytopathology, 2012, 102(10): 937-947), Pectobacterium atrosepticum (ATCC BAA-673), Pectobacterium wasabiae (ATCC 43316), Dickeya solani (DSM 28711) и Dickeya subsp. dianthicola (DSM 18054).
7B, 38124 Braunschweig, Germany; веб-сайт: www.dsmz.de) или выделены из природных источников с использованием известных методов, например: Pectobacterium carotovorum subsp.carotovorum (АТСС 15713), Pectobacterium carotovorum subsp.brasiliensis (De Boer S.H. et al., Phytopathology, 2012, 102(10): 937-947), Pectobacterium atrosepticum (ATCC BAA-673), Pectobacterium wasabiae (ATCC 43316), Dickeya solani (DSM 28711) и Dickeya subsp. dianthicola (DSM 18054).
На Фиг. 4 в качестве примера показаны результаты изучения антагонистической активности штаммов В. amyloliquefaciens Аб8б и Аб60 в отношении бактерий подвида Pectobacterium carotovorum subsp. carotovorum и вида Pectobacterium atrosepticum. В Таблице 2 приведены результаты изучения бактериостатической активности обоих штаммов в отношении исследуемых фитопатогенных бактерий. Из данных, приведенных в Таблице 2, следует, что штаммы В. amyloliquefaciens Аб8б и Аб60 ингибируют рост и размножение бактерий подвидов Pectobacterium carotovorum subsp. carotovorum и Pectobacterium carotovorum subsp. brasiliensis и видов Pectobacterium atrosepticum, Pectobacterium wasabiae, Dickeya solan и Dickeya subsp.dianthicola. Также из Таблицы 2 следует, что штамм В. amyloliquefaciens Аб8б проявляет более выраженное антагонистическое в отношении фитопатогенных бактерий свойство по сравнению со штаммом В. amyloliquefaciens Аб60.
Пример 3. Изучение антагонистической активности штаммов В. amyloliquefaciens Аб8б и Аб60 на овощных и зерновых культурах.
3.1. Растения картофеля.
Полевые опыты с растениями картофеля проводили на полях возле села (с.) Горшково в пойме р. Яхрома и с. Рогачево Московской области.
с. Горшково: опыты закладывали на торфяно-болотной почве с орошением, почва состоит из растительных остатков и имеет кислотную реакцию, микробиологически активна, количество бактерий на 1 грамм почвы - 8,0×1011 KOE.
с. Рогачево: опыты закладывали на дерново-подзолистой легкосуглинистой почве без орошения, реакция почвы нейтральная, количество бактерий на 1 грамм почвы - 3,0×1010 KOE, пектолитические бактерии присутствуют, представлены псевдомонадами и энтеробактериями.
Исследуемый сорт картофеля - Айл оф Джура, первая репродукция. Повторность опыта - 3-х кратная. Общая площадь делянки - 360 м2 (3,6 м×100 м), учетная площадь делянки - 300 м2. Общая площадь делянки для 3-х повторов - 1080 м2 (360 м2×3). Расход семенного картофеля - 3,0 т/га, что соответствует 0,35 т на один опыт в 3-х повторах. В качестве контроля использовали обработку семенных клубней препаратом пестицидов, обработку в период вегетации не делали. Обработку проводили в процессе посадки семенного картофеля (в момент падения клубней из высаживающего аппарата картофелесажалки) опрыскиванием раствором пестицида с нормой расхода 80 л/га.
Состав препарата пестицидов (на 1 т.):
- препарат Юниформ (Syngenta, Швейцария; 0,5 л),
- препарат Регент 800 (Фипронил, BASF, Германия; 30 г),
- микроудобрения (2,0 л).
Штаммы В. amyloliquefaciens Аб8б и Аб60 выращивали раздельно на твердой питательной среде NBY (Пример 2.1) и жидкой питательной среде NBY до достижения концентрации, по меньшей мере, 1×109 живых клеток и спор (КОЕ) на 1 мл культуральной жидкости. Затем готовили смесь микробиологического препарата и препарата пестицидов (баковая смесь) следующего состава:
- препарат пестицидов (1 т),
- микробиологический препарат (культуральная жидкость, содержащая штаммы Аб8б и Аб60 до конечной концентрации каждого штамма 1×104 КОЕ/мл или 1×107 КОЕ/мл; 0,6 л/т).
В случае тестового опыта обрабатывали клубни при посадке и растения в начале цветения (фаза бутонизации) микробиологическим препаратом, содержащим препарат пестицидов, т.е. баковой смесью, с нормой расхода 300 л/га.
Общий вид контрольных и тестовых делянок в с. Горшково (поле №92, дата посадки - 25.05.2016) и с. Рогачево (поле №230, дата посадки - 25.05.2016) приведен на Фиг. 5 и 6, соответственно. Из Фиг. 5 и 6 следует, что наземная часть растений картофеля на тестовых делянках (Б), обработанных препаратом, содержащим штаммы В. amyloliquefaciens Аб8б и Аб60, выглядела значительно лучше по сравнению с контрольными делянками (А). Более точный анализ растений картофеля на полях в с. Горшково и с. Рогачево показал, что обработка растений препаратом, содержащим штаммы В. amyloliquefaciens Аб8б и Аб60, благоприятно влияет на биомассу растений, в частности, повышается высота растения, увеличивается количество здоровых растений и число стеблей на 1 куст (Фиг. 7).
Анализ растений (с. Горшково) на содержание нитратов (NO3-) показал, что обработка растений картофеля препаратом, содержащим штаммы В. amyloliquefaciens Аб8б и Аб60, способствует накоплению нитратов в листьях (Таблица 3). Также, анализ растений (с. Горшково) на содержание микроэлементов показал, что обработка растений картофеля препаратом, содержащим штаммы В. amyloliquefaciens Аб8б и Аб60, способствует накоплению в листьях микроэлементов, таких как калий, фосфор и сера (Таблица 4). Данные эффекты следует рассматривать как положительные, т.к. накопление нитратов и микроэлементов в листьях картофеля во время цветения способствует увеличению массы клубней.
На Фиг. 8 показана динамика накопления урожая (в граммах с 1 м2) растениями картофеля на контрольных и тестовых делянках в с. Горшково и с. Рогачево. Из данных на Фиг. 8 следует, что растения картофеля, обработанные препаратом, содержащим штаммы В. amyloliquefaciens Аб8б и Аб60, увеличивали массу клубней быстрее по сравнению с контрольными делянками. Применение антагонистов дало накопление урожая с одного куста на 80-й день после посадки 30,8% по сравнению с контрольным опытом, в котором штаммы не применялись (с.Рогачево, Фиг. 8Б).
Оценивали урожайность растений картофеля (в тоннах, т) с общей площади делянок для 3-х повторностей (с. Рогачево). Полученные данные представлены в Таблице 5. Как следует из Таблицы 5, растения картофеля, обработанные препаратом, содержащим штаммы В. amyloliquefaciens Аб8б и Аб60, дали на 51% больше урожая по сравнению с контрольными растениями.
3.2. Растения огурца.
Антагонистические свойства штаммов В. amyloliquefaciens Аб8б и Аб60 изучали в отношении физиологических, бактериальных и грибных болезней растений огурца. Отдельное внимание уделяли способности штаммов бактерий-антагонистов ингибировать рост и размножение фитопатогенной бактерии вида Agrobacterium rhizogenes, вызывающей болезнь бородатость корня (корневого мат) у растений огурца (Ходыкина М.В. и др., 2014). В качестве физиологических болезней рассматривали нехватку или переизбыток микро- и макроэлементов, бактериальных - угловатую пятнистость листьев огурца (возбудитель Pseudomonas syringae pv. lachrymans) и сосудистый бактериоз (возбудитель Xanthomonas spp.), грибных - мучнистую росу (возбудитель Erysiphe spp.), пероноспороз (возбудитель Pseudoperonospora cubensis, оомицет) и белую гниль (возбудитель Sclerotinia sclerotiorum).
Опыт с растениями огурца был проведен 20.01.2016 в агрофирме «Ольдеевская», г. Чебоксары. По результатам анализа 26 образцов почвы, субстрата, воды и растений была выбрана теплица, в которой бактериоз проявлялся наиболее заметно. Опыт проводили по схеме, приведенной в Таблице 6. Всего растений в опыте - 6336, в 1 клапане (1/4 теплицы). Сорт - гибрид Атлет (совместно с гибридом-опылителем Гладиатор), гидропонный метод выращивания, тип субстрата - Агроперлит (75%) и торф верховой (25%). Температурные условия в теплице при закладке опыта: влажность - ночью 80-90%, днем 70-80%; температура среднесуточная - от 18 до 20°C (ночью 16-18°C, днем 18-22°C). Дата первого учета: 20.01.2016, дата второго учета: 17.03.2016. Эффективность штаммов В. amyloliquefaciens Аб8б и Аб60 оценивали по стабилизации числа пораженных растений и количеству растений без видимых симптомов поражения. Фитотоксичность использованных в опытах препаратов исследуемых штаммов Аб8б и Аб60 в отношении растений огурца не наблюдали.
Полученные данные представлены в Таблице 7. Как следует из Таблицы 7, штаммы В. amyloliquefaciens Аб8б и Аб60, использованные в обработке по отдельности или в смеси, подавляли развитие физиологических, бактериальных и грибных болезней растений огурца в отличии от контрольного опыта, в котором штаммы не использовали. Наибольшую антагонистическую активность в отношении физиологических и грибных болезней проявлял штамм Аб8б по сравнению со штаммом Аб60. Был выявлен синергетический антагонистический эффект штаммов В. amyloliquefaciens Аб8б и Аб60 против грибных болезней растений огурца (Таблица 7, опыты №2-4). Принимая во внимание тот факт, что внесенные в почву бактерии-антагонисты имеют свойство накапливаться, представляется целесообразным долгосрочное применение штаммов В. amyloliquefaciens Аб8б и Аб60, что в масштабах отдельно взятой теплицы могло бы способствовать эффективному контролю бактериоза и грибных болезней, не угнетая при этом сами растения, что будет благоприятно влиять на урожайность.
3.3. Растения озимой пшеницы.
Антагонистические свойства штаммов В. amyloliquefaciens Аб8б и Аб60 изучали в отношении болезней мучнистая роса, альтернариоз, базальный и черный бактериоз озимой пшеницы. Опыты проводили на семенах озимой пшеницы сорта Московская 39, посев 19.09.2016. Для обработки использовали препарат пестицида (контроль) и смесь препарата пестицида с культуральной жидкостью, содержащей штаммы В. amyloliquefaciens Аб8б и Аб60 (тест). Состав препарата пестицида и микробиологического препарата приведен в Примере 3.1. Масса обработанных семян - 3 т на 1 опыт, дата первого учета: 18.10.2016. Полученные данные приведены в Таблице 8. Как следует из Таблицы 8, растения озимой пшеницы, семена которых были обработаны препаратом, содержащим штаммы В. amyloliquefaciens Аб8б и Аб60, имели повышенную массу и длину надземной части по сравнению контрольными растениями.
Хотя указанное изобретение описано в деталях со ссылкой на наилучшие способы осуществления изобретения, для специалиста в данной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
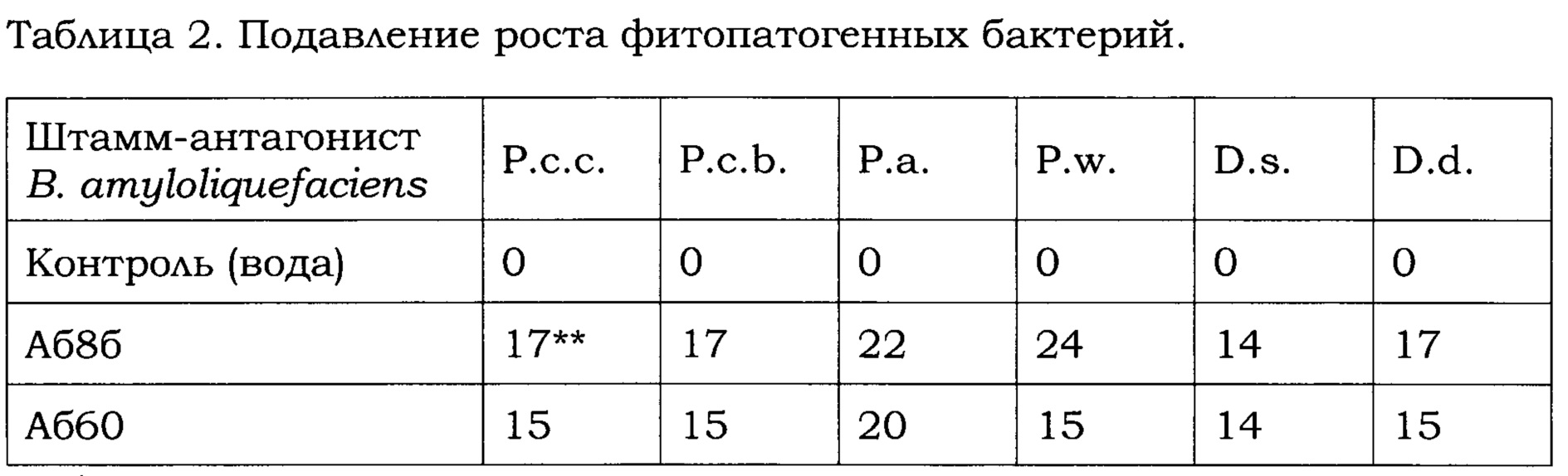
* - Сокращения:
Р.с.с. - Pectobacterium carotovorum subsp. carotovorum,
P.c.b. - Pectobacterium carotovorum subsp. brasiliensis,
P.a. - Pectobacterium atrosepticum,
P.w. - Pectobacterium wasabiae,
D.s. - Dickeya solani,
D.d. - Dickeya subsp. dianthicola.
** - Диаметр зоны подавления (в мм) роста культуры фитопатогенной бактерии.

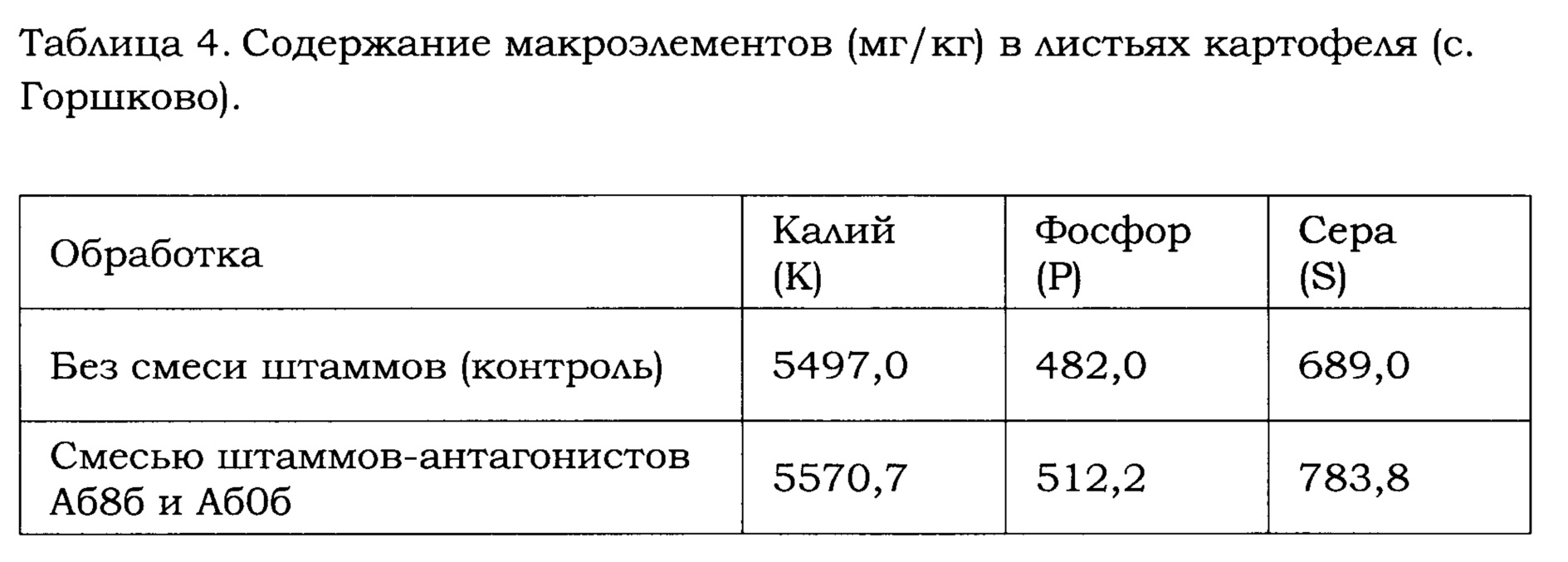


* 1) суммарная концентрация живых бактериальных клеток и спор, 2) в случае смеси штаммов - общая концентрация штаммов Аб8б и Аб60
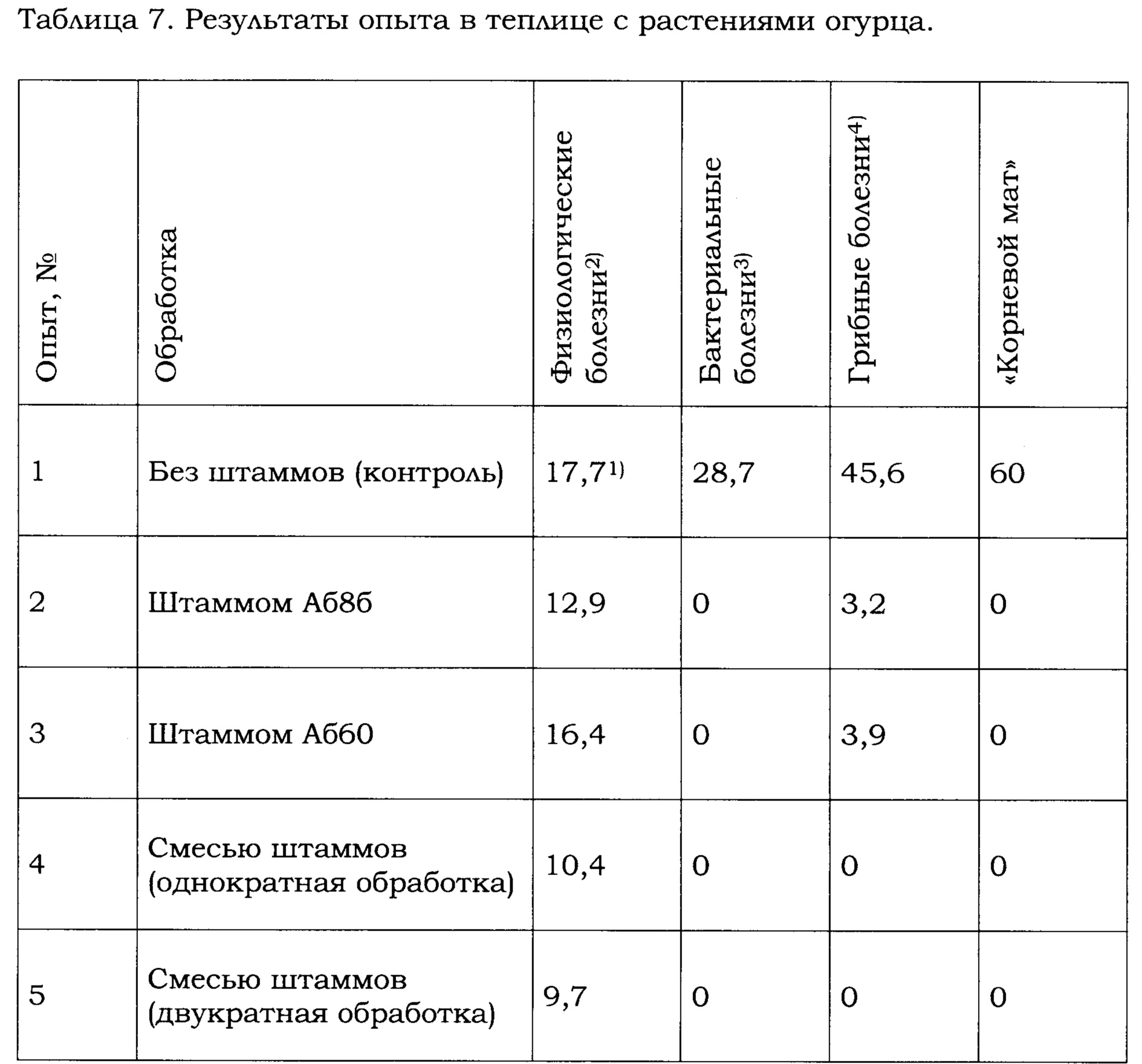
1) частота встречаемости болезней (в %),
2) нехватка или переизбыток микро- и макроэлементов,
3) угловатая пятнистость листьев огурца, сосудистый бактериоз,
4) мучнистая роса, пероноспороз, белая гниль
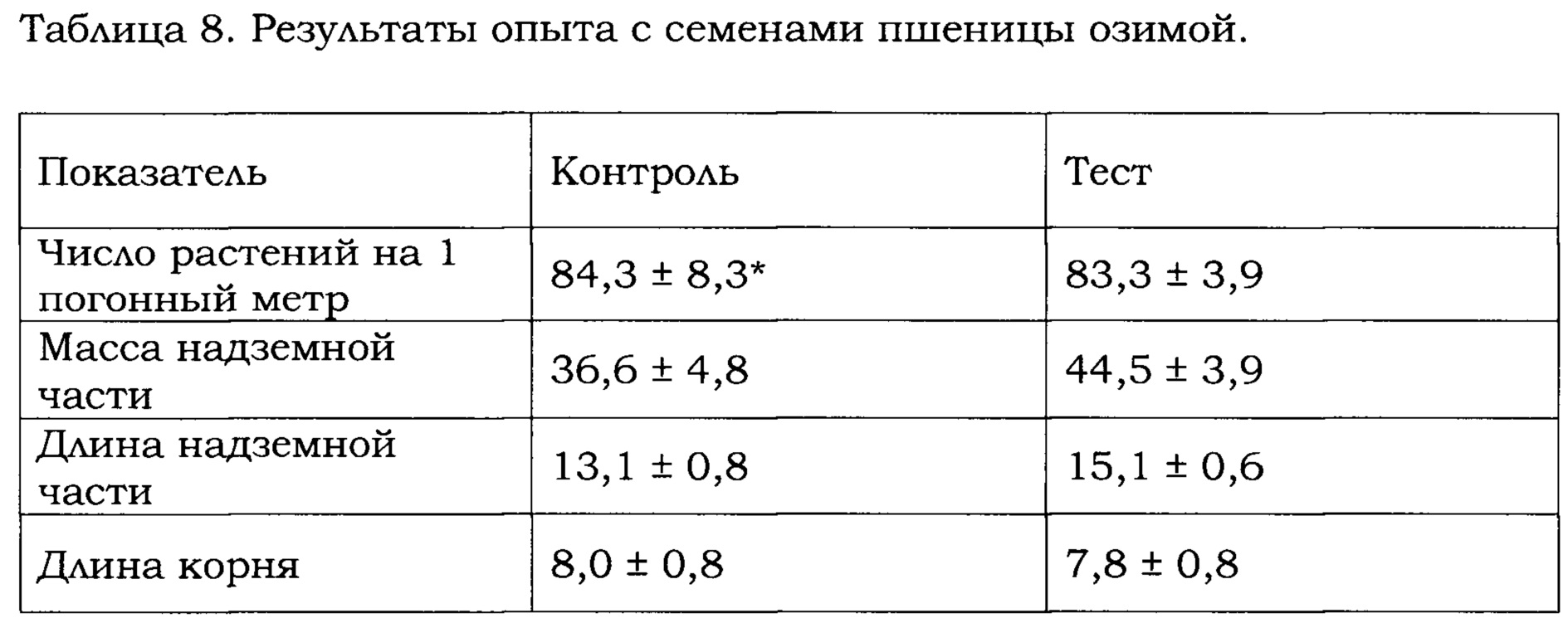
* - значения представлены как «среднее ± стандартное отклонение» и получены для средних значений 4-х повторов (в каждом повторе 30 растений, всего 120 растений в одном опыте)