Результат интеллектуальной деятельности: Композиции PI3K/MTOR-ингибитора для внутривенного введения
Вид РИД
Изобретение
Данное изобретение относится к фармацевтической композиции, содержащей 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину или ее фармацевтически приемлемую соль. Более конкретно, данное изобретение относится к водной фармацевтической композиции, содержащей 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину или ее фармацевтически приемлемую соль, представляющей собой прозрачный раствор. Указанная композиция является особенно подходящей для внутривенного введения пациенту.
1-(4-{[4-(Диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина и ее препараты описаны в WO 2009/143313. Соединение представляет собой ингибитор PI3 киназы и mTOR, и является пригодным для лечения рака.
Кристаллическая форма 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и способ ее получения описаны в WO 2010/096619.
1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина имеет химическую структуру:

1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина может быть получена в кристаллической форме и в этой форме является химически и физически стабильной при температуре 25°С и относительной влажности (RH) 60% до 3 лет. Однако данное свободное основание является недостаточно растворимым в воде для возможности получения водного раствора композиции, подходящего для внутривенного или парентерального введения в необходимых терапевтических дозах.
Существует необходимость в разработке фармацевтически приемлемой композиции 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, которая (а) является химически стабильной при хранении (например, при 25°С и 60% RH) и/или (б) будет облегчать эффективное внутривенное (или парентеральное) введение лекарственного средства млекопитающему, включая человека.
Предпочтительно, композиция подходит для внутривенного введения 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины в виду определенных фармакокинетических свойств и биодоступности данного лекарственного средства.
Необходимо, чтобы композиция любого лекарственного средства для внутривенного введения представляла собой раствор, для облегчения безопасного и эффективного введения пациенту Он должен быть свободным от частиц и не должен образовывать гель или суспензию. Предпочтительным является прозрачный водный раствор.
Прозрачный раствор определяют как визуально прозрачный раствор, по существу свободный от любых видимых частиц, которые можно обнаружить при визуальном контроле. Как правило, при обнаружении каких-либо частиц композиция будет непригодной для внутривенного введения и не должна применяться, во избежание возникновения закупорки кровеносных сосудов. Соответственно, в виду того, что визуальное исследование представляет собой качественную оценку, термин «по существу свободный от видимых механических включений» обычно применяют, когда видимые механические включения не обнаруживают.
Механические включения можно охарактеризовать следующим образом:
- соринки - отдельные частицы, форму которых невозможно определить без увеличения
- дым или завихрение - мелкие частицы, по виду похожие на дым или торнадо, которые обычно поднимаются со дна флакона с образцом и закручиваются вверх при вращении флакона
- хлопьевидный материал - непрочно агрегированные частицы или мягкие хлопья
- частицы, имеющие определенную форму или характеристики, можно описать как стекловидные, внешне похожие на металлические и т.д.
Визуальный контроль можно осуществлять согласно методу, описанному в статье 2.9.20 Европейской фармакопеи, озаглавленной «Загрязнение механическими включениями: видимые невооруженным глазом частицы». Данный метод позволяет определить загрязнение инъекционных и инфузионных препаратов посторонними подвижными нерастворимыми частицами, за исключением пузырьков газа, возможно присутствующих в растворах. Испытание предназначено для обеспечения простой процедуры для визуальной оценки качества растворов для парентерального применения по наличию видимых частиц. Также могут применяться другие валидированные методы.
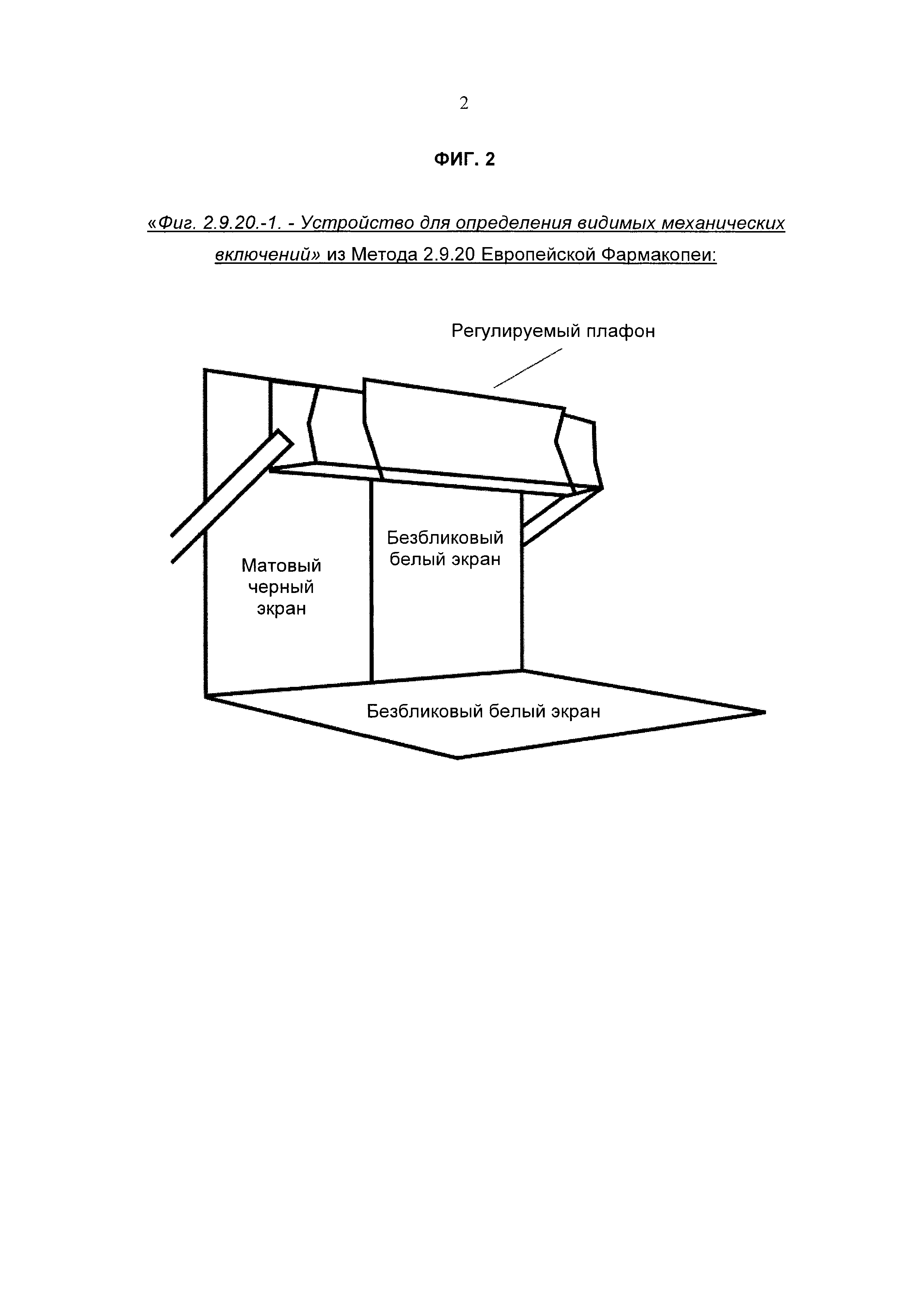
В статье 2.9.20 Европейской фармакопеи оборудование (см. «Фиг. 2.9.20.-1», приведенную на Фиг. 2) представляет собой устройство для просмотра, которое состоит из:
- черного матового экрана подходящего размера, находящегося в вертикальном положении
- безбликового белого экрана подходящего размера, находящегося в вертикальном положении рядом с черным экраном
- регулируемого плафона, снабженного подходящим затемненным источником дневного света с соответствующим отражателем (осветитель может иметь 2 флуоресцентные лампы по 13 Вт каждая, длиной 525 мм). Интенсивность освещения в точке контроля должна быть от 2000 до 3750 люкс, при этом для цветных стеклянных и прозрачных пластмассовых емкостей предпочтительно использовать более высокую мощность.
Метод гласит: «Емкости освобождают от наклеенных этикеток и промывают и подсушивают с внешней стороны. Плавно вращают или переворачивают емкость, избегая образования воздушных пузырьков, и просматривают в течение примерно 5 секунд на фоне белого экрана. Повторяют процедуру на фоне черного экрана. Отмечают наличие любых частиц.»
Неожиданно обнаружили, что техническая проблема решается посредством фармацевтической композицией в виде водного раствора, включающей 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину или ее соль лактат, молочную кислоту и воду, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора менее 6 мг/мл и молочная кислота присутствует в количестве, достаточном для обеспечения прозрачного раствора; или
1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину или ее соль фосфат, ортофосфорную кислоту и воду, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора менее 4 мг/мл и ортофосфорная кислота присутствует в количестве, достаточном для обеспечения прозрачного раствора (далее обозначается «композиция по изобретению»).
Указанную композицию можно непосредственно вводить пациенту (для того, чтобы избежать деградации) внутривенно или парентерально, предпочтительно, с добавлением регулятора тоничности. В альтернативном случае для введения пациенту позднее, указанную композицию, возможно содержащую объемообразующий агент и/или регулятор тоничности, можно подвергать сублимационному высушиванию для получения твердой лиофилизированной композиции, которая является химически стабильной при хранении в течение по меньшей мере 2 лет, указанную твердую лиофилизированную композицию можно затем растворить или восстановить с получением прозрачного водного раствора, предпочтительно, с добавлением регулятора тоничности, по мере необходимости, немедленно перед внутривенным (или парентеральным) введением пациенту.
Было обнаружено, что применение альтернативных кислот, не являющихся молочной кислотой или ортофосфорной кислотой, используемыми в композиции по изобретению, при предпочтительной концентрации 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины приблизительно от 2,5 до 5,5 мг/мл, приводит к образованию мутных композиций, содержащих механические включения или образующие гель, а не по существу прозрачные, свободные от частиц растворы, необходимые для внутривенного (или парентерального) введения пациенту.
Применительно к композициям, содержащим молочную кислоту:
- обнаружили, что при концентрациях раствора 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины 6 мг/мл или выше, получение требуемых прозрачных растворов с pH, необходимым для внутривенного введения пациенту, невозможно или не воспроизводится;
- предпочтительно, в изобретении предложена фармацевтическая композиция в виде водного раствора, содержащая 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину, молочную кислоту и воду, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора менее 6 мг/мл и молочная кислота присутствует в количестве, достаточном для обеспечения прозрачного раствора;
- концентрация 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины в композиции по изобретению может варьироваться от 1 до 5,5 мг/мл, от 2 до 5,5 мг/мл или от 3 до 5,5 мг/мл (в пересчете на свободное основание указанного соединения);
- предпочтительно, в изобретении предложена фармацевтическая композиция в виде водного раствора, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора от 2,5 до 5,5 мг/мл;
- предпочтительно, в изобретении предложена фармацевтическая композиция в виде водного раствора, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора приблизительно 5 мг/мл;
- предпочтительно, при использовании свободного основания 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины в композиции по изобретению присутствует свыше 2,5 моль-эквивалентов молочной кислоты. Более предпочтительно, в композиции по изобретению присутствует от 3 до 10, от более 2,5 до 8,0 или от 3,5 до 4,5 моль-эквивалентов молочной кислоты. Более предпочтительно, в композиции согласно изобретению присутствует приблизительно 4,1 моль-эквивалентов молочной кислоты;
- предпочтительно, при использовании свободного основания 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, в изобретении предложена фармацевтическая композиция в виде водного раствора, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора от 5,0 до 5,5 мг/мл и присутствует по меньшей мере 2,5 моль-эквивалентов молочной кислоты;
- предпочтительно, при использовании свободного основания 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, в изобретении предложена фармацевтическая композиция в виде водного раствора, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора приблизительно 5,0 мг/мл и присутствует по меньшей мере 2,5 моль-эквивалентов молочной кислоты;
- предпочтительно, при использовании свободного основания 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, в изобретении предложена фармацевтическая композиция в виде водного раствора, включающая 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину, молочную кислоту и воду, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора приблизительно 5,0 мг/мл и присутствует по меньшей мере 2,5 моль-эквивалентов молочной кислоты и в количестве, достаточном для образования прозрачного раствора;
- следует отметить, что 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина образует с молочной кислотой соль лактат в соотношении 1:1 (моль-эквивалентов). Композиция по изобретению может быть приготовлена с применением свободного основания 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины или с применением соли молочной кислоты и 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины. При использовании соли молочной кислоты предпочтительно используют более 1,5 моль-эквивалентов молочной кислоты для достижения предпочтительной нижней границы свыше 2,5 моль-эквивалентов молочной кислоты в композиции согласно изобретению;
- предпочтительно, в изобретении предложена фармацевтическая композиция в виде водного раствора, содержащая лактат 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, молочную кислоту и воду, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора приблизительно 5,0 мг/мл и присутствует по меньшей мере 1,5 моль-эквивалентов молочной кислоты и в количестве, достаточном для образования прозрачного раствора;
- в композиции по изобретению можно использовать DL-молочную кислоту, D-молочную кислоту или L-молочную кислоту, или любые их комбинации. Предпочтительно, использована DL-молочную кислоту;
- предпочтительно, pH композиции по изобретению не превышает 3,7. Более предпочтительно, pH композиции по изобретению составляет от 3,0 до 3,7, от 3,3 до 3,6 или от 3,4 до 3,5;
- в предпочтительном воплощении настоящего изобретения предложена фармацевтическая композиция в виде водного раствора, содержащая 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину, молочную кислоту и воду, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора до 5,5 мг/мл и присутствует более 2,5 моль-эквивалентов молочной кислоты и в количестве, достаточном для образования прозрачного раствора с pH не более 3,7;
- в предпочтительном воплощении данного изобретения предложена фармацевтическая композиция в виде водного раствора, содержащая 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину, молочную кислоту и воду, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора приблизительно 5 мг/мл и присутствует приблизительно 4,1 моль-эквивалентов молочной кислоты и в количестве, достаточном для образования прозрачного раствора с pH не более 3,7;
- для приготовления композиции по изобретению можно использовать L-лактат 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины в кристаллической форме. Предпочтительно, кристаллическая форма L-лактата 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины имеет картину дифракции рентгеновских лучей на порошке (PXRD) (зарегистрированную с помощью дифрактометра Bruker D4 и К-альфа излучения меди) с основными пиками приблизительно на 16,2, 17,3, 18,4, 18,9, 19,9, 20,9 и 23,1 градусах 2-тета (+/- 0,2 градуса 2-тета). Данная кристаллическая форма L-лактата 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины отличается от других известных форм данной соли наличием характерных пиков приблизительно на 6,5, 15,9, 20,9, 22,1 и 23,1 градусах 2-тета (+/- 0,2 градуса 2-тета).
Применительно к композициям, содержащим ортофосфорную кислоту:
- предпочтительно, в изобретении предложена фармацевтическая композиция в виде водного раствора, содержащая 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину, ортофосфорную кислоту и воду, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора менее 4 мг/мл и ортофосфорная кислота присутствует в количестве, достаточном для обеспечения прозрачного раствора;
- предпочтительно, в изобретении предложена фармацевтическая композиция в виде водного раствора, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора от 3,0 до 3,5 мг/мл;
- предпочтительно, в изобретении предложена фармацевтическая композиция в виде водного раствора, где использовано по меньшей мере 5 моль-эквивалентов ортофосфорной кислоты;
- предпочтительно, в изобретении предложена фармацевтическая композиция в виде водного раствора, где использовано от 5 до 7 моль-эквивалентов ортофосфорной кислоты;
- в предпочтительном воплощении настоящего изобретения предложена фармацевтическая композиция в виде водного раствора, содержащая 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину, ортофосфорную кислоту и воду, где 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина присутствует в концентрации раствора менее 4 мг/мл и присутствует от 5 до 7 моль-эквивалентов ортофосфорной кислоты и в количестве, достаточном для образования прозрачного раствора;
- предпочтительно, pH полученной композиции перед внутривенным введением составляет от 2 до 2,5. Затем, для внутривенного введения, предпочтительно, pH доводят до 3,0-4,5;
- при использовании фосфатной соли 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, ее предпочтительно получают с использованием ортофосфорной кислоты.
Если композицию по изобретению подвергают сублимационному высушиванию для получения твердой лиофилизированной композиции, предпочтительно, перед началом процесса сублимационной сушки к композиции добавляют объемообразующий агент. Основная функция объемообразующего агента - придание твердому веществу, подвергнутому сублимационному высушиванию, неуплотняемой структурной целостности, которая обеспечит быстрое восстановление при разведении водной композиции перед введением, а также облегчение эффективной лиофилизации. Объемообразующие агенты обычно применяют, когда общая масса растворенных компонентов в композиции составляет менее 2 г/100 мл. Объемообразующие агенты можно также добавлять для достижения изотоничности с кровью. Объемообразующий агент может быть выбран из сахарида, многоатомного спирта, аминокислоты или полимера, или быть смесью любых двух или более перечисленных веществ. Предпочтительно, объемообразующий агент представляет собой углевод или многоатомный спирт, или их смесь. Предпочтительно, углевод представляет собой сахарозу. Предпочтительно, многоатомный спирт представляет собой маннит.
Восстановление лиофилизированной твердой композиции может достигаться добавлением необходимого количества воды, которая присутствовала до лиофилизации для получения прозрачного раствора. Затем перед применением можно добавить регулятор тоничности.
Разведение лиофилизированной твердой композиции может достигаться с помощью соответствующего количества воды и/или водного раствора подходящего регулятора тоничности для обеспечения получения прозрачного раствора.
Регулятор тоничности должен присутствовать перед внутривенным или парентеральным введением композиции пациенту путем инъекции, чтобы не допустить акантоцитоза или гемолиза эритроцитов, а также чтобы облегчить или предотвратить боль и дискомфорт у пациента. Для этого композиция, вводимая пациенту, должна иметь приблизительно такое же эффективное осмотическое давление, как и кровь пациента.
Подходящие регуляторы тоничности представляют собой неионные регуляторы тоничности, такие как глицерин, сорбит, маннит, сахароза, пропиленгликоль или декстроза, или смеси любых двух или более из перечисленного. Предпочтительно, неионный регулятор тоничности представляет собой декстрозу, сахарозу или маннит или представляет собой смесь любых двух или более из перечисленного.
Водные фармацевтические композиции, подходящие для внутривенного введения, обычно имеют pH от 3 до 9. Композиции по изобретению, подлежащие внутривенному введению, предпочтительно, имеют рН от 3 до 4,5.
Композиции по изобретению можно применять для лечения, паллиативной терапии или профилактики рака у млекопитающего, включая человека. Рак, подлежащий лечению, может быть выбран из группы, состоящей из лейкоза, рака кожи, рака мочевого пузыря, рака молочной железы, рака матки, рака яичника, рака предстательной железы, рака легкого, рака толстой кишки, рака поджелудочной железы, рака почки, рака желудка и рака головного мозга.
Недельная дозировка 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, подлежащей внутривенному введению для лечения рака с применением композиции, изложенной в данном документе, предпочтительно находится в диапазоне от 100 до 400 мг/мл в неделю.
Следующие примеры иллюстрируют получение композиций по изобретению.
ПРИМЕРЫ
Пример 1
Приготовление фармацевтической композиции в виде водного раствора, содержащей 5 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил)фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и DL-молочную кислоту
D,L-молочную кислоту (334 мг) растворяли в воде для ирригаций для приготовления раствора общим объемом 100 мл. 1-(4-{[4-(Диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину (200 мг) растворяли в 37 мл указанного раствора молочной кислоты, при перемешивании посредством гомогенизатора Ultra Turrax Т25 (торговая марка) в течение 120 минут и воздействуя на раствор ультразвуком в течение 10 минут в ультразвуковой ванне. Затем смесь перемешивали в течение ночи с магнитной мешалкой для получения прозрачного раствора. Объем доводили до 40 мл в мерной колбе с помощью раствора молочной кислоты. Раствор фильтровали с использованием 0,2 мкм нейлонового фильтра в чистый 50 мл флакон в вытяжном шкафу с ламинарным потоком воздуха. Первые 5 мл отфильтрованного раствора использовали для смачивания фильтра и отбрасывали, как нерепрезентативный для отфильтрованного раствора. Флакон укупоривали чистой пробкой для лиофилизации и обжимали съемным колпачком. Визуальный контроль раствора показал, что раствор является прозрачным и бесцветным.
Пример 2
Приготовление (а) фармацевтической композиции в виде водного раствора с концентрацией 5 мг/мл, содержащей 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину, DL-молочную кислоту и маннит; и (б) приготовление их лиофилизированной твердой композиции
(a) В сосуд отвешивали 36,1 г воды для ирригаций. Медленно добавляли 125,82 г DL-молочной кислоты (90,6% чистоты, для парентерального применения) и смесь перемешивали до растворения молочной кислоты. Медленно добавляли 195,3 г 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и смесь перемешивали до растворения вещества. Постепенно добавляли 1900 г порошка маннита (для парентерального применения) и смесь перемешивали до растворения вещества. Добавляли воду для инъекций до достижения общей массы раствора 38,760 г и раствор перемешивали в течение дополнительных 10 минут. Измеряли значение рН, составившее 3,4 при температуре раствора 29,3°С. Раствор стерилизовали фильтрованием через последовательно расположенные 0,45 мкм осветляющий фильтр и 0,22 мкм фильтр. Затем раствором заполняли 50 мл флаконы с целевым объемом 20,8 мл для каждого флакона. На каждый флакон надевали (не укупоривая) 20 мм серую силиконизированную пробку D777-1 V10-F597W FluroTec (торговая марка).
(b) Затем указанные флаконы помещали на подносы из нержавеющей стали и загружали в лиофилизатор LSL1000 (торговая марка). Устанавливали температуру на полках 5°С. Цикл сублимационной сушки осуществляли согласно приведенному ниже способу.


В лиофилизатор подавали стерилизованный фильтрованием азот до заданного значения приблизительно 700 мбар (70000 Па) и флаконы плотно закрывались пробками. Затем сбрасывали давление в лиофилизаторе до атмосферного с использованием стерилизованного фильтрованием воздуха и выгружали флаконы из лиофилизатора.
Каждый флакон содержал сублимированную композицию в виде белого твердого вещества.
Пример 3
Восстановление лиофилизированной твердой композиции с получением фармацевтической композиции в виде водного раствора с концентрацией 5 мг/мл, содержащей 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил)фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину, DL-молочную кислоту и маннит
Флаконы с образцами лиофилизированной твердой композиции, полученной в Примере 2(б), растворяли следующим образом.
В шприц набирали приблизительно 25 мл воды для инъекций и к шприцу присоединяли 0,2 мкм мембранный фильтр из поливинилидендифторида (PVDF). Через мембрану фильтровали приблизительно 5 мл воды и отбрасывали. Затем 20 мл оставшейся в шприце воды фильтровали в 50 мл флакон, содержащий лиофилизированную композицию, полученную, как описано в Примере 2(б). Смесь перемешивали путем вращения флакона до получения прозрачного бесцветного раствора.
Восстановленный раствор анализировали следующим образом.
(а) pH
Значение pH раствора во флаконе составило 3,52 при температуре 23,2 градуса Цельсия.
(b) Внешний вид восстановленного раствора
Один из флаконов с восстановленным препаратом подвергали визуальному контролю согласно методу, основанному на статье 2.9.20 Европейской Фармакопеи, описанному выше. Метод предназначен для оценки на наличие каких-либо видимых частиц.
Раствор во флаконе подвергали визуальному контролю в соответствии с указанным методом в просмотровом шкафу Verivide DCAC60 (торговая марка) при интенсивности освещения 3250 люкс на фоне черного матового экрана и белого матового экрана.
Результаты показали, что при восстановлении получили прозрачный бесцветный раствор, свободный от механических включений.
(c) Испытание на наличие невидимых механических включений
Раствор во флаконе оценивали на наличие невидимых механических включений с использованием аппарата HIAC (торговая марка) с помощью метода определения невидимых механических включений, основанного на описанном в Фармакопее США 36 <788> Методе 1 («Подсчет частиц, основанный на принципе светоблокировки»). Чтобы раствор был пригодным для парентерального или внутривенного введения, результаты должны соответствовать критериям «Испытание 1.В» Метода 1 Фармакопеи США 36 <788>, поскольку там указаны наиболее широкие границы допустимого содержания невидимых механических включений. Данное испытание проводят следующим образом:
«Испытание 1.В (Инфузионные или инъекционные растворы для парентерального применения, содержащиеся в контейнерах номинальным объемом менее 100 мл) - препарат отвечает требованиям, если в одной упаковке среднее число частиц размером 10 мкм и более не превышает 6000, а среднее число частиц размером 25 мкм и более не превышает 600.»
Для испытания данным методом, вначале, объединяют содержимое 10 упаковок. Из объединенного раствора отбирали четыре пробы объемом не менее 5 мл каждая, и в каждой пробе подсчитывали количество частиц размером, равным или превышающим 10 и 25 мкм, с помощью сенсора HIAC HRLD 400 (торговая марка). Результаты определения для первой пробы не принимали в расчет. В каждой из оставшихся трех проб подсчитывали количество частиц в контейнере и сравнивали с нормативными требованиями для Испытания 1.В USP 36 <788>. Все указанные пробы отвечали требованиям USP 36 <788> для растворов, пригодных для парентерального или внутривенного введения.
Пример 4
Получение кристаллической формы L-лактата 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины.
Получение А:
Брали навеску 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины (52 мг) во флакон объемом 2 мл. Во флакон добавляли раствор L-молочной кислоты с концентрацией 22 мг/мл в смеси этилацетат : диметилформамид 98:2 об./об. (0,5 мл). Суспензию перемешивали в течение 24 часов при температуре приблизительно 23°С. Затем суспензию фильтровали через нейлоновый центрифужный фильтр 0,2 мкм для выделения кристаллического соединения, указанного в заголовке.
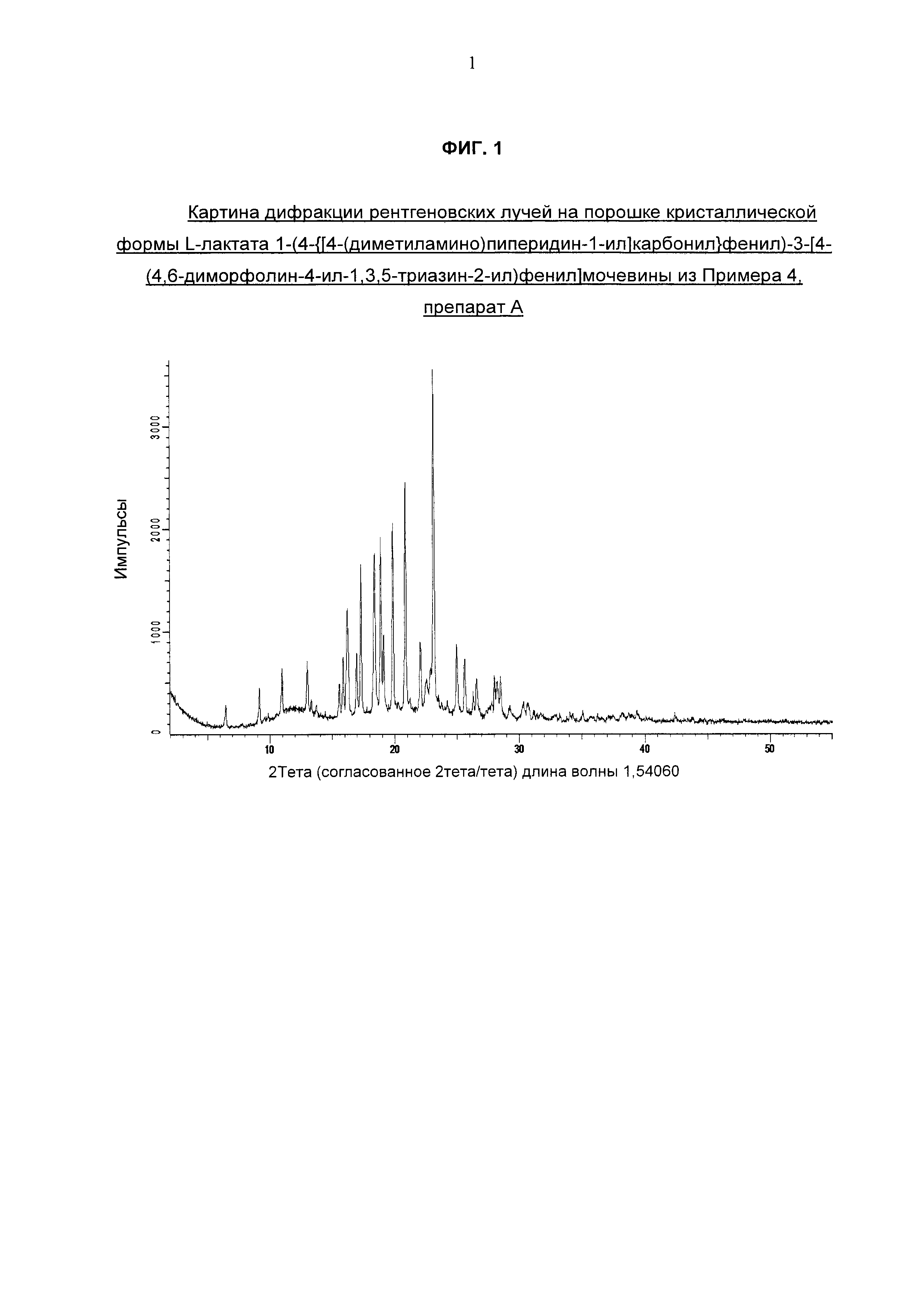
Продукт анализировали методом дифракции рентгеновских лучей на порошке (см. раздел «Испытание 7» ниже) с использованием дифрактометра Bruker D4 (торговая марка) и К-альфа излучения меди и получали картину дифракции рентгеновских лучей на порошке, приведенную на Фиг. 1.
Получение В:
Брали навеску 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины (52 мг) во флакон объемом 2 мл. Во флакон добавляли раствор L-молочной кислоты с концентрацией 22 мг/мл в смеси этилацетат : диметилформамид 98:2 об./об. (0,5 мл). Суспензию нагревали до 60°С со скоростью 5°С/минуту, выдерживали при 60°С в течение 20 мин, а затем охлаждали со скоростью 0,1°С/минуту до температуры 5°С, при которой выдерживали до начала выделения (24 часа от начала стадии нагревания). Суспензию фильтровали через нейлоновый центрифужный фильтр 0,2 мкм для выделения кристаллического соединения, указанного в заголовке.
Продукт анализировали методом дифракции рентгеновских лучей на порошке (см. раздел «Испытание 7» ниже) с использованием дифрактометра Bruker D4 и К-альфа излучения меди и получали картину дифракции рентгеновских лучей на порошке, сопоставимую с приведенной на Фиг. 1.
В соответствии с данным изобретением проводили следующие испытания.
Испытания
1. Испытание водных композиций, содержащих 3 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, с различными кислотами
Методика:
Готовили девять отдельных кислых буферных растворов для получения приблизительно 6,8 моль-эквивалентов каждой кислоты следующим образом (за исключением случаев, где указано иное):



(WFI = вода для ирригаций) (*90% (мас./мас.) водный раствор DL-молочной кислоты)
Испытание на стабильность проводили с использованием трех проб 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины с концентрацией приблизительно 3 мг/мл, в каждом из кислых буферных растворов, приготовленных, как указано выше. Указанные пробы готовили, используя целевую массу 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины 15,45 мг (поскольку активность АФИ составляла 97,1%), взвешивая необходимое количество в каждый флакон следующим образом:

К навеске во флаконе добавляли 5 мл соответствующего буфера и каждый флакон закрывали обжимной крышкой и затем запечатывали защитной пленкой. Флаконы помещали на рольганг в сушильный шкаф с температурой 25°С на 5 суток.
Результаты.
По истечении 5 суток измеряли pH каждой пробы и осуществляли визуальную оценку каждой пробы с использованием просмотровой кабины, как описано в методе 2.9.20 Европейской Фармакопеи (см. выше), просматривая образцы на черном и белом фоне. Также проводили испытание, освещая образцы узким световым пучком (Тиндаля) и затем просматривая в направлении, перпендикулярном световому пучку, для обнаружения нерастворенных твердых частиц.
Шесть флаконов упали с рольганга в ходе эксперимента, то есть время, в течение которого данные флаконы находились на рольганге, неизвестно. Данные образцы помечены звездочкой (*) в приведенных ниже Таблицах «Результаты pH» и «Визуальный осмотр».
Результаты pH через 5 суток при 25°С

Визуальный осмотр образцов через 5 суток при 25°С

Заключение
Результаты показывают, что образцы, содержащие 3 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и DL-молочную кислоту образовывали прозрачный раствор через 5 суток при температуре 25°С. Все остальные образцы, за исключением одного (ортофосфорная кислота - образец №2), не образовывали прозрачного раствора. Таким образом, для приготовления растворов водных фармацевтических композиций с заданной концентрацией АФИ (активного фармацевтического ингредиента) для внутривенного введения пациенту не подходят другие кислоты, кроме DL-молочной кислоты и ортофосфорной кислоты.
2. Испытание водных композиций, содержащих 3 мг/мл и 4 мг/мл 1-(4-([4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и различные кислоты
Методика:
(а) Для использования в композициях с концентрацией 3 мг/мл готовили четыре отдельных кислых буферных раствора для получения приблизительно 6,8 моль-эквивалентов каждой кислоты следующим образом:


(WFI = вода для ирригаций)
Испытание на стабильность проводили с использованием трех проб 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины с концентрацией приблизительно 3 мг/мл, в каждом из кислых буферных растворов, приготовленных, как указано выше. Указанные пробы готовили, используя целевую массу 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины 15,45 мг (поскольку активность АФИ составляла 97,1%), взвешивая необходимое количество в каждый флакон следующим образом:

(b) Для использования в композициях с концентрацией 4 мг/мл готовили отдельные кислые буферные растворы для получения приблизительно 5,1 моль-эквивалентов соответствующей кислоты следующим образом (за исключением случаев, где указано иное):




(WFI = вода для ирригаций) (* 90% (мас./мас.) водный раствор DL-молочной кислоты)
Испытание на стабильность проводили с использованием трех проб 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины с концентрацией приблизительно 4 мг/мл, в каждом из кислых буферных растворов, приготовленных, как указано выше. Указанные пробы готовили, используя целевую массу 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины 20,60 мг (поскольку активность АФИ составляла 97,1%), взвешивая необходимое количество в каждый флакон следующим образом:

Для композиций (а) и (б), указанных выше, к навеске во флаконе добавляли 5 мл соответствующего буфера и каждый флакон закрывали обжимной крышкой и затем запечатывали защитной пленкой. Флаконы помещали на рольганг в сушильный шкаф с температурой 25°С на 5 суток.
Результаты
По истечении 5 суток измеряли pH каждой пробы и осуществляли визуальную оценку каждой пробы с помощью просмотровой кабины, как описано в методе 2.9.20 Европейской Фармакопеи (см. выше), просматривая образцы на черном и белом фоне. Также проводили испытание, освещая образцы узким световым пучком (Тиндаля) и затем просматривая в направлении, перпендикулярном световому пучку, для обнаружения нерастворенных твердых частиц.
pH через 5 суток при 25°С
3 мг/мл

4 мг/мл



Визуальный осмотр образцов через 5 суток при 25°С
3 мг/мл

4 мг/мл


Заключение
Результаты показывают, что образцы, содержащие 3 мг/мл и 4 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, а также D-молочную кислоту, L-молочную кислоту или DL-молочную кислоту, образовывали прозрачный раствор через 5 суток при температуре 25°С.
Результаты показывают, что образцы, содержащие 3 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и ортофосфорную кислоту, также образовывали прозрачный раствор через 5 суток при температуре 25°С.
Все остальные образцы не образовывали прозрачного раствора, и другие кислоты, кроме DL-молочной кислоты, D-молочной кислоты, L-молочной кислоты и ортофосфорной кислоты, не подходят для приготовления фармацевтической композиции в виде водного раствора с заданной концентрацией АФИ для внутривенного введения пациенту.
3. Испытание водных композиций 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил)фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и DL-молочной кислоты при варьировании pH и концентрации
Методика
(а) Буферные растворы для использования в получении композиций, содержащих 3 мг/мл, 5 мг/мл, 5,5 мг/мл, 6 мг/мл и 6,5 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, готовили в соответствии со следующими расчетами (WFI = вода для ирригаций)) (*90% (мас./мас.) водный раствор DL-молочной кислоты)
- 3 мг/мл @ 0,9 моль-эквивалентов в объеме 10 мл соответствуют 4,39 мг DL-молочной кислоты* в 10 мл WFI. (1)
- 3 мг/мл @ 2,25 моль-эквивалентов в объеме 10 мл соответствуют 10.98 мг DL-молочной кислоты* в 10 мл WFI. (2)
- 3 мг/мл @ 3,7 моль-эквивалентов в объеме 10 мл соответствуют 17.99 мг DL-молочной кислоты* в 10 мл WFI. (3)
- 5 мг/мл @ 0,9 моль-эквивалентов в объеме 10 мл соответствуют 7,32 мг DL-молочной кислоты* в 10 мл WFI. (4)
- 5 мг/мл @ 2,25 моль-эквивалентов в объеме 10 мл соответствуют 18,29 мг DL-молочной кислоты* в 10 мл WFI. (5)
- 5 мг/мл @ 3,7 моль-эквивалентов в объеме 10 мл соответствуют 30 мг DL-молочной кислоты* в 10 мл WFI. (6)
- 5 мг/мл @ 7,2 моль-эквивалентов в объеме 10 мл соответствуют 58,54 мг DL-молочной кислоты* в 10 мл WFI. (7)
- 5 мг/мл @ 10,8 моль-эквивалентов в объеме 10 мл соответствуют 87,80 мг DL-молочной кислоты* в 10 мл WFI. (8)
- 5,5 мг/мл @ 2,25 моль-эквивалентов в объеме 10 мл соответствуют 20,12 мг DL-молочной кислоты* в 10 мл WFI. (9)
- 5,5 мг/мл @ 3,7 моль-эквивалентов в объеме 10 мл соответствуют 33 мг DL-молочной кислоты* в 10 мл WFI. (10)
- 5,5 мг/мл @ 10,8 моль-эквивалентов в объеме 10 мл соответствуют 96,58 мг DL-молочной кислоты* в 10 мл WFI. (11)
- 6 мг/мл @ 3,7 моль-эквивалентов в объеме 10 мл соответствуют 36 мг DL-молочной кислоты* в 10 мл WFI. (12)
- 6 мг/мл @ 3,7 моль-эквивалентов в объеме 20 мл соответствуют 72 мг DL-молочной кислоты* в 20 мл WFI. (14)
- 6,5 мг/мл @ 3,7 моль-эквивалентов в объеме 10 мл соответствуют 39 мг DL-молочной кислоты* в 10 мл WFI. (13)
- 6,5 мг/мл @ 3,7 моль-эквивалентов в объеме 20 мл соответствуют 78 мг DL-молочной кислоты* в 10 мл WFI. (15)
Буферные растворы готовили с использованием WFI в мерных колбах объемом 10 мл (*20 мл, где указано в Таблице ниже), используя соответствующие навески DL-молочной кислоты (** 90% (мас./мас.) водный раствор DL-молочной кислоты):


(b) Во флаконы отвешивали следующее количество 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины (прим. 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина имеет активность 97,1% и целевая масса, указанная ниже, скорректирована на эту активность).


К АФИ во флаконе добавляли 5 мл соответствующего буферного раствора DL-молочной кислоты и затем каждый флакон закрывали обжимной крышкой и запечатывали защитной пленкой.
Образцы 1-11 помещали на рольганг при комнатной температуре при 50 об/мин приблизительно на 21,5 ч.
Образцы 12 и 13 помещали на рольганг при комнатной температуре при 50 об/мин приблизительно на 23 ч.
Образцы 14 и 15 помещали на качающийся рольганг при комнатной температуре при 50 об/мин приблизительно на 25 ч.
Результаты по истечении периодов времени приблизительно 21,5/23/25 ч
По истечении указанного периода качания измеряли рН каждой пробы и осуществляли визуальную оценку каждой пробы с помощью просмотровой кабины, как описано в методе 2.9.20 Европейской Фармакопеи (см. выше), просматривая образцы на черном и белом фоне. Также проводили испытание, освещая образцы узким световым пучком (Тиндаля) и затем просматривая в направлении, перпендикулярном световому пучку, для обнаружения нерастворенных твердых частиц.




Были сделаны следующие наблюдения:
- Образцы 7, 8 и 11 образовали раствор в течение 2 ч после помещения на рольганг.
- Образец 6 образовал раствор в течение 4 ч после помещения на рольганг.
- Образцы 3 и 10 образовали раствор в течение 20 ч после помещения на рольганг.
Заключение
Можно сделать вывод, что для образования прозрачного раствора приблизительно через 24 ч концентрация раствора 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины должна быть менее 6 мг/мл и в композиции необходимо использовать более 2,5 моль-эквивалентов DL-молочной кислоты. Однако, приведенные выше результаты для образцов 14 и 15 показывают, что прозрачные растворы могут образоваться при концентрации раствора 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины 6 мг/мл и 6,5 мг/мл и 3,6 и 3,7 моль-эквивалентов DL-молочной кислоты, соответственно. Сравнение результатов, полученных для образцов 14 и 15, с результатами образцов 12 и 13 свидетельствует о возможном существовании метастабильной области, в которой могут образовываться как прозрачные, так и непрозрачные растворы.
Результаты по истечении периода времени 72 ч
По истечении указанного выше приблизительно 21,5-часового периода качания образцы 1-11 хранили при комнатной температуре без качания в течение последующего времени, общая продолжительность эксперимента составляла приблизительно 72 ч. Отметили, что некоторые образцы, которые не образовали раствор по истечении первоначальных 21,5-часового периода качания, образовывали прозрачный раствор в конце общего 72-часового периода.
По истечении указанного выше приблизительно 25-часового периода качания образцы 14 и 15 хранили при комнатной температуре без качания в течение последующего времени, общая продолжительность эксперимента составляла приблизительно 73 ч.
Осуществляли визуальную оценку данных образцов с использованием просмотровой кабины, как описано в методе 2.9.20 Европейской Фармакопеи (см. выше), просматривая образцы на черном и белом фоне. Также проводили испытание, освещая образцы узким световым пучком (Тиндаля) и затем просматривая в направлении, перпендикулярном световому пучку, для обнаружения нерастворенных твердых частиц. Также измеряли pH. Получили следующие результаты:
(i) Визуальная оценка по истечении 72 ч

(ii) Сравнение результатов pH и визуальной оценки по окончании периодов времени приблизительно 24 ч и 72 ч


Заключение
По окончании 72-часового экспериментального периода можно сделать вывод, что прозрачный раствор может образоваться при использовании концентрации раствора 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины 5 и 5,5 мг/мл, когда в композиции используют по меньшей мере 2,3 моль-эквивалентов DL-молочной кислоты. Прозрачный раствор может также образоваться при использовании концентрации раствора 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины 3 мг/мл, когда в композиции используют по меньшей мере 2,5 моль-эквивалентов DL-молочной кислоты. Результаты, приведенные выше для образцов 14 и 15, показывают, что прозрачные растворы могут образоваться при концентрации раствора 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины 6 мг/мл и 6,5 мг/мл и 3,6 и 3,7 моль-эквивалентов DL-молочной кислоты, соответственно. Сравнение результатов, полученных для образцов 14 и 15, с результатами образцов 12 и 13 свидетельствует о возможном существовании метастабильной области, в которой могут образовываться как прозрачные, так и непрозрачные растворы.
4. Испытание водных композиций, содержащих 3 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и 6,8 моль-эквивалентов ортофосфорной кислоты
Методика
Водный раствор ортофосфорной кислоты с концентрацией приблизительно 33,3 мМ готовили следующим образом. Отмеряли 0,32569 г ортофосфорной кислоты приблизительно в 80 мл воды для орошений. Затем доводили объем до 100 мл в мерной колбе с помощью воды для орошений и замеряли значение pH, составившее 1,92.
Целевая концентрация 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины составляла 3 мг/мл, при этом следовало учитывать активность лекарственного средства 97,1%.
Для выбранного объема 10 мл целевая масса 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины составляла 30,9 мг. Готовили 3 образца АФИ, используя следующие навески, каждую в 20-мл флаконе:

В каждый флакон с помощью поршневой пипетки отмеряли 10 мл буферного раствора ортофосфорной кислоты, приготовленного, как указано выше. Каждый флакон закрывали обжимной крышкой и запечатывали защитной пленкой.
Образцы помещали на рольганг при комнатной температуре приблизительно на 19 ч.
Осуществляли визуальную оценку данных образцов с использованием просмотровой кабины, как описано в методе 2.9.20 Европейской Фармакопеи (см. выше), просматривая образцы на черном и белом фоне. Также проводили испытание, освещая образцы узким световым пучком (Тиндаля) и затем просматривая в направлении, перпендикулярном световому пучку, для обнаружения нерастворенных твердых частиц. Также измеряли рН. Получили следующие результаты:

Разведения
Несмотря на то, что описанным выше способом получали прозрачные, свободные от частиц растворы, значения рН каждого раствора были слишком низкими для внутривенного введения, для которого предпочтительны значения pH от 3 до 4,5.
Поэтому выполняли разведение каждого из 3 образцов до 0,5 мг/мл, 0,1 мг/мл и 0,05 мг/мл для определения, будет ли pH повышаться до значений pH, подходящих для внутривенного введения. Разведенные образцы помещали на рольганг на ночь для достижения равновесия. Также измеряли рН. Значения рН образцов оказались следующими:



Осуществляли визуальную оценку каждого образца с использованием просмотровой кабины, как описано в методе 2.9.20 Европейской Фармакопеи (см. выше), просматривая образцы на черном и белом фоне. Также проводили испытание, освещая образцы узким световым пучком (Тиндаля) и затем просматривая в направлении, перпендикулярном световому пучку, для обнаружения нерастворенных твердых частиц. Каждый образец при осмотре оказался визуально прозрачным раствором.
Заключение
Результаты свидетельствуют, что возможно получение прозрачного свободного от частиц раствора водной композиции, содержащей 3 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и 6,8 моль-эквивалентов ортофосфорной кислоты. Однако, рН данной композиции или ее восстановленной формы не подходит для внутривенного введения и, следовательно, нуждается в последующем разведении до 0,5 мг/мл для достижения значений рН раствора, подходящих для внутривенного введения.
При сравнении указанных результатов с результатами, полученными для композиций молочной кислоты, описанными выше, оказалось, что при использовании ортофосфорной кислоты достигаются более низкие значения рН и концентрации 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины. Таким образом, для приготовления композиции в виде водного раствора 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины для внутривенного введения согласно изобретению молочная кислота в целом подходит лучше, чем ортофосфорная кислота.
5. Испытание водных композиций, содержащих 3 мг/мл, 4 мг/мл и 5 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и уксусную кислоту
Методика
Для приготовления 33,3 мМ раствора уксусной кислоты в стеклянный стакан объемом 250 мл вносили 0,2071 г ледяной уксусной кислоты и добавляли приблизительно 80 мл WFI (воды для ирригаций).
В раствор добавляли и растворяли 0,0138 г трехводного ацетата натрия. Затем доводили объем раствора до 100 мл в мерной колбе с помощью WFI и регистрировали значение pH, составившее 3,35.
Три целевые концентрации АФИ (3, 4 и 5 мг/мл) следовало скорректировать с учетом активности АФИ 97,1%. Массу АФИ определяли согласно следующим расчетам.
- 30 мг активного ингредиента соответствуют 30,9 мг 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины
- 40 мг активного ингредиента соответствуют 41,2 мг 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины
- 50 мг активного ингредиента соответствуют 51,49 мг 1-(4-{[4~ (диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины
В 20 мл стеклянные флаконы помещали следующие навески:

В каждый флакон к навескам образцов добавляли 10 мл буферного раствора уксусной кислоты, приготовленного ранее. Каждый флакон закрывали обжимной крышкой и запечатывали защитной пленкой.
Образцы помещали на рольганг при комнатной температуре и осуществляли визуальную оценку с использованием просмотровой кабины, как описано в методе 2.9.20 Европейской Фармакопеи (см. выше), просматривая образцы на черном и белом фоне. Также проводили испытание, освещая образцы узким световым пучком (Тиндаля) и затем просматривая в направлении, перпендикулярном световому пучку, для обнаружения нерастворенных твердых частиц. Визуальную оценку осуществляли через интервалы времени 24 ч, 48 ч, 72 ч и 6 суток.
Результаты
Ни один образец не образовал прозрачного раствора через указанные интервалы времени 24 ч, 48 ч, 72 ч и 6 суток.
Значения рН образцов оказались следующими:
(а) Проверка pH по истечении 48 ч
Исходное значение рН буферного раствора =3,35
(i) Образцы 3 мг/мл

(ii) Образцы 4 мг/мл

(iii) Образцы 5 мг/мл

(b) Проверка рН по истечении 6 сут
(i) Образцы 3 мг/мл

(ii) Образцы 4 мг/мл

(iii) Образцы 5 мг/мл

Заключение
Результаты свидетельствуют, что при концентрациях 3, 4 и 5 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина не образует прозрачного раствора при использовании 33,3 мМ уксусной кислоты. Водная композиция с концентрацией 3 мг/мл содержала приблизительно 6,8 моль-эквивалентов уксусной кислоты. Водная композиция с концентрацией 4 мг/мл содержала приблизительно 5,1 моль-эквивалентов уксусной кислоты. Водная композиция с концентрацией 5 мг/мл содержала приблизительно 4,1 моль-эквивалентов уксусной кислоты.
6. Испытание водных композиций, содержащих 3 и 3,5 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморсролин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и ортофосфорную кислоту
Водный раствор 33,3 мМ ортофосфорной кислоты готовили следующим образом.
Отмеряли 0,32767 г ортофосфорной кислоты приблизительно в 75 мл воды для орошений. Затем доводили объем до 100 мл в мерной колбе с помощью воды для ирригаций и регистрировали значение рН, составившее 1,94.
Целевая концентрация 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины составляла 3 и 3,5 мг/мл, при этом следовало учитывать активность лекарственного средства 97,1%.
Водная композиция с концентрацией 3 мг/мл содержала приблизительно 6,8 моль-эквивалентов ортофосфорной кислоты. Водная композиция с концентрацией 3,5 мг/мл содержала приблизительно 5,9 моль-эквивалентов ортофосфорной кислоты.
Для выбранного объема 5 мл целевая масса 1-(4-{[4_(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины составляла 15,5 мг для композиции с концентрацией 3 мг/мл и 18,0 мг для композиции с концентрацией 3,5 мг/мл. Готовили 3 образца для каждой композиции, используя следующие навески, каждый в 20-мл флаконе:

В каждый флакон с помощью поршневой пипетки отмеряли 5 мл буферного раствора ортофосфорной кислоты, приготовленного, как описано выше. Каждый флакон закрывали обжимной крышкой и запечатывали защитной пленкой.
Образцы помещали на рольганг при комнатной температуре на 15 ч.
Осуществляли визуальную оценку данных образцов с использованием просмотровой кабины, как описано в методе 2.9.20 Европейской Фармакопеи (см. выше), просматривая образцы на черном и белом фоне. Также проводили испытание, освещая образцы узким световым пучком (Тиндаля) и затем просматривая в направлении, перпендикулярном световому пучку, для обнаружения нерастворенных твердых частиц. Все растворы при осмотре оказались визуально прозрачными. Также измеряли pH.
Были получены следующие результаты (примечание: исходное значение рН для 33,3 мМ раствора ортофосфорной кислоты составляло 1,94)


Заключение
Результаты свидетельствуют, что возможно получение прозрачной свободной от частиц композиции в виде водного раствора, содержащей 3,0 или 3,5 мг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины и 5,9 моль-эквивалентов ортофосфорной кислоты.
Однако, значения pH свидетельствуют, что для обеспечения стабильного рН, позволяющего осуществлять непосредственное внутривенное или парентеральное введение указанных композиций, необходимо разведение.
При сравнении указанных результатов с результатами, полученными для композиций молочной кислоты, описанными выше, оказалось, что при использовании ортофосфорной кислоты достигаются более низкие значения рН и концентрации 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины. Таким образом, молочная кислота является более предпочтительной для приготовления прозрачного свободного от частиц раствора водной композиции 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины для внутривенного или парентерального введения.
7. Характеристика кристаллической формы L-лактата 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил)фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины
Анализ дифракции рентгеновских лучей на порошке
Анализ дифракции рентгеновских лучей на порошке (PXRD) выполняли на дифрактометре Bruker D4 (торговая марка) с использованием излучения меди (длина волны: 1,5406  ). Устанавливали напряжение и силу тока на трубке 35 кВ и 40 мА, соответственно. Использовали щель расходимости v6 и щель рассеивания 0,499 мм. Использовали регулируемую приемную щель. Дифрагированное излучение регистрировали с помощью детектора Vantec. Тета - 2 тета сканирование выполняли в непрерывном режиме со скоростью 5,4 7 мин (с шагом 0,2 сек/0,018°) от 2,0 до 55° 2θ. В качестве стандарта для проверки градуировки прибора использовали корунд. Рентгенограммы регистрировали и анализировали с использованием программного обеспечения Bruker AXS. При подготовке образцы помещали на кремниевую подложку. Для визуализации и оценки спектров PXRD использовали программное обеспечение DIFFRAC.EVA V 3.1. Предварительную обработку файлов данных PXRD (.raw) для поиска пиков не проводили. Как правило, для первоначального выделения пиков использовали пороговое значение 1,3 и ширину 0,3. Для валидации результатов автоматического поиска проводили визуальную оценку с корректировкой вручную, при необходимости. Кроме того, при необходимости, пики в спектрах выделяли вручную. Пик на 28,1° 2-тета, соответствующий закрепляющей среде, исключали вручную.
). Устанавливали напряжение и силу тока на трубке 35 кВ и 40 мА, соответственно. Использовали щель расходимости v6 и щель рассеивания 0,499 мм. Использовали регулируемую приемную щель. Дифрагированное излучение регистрировали с помощью детектора Vantec. Тета - 2 тета сканирование выполняли в непрерывном режиме со скоростью 5,4 7 мин (с шагом 0,2 сек/0,018°) от 2,0 до 55° 2θ. В качестве стандарта для проверки градуировки прибора использовали корунд. Рентгенограммы регистрировали и анализировали с использованием программного обеспечения Bruker AXS. При подготовке образцы помещали на кремниевую подложку. Для визуализации и оценки спектров PXRD использовали программное обеспечение DIFFRAC.EVA V 3.1. Предварительную обработку файлов данных PXRD (.raw) для поиска пиков не проводили. Как правило, для первоначального выделения пиков использовали пороговое значение 1,3 и ширину 0,3. Для валидации результатов автоматического поиска проводили визуальную оценку с корректировкой вручную, при необходимости. Кроме того, при необходимости, пики в спектрах выделяли вручную. Пик на 28,1° 2-тета, соответствующий закрепляющей среде, исключали вручную.
Для получения картин рентгеновской дифракции по геометрии Брегга-Брентано на приборе Bruker, описанных в данном документе, образец обычно помещали на плоскую кремниевую подложку. Порошок распределяли по стеклянной пластине и прижимали для получения случайной поверхности и надлежащей высоты образца. Затем держатель образца помещали в прибор. На образец направляли падающий пучок рентгеновских лучей, вначале под небольшим углом к плоскости держателя, затем перемещали по дуге, постепенно увеличивая угол между падающим пучком и плоскостью держателя. Различия в измерениях при таком анализе дифракции рентгеновских лучей на порошке являются следствием различных факторов, включая: (а) ошибки в приготовлении образца (например, высота образца), (б) ошибки прибора (например, ошибки плоского образца), (в) ошибки калибровки, (г) ошибки оператора (включая ошибки при определении положения пиков) и (д) природу материала (например, ошибки, связанные с предпочтительной ориентацией и прозрачностью). Ошибки, связанные с калибровкой и высотой образца, зачастую приводят к сдвигу всех пиков в одном направлении. Небольшие различия в высоте образца при использовании плоского держателя будут приводить к большому смещению положений пиков PXRD. Систематическое исследование показало, что при использовании Shimadzu XRD-6000 в стандартной конфигурации Брегга-Брентано различия в высоте образца 1 мм приводят к сдвигам положений пиков PXRD до 1 градуса 2-тета (Chen et al.; J Pharmaceutical and Biomedical Analysis, 2001; 26,63). Эти сдвиги можно идентифицировать на рентгеновской дифрактограмме и исключить путем внесения поправки на сдвиг (применив поправочный коэффициент ко всем значениям положений пиков) или путем повторной калибровки прибора. Как упоминалось выше, результаты измерений, выполненных на различном оборудовании, можно скорректировать с помощью поправочного коэффициента для приведения в соответствие положений пиков. Как правило, указанный поправочный коэффициент позволит привести в соответствие положения пиков, полученные при измерении на дифрактометре Bruker, с расчетными положениями пиков и может составлять от 0 до 0,2 градусов 2-тета.
Картина дифракции рентгеновских лучей на порошке кристаллической формы L-лактата 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины согласно Примеру 4, препарат А, зарегистрированная на дифрактометре Bruker D4 с К-альфа излучением меди (CuKα), представлена на Фиг. 1 и характеризуется следующими пиками по шкале 2θ, выраженными в градусах (+/- 0,2 градуса 2-тета) и относительной интенсивностью (≥2,5%):


(* показатели относительной интенсивности могут изменяться в зависимости от размера и морфологии кристалла)
Данная кристаллическая форма L-лактата 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины отличается от других известных (полукристаллических) форм данной соли наличием характерных пиков приблизительно на 6,5; 15,9; 20,9; 22,1 и 23,1 градусах 2-тета (+/- 0,2 градуса 2-тета).
7. Химическая стабильность лиофилизированной твердой композиции согласно изобретению
Анализировали химическую стабильность образцов лиофилизированной твердой композиции, приготовленной в соответствии со способом, приведенным в Примере 2, в 50 мл чистых флаконах, в различные моменты времени после хранения при 25°С/относительной влажности (RH) 60% и при 40°С/75% RH. Для получения репрезентативных результатов в определенные моменты времени проводили оценку нескольких образцов в обоих экспериментальных условиях.
Образцы, хранившиеся при 40°С/75% RH, анализировали через 6 месяцев.
Образцы, хранившиеся при 25°С/60% RH, анализировали через 6 месяцев, 12 месяцев, 24 месяца и 36 месяцев.
Анализировали химическую чистоту образцов с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) согласно следующей методике для выявления возможной деградации в ходе экспериментального периода.
Методика ВЭЖХ
Растворы, образцы и стандарты для применения в методике ВЭЖХ готовили следующим образом:
- Референтный стандарт: 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевина с известной активностью.
- Разбавитель: Ацетонитрил/Вода (1:1 об./об.).
- Подвижная фаза А: 10 мМ буферный раствор бикарбоната аммония с доведением рН до 9,8 водным раствором гидроксида аммония
- Подвижная фаза В: Ацетонитрил
- Растворитель для образца: Добавляют 3 мл 0,1 н. водного раствора соляной кислоты в мерную колбу объемом 1000 мл и разводят до указанного объема с помощью разбавителя (ацетонитрил/вода, 1:1 об./об.). Хорошо перемешивают.
Примечание: можно готовить большие или меньшие объемы растворов, используя компоненты в надлежащем соотношении.
Приготовление стандартного и контрольного растворов:
- Тщательно готовят два раствора референтного стандарта 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины с концентрацией приблизительно 2 мг/мл (+- 10%) в растворителе для образца и записывают точные концентрации обоих растворов. Они представляют собой стандартный и контрольный растворы. Готовят разведения стандартного и контрольного растворов с концентрацией приблизительно 2 мкг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, используя разбавитель.
Раствор для определения чувствительности детектора:
- Тщательно разводят стандартный раствор до концентрации приблизительно 0,06 мкг/мл 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины, используя разбавитель.
Приготовление образца:
- Восстанавливают содержимое двух флаконов с лиофилизированной твердой композицией 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины (полученной согласно способу, описанному в Примере 2) путем добавления в каждый флакон 20 мл воды, встряхивая флакон для растворения твердого вещества, и ждут до исчезновения пузырьков. Переносят раствор в мерную колбу объемом 1000 мл. Каждый флакон споласкивают разбавителем по меньшей мере два раза и переносят промывочную жидкость в мерную колбу. Разводят до указанного объема разбавителем.
Условия хроматографии:
- Оборудование для проведения жидкостной хроматографии - например, Waters 2695 (торговая марка) или Agilent 1100 (торговая марка)
- Колонка: Waters Xbridge С18 (торговая марка), 15 см × 4,6 мм, 3,5 мкм или эквивалент
- Температура колонки: 40°С
- Инжектируемый объем: 20 мкл
- Скорость потока: 1,0 мл/мин
- Детекция: УФ при 303 нм
- Время прогона: 60 минут
- Подвижная фаза А
- Подвижная фаза В
- Таблица линейного градиента:

Пояснения:
Готовят оборудование для ВЭЖХ путем прогона мобильной фазы В через колонку до получения стабильной базовой линии (это обычно занимает около 30 минут).
Повторно уравновешивают хроматографическую систему подвижной фазой А (обычно 10-15 минут) перед введением последовательности проб.
Перед исследованием образцов убеждаются в пригодности системы к работе путем инъекции холостой пробы (разбавителя), раствора для определения чувствительности детектора и стандартного раствора в условиях проведения хроматографии, описанных выше.
Необходимо соответствие следующим критериям при первичном проведении ВЭЖХ или после любого существенного изменения в системе. Перед проверкой пригодности системы рекомендуется инжектировать по меньшей мере одну холостую пробу для кондиционирования.


* берут среднее арифметическое всех инъекций для оценки пригодности системы (воспроизводимости)
** формулы расчетов эффективности и асимметрии пика приведены в Фармакопее США (USP)
Инжектируют контрольный раствор в соответствии с условиями хроматографирования, описанными выше. Фактор отклика (рассчитанный по площади, массе стандарта, коэффициенту разведения и коэффициенту чистоты стандарта) для данного контрольного раствора должен находиться в пределах ±5% относительно стандартного раствора.
После подтверждения пригодности системы инжектируют холостой раствор, стандартный раствор и подготовленные исследуемые образцы, затем инжектируют стандартный раствор в соответствии с условиями хроматографирования, описанными выше. Рекомендуется инжектировать не более 6 исследуемых образцов между инъекциями стандартного раствора. Для каждой инъекции (стандарта и образца) на каждой хроматограмме измеряют время удерживания и площадь пика 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевины. Для каждой инъекции образца также определяют время удерживания и площадь пика для любых пиков, присутствующих при инъекции образца и отсутствующих при инъекции холостой пробы. При наличии артефактов, источником которых является градиент, их не интегрируют. Для определения, какие пики в образце обусловлены артефактами, источниками которых являются холостая проба и градиент, сравнивают хроматограммы, полученные при инъекции холостой пробы и при инъекции образца. Рассчитывают % продуктов разложения и указывают отдельные пики продуктов деградации, составляющих или превышающих 0,05%. Неизвестные продукты разложения следует перечислить отдельно с указанием их относительного времени удерживания. Известные продукты разложения следует перечислить отдельно с указанием их наименования.
Результаты обобщены в таблицах ниже.
Легенда
- NMT - не более
- NR - не указано
- RRT - относительное время удерживания
- Все % представляют собой мас./мас.
Продукт разложения 1

Продукт разложения 2

Продукты разложения 3, 4, 5 и 6
Каждый из них характеризуется только значением относительного времени удерживания.

- Продукты разложения 3, 5 и 6 идентифицировали как производственные примеси, стабильность которых не изменялась, и поэтому не указывались в момент времени 36 часов.


Заключение
Результаты свидетельствуют, что образцы лиофилизированной твердой композиции, приготовленные в соответствии со способом, приведенным в Примере 2, в 50 мл чистых флаконах являются химически стабильными по меньшей мере на протяжении 36 месяцев при 25°С/60% RH и по меньшей мере на протяжении 6 месяцев при 40°С/75% RH.