Результат интеллектуальной деятельности: СПОСОБ ФЕРМЕНТАТИВНОГО ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ УЛУЧШЕННЫХ ШТАММОВ СЕМЕЙСТВА Enterobakteriaceae
Вид РИД
Изобретение
Настоящее изобретение относится к способу ферментативного получения L-аминокислот с использованием микроорганизмов семейства Enterobacteriaceae, которые несут ослабленный ген proP, к микроорганизмам, которые можно применять для указанного производства, и к полинуклеотидам, кодирующим варианты транспортера ProP.
Органические соединения, более конкретно серосодержащие L-аминокислоты, имеют большое экономическое значение. L-цистеин применяют в качестве пищевой добавки, в качестве исходного продукта для фармакологических действующих веществ (например, N-ацетилцистеина) и для косметических средств. Аминокислота L-метионин играет важную роль в питании животных. Она представляет собой одну из незаменимых аминокислот, которые не могут образовываться путем биосинтеза в процессе метаболизма в организме позвоночных. Следовательно, в животноводстве необходимо гарантировать потребление в достаточных количествах конкретных аминокислот с кормом. Однако, поскольку L-метионин часто присутствует в традиционных кормовых растениях (таких как соя или зерновые культуры) в количествах, слишком низких для того, чтобы гарантировать оптимальное питание животных, прежде всего свиней и домашней птицы, то целесообразно примешивать метионин в качестве добавки к корму для животных. В организме позвоночных животных D-метионин может превращаться в биологически активный L-метионин. Поэтому в корм для животных, как правило, добавляют рацемат D- и L-метионина. В организме животных L-гомоцистеин может превращаться путем трансметилирования в L-метионин и тем самым возмещать его недостаток.
Когда ниже в настоящем описании упоминаются органические химические соединения, то указанное понятие относится к одному или нескольким соединениям, выбранным из группы L-аминокислот, предпочтительно серосодержащих L-аминокислот, прежде всего, таких как L-метионин, L-цистеин, L-цистин, L-гомоцистеин и L-гомоцистин. Предпочтительным является L-метионин.
Из существующего уровня техники известно получение аминокислот, таких как метионин, путем химического синтеза. При таком получении сначала подвергают взаимодействию акролеин и метилмеркаптан с получением 3-метилтиопропиональдегида, из которого путем взаимодействия с цианидом, аммиаком и монооксидом углерода получают гидантоин. На конечной стадии его гидролизуют с получением рацемата, эквимолярной смеси обоих стереоизомеров, т.е. D- и L-метионина. Поскольку обладающая биологической активностью форма молекулы представляет собой исключительно L-форму, то D-форма, входящая в корм, сначала должна превратиться в процессе метаболизма путем де- и трансаминирования в активную L-форму.
В отличие от метионина большинство других встречающихся в естественных условиях протеиногенных аминокислот, таких, например, как L-треонин, получают главным образом путем ферментации с использованием микроорганизмов. При этом используется то преимущество, что для микроорганизмов характерны соответствующие пути биосинтеза, обеспечивающие синтез встречающихся в естественных условиях аминокислот. Кроме того, многие процессы ферментации позволяют осуществлять очень выгодное с точки зрения стоимости производство с использованием недорогих реактантов, таких как глюкоза и минеральные соли, и, кроме того, позволяют получать биологически активную L-форму конкретной аминокислоты.
Известно, что органические химические соединения можно получать путем ферментации с использованием штаммов Enterobacteriaceae, прежде всего Escherichia coli (Е. coli) и Serratia marcescens. Благодаря их большому значению постоянно предпринимаются усилия по усовершенствованию процессов получения. Усовершенствования процесса могут касаться аспектов технологии ферментации, например, перемешивания и подачи кислорода, или состава питательных сред, таких, например, как выбор применяемого сахара или концентрации сахара, в процессе ферментации, или обработки для получения соответствующей формы продукта, например, с помощью ионообменной хроматографии, или характеристик продуктивности, присущих самому микроорганизму.
В штаммах дикого типа пути биосинтеза аминокислот находятся под строгим метаболическим контролем, это гарантирует, что аминокислоты продуцируются только для обеспечения собственных потребностей клетки. Таким образом, важной предпосылкой для эффективных процессов производства является доступность пригодных микроорганизмов, которые в отличие от организмов дикого типа обладают существенно более высокой, превышающей их собственные потребности, способностью продуцировать требуемую аминокислоту (т.е. обеспечивать ее сверхпроизводство).
Указанные микроорганизмы, отличающиеся сверхпроизводством аминокислот, можно получать общепринятыми методами осуществления мутации/селекции и/или с использованием современных целенаправленных методов рекомбинации («метаболическая инженерия»). В последнем случае, прежде всего, идентифицируют гены или аллели, которые в результате их модификации, активации или инактивации обеспечивают сверхпроизводство аминокислот. Затем эти гены/аллели интродуцируют в штамм микроорганизма или инактивируют с использованием методов молекулярной биологии таким образом, чтобы достигать оптимального сверхпроизводства. Однако часто только комбинация нескольких различных путей приводит к действительно эффективному производству.
L-метионин наряду с лизином и треонином образуется из аспартата. Серу интродуцируют в L-метионин в форме L-цистеина (через цистатионин в качестве промежуточного продукта) путем транссульфурирования. СН3-группа L-метионина образуется в результате С1-метаболизма и переносится на L-гомоцистеин с помощью метионинсинтаз MetE и MetH (см. обзор: Greene R.C. в: «Escherichia coli and Salmonella», под ред. Neidhardt F.C. и др., 2-ое изд., 1996, сс. 542-560). В случае применения Е. coli соответствующие штаммы и методы ферментативного получения L-метионина описаны, например, в WO 2006/001616, WO 2009/043803.
ProP представляет собой симпортер протона/совместимого растворенного вещества в Е. coli, и, таким образом, является одним из транспортеров в Е. coli, которые обладают активностью в гиперосмотических условиях (Grothe и др., Journal of Bacteriology 166, 1986, сс. 253-259; Racher и др., Biochemistry 38, 1999, сс. 1676-1684; Wood, Methods in Enzymology 428, 2007, сс. 77-107). При повышении осмоляльности окружающей клетку среды происходит снижение ее водного потенциала, и молекулы воды диффундируют из клетки в соответствии с осмотическим градиентом. Происходит снижение клеточного тургора и после этого цитоплазматические белки лишаются своей оказывающей влияние на их функциональные свойства гидратной оболочки («шубы»). В результате указанной дегидратации прекращаются клеточный метаболизм и клеточное деление. Для предупреждения этого у микроорганизмов в процессе эволюции развились различные стратегии, например, заключающиеся в синтезе и/или абсорбции так называемых совместимых растворенных веществ. Если такие встречающиеся в естественных условиях протектанты, например, пролин или глицинбетаин, могут поступать извне, то их абсорбция, которая является более быстрой, а также более выгодной с энергетической точки зрения, более предпочтительна по сравнению с их синтезом самими микроорганизмами (Wood, Microbiology and Molecular Biology Reviews 63, 1999, cc. 230-262). Симпортер ProP относится к семейству MFS (главное суперсемейство мембранных транспортеров (major facilitator superfamily)) и катализирует абсорбцию пролина, глицинбетаина, пролинбетаина, эктоина и других структурно сходных субстратов посредством механизма симпорта с протонами в клетку в гиперосмотических условиях. ProP был первым транспортером, у которого были выявлены осмосенсорные и осморегуляторные свойства в восстановленной системе. С-концевой домен может формировать так называемый «coiled coil»-мотив. Формирование этого мотива является важным для осморегуляции и возможно для чувствительности к осмотическим стимулам (Culham и др., Journal of Molecular Recognition 13, 2000, сс. 309-322). Установлено, что ProP активируется при повышении внутренней концентрации ионов калия и при макромолекулярном краудинге, который имитировали в протеолипосомах с помощью полиэтиленгликоля (ПЭГ) с различными длинами цепей (Racher и др., Biochemistry 40, 2001, сс. 7324-7333; Culham и др., Biochemistry 42, 2003, сс. 410-420). Хотя ProP обладает чувствительностью к осмотическим стрессовым ситуациям без участия дополнительных факторов, однако для полной активности носителя in vivo требуется присутствие цитоплазматического белка ProQ (Kunte и др., Journal of Bacteriology 181, 1999, сс. 1537-1543).
Таким образом, уже давно известно, что транспортер ProP Е. coli обладает осморегуляторной функцией.
При создании изобретения неожиданно было установлено, что производство L-аминокислот микроорганизмами семейства Enterobacteriaceae можно повышать путем ослабления гена proP.
В основу настоящего изобретения была положена задача разработать способ и создать микроорганизмы, позволяющие повышать сверхпроизводство серосодержащих аминокислот, более конкретно L-метионина.
Описание изобретения
Первым объектом настоящего изобретения является способ получения L-аминокислот или кормовых добавок, содержащих L-аминокислоты, путем ферментации с использованием микроорганизма семейства Enterobacteriaceae, отличающийся тем, что применяют микроорганизм, в котором ослаблен ген proP.
Указанный микроорганизм продуцирует L-аминокислоту и предпочтительно секретирует ее в окружающую среду.
Кроме того, предпочтительно микроорганизм обеспечивает накопление L-аминокислоты в среде и/или внутри клетки (аккумуляция), при этом предпочтительным является накопление в среде.
Таким образом, следующим объектом настоящего изобретения является также микроорганизм семейства Enterobacteriaceae, который несет ослабленный ген proP, отличающийся тем, что он продуцирует L-аминокислоты и предпочтительно секретирует их в среду, предпочтительно приводя к накоплению L-аминокислот в среде и/или внутри клетки, предпочтительно в среде.
При этом микроорганизм предпочтительно характеризуется повышенной продуктивностью и предпочтительно экскрецией требуемой L-аминокислоты в процессе ферментации по сравнению с применяемым исходным штаммом или родительским штаммом, в котором отсутствует ослабленный ген proP.
В контексте настоящего изобретения понятие «ослабленный» означает, что ген proP либо характеризуется низким уровнем экспрессии, либо полностью «выключен» (элиминирован).
Согласно изобретению в указанном контексте понятие «ослабление» означает снижение или элиминирование в микроорганизме внутриклеточной активности или концентрации одного или нескольких ферментов или белков, в данном случае, прежде всего транспортера ProP, которые кодируются соответствующей ДНК, в данном случае, прежде всего геном proP, например, путем применения более слабого промотора по сравнению с тем, который присутствует в микроорганизме или родительском штамме, не являющимся рекомбинантным в отношении соответствующего фермента или белка, или применения гена или аллеля, который кодирует соответствующий фермент или белок, обладающий низкой активностью, или инактивации соответствующего фермента или белка, или открытой рамки считывания или гена, и, при необходимости путем комбинации указанных подходов.
Методы ослабления, как правило, позволяют снижать активность или концентрацию соответствующего белка до уровня, составляющего от 0 до 75%, от 0 до 50%, от 0 до 25%, от 0 до 10% или от 0 до 5%, от активности или концентрации белка дикого типа, или активности или концентрации белка в микроорганизме или родительском штамме, не являющимся рекомбинантным в отношении соответствующего фермента или белка. Под нерекомбинантным микроорганизмом или родительским штаммом подразумевают микроорганизм, который подвергают манипуляциям для осуществления ослабления или элиминации согласно изобретению.
Ослабления можно достигать, например, путем снижения или элиминации либо экспрессии генов или открытых рамок считывания, либо каталитических свойств ферментных белков. При необходимости можно комбинировать оба подхода.
Экспрессию гена можно снижать, применяя соответствующую процедуру культивирования, с помощью генетической модификации (мутации) сигнальных структур, участвующих в экспрессии гена, или с помощью технологии антисмысловой РНК. Примерами сигнальных структур, участвующих в экспрессии гена, являются гены-репрессоры, гены-активаторы, операторы, промоторы, аттенюаторы, сайты связывания рибосом, стартовый кодон и терминаторы. Соответствующую информацию специалист в данной области может почерпнуть среди прочего, например, у Jensen и Hammer (Biotechnology and Bioengineering 58, 1998, сс. 191-195), Carrier и Keasling (Biotechnology Progress 15, 1999, cc. 58-64), Franch и Gerdes (Current Opinion in Microbiology 3, 2000, cc. 159-164), Kawano и др., (Nucleic Acids Research 33(19), 2005, cc. 6268-6276) и в известных учебниках по генетике и молекулярной биологии, например, в учебнике Knippers («Molekulare Genetik», 6-е изд., изд-во Georg Thieme Verlag, Stuttgart, Germany, 1995) или Winnacker («Gene und Klone», изд-во VCH Verlagsgesellschaft, Weinheim, Germany, 1990).
Из существующего уровня техники известны мутации, приводящие к изменению или снижению каталитических свойств ферментных белков. В качестве примера можно упомянуть исследования, проведенные Qiu и Goodman (Journal of Biological Chemistry 272, 1997, cc. 8611-8617), Yano и др., (Proceedings of the National Academy of Sciences of the United States of America 95, 1998, cc. 5511-5515), Wente и Schachmann (Journal of Biological Chemistry 266, 1991, cc. 20833-20839). Обзоры можно найти в известных учебниках по генетике и молекулярной биологии, например, в учебнике Hagemann («Allgemeine Genetik», изд-во Gustav Fischer Verlag, Stuttgart, 1986).
В качестве мутаций можно рассматривать транзиции, трансверсии, инсерции и делеции по меньшей мере одной (1) пары оснований или нуклеотидов. В зависимости от влияния обусловленной мутацией аминокислотной замены на ферментативную активность различают миссенс-мутации и нонсенс-мутации. Миссенс-мутация приводит к замене рассматриваемой аминокислоты в белке на другую, прежде всего к неконсервативной аминокислотной замене. Это ухудшает функциональность или активность указанного белка, снижение которой составляет от 0 до 75%, от 0 до 50%, от 0 до 25%, от 0 до 10% или от 0 до 5%. Нонсенс-мутация приводит к появлению стоп-кодона в кодирующей области гена и, следовательно, к преждевременному прекращению трансляции. Инсерции или делеции по меньшей мере одной пары оснований в гене приводят к мутациям сдвига рамки считывания, в результате чего имеет место встраивание «неправильных» аминокислот или происходит преждевременное прекращение трансляции. Если в результате мутации в кодирующей области образуется стоп-кодон, то это также приводит к преждевременному прекращению трансляции. Делеции по меньшей мере одного (1) или нескольких ко донов, как правило, также приводят к полной потере ферментативной активности. В WO 03/074719 описано снижение экспрессии гена путем подавления мутации стоп-кодона в кодирующей области с помощью соответствующих супрессоров тРНК.
Из существующего уровня техники известны инструкции по созданию таких мутаций, и их можно найти в известных учебниках по генетике и молекулярной биологии, например, в учебнике Knippers («Molekulare Genetik», 6-е изд., изд-во Georg Thieme Verlag, Stuttgart, Germany, 1995), учебнике Winnacker («Gene und Klone», изд-во VCH Verlagsgesellschaft, Weinheim, Germany, 1990) или учебнике Hagemann («Allgemeine Genetik», изд-во Gustav Fischer Verlag, Stuttgart, 1986).
«Ослабление» и «низкий уровень экспрессии», прежде всего касательно гена proP, означает, что активность и/или концентрацию транспортера ProP снижают с помощью проиллюстрированных выше подходов до уровня, составляющего от 0 до 75%, от 0 до 50%, от 0 до 25%, от 0 до 10% или от 0 до 5% от активности и/или концентрации белка дикого типа или от активности и/или концентрации белка в микроорганизме или родительском штамме, не являющимся рекомбинантным касательно транспортера ProP.
Согласно изобретению L-аминокислоту предпочтительно сверхпродуцируют с использованием микроорганизма. В контексте изобретения «сверхпроизводство» означает, что имеет место значительное повышение способности продуцировать L-аминокислоту по сравнению с присущей микроорганизму способностью.
В контексте изобретения L-аминокислота предпочтительно представляет собой серосодержащую аминокислоту, прежде всего L-метионин, L-цистеин, L-цистин, L-гомоцистеин или L-гомоцистин, наиболее предпочтительно L-метионин.
Микроорганизмы, предлагаемые в изобретении, и применяемые в способах, предлагаемых в изобретении, предпочтительно отличаются тем, что обладают повышенной толерантностью к метионину по сравнению с микроорганизмами без ослабленного гена proP. Предпочтительно они способны расти даже при концентрации L-метионина, составляющей 50 или 60 г/л, наиболее предпочтительно даже при концентрации L-метионина, составляющей 70, 75, 80, 90 или 100 г/л, поскольку они являются устойчивыми к таким концентрациям метионина. Представленные в настоящем описании данные о толерантности к L-метионину предпочтительно основаны на данных, полученных с использованием минимального агара, содержащего L-метионин в указанных концентрациях.
Такие устойчивые к метионину штаммы можно выделять путем селекции на содержащем метионин минимальном агаре, применяя в качестве исходного штамм Е. coli, который уже обладает способностью продуцировать L-метионин.
Для создания устойчивых к метионину бактерий, предлагаемых в изобретении, предпочтительно применяют методы селекции, известные из существующего уровня техники, указанные методы описаны, среди прочего, в руководствах Miller, A Short Course in Bacterial Genetics, A Laboratory Manual and Handbook for Escherichia coli and Related Bacteria, изд-во Cold Spring Harbor Laboratory Press, 1992 или «Manual of Methods for General Bacteriology» Американского бактериологического общества, Washington D.C., USA.
Таким образом, следующим объектом настоящего изобретения является способ идентификации микроорганизмов семейства Enterobacteriaceae, которые обладают улучшенной способностью продуцировать содержащие серу L-аминокислоты, предпочтительно L-метионин, и которые несут ослабленный ген proP, отличающийся тем, что осуществляют стадии, на которых
а) осуществляют скрининг микроорганизмов семейства Enterobacteriaceae, обладающих способностью продуцировать серосодержащие L-аминокислоты, предпочтительно L-метионин, в отношении толерантности к метионину;
б) выделяют и размножают мутантов, полученных на стадии а);
в) необязательно получают нуклеиновые кислоты из мутантов, полученных на стадии б);
г) необязательно создают с помощью полимеразной цепной реакции молекулу нуклеиновой кислоты, используя в качестве исходной нуклеиновую кислоту, полученную на стадии в), и пару праймеров, состоящую из первого праймера, который содержит по меньшей мере 15 смежных нуклеотидов из числа нуклеотидов, находящихся в положениях с 1 по 1000 нуклеотидной последовательности SEQ ID NO: 38, и второго праймера, который содержит по меньшей мере 15 смежных нуклеотидов из числа нуклеотидов, находящихся в положениях с 2504 по 3503 нуклеотидной последовательности, комплементарной SEQ ID NO: 38;
д) необязательно определяют нуклеотидную последовательность молекулы нуклеиновой кислоты, полученной на стадии г), и определяют кодируемую аминокислотную последовательность;
е) необязательно сравнивают аминокислотную последовательность, определенную на стадии д), с SEQ ID NO: 2; и
ж) необязательно идентифицируют полученный мутант proP.
Для направленного осуществления мутаций в гене proP можно применять методы сайтнаправленного мутагенеза с использованием мутагенных олигонуклеотидов (Т.A. Brown: Gentechnologie fur Einsteiger [оригинальное название: Gene Cloning and DNA Analysis - An Introduction], изд-во Spektrum Akademischer Verlag, Heidelberg, Germany, 1993) или полимеразной цепной реакции (ПЦР), описанные в справочнике Gait, Oligonucleotide synthesis: А Practical Approach, изд-во IRL Press, Oxford, UK, 1984, или у Newton и Graham, PCR, изд-во Spektrum Akademischer Verlag, Heidelberg, 1994. Для создания мутаций можно использовать, например, набор для сайтнаправленного мутагенеза Quick Change Site-Directed Mutagenesis фирмы Stratagene (Амстердам, Нидерланды). При использовании указанных методов осуществляют амплификацию известного из существующего уровня техники гена proP с помощью полимеразной цепной реакции (ПЦР), применяя в качестве исходной выделенную полную ДНК штамма дикого типа, клонируют указанный ген в пригодных плазмидных векторах и затем подвергают ДНК процедуре мутагенеза. Применяя метод «GeneSOEing» (сращивание (генов) перекрывающимися расширениями) (Horton, Gene Splicing by Overlap Extension, Molecular Biotechnology 3, 1995, cc. 93-98), можно получать точечные мутации даже с помощью ПЦР. Для создания мутаций в гене proP можно применять также синтез de novo нуклеотидных последовательностей гена (например, на фирме GENEART AG, Регенсбург, Германия). Созданные мутации можно определять и проверять путем секвенирования ДНК, например, с помощью метода, описанного у Sanger и др., Proceedings of the National Academy of Science USA 74 (12), 1977, cc. 5463-5467.
Созданные аллели можно встраивать в хромосому соответствующих штаммов, например, с помощью трансформации и метода замены гена или аллеля.
Одним из распространенных методов является описанный у Hamilton и др., Journal of Bacteriology 171, 1989, сс. 4617-4622, метод замены гена с помощью pMAK705, являющейся производной условно-репликативной плазмиды pSC101, или с помощью pKO3 (Link и др., Journal of Bacteriology 179: 6228-6237). Можно применять также и другие методы, известные из существующего уровня техники, например, метод, описанный у Martinez-Morales и др., Journal of Bacteriology 1999, 1999, сс. 7143-7148, или метод, описанный у Boyd и др., Journal of Bacteriology 182, 2000, сс. 842-847.
Другой широко применяемый метод заключается в том, что с использованием коротких гомологичных фланкирующих последовательностей встраивают фрагмент ДНК, созданный с помощью ПЦР или синтеза гена, непосредственно в хромосому с помощью рекомбиназы Lambda Red, или осуществляют замену (Proc. Natl. Acad. Sci. USA 97(12), 6640-6645 (2000); Nature Genetics 20, 1998, cc. 123-128.
Созданные аллели можно переносить в различные штаммы также посредством конъюгации или трансдукции.
Нуклеотидные последовательности proP имеются в базах данных Национального центра биотехнологической информации (NCBI), Национальной медицинской библиотеки (Бетезда, шт. Мэриленд), базе данных нуклеотидных последовательностей Европейских лабораторий молекулярной биологии (EMBL, Гейдельберг, Германия и Кэмбридж, Великобритания) или в японской базе данных ДНК (DDBJ, Мишима, Япония).
Для целей иллюстрации известная последовательность гена proP Escherichia coli представлена в SEQ ID NO: 1, а известные последовательности генов proP Salmonella enterica и Shigella sonnei, которые также относятся к семейству Enterobacteriaceae, представлены в SEQ ID NO: 3 и SEQ ID NO: 5. Последовательности белков, кодируемых указанными рамками считывания, представлены в SEQ ID NO: 2, SEQ ID NO: 4 и SEQ ID NO: 6. Другими нуклеотидными последовательностями гена proP являются последовательности следующих представителей Enterobacteriaceae: Shigella boydii (регистрационный номер: NC_007613); Shigella flexneri (регистрационный номер: NC_004741); Shigella dysenteriae (регистрационный номер: NC_007606); Citrobacter rodentium (регистрационный номер: NC_013716); Erwinia pyrifoliae (регистрационный номер: NC_012214); Klebsiella pneumoniae (регистрационный номер: NC_011283).
Белок, кодируемый геном proP штамма Escherichia coli K12, называют также осмосенсорным транспортером ProP семейства MFS или симпортером протона/совместимого растворенного вещества (регистрационный номер: 11612 (область: 4328525-4330027); альтернативные названия гена: b4111, ECK4104); Grothe и др., Journal of Bacteriology 166, 1986, сс. 253-259; Racher и др., Biochemistry 38, 1999, сс. 1676-1684; Wood, Methods in Enzymology 428, (2007, cc. 77-107).
В предпочтительном варианте осуществления изобретения ген proP, который требуется ослаблять, представляет собой ген, последовательность которого идентична по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, наиболее предпочтительно по меньшей мере на 98, 99 или 100%, предпочтительно полной нуклеотидной последовательности SEQ ID NO: 1, 3, 5 или 7, более предпочтительно полной нуклеотидной последовательности SEQ ID NO: 1.
Выше приведены литературные ссылки, относящиеся к генам proP и открытым рамкам считывания указанных генов proP. Сведения, представленные в них, можно использовать соответствующим образом для ослабления гена proP. Кроме того, для получения ослабленного гена proP можно использовать также аллели генов или открытых рамок считывания, возникающие вследствие вырожденности генетического кода или в результате функционально нейтральных смысловых мутаций. Предпочтительным является применение эндогенных генов или эндогенных открытых рамок считывания.
Аллели гена proP, которые содержат функционально нейтральные смысловые мутации, включают среди прочего аллели, которые приводят не более чем к 40 или не более чем к 30, или не более чем к 20, предпочтительно не более чем к 10 или не более чем к 5, наиболее предпочтительно не более чем к 3 или не более чем к 2, или строго к одной консервативной аминокислотной замене в кодируемом ими белке.
В случае ароматических аминокислот консервативными заменами являются замены фенилаланина, триптофана и тирозина друг на друга. В случае гидрофобных аминокислот консервативными заменами являются замены лейцина, изолейцина и валина друг на друга. В случае полярных аминокислот консервативными заменами являются замены глутамина и аспарагина друг на друга. В случае основных аминокислот консервативными заменами являются замены аргинина, лизина и гистидина друг на друга. В случае кислотных аминокислот консервативными заменами являются замены аспарагиновой кислоты и глутаминовой кислоты друг на друга. В случае аминокислот, содержащих гидроксильные группы, консервативными заменами являются замены серина и треонина друг на друга.
Аналогично этому можно применять также нуклеотидные последовательности, кодирующие варианты указанных белков, которые дополнительно содержат удлинение или имеют укорочение по меньшей мере на одну (1) аминокислоту HaN- или С-конце. Указанное удлинение или укорочение включает не более чем 10, 5, 3 или 2 аминокислоты или аминокислотных остатка.
К пригодным вариантам относятся также варианты, кодирующие белки, в которые встроена (инсерция) или из которых удалена (делеция) по меньшей мере одна (1) аминокислота. Максимальное количество таких модификаций, которые называют инделами, может затрагивать 2, 3, 5, но в любом случае не более 10 аминокислот.
Пригодными вариантами являются также варианты, которые можно получать путем гибридизации, предпочтительно в строгих условиях, с использованием SEQ ID NO: 1, SEQ ID NO: 3 или SEQ ID NO: 5, или их фрагментов, прежде всего кодирующих областей и/или комплементарных им последовательностей.
Инструкции по идентификации последовательностей ДНК с помощью гибридизации специалист в данной области может почерпнуть среди прочего в справочнике «The DIG System User's Guide for Filter Hybridization» фирмы Boehringer Mannheim GmbH (Маннгейм, Германия, 1993) и у Liebl и др., International Journal of Systematic Bacteriology 41, 1991, cc. 255-260. Когда гибридизация происходит в строгих условиях, то образуются только те гибриды, в которых последовательности зонда и мишени, т.е. полинуклеотиды, обработанные указанным зондом, идентичны по меньшей мере на 70%. Известно, что на строгость гибридизации, включая стадии отмывки, можно влиять или определять ее путем изменения состава буфера, температуры и концентрации солей. Как правило, реакцию гибридизации осуществляют в условиях относительно низкой строгости по сравнению со стадиями отмывки (Hybaid Hybridisation Guide, фирма Hybaid Limited, Теддингтон, Великобритания, 1996).
Например, для реакции гибридизации можно применять 5×SSC-буфер при температуре, составляющей примерно 50-68°С. В этом случае зонды могут гибридизоваться также с полинуклеотидами, которые идентичны менее чем на 70% последовательности зонда. Такие гибриды являются менее стабильными и их удаляют путем отмывки в строгих условиях. Это можно осуществлять, например, путем снижения концентрации соли до 2×SSC и затем при необходимости до 0,5×SSC (The DIG System User's Guide for Filter Hybridisation, фирма Boehringer Mannheim, Маннгейм, Германия, 1995), устанавливая температуру на уровне примерно 50-68°С, примерно 52-68°С, примерно 54-68°С, примерно 56-68°С, примерно 58-68°С, примерно 60-68°°С, примерно 62-68°С, примерно 64-68°С, примерно 66-68°С. Предпочтительным диапазоном температур является примерно 64-68°С или примерно 66-68°С. При необходимости можно снижать концентрацию солей до концентрации, соответствующей 0,2×SSC или 0,1×SSC. Путем постепенного ступенчатого повышения температуры гибридизации примерно на 1-2°С с 50°С до 68°С можно выделять полинуклеотидные фрагменты, которые идентичны, например, по меньшей мере на 70% или по меньшей мере на 80%, или по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% последовательности применяемого зонда или нуклеотидным последовательностям, представленным в SEQ ID NO: 1, SEQ ID NO: 3 или SEQ ID NO: 5. Дополнительные инструкции касательно гибридизации можно получить при использовании поступающих в продажу «наборов» (например, DIG Easy Hyb фирмы Roche Diagnostics GmbH, Маннгейм, Германия, каталожный номер 1603558).
Ген proP, который требуется ослаблять, кодирует белок-транспортер ProP, предпочтительно имеющий аминокислотную последовательность, которая идентична по меньшей мере на 85%, прежде всего по меньшей мере на 90%, предпочтительно по меньшей мере на 95%, наиболее предпочтительно по меньшей мере на 98%, по меньшей мере на 99% или 100% аминокислотной последовательности SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6 или SEQ ID NO: 8, предпочтительно аминокислотной последовательности SEQ ID NO: 2, где указанная идентичность предпочтительно представляет собой идентичность по всей длине указанной(ых) последовательности(ей). Белок-транспортер ProP предпочтительно содержит или состоит практически из 500 аминокислот, предпочтительно его длина составляет 500 аминокислот. Наиболее предпочтительно белок ProP содержит или имеет аминокислотную последовательность SEQ ID NO: 2, указанная последовательность необязательно может иметь не более 40, не более 30, предпочтительно не более 20, не более 10, не более 5, не более 3, не более 2, наиболее предпочтительно не более одной консервативной аминокислотной замены. Консервативные аминокислотные замены практически не изменяют активность транспортера ProP, в контексте изобретения это означает, что в результате указанных консервативных замен указанная активность предпочтительно изменяется не более чем на 10% по сравнению с активностью исходной последовательности.
В контексте настоящего изобретения фраза «длина составляет практически 500 аминокислот» учитывает тот факт, что инсерция или делеция одной (1) или нескольких, но не более чем 10, 9, 8, 7, 6, 5, 4, 3 или 2, аминокислот из внутренней области полипептида или из N- или С-концевого участка указанного полипептида приводит к незначительному изменению длины кодируемого полипептида в различных видах или штаммах семейства Enterobacteriaceae. Одним из таких примеров является белок ProP Erwinia pyrifoliae. В этом случае длина полипептида (см. SEQ ID NO: 8) составляет 501 аминокислоту.
В предпочтительных вариантах осуществления изобретения ослабление гена proP, имеющего SEQ ID NO: 1, достигают путем создания гена, имеющего следующие мутации:
а) замену нуклеотидного основания гуанина в положении 971 или в соответствующем положении полинуклеотидной последовательности SEQ ID NO: 1 на нуклеотидное основание тимин;
б) замену нуклеотидного основания тимина в положении 1399 или в соответствующем положении полинуклеотидной последовательности SEQ ID NO: 1 на нуклеотидное основание цитозин;
в) замену нуклеотидного основания гуанина в положении 1234 или в соответствующем положении полинуклеотидной последовательности SEQ ID NO: 1 на нуклеотидное основание тимин;
г) делецию нуклеотидного основания аденина в положении 854 полинуклеотидной последовательности SEQ ID NO: 1;
д) делецию одного или нескольких нуклеотидных оснований в положениях с 1173 по 1223, предпочтительно делецию всех нуклеотидных оснований в положениях с 1173 по 1223 полинуклеотидной последовательности SEQ ID NO: 1;
е) инсерцию нуклеотидного основания цитозина в положение 842 полинуклеотидной последовательности SEQ ID NO: 1;
ж) инсерцию одного или нескольких нуклеотидного(ых) основания(й) в положение 973, предпочтительно инсерцию 19 нуклеотидных оснований в положение 973 полинуклеотидной последовательности SEQ ID NO: 1;
з) инсерцию одного или нескольких нуклеотидного(ых) основания(й) в положение 183, предпочтительно инсерцию 1359 нуклеотидных оснований в положение 183 полинуклеотидной последовательности SEQ ID NO: 1.
Таким образом, в предпочтительных вариантах осуществления изобретения ослабленный ген proP представляет собой полинуклеотид, последовательность которого идентична по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, прежде всего по меньшей мере на 95%, наиболее предпочтительно по меньшей мере на 98, 99 или 100%, последовательности полинуклеотида SEQ ID NO: 1, предпочтительно по всей длине последовательности полинуклеотида SEQ ID NO: 1, и который, кроме того, обязательно имеет одну или несколько, предпочтительно строго одну, из следующих мутаций относительно полинуклеотида SEQ ID NO: 1;:
а) замену триплета, кодирующего L-аргинин в положении 324 SEQ ID NO: 2 или соответствующем положении аминокислотной последовательности, на триплет, кодирующий аминокислоту, выбранную из группы, включающей L-лейцин, L-изолейцин и L-валин, предпочтительно L-лейцин;
б) замену триплета, кодирующего L-тирозин в положении 467 SEQ ID NO: 2 или соответствующем положении аминокислотной последовательности, на триплет, кодирующий аминокислоту, выбранную из группы, включающей L-лизин, L-аргинин и L-гистидин, предпочтительно L-гистидин;
в) замену триплета, кодирующего L-глутаминовую кислоту в положении 412 SEQ ID NO: 2 или в соответствующем положении аминокислотной последовательности, на триплет, кодирующий стоп-кодон;
г) делецию нуклеотидного основания аденина в положении 854 гена proP, имеющего SEQ ID NO: 1;
д) делецию одного или нескольких нуклеотидных оснований в положениях с 1173 по 1223, предпочтительно делецию всех нуклеотидных оснований в положениях с 1173 по 1223 гена proP, имеющего SEQ ID NO: 1;
е) инсерцию нуклеотидного основания цитозина в положение 842 гена proP, имеющего SEQ ID NO: 1;
ж) инсерцию одного или нескольких нуклеотидного(ых) основания(й) в положение 973, предпочтительно инсерцию 19 нуклеотидных оснований в положение 973 гена proP, имеющего SEQ ID NO: 1;
з) инсерцию одного или нескольких нуклеотидного(ых) основания(й) в положение 183, предпочтительно инсерцию 1359 нуклеотидных оснований в положение 183 гена proP, имеющего SEQ ID NO: 1.
Индивидуальные характеристики, которые указаны со ссылкой на полинуклеотид, имеющий SEQ ID NO: 1, относятся в настоящем описании в каждом случае к полинуклеотидной последовательности, не имеющей одной или нескольких из указанных выше обязательных мутаций.
«Соответствующие положения» можно легко идентифицировать путем сравнения аминокислотных последовательностей, осуществляя их выравнивание, например, с помощью программы Clustal W (Thompson и др., Nucleic Acids Research 22, 1994, сс. 4637-4680) или с помощью программы MAFFT (Katoh и др., Genome Information; 16(1), 2005, сс. 22-33).
Микроорганизм семейства Enterobacteriaceae, предлагаемый в изобретении и применяемый в способах, предлагаемых в изобретении, предпочтительно представляет собой бактерию рода Escherichia, Erwinia, Providencia или Serratia, прежде всего рода Escherichia. Наиболее предпочтительно он представляет собой Escherichia coli.
В предлагаемых в изобретении способах получения L-аминокислоты, прежде всего серосодержащей L-аминокислоты, ферментацию предпочтительно осуществляют в среде, содержащей неорганический источник серы. В качестве источника серы можно использовать соль дитиосерной кислоты (тиосульфат), при необходимости в сочетании с другими источниками серы, такими, например, как сульфат, сильфит или дитионит (см. также заявку ЕР 11151526.8).
L-аминокислоту предпочтительно накапливают в полученном ферментационном бульоне и затем при необходимости выделяют, собирают и/или очищают.
L-аминокислоту можно также выделять или собирать вместе с другими компонентами из ферментационного бульона и/или биомассы.
Продуктивность выделенных бактерий или процесса ферментации с их использованием касательно одного или нескольких параметров, выбранных из группы, включающей концентрацию продукта (продукт на единицу объема), выход продукта (продукт, образовавшийся на единицу поглощенного источника углерода) и образование продукта (продукт, образовавшийся на единицу объема и в единицу времени), или также другие параметры процесса и их комбинации, повышают по меньшей мере на 0,5%, по меньшей мере на 1%, по меньшей мере на 1,5% или по меньшей мере на 2% относительно исходного штамма или родительского штамма или процесса ферментации с их использованием.
Согласно способу, предлагаемому в изобретении, бактерии можно культивировать непрерывно, что описано, например в РСТ/ЕР 2004/008882, или с перерывами с помощью периодического процесса (культивирование партий) или периодического процесса с подпиткой (процесс с подпиткой), или периодического процесса с повторной подпиткой (процесс с повторной подпиткой), для получения L-аминокислот. Обзор общих принципов, на которых основаны известные методы культивирования, представлен в учебнике Chmiel, Bioprozesstecknik [Bioprocess Technology], 1.  in die Bioverfahrenstechnik [Introduction to Bioprocess Engineering], изд-во Gustav Fischer Verlag, Stuttgart, 1991, или в учебнике Storhas, Bioreaktoren und periphere Einrichtungen [Bioreactors and Peripheral Equipment], изд-во Vieweg Verlag, Braunschweig/Wiesbaden, Germany, 1994.
in die Bioverfahrenstechnik [Introduction to Bioprocess Engineering], изд-во Gustav Fischer Verlag, Stuttgart, 1991, или в учебнике Storhas, Bioreaktoren und periphere Einrichtungen [Bioreactors and Peripheral Equipment], изд-во Vieweg Verlag, Braunschweig/Wiesbaden, Germany, 1994.
Предназначенная для применения культуральная среда или ферментационная среда должна соответствующим образом удовлетворять требованиям, зависящим от конкретных штаммов. В руководстве «Manual of Methods for General Bacteriology» Американского общества бактериологов (Washington D.C., USA, 1981) приведено описание культуральных сред для различных микроорганизмов. Понятия «культуральная среда» и «ферментационная среда» или среда используются взаимозаменяемо.
В качестве источника углерода можно использовать сахара и углеводы, такие, например, как глюкоза, сахароза, лактоза, фруктоза, мальтоза, меласса, содержащие сахарозу растворы, полученные в результате обработки сахарной свеклы или сахарного тростника, крахмал, гидролизат крахмала и целлюлозу, масла и жиры, такие, например, как соевое масло, подсолнечное масло, арахисовое масло и кокосовый жир, жирные кислоты, такие, например, как пальмитиновая кислота, стеариновая кислота и линолевая кислота, спирты, такие, например, как глицерин, метанол и этанол, и органические кислоты, такие, например, как уксусная кислота. Эти субстанции можно применять индивидуально или в виде смеси.
В качестве источника азота можно использовать содержащие азот органические соединения, такие как пептоны, дрожжевой экстракт, мясной экстракт, солодовый экстракт, кукурузный экстракт, соевая мука и мочевина, или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Источники азота можно применять индивидуально или в виде смеси.
В качестве источника фосфора можно использовать фосфорную кислоту, первичный кислый фосфат калия или вторичный кислый фосфат калия или соответствующие содержащие натрий соли.
Кроме того, культуральная среда предпочтительно содержит соли, например, в форме хлоридов металлов, таких, например, как натрий, калий, магний, кальций и железо, сульфатов, таких, например, как сульфат магния или сульфат железа, которые необходимы для роста. И, наконец, помимо указанных выше субстанций можно применять незаменимые факторы роста, такие как аминокислоты, например, гомосерин, и витамины, например, кобаламин, тиамин, биотин или пантотеновую кислоту.
Кроме того, в культуральную среду можно добавлять также приемлемые предшественники конкретной аминокислоты.
Указанные исходные продукты можно добавлять в культуру в виде одной партии или осуществлять соответствующим образом подпитку в процессе культивирования.
Значение pH культуры можно контролировать соответствующим образом путем применения основных соединений, таких как гидроксид натрия, гидроксид калия, аммиак или водный раствор аммиака, или кислот, таких как фосфорная кислота или серная кислота. Как правило, pH доводят до значения, составляющего от 6,0 до 9,0, предпочтительно от 6,5 до 8. Для контроля пенообразования можно применять противовспенивающие средства, такие, например, как эфиры жирной кислоты и полигликоля. Для поддержания стабильности плазмид можно добавлять в среду пригодные обладающие избирательным действием субстанции, такие, например, как антибиотики. Для поддержания аэробных условий в культуру вводят кислород или кислородсодержащие газовые смеси, такие, например, как воздух. Можно применять также жидкости, обогащенные пероксидом водорода. Ферментацию при необходимости осуществляют при избыточном давлении, например, при избыточном давлении, составляющем от 0,03 до 0,2 МПа. Температура культуры обычно составляет от 20 до 45°С и предпочтительно от 25 до 40°С. В случае периодических процессов культивирование продолжают вплоть до образования максимального количества требуемой аминокислоты. Как правило, для достижения этой цели требуется от 10 до 160 ч. В случае непрерывных процессов может потребоваться осуществлять культивирование в течение более длительных промежутков времени.
Примеры пригодных ферментационных сред описаны, среди прочего, в US 6221636, US 5840551, US 5770409, US 5605818, US 5275940 и US 4224409.
Методы определения L-аминокислот известны из существующего уровня техники. Анализ можно осуществлять, например, согласно методу, описанному у Spackman и др., Analytical Chemistry, 30, 1958, с. 1190), с помощью ионообменной хроматографии с последующей дериватизацией с использованием нингидрина, или его можно осуществлять с помощью ЖХВР с обращенной фазой согласно методу, описанному у Lindroth и др., Analytical Chemistry, 1979, 51, сс. 1167-1174).
Полученный таким образом ферментационный бульон затем дополнительно перерабатывают с получением твердого или жидкого продукта.
Под ферментационным бульоном подразумевают ферментационную среду, в которой осуществляли культивирование микроорганизма в течение определенного периода времени и при определенной температуре. Ферментационная среда или среда, применяемая при ферментации, содержит все субстанции или компоненты, обеспечивающие размножение и жизнеспособность микроорганизма, и образование требуемой аминокислоты.
После завершения ферментации полученный ферментационный бульон содержит соответственно:
а) биомассу микроорганизма, образовавшуюся в процессе размножения клеток микроорганизма,
б) требуемую аминокислоту, образовавшуюся в процессе ферментации,
в) органические побочные продукты, образовавшиеся в процессе ферментации, и
г) компоненты применявшейся ферментационной среды или исходных продуктов, такие, например, как витамины, например, биотин, аминокислоты, такие как гомосерин, или соли, такие как сульфат магния, которые не были поглощены в процессе ферментации.
К органическим побочным продуктам относятся субстанции, которые могут производиться и могут секретироваться микроорганизмами, применяемыми для ферментации, помимо конкретной требуемой L-аминокислоты. Они включают L-аминокислоты, содержание которых составляет менее 30%, 20% или 10% по сравнению с содержанием требуемой аминокислоты. К ним относятся также органические кислоты, которые несут одну-три карбоксильных группы, такие, например, как уксусная кислота, молочная кислота, лимонная кислота, яблочная кислота или фумаровая кислота. И, наконец, к ним относятся также сахара, такие, например, как трегалоза.
Как правило, в ферментационных бульонах, которые можно применять для промышленных процессов и которые являются предпочтительными согласно изобретению, содержание аминокислоты составляет от 40 до 180 или от 50 до 150 г/кг. Содержание биомассы (в виде высушенной биомассы), как правило, составляет от 20 до 50 г/кг.
Таким образом, объектом настоящего изобретения являются также полинуклеотиды, идентичные по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, прежде всего по меньшей мере на 98, 99 или 100% последовательности SEQ ID NO: 1, где указанная идентичность предпочтительно относится к полной последовательности SEQ ID NO: 1, отличающиеся тем, что полинуклеотид обязательно содержит одну или несколько мутаций по сравнению с полинуклеотидом, имеющим SEQ ID NO: 1, которые выбраны из группы, включающей:
а) замену триплета, кодирующего L-аргинин в положении 324 SEQ ID NO: 2 или соответствующем положении аминокислотной последовательности на триплет, кодирующий аминокислоту, выбранную из группы, включающей L-лейцин, L-изолейцин и L-валин, предпочтительно L-лейцин;
б) замену триплета, кодирующего L-тирозин в положении 467 SEQ ID NO: 2 или соответствующем положении аминокислотной последовательности, на триплет, кодирующий аминокислоту, выбранную из группы, включающей L-лизин, L-аргинин и L-гистидин, предпочтительно L-гистидин;
в) замену триплета, кодирующего L-глутаминовую кислоту в положении 412 SEQ ID NO: 2 или в соответствующем положении аминокислотной последовательности, на триплет, кодирующий стоп-кодон;
г) делецию нуклеотидного основания аденина в положении 854 гена proP, имеющего SEQ ID NO: 1;
д) делецию одного или нескольких нуклеотидных оснований в положениях с 1173 по 1223, предпочтительно делецию всех нуклеотидных оснований в положениях с 1173 по 1223 гена proP, имеющего SEQ ID NO: 1;
е) инсерцию нуклеотидного основания цитозина в положение 842 гена proP, имеющего SEQ ID NO: 1;
ж) инсерцию одного или нескольких нуклеотидного(ых) основания(й) в положение 973, предпочтительно инсерцию 19 нуклеотидных оснований в положение 973 гена proP, имеющего SEQ ID NO: 1;
з) инсерцию одного или нескольких нуклеотидного(ых) основания(й) в положение 183, предпочтительно инсерцию 1359 нуклеотидных оснований в положение 183 гена proP, имеющего SEQ ID NO: 1.
Индивидуальные характеристики, которые указаны со ссылкой на полинуклеотид, имеющий SEQ ID NO: 1, относятся в настоящем описании в каждом случае к полинуклеотидной последовательности, не имеющей одной или нескольких из указанных выше обязательных мутаций.
В контексте настоящего описания наиболее предпочтительными являются одна или несколько обязательная(ых) мутация(й), выбранная(ые) из группы, включающей:
а) замену нуклеотидного основания гуанина в положении 971 или в соответствующем положении полинуклеотидной последовательности SEQ ID NO: 1 на нуклеотидное основание тимин;
б) замену нуклеотидного основания тимина в положении 1399 или в соответствующем положении полинуклеотидной последовательности SEQ ID NO: 1 на нуклеотидное основание цитозин;
в) замену нуклеотидного основания гуанина в положении 1234 или в соответствующем положении полинуклеотидной последовательности SEQ ID NO: 1 на нуклеотидное основание тимин;
г) делецию нуклеотидного основания аденина в положении 854 полинуклеотидной последовательности SEQ ID NO: 1;
д) делецию одного или нескольких нуклеотидного(ых) основания(й) в положениях с 1173 по 1223, предпочтительно делецию всех нуклеотидных оснований в положениях с 1173 по 1223 полинуклеотидной последовательности SEQ ID NO: 1;
е) инсерцию нуклеотидного основания цитозина в положение 842 полинуклеотидной последовательности SEQ ID NO: 1;
ж) инсерцию одного или нескольких нуклеотидного(ых) основания(й) в положение 973, предпочтительно инсерцию 19 нуклеотидных оснований в положение 973 полинуклеотидной последовательности SEQ ID NO: 1;
з) инсерцию одного или нескольких нуклеотидного(ых) основания(й) в положение 183, предпочтительно инсерцию 1359 нуклеотидных оснований в положение 183 полинуклеотидной последовательности SEQ ID NO: 1.
Согласно изобретению указанные выше полинуклеотиды, предлагаемые в изобретении, предпочтительно отличаются тем, что они гибридизуются с одним или несколькими полинуклеотидами, комплементарными SEQ ID NO: 1, 3 или 5, предпочтительно комплементарными SEQ ID NO: 1, предпочтительно в строгих условиях гибридизации, где указанные строгие условия предпочтительно обеспечиваются тем, что стадию отмывки осуществляют при температуре в пределах от 64 до 68°С и использовании буфера с концентрацией солей в пределах от 2×SSC до 0,1×SSC.
Последовательности наиболее предпочтительных полинуклеотидов, предлагаемых в изобретении, идентичны по меньшей мере на 90%, предпочтительно по меньшей мере на 95%, прежде всего по меньшей мере на 98, 99 или 100%, последовательностям полинуклеотидов SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21 или SEQ ID NO: 23.
Наиболее предпочтительные полинуклеотиды, предлагаемые в изобретении, представляют собой и/или содержат полинуклеотиды SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21 и SEQ ID NO: 23.
Настоящее изобретение относится также к векторам, содержащим полинуклеотиды, предлагаемые в изобретении.
Таким образом, настоящее изобретение относится также к полипептидам, идентичным по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, прежде всего по меньшей мере на 95%, наиболее предпочтительно по меньшей мере на 98, 99 или 100%, последовательности SEQ ID NO: 2, отличающимся тем, что полипептид обязательно имеет одну или несколько мутаций относительно полипептида SEQ ID NO: 2, выбранных из группы, включающей:
а) замену L-аргинина в положении 324 SEQ ID NO: 2 или соответствующем положении аминокислотной последовательности на аминокислоту, выбранную из группы, включающей L-лейцин, L-изолейцин и L-валин, предпочтительно L-лейцин;
б) замену L-тирозина в положении 467 SEQ ID NO: 2 или соответствующем положении аминокислотной последовательности на аминокислоту, выбранную из группы, включающей L-лизин, L-аргинин и L-гистидин, предпочтительно L-гистидин;
в) делецию 17 аминокислот в положениях с 392 по 408 SEQ ID NO: 2 или в сопоставимых положениях аминокислотной последовательности;
г) делецию вплоть до 420 аминокислот на С-конце последовательности SEQ ID NO: 2, предпочтительно делеция 88, 163, 202, 212 или 420 аминокислот на С-конце аминокислотной последовательности SEQ ID NO: 2.
В данном случае индивидуальные характеристики относятся в случае мутантов, указанных в пунктах а) и б), к полной последовательности SEQ ID NO: 2, в случае мутантов, указанных в пунктах в) и г), в каждом случае к подобластям последовательности SEQ ID NO: 2 без указанных исключенных путем делеции областей.
Предпочтительными полипептидами, предлагаемыми в изобретении, являются полипептиды, последовательности которых идентичны по меньшей мере на 90%, предпочтительно по меньшей мере на 95%, прежде всего по меньшей мере на 98, 99 или 100%, полипептидам SEQ ID NO: 10, 12, 14, 16, 18, 20, 22 или 24.
Наиболее предпочтительные полипептиды, предлагаемые в изобретении, представляют собой и/или содержат полипептиды SEQ ID NO: 10, 12, 14, 16, 18, 20, 22 или 24.
Настоящее изобретение относится также к рекомбинантным микроорганизмам, содержащим полинуклеотиды и/или векторы, и/или полипептиды, предлагаемые в изобретении.
Микроорганизмы, предлагаемые в изобретении, и микроорганизмы, применяемые в способах, предлагаемых в изобретении, предпочтительно характеризуются повышенной ферментативной активностью аспартаткиназы (КФ 2.7.2.4), при этом предпочтительными являются обладающие устойчивостью к регуляции по типу обратной связи аллели. В Е. coli присутствуют три различные аспартаткиназы, которые кодируются генами thrA, metL или lysC. Согласно изобретению наиболее предпочтительным является наличие повышенной активности аспартаткиназы ThrA.
Кроме того, микроорганизмы, предлагаемые в изобретении, и микроорганизмы, применяемые в способах, предлагаемых в изобретении, предпочтительно отличаются тем, что обладают повышенной активностью гомосерин-О-сукцинилтрансферазы MetA (КФ 2.3.1.46) и/или серинацетилтрансферазы CysE (КФ 2.3.1.30).
Кроме того, можно усиливать биосинтез L-метионина путем ослабления или делеции регуляторного белка MetJ, кодируемого геном metJ. MetJ является основным репрессором биосинтеза L-метионина в Е. coli. Следовательно, предпочтительным согласно изобретению является также ослабление гена metJ.
Кроме того, микроорганизмы, предлагаемые в изобретении, и микроорганизмы, применяемые в способах, предлагаемых в изобретении, предпочтительно отличаются тем, что обладают пониженной активностью S-аденозилметионинсинтазы MetK (КФ 2.5.1.6).
Кроме того, для получения серосодержащих аминокислот с использованием бактерий семейства Enterobacteriaceae может оказаться предпочтительным дополнительно усиливать один или несколько фермент(ов) известных путей биосинтеза аминокислот или фермент(ов) анаплеротического метаболизма или ферментов для получения восстановленного никотинамидадениндинуклеотидфосфата, или ферментов гликолиза, или PTS-ферментов (фосфотрансфераз), или ферментов метаболизма серы, или повышать их активность.
Кроме того, в предпочтительных вариантах осуществления изобретения продуцирующие L-метионин бактерии обладают одним или несколькими отличительными признаками, выбранными группы, включающей:
а) сверхэкспрессию полинуклеотида, кодирующего один или несколько компонентов системы транспорта тиосульфата/сульфата CysPUWA (КФ 3.6.3.25),
б) сверхэкспрессию полинуклеотида, кодирующего 3'-фосфоаденозин-5'-фосфосульфатредуктазу CysH (КФ 1.8.4.8),
в) они сверхэкспрессируют полинуклеотид, кодирующий один или несколько компонентов сульфитредуктазы CysJI (ЕС 1.8.1.2),
г) сверхэкспрессию полинуклеотида, кодирующего цистеинсинтазу A CysK (КФ 2.5.1.47),
д) сверхэкспрессию полинуклеотида, кодирующего цистеинсинтазу В CysM (КФ 2.5.1.47),
е) сверхэкспрессию полинуклеотида, кодирующего серинацетилтрансферазу CysE (КФ 2.3.1.30),
ж) сверхэкспрессию полинуклеотида, кодирующего один или несколько компонентов системы расщепления глицина GcvTHP-Lpd (КФ 2.1.2.10, КФ 1.4.4.2, КФ 1.8.1.4),
з) сверхэкспрессию полинуклеотида, кодирующего липоилсинтазу LipA (КФ 2.8.1.8),
и) сверхэкспрессию полинуклеотида, кодирующего липоилпротеинлигазу LipB (КФ 2.3.1.181),
к) сверхэкспрессию полинуклеотида, кодирующего фосфоглицератдегидрогеназу SerA (КФ 1.1.1.95),
л) сверхэкспрессию полинуклеотида, кодирующего 3-фосфосеринфосфатазу SerB (КФ 3.1.3.3),
м) сверхэкспрессию полинуклеотида, кодирующего 3-фосфосерин/фосфогидрокситреонинаминотрансферазу SerC (КФ 2.6.1.52),
н) сверхэкспрессию полинуклеотида, кодирующего серингидроксиметилтрансферазу GlyA (КФ 2.1.2.1),
о) сверхэкспрессию полинуклеотида, кодирующего аспартокиназу I ThrA и гомосериндегидрогеназу I (КФ 2.7.2.4, КФ 1.1.1.3),
п) сверхэкспрессию полинуклеотида, кодирующего аспартаткиназу LysC (КФ 2.7.2.4),
р) сверхэкспрессию полинуклеотида, кодирующего гомосериндегидрогеназу Hom (КФ 1.1.1.3),
с) сверхэкспрессию полинуклеотида, кодирующего гомосерин-О-ацетилтрансферазу MetX (КФ 2.3.1.31),
т) сверхэкспрессию полинуклеотида, кодирующего гомосерин-О-сукцинилтрансферазу MetA (КФ 2.3.1.46),
у) сверхэкспрессию полинуклеотида, кодирующего цистатионин-гамма-синтазу MetB (КФ 2.5.1.48),
ф) сверхэкспрессию полинуклеотида, кодирующего β-C-S-лиазу AecD (КФ 4.4.1.8, которую обозначают также как бета-лиаза),
х) сверхэкспрессию полинуклеотида, кодирующего цистатионин-бета-лиазу MetC (ЕС 4.4.1.8),
ц) сверхэкспрессию полинуклеотида, кодирующего В12-независимую гомоцистеин-S-метилтрансферазу MetE (КФ 2.1.1.14),
ч) сверхэкспрессию полинуклеотида, кодирующего В12-зависимую гомоцистеин-S-метилтрансферазу MetH (КФ 2.1.1.13),
ш) сверхэкспрессию полинуклеотида, кодирующего метилентетрагидрофолатредуктазу MetF (КФ 1.5.1.20),
щ) сверхэкспрессию полинуклеотида, кодирующего один или несколько компонентов экспортера L-метионина BrnFE Corynebacterium glutamicum,
э) сверхэкспрессию полинуклеотида, кодирующего один или несколько компонентов экспортера валина YgaZH Escherichia coli (b2682, b2683),
аа) сверхэкспрессию полинуклеотида, кодирующего предполагаемый транспортер YjeH Escherichia coli (b4141),
бб) сверхэкспрессию полинуклеотида, кодирующего один или несколько компонентов пиридиннуклеотидтрансгидрогеназы PntAB (КФ 1.6.1.2),
вв) сверхэкспрессию полинуклеотида, кодирующего О-сукцинилгомосеринсульфгидрилазы MetZ (КФ 2.5.1.48),
гг) сверхэкспрессию полинуклеотида, кодирующего фосфоенолпируваткарбоксилазу Pyc (КФ 4.1.1.31),
дд) сверхэкспрессию полинуклеотида, кодирующего тиосульфат-сульфотрансферазу RDL2 (КФ 2.8.1.1),
ее) сверхэкспрессию полинуклеотида, кодирующего тиосульфат-тиол-сульфотрансферазу (КФ 2.8.1.3),
жж) сверхэкспрессию полинуклеотида, кодирующего тиосульфат-дитиол-сульфотрансферазу (КФ 2.8.1.5).
В контексте настоящего изобретения предпочтительными отличительными признаками являются один или несколько признаков, выбранных из группы, включающей:
а) сверхэкспрессию полинуклеотида, кодирующего один или несколько компонентов системы транспорта тиосульфата/сульфата CysPUWA (КФ 3.6.3.25),
б) сверхэкспрессию полинуклеотида, кодирующего 3'-фосфоаденозин-5'-фосфосульфатредуктазу CysH (КФ 1.8.4.8),
в) сверхэкспрессию полинуклеотида, кодирующего один или несколько компонентов сульфитредуктазы CysJI (КФ 1.8.1.2),
г) сверхэкспрессию полинуклеотида, кодирующего цистеинсинтазу A CysK (КФ 2.5.1.47),
д) сверхэкспрессию полинуклеотида, кодирующего цистеинсинтазу В CysM (КФ 2.5.1.47),
е) сверхэкспрессию полинуклеотида, кодирующего серинацетилтрансферазу CysE (КФ 2.3.1.30),
ж) сверхэкспрессию полинуклеотида, кодирующего один или несколько компонентов системы расщепления глицина GcvTHP-Lpd (КФ 2.1.2.10, КФ 1.4.4.2, КФ 1.8.1.4),
з) сверхэкспрессию полинуклеотида, кодирующего липоилсинтазу LipA (КФ 2.8.1.8),
и) сверхэкспрессию полинуклеотида, кодирующего липоилпротеинлигазу LipB (КФ 2.3.1.181),
к) сверхэкспрессию полинуклеотида, кодирующего фосфоглицератдегидрогеназу SerA (КФ 1.1.1.95),
л) сверхэкспрессию полинуклеотида, кодирующего 3-фосфосеринфосфатазу SerB (КФ 3.1.3.3),
м) сверхэкспрессию полинуклеотида, кодирующего 3-фосфосерин/фосфогидрокситреонинаминотрансферазу SerC (КФ 2.6.1.52),
н) сверхэкспрессию полинуклеотида, кодирующего серингидроксиметилтрансферазу GlyA (КФ 2.1.2.1),
о) сверхэкспрессию полинуклеотида, кодирующего аспартокиназу I ThrA и гомосериндегидрогеназу I (КФ 2.7.2.4, КФ 1.1.1.3),
п) сверхэкспрессию полинуклеотида, кодирующего аспартаткиназу LysC (КФ 2.7.2.4),
р) сверхэкспрессию полинуклеотида, кодирующего гомосериндегидрогеназу Hom (КФ 1.1.1.3),
с) сверхэкспрессию полинуклеотида, кодирующего гомосеринацетилтрансферазу MetX (КФ 2.3.1.31),
т) сверхэкспрессию полинуклеотида, кодирующего гомосерин-О-транссукцинилазу MetA (КФ 2.3.1.46),
у) сверхэкспрессию полинуклеотида, кодирующего цистатионин-гамма-синтазу MetB (КФ 2.5.1.48),
ф) сверхэкспрессию полинуклеотида, кодирующего β-C-S-лиазу AecD (КФ 4.4.1.8, которую обозначают также как бета-лиаза,
х) сверхэкспрессию полинуклеотида, кодирующего цистатионин-бета-лиазу MetC (КФ 4.4.1.8),
ц) сверхэкспрессию полинуклеотида, кодирующего В12-независимую гомоцистеин-S-метилтрансферазу MetE (КФ 2.1.1.14),
ч) сверхэкспрессию полинуклеотида, кодирующего В12-зависимую гомоцистеин-S-метилтрансферазу MetH (КФ 2.1.1.13),
ш) сверхэкспрессию полинуклеотида, кодирующего метилентетрагидрофолатредуктазу MetF (КФ 1.5.1.20),
щ) сверхэкспрессию полинуклеотида, кодирующего тиосульфат-сульфотрансферазу RDL2 (КФ 2.8.1.1).
Наиболее предпочтительные отличительные признаки выбирают из группы, включающей:
а) сверхэкспрессию полинуклеотида, кодирующего аспартокиназу I ThrA и гомосериндегидрогеназу I (КФ 2.7.2.4, КФ 1.1.1.3),
б) сверхэкспрессию полинуклеотида, кодирующего серинацетилтрансферазу CysE (КФ 2.3.1.30),
в) сверхэкспрессию полинуклеотида, кодирующего аспартаткиназу LysC (КФ 2.7.2.4),
г) сверхэкспрессию полинуклеотида, кодирующего гомосериндегидрогеназу Hom (КФ 1.1.1.3),
д) сверхэкспрессию полинуклеотида, кодирующего гомосеринацетилтрансферазу MetX (КФ 2.3.1.31),
е) сверхэкспрессию полинуклеотида, кодирующего гомосерин-О-транссукцинилазу MetA (КФ 2.3.1.46),
ж) сверхэкспрессию полинуклеотида, кодирующего цистатионин-гамма-синтазу MetB (КФ 2.5.1.48),
з) сверхэкспрессию полинуклеотида, кодирующего β-C-S-лиазу AecD (КФ 4.4.1.8, которую обозначают также как бета-лиаза),
и) сверхэкспрессию полинуклеотида, кодирующего цистатионин-бета-лиазу MetC (КФ 4.4.1.8),
к) сверхэкспрессию полинуклеотида, кодирующего В12-независимую гомоцистеин-S-метилтрансферазу MetE (КФ 2.1.1.14),
л) сверхэкспрессию полинуклеотида, кодирующего В12-зависимую гомоцистеин-S-метилтрансферазу MetH (КФ 2.1.1.13),
м) сверхэкспрессию полинуклеотида, кодирующего метилентетрагидрофолатредуктазу MetF (КФ 1.5.1.20),
н) сверхэкспрессию полинуклеотида, кодирующего тиосульфат-сульфотрансферазу RDL2 (КФ 2.8.1.1).
В контексте изобретения понятие «сверхэкспрессия», «усиление» или «повышенная активность» относится к повышению внутриклеточной ферментативной активности одного или нескольких ферментов в микроорганизме, которые кодируются соответствующей ДНК.
В принципе, повышения ферментативной активности можно достигать, например, путем увеличения количества копий генной последовательности или генных последовательностей, которая(ые) кодирует(ют) фермент, путем использования сильного промотора или использования гена или аллеля, который кодирует соответствующий фермент, обладающий повышенной активностью, и при необходимости путем объединения этих путей. Клетки, генетически модифицированные согласно изобретению, получают, например, путем трансформации, трансдукции, конъюгации или объединения этих методов, с использованием вектора, который содержит требуемый ген, аллель этого гена или его часть, и вектора, который обеспечивает возможность экспрессии указанного гена. Для достижения гетерологичной экспрессии, в частности, интегрируют ген или аллели в хромосому клетки или в реплицирующийся вне хромосомы вектор.
Обзор возможностей повышения ферментативной активности в клетках, например в случае пируваткарбоксилазы, представлен в DE-A-10031999, указанный документ включен в настоящее описание в качестве ссылки и его содержание в части, касающейся возможностей повышения ферментативной активности в клетках, включено в качестве составной части в описание настоящего изобретения.
Повышения ферментативной активности можно достигать, например, путем увеличения количества копий соответствующих полинуклеотидов внутри хромосомы или вне хромосомы по меньшей мере на одну копию.
Широко применяемый метод увеличения количества копий заключается в том, что встраивают соответствующий полинуклеотид в вектор, предпочтительно плазмиду, которая реплицируется в бактерии.
Приемлемыми плазмидными векторами, которые можно применять для Enterobacteriaceae, являются, например, клонирующие векторы, выведенные из pACYC184 ( и др., Gene 102, 1991, сс. 75-78), pTrc99A (Amann и др., Gene 69, 1988, сс. 301-315), или производные pSC101 (Vocke и Bastia; Proceedings of the National Academy of Sciences USA 80(21), 1983, cc. 6557-6561). Предпочтительными являются также плазмиды, выведенные из pCL1920 (Lerner C.G. и Inouye М., Nucl. Acids Res., 18, 1990, с. 4631 [PMID: 2201955]). Для увеличения количества копий соответствующих полинуклеотидов в Е. coli. можно применять также плазмидные векторы, выведенные из бактериальных искусственных хромосом (ВАС), такие, например, как pCC1BAC (фирма EPICENTRE Biotechnologies, Мэдисон, США).
и др., Gene 102, 1991, сс. 75-78), pTrc99A (Amann и др., Gene 69, 1988, сс. 301-315), или производные pSC101 (Vocke и Bastia; Proceedings of the National Academy of Sciences USA 80(21), 1983, cc. 6557-6561). Предпочтительными являются также плазмиды, выведенные из pCL1920 (Lerner C.G. и Inouye М., Nucl. Acids Res., 18, 1990, с. 4631 [PMID: 2201955]). Для увеличения количества копий соответствующих полинуклеотидов в Е. coli. можно применять также плазмидные векторы, выведенные из бактериальных искусственных хромосом (ВАС), такие, например, как pCC1BAC (фирма EPICENTRE Biotechnologies, Мэдисон, США).
Кроме того, в качестве векторов можно применять также транспозоны, инсерционные элементы (IS-элементы) или фаги. Указанные генетические системы представлены, например, в описаниях патентов US 4822738, US 5804414 и US 5804414. Аналогично этому можно применять IS-элемент ISaBl, описанный в WO 92/02627, или транспозон Tn 45 плазмиды pXZ10142 (в качестве ссылки см. «Handbook of Corynebacterium glutamicum», под ред. L. Eggeling и M. Bott).
Другим широко применяемым методом достижения сверхэкспрессии является метод амплификации хромосомальных генов. Согласно этому методу по меньшей мере одну дополнительную копию представляющего интерес полинуклеотида встраивают в хромосому бактерии. Указанные методы амплификации описаны, например, в WO 03/014330 или WO 03/040373.
Еще один метод достижения сверхэкспрессии предусматривает функциональное соединение (осуществление функциональной связи) соответствующего гена или аллеля с промотором или кассетой экспрессии. Например, пригодными для Е. coli промоторами являются Т3, Т7, SP6, М13, lac, tac и trc, которые описаны у Amann и др., Gene 69(2), 1988, сс. 301-315 и у Amann и Brosius, Gene 40(2-3), 1985, сс. 183-190. Указанный промотор можно встраивать, например, против хода транскрипции относительно рассматриваемого гена, как правило, на расстоянии примерно 1-500 нуклеотидных оснований от стартового кодона. В US 5939307 описано, что для повышения экспрессии можно применять включение кассет экспрессии или промоторов, таких, например, как промотор tac, промотор trp, промотор lpp или промоторы PL и PR фага λ, например, против хода транскрипции относительно хромосомального оперона треонина. Аналогично этому можно применять промоторы фага Т7, промотор gear-box или промотор nar, или промоторы генов rrsG, rnpB, csrA, csrB, ompA, fusA, pepQ, rp1X или rpsG. Указанные кассеты экспрессии или промоторы можно применять также для сверхэкспрессии связанных с плазмидами генов согласно методу, описанному в ЕР 0593792. С использованием аллеля lacIQ, в свою очередь, можно контролировать экспрессию связанных с плазмидами генов (Glascock и Weickert, Gene 223, 1998, сс. 221-231). Для повышения активности промоторов можно применять также модификацию их последовательности посредством одного или нескольких изменений нуклеотидов с помощью инсерции(ий) и/или делеции(ий).
Если повышение ферментативной активности осуществляют посредством мутации эндогенного гена, то такие мутации можно создавать либо с помощью общепринятых методов, основанных на ненаправленном подходе, например, с использованием УФ-облучения или индуцирующих мутацию химических веществ, либо с использованием направленного подхода с помощью методов генной инженерии, например, путем осуществления делеции(й), инсерции(й) и/или замены/замен нуклеотидов. С помощью таких мутаций создают генетически модифицированные клетки. Наиболее предпочтительными мутантными ферментами являются, в частности, ферменты, которые не могут более подвергаться ингибированию по типу обратной связи или могут подвергаться ингибированию по типу обратной связи по крайней мере в меньшей степени, чем фермент дикого типа.
Если повышение ферментативной активности осуществляют путем повышения уровня экспрессии фермента, то для этого увеличивают количество копий, например, соответствующих генов, или изменяют посредством мутации промоторные и регуляторные области или сайт связывания рибосом против хода транскрипции относительно структурного гена. Кассеты экспрессии, которые встраивают против хода транскрипции относительно структурного гена, действуют аналогичным образом. С помощью индуцибельных промоторов можно дополнительно повышать уровень экспрессии в любой требуемый момент времени. Кроме того, можно создавать также так называемые «энхансеры» для гена в качестве регуляторных последовательностей, которые также могут обусловливать повышение уровня экспрессии гена путем улучшения взаимодействия между РНК-полимеразой и ДНК. Аналогично этому уровень экспрессии можно повышать путем пролонгирования жизни мРНК. Кроме того, ферментативную активность можно повышать также, предупреждая расщепление белка фермента. В этом контексте гены или генные конструкции либо присутствуют в плазмидах с другим количеством копий, либо их интегрируют в хромосому и амплифицируют. Альтернативно этому, для достижения сверхэкспрессии рассматриваемых генов можно модифицировать также состав сред и процедуру культивирования. Инструкции по осуществлению модификации специалист в данной области может среди прочего почерпнуть у Martin и др., Bio/Technology 5, 1987, сс. 137-146, Guerrero и др., Gene 138, 1994, сс. 35-41, Tsuchiya и Morinaga, Bio/Technology 6, 1988, сс. 428-430, Eikmanns и др., Gene 102, 1991, сс. 93-98, в ЕР-А-0472869, в US 4601893, у Schwarzer и Puhler, Bio/Technology 9, 1991, сс. 84-87, Reinscheid и др., Applied and Environmental Microbiology 60, 1994, cc. 126-132, LaBarre и др., Journal of Bacteriology 175, 1993, cc. 1001-1007, в WO-A-96/15246, у Malumbres и др., Gene 134, 1993, cc. 15-24, в JP-A-10-229891, у Jensen и Hammer, Biotechnology and Bioengineering 58, 1998, cc. 191-195 и в известных руководствах по генетике и молекулярной биологии. Описанные выше подходы, также как и мутации, приводят к получению генетически модифицированных клеток.
Можно применять также те плазмидные векторы, с помощью которых можно осуществлять метод генной амплификации путем интеграции в хромосому. После гомологичной рекомбинации в результате случая кроссовера образовавшийся штамм содержит по меньшей мере две копии требуемого гена. Соответствующий метод для Е. coli описан, например, у Link, A.J., Phillips, D. и Church G.M., J. Bacteriology 179, 1997, cc. 6228-6237.
Для инсерции или делеции ДНК в хромосоме можно применять также методы, основанные на использовании рекомбиназы, такие, как методы, описанные, например у Datsenko К.А., Wanner B.L., Proc Natl Acad Sci USA., 97(12), 2000, cc. 6640-6645.
Применяемую выше и далее в описании фразу «активность фермента, повышенная по сравнению с активностью штамма дикого типа или исходного штамма» предпочтительно всегда следует понимать как активность конкретного фермента, которая увеличена по меньшей мере в 2 раза, в частности, предпочтительно по меньшей мере в 10 раз, более предпочтительно по меньшей мере в 100 раз, еще более предпочтительно по меньшей мере в 1000 раз и наиболее предпочтительно по меньшей мере в 10000. К клетке, предлагаемой в изобретении, которая обладает «активностью фермента, повышенной по сравнению с активностью штамма дикого типа или исходного штамма» относится также такая клетка, штамм которой дикого типа или исходный штамм не обладает вообще или по меньшей мере не обладает выявляемой активностью указанного фермента, и которая обладает выявляемой активностью указанного фермента только после повышения ферментативной активности, например, посредством сверхэкспрессии. В этом контексте понятие «сверхэкспрессия» или фраза «повышение экспрессии», которые используются далее, включают также случай, при котором в исходной клетке, например, клетке дикого типа, экспрессия фермента вообще не обнаружена или по меньшей мере не поддается обнаружению, и выявляемая экспрессия фермента индуцируется только с помощью методов рекомбинации.
Методы определения ферментативной активности различных штаммов можно почерпнуть из литературы.
Экспрессию вышеуказанных ферментов или генов можно выявлять с помощью 1-й 2-мерного фракционирования белков в геле и последующего определения оптическими методами концентрации белка в геле с использованием соответствующей предназначенной для оценки программы. Если повышение ферментативной активности базируется только на повышении уровня экспрессии соответствующего гена, то повышение ферментативной активности можно оценивать количественно просто путем сравнения результатов 1- или 2-мерного фракционирования белков, присутствующих в клетке дикого типа и генномодифицированной клетке. Общепринятый метод получения содержащих белки гелей в случае бактерий и идентификации белков представляет собой метод, описанный у Hermann и др., Electrophoresis, 22, 2001, сс. 1712-1723. Концентрацию белка можно определять также путем анализа методом вестерн-блоттинга, осуществляя гибридизацию с антителом, специфическим в отношении подлежащего определению белка (Sambrook и др., Molecular Cloning: a laboratory manual, 2-ое изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY USA, 1989), и последующего определения концентрации оптическими методами с использованием соответствующей программы, предназначенной для оценки концентрации (Lohaus и Meyer, Biospektrum, 5, 1989, сс. 32-39; Lottspeich, Angewandte Chemie 111, 1999, cc. 2630-2647). Активность ДНК-связывающих белков можно измерять путем анализа сдвига полос ДНК (который называют также методом гель-ретардации; Wilson и др., Journal of Bacteriology, 183, 2001, сс. 2151-2155). Воздействие ДНК-связывающих белков на экспрессию других генов можно определять с помощью различных подробно описанных методов анализа с использованием репортерного гена (Sambrook и др., Molecular Cloning: а laboratory manual, 2-е изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY USA, 1989). Внутриклеточную ферментативную активность можно определять различными известными из литературы методами (Donahue и др., Journal of Bacteriology 182 (19), 2000, сс. 5624-5627; Ray и др., Journal of Bacteriology 182 (8), 2000, cc. 2277-2284; Freedberg и др., Journal of Bacteriology 115 (3), 1973, cc. 816-823). Если ниже не указаны конкретные методы определения активности конкретного фермента, то определение повышения ферментативной активности, а также определение снижения ферментативной активности предпочтительно осуществляют с помощью методов, описанных у Hermann и др., Electophoresis, 22, 2001, сс. 1712-1723 (2001), Lohaus и др., Biospektrum 5, 1998, сс. 32-39, Lottspeich, Angewandte Chemie 111, 1999, cc. 2630-2647 и Wilson и др., Journal of Bacteriology 183, 2001, cc. 2151-2155).
Кроме того, для производства L-аминокислот, прежде всего L-метионина, может оказаться предпочтительным исключить нежелательные вторичные реакции (Nakayama, «Breeding of Amino Acid Producing Microorganisms», в: Overproduction of Microbial Products, Krumphanzl, Sikyta, под ред. Vanek, изд-во Academic Press, London, UK, 1982).
Так, для повышения производства L-метионина в Е. coli, может оказаться целесообразным ослаблять, при необходимости «выключать» или снижать экспрессию одного или нескольких генов, выбранных из группы, включающей:
а) ген metJ, кодирующий транскрипционный регулятор биосинтеза L-метионина (MetJ) (b3938, ECK3930),
б) ген pgi, кодирующий глюкозо-6-фосфатизомеразу (Pgi, КФ №5.3.1.9) (b4025, ECK4017),
в) ген thrB, кодирующий гомосеринкиназу (ThrB, КФ №2.7.1.39) (b0003, ECK0003),
г) ген metK, кодирующий S-аденозилметионинсинтазу (MetK, КФ №2.5.1.6) (b2942, ECK2937),
д) ген dapA, кодирующий дигидродипиколинатсинтазу (DapA, КФ №4.2.1.52) (b2478, ECK2474),
е) ген pck, кодирующий фосфоенолпируваткарбоксикиназу (Pck, КФ №4.1.1.49) (b3403, ECK3390),
ж) ген purU, кодирующий формилтетрагидрофолатгидролазу (PurU, КФ №3.5.1.10) (b1232, ECK1227),
з) ген pykA, кодирующий пируваткиназу II (PykA, КФ №2.7.1.40) (b1854, ECK1855)
и) ген pykF, кодирующий пируваткиназу I (PykF, КФ №2.7.1.40) (b1676, ECK1672),
к) ген metQ, кодирующий субъединицу транспортера L-метионина (MetQNI) (b0197, ECK0197),
л) ген metI, кодирующий субъединицу транспортера L-метионина (MetQNI) (b0198, ECK0198),
м) ген metN, кодирующий субъединицу транспортера L-метионина (MetQNI) (b0199, ECK0199),
н) ген dcd, кодирующий дезоксицитидин-5'-трифосфатдеаминазу (Dcd, ЕС №3.5.4.13) (b2065, ECK2059),
о) ген yncA, кодирующий предполагаемую N-ацилтрансферазу (YncA, WO 2010/020681 на имя фирмы Metabolic Explorer) (b1448, ECK1442),
п) ген fhrS, кодирующий регуляторную малую РНК (sPHК) FnrS (b4699, ECK4511),
р) ген rpoS, кодирующий фактор сигма RpoS (b2741, ECK2736). Более предпочтительные отличительные признаки выбирают из группы, включающей:
а) ген metJ, кодирующий транскрипционный регулятор биосинтеза L-метионина (MetJ) (b3938, ECK3930),
б) ген metK, кодирующий S-аденозилметионинсинтазу (MetK, КФ №2.5.1.6) (b2942, ECK2937),
в) ген pck, кодирующий фосфоенолпируваткарбоксикиназу (Pck, КФ №4.1.1.49) (b3403, ECK3390),
г) ген purU, кодирующий формилтетрагидрофолатгидролазу (PurU, КФ №3.5.1.10) (b1232, ECK1227),
д) ген pykA, кодирующий пируваткиназу II (PykA, КФ №2.7.1.40) (b1854, ECK1855),
е) ген pykF, кодирующий пируваткиназу I (PykF, КФ 2.7.1.40) (b1676, ECK1672),
ж) ген metQ, кодирующий субъединицу транспортера L-метионина (MetQNI) (b0197, ECK0197),
з) ген metl, кодирующий субъединицу транспортера L-метионина (MetQNI) (b0198, ECK0198),
и) ген metN, кодирующий субъединицу транспортера L-метионина (MetQNI) (b0199, ECK0199),
к) ген yncA, кодирующий предполагаемую N-ацилтрансферазу (YncA, WO 2010/020681 на имя фирмы Metabolic Explorer) (b1448, ECK1442),
л) ген rpoS, кодирующий фактор сигма RpoS (b2741, ECK2736).
Наиболее предпочтительные отличительные признаки выбирают из группы, включающей:
а) ген metJ, кодирующий транскрипционный регулятор биосинтеза L-метионина (MetJ) (b3938, ECK3930),
б) ген metK, кодирующий S-аденозилметионинсинтазу (MetK, КФ №2.5.1.6) (b2942, ECK2937),
в) ген metK, кодирующий S-аденозилметионинсинтазу (MetK, КФ №2.5.1.6) (b2942, ECK2937),
г) ген metQ, кодирующий субъединицу транспортера L-метионина (MetQNI) (b0197, ECK0197),
д) ген metI, кодирующий субъединицу транспортера L-метионина (MetQNI) (b0198, ECK0198),
е) ген metN, кодирующий субъединицу транспортера L-метионина (MetQNI) (b0199, ECK0199),
ж) ген yncA, кодирующий предполагаемую N-ацилтрансферазу (YncA, WO 2010/020681 на имя фирмы Metabolic Explorer) (b1448, ECK1442),
з) ген rpoS, кодирующий фактор сигма RpoS (b2741, ECK2736).
При необходимости меры по ослаблению осуществляют дополнительно или в соответствующей комбинации с указанными мерами по усилению генов с целью повышения производства метионина.
Согласно изобретению микроорганизмы, которые продуцировали L-аминокислоты до осуществления мер, предлагаемых в изобретении, не включают штаммы дикого типа и широко распространенные лабораторные штаммы, такие, как, среди прочего, DH5α, DH5αmcr, W3110, MG1655, МС4100, Y1089, Н560, BL21 и ММ152.
Однако продуцирующие L-аминокислоты микроорганизмы могут быть выведены из указанных штаммов дикого типа и широко распространенных лабораторных штаммов.
Так, исходный штамм микроорганизма предпочтительно выводят из группы штаммов, которая состоит из Escherichia coli MG1655, Escherichia coli W3110, Escherichia coli DH5α, Escherichia coli DH10B, Escherichia coli BW2952, Escherichia coli REL606.
Примером предпочтительного согласно изобретению секретирующего или продуцирующего L-метионин штамма служит продуктивный штамм (штамм-продуцент) Е. coli MG1655 ΔmetJ metA*11 Ptrc-metH Ptrc-metF PtrcF-cysPUWAM PtrcF-cysJIH ΔpykF ΔpykA Ptrc09-gcvTHP ΔpurU Ptrc36-ARNmst17-metF, несущий продуктивные плазмиды pME101-thrA*1-cysE-Pgap-metA*11 и pCC1BAC-serB-glyA-serA-serC (WO 2009/043803).
Другим примером секретирующего или продуцирующего L-метионин штамма, предпочтительного согласно изобретению, служит штамм-продуцент Е. coli MG1655 ΔmetJ Ptrc-metH Ptrc-metF PtrcF-cysPUWAM PtrcF-cysJIH Ptrc09-gcvTHP, несущий продуктивную плазмиду pME101-thrA*1-cysE-Pgap-metA*11.
Штамм-продуцент E. coli MG1655 ΔmetJ Ptrc-metH Ptrc-metF PtrcF-cysPUWAM PtrcF-cysJIH Ptrc09-gcvTHP можно клонировать, осуществляя серии Р1-трансдукций и элиминаций согласно методу, описанному в заявке на патент WO 2009/043803. Основой штамма является штамм Е. coli K12 MG1655 дикого типа. В геном этого штамма интродуцировали следующие модификации:
- удаляли путем делеции ген репрессора биосинтеза L-метионина metJ;
- встраивали сильный промотор trc против хода транскрипции относительно гена metH (кодирует кобаламинзависимую метионинсинтазу);
- встраивали сильный промотор trc против хода транскрипции относительно гена metF (кодирует 5,10-метилентетрагидрофолатредуктазу);
- встраивали сильный промотор trcF против хода транскрипции относительно оперона cysPUWAM. cysPUWA кодирует транспортер поглощения сульфата/тиосульфата. cysM кодирует цистеинсинтазу В;
- встраивали сильный промотор trcF против хода транскрипции относительно оперона cysJIH. cysJI кодирует сульфитредуктазу, a cysH кодирует 3'-фосфоаденилил-сульфатредуктазу;
- встраивали сильный промотор trc09 против хода транскрипции относительно оперона gcvTHP. gcvT, gcvH и gcvP кодируют три компонента системы расщепления глицина.
Клонирование в Е. coli продуктивной плазмиды pME101-thrA*1-cysE-Pgap-metA*11 описано в заявках на патент WO 2007/077041 и WO 2009/043803. Основой этой плазмиды с малым количеством копий (малокопийная плазмида) являлся вектор pCL1920 (Lerner C.G. и Inouye М., Nucl. Acids Res. 18, 1990, с. 4631 [PMID: 2201955]). Незагруженная (пустая) плазмида рМЕ101 несет ген lacIq, который кодирует высокоэкспрессируемый аллель репрессора lac. Ген thra*1 клонировали по ходу транскрипции относительно сильного промотора trc, который может подавляться репрессором Lac. Он кодирует устойчивый к регуляции по типу обратной связи вариант аспартаткиназы/гомосериндегидрогеназы ThrA из Е. coli. В той же ориентации за ним по ходу транскрипции расположен ген cysE вместе с его встречающимся в естественных условиях промотором. Он кодирует серинацетилтрансферазу из Е. coli. По ходу транскрипции относительно cysE расположен сильный промотор gap А из Е. coli, который контролирует экспрессию гена metA*11. Ген metA*11 кодирует устойчивый к регуляции по типу обратной связи вариант гомосерин-О-сукцинилтрансферазы из Е. coli.
В качестве примеров других предпочтительных согласно изобретению микроорганизмов, которые секретируют или продуцируют L-метионин, можно упомянуть следующие штаммы:
- Е. coli TF4076BJF metA#10 + metYX(Lm) (WO 2008/127240; с 46);
- E. coli W3110ΔJ/pKP451 (EP 1445310 B1, c. 7, пример 4);
- E. coli WΔthrBCΔmetJmetK32 pMWPthrmetA4Δ5Δ9 (Yoshihiro Usuda и Osamu Kurahashi, Applied and Environmental Microbiology, т. 71, №6, 2005, cc. 3228-3234);
- W3110/pHC34 (WO 01/27307 c. 13, пример 3);
- E. coli ECM2 (EP 2205754 A2, EP 2326724 A1 и EP 12156052.8).
Дополнительные примеры различных пригодных микроорганизмов описаны у Gomes и др., Enzyme and Microbial Technology 37, 2005, cc. 3-18.
Нуклеотидные последовательности генов или открытых рамок считывания (ОРС) Escherichia coli известны из существующего уровня техники, и их можно найти в геномной последовательности Escherichia coli, опубликованной у Blattner и др., (Science 277, 1997, сс. 1453-1462). Известны ферменты, эндогенные для хозяина (метионинаминопептидаза), обладающие способностью элиминировать N-концевую аминокислоту метионин.
Более подробное объяснение понятий генетики и молекулярной биологии можно найти в известных учебниках по генетике и молекулярной биологии, таких, например, как учебник Birge (Bacterial and Bacteriophage Genetics, 4-e изд., изд-во Springer Verlag, New York (USA), 2000) или учебник Berg, Tymoczko и Stryer (Biochemistry, 5-е изд., изд-во Freeman and Company, New York (USA), 2002), или в справочнике Sambrook и др., (Molecular Cloning, A Laboratory Manual, (3-томное издание), изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor (USA), 2001).
В контексте настоящего описания понятие «ген» относится к сегменту дезоксирибонуклеиновой кислоты (ДНК), который содержит информацию, необходимую для производства (транскрипции) прежде всего рибонуклеиновой кислоты (РНК), которая содержит информацию, необходимую для производства (трансляции) белка (полипептида), в данном случае полипептида с активностью синтетазы II (p)ppGpp. Тот факт, что ген или полинуклеотид содержит информацию, необходимую для производства белка, называют также кодированием белка или полипептида геном или РНК. Под эндогенными генами и полинуклеотидами подразумеваются открытые рамки считывания (ОРС), гены или аллели и полинуклеотиды соответственно, присутствующие в популяции вида. Понятие «ген» и «ОРС» (открытая рамка считывания) в настоящем изобретении используют в качестве синонимов.
Понятие «полинуклеотид» в целом относится к полирибонуклеотидам и полидезоксирибонуклеотидам, которые могут представлять собой немодифицированную РНК или ДНК или модифицированную РНК или ДНК.
Понятие «полипептид» относится к пептидам или белкам, которые содержат две или большее количество аминокислот, сцепленных помощью пептидных связей. Понятие полипептид и белок используют в качестве синонимов. Белки принадлежат к основным единицам всех клеток. Они не только обеспечивают структуру клетки, но представляют собой молекулярные «устройства», которые транспортируют субстанции, катализируют химические реакции и распознают сигнальные субстанции.
Под «протеиногенными аминокислотами» подразумеваются аминокислоты, которые встречаются в природных белках, т.е. в белках микроорганизмов, растений, животных и человека. Более предпочтительно они включают L-аминокислоты, выбранные из группы, включающей L-аспарагиновую кислоту, L-аспарагин, L-треонин, L-серин, L-глутаминовую кислоту, L-глутамин, глицин, L-аланин, L-цистеин, L-валин, L-метионин, L-изолейцин, L-лейцин, L-тирозин, L-фенилаланин, L-гистидин, L-лизин, L-триптофан, L-пролин и L-аргинин, а также селеноцистеин. В этом контексте протеиногенные аминокислоты всегда представляют собой α-аминокислоты. За исключением аминокислоты глицина, у всех протеиногенных аминокислот α-углеродный атом является асимметричным (т.е. молекулы являются хиральными): существует два энантиомера каждой из этих аминокислот. В этом контексте только один из двух энантиомеров является протеиногенным, и он фактически представляет собой L-аминокислоту: аппарат, необходимый для синтеза белков - рибосома, тРНК, аминоацил-тРНК-синтетаза (которая загружает тРНК аминокислотами) и другие компоненты сами также обладают хиральностью и могут распознавать только L-варианты.
Понятие «генная экспрессия» (для краткости «экспрессия») в целом относится к проявлению генетической информации в виде фенотипа. В узком смысле генная экспрессия обозначает транскрипцию гена с образованием РНК и последующую трансляцию РНК с образованием полипептида, который может обладать ферментативной активностью.
Под «исходным штаммом» (родительским штаммом) подразумевается штамм микроорганизма, на который оказывают воздействия, обеспечивающие увеличение продуктивности одной/одного или нескольких аминокислот, пептидов или белков, или оказывают воздействия, обеспечивающие повышение активности одного или нескольких ферментов (например, воздействия, приводящие к сверхэкспрессии). Исходный штамм может представлять собой штамм дикого типа, но также штамм, который уже был предварительно модифицирован (например, микроорганизм, продуцирующий L-аминокислоты (штамм-продуцент)).
«Дикий тип» клетки предпочтительно относится к клетке, геном которой находится в том состоянии, в котором он сформировался в природе в процессе эволюции. Понятие применяют как к целой клетке, так и к индивидуальным генам. Таким образом, те конкретные клетки или те гены, генные последовательности которых были по меньшей мере частично модифицированы человеком с использованием методов рекомбинации, не подпадают под понятие «дикий тип».
Настоящее изобретение описано более подробно ниже на примерах вариантов осуществления изобретения.
Минимальная среда (М9) и полная среда (LB), используемые для Escherichia coli, описаны у J.H. Miller (A Short Course in Bacterial Genetics, изд-во Cold Spring Harbor Laboratory Press, 1992). Если не указано иное, то выделение плазмидной ДНК из Escherichia coli и все процедуры, касающиеся рестрикции, лигирования, обработки по Кленову и обработки щелочной фосфатазой, осуществляли согласно методу, описанному у Sambrook и др., (Molecular Cloning - A Laboratory Manual, изд-во Cold Spring Harbor Laboratory Press, 1989). Если не указано иное, то трансформацию Escherichia coli осуществляли согласно методу, описанному у Chung и др., (Proceedings of the National Academy of Sciences of the United States of America 86, 1989, cc. 2172-2175).
Если не указано иное, то температура инкубации для продуцирующих штаммов и трансформантов составляла 37°С.
Пример 1
Скрининг толерантных к L-метионину мутантов
Основой продуцирующего L-метионин штамма Е. coli ЕСМ2 является штамм дикого типа MG1655 K12. Как описано в ЕР 2205754 А2, ЕР 2326724 А1 и ЕР 12156052.8, штамм ЕСМ2 несет устойчивый к регуляции по типу обратной связи аллель metA, имеет делецию генов metJ, yncA, pykA и pykF, вариант гена spoT, а также находящиеся против хода транскрипции усиленные промоторы каждого из генов metH, metF, gcvT, cysP и cysJ.
1.1 Клонирование гена serC в плазмиде pUC18
Ген serC из штамма Escherichia coli MG1655 амплифицировали с помощью полимеразной цепной реакции (ПЦР) и затем клонировали в плазмиде pUC18 (фирма Fermentas GmbH, Санкт-Леон-Рот, Германия).
ПЦР-праймеры serCF(XbaI) и serCR(HindIII) имели на своих 5'-концах в каждом случае по 6 случайных нуклеотидов, за которыми располагались последовательности, распознаваемые рестриктазами XbaI (TCTAGA) и HindIII (AAGCTT) соответственно. Нуклеотиды с 13 по 38 serCF(XbaI) располагались в геноме штамма Е. coli MG1655 с положения 956619 до положения 956644. Нуклеотиды с 13 по 37 serCR(HindIII) располагались в геноме штамма Е. coli MG1655 с положения 958028 до положения 958004.
serCF(XbaI) (SEQ ID NO: 25)
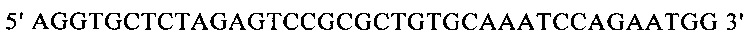
serCR(HindIII) (SEQ ID NO: 26)
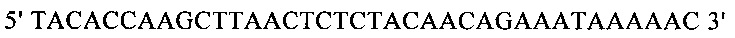
Ген serC амплифицировали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров serCF(XbaI) и serCR(HindIII) и ДНК-полимеразы Phusion (фирма Finnzymes Оу, Эспоо, Финляндия). Геномная ДНК штамма Е. coli MG1655 служила в качестве матрицы. Полученный в результате этого ДНК-фрагмент имел размер 1434 пары оснований. Его расщепляли рестриктазами XbaI и HindIII и очищали с помощью набора для очистки ПЦР-продуктов QIAquick (фирма Qiagen, Гильден, Германия). Неметилированную ДНК плазмиды pUC18 расщепляли с помощью рестриктаз XbaI и HindIII и очищали с помощью набора для очистки ПЦР-продуктов QIAquick (фирма Qiagen, Гильден, Германия). Затем расщепленную плазмиду лигировали с ПЦР-продуктом и трансформировали штамм Е. coli DH5α. Плазмидные клоны, содержащие ген serC, идентифицировали путем расщепления рестриктазами и ДНК-секвенирования. Полученную таким образом плазмиду обозначали как pUC18-serC.
1.2 Клонирование гена serA в плазмиде pUC18-serC
Ген serA из штамма Escherichia coli MG1655 амплифицировали с помощью полимеразной цепной реакции (ПЦР) и затем клонировали в плазмиде pUC18-serC.
ПЦР-праймер serAF(XbaI) содержал на своем 5'-конце 6 случайных нуклеотидов, за которыми располагалась последовательность, распознаваемая рестриктазой XbaI (TCTAGA). Нуклеотиды с 12 по 33 располагались в геноме штамма Е. coli MG1655 с положения 3055199 до положения 3055220. ПЦР-праймер serAR(SHSSNB) содержал на своем 5'-конце 6 случайных нуклеотидов, за которыми располагались последовательности, распознаваемые рестриктазами SacI, HindIII, SphI, SmaI, NotI и BglII. Нуклеотиды с 49 по 58 располагались в геноме штамма Е. coli MG1655 с положения 3056880 до положения 3056861.
serAF(XbaI) (SEQ ID NO: 27)
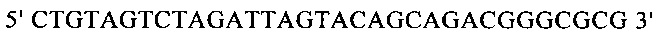
serAR(SHSSNB) (SEQ ID NO: 28)
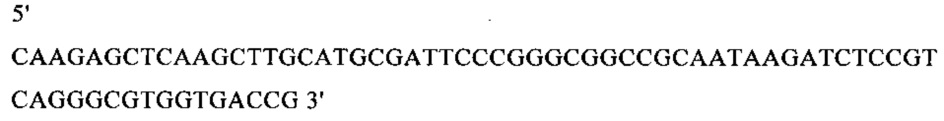
Ген serA амплифицировали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров serAF(XbaI) и serAR(SHSSNB) и ДНК-полимеразы Phusion (фирма Finnzymes Оу, Эспоо, Финляндия). Геномная ДНК штамма Е. coli MG1655 служила в качестве матрицы. Полученный в результате этого фрагмент ДНК имел размер 1731 пару оснований.
Его расщепляли рестриктазами XbaI и SacI и очищали с помощью набора для очистки ПЦР-продуктов QIAquick (фирма Qiagen, Гильден, Германия). Плазмиду pUC18-serC также расщепляли с помощью рестриктаз XbaI и SacI и очищали с помощью набора для очистки ПЦР-продуктов QIAquick (фирма Qiagen, Гильден, Германия). Затем расщепленную плазмиду лигировали с ПЦР-продуктом и трансформировали штамм Е. coli DH5α. Плазмидные клоны, содержащие ген serA, идентифицировали путем расщепления рестриктазами и ДНК-секвенирования. Полученную таким образом плазмиду обозначали как pUC18-serAC.
1.3 Клонирование гена serB в плазмиде pUC18-serAC
Ген serB из клона Escherichia coli MG1655 амплифицировали с помощью полимеразной цепной реакции (ПЦР) и затем клонировали в плазмиде pUC18-serAC.
ПЦР-праймер serB(SphI) имел на своем 5'-конце 6 случайных нуклеотидов, за которыми располагалась последовательность, распознаваемая рестриктазой SphI (GCATGC). Нуклеотиды с 13 по 34 располагались в геноме штамма Е. coli MG1655 с положения 4622816 до положения 4622837.
ПЦР-праймер serB(SmaI) имел на своем 5'-конце 6 случайных нуклеотидов, за которыми располагались последовательности, распознаваемые рестриктазами SalI (GTCGAC) и SmaI (CCCGGG). Нуклеотиды с 54 по 75 располагались в геноме штамма Е. coli MG1655 с положения 4623887 до положения 4623866.
serB(SphI) (SEQ ID NO: 29)
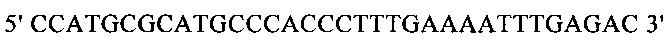
serB(SmaI) (SEQ ID NO: 30)
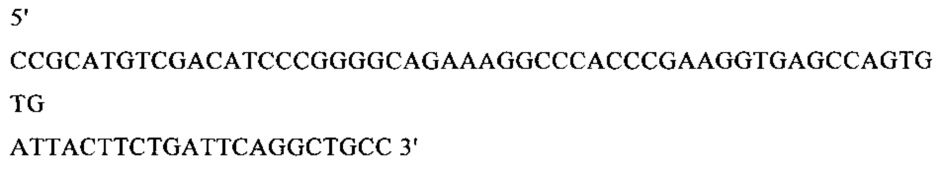
Ген serB амплифицировали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров serB(SphI) и serB(SmaI) и ДНК-полимеразы Phusion (фирма Finnzymes Оу, Эспоо, Финляндия). Геномная ДНК штамма Е. coli MG1655 служила в качестве матрицы. Полученный в результате этого ДНК-фрагмент имел размер 1137 пар оснований.
Его расщепляли рестриктазами SphI и SmaI и очищали с помощью набора для очистки ПЦР-продуктов QIAquick (фирма Qiagen, Гильден, Германия). Плазмиду pUC18-serAC также расщепляли с помощью рестриктаз SphI и SmaI, дефосфорилировали с помощью щелочной фосфатазы и очищали с использованием набора для очистки ПЦР-продуктов QIAquick (фирма Qiagen, Гильден, Германия). Затем расщепленную плазмиду лигировали с ПЦР-продуктом и трансформировали штамм Е. coli DH5α. Плазмидные клоны, содержащие ген serC, идентифицировали путем расщепления рестриктазами и ДНК-секвенирования. Полученную таким образом плазмиду обозначали как pUC18-serBAC.
1.4 Клонирование гена glyA в плазмиде pUC18-serBAC
Ген glyA из штамма Escherichia coli MG1655 амплифицировали с помощью полимеразной цепной реакции (ПЦР) и затем клонировали в плазмиду pUC18-serBAC.
ПЦР-праймер glyA-прямой имел на своем 5'-конце 6 случайных нуклеотидов, за которыми располагалась последовательность, распознаваемая рестриктазой BglII (AGATCT). Нуклеотиды с 54 по 75 располагались в геноме штамма Е. coli MG1655 с положения 2682063 до положения 2682085.
ПЦР-праймер glyA-обратный имел на своем 5'-конце 6 случайных нуклеотидов, за которыми располагалась последовательность, распознаваемая рестриктазой NotI (GCGGCCGC). Нуклеотиды с 54 по 75 располагались в геноме штамма Е. coli MG1655 с положения 2683762 до положения 2683744.
glyA-прямой (SEQ ID NO: 31)
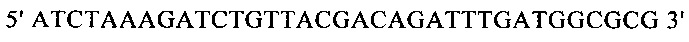
glyA-обратный (SEQ ID NO: 32)
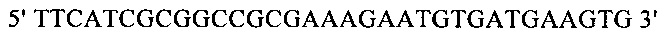
Ген glyA амплифицировали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров glyA-прямой и glyA-обратный и ДНК-полимеразы Phusion (фирма Finnzymes Оу, Эспоо, Финляндия). Геномная ДНК штамма Е. coli MG1655 служила в качестве матрицы. Полученный в результате этого фрагмент ДНК имел размер 1726 пар оснований.
Его расщепляли рестриктазами BgHI и NotI и очищали с помощью набора для очистки ПЦР-продуктов QIAquick (фирма Qiagen, Гильден, Германия). Плазмиду pUC18-serBAC также расщепляли рестриктазами BglII и NotI и очищали с помощью набора для очистки ПЦР-продуктов QIAquick (фирма Qiagen, Гильден, Германия). Затем расщепленную плазмиду лигировали с ПЦР-продуктом и трансформировали штамм Е. coli DH5α. Плазмидные клоны, содержащие ген glyA, идентифицировали путем расщепления рестриктазами и ДНК-секвенирования. Полученную таким образом плазмиду обозначали как pUC18-serB-glyA-serAC.
1.5 Клонирование генов serB-glyA-serAC из pUC18-serB-glyA-serAC в рСС1-ВАС
Плазмиду pUC18-serB-glyA-serAC расщепляли с помощью рестриктазы HindIII и фрагменты ДНК разделяли с помощью электрофореза в агарозном геле. Выделяли из геля ДНК-фрагмент длиной 5,9 т.п.н., содержащий гены serB, glyA, serA и serC. Фрагмент встраивали путем лигирования в плазмидный вектор pCC1BAC Cloning-Ready Vector (Hind III) фирмы Epicentre (шт. Мэдисон, США), уже расщепленный с помощью HindIII, и трансформировали штамм Е. coli EPI300. Плазмидные клоны, содержащие ДНК-фрагмент, несущий serB, glyA, serA и serC, идентифицировали с помощью расщепления рестриктазами и ДНК-секвенирования. Полученную таким образом плазмиду обозначали как рСС3.
1.6 Клонирование продуктивной плазмиды pME-RDL2a
Продуктивную плазмиду pME-RDL2a клонировали согласно методу, описанному в заявке ЕР 11151526.8. Она содержала ген cysE Escherichia coli, устойчивые к регуляции по типу обратной связи аллели генов thrA и metA Escherichia coli и ген RDL2a, кодирующий тиосульфатсульфотрансферазу RDL2p Saccharomyces cerevisiae. Кроме того, она содержала ген, обусловливающий устойчивость к стрептомицину.
1.7 Трансформация штамма ЕСМ2 продуктивными плазмидами
Штамм ЕСМ2 трансформировали продуктивной плазмидой рСС3, полученной согласно процедуре, описанной в примере 1.5, и осуществляли отбор трансформантов с использованием 20 мг/л хлорамфеникола. Затем клетки трансформировали плазмидой pME-RDL2a, полученной согласно процедуре, описанной в примере 1.6, и осуществляли отбор полученных таким образом трансформантов с использованием 20 мг/л хлорамфеникола + 100 мг/л стрептомицина. Полученный таким образом штамм обозначали как ECM2/pCC3/pME-RDL2a.
1.8 Скрининг и секвенирование толерантных к L-метионину мутантов
Отбор толерантных к L-метионину мутантов проводили, высевая предварительную культуру штамма ECM2/pCC3/pME-RDL2a на планшеты с минимальной средой РС1 (таблица 1, с 14 г/л агара), содержащей 75 г/л L-метионина (фирма Merck, Франкфурт, Германия). В качестве предварительной культуры использовали 10 мл среды для предварительной культуры (10% LB-среды, содержащей 2,5 г/л глюкозы, и 90% минимальной среды РС1), которую инокулировали 100 мкл культуры клеток и культивировали при 37°С в течение 10 ч.

После инкубации в течение 5 дней из планшетов выделяли единичные колонии толерантных к L-метионину мутантов.
Для подготовки к осуществлению секвенирования производные толерантных к L-метионину мутантов штамма ECM2/pCC3/pME-RDL2a, которые уже не содержали плазмид рСС3 и pME-RDL2a, выделяли после размножения в свободной от антибиотиков среде LB в течение примерно шести поколений. Полученные штаммы являлись чувствительными к стрептомицину и хлорамфениколу.
Из 8 мутантов выделяли хромосомальную ДНК. Эту ДНК использовали для секвенирования всего генома (фирма GATC, Констанца, Германия).
По сравнению с исходным штаммом ЕСМ2 были обнаружены мутации только в гене proP. В приведенной ниже таблице 2 дан перечень мутаций. Последовательности аллелей proP представлены в SEQ ID NO: 9 - SEQ ID NO: 24.
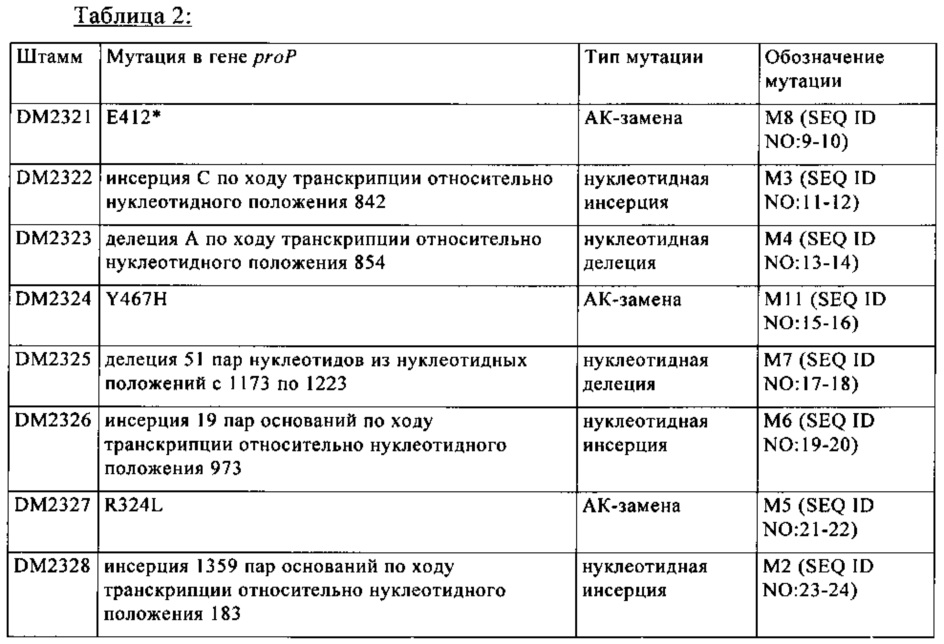
В соответствии с Будапештским договором штаммы DM2321, DM2322, DM2323, DM2324, DM2325, DM2326, DM2327 и DM2328 были депонированы 23 августа 2011 г. в DSMZ (Немецкая коллекция микроорганизмов и клеточных культур, GmbH, Иноффенштрассе 7 В, 38124, Брауншвейг, Германия) под регистрационными DSM-номерами DSM 25095 (т.е. DM2321), 25096 (т.е. DM2322), 25097 (т.е. DM2323), 25098 (т.е. DM2324), 25099 (т.е. DM2325), 25100 (т.е. DM2326), 25101 (т.е. DM2327) и 25102 (т.е. DM2328).
Пример 2
Обнаружение активности толерантных к L-метионину мутантов proP
ProP-активность мутантов proP определяли, например, путем сравнительного анализа поглощения пролина штаммом DM2328 и исходным штаммом ЕСМ2. Для этого 10 мл предварительной культуры 1 инкубировали в течение дня при встряхивании в среде LB при 37°С. 1 мл предварительной культуры переносили в 20 мл М9-среды в качестве предварительной культуры 2 и культивировали в течение ночи. Предварительной культурой 2 инокулировали 50 мл свежей М9-среды до достижения ОП600, равной 0,2. После этого клетки культивировали в течение 3-4 ч, затем трижды отмывали охлажденным на льду М9-буфером, доводили до ОП600, равной 2, и хранили на льду.
Поглощение пролина определяли с использованием радиоактивномеченного [14С(U)]L-пролина (удельная активность: 1,85 МБк; фирма Hartmann Analytic, Германия). Для этого вносили каждый раз по 2,3 мл клеточной суспензии в сосуд, в котором проводили перемешивание, и осуществляли энергетическую подпитку при 37°С в течение 2 мин путем добавления 10 мМ глюкозы. Измерение транспорта начинали при перемешивании путем добавления 20 мкл L-[14С]-пролина в концентрации 24,6 мМ. В различные моменты времени (0, 15, 30, 45, 60, 75, 90, 105 и 120 с) отбирали каждый раз по 200 мкл и пипеткой наносили на стекловолоконные фильтры (фирма Millipore). Окружающую среду удаляли путем всасывания с помощью вакуумного фильтрационного коллектора и клетки отмывали дважды с использованием 2,5 мл 0,1 М раствора LiCl. Фильтры обрабатывали 3,8 мл сцинтилляционной жидкости (фирма Roth, Карлсруэ, Германия) и измеряли радиоактивность с помощью сцинтилляционного счетчика (LS 6500, фирма Beckman Instruments, Мюнхен, Германия). Общую активность в реакционной смеси определяли путем непосредственного измерения в образце без фильтрации. Для каждого образца измеряли количество распадов в минуту (dpm). Активность поглощения рассчитывали в нмолях/мин (на мг сухой массы) (относительное содержание сухой массы для Е. coli составляло 0,36 [мг/мл, ОП=1]). Скорость транспорта в нмолях/мг мин определяли в диапазоне линейного изменения кинетических характеристик. В представленной ниже таблице 3 приведены средние данные, полученные по трем параллельным измерениям.

Пример 3
Трансформация штаммов DM2321, DM2322, DM2323, DM2324, DM2325, DM2326, DM2327 и DM2328 продуктивными плазмидами
Штаммы DM2321, DM2322, DM2323, DM2324, DM2325, DM2326, DM2327 и DM2328 трансформировали продуктивной плазмидой рСС3, созданной согласно процедуре, описанной в примере 1.5, и осуществляли отбор трансформантов с использованием 20 мг/л хлорамфеникола. Затем клетки трансформировали плазмидой pME-RDL2a, созданной согласно процедуре, описанной в примере 1.6, и осуществляли отбор полученных в результате этого трансформантов с использованием 20 мг/л хлорамфеникола и 100 мг/л стрептомицина. Полученные в результате этого штаммы обозначали как DM2321/pCC3/pME-RDL2a, DM2322/pCC3/pME-RDL2a, DM2323/pCC3/pME-RDL2a, DM2324/pCC3/pME-RDL2a, DM2325/pCC3/pME-RDL2a, DM2326/pCC3/pME-RDL2a, DM2327/pCC3/pME-RDL2a и DM2328/pCC3/pME-RDL2a.
Пример 4
Анализ продуктивности в эксперименте с использованием встряхиваемых колб
Продуктивность штаммов Е. coli, продуцирующих L-метионин, оценивали в тестах по оценке продуктивности в конических колбах вместимостью 100 мл. Предварительные культуры в каждом случае получали путем инокуляции 10 мл среды для предварительной культуры (10% LB-среды, содержащей 2,5 г/л глюкозы и 90% минимальной среды РС1) с использованием 100 мкл культуры клеток и их культивировали в течение 10 ч при 37°С. Затем их использовали для инокуляции в каждом случае 10 мл минимальной среды РС1 (см. таблицу 1 в примере 1) до ОП600, составляющей 0,2 (Eppendorf Bio-Photometer; фирма Eppendorf AG, Гамбург, Германия), и культуры выращивали в течение 24 ч при 37°С. Концентрацию внеклеточного L-метионина определяли с помощью ионообменной хроматографии и постколоночной дериватизации с обнаружением нингидрина с использованием аминокислотного анализатора (фирма Sykam GmbH, Эрезинг, Германия). Концентрацию внеклеточной глюкозы определяли с помощью глюкозного анализатора YSI 2700 Select (фирма YSI Life Sciences, Йеллоу Спрингс, шт. Огайо, США). Результаты представлены в таблице 4. Через 24 ч в обеих культурах имело место полное поглощение глюкозы.
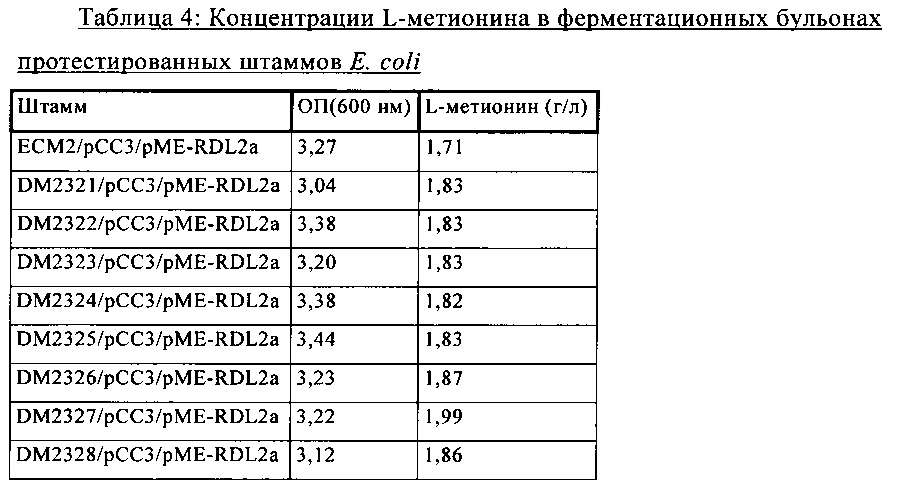
Пример 5
Клонирование аллелей М8, М4 и М6 proP в плазмиде pMAK705
Аллели proP М8 из DM2321, М4 из DM2323 и М6 из DM2326 амплифицировали с помощью полимеразной цепной реакции (ПЦР) и клонировали в плазмиде pMAK705.
На основе последовательностей аллелей proP (см. пример 1) создавали пару праймеров, которые позволяли амплифицировать в каждом случае фрагмент, содержащий конкретную мутацию. Затем указанный фрагмент можно было клонировать в плазмиде pMAK705 (Hamilton С.М., Aldea М., Washburn В.K., Babitzke P., Kushner S.R.; J Bacteriol.; 171(9), 1989, сс. 4617-4622).
ПЦР-праймер proPmut1(NotI) содержал на своем 5'-конце 4 случайных нуклеотида, за которыми располагалась последовательность, распознаваемая рестриктазой HindIII.
ПЦР-праймер proPmut2(BamHI) содержал на своем 5'-конце 4 случайных нуклеотида, за которыми располагалась последовательность, распознаваемая рестриктазой BamHI.
Нуклеотиды с 13 по 32 proPmut1(NotI) располагались в геноме штамма Е. coli MG1655 с положения 4328800 до положения 4328819. Нуклеотиды с 13 по 37 proPmut2(NotI) располагались в геноме штамма Е. coli MG1655 с положения 4330303 до положения 4330322.
proPmut1(HindIII) (SEQ ID NO: 33)
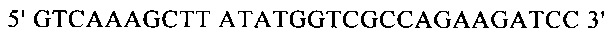
proPmut2(BamHI) (SEQ ID NO: 34)
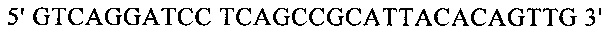
Геномная ДНК штаммов DM2321, DM2323 и DM2328 (см. пример 1) служила в качестве матрицы.
В каждом случае фрагмент, охватывающий соответствующую мутацию в гене proP, амплифицировали с помощью полимеразной цепной реакции (ПЦР) с использованием ДНК-полимеразы Phusion (фирма Finnzymes Оу, Эспоо, Финляндия). Фрагмент из DM2321 (несущий proP-М8), содержащий мутацию Е412*, имел размер 1564 пары оснований (SEQ ID NO: 35). Фрагмент из DM2323 (несущий proP-М4), имеющий делецию «А» по ходу транскрипции относительно нуклеотидного положения 854, имел размер 1542 пары оснований (SEQ ID NO: 36). Фрагмент из DM2326 (несущий proP-М6), содержащий инсерцию 19 пар оснований по ходу транскрипции относительно нуклеотидного положения 973, имел размер 1563 пары оснований (SEQ ID NO: 37).
Все три фрагмента расщепляли рестриктазами HindIII и BamHI и очищали с помощью набора для очистки продуктов ПЦР QIAquick (фирма Qiagen, Гильден, Германия). Затем фрагменты использовали для встраивания путем лигирования в плазмиду pMAK705.
Плазмиду pMAK705 расщепляли рестриктазами HindIII и BamHI, дефосфорилировали с помощью щелочной фосфатазы (щелочная фосфатаза, кишечник теленка, фирма New England Biolabs, Франкфурт-на Майне, Германия) и очищали с помощью набора для очистки продуктов ПЦР QIAquick (фирма Qiagen, Гильден). Затем плазмиду смешивали с конкретными фрагментами proP и лигировали с помощью ДНК-лигазы Quick (фирма New England BioLabs, Франкфурт, Германия). Полученной в результате лигирования смесью трансформировали штамм E. coli DH5α (Grant и др., Proceedings of the National Academy of Sciences USA, 87, 1990, cc. 4645-4649). Правильные плазмидные клоны отбирали с использованием 20 мг/л хлорамфеникола и идентифицировали путем расщепления рестриктазами и последующего секвенирования вставок. Полученные таким образом плазмиды обозначали как pMAK_proP-М4, pMAK_proP-М6 и pMAK_proP-М8. В качестве примера на фиг. 3 представлена плазмида pMAK_proP-М8.
Пример 6
Мутагенез гена proP в штамме Е. coli ЕСМ2
Хромосомальный аллель proP дикого типа в продуцирующем L-метионин штамме E. coli ЕСМ2 (см. пример 1) заменяли в каждом случае аллелями proP М4, М6 и М8, опосредующими устойчивость к метионину. Для этой цели штамм трансформировали в каждом случае путем электропорации плазмидами pMAK_proP-М4, pMAK_proP-М6 и pMAK_proP-М8 (см. пример 5). pMAK-плазмиды имели ген, обусловливающий устойчивость к хлорамфениколу, и чувствительный к температуре сайт начала инициации репликации. Репликация плазмиды в E. coli имеет место при 30°С, но не при 44°С. Смеси для трансформации высевали в каждом случае на LB-arap, содержащий 20 мг/л хлорамфеникола и инкубировали при 30°С в течение 40 ч. Затем клетки удаляли с помощью петли для инокуляции, ресуспендировали в LB-среде и разводили в 10000 раз LB-средой. По 100 мкл разведения высевали на LB-arap, содержащий 20 мг/л хлорамфеникола и инкубировали при 44°С в течение еще 24 ч. Таким путем в каждом случае отбирали колонии, которые несли плазмиды pMAK_proP-М4, pMAK_proP-М6 и pMAK_proP-М8, интегрированные в хромосому. В каждом случае изымали с помощью петли для инокуляции одну из этих колоний, разводили на LB-arape, содержащем 20 мг/л хлорамфеникола, и инкубировали при 44°С в течение 24 ч. Интродуцированные мутации выявляли с помощью стандартных методов ПЦР (Innis и др., PCR Protocols. A guide to methods and applications, изд-во Academic Press, 1990) с использованием следующей пары праймеров (см. пример 11):
proPmut1(HindIII) (SEQ ID NO: 33)
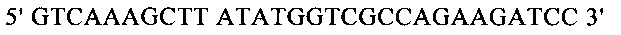
proPmut2(BamHI) (SEQ ID NO: 34)
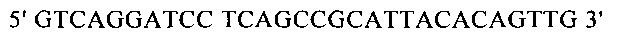
Полученный в каждом случае ПЦР-продукт секвенировали с использованием обоих праймеров в GATC (Констанц, Германия). Все три аллеля proP переносили в каждом случае в штамм E. coli ЕСМ2, полученные в результате штаммы обозначали как ЕСМ2_proP-М4, ЕСМ2_proP-М6 и ЕСМ2_proP-М8.
Пример 7
Трансформация штаммов ЕСМ2_proP-M4, ЕСМ2_proP-М6 и ЕСМ2_proP-М8 продуктивными плазмидами
Штаммы ЕСМ2_proP-М4, ЕСМ2_proP-М6 и ЕСМ2_proP-М8 трансформировали продуктивной плазмидой рСС3, созданной согласно процедуре, описанной в примере 1.5, и осуществляли отбор трансформантов с использованием 20 мг/л хлорамфеникола. Затем клетки трансформировали плазмидой pME-RDL2a, созданной согласно процедуре, описанной в примере 1.6, и осуществляли отбор трансформантов с использованием 20 мг/л хлорамфеникола и 100 мг/л стрептомицина. Полученные в результате штаммы обозначали как ECM2_proP-M4/pCC3/pME-RDL2a, ЕСМ2_proP-М6/рСС3/рМЕ-RDL2a и ECM2_proP-M8/pCC3/pME-RDL2a.
Пример 8
Анализ продуктивности в эксперименте с использованием встряхиваемых колб
Продуктивность продуцирующих L-метионин штаммов Е. coli ЕСМ2_proP-M4/pCC3/pME-RDL2a, ECM2_proP-M6/pCC3/pME-RDL2a и ЕСМ2_proP-M8/pCC3/pME-RDL2a оценивали в тестах по оценке продуктивности в конических колбах вместимостью 100 мл. Предварительные культуры в каждом случае получали путем инокуляции 10 мл среды для предварительной культуры (10% LB-среды, содержащей 2,5 г/л глюкозы и 90% минимальной среды РС1) с использованием 100 мкл культуры клеток и их культивировали в течение 10 ч при 37°С. Затем их использовали для инокуляции в каждом случае 10 мл минимальной среды РС1 (см. таблицу 1 в примере 1) до ОП600 нм, составляющей 0,2 (биофотометр Eppendorf; фирма Eppendorf AG, Гамбург, Германия), и культуры выращивали в течение 24 ч при 37°С. Концентрацию внеклеточного L-метионина определяли с помощью ионообменной хроматографии и постколоночной дериватизации с обнаружением нингидрина с использованием аминокислотного анализатора (фирма Sykam GmbH, Эрезинг, Германия). Концентрацию внеклеточной глюкозы определяли с помощью глюкозного анализатора YSI 2700 Select (фирма YSI Life Sciences, Йеллоу Спрингс, шт. Огайо, США). Результаты представлены в таблице 5. Через 24 ч в обеих культурах имело место полное поглощение глюкозы.