Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ АМИНОБЕНЗОПЕНТАТИЕПИНЫ В КАЧЕСТВЕ АНТИМИКРОБНЫХ СРЕДСТВ
Вид РИД
Изобретение
Изобретение относится к медицине и фармацевтике, а именно, к лекарственным средствам, обладающим антибактериальным и фунгицидным действием.
Возникновение резистентности бактерий к известным антибактериальным средствам является серьезной проблемой в лечении бактериальных инфекций. По данным Всемирной организации здравоохранения (ВОЗ) устойчивость к антибиотикам приближается к угрожающе высоким уровням, угрожая способности лечить распространенные инфекционные заболевания [1]. Большинство разрабатывающихся в настоящее время агентов являются модификациями уже использующихся классов антибиотиков, тогда как для преодоления резистентности необходимым является поиск антибиотиков новых структурных типов и механизмов действия [2].
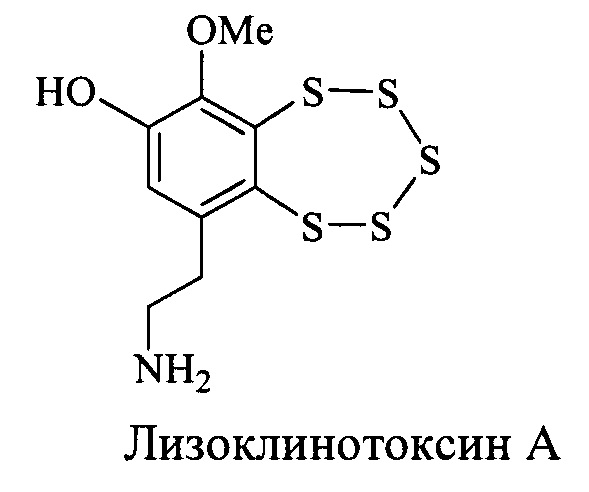
Ранее было обнаружено, что высокой антибактериальной активностью обладает лизоклинотоксин А [3], выделяемый из морского животного (асцидии) Lissoclinum sp. [4]. Недостатком лизоклинотоксина А является его низкое содержание в природных источниках и сложность его выделения или полного синтеза.
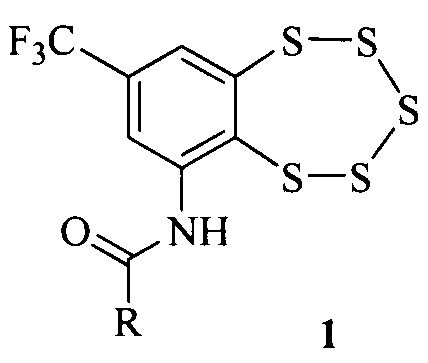
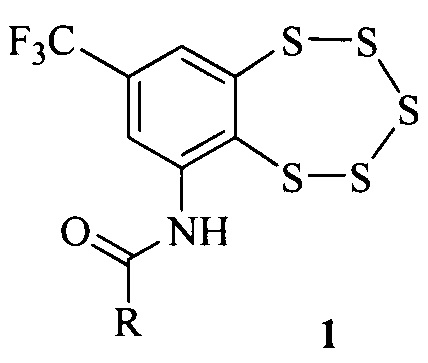
Нами обнаружено, что высокой антибактериальной и фунгицидной активностью обладают соединения общей формулы 1,
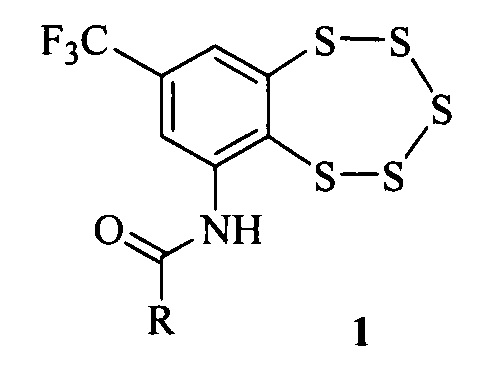
где R это алкильная группа, в том числе содержащая атомы галогена.
Соединения типа 1 могут быть получены, например, взаимодействием аминобензопентатиепина 2 с ангидридами соответствующих кислот [5].
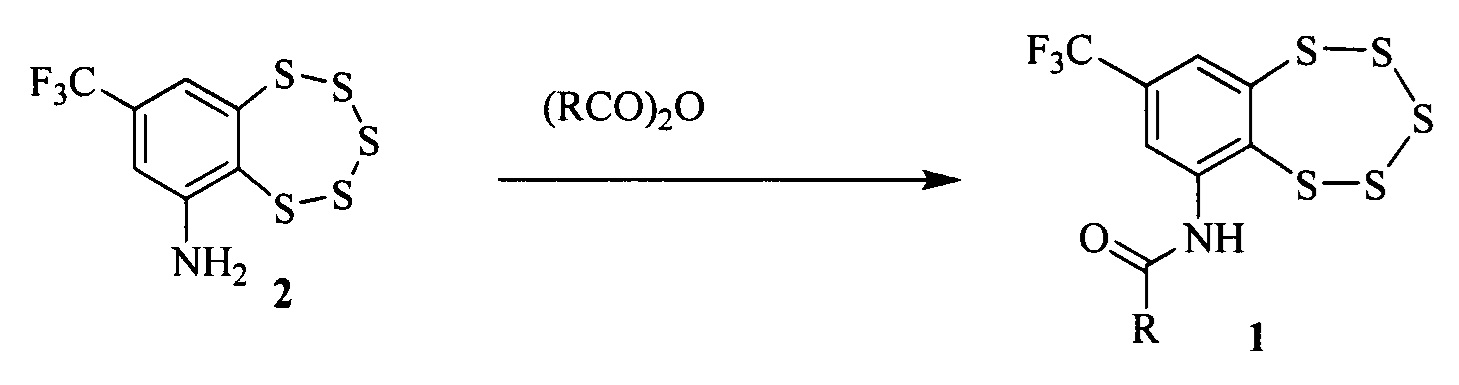
Соединение 2, в свою очередь, может быть синтезировано в две стадии из коммерчески доступного 2-хлор-1,3-динитро-5-(трифторметил)бензола 3 [5].
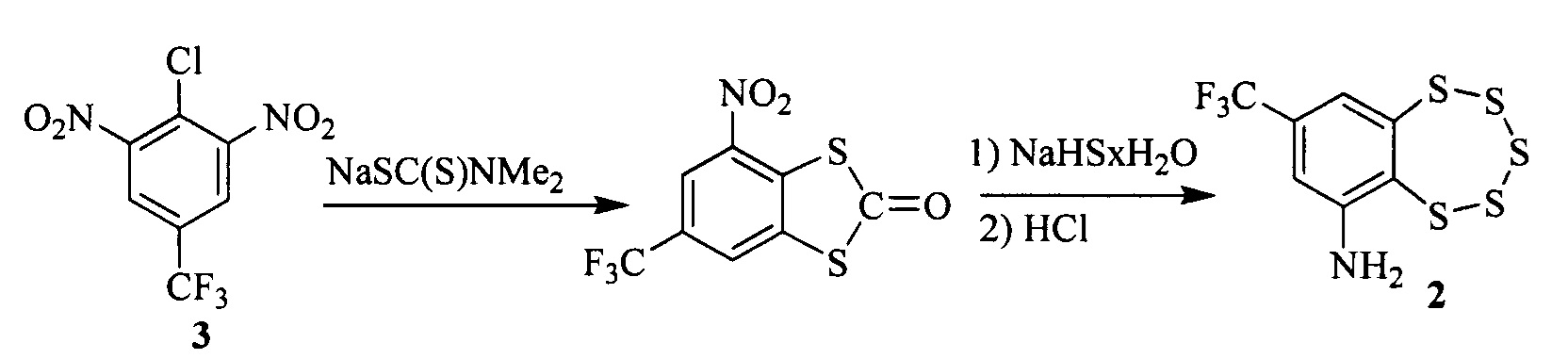
Таким образом, соединения общей формулы 1 могут быть получены в три стадии из коммерчески доступного исходного соединения 3 без использования дорогостоящих реагентов, что выгодно отличает их от лизоклинотоксина А и его аналогов.
Для тестирования на наличие антибактериальной активности был выбран метициллинрезистентный золотистый стафилококк (MRSA), вызывающий сложно излечимые заболевания у людей, такие как сепсис и пневмонии. Разработка антибиотиков для борьбы с MRSА обозначена ВОЗ в качестве высокоприоритетной [6].
Тестирование на наличие антимикробной активности проводилось CO-ADD (The Community for Antimicrobial Drug Discovery), Австралия.
Фунгицидная активность изучалась на двух видах грибков:
- молочница Candida albicans (С. albicans), являющаяся важным возбудителем инфекций, передающихся в больницах;
- Cryptococcus neoformans (С. neoformans), возбудитель криптококкоза у человека, характеризующимся поражением ЦНС, легких, кожи и слизистых оболочек.
Особенно опасными грибковые инфекции являются у пациентов с иммунодефицитом, например, в результате СПИДа, химиотерапии рака или трансплантации органов.
Для тестируемых соединений определялась Минимальная ингибирующая концентрация (МИК), представляющая собой минимальную концентрацию, полностью ингибирующую рост бактерий или грибков.
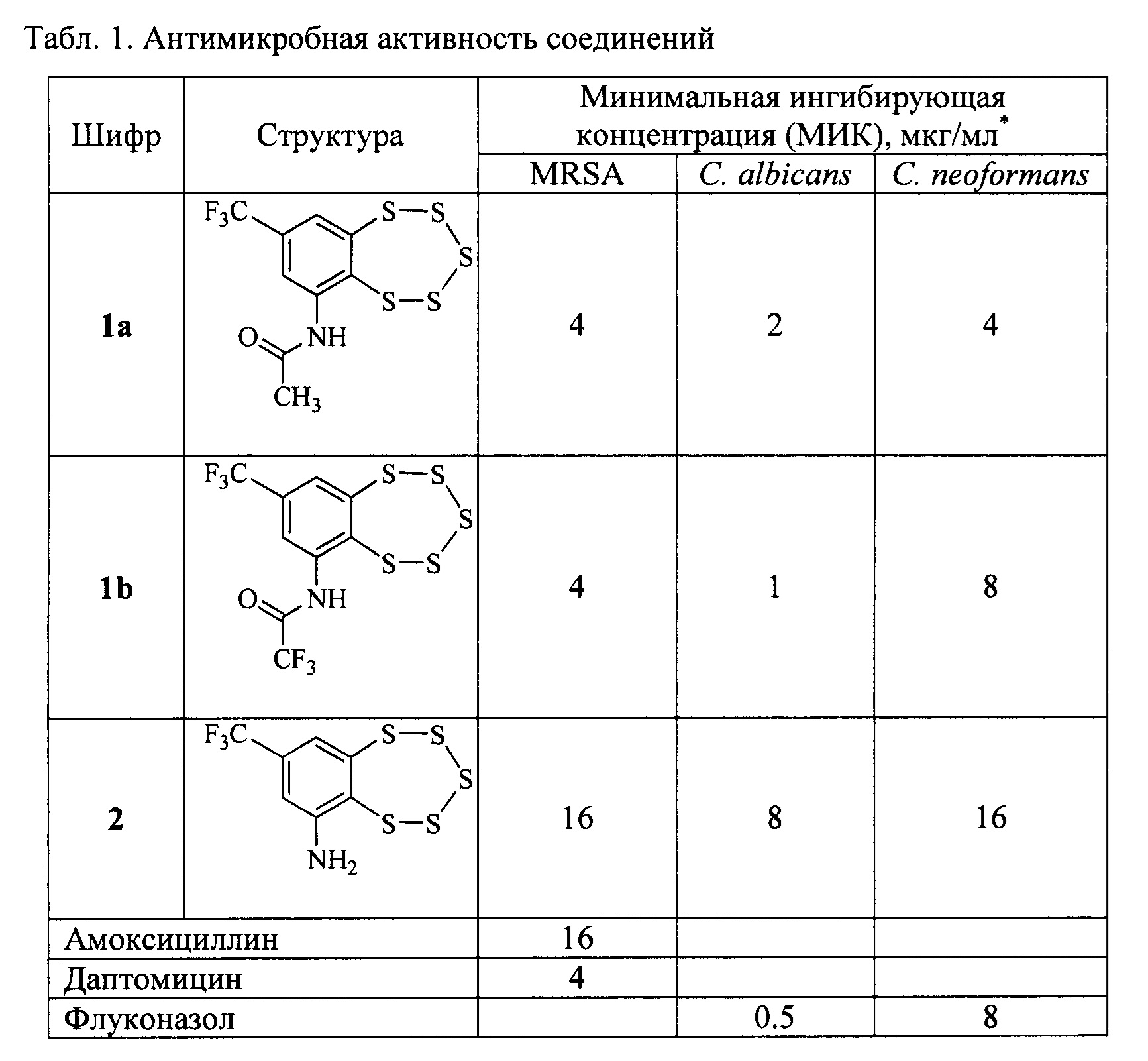
Результаты тестирования представлены в Табл. 1.
Из полученных данных видно, что исходный аминобензопентатиепин 2 обладает умеренной антибактериальной активностью против золотистого стафилококка MRSA с МИК 16 мкг/мл. Переход к соединениям общей структуры 1, представленных ацетамидом 1а и трифторацетамидом 1b, привел к четырехкратному увеличению активности с МИК 4 мкг/мл. Соединения 1а, b совпадают по активности с препаратом сравнения Даптомицином и в четыре раза превосходят по активности препарат сравнения Амоксициллин.
Соединения 1а, b продемонстрировали высокую фунгицидную активность против молочницы Candida albicans с МИК 1÷2 мкг/мл и криптококка Cryptococcus neoformans (МИК 4÷8 мкг/мл), существенно превосходя по активности соединение 2. Соединения 1а, b сопоставимы по активности с препаратом сравнения Флуконазолом.
*MRSA - метициллинрезистентный золотистый стафилококк; Candida albicans; Cryptococcus neoformans.
Технический результат состоит в обнаружении нового типа эффективных антимикробных препаратов, расширяющих арсенал имеющихся средств.
Изобретение иллюстрируется следующими примерами:
Пример 1. Синтез N-(8-(трифторометил)бензо[ƒ][1,2,3,4,5]пентатиепин-6-ил)ацетамида 1а.
К раствору 0.038 г (0.12 ммоль) 8-(трифторметил)бензо[ƒ][1,2,3,4,5]пентатиепин-6-амина 2 в 0.4 мл CH2Cl2 при перемешивании и при комнатной температуре прибавили 0.4 мл (4.2 ммоль) Ac2O, перемешивали при 20°С в течение 4 ч и оставили на ночь. Затем прибавили лед и экстрагировали CH2Cl2, промыли водой и высушили над Na2SO4. После удаления растворителя получили 0.040 г (92%) N-(8-(трифторометил)бензо[ƒ][1,2,3,4,5]пентатиепин-6-ил)ацетамида 1а.
Соединение 1а. Т. пл. 134-135°С. Спектр ЯМР 1Н (δ, м.д.): 2.27 с. (СН3), 7.75 д.к. (Н-9, J9,7 2.0 Гц, 4JH,F 0.6 Гц), 8.45 ш.с.(NH), 8.88 д.к. (Н-7, J7,9 2.0 Гц, 4JH,F 0.6 Гц). Спектр ЯМР 13С (δ, м.д.): 133.62 (С-5а), 142.23 (С-6), 118.98 (С-7, 3JC,F 3.8 Гц), 133.22 (С-8, 2JC,F 33.6 Гц), 126.43 (С-9, 3JC,F 3.5 Гц), 145.92 (С-9а), 122.54 (CF3, 1FC,F 273.8 Гц), 167.94 (С=O), 25.09 (СН3). Найдено: m/z 360.8999 [М]+ C9H6NF3OS5. Вычислено: М=360.8981. Масс-спектр: m/z 361 (М+, 1%), 297 (М+ - 2S, 100), 265 (М+ - 3S, 9), 255 (66), 233 (М+ - 4S, 18), 223 (29), 191 (9), 64 (21), 43 (52).
Пример 2. Синтез 2,2,2-трифторо-N-(8-(трифторометил)бензо[ƒ][1,2,3,4,5]пентатиепин-6-ил)ацетамида 1b.
К раствору 0.430 г (1.35 ммоль) 8-(трифторметил)бензо[ƒ][1,2,3,4,5]пентатиепин-6-амина 2 в 0.4 мл CH2Cl2 при перемешивании и при комнатной температуре прибавили 0.45 мл (3.20 ммоль) (CF3CO)2O, перемешивали при 20°С в течение 2 ч. После удаления растворителя получили 0.507 г (91%) 2,2,2-трифторо-N-(8-(трифторометил)бензо[ƒ][1,2,3,4,5]пентатиепин-6-ил)ацетамида 1b.
Соединение 1b. Т. пл. 116-118°С. Спектр ЯМР 1Н (δ, м.д.): 7.93 д.к. (Н-9, J9,7 2.1 Гц, 4JH,F 0.6 Гц), 8.78 д. (Н-7, J7,9 2.1 Гц), 9.31 ш.с.(NH). Спектр ЯМР 13С (δ, м.д.): 135.91 (С-5а), 139.25 (С-6), 119.14 (С-7, 3JC,F 3.7 Гц), 133.36 (С-8, 2JC,F 34.0 Гц), 128.60 (С-9, 3JC,F 3.6 Гц), 146.58 (С-9а), 122.16 (CF3, 1JC,F 273.8 Гц), 154.88 (С=O, 2JC,F 38.6 Гц), 115.15 (COCF3, 1JCC,F 288.7 Гц). Найдено: m/z 414.8727 [М]+ C9H3NF6OS5. Вычислено: М=414.8722. Масс-спектр: m/z 415 (М+, 18%), 351 (М+ - 2S, 100), 319 (М+ - 3S, 19), 287 (М+ - 4S, 28), 255 (М+ - 5S, 16), 222 (16), 190 (10), 69 (37), 64 (57).
Пример 3. Изучение антибактериальной активности соединений 1а, b.
Тестирование на наличие антибактериальной активности проводилось против метициллинрезистентного золотистого стафилококка (MRSA). Тестирование проводилось СО-ADD (The Community for Antimicrobial Drug Discovery), Австралия.
Тестируемые соединения растворяли в ДМСО и воде до конечной тестовой концентрации 32 мкг/мл и последовательно разбавляли вдвое, до 8 раз. Образцы готовили в 384-луночных планшетах, сохраняя конечную концентрацию ДМСО максимально до 0.5% ДМСО.
Бактерии культивировались с использованием среды САМНВ (Cation-adjusted Mueller Hinton broth) при 37°C. Плотность бактерий в лунках планшета составляла 5×105 КОЕ/мл. Бактерии инкубировались в присутствии тестируемых соединений в течение 18 ч при 37°С.
Ингибирование роста бактерий определяли при измерении поглощения при 600 нм с использованием монохромного считывателя Tecan M1000 Pro. Процент ингибирования роста рассчитывали для каждой лунки с использованием отрицательного контроля (только среда) и положительного контроля (бактерии без ингибиторов) на том же планшете, что и изучаемые соединения. MIC определяли как самую низкую концентрацию, при которой рост полностью ингибировался, определяемый ингибированием роста бактерий ≥80%. Все эксперименты повторялись на другом планшете.
Результаты тестирования представлены в Табл. 1.
Пример 4. Изучение фунгицидной активности соединений 1а, b.
Тестирование на наличие фунгицидной активности проводилось на двух видах грибков: молочница Candida albicans (CLSI reference, С. albicans) и Cryptococcus neoformans (Cryptococcus neoformans H99 Type strain, С. neoformans).
Тестируемые соединения растворяли в ДМСО и воде до конечной тестовой концентрации 32 мкг/мл и последовательно разбавляли в двое, до 8 раз. Образцы готовили в 384-луночных планшетах, сохраняя конечную концентрацию ДМСО максимально до 0.5% ДМСО.
Штаммы грибов культивировали в течение 3 дней с использованием среды YPD (Yeast Extract-Peptone Dextrose) при 30°С. Плотность грибов в лунках планшета составляла 2.5×103 КОЕ/мл. Грибы инкубировались в присутствии тестируемых соединений в течение 36 ч при 35°С.
Ингибирование роста С. albicans определяли измерение поглощения при 630 нм (OD630), ингибирование роста С. neoformans определяли, измеряя разницу в оптической плотности между 600 и 570 нм (OD600-570) после добавления резазурина (концентрация 0.001.) и инкубации при 35°С в течение 2 часов. Абсорбцию измеряли с использованием Biotek Multiflo Synergy НТХ. В обоих случаях процентная доля ингибирования роста рассчитывалась для каждой лунки с использованием отрицательного контроля (только среды) и положительного контроля (грибы без ингибиторов) на том же планшете. MIC определяли как самую низкую концентрацию, при которой рост полностью ингибировался, определялся ингибированием ≥80% для С. albicans и ингибированием ≥70% для С. neoformans. Все эксперименты повторялись на другом планшете.
Полученные результаты приведены в таблице 1.
Литература.
1. Antibiotic resistance. WHO. 2017. http://www.who.int/mediacentre/factsheets/antibiotic-resistance/en/.
2. Antibacterial agents in clinical development. World Health Organization 2017, WHO/EMP/IAU/2017.11.
3. M. Litaudon. F. Trigalo, M.T. Martin, F. Frappier, M. Guyot. Lissoclinotoxins: antibiotic polysulfur derivatives from the tunicate Lissodinum perforatum. Revised Structure of Lissoclinotoxin A. Tetrahedron, 1994, Vol. 50, No. 18. pp. 5323-5334.
4. Л.С. Константинова, С.А. Амеличев, О.А. Ракитин. Успехи химии, 76 (3) 2007 С. 219-236.
5. Т.М. Khomenko, T.G. Tolstikova, A.V. Bolkunov, M.P. Dolgikh, A.V. Pavlova, D.V. Korchagina, K.P. Volcho, N.F. Salakhutdinov. 8-(Trifluoromethyl)-1,2,3,4,5-benzopentathiepin-6-amine: Novel Aminobenzopentathiepine having In Vivo Anticonvulsant and Anxiolytic Activities. Letters in Drug Design & Discovery. Volume 6, Number 6, 2009, Pp. 464-467.
6. Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. WHO. 2017. http://www.who.int/mediacentre/news/releases/2017/bacteria-antibiotics-needed/en/.