Результат интеллектуальной деятельности: Способ подготовки биологического образца к исследованию при помощи сканирующей электронной микроскопии
Вид РИД
Изобретение
Изобретение относится к биологии и медицине и может быть использовано для подготовки биологического образца к исследованию при помощи сканирующей электронной микроскопии.
Быстрое получение изображений объектов биологического происхождения (микроорганизмов, животных и растительных клеток и тканей, а также их производных и субклеточных структур) с высокой разрешающей способностью является актуальной проблемой, решение которой окажет влияние на прогресс медицины, биологии, ветеринарии и фармацевтической индустрии.
В настоящее время в исследовательской практике используются различные варианты высокоразрешающей микроскопии. Все они выполняются на сложных аппаратных станциях и требуют специальной пробоподготовки материала. Электронная микроскопия (ЭМ) до настоящего времени остается «золотым стандартом» микроскопии с высокой разрешающей способностью, ни один из бесконтактных (незондовых) методов микроскопии не способен обеспечить разрешающую способность подобную той, которая достигается при ЭМ (Хокс П. Электронная оптика и электронная микроскопия. Москва. Издательство: "Мир", 1974. - 319 с.). Главное препятствие на пути внедрения ЭМ в повседневную практику медико-биологических наук связано с трудоемкой, длительной и дорогостоящей подготовкой биологических проб (Власов А.И., Елсуков К.А., Косолапов И.А. Электронная микроскопия. Москва. Издательство: "МГТУ им. Н.Э. Баумана", 2011. - 320 с.). Даже самые современные варианты пробоподготовки, включающие фиксацию, обезвоживание, приготовление ультратонких срезов (для трансмиссионной ЭМ) или металлизацию (для сканирующей ЭМ), занимают не менее суток. Существующая подготовка препаратов для ЭМ подразумевает использование высокотоксичных субстанций, таких как тетраоксид осмия, глутаровый альдегид, соли свинца и т.п. Перечисленные сложности ограничивают применение ЭМ в практике диагностических и научно-исследовательских лабораторий. Поэтому разработка новых способов ускоренной и безопасной пробоподготовки препаратов для ЭМ, позволяющих добиться качественной визуализации наноразмерных биологических структур, является важной научно-технической задачей.
В 2015 году было предложено применение лантаноидов и суправитальной схемы контрастирования, предполагающей вовлечение контрастирующего вещества в метаболизм контрастируемого объекта и его ингибирование. К настоящему моменту этот метод апробирован и нашел свое применение при визуализации ряда объектов (Новиков И.А., Вахрушев И.В., Антонов Е.Н., Ярыгин К.Н., Суббот A.M. Визуализация мезенхимных стромальных клеток в двумерных и трехмерных культурах методом сканирующей электронной микроскопии с лантаноидным контрастированием. Клеточные технологии в биологии и медицине. 2016;(4):248-53.; Аветисов С.Э., Труфанов С.В., Новиков И.А., Суббот A.M., Федоров А.А. Визуализация структуры эпителия роговицы методом сканирующей электронной микроскопии с лантаноидным контрастированием на основе Ca/Nd изоморфного замещения в Ca-зависимых молекулярных системах. Вестник офтальмологии. 2016; 132(6): 11-9.; Новиков И.А., Суббот A.M., Федоров А.А., Грибоедова И.Г., Антонов Е.Н., Вахрушев И.В. Суправитальное контрастирование лантаноидами для визуализации структуры биологических образцов на сканирующем электронном микроскопе. Гены и Клетки. 2015; 10(2): 90-6.).
Ближайшим аналогом предлагаемого способа является способ того же назначения, включающий использование контрастирующего вещества, причем перед контрастированием промывают образцы в изотоническом растворе хлорида натрия, а в качестве контрастирующего вещества используют изотонический водный раствор одного из хлоридов редкоземельных элементов или их смеси, при этом нативный образец подвергают суправитальному контрастированию с экспозицией от 20 минут до 6 часов (патент RU 2578977 С1, 12.05.2015).
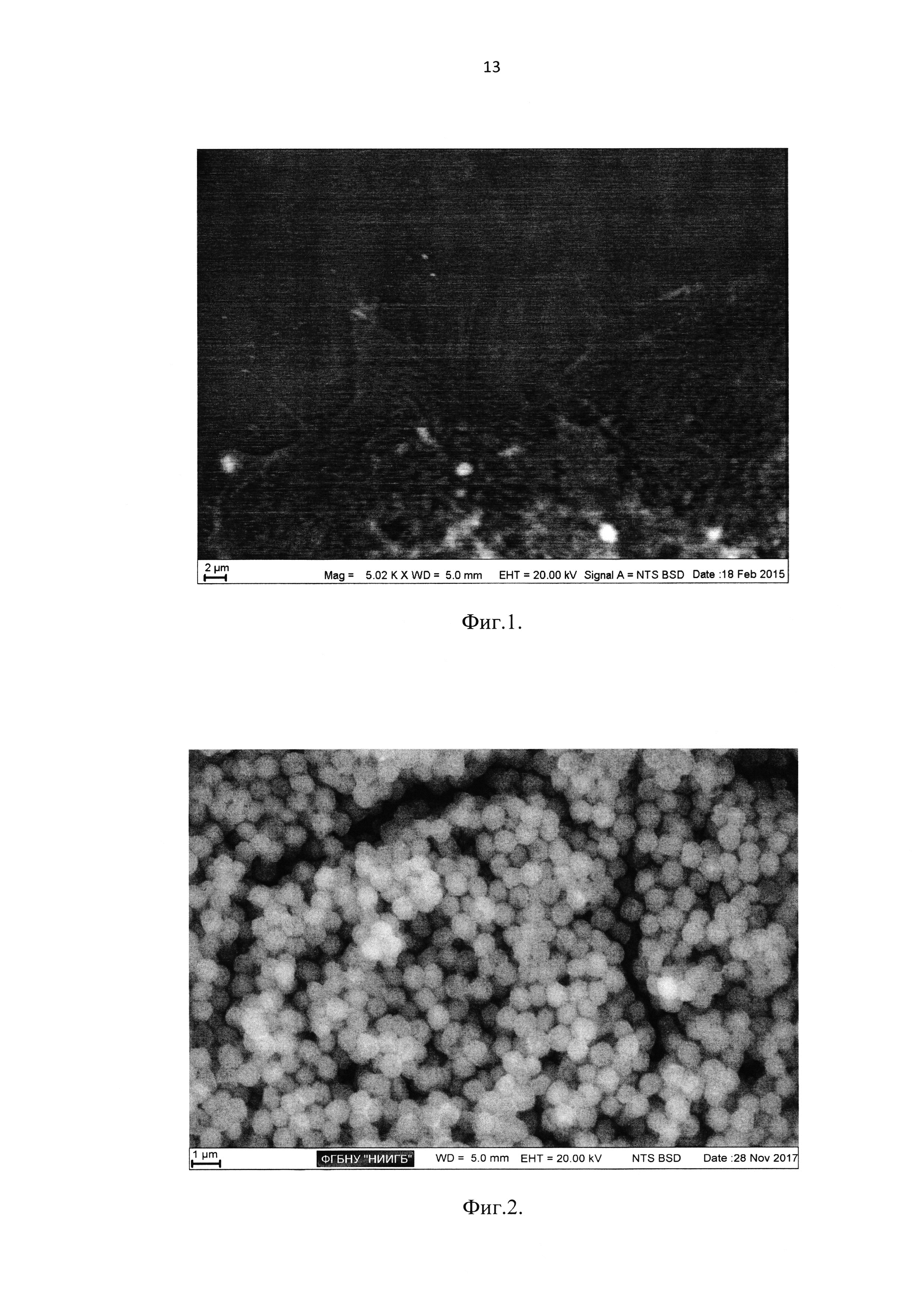
Применение такого способа контрастирования дало возможность визуализации внутренней структуры и ультраструктуры клетки, позволило существенно сократить время пробоподготовки, минимизировать контракционную деформацию образцов, отказаться от использования в технологическом цикле опасных веществ. Но, несмотря на эти преимущества, контрастность получаемых изображений в режиме детекции обратнорассеянных электронов, хотя и превышала в 2-2,5 раза контрастность нативного объекта, но все-таки находилась вблизи нижней границы «комфортного» диапазона усилений BSE-детекторов сканирующих электронных микроскопов. Например, при эксплуатации микроскопа ZEISS EVO LS10 (Zeiss, Германия), при давлении остаточной атмосферы в камере Р=70 Па и токе зонда 60-100 пА, для достижения удовлетворительной контрастности было необходимо использовать режим предусиления детектора «High» и цифровую контрастность Contr=75%. Такое сочетание низкого вакуума, тока и усиления приводило к появлению шума на изображении, связанного с девиациями давления в камере и эффективности моментальной компенсации заряда. Шум проявлялся в заметной наложенной полосчатости изображений, устраняемой только постобработкой с необратимым искажением информации (Фиг. 1 - Изображение лимбальных клеток роговицы на культуральном пластике, получаемое с использованием ближайшего аналога. Видна структурная организация объекта, однако наблюдается значительная зашумленность, полосчатость).
Достигнутая контрастность изображений биологических объектов в ближайшем аналоге обеспечивалась двумя факторами - концентрацией определенного типа сайтов связывания в клетках и экстрацеллюлярном матриксе, а также - атомным номером контрастирующего агента.
В условиях, когда объект наблюдения уже ингибирован лантаноидами, гарантирующими сохранность его формы и стабильность степени гидратации внутренних структур, можно предпринять попытки увеличения контрастности за счет последовательного замещения лантаноидов более «тяжелыми» элементами в тех же позициях связывания. Кроме того, контрастность наблюдаемых объектов можно увеличить и за счет расширения перечня структур, тропных к дополнительному «тяжелому» контрастеру.
Задачей изобретения явилась дальнейшее совершенствование способа подготовки биологических объектов к исследованию при помощи сканирующей электронной микроскопии.
Техническим результатом предлагаемого способа является увеличение контрастности изображений биологических объектов в обратнорассеянных электронах с одновременным увеличением информативности изображений с расширением перечня контрастируемых элементов ультраструктуры.
Технический результат достигается за счет повышения интенсивности обратного рассеяния электронов при проведении сканирующей электронной микроскопии, и как следствие - снижения зашумленности изображений и возможности визуализации дополнительных элементов структуры, ультраструктуры подповерхностного слоя биологического образца и матрикса с помощью применения двухступенчатой последовательной схемы контрастирования, в которой в качестве первого контрастирующего агента используют водный раствор на основе смеси гексагидрата хлорида магния и гексагидрата хлорида химического элемента группы лантаноидов, а в качестве второго контрастирующего агента используют водный раствор уксуснокислого свинца.
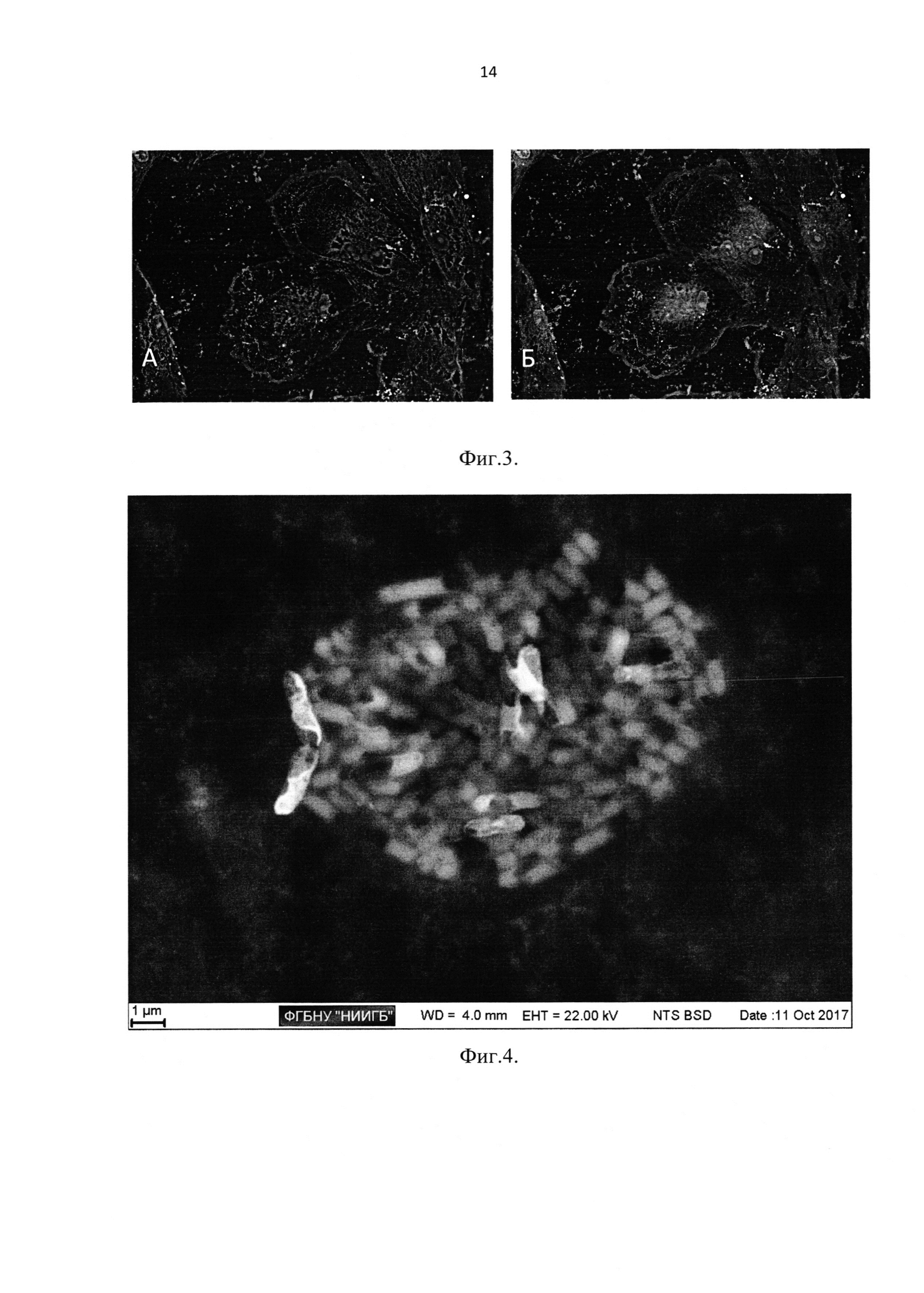
В рамках логики последовательного замещения, было предпринято несколько попыток найти оптимальный «тяжелый» заместитель лантана. В качестве первого кандидата на аддитивное применение последовательно с лантаноидами, был выбран ацетат уранила. Это соединение применяется как в «классической» пробоподготовке для СЭМ, так и при контрастировании объектов для просвечивающей электронной микроскопии. Реакция с ацетатом уранила низкоспецифична, но считается, что основной мишенью для связывания в визуализируемых объектах являются преимущественно белки. Характер связывания определяется агрессивными окислительными свойствами уранил-иона. Последнее свойство вынудило отказаться от применения его в качестве контрастирующего агента второй ступени, так как устойчивости структуры клетки после ингибирования объектов лантаноидами оказалось недостаточно. Ацетат уранила позволил достигнуть беспрецедентного увеличении контрастности в 12 раз по отношению к нативному объекту в обратнорассеянных электронах, но вместе с тем, «окрашенные» объекты не сохраняли свою форму, экстрацеллюлярный матрикс вымывался, внутренняя структура клетки переставала быть видимой (Фиг. 2 - Изображение культуры Staphylococcus aureus, получаемое при использовании двухступенчатой схемы окраски с использованием в качестве второго контрастирующего вещества ацетата уранила. Взаиморасположение объектов сохранено, однако наблюдается отсутствие биопленочного матрикса, частичная потеря сферичной формы, детали внутренней структуры не визуализируются). Более мягким контрастирующим агентом, применение которого дало удовлетворительный результат с минимальным влиянием на структуру, стал ацетат свинца. Применение водного раствора ацетата свинца позволяет увеличить контрастность в результате протекания следующих реакций.
А) Реакции вытеснения свинцом лантаноида в простых фосфатах, по принципу наименьшей растворимости 3Pb2++2Ln[PO4]→2Ln3++Pb3[PO4]2, исходя из ПРLn[PO4]=3.7*10-23; ПРРb3[РO4]2=7.9*10-43. При этом стоит отметить, что на два фосфат-аниона будет приходиться три катиона свинца, против двух катионов лантаноидов. Эта реакция преимущественно увеличивает яркость в обратнорассеянных электронах элементов цитоскелета и митохондрий, как объектов пространственно связанных с большим количеством свободного фосфат-аниона.
Б) Реакций, протекающих по типу реакции Барфеда, с той разницей, что катионом является не медь а свинец:
Мишенью для реакций этого типа в клетках и экстрацеллюлярном матриксе будут служить глюкоза, фосфолипиды и биохимические элементы цепей энергетического обеспечения клетки, располагающиеся преимущественно в цитоплазме и эндоплазматическом ретикулуме.
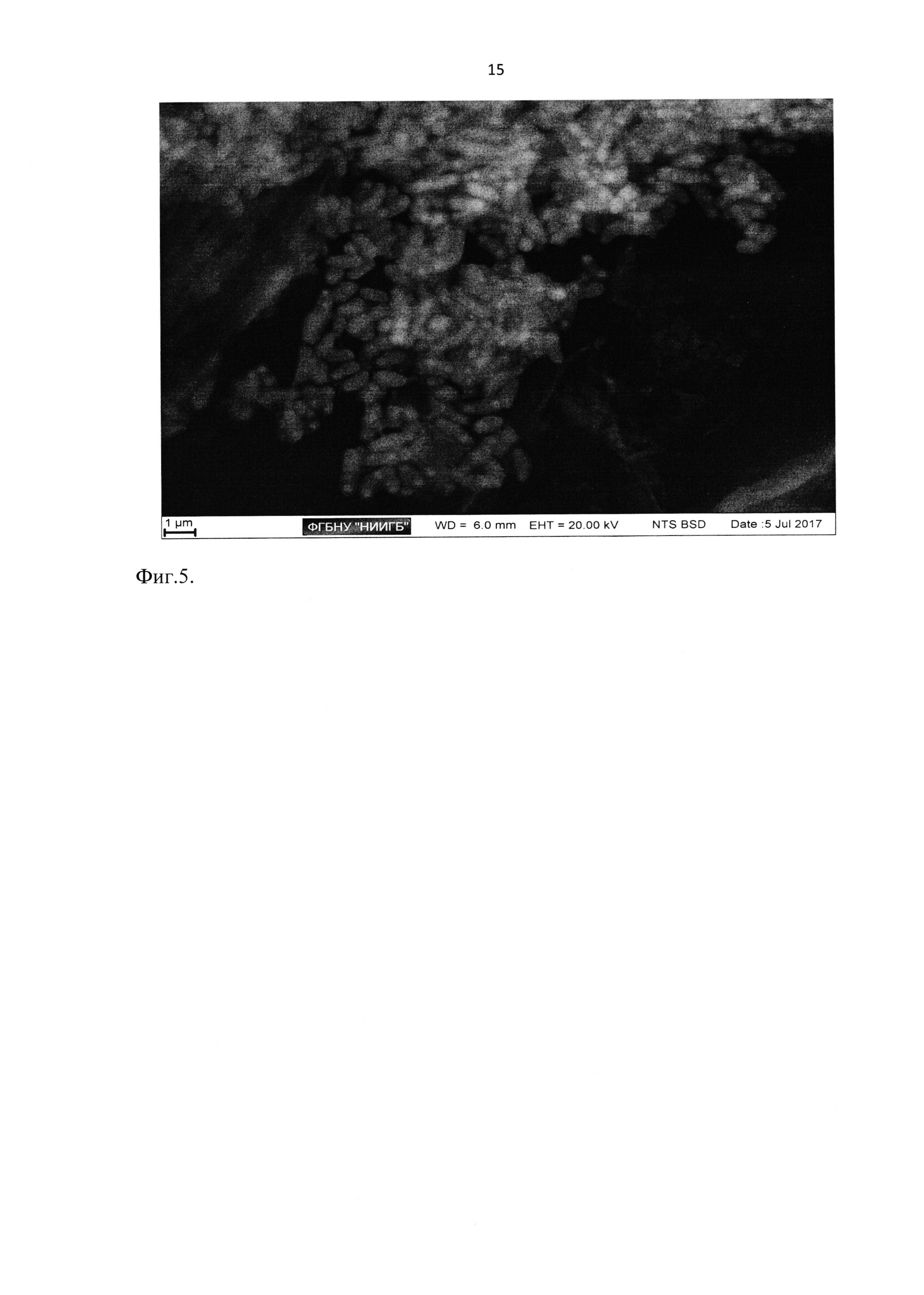
Результаты применения двухступенчатой схемы можно проиллюстрировать, используя методику корреляционной микроскопии и последовательную съемку одного объекта после каждой ступени контрастирования (Фиг. 3 - Изображения клеток лимба роговицы на культуральном пластике получаемые при последовательном применении двух ступеней контрастирования с применением в качестве второго контрастирующего вещества ацетата свинца, а) после первого шага, б) после второго шага).
Последовательное контрастирование ацетатом свинца поверх хлоридов лантаноидов, выявило проблему устойчивости раствора для первой ступени контрастирования. Для стабилизации раствора и предотвращения выпадения оксихлоратов лантаноидов во время промежуточной промывки и второй ступени контрастирования, в состав первого раствора был введен магний.
Таким образом, первый контрастирующий агент представляет собой водный раствор на основе смеси гексагидрата хлорида магния в концентрации 1,1-1,8 г/л и гексагидрата хлорида химического элемента группы лантаноидов в концентрации 13,5-20,2 г/л.
Концентрация применяемых компонентов подбирается из указанных диапазонов эмпирически, в зависимости от свойств (рН, осмотическая адаптированность) объекта контрастирования и конкретного применяемого элемента группы лантана.
Для некоторых типов объектов, например, требующих для сохранения жизнеспособности высоких или, наоборот, низких значений рН, допускается модификация кислотности растворов добавлением буферных систем на основе ацетат-аниона или едкого натра.
При необходимости долговременного хранения образца или для обеспечения норм безопасности при работе с патогенными микроорганизмами возможно применение раствора глутарового альдегида или формалина для фиксации образца после контрастирования, но необходимо учесть, что в результате этого некоторые элементы структуры потеряют контрастность (например, цитоскелет).
Способ осуществляют следующим образом:
Проводят суправитальное контрастирование, для этого применяют двухступенчатую схему контрастирования. В качестве первого контрастирующего агента используют водный раствор на основе смеси гексагидрата хлорида магния в концентрации 1,1-1,8 г/л и гексагидрата хлорида химического элемента группы лантаноидов в концентрации 13,5-20,2 г/л. В качестве второго контрастирующего агента используют водный раствор уксуснокислого свинца в концентрации 82-104 г/л. Дополнительно модифицируют кислотность растворов с помощью буферных систем на основе ацетат-аниона или едкого натра. Для хранения и фиксации образца после контрастирования его обрабатывают раствором глутарового альдегида или формалина.
При проведении сканирующей электронной микроскопии в режиме низкого вакуума, наибольшая контрастность структуры подповерхностного слоя образца достигается при использовании детектора обратнорассеянных электронов, ускоряющем напряжении 15-30 кВ и остаточном давлении атмосферных газов в камере микроскопа 60-100 Па.
Пример 1. Осуществление способа при работе с суспензионным образцом, требующим коррекции рН:
1) Образец, содержащий Amoeba proteus, центрифугировали, убирали супернатант и добавляли промывочный раствор - изотонический раствор NaCl. Встряхивали на вортексе. Центрифугировали, убирали супернатант.
2) К клеточному осадку добавили первый контрастирующий раствор на основе смеси гексагидрата хлорида магния, в концентрации 1,8 г/л, и гексагидрата хлорида лантана в концентрации 20,2 г/л, с рН раствора, доведенным до 5,6 добавлением уксусной кислоты, ресуспендировали и экспонировали образец с раствором 20 минут при температуре 37°С, со встряхиванием.
3) Образец центрифугировали, убирали супернатант и добавляли промежуточный промывочный раствор - изотонический раствор NaCl.
Встряхивали на вортексе. Центрифугировали, убирали супернатант.
4) К клеточному осадку добавляли второй контрастирующий раствор - водный раствор уксуснокислого свинца в концентрации 104 г/л., инкубировали с раствором 5 минут.
5) Образец центрифугировали, убирали супернатант и добавляли промежуточный промывочный раствор - изотонический раствор NaCl.
6) Осаждали клетки на мембрану шприцевого фильтра.
7) Промывали кассету мембранного фильтра дистиллированной водой для удаления излишков контрастирующего вещества и извлекали мембрану с осажденными клетками из кассеты.
8) Подготовленный объект размещали на предметном столике микроскопа.
Пример 2. Осуществление способа при работе с патогенными организмами и при необходимости длительного сохранения образца после контрастирования.
1. Образец биологической ткани (культуру клеток, изолированный блок ткани и т.п.) промывали в изотоническом растворе NaCl.
2. После первичной промывки биологический образец размещали в емкости с первым контрастирующим раствором на основе смеси гексагидрата хлорида магния, в концентрации 1,1-1,8 г/л, и шестиводного хлорида химического элемента группы лантаноидов, в концентрации 13,5-20,2 г/л, экспонировали в растворе 20 минут при температуре 37°С, желательно со встряхиванием.
3. Переносили образец в емкость с жидкостью для промежуточной промывки и тщательно промывали.
4. Переносили образец в емкость со вторым контрастирующим водный раствором уксуснокислого свинца в концентрации 82-104 г/л инкубировали в растворе 5 минут.
5. Переносили образец в емкость с дистиллированной водой и промывали в течение не более 1 минуты.
6 Образец помещали в емкость с раствором нейтрального 2,5% глутарового альдегида или формалина на время, достаточное для фиксации (в зависимости от объема образца).
7. Удаляли остатки влаги с поверхности образца и размещали его на предметном столике сканирующего электронного микроскопа.
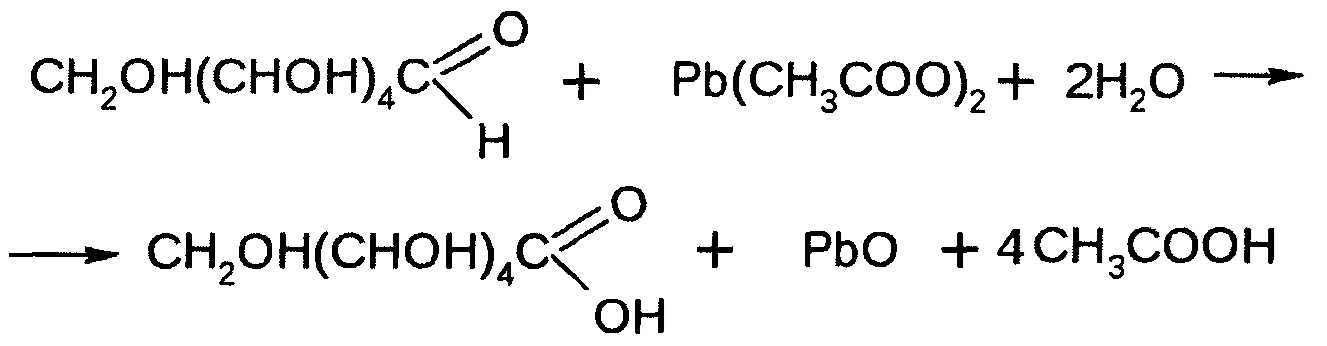
Результат иллюстрирует фиг. 4 - Изображение колонии патогенного микроорганизма Salmonella enterica typhimurium полученное после применения двухступенчатой схемы контрастирования и последующей обработки глутаровым альдегидом.
Пример 3.
Для изучения методом сканирующей электронной микроскопии был получен образец культуры клеток эпителия роговицы человека на поверхности культурального пластика. Решался вопрос о внутриклеточной позиции наночастиц золота, захватываемых клеткой в эксперименте. Образец промыли в изотоническом растворе NaCl. После промывки образец разместили в емкости с первым контрастирующим раствором на основе смеси гексагидрата хлорида магния, в концентрации 1,5 г/л, и гексагидрата хлорида лантана, в концентрации 18 г/л и оставили в нем на 20 минут при 37°С. Затем образец переместили в кювету с дистиллированной водой и промыли его в течение 15 секунд. После чего, переместили образец в емкость с водным раствором уксуснокислого свинца в концентрации 85 г/л и оставили в растворе на 5 минут. Финишную промывку осуществили в течение 1 минуты дистиллированной водой. Удалив с поверхности образца избыток воды, разместили образец на предметном столике микроскопа.
Сканирующая электронная микроскопия образца в режиме низкого вакуума, при ускоряющем напряжении 20 кВ, позволила получить изображения в обратнорассеянных электронах с визуализацией в каждой клетке клеточной мембраны, ядра, цитоскелета и зоны ЭПР. На изображениях было хорошо видно, что наночастицы золота сегрегируются в цитоплазме клетки, в зоне, сопряженной с ядром. Задача экспериментальной работы была решена.
Пример 4.
При удалении силиконового дренажа из слезоотводящих путей возникло подозрение о сопутствующем бактериальном поражении. Стандартные бактериологические тесты не дали положительного ответа. Было принято решение о визуальном контроле поверхности дренажа на СЭМ, с целью выявления редких микроорганизмов.
Образец промыли в изотоническом растворе NaCl. После промывки образец разместили в емкости с первым контрастирующим раствором на основе смеси шестиводного хлорида магния, в концентрации 1,8 г/л, и гексагидрата хлорида неодима, в концентрации 18 г/л и оставили в нем на 20 минут при 37°С. Затем образец переместили в кювету с дистиллированной водой и промыли его в течение 15 секунд. После этого, переместили образец в емкость со вторым контрастирующим раствором - водным раствором уксуснокислого свинца в концентрации 85 г/л и оставили в растворе на 5 минут. Финишную промывку осуществили в течение 1 минуты дистиллированной водой. Удалив с поверхности образца избыток воды, разместили образец на предметном столике микроскопа.
Сканирующая электронная микроскопия образца в режиме низкого вакуума, при ускоряющем напряжении 20 кВ, позволила получить изображения поверхности дренажа в обратнорассеянных электронах и выявила обширные биопленки с доминированием палочек. Было проведено повторное бактериологическое исследование, выявившее субпатогенные бактерии рода Буркхолдерия (Фиг. 5 - Изображение поверхности эксплантированного из слезного протока силиконового дренажа. Наблюдается обширная биопленка с доминированием палочек в составе).
Способ позволил в короткие сроки решить вопрос о бактериальной обсемененности эксплантированного объекта.
Таким образом, предложенный способ обеспечивает увеличение контрастности изображений биологических объектов в обратнорассеянных электронах с одновременным увеличением информативности изображений с расширения перечня контрастируемых элементов ультраструктуры и может использоваться при необходимости изучения объемных объектов состоящих из подложки и адгезированных на ней живых клеток, а также при изучении текущего метаболического статуса суспензионных культур.