Результат интеллектуальной деятельности: Жидкая композиция конъюгата инсулинотропного пептида длительного действия
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к жидкой композиции конъюгата инсулинотропного пептида длительного действия, содержащей фармацевтически эффективное количество конъюгата инсулинотропного пептида длительного действия, где физиологически активный пептид, представляющий собой инсулинотропный пептид, связан с Fc-областью иммуноглобулина; и свободный от альбумина стабилизатор, содержащий буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент, и способу получения этой композиции.
Предшествующий уровень техники
Диабет является заболеванием, возникающим вследствие множественных патогенетических факторов, и, как правило, выделяют два типа диабета. У пациентов с диабетом I типа, или инсулинозависимым сахарным диабетом (IDDM), вырабатывается ничтожно малое количество инсулина или вообще не вырабатывается инсулин, который является гормоном, регулирующим использование углеводов. А пациенты с диабетом II типа, или инсулиннезависимым сахарным диабетом (NIDDM), демонстрируют такой же или повышенный уровень инсулина в плазме по сравнению с пациентами без диабета. Однако у пациентов с диабетом II типа развивается резистентность к инсулину, выработка которого стимулируется глюкозой, и нарушается липидный обмен в основных чувствительных к инсулину тканях, т.е. мышечной, печеночной и жировой ткани. Хотя уровень инсулина в плазме может быть повышен, этого недостаточно, чтобы преодолеть значительную инсулинорезистентность, что, таким образом, вызывает гипергликемию. Длительная или нерегулируемая гипергликемия связана с повышенной преждевременной заболеваемостью и смертностью. Зачастую аномальное повышение уровня сахара напрямую и косвенно имеет отношение к метаболическим и гемодинамическим изменениям в заболеваниях, связанных с метаболизмом липидов, липопротеинов, аполипопротеинов и других веществ. Например, особенно пациенты с сахарным диабетом II типа имеют высокий риск развития коронарной болезни сердца, инсульта, заболевания периферических сосудов, гипертензии, нефропатии и невропатии, а также гигантской гемангиомы и микрососудистых осложнений.
Виды терапии, используемые в настоящее время для лечения диабета II типа, включают введение чужеродного инсулина, пероральное введение лекарственного средства, диетотерапию и лечебную физкультуру. В 2005, эксенатид (эксендин-4: Byetta®) был одобрен FDA (Управлением по санитарному надзору за качеством пищевых продуктов и лекарственных средств) в качестве дополнительной терапии для пациентов с диабетом II типа, у которых невозможно было достичь соответствующей регуляции уровня глюкозы даже при приеме метформина и/или сульфонилмочевины.
Эксенатид (эксендин-4) является мощным агонистом рецепторов ГПП-1 (глюкагоноподобного пептида-1) и вырабатывается в слюнной железе ящерицы. Эксендин-4 демонстрирует сродство к инсулину, сдерживает потребление пищи и опорожнение желудка и демонстрирует сродство к β-клеткам у грызунов (Parks et al., Metabolism. 50: 583-589, 2001; Aziz and Anderson, J. Nutr. 132: 990-995, 2002; и Egan et al., J. Clin. Endocrinol. Metab. 87: 1282-1290, 2002). Кроме того, поскольку глицин находится во 2 положении N-терминального конца эксендина-4, он не является субстратом для DPP IV (дипептидилпептидазы IV) в отличие от ГПП-1. Недостатком применения эксенатида является короткий период полувыведения (t1/2), который составляет только 2-4 часа, и, таким образом, его приходится инъецировать дважды в сутки (Kolterman et al., J. Clin. Endocrinol. Metab. 88: 3082-3089, 2003; и Fineman et al., Diabetes Care. 26: 2370-2377, 2003).
Пептиды, подобные вышеописанному эксенатиду, легко денатурируются или расщепляются в организме протеазами вследствие низкой стабильности и потери активности. Также размер эксенатида относительно мал, и поэтому он легко выводятся почками. Следовательно, лекарственные средства, содержащие пептиды в качестве фармацевтически активных ингредиентов, приходится вводить пациентам часто, чтобы поддерживать их заданный уровень и титр в сыворотке. Обычно пептидные лекарственные средства вводят пациентам в виде инъекции и с высокой частотой, чтобы поддерживать уровень физиологически активного пептида в сыворотке, но это причиняет много боли пациентам.
Было предпринято много попыток решить эти проблемы, и одна из них представляла собой доставку пептидного лекарственного средства в организм посредством пероральной или назальной ингаляции путем повышения биомембранной проницаемости для пептидного лекарственного средства. Однако этот способ имеет значительно более низкую эффективность доставки пептида в организм по сравнению с инъекциями. Поэтому существует еще много ограничений при поддержании активности пептидного лекарственного средства in vivo на требуемом уровне.
Между тем предпринимаются непрекращающиеся попытки максимизировать терапевтические эффекты лекарственного средства путем повышения стабильности пептидного лекарственного средства в крови и поддержания высокого уровня лекарственного средства в крови в течение длительного периода времени. Эти композиции длительного действия пептидных лекарственных средств должны способствовать повышенной стабильности пептидного лекарственного средства, а также поддерживать достаточно высокий титр самого лекарственного средства, не вызывая иммунных ответов у пациентов.
В качестве способа стабилизации пептидов и предотвращения расщепления пептидов протеазой предпринимаются многие попытки модифицировать специфическую аминокислотную последовательность, чувствительную к протеазе. Например, ГПП-1 (7-37 или 7-36, амид), который является эффективным при лечении диабета II типа посредством снижения уровня глюкозы в крови, имеет период полувыведения меньше 4 минут (Kreymann et al., 1987). Короткий период полувыведения обусловлен недостаточным титром ГПП-1 из-за расщепления пептида между аминокислотой №8 (Ala) и №9 (Asp) ГПП-1 дипептидилпептидазой IV (DPP IV). Таким образом, проводилось много исследований по разработке производных ГПП-1, обладающих устойчивостью к DPP IV, и в этих исследованиях Ala8 был заменен на Gly (Deacon et al., 1998; Burcelin et al., 1999), либо на Leu или D-Ala (Xiao et al., 2001) для повышения устойчивости к DPP IV при поддержании активности пептида. Также N-терминальная аминокислота ГПП-1, His7, является важной аминокислотой для активности ГПП-1, а также мишенью для DPP IV, и поэтому в патенте США №5545618 N-терминальная аминокислота была замещена алкильной группой или ацильной группой. Аналогично, в Gallwitz et al. His7 был N-метилирован или альфа-метилирован либо His был целиком замещен имидазолом для повышения устойчивости пептида к DPP IV при поддержании биоактивности (Baptist Gallwitz, et al., Regulatory Peptides 86, 103-111, 2000).
Помимо этих вариантов эксенатид (эксендин-4, патент США №5424686), который представляет собой производное ГПП-1, выделенное из слюнной железы ящерицы ядозуба, обладает устойчивостью к DPP IV и более высокой биоактивностью, чем ГПП-1, тем самым обладая периодом полувыведения из организма длительностью от 2 до 4 часов, что намного дольше чем у ГПП-1. Однако значительная продолжительность периода биоактивности in vivo не может быть объяснена только повышением устойчивости пептида к DPP IV. Например, имеющийся в настоящее время эксендин-4 (эксенатид) следует вводить пациентам дважды в сутки посредством инъекций, что приводит к чрезмерной нагрузке на пациентов.
Ограничение в применении этих инсулинотропных пептидов заключается в том, что размер пептида слишком мал, чтобы он накапливался в почках, и, таким образом, он легко выводится из организма. Поэтому, чтобы предотвратить выведение пептида почками, к поверхности пептида присоединяют легкорастворимую макромолекулу, такую как полиэтиленгликоль (ПЭГ).
ПЭГ неспецифически связывается со специфическим сайтом или различными сайтами целевого пептида и увеличивает молекулярную массу пептида, что затем предотвращает выведение пептида почками и гидролиз пептида, не вызывая побочных эффектов. Например, в WO 2006/076471 раскрыто, что биоактивность BNP может сохраняться при присоединении ПЭГ к натрийуретическому пептиду В-типа (BNP), который активирует выработку цГМФ (циклического гуанозинмонофосфата) посредством связывания с NPR-A (рецептором натрийуретического пептида типа А) и снижает артериальное давление, тем самым являясь эффективным в качестве терапевтического агента при застойной сердечной недостаточности. Также в патенте США №6924264 описан способ увеличения продолжительности действия эксендина-4 in vivo путем присоединения ПЭГ к остатку лизина эксендина-4. Однако, поскольку при этих способах может увеличиваться продолжительность действия in vivo пептидного лекарственного средства при увеличении молекулярной массы ПЭГ, титр пептидного лекарственного средства значительно снижается одновременно с увеличением молекулярной массы ПЭГ, а также уменьшается способность ПЭГ вступать в реакцию с пептидом, что, тем самым, снижает продуктивность.
В качестве другого способа увеличения in vivo стабильности физиологически активного пептида разработан способ получения слитого белка, где гены, кодирующие пептид и физиологически активный белок, сцеплены посредством генетической рекомбинации и культивируются клетки, трансформированные с помощью рекомбинантного гена. Например, ранее сообщалось об образующем слитый белок эксендине-4, который слит с трансферрином (Tf) посредством полипептидного линкера (заявка на патент Кореи №10-2009-7003679). Также в качестве способа применения иммуноглобулина ранее был также раскрыт белок слияния производного ГПП-1, слитого с Fc lgG4 (заявка на патент Кореи №10-2007-7014068).
Недавно в качестве длительно действующей композиции белкового и пептидного лекарственного средства, которая может способствовать минимальному снижению активности и повышенной стабильности, в патенте Кореи №10-0567902 (Физиологически активный полипептидный конъюгат, обладающий увеличенной продолжительностью действия in vivo) и патенте Кореи №10-0725315 (Белковый комплекс, полученный с использованием фрагмента иммуноглобулина, и способ его получения) раскрыт конъюгат, образованный путем объединения Fc-области иммуноглобулина, непептидильного полимера и физиологически активного полипептида.
Согласно вышеуказанному способу инсулинотропный пептид может быть использован в качестве физиологически активного полипептида для получения конъюгата инсулинотропного пептида длительного действия (патент Кореи №10-2008-0001479). Для производства лекарственного средства, содержащего конъюгат инсулинотропного пептида длительного действия, существенным является предотвращение физико-химических изменений, таких как тепловая денатурация, агрегация, адсорбция или гидролиз, вызванный светом, нагреванием или примесями во вспомогательных веществах, во время хранения и процесса доставки при одновременном поддержании эффективности in vivo. В частности, конъюгат инсулинотропного пептида длительного действия обладает большими объемом и молекулярной массой по сравнению с инсулинотропным пептидом самим по себе и, следовательно, его трудно стабилизировать.
Как правило, белки и пептиды обладают коротким периодом полувыведения и могут быть подвержены денатурации, такой как агрегация мономеров, осаждение посредством агрегации и адсорбция на поверхности контейнера, при воздействии неподходящих температур, на разделе фаз воды и воздуха, при воздействии высокого давления, физических или механических напряжений, органических растворителей и бактериальной контаминации. Денатурированные белки и пептиды теряют присущие им физико-химические свойства и физиологическую активность. Поскольку денатурация белка является в большинстве случаев необратимой, денатурированные белки и пептиды не могут восстановить присущие им свойства. Также вероятно, что белки являются нестабильными и легко подвергаются воздействию внешних факторов, таких как температура, влажность, кислород, ультрафиолетовое излучение, и, таким образом, они подвергаются физическим и химическим изменениям, включая агрегацию, полимеризацию или окисление, тем самым теряя активность.
Также адсорбированные белки и пептиды, имеют склонность к агрегации в результате денатурации, а при введении агрегированных белков и пептидов в организм они могут вызывать образование антител. Таким образом, должны вводиться достаточно стабильные белки и пептиды. В связи с этим разрабатываются различные способы предотвращения денатурации белка и пептида в растворе (John Geigert, J. Parenteral Sci. Tech., 43, No5, 220-224, 1989, David Wong, Pharm. Tech. October, 34-48, 1997, Wei Wang., Int. J. Pharm., 185, 129-188, 1999, Willem Norde, Adv. Colloid Interface Sci., 25, 267-340, 1986, Michelle et al., Int. J. Pharm. 120, 179-188, 1995).
При получении некоторых белковых и пептидных лекарственных средств используют способ лиофилизации для решения проблемы стабильности. Однако этот способ является неподходящим, поскольку лиофилизированные продукты снова приходится растворять в растворителях для инъекций перед применением, и поскольку в процесс производства вовлечен способ лиофилизации, это требует масштабных капиталовложений, например применения большого числа лиофильных сушилок. В качестве альтернативы также применяется способ получения порошкообразных форм с использованием распылительной сушилки. Однако этот способ имеет низкую экономическую ценность вследствие низкого выхода продукта и может оказывать отрицательный эффект на стабильность продукта, поскольку белки подвергаются воздействию высокой температуры.
В качестве альтернативного пути для преодоления этих ограничений в других исследованиях пробовали добавлять стабилизаторы к раствору белка и пептида для предотвращения физико-химических изменений белкового лекарственного средства при поддержании его эффективности in vivo во время длительного хранения. В качестве стабилизаторов для различных белковых лекарственных средств широко используется один из видов белка, человеческий сывороточный альбумин, и его эффективность подтверждена (Edward Tarelli et al., Biologicals (1998) 26, 331-346).
Очистка человеческого сывороточного альбумина включает инактивацию биологических контаминантов, таких как микоплазма, прионы, бактерии и вирусы, либо скрининг или контроль одного или более чем одного биологического контаминанта или патогенна, но даже с помощью этих способов такие контаминанты не могут быть удалены или инактивированы полностью. Поэтому пациенты могут быть подвергнуты воздействию этих биологических контаминантов или патогенов при введении человеческого сывороточного альбумина. Например, хотя способ скрининга включает контроль некоторых вирусов в образце крови донора, способ контроля не всегда надежен, и с его помощью невозможно определить некоторые вирусы, которые присутствуют в небольшом количестве.
Из-за своих химических различий разные белки могут быть инактивированны постепенно с различной скоростью в различных условиях во время хранения. То есть увеличение длительности хранения с помощью стабилизатора не является одинаковым для различных белков. По этой причине подходящее соотношение, концентрация и вид стабилизаторов, которые используют для улучшения стабильности белков при хранении, изменяются в зависимости от физико-химических свойств белка-мишени. Кроме того, когда различные стабилизаторы используют совместно, они могут вызывать нежелательные эффекты, отличные от требуемых эффектов, вследствие конкурентного взаимодействия и побочных эффектов. Также во время хранения свойства хранящегося белка или его концентрация могут измениться, тем самым вызывая другие эффекты.
Поэтому предпринимается множество попыток и мер предосторожности для стабилизации белков в растворе. В частности, конъюгат инсулинотропного пептида длительного действия, обладающий увеличенной продолжительностью действия и стабильностью in vivo, имеет форму инсулинотропного пептида, объединенного с Fc-областью иммуноглобулина, и, таким образом, он имеет молекулярную массу и объем, значительно отличающиеся от обычного инсулинотропного пептида. Поэтому для стабилизации белка требуется особая композиция. Также инсулинотропный пептид и Fc-область иммуноглобулина являются пептидами или белками, отличающимися физико-химическими свойствами, и, следовательно, их следует стабилизировать одновременно. Однако, как описано выше, различные пептиды или белки могут быть инактивированы постепенно с различной скоростью в различных условиях во время хранения вследствие физико-химических различий между ними. Также, когда стабилизаторы, которые подходят для каждого пептида или белка используются совместно, они могут вызывать нежелательные эффекты, отличные от требуемых эффектов, вследствие конкурентного взаимодействия и побочных эффектов. Поэтому в отношении конъюгата инсулинотропного пептида длительного действия крайне сложно найти композицию стабилизаторов, которая могла бы одновременно стабилизировать как инсулинотропный пептид, так и Fc-область иммуноглобулина.
В последнее время разрабатывается композиция белка и пептида, который может быть использован многократно для удобства пациента. Однако композиция, предназначенная для многократного применения, должна содержать консервант для предотвращения микробной контаминации после повторных введений и до окончательной утилизации. Композиция для многократного применения, содержащая консервант, имеет несколько преимуществ по сравнению с композицией для однократного применения. Например, в случае композиции для однократного применения большое количество лекарственного средства остается неиспользованным в зависимости от различий в дозировке. Но при использовании композиции для многократного применения количество неиспользованного продукта может быть снижено. Более того, композиция для многократного применения может быть использована несколько раз без контроля микробного роста в пределах определенного периода, и поскольку она может поставляться в отдельном контейнере, упаковка может быть минимизирована, что приводит к экономическим преимуществам.
Однако применение консерванта может повлиять на стабильность белка. Наиболее известной проблемой при применении консерванта является проблема осаждения. Осаждение белка может снижать терапевтические эффекты лекарственного средства и при введении в организм может вызывать неожиданный иммунный ответ. Поэтому крайне важно выбрать вид и соответствующую концентрацию консерванта, чтобы поддерживать способность предотвращать микробную контаминацию, не оказывая при этом влияния на стабильность белка.
Описание изобретения
Техническая проблема
С целью представления стабильной жидкой композиции конъюгата инсулинотропного пептида длительного действия, которая может сохранять конъюгат инсулинотропного пептида длительного действия без риска вирусной контаминации в течение длительного периода времени, в настоящем изобретение установлено, что композиция, которая повышает стабильность конъюгата инсулинотропного пептида длительного действия, может быть предложена при использовании стабилизатора, содержащего буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент, или дополнительно метионин, и что композиция может быть использована многократно, когда композиция дополнительно содержит консервант, что дает эффективную с экономической точки зрения и стабильную жидкую композицию.
Решение проблемы
Одна задача настоящего изобретения заключается в том, чтобы предложить жидкую композицию конъюгата инсулинотропного пептида длительного действия, содержащую фармацевтически эффективное количество конъюгата инсулинотропного пептида длительного действия, где физиологически активный пептид, т.е. инсулинотропный пептид, связан с Fc-областью иммуноглобулина; и свободный от альбумина стабилизатор, содержащий буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент.
Другая задача настоящего изобретения заключается в том, чтобы предложить жидкую композицию конъюгата инсулинотропного пептида длительного действия для многократного введения, дополнительно содержащую консервант в дополнение к конъюгату инсулинотропного пептида и свободному от альбумина стабилизатору.
Другая задача настоящего изобретения заключается в том, чтобы предложить способ получения жидкой композиции конъюгата инсулинотропного пептида длительного действия.
Полезные эффекты изобретения
Поскольку жидкая композиция конъюгата инсулинотропного пептида длительного действия по настоящему изобретению содержит буфер, изотонический агент, сахарный спирт и неионное поверхностно-активное вещество, или дополнительно метионин, но свободна от человеческого сывороточного альбумина и других потенциально опасных для организма факторов, поэтому риск вирусной контаминации отсутствует. Также она может обеспечить отличную стабильность при хранении конъюгата инсулинотропного пептида длительного действия, который содержит инсулинотропный пептид и Fc-область иммуноглобулина, обладая более высокой молекулярной массой и увеличенной продолжительностью физиологической активности in vivo по сравнению с белком дикого типа. Такая жидкая композиция по настоящему изобретению может обеспечить отличную стабильность при хранении в случае простой композиции и обеспечить пептидное лекарственное средство, более эффективное с экономической точки зрения по сравнению с композицией, содержащей другой стабилизатор или полученной лиофильной сушкой.. Если в композицию добавляют консервант, композиция может быть использована многократно. Также композиция по настоящему изобретению может сохранять активность белка в организме в течение более длительного периода времени по сравнению с традиционной композицией инсулинотропного пептида, и, таким образом, ее можно использовать в качестве эффективной лекарственной композиции.
Описание графических материалов
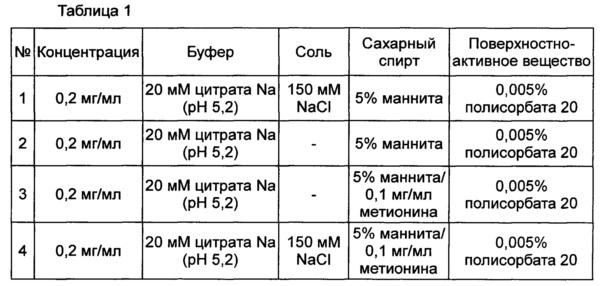
На Фиг. 1 представлен график, демонстрирующий анализ стабильности пептида путем ОФ-ВЭЖХ в выбранной в итоге жидкой композиции при значении рН 5,2 (жидкая композиция №1); в жидкой композиции, полученной путем внесения конъюгата инсулинотропного пептида длительного действия в композицию стабилизатора жидкой композиции имеющегося в продаже лекарственного средства на основе инсулинотропного пептида, эксенатида, т.е. эксендина-4 (Byetta) (жидкая композиция №2); в жидкой композиции, полученной путем внесения конъюгата инсулинотропного пептида длительного действия в композицию стабилизатора жидкой композиции лекарственного средства на основе слитого белка, содержащего иммуноглобулин, этанерцепта (слитый белок TNFR (рецептор фактора некроза опухоли) - Fc, энбрел) (жидкая композиция №3); и в контрольной группе (жидкая композиция №4), все из которых хранили при 25±2°C в течение 8 недель.
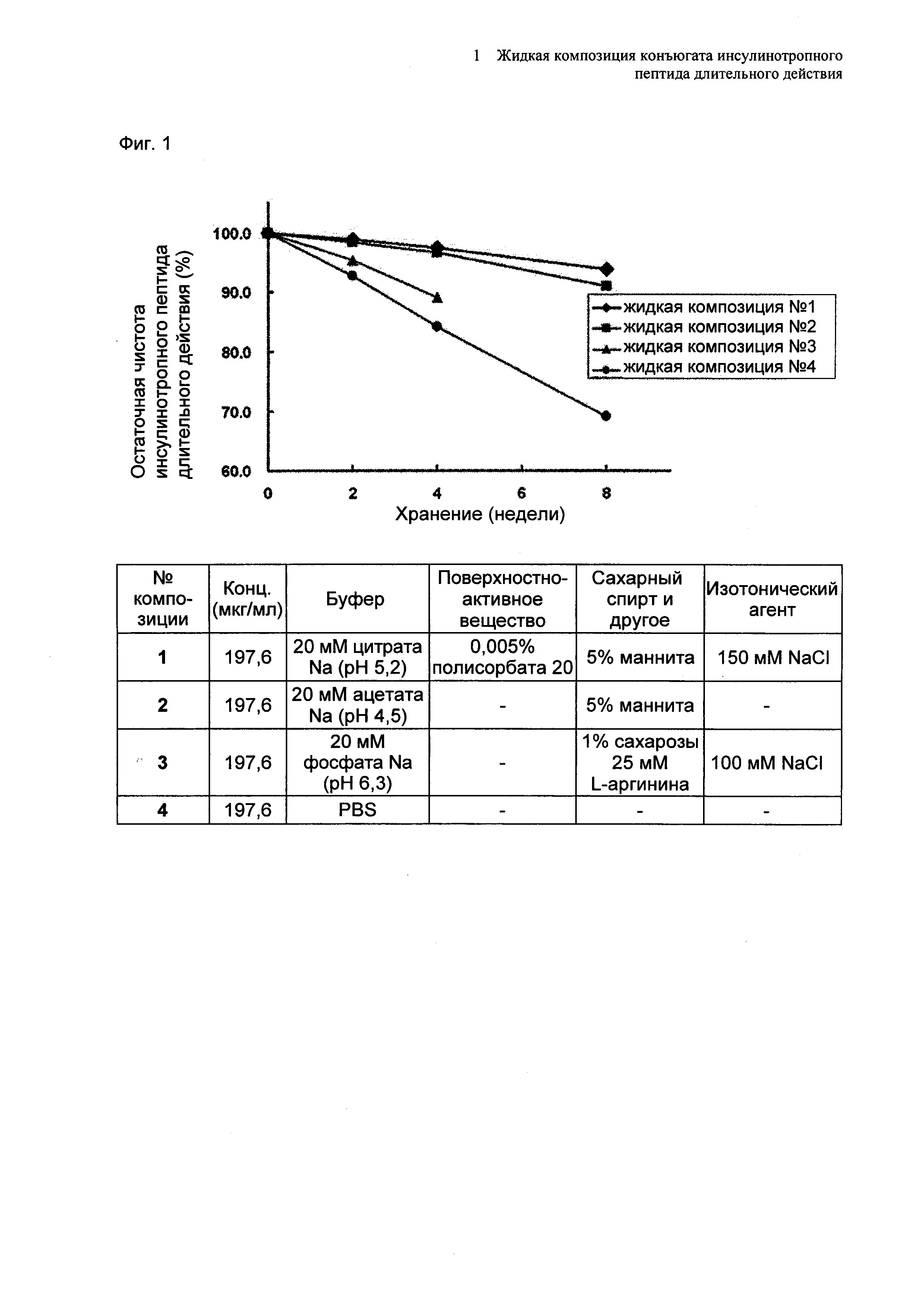
На Фиг. 2 представлен график, демонстрирующий анализ доли окисленного конъюгата инсулинотропного пептида длительного действия путем ОФ-ВЭЖХ в выбранной в итоге жидкой композиции, не содержащей метионина, при значении рН 5,2 (жидкая композиция №1) и в жидкой композиции, содержащей метионин, при значении pH 5,2 (жидкая композиция №2) при хранении их при 25±2°C и при 40±2°C в течение 4 недель.
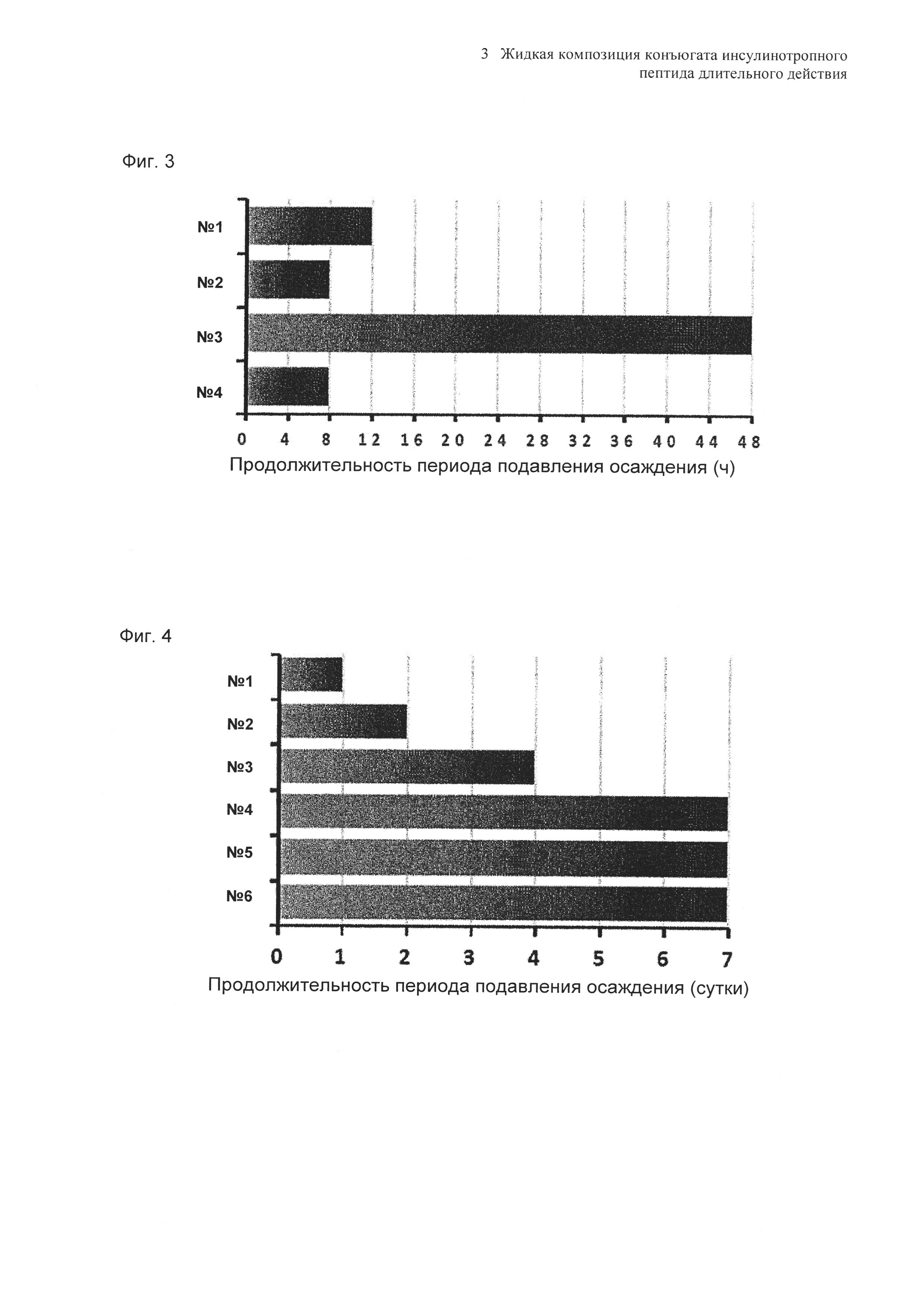
На Фиг. 3 показаны результаты контроля невооруженным глазом случаев проявления осаждения в композициях конъюгата инсулинотропного пептида длительного действия согласно таблице 18 при 40°C в течение 48 часов. Продолжительность периода отсутствия осаждения показывает время, в течение которого не происходило осаждения белка после хранения пептида.
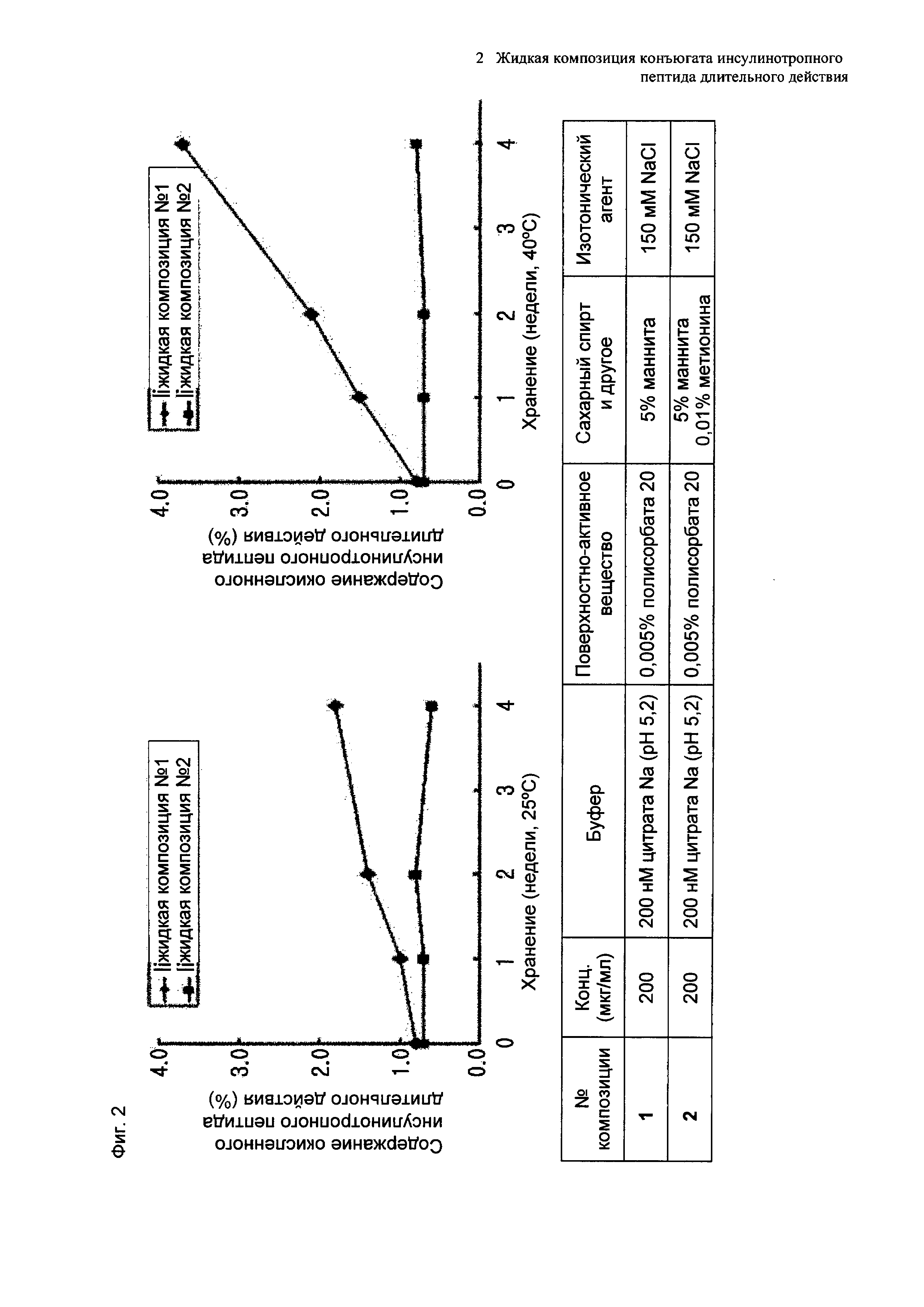
На Фиг. 4 показаны результаты контроля невооруженным глазом случаев проявления осаждения в композициях конъюгата инсулинотропного пептида длительного действия согласно таблице 19 при 40°C в течение 7 суток. Продолжительность периода отсутствия осаждения показывает время, в течение которого не происходило осаждения белка после хранения пептида.
Лучший способ осуществления изобретения
В одном аспекте согласно настоящему изобретению предложена жидкая композиция конъюгата инсулинотропного пептида длительного действия, содержащая фармацевтически эффективное количество конъюгата инсулинотропного пептида длительного действия, где инсулинотропный пептид связан с Fc-областью иммуноглобулина; и свободный от альбумина стабилизатор, содержащий буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент.
Кроме того, согласно настоящему изобретению предложена жидкая композиция конъюгата инсулинотропного пептида длительного действия для многократного введения, дополнительно содержащая консервант в дополнение к конъюгату инсулинотропного пептида и свободному от альбумина стабилизатору.
Использованный в данной заявке термин "конъюгат инсулинотропного пептида длительного действия" относится к конъюгату, где физиологически активный инсулинотропный пептид, включающий производное, вариант, предшественник и фрагмент, и Fc-область иммуноглобулина связаны между собой, и он может дополнительно относится к конъюгату, обладающему повышенной продолжительностью in vivo физиологической активности по сравнению с инсулинотропным пептидом дикого типа.
Использованный в данной заявке термин "длительного действия" относится к увеличению продолжительности физиологической активности по сравнению с диким типом. Термин "конъюгат" относится к форме, где инсулинотропный пептид и Fc-область иммуноглобулина объединены.
Инсулинотропный пептид, использованный в настоящем изобретении, обладает функцией секретирования инсулина и стимулирует синтез и экспрессию инсулина в В-клетках поджелудочной железы. Вид инсулинотропного пептида включает предшественник, агонист, производные, фрагменты и варианты. Предпочтительно, инсулинотропный пептид может представлять собой глюкагоноподобный пептид-1 (ГПП-1), глюкагоноподобный пептид-2 (ГПП-2), эксендин-3, эксендин-4 и имидазоацетил(СА)-эксендин-4, и более предпочтительно имидазоацетил(СА)-эксендин-4. Может быть использован любой инсулинотропный пептид, или нативный, или рекомбинантный, и предпочтительно он представляет собой рекомбинантный инсулинотропный пептид, полученный с использованием Е. coli в качестве клетки-хозяина. При условии, что на его биологическую активность не оказывается значительного влияния любые его производные, которые получены путем замены, делеции или инсерции аминокислот, могут быть использованы в настоящем изобретении.
Последовательность инсулинотропного пептида может быть получена из известной базы данных, такой как GenBank Национального центра биотехнологической информации (NCBI), и он может обладать 70% или более, предпочтительно 80% или более, более предпочтительно 90% или более, и даже более предпочтительно 95% или более, и наиболее предпочтительно 98% или более гомологией последовательностей с белком дикого типа, поскольку он демонстрирует активность инсулинотропного пептида.
Более того, Fc иммуноглобулина, применимая в настоящем изобретении, может представлять собой Fc человеческого иммуноглобулина или ее близкородственный аналог либо Fc иммуноглобулина, имеющего происхождение из животных, таких как корова, козы, свиньи, мыши, кролики, хомяки, крысы и морские свинки. Кроме того, Fc-область иммуноглобулина может иметь происхождение из IgG, IgA, IgD, IgE, IgM или их комбинации или гибрида. Предпочтительно Fc-область иммуноглобулина имеет происхождение из IgG или IgM, которые преобладают в крови человека, и наиболее предпочтительно имеет происхождение из IgG, который, как известно, увеличивает период полувыведения лиганд-связывающего белка. Также Fc-область иммуноглобулина может представлять собой димер или мультимер одноцепочечных иммуноглобулинов, имеющих домены одинакового происхождения. Fc иммуноглобулина может быть образована посредством обработки нативного IgG определенной протеазой или с помощью трансформированных клеток с использованием метода генетической рекомбинации. Предпочтительно Fc иммуноглобулина представляет собой Fc рекомбинантного иммуноглобулина человека, полученного из Е. coli.
Между тем IgG могут быть подразделены на подклассы IgG1, IgG2, IgG3 и IgG4, и в настоящем изобретении могут быть использованы их комбинация или гибрид. Предпочтительными являются подклассы IgG2 и IgG4, а наиболее предпочтительным является Fc-область IgG4, который редко обладает эффекторной функцией, такой как комплемент-зависимая цитотоксичность (CDC). То есть в качестве носителя лекарственного средства по настоящему изобретению наиболее предпочтительной Fc-областью иммуноглобулина является негликозилированная Fc-область, имеющая происхождение из человеческого IgG4. Fc-область, имеющая происхождение из иммуноглобулина человека, является более предпочтительной, чем Fc-область иммуноглобулина нечеловеческого происхождения, которая может действовать как антиген в организме человека и вызывать нежелательные иммунные ответы, такие как выработка нового антитела.
Конъюгат инсулинотропного пептида длительного действия, используемый в настоящем изобретении, получают посредством объединения синтезированного инсулинотропного пептида и Fc-области иммуноглобулина. Способом их объединения может служить перекрестное сшивание инсулинотропного пептида и Fc-области иммуноглобулина посредством непептидильного полимера или получение слитого белка, в котором инсулинотропный пептид и Fc-область иммуноглобулина связаны посредством генетической рекомбинации.
Непептидильный полимер, используемый для перекрестного сшивания, может быть выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимеров этиленгликоля и пропиленгликоля, полиоксиэтилированных полиолов, поливинилового спирта, полисахаридов, декстрана, поливинилэтилового эфира, биоразлагаемых полимеров, таких как PLA (полимолочная кислота) и PLGA (поли(молочная-гликолевая) кислота), липидных полимеров, хитинов, гиалуроновой кислоты и их комбинации. Предпочтительно можно использовать полиэтиленгликоль, но им не ограничиваются. Также в объем настоящего изобретения включены их производные, хорошо известные в данной области техники, и производные, которые легко могут быть получены с использованием способа, известного в данной области техники.
При получении конъюгата инсулинотропного пептида длительного действия, используемого в настоящем изобретении, можно опираться на патент Кореи №10-0725315, патент Кореи №10-2009-0008151 и патент Кореи №10-1058290. Специалисты в данной области техники могут получить конъюгат инсулинотропного пептида длительного действия по настоящему изобретению, опираясь на эти ссылочные материалы.
Жидкая композиция конъюгата инсулинотропного пептида длительного действия по настоящему изобретению содержит конъюгат инсулинотропного пептида длительного действия в терапевтически эффективном количестве. Как правило, терапевтически эффективное количество инсулинотропного пептида, особенно эксендина-4 (Byetta), относится к 250 мкг в шприц-ручке. Концентрация конъюгата инсулинотропного пептида длительного действия, используемого в настоящем изобретении, находится в пределах от 0,1 мг/мл до 200 мг/мл и предпочтительно от 0,5 мг/мл до 150 мг/мл. Инсулинотропный пептид может предпочтительно представлять собой конъюгат СА-эксендин-4 длительного действия. Жидкая композиция конъюгата инсулинотропного пептида длительного действия по настоящему изобретению может стабильно поддерживать конъюгат без осаждения, не только когда конъюгат инсулинотропного пептида находится в низкой концентрации, но также и тогда, когда он находится в высокой концентрации. Поэтому композиция по настоящему изобретению может стабильно обеспечивать инсулинотропный пептид в организме в высокой концентрации.
Используемый в данной заявке термин "стабилизатор" относится к веществу, которое делает возможным стабильное хранение конъюгата инсулинотропного пептида длительного действия. Термин "стабилизация" относится к состоянию, когда потеря активного ингредиента составляет меньше некоторого количества, типично меньше 10% в течение определенного периода и в конкретных условиях хранения. Композиция считается стабильной композицией, когда остаточная чистота конъюгата инсулинотропного пептида длительного действия в ней составляет 90% или более, и более предпочтительно от 92 до 95%, после хранения при 5±3°C в течение 2 лет, при 25±2°C в течение 6 месяцев или при 40±2°C в течение 1-2 недель. Что касается белков, подобных конъюгатам инсулинотропного пептида длительного действия, то их стабильность при хранении важна для обеспечения точной дозировки, а также для подавления возможного образования антигенных веществ к конъюгату инсулинотропного пептида длительного действия. Во время хранения 10%-ная потеря конъюгата инсулинотропного пептида длительного действия допустима для введения вещества, если это не вызывает образования агрегатов или фрагментов в композиции, приводящих к образованию антигенных соединений.
Стабилизатор по настоящему изобретению предпочтительно содержит буфер, сахарный спирт, изотонический агент, такой как хлорид натрия, и неионное поверхностно-активное вещество, и более предпочтительно дополнительно содержит метионин для стабилизации конъюгата инсулинотропного пептида длительного действия.
Буфер осуществляет поддержание pH раствора с целью предотвращения резких изменений значения pH в жидкой композиции для стабилизации конъюгата инсулинотропного пептида длительного действия. Буфер может включать соль щелочного металла (фосфат натрия или калия или их гидраты или дигидраты), цитрат натрия/лимонную кислоту, ацетат натрия/уксусную кислоту, гистидин/гидрохлорид гистидина, любой другой фармацевтически приемлемый регулирующий pH буфер, известный в данной области техники, и их комбинацию. Предпочтительный пример такого буфера включает цитратный буфер, ацетатный буфер и гистидиновый буфер. Концентрация буфера составляет предпочтительно от 5 мМ до 100 мМ, более предпочтительно от 10 мМ до 50 мМ. Значение pH буфера составляет предпочтительно от 4,0 до 7,0, более предпочтительно от 5,0 до 7,0, даже более предпочтительно от 5,2 до 7,0, и еще более предпочтительно от 5,2 до 6,0.
Сахарный спирт действует, повышая стабильность конъюгата инсулинотропного пептида длительного действия. Концентрация сахарного спирта, используемого в настоящем изобретении, составляет предпочтительно от 1 до 20% (масс/об.) от общего объема раствора, более предпочтительно от 3 до 10% (масс/об.) от общего объема раствора. Сахарный спирт может представлять собой один или более чем один спирт, выбранный из группы, состоящей маннита, сорбита и сахарозы, но не ограничивается ими.
Изотонический агент действует, поддерживая подходящее осмотическое давление, при введении конъюгата инсулинотропного пептида длительного действия в виде раствора в организм, а также действует, стабилизируя конъюгат инсулинотропного пептида длительного действия в растворе. Осмотическое давление композиции регулируют так, чтобы она была изотонична крови. Эти изотонические жидкие композиции имеют осмотическое давление в основном примерно 300 мОсм/кг. Типичный пример изотонического агента включает сахарный спирт, растворимую в воде неорганическую соль и аминокислоту, а предпочтительным примером является растворимая в воде неорганическая соль, т.е. хлорид натрия. Концентрация хлорида натрия в качестве изотонического агента составляет предпочтительно от 0 до 150 мМ, и ее можно регулировать в зависимости от вида и количества компонентов, включенных в композицию, так, чтобы жидкая композиция, включающая смесь всех компонентов, стала изотонической.
Неионное поверхностно-активное вещество снижает поверхностное натяжение раствора белка, предотвращая абсорбцию или агрегацию белков на гидрофобной поверхности. Примеры неионного поверхностно-активного вещества, применимого в настоящем изобретении, включают полисорбаты, полоксамеры и их комбинации, преимущественно полисорбаты. Среди неионных поверхностно-активных веществ, представляющих собой полисорбаты, находятся полисорбат 20, полисорбат 40, полисорбат 60 и полисорбат 80. Наиболее предпочтительным неионным поверхностно-активным веществом является полисорбат 20.
Неприемлемо использовать неионное поверхностно-активное вещество в высокой концентрации в жидкой композиции, и это обусловлено тем, что неионное поверхностно-активное вещество в высокой концентрации вызывает помехи при измерении концентрации белка и определении стабильности белка посредством аналитических способов, таких как УФ-спектроскопия или изоэлектрическое фокусирование, затрудняя тем самым точную оценку стабильности белка. Поэтому жидкая композиция по настоящему изобретению содержит неионное поверхностно-активное вещество предпочтительно в низкой концентрации не более чем 0,2% (масс/об.), более предпочтительно в концентрации от 0,001% до 0,05% (масс/об.).
Согласно одному примеру по настоящему изобретению было продемонстрировано, что при добавлении в качестве изотонического агента хлорида натрия в присутствии буфера, сахарного спирта и неионного поверхностно-активного вещества стабильность при хранении конъюгата инсулинотропного пептида длительного действия в низкой концентрации значительно возрастала. Это показывает, что применение хлорида натрия в качестве изотонического агента совместно с буфером, сахарным спиртом и неионным поверхностно-активным веществом вызывает синергические эффекты, тем самым обеспечивая высокую стабильность конъюгата инсулинотропного пептида длительного действия. Однако, что касается конъюгата инсулинотропного пептида длительного действия в высокой концентрации, при исключении хлорида натрия предотвращалось наступление осаждения и растворимость белка улучшалась. Эти результаты означают, что при использовании хлорида натрия в качестве изотонического агента его содержание можно регулировать в соответствии с концентрацией конъюгата инсулинотропного пептида длительного действия.
Кроме того, было подтверждено, что конъюгат инсулинотропного пептида длительного действия в низкой концентрации является наиболее стабильным в буфере при значении pH 5,2, тогда как конъюгат инсулинотропного пептида длительного действия в высокой концентрации является наиболее стабильным в буфере при значении pH 5,4 или 5,6. Таким образом, было определено, что pH буфера можно соответствующим образом регулировать в зависимости от концентрации конъюгата.
Метионин, содержащийся в стабилизаторе по настоящему изобретению, подавляет образование примесей, которые могут встречаться вследствие окисления белка в растворе, стабилизируя целевой белок еще больше. Концентрация метионина составляет от 0,005 до 0,1% (масс/об.) от общего объема раствора, предпочтительно от 0,01 до 0,1% (масс/об.).
Предпочтительно, чтобы стабилизатор по настоящему изобретению не содержал альбумина. Поскольку человеческий сывороточный альбумин, пригодный в качестве стабилизатора белка, получают из сыворотки человека, всегда есть вероятность, что он может быть контаминирован патогенными вирусами человеческого происхождения. Желатин или бычий сывороточный альбумин могут вызывать заболевания или могут иметь тенденцию вызывать аллергическую реакцию у некоторых пациентов. Вероятность вызвать вирусную контаминацию стабилизатором по настоящему изобретению, свободным от гетерологичных белков, таких как сывороточные альбумины человеческого или животного происхождения или очищенный желатин, отсутствует.
Кроме того, стабилизатор по настоящему изобретению может дополнительно содержать сахара, полиспирт или аминокислоты. Предпочтительные примеры сахаров, которые могут быть дополнительно добавлены для повышения стабильности конъюгата инсулинотропного пептида длительного действия при хранении, включают моносахариды, такие как манноза, глюкоза, фукоза и ксилоза, и полисахариды, такие как лактоза, мальтоза, сахароза, рафиноза и декстран. Предпочтительные примеры полиспирта включают пропиленгликоль, низкомолекулярный полиэтиленгликоль, глицерин, низкомолекулярный полипропиленгликоль и их комбинацию.
Жидкая композиция по настоящему изобретению в дополнение к вышеописанным конъюгату, буферу, изотоническому агенту, сахарному спирту и неионному поверхностно-активному веществу, или дополнительно метионину, может дополнительно содержать консервант с целью предотвращения микробной контаминации в композиции для многократного применения.
Использованный в данной заявке термин "консервант" относится к соединению, которое добавляют в фармацевтическую композицию в качестве антимикробного агента. Пример консерванта включает бензетоний, хлоргексидин, фенол, мета-крезол, бензиловый спирт, метилпарабен, пропилпарабен, хлорбутанол, орто-крезол, пара-крезол, хлоркрезол, бензалкония хлорид, нитрат фенилртути, тиомерсал и бензойную кислоту, но не ограничивается ими. Один вид консерванта может быть использован отдельно, или же может быть использована произвольная комбинация двух или более видов консервантов. Предпочтительно жидкая композиция по настоящему изобретению в качестве консерванта может содержать один или более чем один из мета-крезола, фенола и бензилового спирта.
Жидкая композиция по настоящему изобретению может содержать от 0,001% до 1% (масс./об.) консерванта, и предпочтительно от 0,001% до 0,5% (масс./об.) консерванта, и более предпочтительно от 0,001 до 0,25% (масс./об.) консерванта.
В одном примере по настоящему изобретению в качестве консерванта добавляли 0,22% (масс./об.) мета-крезола в жидкую композицию по настоящему изобретению и оценивали действие крезола на стабильность конъюгата инсулинотропного пептида. В результате было установлено, что конъюгат в композиции, в которую добавлен консервант, остается стабильным и не осаждается. Поэтому жидкая композиция конъюгата инсулинотропного пептида по настоящему изобретению, которая содержит консервант в дополнение к стабилизатору, может быть использована для многократного введения.
Жидкая композиция по настоящему изобретению в дополнение к вышеописанным буферу, изотоническому агенту, сахарному спирту и неионному поверхностно-активному веществу, или дополнительно метионину и консерванту, может дополнительно содержать по выбору другие вещества и материалы, известные в данной области техники при условии, что они не оказывают влияния на действие жидкой композиции по настоящему изобретению.
Свободная от альбумина жидкая композиция конъюгата инсулинотропного пептида длительного действия по настоящему изобретению, обеспечивающий стабильность конъюгата инсулинотропного пептида длительного действия, не несет в себе риска вирусной контаминации, обеспечивая при этом отличную стабильность при хранении в случае простой композиции, и, таким образом, может быть обеспечена композиция по настоящему изобретению, более эффективная с экономической точки зрения по сравнению с композицией, содержащей другой стабилизатор или полученной лиофильной сушкой.
Также, поскольку жидкая композиция по настоящему изобретению содержит конъюгат инсулинотропного пептида длительного действия, который обладает увеличенной продолжительностью физиологической активности по сравнению с диким типом, она может быть использована в качестве эффективной лекарственной композиции при поддержании активности белка в организме в течение более длительного периода по сравнению с традиционной композицией инсулинотропного пептида. Также жидкая композиция по настоящему изобретению обеспечивает отличную стабильность при хранении конъюгата инсулинотропного пептида длительного действия в высокой концентрации, а также в низкой концентрации.
В качестве другого аспекта согласно настоящему изобретению предложен способ получения жидкой композиции по настоящему изобретению.
Стабильная жидкая композиция конъюгата инсулинотропного пептида длительного действия может быть получена посредством образования конъюгата инсулинотропного пептида длительного действия и смешивания образованного конъюгата инсулинотропного пептида длительного действия со стабилизатором, содержащим буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент. Также для многократного применения стабильная жидкая композиция конъюгата инсулинотропного пептида длительного действия может быть образована посредством дополнительного введения в смесь консерванта в дополнение к стабилизаторам.
Способ осуществления изобретения
В дальнейшем настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако эти примеры представлены только с иллюстративной целью и не предназначены для ограничения изобретения.
Пример 1: оценка стабильности конъюгата инсулинотропного пептида длительного действия в присутствии или в отсутствие изотонического агента, такого как соль
Стабильность конъюгата инсулинотропного пептида длительного действия (15,41 мкг/мл (СА)-эксендина-4, номинальная концентрация) оценивали в присутствии или в отсутствие хлорида натрия в качестве изотонического агента в композиции, содержащей буфер, сахарный спирт и неионное поверхностно-активное вещество в качестве стабилизатора; и в композиции, содержащей буфер, сахарный спирт, неионное поверхностно-активное вещество и метионин в качестве стабилизатора. С этой целью конъюгат инсулинотропного пептида длительного действия хранили при 25°C и 40°C в течение 0-4 недель в составе следующих композиций, указанных в таблице 1, и затем анализировали стабильность конъюгата посредством обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) и эксклюзионной высокоэффективной жидкостной хроматографии (Э-ВЭЖХ). В качестве буфера использовали цитратный буфер, в качестве сахарного спирта использовали маннит, а в качестве неионного поверхностно-активного вещества использовали полисорбат 20. В таблицах 2 и 3 результаты ОФ-ВЭЖХ (%) и Э-ВЭЖХ (%) представлены в виде величины "% площади/% исходной площади", демонстрирующей остаточную чистоту конъюгата инсулинотропного пептида длительного действия в сравнении с исходной чистотой. В таблице 2 показана остаточная чистота конъюгата инсулинотропного пептида длительного действия после хранения при 25°C, а в таблице 3 показана остаточная чистота конъюгата инсулинотропного пептида длительного действия после хранения при 40°C.
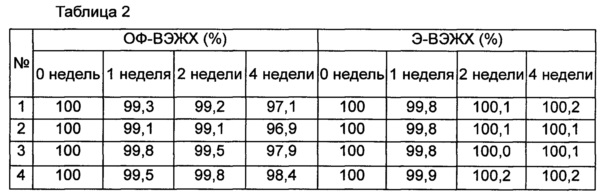
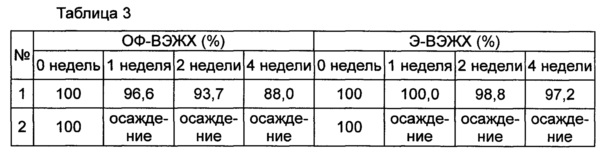

На основании сравнения между исследуемыми группами №1 и №2 и между №3 и №4 в таблицах 2 и 3 очевидно, что при хранении жидкой композиции конъюгата инсулинотропного пептида длительного действия при 25°C и 40°C, особенно при 40° в течение 4 недель, и в присутствии в качестве изотонического агента NaCl, в частности 150 мМ NaCl, стабильность конъюгата инсулинотропного пептида длительного действия сохранялась на весьма высоком уровне (таблицы 2 и 3).
Пример 2: оценка стабильности конъюгата инсулинотропного пептида длительного действия при различных значениях pH буфера
Хотя значение pH обычного жидкого белкового лекарственного средства находится в диапазоне от 5 до 7, значение pH жидкой композиции эксендина-4 (Byetta), лекарственного средства на основе инсулинотропного пептида, составляет 4,5, что ниже, чем обычный диапазон рН. Поэтому в этом примере влияние pH буфера на стабильность конъюгата изучали на примере конъюгата инсулинотропного пептида длительного действия, содержащего инсулинотропный пептид и Fc белка иммуноглобулина, предпочтительно конъюгат имидазоацетил(СА)-эксендин-4 длительного действия.
В качестве буфера использовали цитратный буфер, в качестве сахарного спирта использовали маннит, в качестве изотонического агента использовали хлорид натрия, а в качестве неионного поверхностно-активного вещества использовали полисорбат 80. Следующие композиции, показанные в таблице 4, использовали в качестве стабилизатора конъюгата инсулинотропного пептида длительного действия. Затем композиции конъюгата инсулинотропного пептида длительного действия хранили при 25±2°C в течение 4 недель, и их стабильность анализировали посредством эксклюзионной хроматографии (Э-ВЭЖХ) и обращенно-фазовой хроматографии (ОФ-ВЭЖХ). Результаты ОФ-ВЭЖХ (%) и Э-ВЭЖХ (%) в таблице 5 представлены в виде величины "% площади/% исходной площади", демонстрирующей остаточную чистоту конъюгата инсулинотропного пептида длительного действия в сравнении с исходной чистотой.
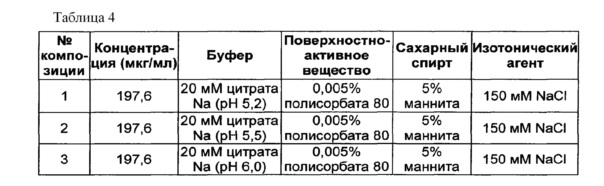
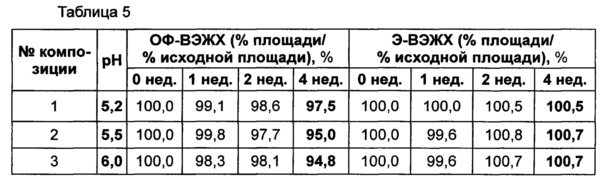
Как показано выше, когда в вышеуказанной жидкой композиции значение pH составляло 5,2, конъюгат инсулинотропного пептида длительного действия был наиболее стабилен (таблица 5).
Пример 3: оценка стабильности конъюгата инсулинотропного пептида длительного действия в зависимости от вида и концентрации неионного поверхностно-активного вещества
Стабильность конъюгата инсулинотропного пептида длительного действия исследовали, используя различные виды и концентрации полисорбата, который представляет собой неионное поверхностно-активное вещество в составе стабилизатора по настоящему изобретению.
Неионные поверхностно-активные вещества, т.е. полисорбат 80 и полисорбат 20, исследовали в двух концентрациях - 0,005% и 0,01%. Композиция стабилизатора содержит буфер, сахарный спирт и изотонический агент, а также поверхностно-активное вещество, используемые в вышеуказанном примере для обеспечения стабильности конъюгата инсулинотропного пептида длительного действия. В качестве буфера использовали цитратный буфер с pH 5,2, который продемонстрировал высокую стабильность в примере 2, в качестве сахарного спирта использовали маннит, а в качестве изотонического агента использовали хлорид натрия.
Следующие композиции, показанные в таблице 6, использовали в качестве стабилизатора конъюгата инсулинотропного пептида длительного действия, предпочтительно конъюгата СА-эксендин-4 длительного действия. Затем композиции хранили при 25±2°C в течение 8 недель, и их стабильность анализировали посредством ОФ-ВЭЖХ и Э-ВЭЖХ. Результаты ОФ-ВЭЖХ (%) и Э-ВЭЖХ (%) в таблице 7 представляют остаточную чистоту конъюгата инсулинотропного пептида длительного действия в сравнении с исходной частотой.
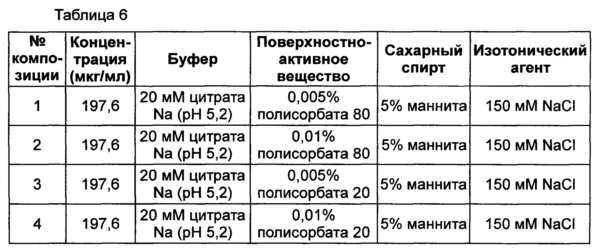
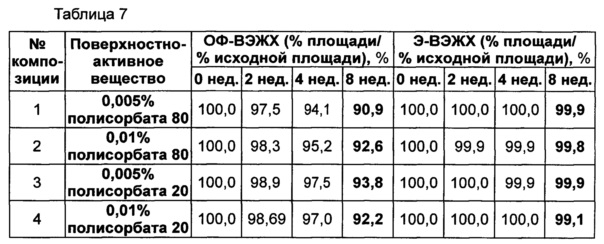
Как показано выше на основании результатов анализа Э-ВЭЖХ, стабильность конъюгата инсулинотропного пептида длительного действия была практически одинаковой, даже когда использовали различные виды и концентрации полисорбатов. Однако на основании результатов анализа ОФ-ВЭЖХ было отмечено, что при использовании полисорбата 20 стабильность конъюгата пептида была сходной или выше, чем стабильность при использовании такой же концентрации полисорбата 80. Также стабильность конъюгата инсулинотропного пептида длительного действия была выше в жидкой композиции, содержащей 0,005% полисорбата 20, по сравнению с композицией, содержащей 0,01% полисорбата 20 (таблица 7).
Пример 4: сравнение стабильности выбранного в итоге жидкой композиции конъюгата инсулинотропного пептида длительного действия и имеющейся в продаже жидкой композиции белкового или пептидного лекарственного средства, содержащего этот же конъюгат
В данном примере оценивали стабильность композиции, которая была отобрана в результате тестов на стабильность, представленных в примерах 1-3. Выбранная в итоге композиция конъюгата инсулинотропного пептида длительного действия содержит цитратный буфер с pH 5,2, хлорид натрия, маннит и полисорбат 20. С этой целью сравнение стабильности лекарственных композиций проводили между жидкими композициями, которые получают путем внесения конъюгата инсулинотропного пептида длительного действия в жидкую композицию имеющегося в продаже лекарственного средства на основе инсулинотропного пептида, эксендина-4 (Byetta); и в жидкую композицию лекарственного средства на основе слитого белка, содержащего иммуноглобулин, этанерцепта (слитый белок TNFR-Fc, энбрел).
При использовании следующих композиций, показанных в таблице 8, готовили следующие композиции: жидкая композиция конъюгата инсулинотропного пептида длительного действия, более предпочтительно конъюгата СА-эксендин-4 длительного действия (жидкая композиция №1); жидкая композиция, полученная путем внесения конъюгата инсулинотропного пептида длительного действия в композицию стабилизатора жидкой композиции лекарственного средства на основе инсулинотропного пептида, эксендина-4 (Byetta) (жидкая композиция №2); и жидкая композиция, полученная путем внесения конъюгата инсулинотропного пептида длительного действия в композицию стабилизатора жидкой композиции лекарственного средства на основе слитого белка, содержащего иммуноглобулин, этанерцепта (слитый белок TNFR-Fc, энбрел) (жидкая композиция №3). В качестве контрольной группы жидкую композицию готовили путем внесения конъюгата инсулинотропного пептида длительного действия в композицию стабилизатора, содержащую только PBS (фосфатно-солевой буферный раствор) (жидкая композиция №4). Затем композиции хранили при 25±2°C в течение 8 недель, и их стабильность анализировали посредством ОФ-ВЭЖХ и Э-ВЭЖХ. Результаты ОФ-ВЭЖХ (%) и Э-ВЭЖХ (%) в таблице 9 представляют остаточную чистоту конъюгата инсулинотропного пептида длительного действия в сравнении с исходной частотой.
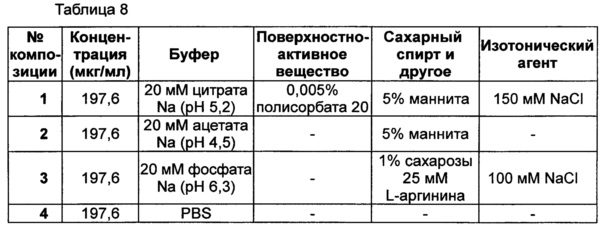
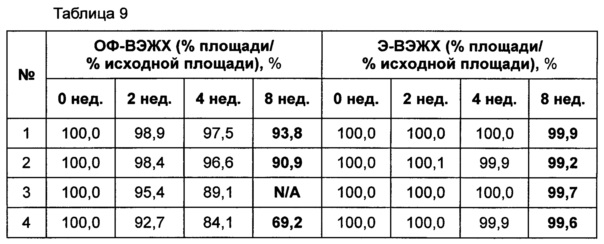
В результате проведения теста на стабильность было отмечено, что жидкая композиция конъюгата инсулинотропного пептида длительного действия по настоящему изобретению демонстрирует более высокую стабильность, чем жидкие композиции, полученные путем внесения конъюгата инсулинотропного пептида длительного действия в жидкие композиции имеющегося в продаже лекарственного средства на основе инсулинотропного пептида, эксендина-4 (Byetta), и лекарственного средства на основе слитого белка, содержащего иммуноглобулин, этанерцепта (слитый белок TNFR-Fc, энбрел), как показано на Фиг. 1 и в таблице 9.
Пример 5: оценка стабильности конъюгата инсулинотропного пептида длительного действия в зависимости от добавления метионина
Чтобы определить влияние метионина на стабильность конъюгата, жидкую композицию готовили путем добавления метионина для предотвращения окисления в композицию, содержащую цитратный буфер с pH 5,2, хлорид натрия, маннит и полисорбат 20, которые были отобраны в вышеуказанных примерах. Композиции хранили при 25±2°C в течение 4 недель и при 40±2°C в течение 4 недель, а затем анализировали их стабильность.
Жидкую композицию конъюгата инсулинотропного пептида длительного действия, более предпочтительно конъюгата СА-эксендин-4 длительного действия, готовили в виде следующих композиций, указанных в таблице 10, и анализировали их стабильность. Результаты ОФ-ВЭЖХ (%) и Э-ВЭЖХ (%) в таблицах 11-14 представляют соотношения конъюгата инсулинотропного пептида длительного действия и примесей в каждый момент времени. В таблице 11 показаны результаты ускоренного испытания стабильности, полученные посредством ОФ-ВЭЖХ (25±2°C), а в таблице 12 показаны результаты ускоренного испытания стабильности, полученные посредством Э-ВЭЖХ (25±2°C). В таблице 13 показаны результаты испытания при усилении нестабильности, полученные посредством ОФ-ВЭЖХ (40±2°C), а в таблице 14 показаны результаты испытания при усилении нестабильности, полученные посредством Э-ВЭЖХ (40±2°C). Примесь №3 представляет собой окисленную форму конъюгата инсулинотропного пептида длительного действия. Однако, поскольку с помощью Э-ВЭЖХ осуществляют разделение образца по молекулярной массе, а разница в молекулярной массе окисленной формы и неокисленной формы является незначительной, выделить окисленную форму конъюгата инсулинотропного пептида длительного действия с помощью Э-ВЭЖХ было сложно.
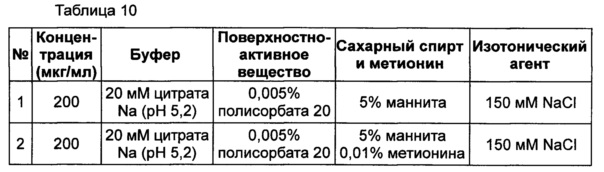
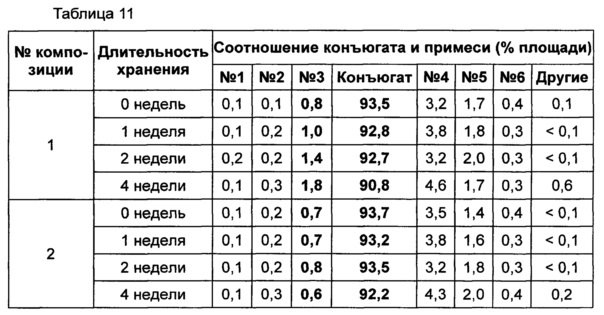
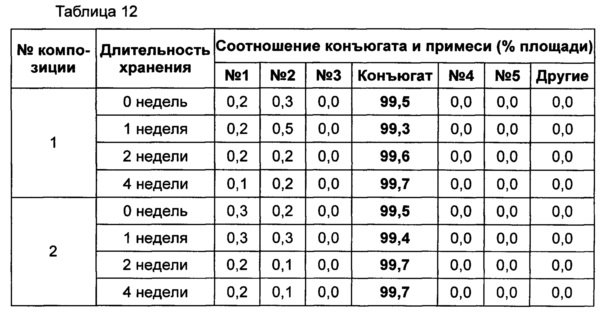
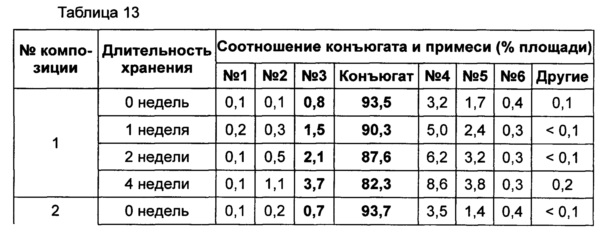
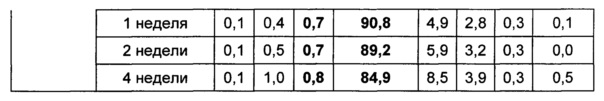
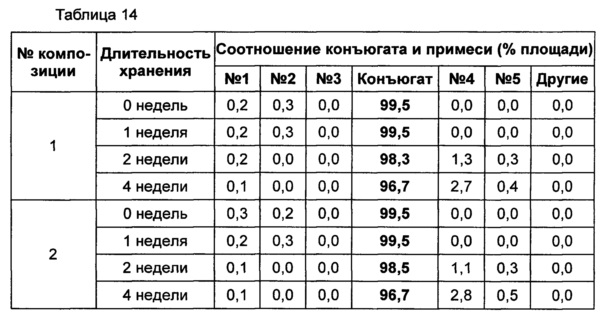
В результате проведения ускоренного испытания стабильности и испытания при усилении нестабильности, и как это показано на Фиг. 2, было отмечено, что соотношение окисленного конъюгата инсулинотропного пептида длительного действия (примесь №3 в анализе ОФ-ВЭЖХ) повышалось в жидкой композиции без метионина, но не повышалось в жидкой композиции, содержащей 0,01% метионина (Фиг. 2). Поэтому было подтверждено, что жидкая композиция, содержащая метионин, может обеспечить стабильность конъюгата инсулинотропного пептида длительного действия более эффективно.
Пример 6: оценка стабильности выбранной в итоге жидкой композиции конъюгата инсулинотропного пептида длительного действия при длительном хранении
В данном примере жидкая композиции, которая была в итоге выбрана по результатам, полученным в вышеуказанных примерах, оценивали на стабильность при длительном хранении и ускоренную стабильность. Выбранная в итоге жидкая композиция содержит цитратный буфер с pH 5,2, хлорид натрия, маннит, полисорбат 20 и метионин. С этой целью композиции хранили при 5±3°C в течение 6 месяцев и при 25±2°C в течение 6 месяцев и анализировали их стабильность. Результаты показаны в таблицах 15 и 16, а результаты анализов ОФ-ВЭЖХ (%), Э-ВЭЖХ (%), содержания белка (%) и удельной активности (%) представляют остаточную чистоту конъюгата в сравнении с исходной частотой. В таблице 15 показаны результаты испытания стабильности композиции при длительном хранении после хранения его при 5±3°C, а в таблице 16 показаны результаты ускоренного испытания стабильности после хранения композиции при 25±2°C.
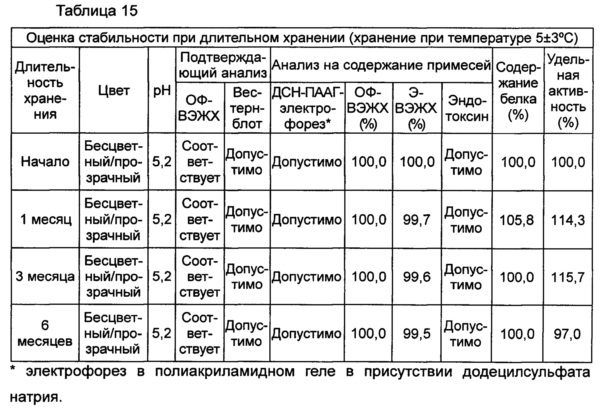
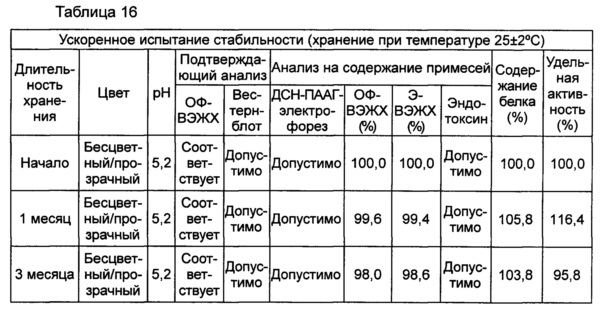
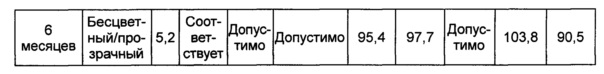
В результате проведения испытания стабильности при длительном хранении установили, что конъюгат инсулинотропного пептида длительного действия был стабилен в течение более чем 6 месяцев в жидкой композиции по настоящему изобретению. Также даже при хранении в условиях ускоренных испытаний в течение 6 месяцев результаты анализа ОФ-ВЭЖХ показали, что 95,4% конъюгата пептида или более в композиции оставалось неизменным, тем самым подтверждая, что жидкая композиция по настоящему изобретению обеспечивает отличную стабильность конъюгата инсулинотропного пептида длительного действия при хранении.
Пример 7: оценка стабильности конъюгата инсулинотропного пептида длительного действия в зависимости от концентрации белка
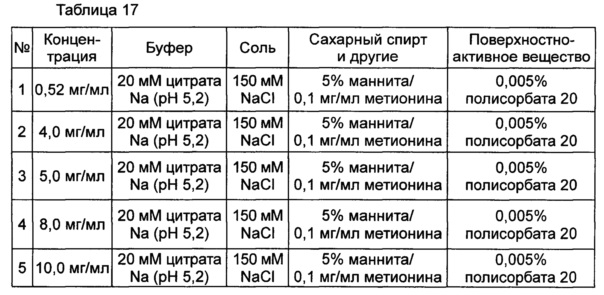
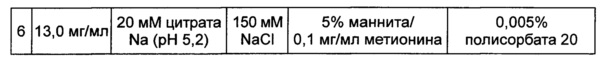
Влияние высокой концентрации конъюгата оценивали в выбранной в итоге жидкой композиции, содержащей цитратный буфер с pH 5,2, хлорид натрия, маннит, полисорбат 20 и метионин для предотвращения окисления. С этой целью осаждение в композиции контролировали невооруженным глазом при 40°C и при различных концентрациях конъюгата, показанных в таблице 17. После 72 часов наблюдений было установлено, что осаждение происходило во всех данных композициях при высокой концентрации (4 мг/мл или более). К тому же, когда концентрацию повышали, случаи возникновения осаждения также возрастали.
Пример 8: оценка стабильности конъюгата инсулинотропного пептида длительного действия в высокой концентрации в зависимости от концентрации соли и сахарного спирта и присутствия метионина
Влияние концентрации NaCl и маннита в качестве сахарного спирта на предотвращение осаждения оценивали в выбранной в итоге жидкой композиции конъюгата инсулинотропного пептида длительного действия в высокой концентрации. Композиции готовили в виде следующих композиций, показанных в таблице 18, и контролировали возникновение осаждения невооруженным глазом при 40°C в течение 48 часов. Продолжительность периода отсутствия осаждения, показанного на Фиг. 3, демонстрирует время, в течение которого не происходило осаждения белка после хранения.
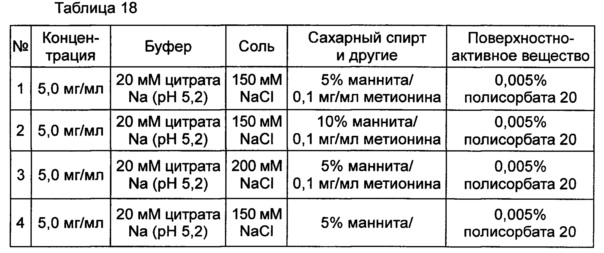
Как видно из вышеуказанных результатов, на основании наблюдения невооруженным глазом было подтверждено, что концентрация NaCl не оказывает значительного влияния на возникновение осаждения и стабильность конъюгата инсулинотропного пептида в высокой концентрации. Однако, когда концентрация маннита, взятого в качестве сахарного спирта, была увеличена от 5% до 10%, осаждение могло подавляться в значительной степени (Фиг. 3). К тому же, когда в композицию не добавляли метионин, осаждение также могло подавляться.
Пример 9: оценка стабильности конъюгата инсулинотропного пептида длительного действия в высокой концентрации в зависимости от присутствия соли и при различных значениях рН
Используя 10% маннита, концентрация которого была выбрана в примере 8, изучали влияние pH на подавление осаждения и поддержание стабильности конъюгата инсулинотропного пептида длительного действия в высокой концентрации. В качестве буфера использовали цитратный буфер, а в качестве неионного поверхностно-активного вещества использовали полисорбат 20. Согласно примеру 8, осаждение могло быть подавлено путем исключения метионина из композиции. Однако метионин все же добавляли в композицию с целью предотвращения окисления белка. Кроме того, для подтверждения синергического действия NaCl и рН, в композицию добавляли или исключали из нее 150 мМ NaCl. Конъюгат инсулинотропного пептида длительного действия в высокой концентрации готовили в виде следующих композиций, показанных в таблице 19, и контролировали возникновение осаждения при 40°C в течение 7 суток. Через 7 суток хранения образцы анализировали посредством ОФ-ВЭЖХ и Э-ВЭЖХ.
Продолжительность периода отсутствия осаждения, показанного на Фиг. 4, показывает время, в течение которого не происходило осаждения белка после хранения. Результаты анализа ОФ-ВЭЖХ (%) в таблице 20 и Э-ВЭЖХ (%) в таблице 21 показывают остаточную чистоту конъюгата инсулинотропного пептида длительного действия в сравнении с исходной частотой.
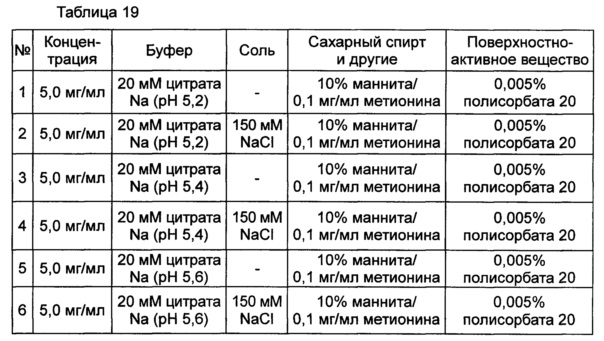
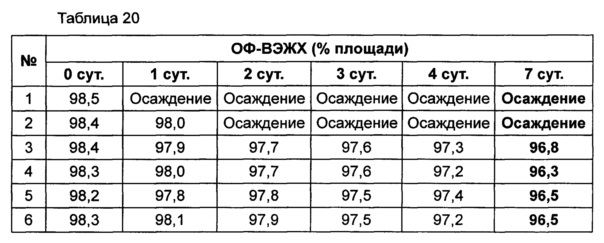
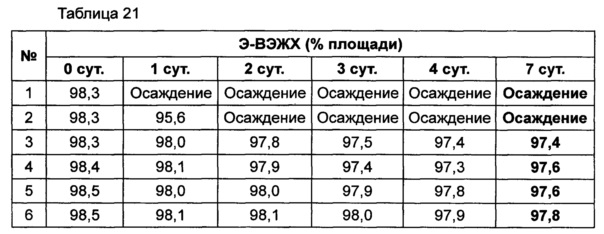
Как показано выше, осаждение лучше подавлялось при высоких значениях pH 5,4 и 5,6, чем при pH 5,2. После 7 суток хранения осаждение наблюдали во всех композициях. Однако в композиции, содержащей 10% маннита и 150 мМ NaCl при pH 5,6 (композиция №6), количество образовавшихся примесей было наименьшим. При значениях pH 5,4 и 5,6 присутствие NaCl не оказывает значительного влияния на стабильность конъюгата инсулинотропного пептида длительного действия в высокой концентрации, за исключением осаждения (таблицы 20 и 21 и Фиг. 4).
Пример 10: оценка стабильности конъюгата инсулинотропного пептида длительного действия в высокой концентрации в зависимости от концентрации сахарного спирта и при различных значениях рН
На основании вышеуказанных примеров изучали влияние концентрации сахарного спирта и pH на стабильность конъюгата инсулинотропного пептида длительного действия в высокой концентрации. В качестве буфера использовали цитратный буфер, а в качестве неионного поверхностно-активного вещества использовали полисорбат 20. Также в композицию добавляли метионин с целью предотвращения окисления. Кроме того, на основании результатов, полученных в примере 9, NaCl был исключен из композиции конъюгата инсулинотропного пептида длительного действия в высокой концентрации. Конъюгат инсулинотропного пептида длительного действия в высокой концентрации готовили в виде следующих композиций, как показано в таблице 22, и хранили при 40°C в течение 5 суток, а затем переносили и хранили при температуре 25°C в течение еще 4 недель. Каждую неделю стабильность белка анализировали посредством Э-ВЭЖХ, ИО-ВЭЖХ (ионообменная высокоэффективная жидкостная хроматография) и ОФ-ВЭЖХ. Результаты анализов Э-ВЭЖХ (%) в таблице 23, ИО-ВЭЖХ (%) в таблице 24 и ОФ-ВЭЖХ (%) в таблице 25 представляют остаточную чистоту конъюгата инсулинотропного пептида длительного действия.
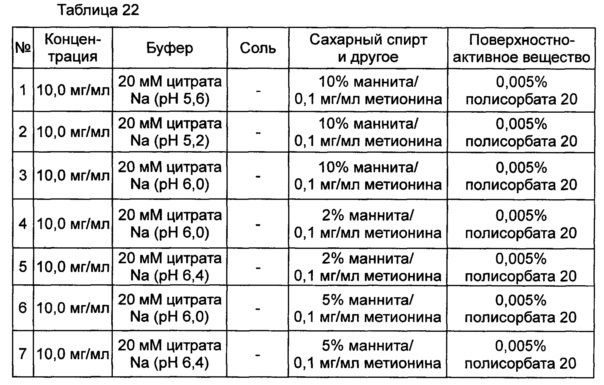
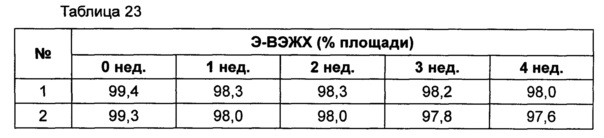
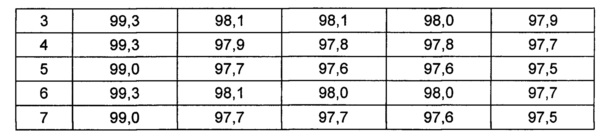
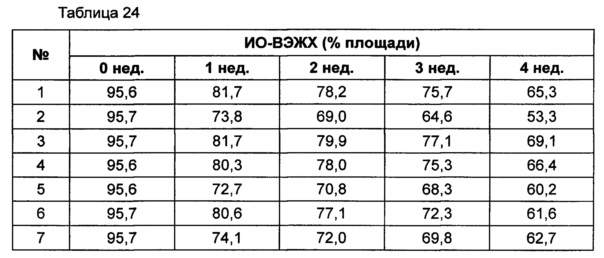
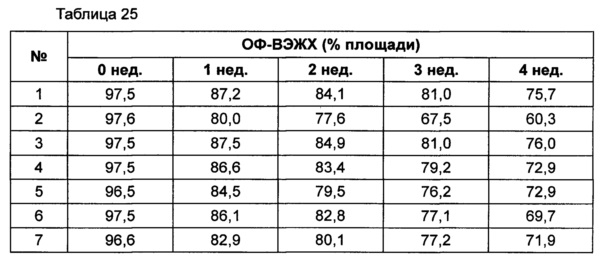
Как показано выше, когда значение pH было низким, стабильность также снижалась по сравнению с тем, когда значение pH было высоким. Стабильность конъюгата была наивысшей при содержании маннита 10%, тогда как содержание маннита 2% и 5% не влияло на стабильность конъюгата инсулинотропного пептида длительного действия в высокой концентрации.
Пример 11: оценка стабильности конъюгата инсулинотропного пептида длительного действия в высокой концентрации в зависимости от вида и концентрации сахарного спирта
Для разработки изотонической жидкой композиции изучали влияние вида и концентрации сахарного спирта, воздействующего на осмотическое давление композиции наиболее значительно, на стабильность конъюгата инсулинотропного пептида в тех же условиях, как и в вышеуказанных примерах. Сахарный спирт был заменен на сахарозу. Взяв за основу композицию №1 в примере 10, 10% маннита заменили на 5% и 7% сахарозы (таблица 26). Композиции хранили при 25°C в течение 4 недель, а их стабильность анализировали каждую неделю посредством Э-ВЭЖХ, ИО-ВЭЖХ и ОФ-ВЭЖХ. Результаты анализа Э-ВЭЖХ (%) в таблице 27, ИО-ВЭЖХ (%) в таблице 28 и ОФ-ВЭЖХ (%) в таблице 29 представляют остаточную чистоту конъюгата инсулинотропного пептида длительного действия.
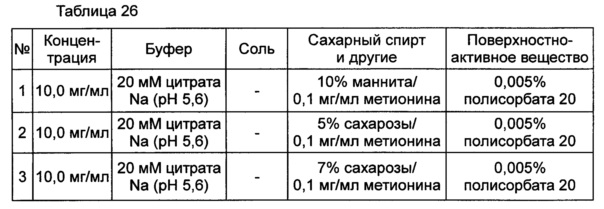
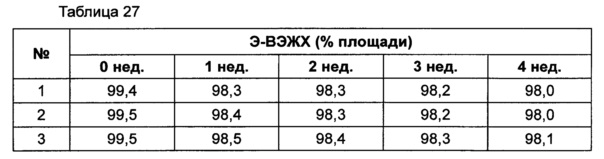
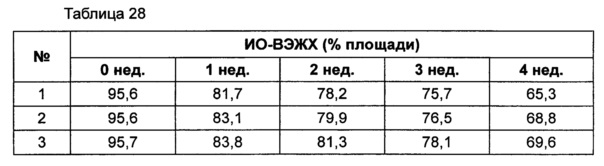
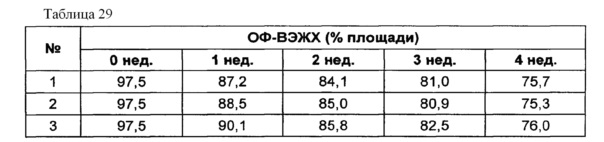
Как показано выше, когда сахарозу использовали вместо маннита, стабильность конъюгата сохранялась, и стабильность конъюгата незначительно повышалась при содержании сахарозы 7%, нежели чем при содержании сахарозы 5%, но значительной разницы не было.
Пример 12: оценка стабильности конъюгата инсулинотропного пептида длительного действия в высокой концентрации в зависимости от вида буфера, регулирования осмотического давления и добавления консерванта
Для разработки изотонической жидкой композиции регулировали концентрацию сахарного спирта, который оказывает наибольшее влияние на осмотическое давление, и тестировали различные виды буферов на способность обеспечивать стабильность конъюгата в условиях, аналогичных условиям в вышеуказанных примерах. Кроме того, в тех же условиях добавляли 0,22% мета-крезола в качестве консерванта и также исследовали его влияние на стабильность конъюгата. Конъюгат инсулинотропного пептида длительного действия готовили в виде следующих композиций, показанных в таблице 30, и хранили при 25°C в течение 2 недель. Затем каждую неделю анализировали стабильность образцов посредством Э-ВЭЖХ, ИО-ВЭЖХ и ОФ-ВЭЖХ. Результаты анализов Э-ВЭЖХ (%) в таблице 31, ИО-ВЭЖХ (%) в таблице 32 и ОФ-ВЭЖХ (%) в таблице 33 представляют остаточную чистоту конъюгата инсулинотропного пептида длительного действия.
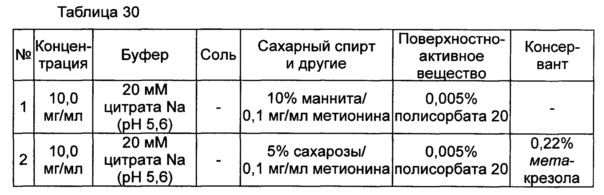

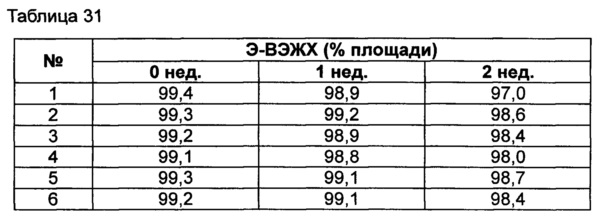
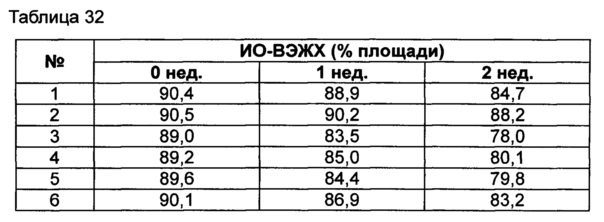
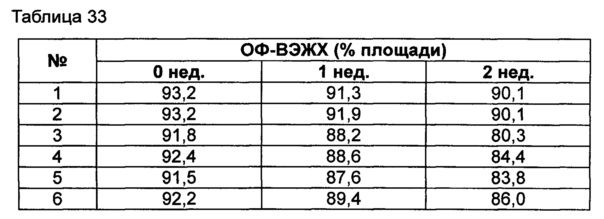
Как показано выше, когда использовали различные виды буферов, конъюгат пептида каждой композиции был стабилен. Также добавление мета-крезола не оказывало влияния на стабильность пептида.
Эти результаты подтверждают, что композиция жидкой композиции по настоящему изобретению может сохранять высокую стабильность конъюгата инсулинотропного пептида в высокой концентрации.
Исходя из вышеуказанного описания, специалистам в данной области техники будет очевидно, что различные модификации и изменения могут быть сделаны без отступления от объема и существа изобретения. Поэтому следует понимать, что вышеуказанное воплощение является не ограничивающим, а иллюстративным во всех аспектах. Объем изобретения определяется прилагаемой формулой изобретения, нежели предшествующим ей описанием, и поэтому все изменения и модификации, которые находятся в пределах границ и пределов формулы изобретения или эквивалентов таких границ и пределов, предназначены для того, чтобы быть охваченными формулой изобретения.