Результат интеллектуальной деятельности: Микроорганизм рода Corynebacterium для продуцирования L-аргинина и способ получения L-аргинина с использованием этого микроорганизма
Вид РИД
Изобретение
Область изобретения
Изобретение относится к микроорганизму рода Corynebacterium, обладающему способностью продуцировать L-аргинин, и способу получения L-аргинина с его использованием.
Предшествующий уровень техники
L-аргинин представляет собой аминокислоту, широко применяемую в аминокислотных добавках, фармацевтических лекарственных средствах, пищевых продуктах и так далее, и существует потребность в разработке эффективного получения L-аргинина в соответствующих областях промышленности.
Способ получения L-аргинина традиционным способом биологической ферментации представляет собой способ получения L-аргинина непосредственно из источников углерода и азота, и сообщалось о разных способах, включая способ с использованием индуцированного модифицированного штамма микроорганизма рода Brevibacterium или Corynebacterium, способ с использованием бактериальной клеточной линии, разработанной для получения усиленной способности продуцировать аминокислоты путем слияния клеток и так далее. Недавно сообщалось о способе использования штамма, полученного методом генетической рекомбинации, у которого инактивирован ген, ингибирующий экспрессию аргинин-биосинтезирующего оперона argR (патент США No. 7160705), и способе использования сверхэкспрессии argF в аргининовом опероне (патент Кореи No. 10-0854234), и так далее. В частности, делецию в argR, который контролирует аргининовый оперон, рассматривают как важный фактор в продукции аргинина.
В соответствии с фактами, известными к настоящему времени, у микроорганизма Corynebacterium ген argCJBDFR, который вовлечен в биосинтез аргинина, составлен в форме оперона и подвержен ингибированию по типу обратной связи внутриклеточным аргинином (Vehary Sakanyan, et al., Microbiology, 142:9-108, 1996), что таким образом накладывает ограничение на продукцию L-аргинина с высоким выходом.
Техническая задача
Соответственно авторы настоящего изобретения, работая над увеличением выхода продукции L-аргинина, обнаружили, что L-аргинин может быть получен с высоким выходом по сравнению с родительским штаммом, продуцирующим L-аргинин, путем усиления активностей аргининового оперона и орнитин-карбамоилтрансферазы, без какой-либо делеции в аргининовом репрессоре (argR), который традиционно известен как важный фактор, тем самым создав настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы предложить микроорганизм рода Corynebacterium, обладающий способностью продуцировать L-аргинин.
Другая задача настоящего изобретения заключается в том, чтобы предложить способ получения L-аргинина с использованием микроорганизма рода Corynebacterium.
Полезные эффекты изобретения
L-аргинин может быть получен с высоким выходом с использованием микроорганизма рода Corynebacterium, продуцирующего L-аргинин, с усиленными активностями аргининового оперона и орнитин-карбамоилтрансферазы (ArgF или ArgF2) согласно настоящему изобретению. Дополнительно, L-аргинин, полученный с высоким выходом, можно эффективно применять в фармацевтической и фармакологической отрасли для человека.
Наилучшее воплощение изобретения
В одном аспекте настоящего изобретения для достижения описанных выше задач предложен микроорганизм рода Corynebacterium, обладающий способностью продуцировать L-аргинин с усиленными активностями аргининового оперона и орнитин-карбамоилтрансферазы.
В настоящем изобретении аргининовый оперон представляет собой оперон, состоящий из ферментов, вовлеченных в механизм биосинтеза L-аргинина, и, в частности, аргининовый оперон состоит из ферментов, составляющих циклические этапы биосинтеза L-аргинина. Более конкретно, аргининовый оперон состоит из N-ацетилглутамилфосфатредуктазы (ArgJ), глутамат-N-ацетилтрансферазы (ArgJ), N-ацетилглутаматкиназы (ArgB), ацетилорнитин-аминотрансферазы (ArgD), орнитин-карбамоилтрансферазы (ArgF) и аргининового репрессора (ArgR), и эти ферменты вовлечены в непрерывные ферментативные реакции биосинтеза L-аргинина.
Эти ферменты, которые составляют аргининовый оперон, вовлечены в конечный биосинтез L-аргинина с использованием L-глутамата в качестве предшественника. Глутамат-N-ацетилтрансфераза (ArgJ) синтезирует N-ацетилглутамат с использованием L-глутамата в качестве предшественника, и ее может кодировать ген argJ. В частности, ацетильная группа получается при расщеплении N-ацетилорнитина до L-орнитина. Известно, что глутамат-N-ацетилтрансфераза вовлечена в реакцию метаболического цикла биосинтеза L-аргинина у микроорганизмов, принадлежащих роду Corynebacterium.
Из полученного N-ацетилглутамата N-ацетилглутаматкиназа (ArgВ), которую может кодировать ген argB, синтезирует N-ацетилглутамилфосфат, ADP образуется при использовании АТР в качестве кофермента. Поскольку известно, что эта реакция подвержена ингибированию по типу обратной связи конечным продутом, L-аргинином, известны модификации, освобождающие от ингибирования по типу обратной связи L-аргинином, и сообщалось, что продуктивность по L-аргинину может быть улучшена с использованием этих же модификаций (патент Китая No. 102021154 и Amino Acids. 2012 Jul; 43(1): 255-66. doi: 10.1007/s00726-011-1069-x. Epub 2011 Sep 8).
N-ацетилглутамилфосфатредуктазу (ArgC) также называют ацетилглутамат-полуальдегид-дегидрогеназой у Е. coli или дрожжей, и ее может кодировать ген argС. Этот фермент превращает N-ацетилглутамилфосфат в N-ацетилглутамат-5-полуальдегид. NADPH используется в качестве кофермента для обеспечения энергии. Полученный N-ацетилглутамат-5-полуальдегид превращается в N-ацетилорнитин с использованием L-глутамата в качестве донора аминокислоты, и эта реакция опосредуется ацетилорнитин-аминотрансферазой (ArgD). Ацетилорнитин-аминотрансферазу может кодировать ген argD. Преобразованный N-ацетилорнитин доставляет свои ацетильные группы к L-глутамату путем реакции метаболического цикла глутамат-N-ацетилтрансферазы (ArgJ), и действует как L-орнитин.
Орнитин-карбамоилтрансферазу (ArgF) обычно называют орнитинкарбамоилазой, и ее могут кодировать гены argF или argF2. L-орнитин связывается с карбамоилфосфатом с образованием L-цитруллина, и фосфат образуется как продукт побочной реакции. В итоге из полученного L-цитруллина синтезируется L-аргинин путем ферментативных реакций синтазы аргинин-янтарной кислоты (ArgG) и лиазы аргинин-янтарной кислоты (ArgH), которые присутствуют отдельно от аргининового оперона, упомянутого выше. L-аргинин синтезируется в общей сложности за 8 биосинтетических этапов, и в настоящем изобретении усиление продукции L-аргинина индуцировали путем усиления активности аргининового оперона (argCJBDFR).
Ферменты, которые составляют аргининовый оперон, могут быть включены в объем настоящего изобретения до тех пор, пока они обладают активностями, описанными выше, и в особенности, ферменты могут представлять собой белки, имеющие происхождение из микроорганизма рода Corynebacterium. Более конкретно, глутамат-N-ацетилтрансфераза (ArgJ) может включать аминокислотную последовательность SEQ ID NO: 19 или аминокислотную последовательность, которая гомологична этой последовательности по меньшей мере на 70%, в частности на 80%, и, более конкретно, на 90% или больше. N-ацетилглутаматкиназа (ArgВ) может включать аминокислотную последовательность SEQ ID NO: 21 или аминокислотную последовательность, которая гомологична этой последовательности по меньшей мере на 70%, в частности на 80% и, более конкретно, на 90% или больше. Дополнительно, в случае соответствующего фермента, модификации, известные в данной области техники, могут быть введены для освобождения от ингибирования по типу обратной связи аргинином. N-ацетилглутамилфосфатредуктаза (ArgС) может включать аминокислотную последовательность SEQ ID NO: 23 или аминокислотную последовательность, которая гомологична этой последовательности по меньшей мере на 70%, в частности на 80% и, более конкретно, на 90% или больше. Ацетилорнитин-аминотрансфераза (ArgD) может включать аминокислотную последовательность SEQ ID NO: 25 или аминокислотную последовательность, которая гомологична этой последовательности по меньшей мере на 70%, в частности на 80% и, более конкретно, на 90% или больше. Орнитин-карбамоилтрансфераза (ArgF) может включать аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 3 или может включать аминокислотную последовательность, которая по меньшей мере на 70% гомологична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 3. В частности, орнитин-карбамоилтрансфераза (ArgF) может включать аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% или больше гомологична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 3. Кроме того, очевидно, что аминокислотные последовательности, включающие делецию, модификацию, замену или вставку одного или более чем одного аминокислотного остатка, попадают в объем настоящего изобретения до тех пор, пока они обладают гомологией с вышеупомянутыми белками и обладают по существу такой же биологической активностью как и вышеупомянутые белки или соответствующей биологической активностью.
Как его используют здесь, термин ''гомология'' относится к степени сходства между двумя аминокислотными последовательностями или нуклеотидными последовательностями для сравнения, и их гомологию можно определить путем сравнения невооруженным глазом или с использованием биоинформационного алгоритма, который обеспечивает результаты анализа степени гомологии путем выравнивания последовательностей для сравнения. Гомология между двумя аминокислотными последовательностями может быть указана в процентах. Полезные автоматизированные алгоритмы могут быть использованы в модулях GAP, BESTFIT, FASTA и TFASTA компьютерного программного обеспечения Wisconsin Genetics Software Package (Genetics Computer Group, Madison, WI, USA). Другие полезные алгоритмы и определения гомологии по выравниванию уже автоматизированы в программном обеспечении, таком как FASTP, BLAST, BLAST2, PSIBLAST и CLUSTAL W.
В настоящем изобретении усиление активности аргининового оперона может относиться к усилению активности по меньшей мере одного фермента из ферментов, присутствующих в аргининовом опероне, однако это не включает единственное усиление только одного гена argR. Например, усиление активности аргининового оперона может относиться к усилению активностей всех ферментов, присутствующих в опероне, путем усиления промотора для одного фермента, присутствующего в аргининовом опероне, и в особенности может относиться к усилению активности всего оперона путем усиления промотора для N-ацетилглутамилфосфатредуктазы. Дополнительно в настоящем изобретении усиление экспрессии гена, кодирующего по меньшей мере один фермент из ферментов, составляющих аргининовый оперон, также можно рассматривать как усиление активности аргининового оперона.
Как его используют здесь, термин ''усиление'' активности относится к обеспечению микроорганизма без специфической активности какого-либо белка активностью этого белка, или к увеличению внутриклеточной активности у микроорганизма, обладающего активностью белка, и так далее, и относится к увеличению внутриклеточной активности белка по сравнению с собственной активностью белка. Как его используют здесь, термин ''собственная активность'' относится к активному состоянию фермента, которым обладает микроорганизм, принадлежащий роду Corynebacterium, в природном или предварительно модифицированном состоянии.
Для усиления или увеличения активности фермента можно использовать различные способы, известные в данной области техники. Примеры способа, без ограничений, могут включать способ увеличения числа копий нуклеотидных последовательностей, кодирующих ферменты, путем дополнительной вставки полинуклеотида, включающего нуклеотидную последовательность, кодирующую соответствующий фермент в хромосому, или введения полинуклеотида в векторную систему и так далее, способ замены промоторов генов ферментов на сильные промоторы, и в особенности могут включать способ введения модификации в промоторы и способ модификации фермента в таковой с сильной активностью путем генетической модификации.
Конкретные примеры настоящего изобретения могут включать способ модификации промотора фермента, присутствующего в аргининовом опероне, в промотор, который является сильным по сравнению с эндогенным промотором, путем модификации или замены промотора. Улучшенный промотор или гетерогенный промотор с модификацией, представляющей собой нуклеотидную замену, может быть присоединен вместо промотора для эндогенного фермента, и примеры гетерогенных промоторов могут включать промотор pcj7 (патент Кореи No. 10-0620092), промотор lysCP1 (патент Кореи No. 10-0930203), промотор EF-Tu, промотор groEL, промотор асеА, промотор асеВ и так далее, но не ограничиваясь ими.
Как его используют здесь, термин ''промотор'' относится к некодирующей последовательности нуклеиновой кислоты выше по ходу транскрипции от кодирующего участка, который включает участок связывания с полимеразой и обладает активностью по иницииации транскрипции в мРНК гена, лежащего ниже по ходу транскрипции от промотора, то есть участка ДНК, где полимераза связывается и инициирует транскрипцию гена, и расположенной на участке 5' от участка инициации транскрипции мРНК.
В настоящем изобретении усиление активности орнитин-карбамоилтрансферазы может быть выполнено с использованием различных способов, хорошо известных в данной области техники, и они являются такими же, как описано выше. В частности, усиление может быть достигнуто путем трансформации вектора экспрессии, включающего полинуклеотид, кодирующий орнитинкарбамоилтрансферазу, в бактериальный штамм, но не ограничиваясь этим.
Как его используют здесь, термин ''трансформация'' относится к введению ДНК в хозяина, что тем самым делает вставленную ДНК способной к репликации в форме внехромосомного фактора или путем хромосомной интеграции. В частности, трансформант по настоящему изобретению может быть вставлен в хромосому путем гомологичной рекомбинации между последовательностью молекулы нуклеиновой кислоты, которая обладает активностью промотора в векторе после трансформации вектором, включающим вышеописанную ДНК, в клетку-хозяин, и последовательностью в промоторной области эндогенного гена-мишени, или может оставаться в форме плазмиды.
Способ трансформации вектором по настоящему изобретению может включать любой способ, который позволяет вводить нуклеиновую кислоту в клетку, и любая подходящая стандартная технология, известная в данной области техники, может быть выбрана и выполнена в соответствии с каждой клеткой-хозяином. Например, можно использовать электропорацию, осаждение фосфатом кальция (СаРO4), осаждение хлоридом кальция (СаСl2), микроинъекцию, способ с полиэтиленгликолем (ПЭГ), способ с диэтиламиноэтилдекстраном (ДЭАЭ), способ с катионными липосомами, способ с ацетатом лития/ДМСО (диметилсульфоксид) и так далее, но способ не ограничивается вышеперечисленным.
Как его используют здесь, термин ''микроорганизм рода Corynebacterium (Corynebacterium sp.)'' может относиться ко всем штаммам, принадлежащим к роду Corynebacterium, обладающим способностью продуцировать L-аргинин, то есть Corynebacterium glutamicum, Corynebacterium ammoniagenes, Corynebacterium thermoaminogenes, Brevibacterium flavum, Brevibacterium fermentum и так далее, но не ограничиваясь ими. В частности, можно использовать Corynebacterium glutamicum, но микроорганизм не ограничивается им.
В другом аспекте настоящего изобретения предложен способ получения L-аргинина, включающий культивирование микроорганизма рода Corynebacterium, продуцирующего L-аргинин, в подходящей культуральной среде.
В настоящем изобретении культуру микроорганизма можно получать согласно способам, широко известным в данной области техники, и условия температуры культивирования, количества часов культивирования, рН культуральной среды и так далее, можно регулировать соответствующим образом. Известные способы культивирования подробно описаны в литературе (Chmiel; Bioprozesstechnik 1. Einfuhrung in die Bioverfahrenstechnik (Gustav Fischer Verlag, Stuttgart, 1991) и Storhas; Bioreaktoren und periphere Einrichtungen (Vieweg Verlag, Braunschweig / Wiesbaden, 1994)). Дополнительно, способы культивирования могут включать периодическую культуру, непрерывную культуру и культуру с подпиткой, и в частности, культивирование можно выполнять непрерывно путем периодического процесса, или процесса с подпиткой, или повторяющегося процесса подпитки, но не ограничиваясь этим.
Культуральные среды, предназначенные для использования, должны подходящим образом соответствовать требуемым условиям конкретного штамма. Культуральные среды, используемые для различных микроорганизмов, уже известны (например ''Manual of Methods for General Bacteriology'' от Американского Общества Бактериологии (Washington D.C., USA, 1981)). Источники углерода, которые должны содержаться в средах, могут включать сахариды и углеводы (например, глюкозу, сахарозу, лактозу, фруктозу, мальтозу, мелассу, крахмал и целлюлозу), масла и жиры (например, соевое масло, масло семян подсолнечника, арахисовое масло и кокосовое масло), жирные кислоты (например, пальмитиновую кислоту, стеариновую кислоту и линоленовую кислоту), спирты (например, глицерин и этанол), органические кислоты (например, уксусную кислоту) и так далее. Эти вещества могут быть использованы по отдельности или в форме смеси, но не ограничиваясь этим. Источники азота, которые должны содержаться в средах, могут включать азотсодержащие органические соединения (например, пептон, дрожжевой экстракт, мясной бульон, солодовый экстракт, жидкий кукурузный экстракт, соевую муку и мочевину) и неорганические соединения (например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония), и эти вещества также можно применять индивидуально или в форме смеси, но не ограничиваясь этим. Источники фосфора, которые должны содержаться в средах, могут включать однозамещенный фосфорнокислый калий или гидроортофосфат калия или эквивалентные им натрий-содержащие соли, но не ограничиваясь этим. Культуральные среды могут содержать соли металлов, необходимые для роста (например, сульфат магния или сульфат железа), и могут содержать необходимые вещества, стимулирующие рост, такие как аминокислоты и витамины, дополнительно к веществам, описанным выше. Кроме того, в культуральную среду может быть дополнительно добавлен соответствующий предшественник. Вещества, которые должны быть обеспечены, описанные выше, могут быть добавлены в среду сразу или подходящим образом во время культивирования.
Значение рН культуральной среды подходящим образом может быть подведено с использованием щелочного соединения (например, гидроксида натрия, гидроксида калия или аммония) или кислотного соединения (например, фосфорной кислоты или серной кислоты).
Вспенивание можно контролировать с использованием пеногасителя, такого как полигликолевый сложный эфир жирной кислоты. Аэробные условия можно поддерживать путем введения кислорода или кислород-содержащей газовой смеси, например воздуха, в культуральную среду. Температура в культуре может составлять от 20°С до 45°С и, в частности, от 25°С до 40°С. Культивирование можно продолжать до достижения максимального количества продукции желаемой L-аминокислоты, и в частности от 10 часов до 160 часов. L-аргинин может высвобождаться в культуральную среду или может оставаться содержащимся в клетке.
При этом способ получения L-аргинина по настоящему изобретению, включающий культивирование микроорганизма, описанное выше, может дополнительно включать стадию выделения L-аргинина во время культивирования. То есть, способ получения L-аргинина по настоящему изобретению может включать культивирование микроорганизма рода Corynebacterium в культуральной среде и выделение L-аргинина из микроорганизма и культуральной среды. Стадия выделения аргинина может подразумевать отделение аргинина от клеток или культуральной среды, используя способ выделения аргинина, широко известный в данной области техники. Способы выделения L-аргинина могут включать центрифугирование, фильтрование, экстрагирование, распыление, сушку, выпаривание, осаждение, кристаллизацию, электрофорез, фракционное растворение, хроматографию (например, ионообменную, афинную, гидрофобную, эксклюзионную и высокоэффективную жидкостную) и так далее, но не ограничиваясь этим.
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры. Однако эти примеры даны только для иллюстративных целей и не предназначены ограничивать объем изобретения.
Пример 1: Конструирование вектора с усиленным аргининовым опероном
Для усиления аргининового оперона в хромосоме микроорганизма был сконструирован вектор, где собственный промотор для N-ацетилглутамилфосфатредуктазы (ArgС) был вырезан и заменен другим промотором. В качестве заменяющего промотора использовали lysCP1 (SEQ ID NO: 18, раскрыта в патенте Кореи No. 10-0930203), который имеет высокую активность индукции экспрессии.
Прежде всего, фрагменты ДНК амплифицировали путем первичной полимеразной цепной реакции (PCR) с использованием хромосомной ДНК штамма дикого типа Corynebacterium glutamicum (No доступа: АТСС13869) в качестве матрицы, вместе с парой праймеров с SEQ ID NO: 13 (праймер SF_pargC_PR_pDC in-fusion; 5'-CGAGCTCGGTACCCGGGCAAAGAATACGGCTTCCTTGGC-3') и SEQ ID NO: 14 (праймер SR_pargC_PR_Xbal-Xhol-BamHI in-fusion/фермент рестрикции; 5'-CTGGATCCTCGAGTCTAGAGACGGGTTAGACATGCAAAA-3') и парой праймеров с SEQ ID NO: 15 (праймер SF_pargC_PR_Spel-Scal-BamHI in-fusion/фермент рестрикции; 5'-GACTCGAGGATCCAGTACTAGTATGATAATCAAGGTTGCAAT-3') и SEQ ID NO: 16 (праймер SR_pargC_PR_pDC in-fusion; 5'-TGCAGGTCGACTCTAGGGTAACGCCTTCTTTCAAAG-3'). Специфические условия для реакции ПЦР были следующими: реакцию ПЦР проводили путем денатурации при 95°С в течение 10 минут, отжига при 55°С в течение 30 секунд и элонгации при 72°С в течение 1 минуты с использованием устройства для ПЦР (термоциклер Bio-rad С1000) и полимеразы Pfu (Macrogen) и повторяли в течение 28 циклов.
Полученные таким образом первичные ПЦР-фрагменты очищали с использованием набора для очистки фрагментов ДНК (GeneAII), и затем три фрагмента ДНК соединяли путем смешивания их с вектором pD, который был уже подготовлен путем расщепления ферментами рестрикции Xmal-Xbal. Соединенные фрагменты ДНК подвергали реакции при 50°С в течение 10 минут с использованием набора In-fusion Cloning (Clontech), и таким образом был сконструирован вектор pD-RargC_PR.
Вставку заменяющего промотора выполняли таким образом, что промотор lysCP1 амплифицировали с использованием pDZ-lysCP1 (патент Кореи No. 10-0930203) в качестве матрицы вместе с парой праймеров с SEQ ID NO: 5 (праймер SF_PlysCP1_Xhol-Xbal in-fusion; 5'-CCGTCTCTAGACTCGAGCCATCTTTTGGGGTGCGG-3') и SEQ ID NO: 6 (праймер SR_PlysCP1_Spel in-fusion; 5'-TTGATTATCATACTAGTCTTTGTGCACCTTTCGAT-3') и соединяли путем смешивания их с вектором pD-PargC_PR, который был уже подготовлен путем расщепления ферментами рестрикции Xhol-Spel. Способы ПЦР и клонирования In-fusion являются такими же, как изложено выше, и наконец вектор pD-PargC::lysCP1 был сконструирован этими способами.
Пример 2: Конструирование вектора с усиленной орнитин-карбамоилтрансферазой
Для усиления орнитин-карбамоилтрансферазы, одного из ферментов биосинтеза аргинина, был сконструирован рекомбинантный вектор экспрессии. p117-cj7-GFP (патент Кореи No. 10-0620092) использовали в качестве матричного вектора (template vector), и нуклеотидную последовательность, кодирующую GFP в основном векторе, удаляли путем обработки ферментами рестрикции EcoRV-Xba I, и вставляли argF, имеющий происхождение из штамма дикого типа Corynebacterium glutamicum АТСС13869, и argF2 (патент Кореи No. 10-0830290).
Фрагменты ДНК гена argF амплифицировали путем ПЦР с использованием хромосомной ДНК штамма дикого типа Corynebacterium glutamicum (No доступа: АТСС13869) в качестве матрицы вместе с парой праймеров SEQ ID NO: 7 (праймер SF_argF_EcoRV in-fusion; 5'-ACGAAAGGAAACACTCGATATCATGACTTCACAACCACAGGT-3') и SEQ ID NO: 8 (праймер SR_argF_Xbal in-fusion; 5'-GCCAAAACAGCTCTAGATTACCTCGGCTGGTGGGCCA-3'). Реакцию ПЦР проводили путем денатурации при 95°С в течение 10 минут, отжига при 55°С в течение 30 секунд и элонгации при 72°С в течение 2 минут с использованием полимеразы Pfu, и повторяли в течение 28 циклов. Полученные таким образом фрагменты ДНК очищали и смешивали с p117-cj7-GFP, который был уже обработан ферментами рестрикции EcoRV-Xbal, и соединяли методом клонирования In-fusion, и таким образом был сконструирован рекомбинантный вектор экспрессии p117-Pcj7-argF.
Ген argF2 амплифицировали путем ПЦР с использованием хромосомной ДНК штамма дикого типа Corynebacterium glutamicum (No доступа: АТСС13032) в качестве матрицы вместе с парой праймеров SEQ ID NO: 9 (праймер SF_argF2_EcoRV in-fusion; 5'-ACGAAAGGAAACACTCGATATCATGGCCAGAAAACATCTGCT-3') и SEQ ID NO: 10 (праймер SR_argF2_Xbal in-fusion; 5'-GCCAAAACAGCTCTAGACTACGCATTGATCGACCGAG-3') и полимеразой Pfu (Macrogen) посредством ПЦР путем денатурации при 95°С в течение 10 минут, отжига при 55°С в течение 30 секунд и элонгации при 72°С в течение 2 минут с использованием полимеразы Pfu, которые повторяли в течение 28 циклов. Полученные таким образом фрагменты ДНК очищали и смешивали с p117-cj7-GFP, который был уже обработан ферментами рестрикции EcoRV-Xbal, и соединяли с помощью набора In-fusion Cloning, и таким образом был сконструирован рекомбинантный вектор экспрессии p117-Pcj7-argF2.
Дополнительно был сконструирован рекомбинантный вектор экспрессии, который может одновременно экспрессировать оба гена, argF и argF2. Сконструированный таким образом вектор экспрессии p117-Pcj7-argF обрабатывали Notl и затем в него вставляли p117-Pcj7-argF2. Более конкретно, реакцию ПЦР проводили с использованием рекомбинантной плазмиды р117-Pcj7-argF2 в качестве матрицы вместе с SEQ ID NO: 11 (праймер SF_Pcj7_argF2_Notl in-fusion; 5'-CCTTTTTGCGGCGGCCGCAGAAACATCCCAGCGCTACT-3'), и праймером SEQ ID NO: 12 (праймер SR_argF2_Notl in-fusion; 5'-CACCGCGGTGGCGGCCGCCGCAAAAAGGCCATCCGTCA-3'), и полимеразой Pfu путем денатурации при 95°С в течение 10 минут, отжига при 55°С в течение 30 секунд и элонгации при 72°С в течение 2,5 минут и повторяли в течение 28 циклов. Полученные таким образом фрагменты ДНК очищали и смешивали с p117-Pcj7-argF, который был уже обработан ферментом рестрикции Notl, и соединяли с помощью набора In-fusion Cloning, и наконец был сконструирован рекомбинантный вектор экспрессии p117-Pcj7-aryF/Pcj7-argF2.
Пример 3: Конструирование штамма со вставленным в него рекомбинантным вектором
3-1. Вставка вектора с усиленным аргининовым опероном
Для замены собственного промотора аргининового оперона в хромосоме Corynebacterium рекомбинантным вектором pD-PargC::lysCP1, сконструированным в Примере 1, трансформировали существующий штамм Corynebacterium, продуцирующий аргинин, и таким образом был сконструирован штамм Corynebacterium с вставленным рекомбинантным вектором. Более конкретно, последовательность промотора lysCP1 вставляли в хромосому путем трансформации имеющихся аргинин-продуцирующих штаммов KССМ10741Р (патент Кореи No. 10-07916590) и АТСС21831 рекомбинантным вектором pD-PargC::lysCP1, сконструированным в Примере 1, таким образом заменяя собственную промоторную последовательность, которой обладает родительский штамм, на промоторную последовательность вектора путем гомологичной рекомбинации.
При проведении трансформации рекомбинантный вектор сначала вставляли в KССМ10741Р и АТСС21831 методом электрического импульса (Appl Microbiol Biotechnol. 1999 Oct; 52(4): 541-5) и штаммы со вставками в их хромосому вследствие рекомбинации гомологичных последовательностей отбирали в среде, содержащей 25 мг/л канамицина. Отобранные первичные штаммы подвергали кроссинговеру и тем самым отбирали те штаммы, у которых промоторы были заменены на промотор lysCP1 и вектор был удален. Наличие замены промотора у конечных трансформированных штаммов подтверждали путем ПЦР с использованием пары праймеров SEQ ID NO: 5 и SEQ ID NO: 6, и штаммы получили названия KCCM10741P_ΔPargC::lysCP1 и ATCC21831_ΔPargC::lysCP1.
3-2. Вставка вектора с усиленной орнитин-карбамоилтрансферазой
Рекомбинантные векторы экспрессии p117-Pcj7-argF, p117-Pcj7-argF2 и p117-Pcj7-argF/Pcj7-argF2, сконструированные в Примере 2, вставляли в штамм KCCM10741P_ΔPargC::lysCP1 и ATCC21831_ΔPargC::lysCP1 методом электрического импульса, отбирали в среде, содержащей 25 мг/л канамицина, и завершали конструирование штаммов, дополнительно экспрессирующих argF, argF2 и argF/argF2. Эти штаммы получили названия KCCM10741P_ΔPargC::lysCP1_Pcj7-argF, KCCM10741P_ΔPargC::lysCP1_Pcj7-argF2, KCCM10741P_ΔPargC::lysCP1_Pcj7-argF/Pcj7-argF2, ATCC21831__ΔPargC::lysCP1_Pcj7-argF, ATCC21831_ΔPargC::lysCP1_Pcj7-argF2 и ATCC21831_ΔPargC::lysCP1_Pcj7-argF/Pcj7-argF2, и из них KCCM10741P_ΔPargC::lysCP1_Pcj7-argF2 был переименован в СА06-2044 и депонирован в Корейском центре культивирования микроорганизмов (KССМ) в соответствии с Будапештским договором 9 декабря 2013 года с номером доступа KССМ11498Р.
Пример 4: Оценка сконструированных штаммов
Для изучения эффекта усиления аргининового оперона и орнитин-карбамоилтрансферазы в отношении способности продуцировать аргинин с использованием Corynebacterium glutamicum KCCM10741P_ΔPargC::lysCP1, KCCM10741P_ΔPargC::lysCP1_Pcj7-argF, KCCM10741P_ΔPargC::lysCP1_Pcj7-argF2, KCCM10741P_ΔPargC::lysCP1_Pcj7-argF/Pcj7-argF2, ATCC21831_ΔPargC::lysCP1, ATCC21831_ΔPargC::lysCP1_Pcj7-argF, ATCC21831_ΔPargC::lysCP1_Pcj7-argF2 и ATCC21831_ΔPargC::lysCP1_Pcj7-argF/Pcj7-argF2, которые представляют собой штаммы, продуцирующие аргинин, сконструированные в Примере 3, их культивировали как показано ниже. В частности, Corynebacterium glutamicum KССМ10741Р и АТСС21831, которые представляют собой родительские штаммы, использовали в качестве контроля, и платиновую петлю этих штаммов соответственно вносили в 250 мл колбу с угловыми перегородками, содержащую 25 мл (6% глюкозы, 3% сульфата аммония, 0,1% фосфата калия, 0,2% гептагидрата сульфата магния, 1,5% жидкого кукурузного экстракта (CSL), 1% NaCl, 0,5% дрожжевого экстракта и 100 мкг/л биотина, рН 7,2) продукционной среды и инкубировали при 30°С при 200 об/мин в течение 48 часов. После завершения культивирования количество полученного L-аргинина измеряли путем ВЭЖХ, и результаты показаны в Таблице 1 ниже.
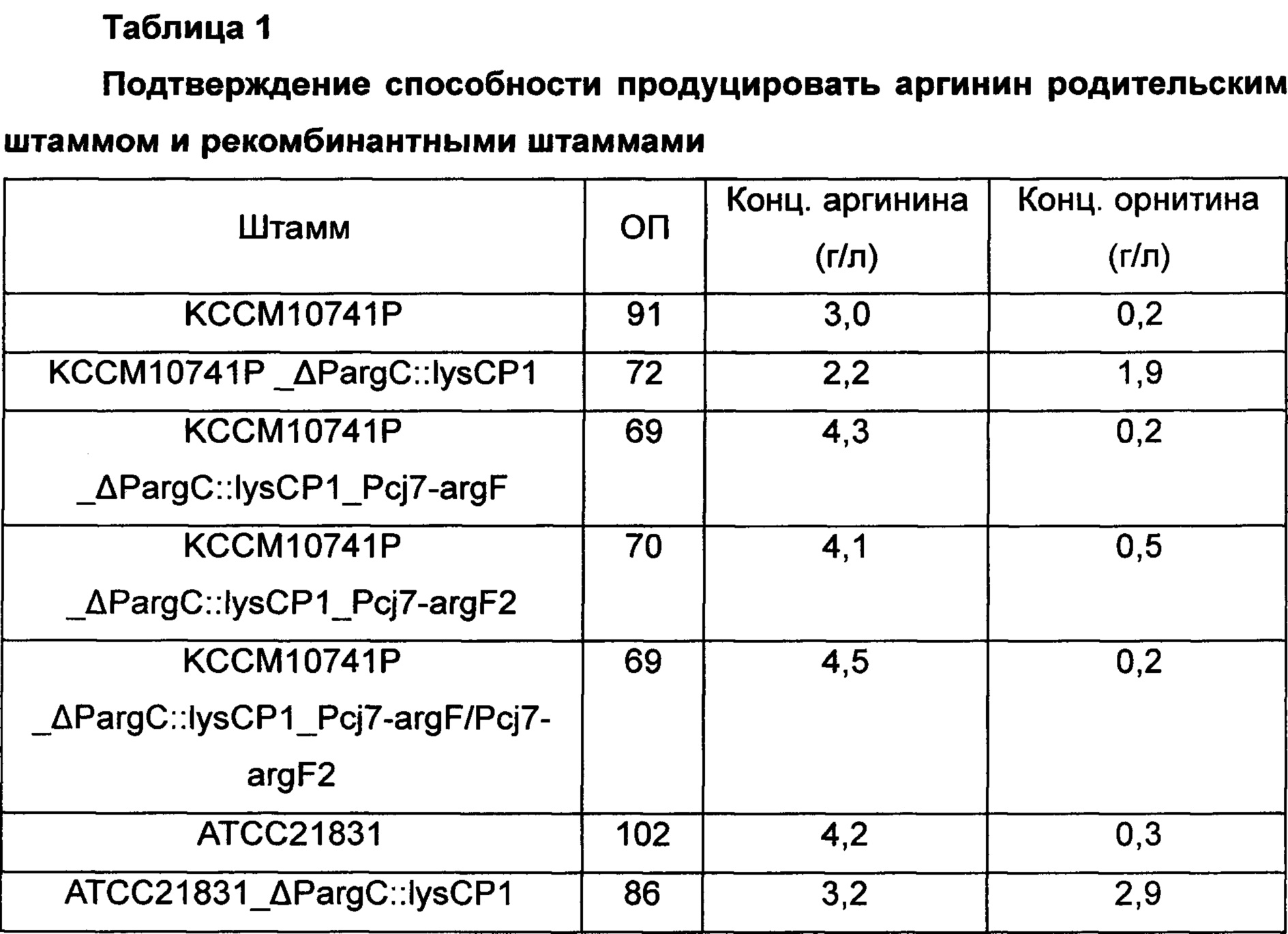
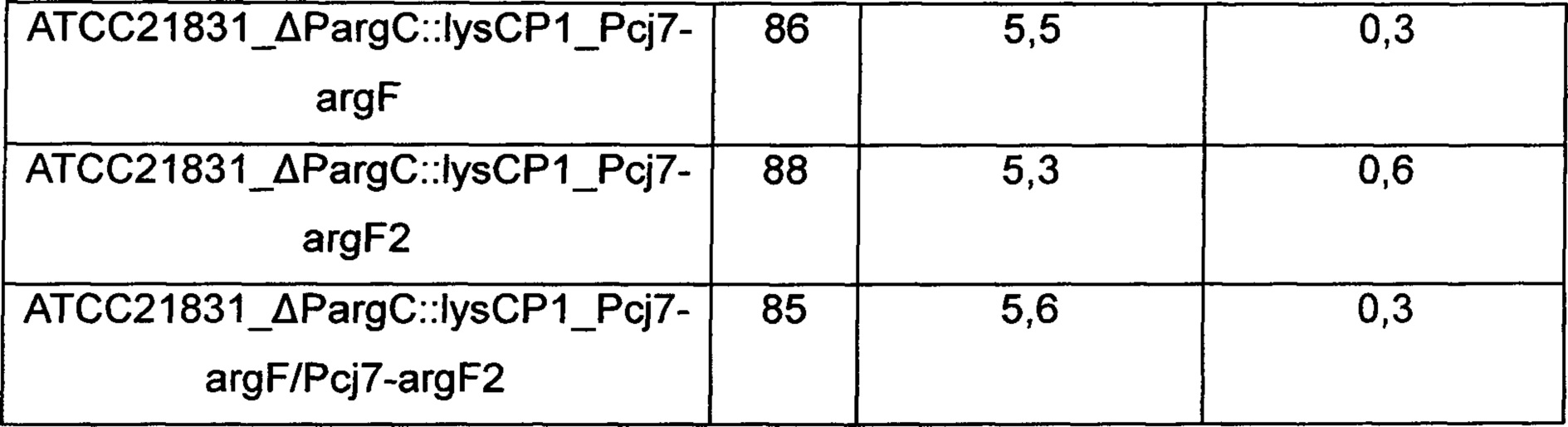
ОП - оптическая плотность
Как показано в Таблице 1 выше, штаммы, у которых гены, кодирующие аргининовый оперон и орнитин-карбамоилтрансферазу, были одновременно усилены, демонстрировали макимальное 50% усиление способности продуцировать аргинин относительно таковой в контроле. Дополнительно, увеличение концентрации аргинина и концентрации орнитина, показанных при усилении только аргининового оперона (KCCM10741P_ΔPargC::lysCP1 и ATCC21831_ΔPargC::lysCP1), было достигнуто путем введения argF, argF2 или argF и argF2, и в итоге демонстрируя результат по увеличению концентрации аргинина.
На основании вышеизложенного специалист в области техники, к которой относится данное изобретение, способен понять, что настоящее изобретение может быть воплощено в других конкретных формах без изменения технической идеи или существенных признаков настоящего изобретения. В этом отношении примеры воплощений, раскрытые здесь, служат исключительно для иллюстративных целей и не предназначены ограничивать объем настоящего изобретения. Наоборот, настоящее изобретение предназначено охватывать не только воплощения, представленные в примерах, но также различные альтернативные, модифицированные, эквивалентные и другие воплощения, которые могут быть включены в пределах сущности и объема настоящего изобретения, как определено в прилагаемой формуле.

