Результат интеллектуальной деятельности: СПОСОБ ИЗМЕРЕНИЯ КОЛИЧЕСТВА ПОЛИСОРБАТА-80 С ПРИМЕНЕНИЕМ ЩЕЛОЧНОГО ГИДРОЛИЗА ОБРАЗЦА С ПОСЛЕДУЮЩЕЙ ВЭЖХ
Вид РИД
Изобретение
Изобретение относится к способам количественного определения полисорбата-80 в растворах терапевтических белков и к способам быстрой высокоэффективной жидкостной хроматографии. Предложенный способ позволяет значительно сократить время проведения анализа и повысить его чувствительность за счет применения изократической обращенно-фазовой высокоэффективной жидкостной хроматографии.
Полисорбат-80 - один из самых популярных детергентов, предотвращающий агрегацию белка и обладающий выраженной противовирусной активностью. По этой причине его часто добавляют в полупродукты и готовые формы препаратов на основе терапевтических белков. Содержание полисорбата-80 в составе лекарственного средства должно тщательно контролироваться в связи с его склонностью к деградации.
Из уровня техники известны следующие способы решения задачи контроля содержания полисорбата-80 в продуктах: документы WO 2012119724, CN 103403544 и ЕР 2681553 раскрывают способы, включающие проведение щелочного гидролиза проб, дериватизацию продуктов гидролиза полисорбата-80 путем присоединения хромофорных меток, и последующего количественного определения полисорбата-80 оптическими способами (например, спектрофотометрией). Недостатком данного подхода можно считать необходимость предварительного осаждения белковой фракции, длительность и сложность пробоподготовки, а также высокую погрешность метода. Документ CN 101943684 раскрывает количественный анализ полисорбата-80 без гидролиза и дериватизации путем обращенно-фазовой ВЭЖХ с УФ-детектированием сигнала. Недостатками метода являются низкие специфичность и чувствительность, а также относительно большая длительность хроматографии. Если принять во внимание необходимость проведения щелочного гидролиза образца, наиболее близким к предлагаемому способу может быть назван способ, раскрытый в документе WO 2012119724. От известного способа предложенный в настоящей заявке метод отличается тем, что после проведения щелочного гидролиза проводят анализ образца методом высокоэффективной жидкостной хроматографии в изократическом режиме, детекция аналита ведется с помощью УФ-детектора, и идентификация продукта реакции производится путем хроматографирования аналитического стандарта олеиновой кислоты с регистрацией времени удерживания ее пика.
В целом, известные подходы, основанные на хроматографическом анализе интактного полисорбата-80, характеризуются недостатками, связанными с необходимостью предварительного осаждения белковой фракции, а также необходимостью использования дополнительных детекторов: испарительного светорассеяния, заряженного аэрозоля; невысокой чувствительностью, нелинейной зависимостью между количеством введенного вещества и откликом детектора. Недостатки подходов, связанных с предварительным проведением щелочного гидролиза полисорбата-80 с последующим присоединением хромофорной метки и
спектрофотометрическим анализом, заключаются в необходимости проведения стадий предварительного осаждения белковой фракции и присоединения метки, что отрицательно сказывается на длительности пробоподготовки и всего анализа.
Основными проблемами в количественном анализе полисорбата-80 является его полимерная природа и отсутствие хромофорных групп, что, во-первых, требует большой длительности применяемых методик хроматографического анализа как для самого полисорбата-80, так и для его характеристических производных, а во-вторых, ведет к высокому уровню ошибок при определении концентрации полисорбата-80 спектрофотометрическим методом.
Для решения проблем количественного анализа полисорбата-80 автор изобретения взял за основу способ щелочного гидролиза, совместив его с высокоэффективной жидкостной хроматографией, во время которой проводится определение количества аналита с помощью УФ-детектора. Тем самым удалось избавиться от стадий осаждения белковой фракции и дериватизации гидролизата. Применение изократического элюирования и короткой колонки позволило сократить время хроматографического анализа, повысить его чувствительность, снизить требования к хроматографической системе и расход подвижной фазы. Применение УФ-детектора в предложенном способе дает значительные преимущества в чувствительности и производительности по сравнению с применением метода ВЭЖХ в сочетании с ELS-детектором: ориентировочный предел детектирования в случае ELS-детектора составляет порядка 1.2 мкг полисорбата-80 против 25 нг в предложенном способе; общая длительность пробоподготовки составляет порядка 1,5 часов против 6 часов для ELS-детектора, а время получения одной хроматограммы составляет 5 минут (против диапазона от 13 до 30 минут, в зависимости от колонки, для ELS). Нелинейное изменение отклика ELS-детектора на ввод разных количеств полисорбата-80 усложняет построение калибровочной кривой и сужает аналитический диапазон метода. Требуется также большее количество образца для анализа: порядка 1 мл (против 0,2 мл у предложенного способа).
Снижение нижнего предела детектирования (LOD) и нижнего предела количественного обнаружения (LLOQ) было достигнуто, прежде всего, за счет минимального дрейфа базовой линии при изократическом режиме хроматографии. Высокая скорость потока и использование колонки с небольшим размером пор сорбента (в диапазоне от 1,7 до 5,0 мкм) позволяет получить узкую хроматографическую фракцию целевого компонента, а, следовательно, увеличить высоту пика, что также снижает пределы LOD и LLOQ. Установка длины волны УФ-детектора для снятия сигнала на уровне 200 нм определяет максимальное соотношение «сигнал : шум» в диапазоне от 190 до 210 нм, таким образом также улучшая параметры LOD и LLOQ.
Краткое описание чертежей
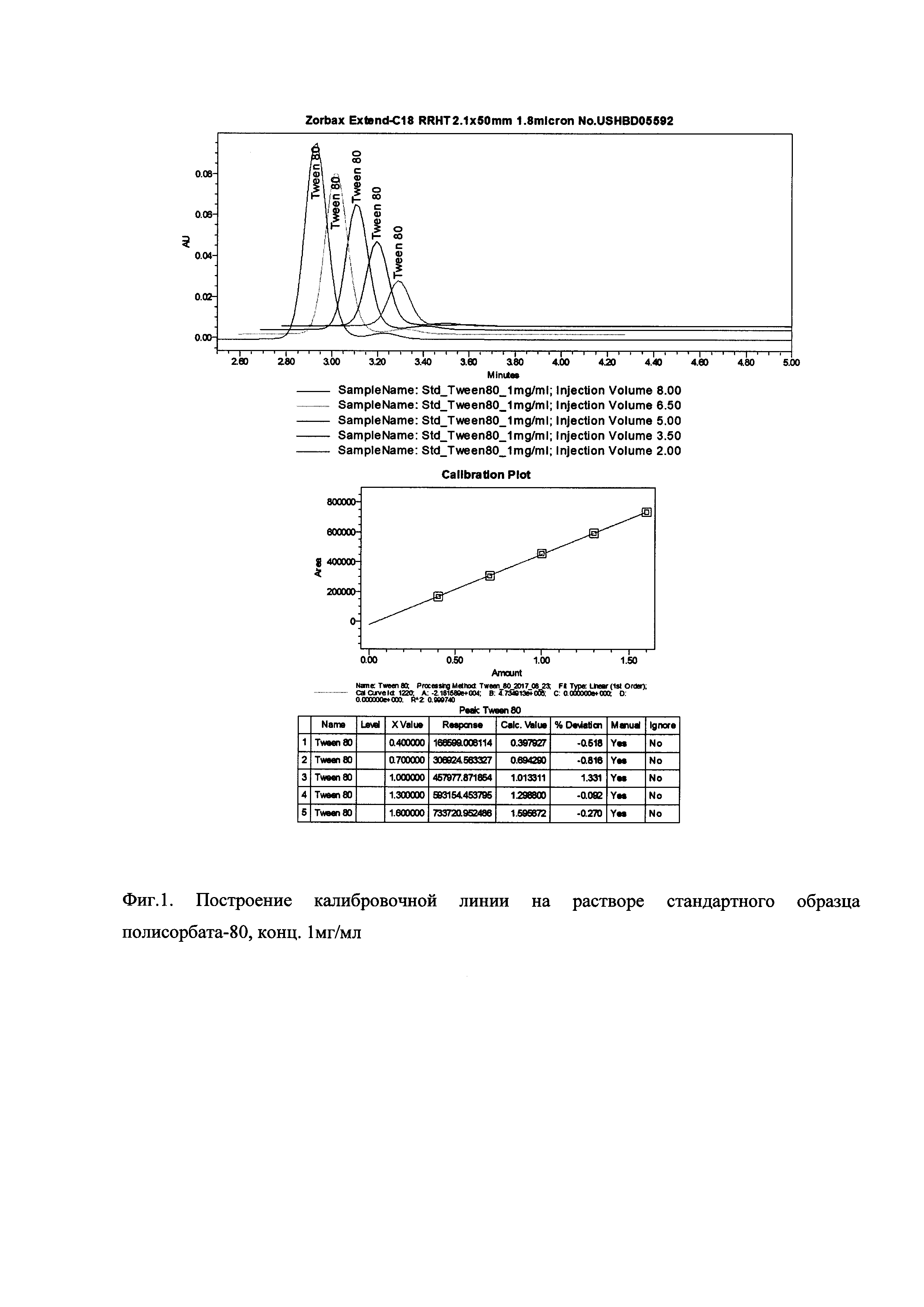
Фиг. 1. Построение калибровочной линии на растворе стандартного образца полисорбата-80, конценрация 1 мг/мл.
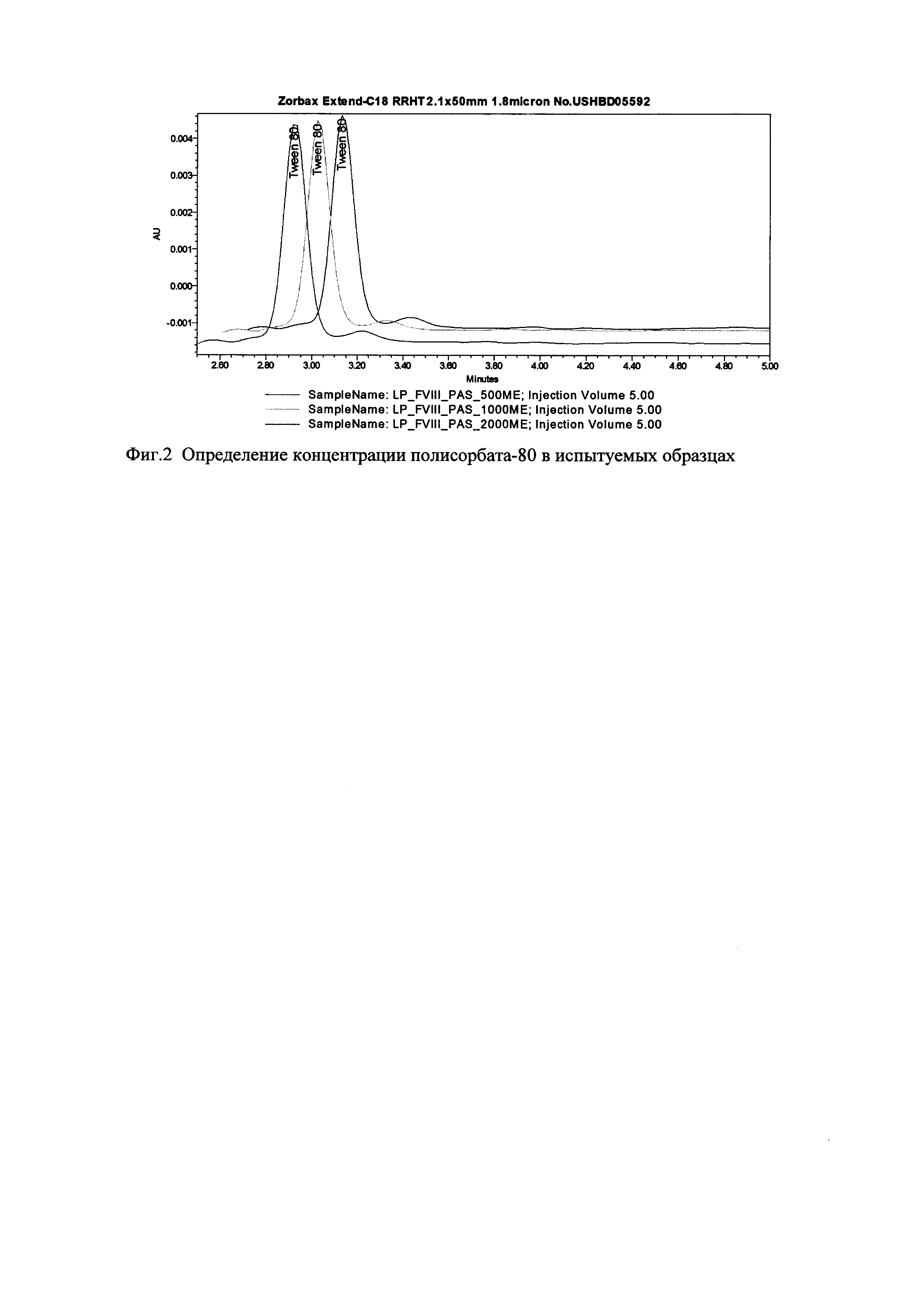
Фиг. 2. Определение концентрации полисорбата-80 в испытуемых образцах.
Фиг. 3. Хроматографические профили 6 повторных инжекций Экулизумаба серии Р0002701 в разведении 1/10. Отмечены пики олеиновой кислоты.
Фиг. 4. Хроматографические профили 6 повторных инжекций Адалимумаба серии 011115 в разведении 1/100. Отмечены пики олеиновой кислоты.
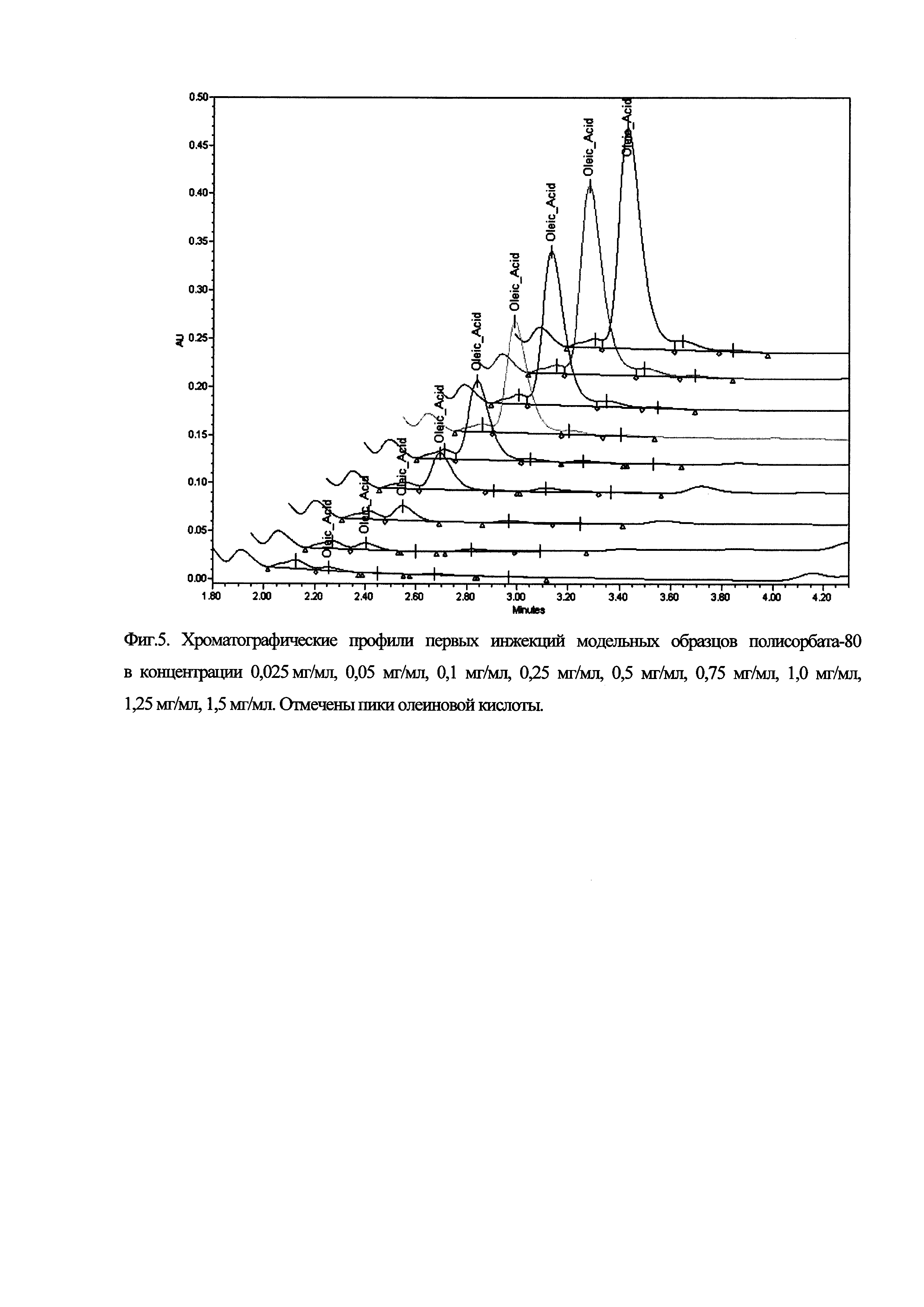
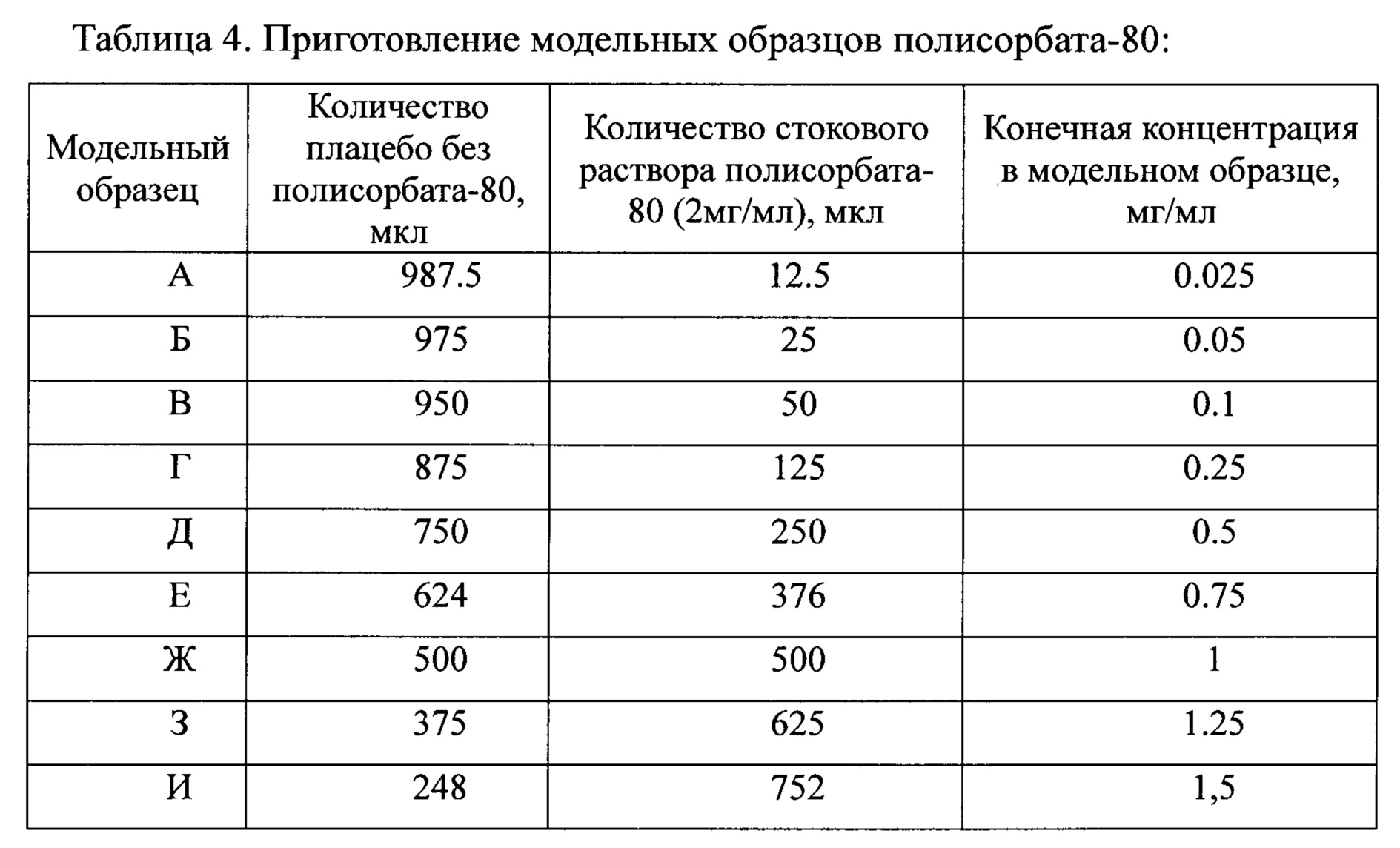
Фиг. 5. Хроматографические профили первых инжекций модельных образцов полисорбата-80 в концентрации 0,025 мг/мл, 0,05 мг/мл, 0,1 мг/мл, 0,25 мг/мл, 0,5 мг/мл, 0,75 мг/мл, 1,0 мг/мл, 1,25 мг/мл, 1,5 мг/мл. Отмечены пики олеиновой кислоты.
Материалы и методы.
Щелочной гидролиз.
Гидролиз полисорбата-80 проводят добавлением к 0,2 мл образца 0,2 мл 5М раствора КОН с последующей инкубацией в течение 30 минут при 85°C с получением характеристического продукта - олеиновой кислоты. По окончании инкубации к образцу дополнительно добавляют 0,1 мл 5М раствора KOH и 0,4 мл ацетонитрила. Смесь тщательно перемешивают на вортексе и центрифугируют в течение 5 минут на скорости 9300g. Затем отбирают 0,1 мл жидкости из верхнего слоя, добавляют к 0,0235 мл воды и перемешивают. Экстракт используют свежеприготовленным.
Хроматографический анализ проб
Анализ проводят с использованием хроматографической колонки с сорбентом на основе бутилсилана, пентилсилана, октилсилана или октодецилсилана, оптимально - октодецилсилана; размером пор от 1,7 до 5,0 мкм, предпочтительно от 1,7 до 3,5 мкм, оптимально - 1,8 мкм; внутренним диаметром 0,5-5,0 мм, предпочтительно - 1,0-3,0 мм, оптимально - 2,1 мм; длиной 30-300 мм, предпочтительно 30-75 мм, оптимально - 50 мм; с использованием водно-ацетонитрильной подвижной фазы с объемным соотношением компонентов в диапазоне от 30/70 до 15/95, соответственно, предпочтительно - 25/74-20/80, оптимально - 19/81; с добавкой объемной доли ион-парного реагента (дифторуксусной кислоты, трифторуксусной кислоты, муравьиной кислоты, уксусной кислоты, пропионовой кислоты; предпочтительно - дифторуксусной или трифторуксусной кислоты, оптимально - трифторуксусной кислоты) в диапазоне 0,01-2%, предпочтительно - 0,05-0,5%, оптимально - 0,1% при скорости потока фазы 0,02-5,0 мл/мин; предпочтительно - 0,2-1,0 мл/мин, оптимально - 0,5 мл/мин; температуре термостата колонок от +15 до +50°C, предпочтительно - от +25 до +35°C, оптимально - при +30°C; временем регистрации хроматограммы от 1,0 до 20 минут, предпочтительно - 3,0-10,0 минут, оптимально - 5,0 минут на детекторе УФ/видимой области или диодной матрице в диапазоне длин волн 190-240 нм, предпочтительно - 195-205 нм, оптимально - 200 нм.
Идентификация целевого компонента (олеиновой кислоты).
Идентификация продукта реакции производится путем хроматографирования аналитического стандарта олеиновой кислоты с регистрацией времени удерживания ее пика и последующим сравнением его с временами удерживания хроматографических пиков в испытуемых образцах. Установление концентрации полисорбата-80 в исследуемом образце производят по методу внешней калибровки. Для этого вводят в хроматограф различные количества гидролизата полисорбата-80 того же производителя, что и в исследуемом образце, и строят линейную зависимость площади пика олеиновой кислоты от количества введенного гидролизата. Затем вводят значение площади пика олеиновой кислоты хроматограммы анализируемого образца в полученное уравнение зависимости и получают массовую концентрацию полисорбата-80 в пробе.
По результатам валидации методики была установлена следующая характеристика способа:
Нижний предел детектирования составляет 25 нг полисорбата-80 (125 ppb); нижний предел количественного определения - 100 нг полисорбата-80 (500 ppb).
Аналитический диапазон методики находится в границах 0,025-1,5 мг/мл полисорбата-80.
Степень извлечения находится в диапазоне 92,1-107,5%.
Максимальное значение коэффициента вариации (CV) 18 повторных определений, выполненных в течение 3 дней двумя различными операторами, характеризующего воспроизводимость методики, составляет 2,69%.
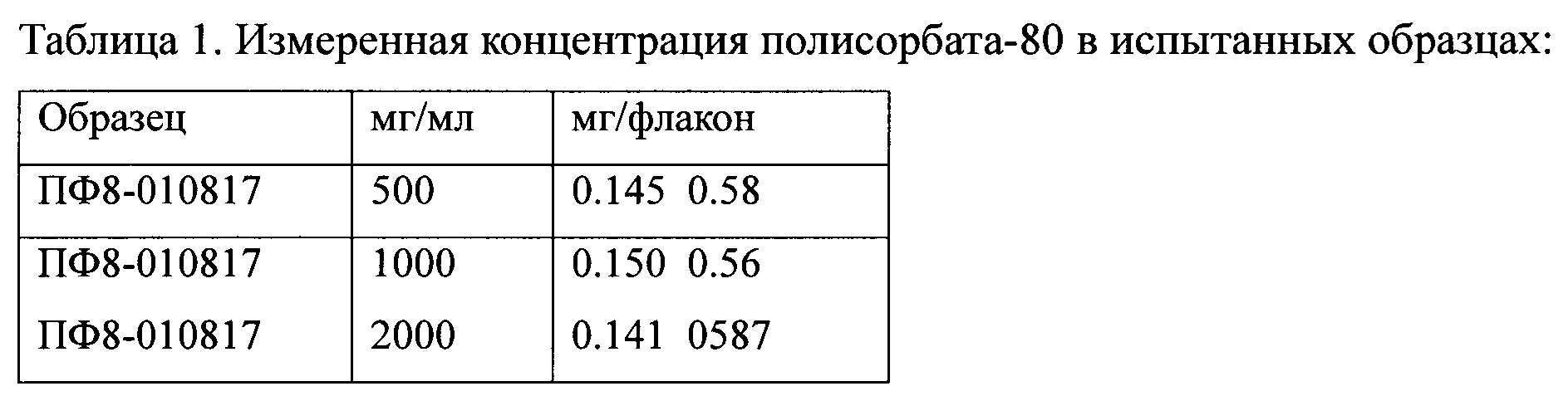
Пример 1. Количественное определение полисорбата-80 в образцах с различным содержанием модифицированного антигемофильного глобулина.
Оборудование: Система ВЭЖХ Alliance е2695, с детектором UV/Visible Detector 2489
Колонка: Zorbax Extend-C18 RRHT 2.1×50 mm 1.8 micron №USHBD05592
Параметры: Vкол=0.17 мл, Рmax=8700 psi; рН=2.0-11.5
Условия: Скорость потока: 0,5 мл/мин
Время и параметры регистрации хроматограммы: 5 мин
температура колонки = 30°C; температура образца = 25°C; □=200 нм
Подвижная фаза: 0,1% ТФУ в 81% ацетонитриле
Реагенты: 5М раствор KOH, исходный раствор полисорбата-80 с концентрацией 200,0 мг/мл, стандартный раствор полисорбата-80 с концентрацией 1,0 мг/мл.
Приготовление подвижной фазы: Смешать 202.5 мл ацетонитрила, 250 мкл трифторуксусной кислоты и довести до 250 мл водой очищенной.
Раствор олеиновой кислоты с концентрацией 1 мг/мл: 0,1 г олеиновой кислоты растворить в 90 мл смеси ацетонитрил : вода в соотношении 1:1, довести объем раствора до 100 мл смесью ацетонитрил : вода в соотношении 1:1
Испытуемый раствор / Стандартный раствор полисорбата-80. 0,2 мл испытуемого образца / стандартного раствора полисорбата-80 с концентрацией 1,0 мг/мл поместить в центрифужную микропробирку вместимостью 1,5 мл, добавить 0,2 мл 5 М раствора гидроксида калия, перемешать и инкубировать в течение 30±2 мин в термошейкере при температуре (85±0,2)°C.
По окончании инкубации к полученному раствору добавить 100 мкл 5 М раствора гидроксида калия, 400 мкл ацетонитрила, тщательно (в течение 20 секунд) перемешать на Вортекс V-1 plus и центрифугировать полученный раствор в течение 5 мин со скоростью 9300 g при температуре (22±0,1)°C. Далее, из приготовленных растворов перенести 100 мкл жидкости из верхнего слоя в пробирку вместимостью 1,5 мл, добавить 23,5 мкл воды и перемешать. Полученные таким образом холостой раствор / испытуемый раствор / Калибровочный раствор полисорбата-80 перенести в соответствующим образом промаркированные флаконы.
Процесс построения калибровочной линии проиллюстрирован на Фиг. 1. Определение концентрации полисорбата-80 в опытных образцах проиллюстрировано на Фиг. 2.
Пример 2. Определение предела количественного определения пика олеиновой кислоты
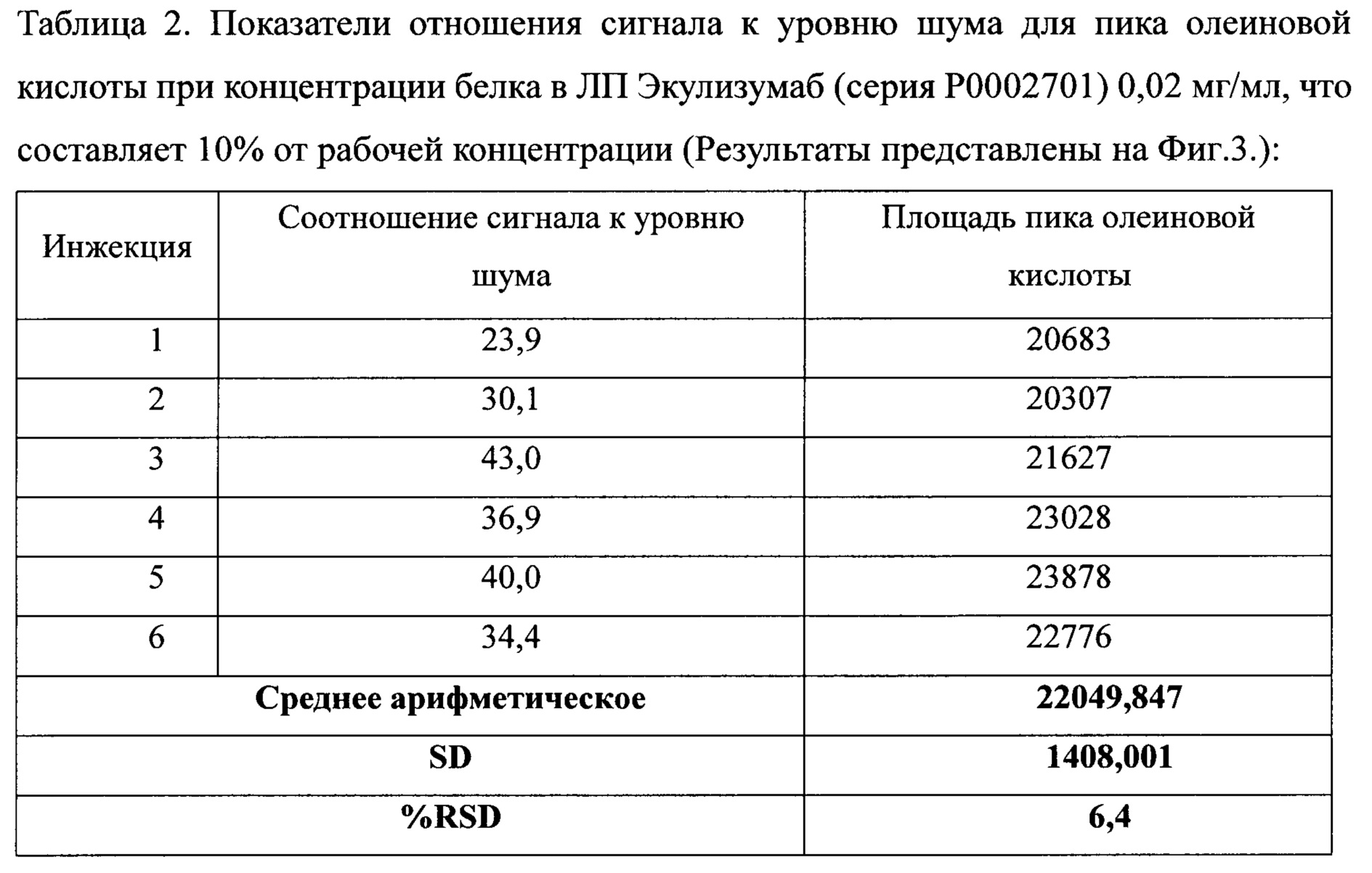
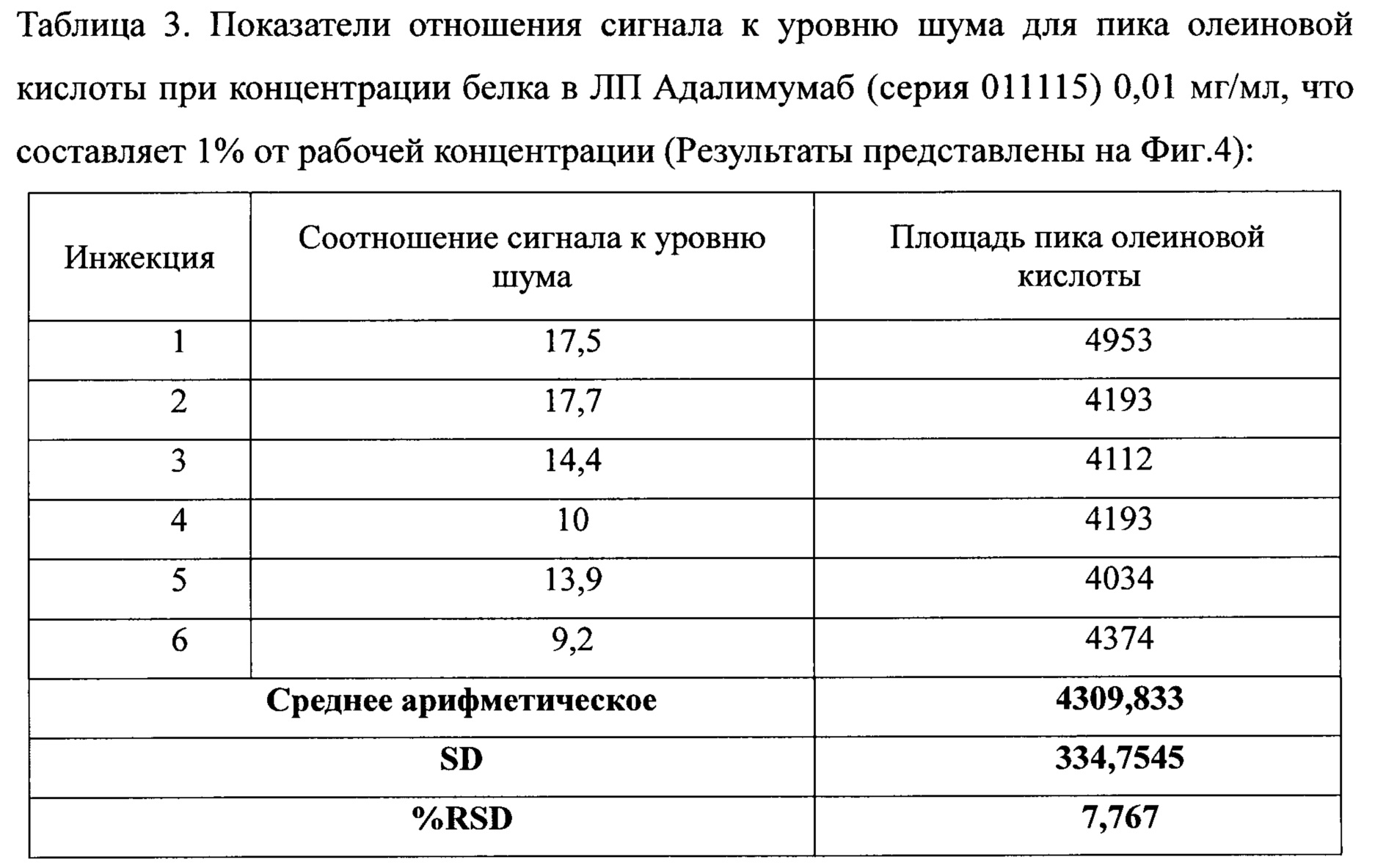
Анализировались разведения 1 серии лекарственного препарата (далее ЛП) Экулизумаб и 1 серии ЛП Адалимумаб по 6 инжекций каждого, начиная от 2 мкг/мл до рабочей концентрации ЛП.
Критерий оценки:
- Соотношение уровня сигнала к уровню шума для пика олеиновой кислоты должно быть ≥10:1 по крайней мере 5 раз из 6 повторов.
- RSD шести определений для ЛП Экулизумаб должно быть меньше или равно 7,5%, для ЛП Адалимумаб - меньше или равно 10,7%.
Результат:
Предел количественного определения пика олеиновой кислоты был определен как концентрации белков в ЛП Экулизумаб - 20 мкг/мл, что составляет 10% от рабочей концентрации, и в ЛП Адалимумаб - 10 мкг/мл, что составляет 1% от рабочей концентрации. Эти концентрации дают сигнал приблизительно в 10 раза больше, чем уровень шума.
Пример 3. Проверка линейности аналитического диапазона
Анализировались модельные образцы полисорбата-80 по 6 инжекций каждого, начиная от 0,025 до 1,5 мг/мл. По итогам эксперимента строили график зависимости заданной концентрации полисорбата-80 в модельных образцах от площади пика олеиновой кислоты и аппроксимировали его линейной функцией.
Критерий оценки:
Коэффициент детерминации (R2) линейной зависимости концентрации полисорбата-80 от площади пика олеиновой кислоты должен составлять ≥0,98 (что соответствует значениям модуля коэффициента корреляции r≥0,99).
Результаты представлены на Фиг. 5.
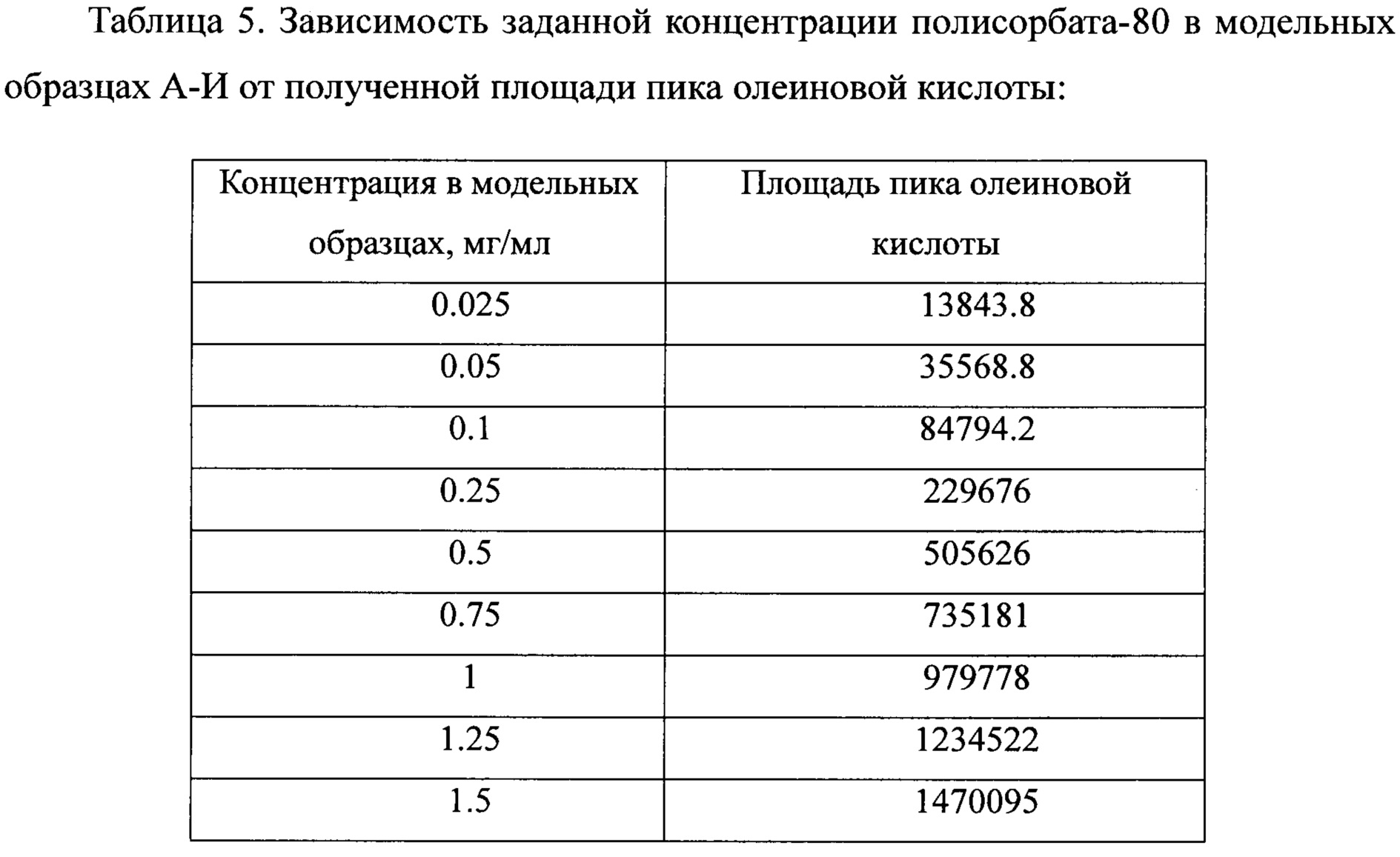
Полученное уравнение линейной функции: у=992428х-10538,
Коэффициент детерминации: 0.9998.
Вывод:
Зависимость заданной концентрации полисорбата-80 в модельных образцах от полученной площади пика олеиновой кислоты линейна, результаты соответствуют критериям оценки.
Пример 4. Проверка правильности метода.
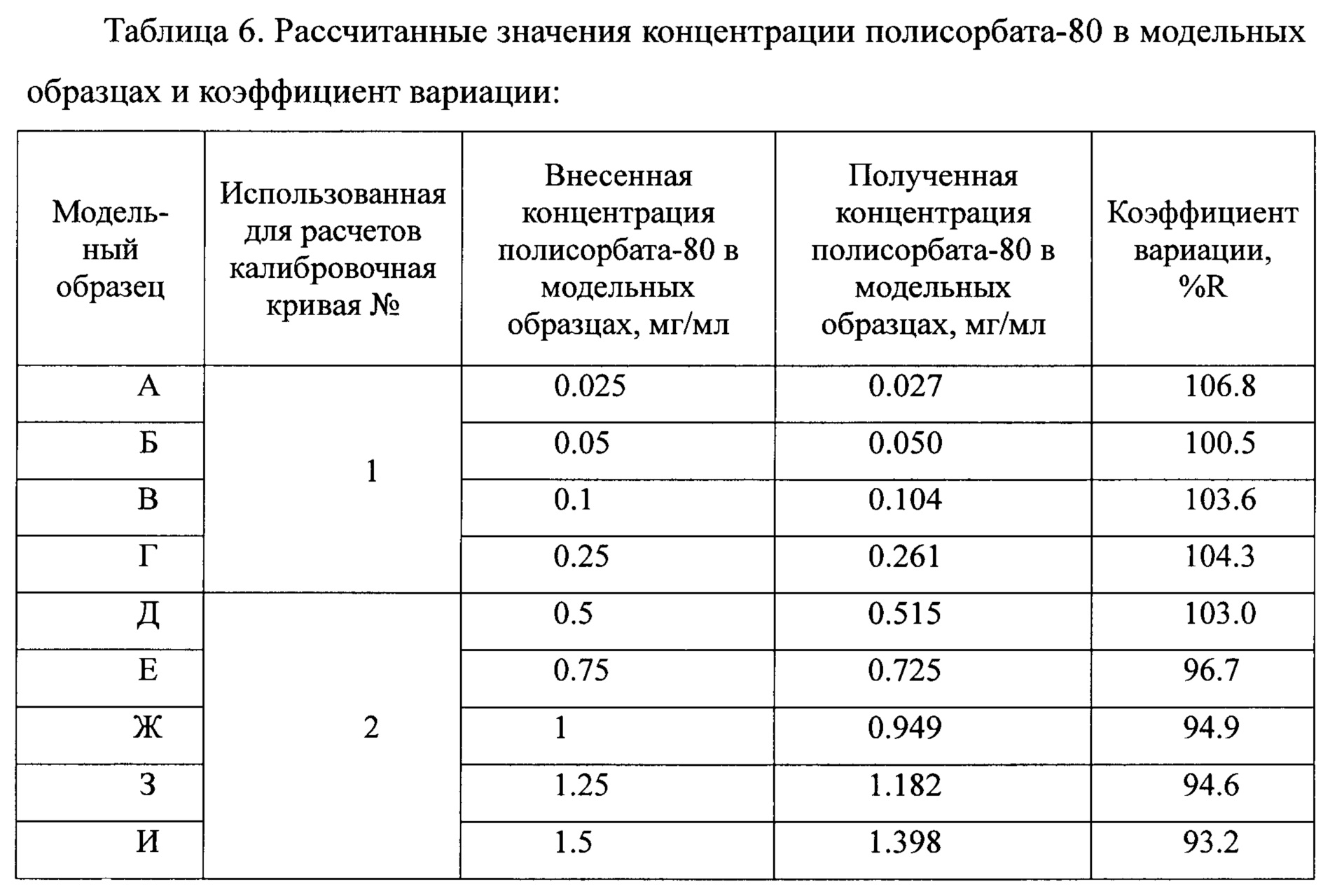
Анализировались модельные образцы полисорбата-80 в диапазоне концентраций от 0,025 мг/мл до 1,5 мг/мл по 6 инжекций каждого. По полученным результатам рассчитывали коэффициент вариации (%R)
Анализировались модельные образцы полисорбата-80 по 6 инжекций каждого, начиная от 0,025 до 1,5 мг/мл. По калибровочной кривой, построенной с помощью стоковых растворов полисорбата-80 (0,2 мг/мл и 1,0 мг/мл) рассчитывали концентрацию полисорбата-80 в модельных образцах. По итогам определяли коэффициент вариации. Результаты представлены на Фиг. 5 и Таблице 6.
Для расчета концентрации полисорбата-80 в образце использовались калибровочные кривые, построенные с использованием стоковых растворов полисорбата-80 (0,2 и 1,0 мг/мл).
Степень извлечения, характеризующую способ, вычисляли по формуле
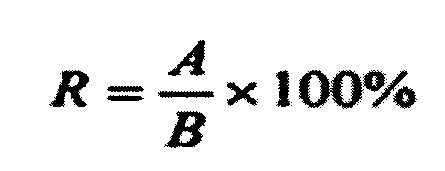
где R (Recovery) - выход, А - измеренное содержание, В - заданный (фактический) уровень.