Результат интеллектуальной деятельности: 3-ГУАНИДИНОАЗОЛО[1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИГЛИКИРУЮЩЕЙ АКТИВНОСТЬЮ И СПОСОБ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к фармацевтической химии и касается азолоаннелированных производных 1,2,4,5-тетразина, содержащих в 3 положении азолотетразиновой системы фрагмент гуанидина, а в 6-ом положении азолотетразиновой системы водород или S-алкильные заместители. Указанные вещества расширяют арсенал биологически активных соединений, обладающих антигликирующей активностью, и могут быть использованы при создании лекарственных средств для профилактики и лечения осложнений сахарного диабета.
Уровень техники
Неферментативное взаимодействие белков с глюкозой (реакция Майяра) приводит к образованию химических соединений - конечных продуктов гликирования (КПГ) [Н. Ансари, З. Рашид, Биомедицинская химия, 2010, 56(2), с. 168]. Именно внутри- и внеклеточное накопление КПГ считают важным фактором патогенеза таких заболеваний, как атеросклероз, сердечная недостаточность, ревматоидный артрит и остеоартрит, нейродегенеративные заболевания [J. Li et al., Nat. Med, 2012, 18(5), p. 783-790], включая болезни Альцгеймера и Паркинсона.
Особенно интенсивно данный процесс протекает при сахарном диабете и имеет немаловажное значение в развитии его осложнений [Шестакова М.В., Шамхалова М.Ш. Ярек-Мартынова И.Я и др. Сахарный диабет, 2011, №1, с. 81-88]. Скорость образования КПГ зависит от уровня и длительности экспозиции глюкозы [Балаболкин М.И. Сахарный диабет, 2002, №. 4, с. 8-16]. Поскольку гликирование происходит в течение длительного периода времени, КПГ влияют на долгоживущие белки, например, главными мишенями являются структурные компоненты соединительной ткани, в частности, коллаген типа IV. Другие долгоживущие белки могут также подвергаться гликированию, в том числе миелин, тубулин, активатор плазминогена 1, фибриноген. Накопление КПГ во внеклеточном матриксе приводит к образованию меж- и внутримолекулярных поперечных сшивок и повышению ригидности кровеносных сосудов. Кроме того, под действием КПГ изменяется состав внеклеточного матрикса, с повышенной экспрессией фибронектина, коллагена типа III, IV, VI и ламинина, возможно, опосредовано через активацию ключевых профибротических цитокинов, таких как трансформирующий фактор роста β и фактор роста соединительной ткани. Рецептор-зависимые эффекты КПГ опосредованы их взаимодействием со специфическими рецепторами, что приводит к активации вторичных передатчиков, таких как протеинкиназа С. Ключевая мишень РКПГ - ядерный фактор NF-κВ, который перемещается в ядро и приводит к повышению транскрипции таких белков, как молекулы межклеточной адгезии-1, Е-селектин, эндотелин-1, сосудистый эндотелиальный фактор роста, провоспалительные цитокины [S.Y. Goh, М.Е. Cooper, Clinical review, the role of advanced glycation end products in progression and complications of diabetes. J. Clin. Endocrinol. Metab., 2008, 1143-1152]. Bee вышеперечисленное лежит в основе патогенеза таких последствий сахарного диабета, как диабетические атеросклероз, нефро-, нейро-, ретино-, кардио-, ангиопатии, которые являются причиной высокого риска инвалидизации и смертности среди пациентов с сахарным диабетом.
На сегодняшний день нет препаратов, специфически угнетающих образование КПГ, применяемых в клинической практике. Интерес к данной проблематике и поиску лекарственных средств, способных тормозить реакцию Майяра, снижать образование конечных продуктов гликирования и предотвращать развитие осложнений сахарного диабета, неуклонно растет. Первым и наиболее изученным веществом, ингибирующим пикирование белков, является аминогуанидин (АГ). Он предотвращает формирование флюоресцирующих КПГ и глюкозо-производных поперечносшитых молекул коллагена [Peyroux J., Sternberg М. Pathologie Biologie, 2006, 54, 405-419]. Механизм антигликирующего действия аминогуанидина связывают с его способностью захватывать реактивные дикарбонильные интермедиаты. Однако клинические испытания данного препарата были остановлены в связи с наличием побочных эффектов [Freedman В.I., Wuerth J.P., Cartwright K., et al Control. Clin. Trials, 1999, 20(5), 493-510; [Bolton W.K., Cattran D.C., Williams M.E., et al. Am. J. Nephrol, 2004, 7, 32-40]
Все вышеперечисленное обусловливает повышенный интерес к поиску ингибиторов образования конечных продуктов избыточного гликозилирования, поскольку препаратов, ингибирующих реакцию Майяра и разрешенных для клинического применения на сегодняшний день, не существует.
Раскрываемые в настоящем изобретении соединения являются новыми, не описанными ранее производными азоло[1,2,4,5]тетразинов и представляют собой вещества общей формулы:
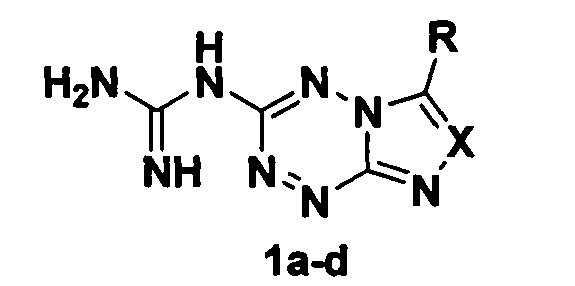
где: X=СН, R=Н (1a); X=СН, R = изопропилтио (1b); X=N, R = изопропилтио (1с);
X=N, R = додецилтио (1d). Аналогами заявляемых соединений по строению являются 3-гуанидинотриазоло[4,3-b][1,2,4,5]тетразин (А) и 3-(3,5-диметилпиразол-1-ил)-6-(изопропилтио)имидазо[1,2-b][1,2,4,5]тетразин (В), аналогом по действию является аминогуанидин (С). Синтез соединения А описан [Успехи в химии и химической технологии, Т. XXVI, 2012, 2 (131), с. 105-109], методика получения вещества В приведена в [Известия АН, сер. химическая, 2015, №9, с. 2100-2105]. Известна ингибирующая активность имидазотетразина В в отношении серин-треониновых протеинкиназ [патент RU 2545438], антигликирующая активность соединений А и В не известна.
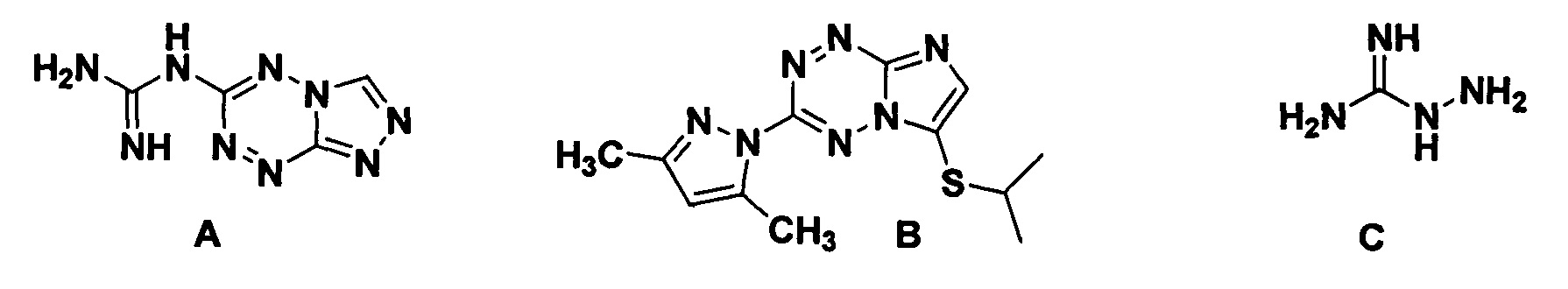
Аналог по действию аминогуанидин (С) тормозит образование карбоксиметиллизина, поперечных сшивок в белке, является не специфическим ингибитором образования КПГ, а также ингибирует NO-синтазу (Ramasamy, R. et al. Receptor for AGE (RAGE): signaling mechanisms in the pathogenesis of diabetes and its complications. R. Ramasamy, S.F. Yan, A.M. Schmidt. Ann N Y Acad Sci. 2011 Dec; 1243:88-102).
При экспериментальном сахарном диабете было показано, что аминогуанидин препятствует развитию диабетической нефропатии, ретинопатии, нейропатии. Однако клинические испытания данного препарата были прекращены из-за выявленных побочных эффектов, таких как пернициозная анемия, гастроинтестинальные симптомы, волчаночно-подобный и гриппоподобный синдромы, васкулит (Thornalley P.J. Use of aminoguanidine (Pimagedine) to prevent the formation of advanced glycation endproducts. / P.J. Thornalley / Archives of Biochemistry and Biophysics 419 (2003) P. 31-40).
Новые соединения, раскрываемые в настоящем изобретении, отличаются от известных и близких по структуре соединений А и В тем, что в положении 6 триазолотетразиновой системы атом водорода заменен на алкилтио, а заместитель 3,5-диметилпиразол-1-ил в положении 3 имидазо[1,2-b][1,2,4,5]тетразина заменен на фрагмент гуанидина. Структуры представленных в изобретении новых соединений подтверждены данными спектроскопии ЯМР 1Н, (спектрометр Avance DRX-400 (Bruker) с рабочей частотой 400 МГц), элементного анализа (автоматический анализатор CHN РЕ 2400 сер. II (Perkin Elmer), масс-спектрометрии.
В литературе [Успехи в химии и химической технологии, T. XXVI, 2012, 2 (131), с. 105-109] описан способ получения 3-гуанидино[1,2,4]триазоло[4,3-b][1,2,4,5]тетразина (А) с выходом 92% взаимодействием 3-(3,5-диметилпиразол-1-ил)[1,2,4]триазоло[4,3-b][1,2,4,5]тетразина с гуанидин гидрохлоридом в ацетонитриле при температуре 20°С в присутствии 1,8-диазабицикло[5,4,0]ундец-7-ена в качестве основания. По утверждению авторов, процесс зависит от температуры: увеличение температуры приводит к образованию значительных количеств побочного продукта - N,N'-ди-[1,2,4]триазоло[4,3-b][1,2,4,5]тетразина. Поскольку авторы не указали время протекания реакции, вероятнее всего, варьирование температуры было необходимо для лучшего растворения гуанидин гидрохлорида.
Нами предложен способ получения заявленных соединений, отличающийся от известного тем, что для их синтеза используют раствор свободного гуанидина в метаноле. Взаимодействие эквимолярных количеств 3-(3,5-диметилпиразол-1-ил)-6-R-азоло[1,2,4,5]тетразина и свободного гуанидина проходит в ацетонитриле при комнатной температуре и не требует присутствия дорогостоящего 1,8-диазабицикло[5,4,0]ундец-7-ена (ДБУ), вследствие высокой основности гуанидина. Процесс длится 15-30 минут, выход соединений составляет 88-93%. Примеры конкретного выполнения
Пример 1
Синтез 3-гуанидиноимидазо[1,2-6][1,2,4,5]тетразина (1а)
В плоскодонную колбу с 10 мл ацетонитрила вносят 215 мг (1 ммоль) 3-(3,5-диметилпиразол-1-ил)имидазо[1,2-b][1,2,4,5]тетразина и при перемешивании на магнитной мешалке прикапывают 0.5 мл метанольного раствора свободного гуанидина (Тр-ра = 118 мг/мл), что соответствует 1 ммоль гуанидина. Через 15 минут выпавший осадок отфильтровывают, промывают на фильтре ацетонитрилом, сушат. Выход 165 мг (93%). Кристаллическое вещество, т.пл. > 350°С (из H2O). Найдено (%): С, 34.06; Н, 3.59; N, 62.79. C5H6N8. Вычислено (%): С, 33.71; Н, 3.39; N, 62.90. Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.97 (уш.с, 4 Н, гуанидино); 8.01, 8.08 (оба с, по 1Н, Н (7) и Н(6) в имидазотетразине).
Пример 2
Синтез 3-гуанидино-6-(изо-пропилтио)имидазо[1,2-b] [1,2,4,5]тетразина (1b)
Получают аналогично соединению 1а из 289 мг (1 ммоль) 3-(3,5-диметилпиразол-1-ил)-6-(изо-пропилтио)имидазо[1,2-b][1,2,4,5]тетразина 0.5 мл раствора свободного гуанидина с Т = 118 мг/мл. Выход 227 мг (90%). Кристаллическое вещество, т.пл. 249-250°С (из ацетонитрила). Найдено (%): С, 38.10; Н, 4.52; N, 44.49. C8H12N8S. Вычислено (%): С, 38.08; Н, 4.79; N, 44.41. Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.22 (д, 6 Н, СН(СН3)2); 3.51-3.47 (м, 1Н, СН(СН3)2); 7.08 (уш.с, 4 Н, гуанидино); 8.12 (с, 1Н, Н (6) в имидазотетразине).
Пример 3
Синтез 3-гуанидино-6-изо-пропилтио[1,2,4]триазоло[4,3-b][1,2,4,5]тетразина (1с)
Получают аналогично соединению 1b из 290 мг (1 ммоль) 3-(3,5-диметилпиразол-1-ил)-6-(изо-пропилтио)триазоло[4,3-b][1,2,4,5]тетразина 0.5 мл раствора свободного гуанидина с Тр-ра = 118 мг/мл. Выход 235 мг (93%). Кристаллическое вещество, т.пл. 269-271°С. Найдено (%): С, 33.32; Н, 4.31; N, 49.45. C7H11N9S. Вычислено (%): С, 33.19; Н, 4.38; N, 49.77. Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.20 (с, 6 Н, СН(СН3)2); 3.84-381 (м, 1Н, СН(СН3)2); 7.17 (уш.с, 4 Н, гуанидино).
Пример 4
Синтез 3-гуанидино-6-додецилтриазоло[4,3-b][1,2,4,5]тетразина (1d)
Получают аналогично соединению 1b из 416 мг (1 ммоль) 3-(3,5-диметилпиразол-1-ил)-6-(додецилтио)триазоло[4,3-b][1,2,4,5]тетразина 0.5 мл раствора свободного гуанидина с Тр-ра = 118 мг/мл. Выход 333 мг (88%). Кристаллическое вещество, т.пл. 270°С (из ацетонитрила). Найдено (%): С, 48.56; Н, 7.81; N, 31.92. C16H29N9S * H2O. Вычислено (%): С, 48.34; Н, 7.86; N, 31.71. Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., Гц): 0.85 (т, 3 Н, -S(CH2)11CH3); 1.23-1.28 (м, 14Н, -SCH2CH2(CH2)7C2H5); 1.34-1.40 (м, 2Н, -S-(CH2)10CH2CH3). 1.66 (дт, 2Н, -S-CH2-CH2, J1=7.40; J2=14.80); 3.24 (т, 2Н, -S-CH2-, J=7.25); 7.16 (уш. с, 4, Н гуанидино).
Определение антигликирующей активности.
Реакцию гликирования воспроизводят по методу [A. Jedsadayanmata Naresuan University Journal, 2005, 13(2), 35-41.]. Реакционная смесь содержит растворы бычьего сывороточного альбумина (1 мг/мл) и глюкозы (500 мМ) в фосфатном буфере (рН 7,4). Для предупреждения бактериального роста в буферный раствор вносят азид натрия в конечной концентрации 0,02%. Все вещества растворяют в диметилсульфоксиде (ДМСО). На первом этапе все вещества изучают в концентрациях 10-3 и 10-4 М. Все экспериментальные образцы инкубируют в течение 24 часов при 60°С. По истечении срока инкубации, проводят определение специфической флуоресценции пикированного бычьего сывороточного альбумина (БСА) на спектрофлуориметре F-7000 (Hitachi, Япония) при длине волны возбуждения 370 нм и испускания 440 нм. В качестве вещества сравнения используют аминогуанидин (соединение С). Статистическую обработку результатов проводят с использованием непараметрического критерия Краскела-Уоллиса с посттестом Данна, табличного редактора Microsoft Excel 2007 и программы GraphPad Prism 5.0. Полученные результаты представлены в таблице 1.
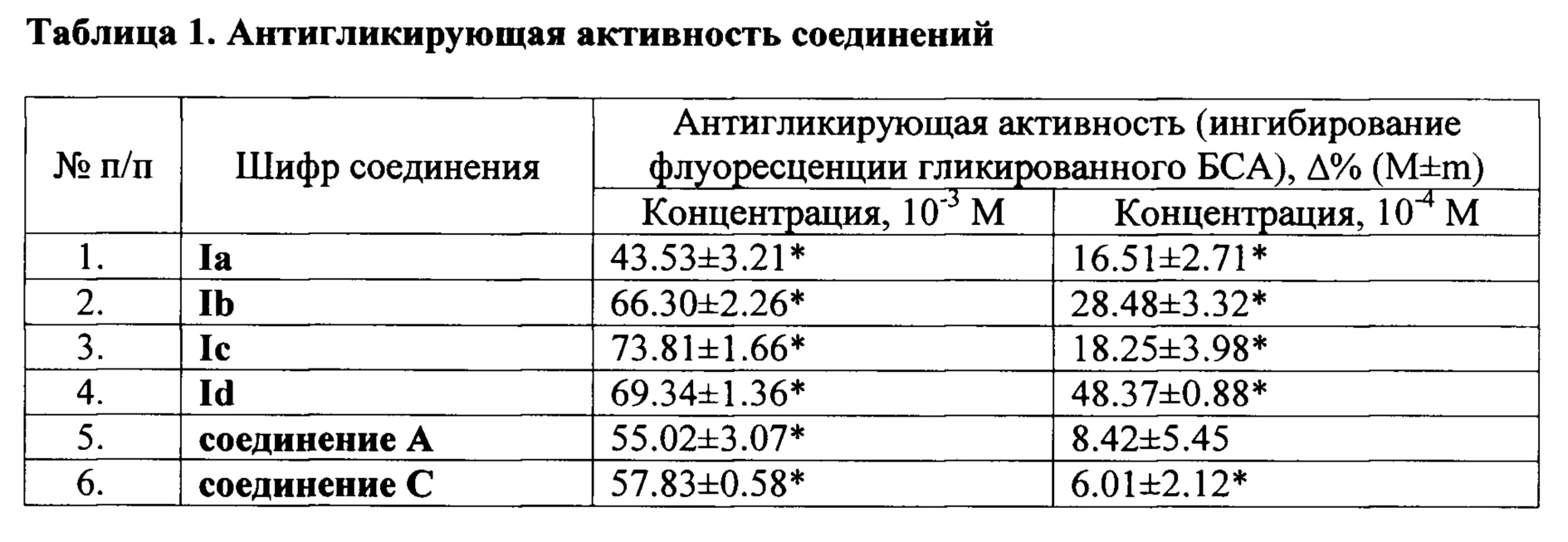
* - данные достоверны по отношению к положительному контролю (критерий Краскела-Уоллиса с посттестом Данна, р<0,05).
Для наиболее активных соединений (1b, 1c, 1d) изучена зависимость антигликирующего эффекта от концентрации и на основе полученных данных рассчитаны показатели IC50 (Табл. 2).
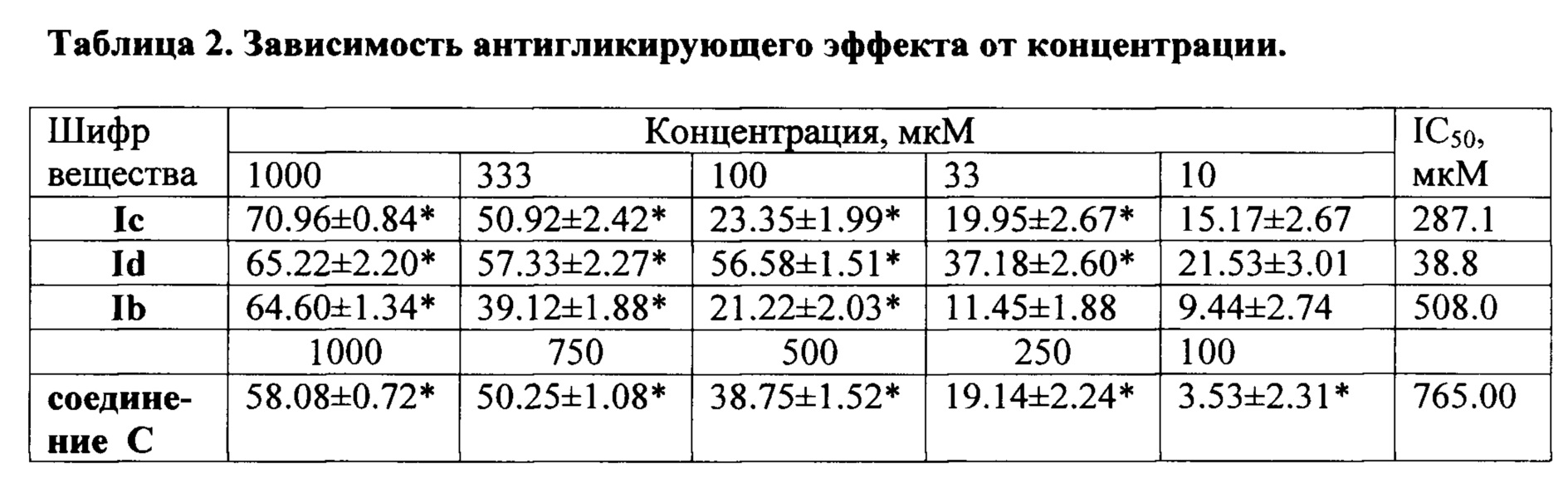
Таким образом, заявляемые соединения (1b-d) обладают антигликирующей активностью, сопоставимой либо превосходящей аналог по действию аминогуанидин (соединение С), и могут быть использованы в практической медицине для профилактики и лечения поздних осложнений сахарного диабета и болезней, вызываемых накоплением в организме продуктов неферментативного взаимодействия белков с глюкозой. Соединения (1a-d), синтезированные взаимодействием эквимолярных количеств соответствующего 3-(3,5-диметилпиразол-1-ил)-6-R-азоло[1,2,4,5]тетразина и свободного гуанидина в ацетонитриле при комнатной температуре, не требуют больших энергозатрат, сравнительно легкодоступны, получаются из товарного, многотоннажного сырья.
![3-ГУАНИДИНОАЗОЛО[1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИГЛИКИРУЮЩЕЙ АКТИВНОСТЬЮ И СПОСОБ ИХ ПОЛУЧЕНИЯ](https://fips.edrid.ru/images/rid/25/62/8f/b0815addccf670df5933af49f2d15104.jpg)
![3-ГУАНИДИНОАЗОЛО[1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИГЛИКИРУЮЩЕЙ АКТИВНОСТЬЮ И СПОСОБ ИХ ПОЛУЧЕНИЯ](https://fips.edrid.ru/images/rid/25/62/8f/d1fe19828e797dd88498050cbc3d17fd.jpg)

