ВНОВЬ ИДЕНТИФИЦИРОВАННЫЕ ПЕПТИДЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ИНДУКЦИИ ТОЛЕРАНТНОСТИ ПРИ ПЕРОРАЛЬНОМ ВВЕДЕНИИ У МОЛОДЫХ МЛЕКОПИТАЮЩИХ
Вид РИД
Изобретение
Область применения изобретения
Настоящее изобретение относится к вновь идентифицированным пептидам β-лактоглобулина, которые являются гипоаллергенными, но сохраняют способность к индукции толерантности к нативному белку. Пептиды можно вводить всем младенцам, особенно тем, которые подвержены риску развития аллергии на белки коровьего молока, в частности на β-лактоглобулин. Пептиды способны к модулированию иммунного ответа младенца на аллергены.
Предпосылки создания изобретения
Аллергия на коровье молоко (СМА) возникает у приблизительно 2,5% всех младенцев и считается наиболее распространенной пищевой аллергией в этой возрастной группе [Sicherer SH et al. (2010), Food allergy, Sampson HA, J. Allergy Clin. Immunol. (125)]. У приблизительно 85% детей аллергия на коровье молоко исчезает до достижения возраста 2-3 лет. Таким образом, в других возрастных группах распространенность СМА ниже.
Аллергии на коровье молоко и смеси, содержащие коровье молоко, приспособленные к потребностям младенцев, обусловлены тем, что белки коровьего молока отличаются от белков материнского молока и могут представлять собой аллергены.
Помимо грудного вскармливания, основной рекомендацией для профилактики СМА является применение частично гидролизованных гипоаллергенных смесей, которые рекомендуется назначать подверженным риску, не имеющим симптомов младенцам, родители которых имеют атопические заболевания.
В противоположность стандартным детским смесям на основе коровьего молока, в гипоаллергенных смесях белки коровьего молока гидролизованы с целью снижения их потенциальной аллергенности. Этот подход показал свою эффективность в профилактике сенсибилизации с помощью нативных (полноразмерных) белков, присутствующих в смесях (хотя и в гораздо меньшем количестве, чем в негидролизованной смеси).
Гидролизаты могут характеризоваться как «частичные» или «глубокие» в зависимости от степени прохождения реакции гидролиза. В настоящее время не существует утвержденного юридического/клинического определения глубоко гидролизованных продуктов согласно руководящим указаниям WAO (Всемирной аллергологической организации) в отношении СМА, но существует соглашение о том, что, согласно WAO, гидролизованные смеси зарекомендовали себя как полезный и широко применяемый источник белка для младенцев, страдающих СМА. В настоящем изобретении частичным считается гидролизат, в котором 60% популяции белков/пептидов имеет молекулярную массу менее 1000 дальтон, в то время как глубоким считается гидролизат, в котором по меньшей мере 95% популяции белков/пептидов имеет молекулярную массу менее 1000 дальтон. Эти определения используются в отрасли в настоящее время.
На данный момент на рынке представлено много примеров гипоаллергенных частично или глубоко гидролизованных смесей на основе казеина или молочной сыворотки (например, NAN-HA™, также известная как ВЕВА-НА™, Alfare™,  от компании
от компании  и S26-HA™ от компании Pfizer).
и S26-HA™ от компании Pfizer).
Для детей, у которых уже есть проявления симптомов СМА, подходящей альтернативой стандартным или гипоаллергенным смесям на основе коровьего молока может служить смесь на основе неаллергенного заменителя молока, например смеси на основе свободных аминокислот (например, Vivonex™ от компании  ) или сои (такие как S-26 Soy™, NURSOY™ от компании Pfizer, г. Нью-Йорк, и
) или сои (такие как S-26 Soy™, NURSOY™ от компании Pfizer, г. Нью-Йорк, и  Good Start® ALSOY® от компании
Good Start® ALSOY® от компании  ).
).
Таким образом, на сегодняшний день в области обеспечения питания для детей с аллергией на коровье молоко основное внимание уделяется выявлению препаратов, не индуцирующих аллергический ответ, - т.е. созданию неаллергенных композиций. Один из недостатков введения неаллергенных смесей (содержащих свободные аминокислоты, соевое молоко или глубоко гидролизованные белки коровьего молока) младенцам заключается в том, что такие композиции позволяют младенцам с аллергией на коровье молоко избегать аллергического ответа, но при этом они не позволяют этим детям вырабатывать толерантность при пероральном введении к аллергенам белков коровьего молока, так чтобы в дальнейшей жизни они смогли продолжать пить неизмененные молочные продукты.
Толерантность при пероральном введении представляет собой специфическую супрессию клеточной и/или гуморальной иммунной реактивности на антиген предшествующим введением антигена пероральным путем. Это важная составляющая развития иммунной системы в первые месяцы жизни, которая позволяет младенцу употреблять продукты питания без развития нежелательной реакции. Неудачное формирование толерантности при пероральном введении приводит к развитию аллергии. Развитие толерантности при пероральном введении связано с нормальным обучением иммунной системы, которое приводит к уменьшению реакции на пищевые антигены.
Было выявлено несколько факторов, влияющих на индукцию и поддержание толерантности при пероральном введении, к которым относятся: структура пищевого белка, доза и частота введения антигена, а также иммунный статус организма-хозяина.
Считается, что некоторые пептиды, которые могут определенно присутствовать в частично гидролизованной детской смеси, обладают способностью к взаимодействию с иммунной системой и индукции толерантности при пероральном введении.
Обнаружено, что частично гидролизованные молочные композиции не только характеризуются пониженной аллергенностью, но также могут индуцировать иммунологическую толерантность к белкам молока (ЕР 0827679).
Таким образом, в заявке на европейский патент ЕР 2332428 описана композиция, содержащая гидролизат, содержащий пептиды коровьего молока, способные к индукции толерантности при пероральном введении. Рассматриваемые пептиды были идентифицированы как происходящие от коровьего казеина.
В публикации WO 00/42863 описана идентификация ряда толерогенных пептидов β-лактоглобулина (одного из основных аллергенов коровьего молока), способных к индукции толерантности при пероральном введении, о чем свидетельствует снижение иммунного ответа (IgE) на нативный белок у мышей, которых предварительно подвергали воздействию рассматриваемых пептидов, по сравнению с мышами, которых не подвергали воздействию этих пептидов. В этой заявке на патент авторы ссылаются на публикацию ЕР 0629350, в которой описано применение неаллергенных гидролизатов белков молочной сыворотки, способных, как утверждается, к индукции толерантности к белкам коровьего молока. Авторы публикации WO 00/42863 указывают на то, что, хотя в публикации ЕР 0629350 было заявлено, что гидролизаты белков молочной сыворотки, по существу не содержащие аллергенных белков, можно применять для индукции толерантности к белкам коровьего молока у детей, подверженных риску развития аллергии на коровье молоко, проанализировав другие неаллергенные гидролизаты белков молочной сыворотки, они обнаружили, что неаллергенность не обязательно гарантирует способность индуцировать толерантность к белкам коровьего молока. Далее они сообщают, что даже некоторые из композиций, демонстрирующих наивысшую степень неаллергенности, оказались неподходящими для индукции толерантности к белкам коровьего молока.
Кроме того, известно, что глубоко гидролизованные смеси утрачивают свою способность к индукции длительной толерантности при пероральном введении, т.е. гидролиз в значительной степени модифицирует природу белка таким образом, что иммунная система перестает его распознавать. Это приводит к потере ключевого преимущества.
Таким образом, существует потребность в дополнительном выявлении факторов, которые могут влиять на индукцию толерантности при пероральном введении. Крайне желательно обеспечить гипоаллергенные или неаллергенные композиции для применения в качестве дополнения к грудному молоку или его заменителя, которые обладают способностью к индукции толерантности при пероральном введении у младенца.
Существует потребность в обеспечении синтетических питательных растворов, которые могут ослаблять развитие аллергий, особенно у младенцев. Существует потребность в индукции толерантности к разнообразным аллергенам, включая аллергены молока и белки молока.
Существует потребность в разработке и получении введений в рацион, особенно посредством синтетических ингредиентов или комбинаций ингредиентов, которые можно вводить младенцам на ранних этапах развития и которые снижают вероятность или интенсивность наличия или развития аллергии либо развития аллергии в дальнейшей жизни.
Эта потребность существует как для общей популяции младенцев, так и для субпопуляций младенцев, имеющих предрасположенность к аллергиям или имеющих проявляющиеся аллергии.
Существует общая потребность в обеспечении средств облегчения аллергии или симптомов аллергии и в разработке средств индукции толерантности к распространенным аллергенам, таким как аллергены молока, особенно у детей и младенцев.
Изложение сущности изобретения
В настоящем изобретении предложены вновь идентифицированные пептиды β-лактоглобулина (BLG) SEQ ID No. 1-SEQ ID No. 5 для индукции толерантности к белкам молока у индивидов, подверженных риску аллергии на белки, а также у тех, кто уже страдает аллергией. Вновь идентифицированные пептиды SEQ ID No. 1-5 распознаются и связываются HLA-DR (DR-антигеном лейкоцитов человека). Таким образом, каждый из этих пептидов содержит эпитоп HLA, который облегчает распознавание иммуноцитами и стимулирует индукцию у млекопитающих толерантности при пероральном введении по отношению к белкам молока, особенно β-лактоглобулину (BLG). Белок молока может происходить от коровы, овцы, козы или буйвола.
Таким образом, изобретение относится к пептиду или комбинации пептидов, имеющих длину от пяти до двенадцати аминокислот и содержащих последовательность, выбранную из SEQ ID No. 1-5, для индукции толерантности при пероральном введении к белкам коровьего, овечьего, буйволиного или козьего молока у млекопитающих. В особенности это относится к человеческим младенцам.
Для усиления толерогенного действия один или более пептидов, имеющих длину от пяти до двенадцати аминокислот и содержащих одну из последовательностей a, b и с из таблицы 1, можно вводить в комбинации с пептидом или комбинацией пептидов на основе SEQ ID No. 1-5, описанных в предыдущем абзаце.
Пептиды можно вводить в чистом виде, разбавленными в подходящей жидкости или в виде фармацевтической композиции, питательной композиции или питательной добавки.
В соответствии с одним вариантом осуществления изобретения пептиды находятся в виде (i) выделенных пептидных фракций, полученных в результате гидролиза белкового материала, содержащего BLG, и/или (ii) пептидов, полученных синтетическим путем.
Основное преимущество этих пептидов состоит в индукции толерантности при пероральном введении к белкам коровьего, овечьего, буйволиного или козьего молока, в частности к β-лактоглобулину, у млекопитающих. Эти млекопитающие могут представлять собой молодых млекопитающих и, в частности, человеческих младенцев, подверженных риску развития аллергии на коровье молоко, имеющих по меньшей мере одного родителя или родного (-ую) брата/сестру с аллергией на коровье молоко, или не подверженных риску. Таким образом, пептиды изобретения обладают пользой для общей популяции молодых млекопитающих. Другая группа, которая может получить пользу от введения пептидов изобретения, представляет собой взрослых млекопитающих, уже имеющих аллергию на коровье молоко. Таким образом, после воздействия толерогенных пептидов изобретения взрослые с аллергией могут быть «десенсибилизированы» по отношению к нативному аллергену. Таким образом, один или более (два, три, четыре или все пять) пептидов можно вводить млекопитающему для индукции толерантности при пероральном введении к белкам молока, особенно BLG.
Пептиды можно вводить домашним питомцам, например собакам и кошкам.
Эти пептиды имеют преимущество перед ранее идентифицированными пептидами (см. таблицу 1, пептиды а, b, с) из BLG (см. публикацию WO 0042863). После воздействия BLG пептиды 2-5 снижают экспрессию IgE в большей степени (см. Фиг. 1), чем ранее идентифицированные пептиды a, b и с (см. Фиг. 1).
В предпочтительном варианте осуществления пептид или комбинация пептидов имеют форму пептидной фракции, содержащей по меньшей мере один из пептидов SEQ ID No. 1-SEQ ID No. 5. Пептид или комбинацию пептидов можно вводить молодому млекопитающему или взрослому млекопитающему в дозе 0,4-50 мкмоль/кг массы тела/сутки, предпочтительно 0,9-40 мкмоль/кг массы тела/сутки. Введение может осуществляться ежедневно, или каждые вторые сутки, или каждые третьи сутки, или один раз в неделю в течение периода, составляющего по меньшей мере две недели, предпочтительно по меньшей мере один месяц, более предпочтительно по меньшей мере три месяца. Период введения может быть более длительным, например до трех лет.
Для эффективной индукции толерантности при пероральном введении к BLG у субъектов, ранее не подвергавшихся воздействию BLG, может быть достаточно однократного введения.
Пептиды можно вводить в составе композиции, содержащей 25-250 мкг пептида на грамм сухой композиции, предпочтительно 50-150 мкг пептида на грамм сухой композиции. Пептиды можно добавлять в базовую композицию, то есть начальную детскую смесь, смесь для прикармливаемых детей или молочную смесь для питания детей 1-3 лет. Базовая композиция может представлять собой неаллергенную или гипоаллергенную композицию.
Пептиды можно вводить в составе композиции, содержащей дополнительные ингредиенты или пребиотики, предпочтительно выбранные из инулина, фруктоолигосахарида (FOS), короткоцепочечного фруктоолигосахарида (короткоцепочечного FOS), галактоолигосахарида (GOS), ксилоолигосахарида (XOS), ганглиозида, частично гидролизованной гуаровой камеди, аравийской камеди, соевой смолы или их смесей.
Пептиды можно вводить в составе композиции, содержащей дополнительные ингредиенты или пробиотики, предпочтительно выбранные из штаммов Lactobacillus paracasei, Lactobacillus GG, Lactobacillus rhamnosus, Bifidobacterium longum, Bifidobacterium lactis и Bifidobacterium breve.
Краткое описание рисунков
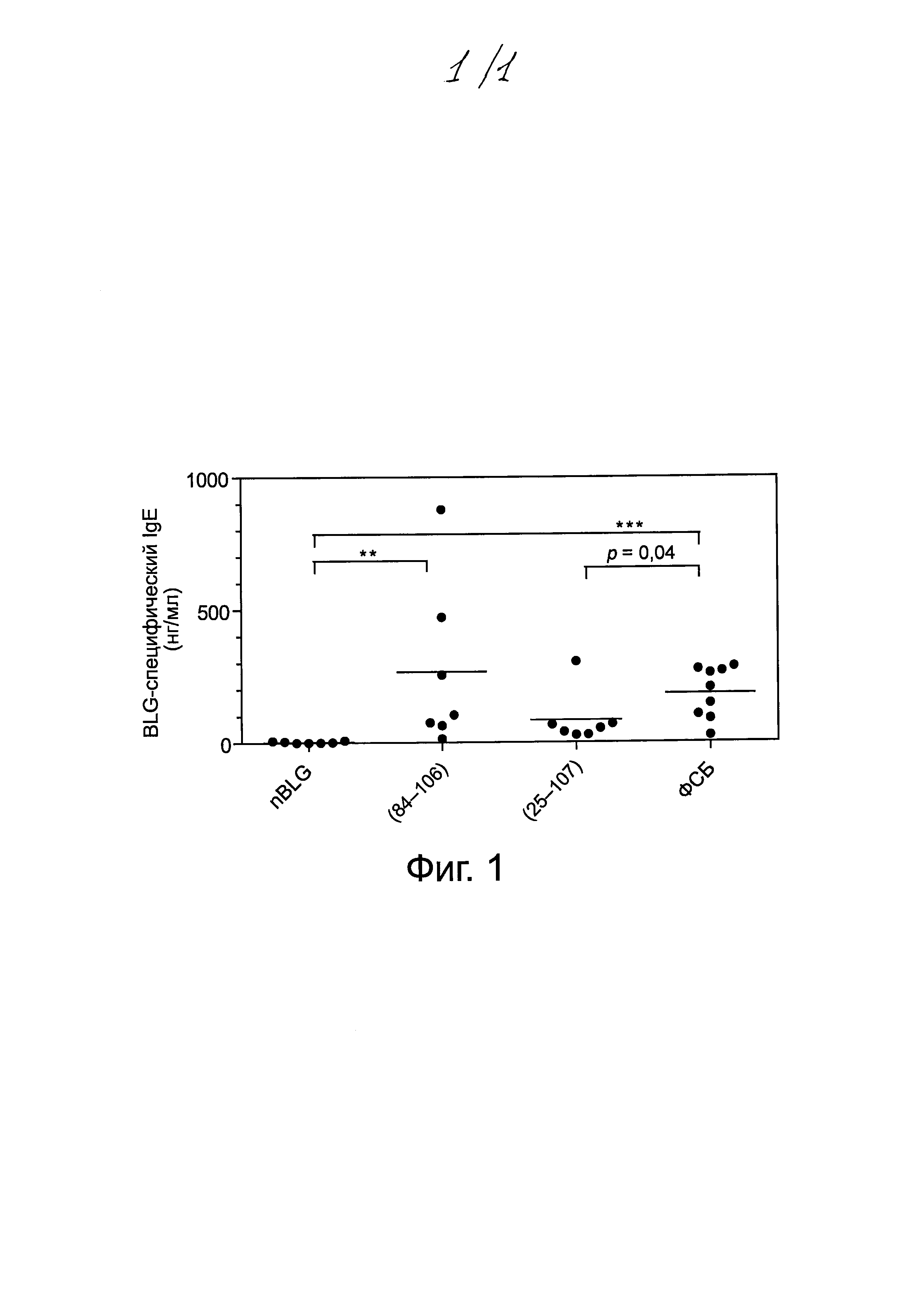
Фиг. 1: специфические гуморальные иммунные ответы на β-лактоглобулин (BLG) у мышей, которым через зонд вводили нативный β-лактоглобулин (nBLG) или синтетические пептиды, а затем сенсибилизировали их экспериментальным путем.
Мышам через зонд вводили nBLG или синтетические пептиды, а затем сенсибилизировали их экспериментальным путем nBLG. BLG-специфические антитела IgE (А) количественно определяли в индивидуальных сыворотках крови, собранных на сутки 30. Определяли статистическую значимость различий между указанными группами, используя критерий Краскела-Уоллиса и апостериорный критерий множественного сравнения Данна (* р<0,05, ** 0,01<р<0,001, *** р<0,001).
Подробное описание изобретения
В настоящем изобретении под термином «толерантность» следует понимать состояние специфической иммунологической неотвечаемости. Посредством индукции толерантности можно супрессировать как гуморальные (посредством антител), так и опосредованные клетками (лимфоцитами и т.д.) пути иммунного ответа. Первопричиной пищевой аллергии считается нарушение толерантности при пероральном введении.
Под термином «аллерген» следует понимать белок или макропептид, способный к инициации аллергических реакций у млекопитающих, в частности у подверженных риску молодых млекопитающих, включая младенцев или детенышей животных. Младенцы в первые месяцы жизни считаются подверженными риску развития аллергии на белок, если по меньшей мере один родитель или родной (-ая) брат/сестра имеют атопическое заболевание.
Под термином «толерогенные пептиды» следует понимать белковые фрагменты, соответствующие участкам нативного белка размером от 200 до 6000 Да (от 3 до 50 аминокислот), предпочтительно от 500 до 3000 Да и более предпочтительно от 500 до 1400 Да и способные к индукции специфической толерантности при пероральном введении к нативным белкам.
Под термином «неаллергенная базовая композиция» следует понимать композицию, имеющую источник азота, содержащий сбалансированную композицию аминокислот. Термин «неаллергенность» в отношении молочных белков определяется как остаточная аллергенность отдельных белков молочной сыворотки, не превышающая 1 ppm, и остаточная аллергенность общего количества казеинов, не превышающая 10 ppm.
Термин «сенсибилизация» означает индукцию/развитие аллерген-специфических антител IgG1 и/или IgE.
Настоящее изобретение относится к ряду вновь идентифицированных пептидов и их применению для индукции толерантности при пероральном введении к белкам коровьего молока, в частности к β-лактоглобулину, у общей популяции молодых млекопитающих, включая тех, кто считается подверженным риску, и тех, кто не подвержен риску развития СМА, а также у взрослых млекопитающих с аллергией на коровье молоко. Вновь идентифицированные пептиды также могут индуцировать толерантность при пероральном введении к BLG от овцы, козы или буйвола, поскольку они также обнаружены в овечьем, козьем и буйволином молоке.
Пептиды настоящего изобретения имеют длину от пяти до двенадцати аминокислот и содержат последовательность, выбранную из SEQ ID No. 1-5 (см. таблицу 1). Таким образом, пептид имеет определенную длину (5-12 аминокислот).
Пептиды короче пентамеров (длиной пять аминокислот) могут не обеспечивать толерогенное действие; в то же время считается, что пептиды длиннее 12-меров имеют повышенный риск аллергенности.
Таким образом, пептид может представлять собой 5-мер, 6-мер, 7-мер, 8-мер, 9-мер, 10-мер, 11-мер или 12-мер, содержащий любую одну из последовательностей, выбранных из SEQ ID No. 1-5. Таким образом, пептид может представлять собой любой пептид, являющийся 5-мером, 6-мером, 7-мером, 8-мером, 9-мером, 10-мером, 11-мером или 12-мером, содержащий последовательность IIAEK (Seq ID No. 1) или IVTQTM (Seq ID No. 1), либо KGLDIQK (Seq ID No. 2), либо DAQSAPLR (Seq ID No. 3), VEELKPTPE (Seq ID No. 4), либо IIAEK (Seq ID No. 5).
Аналогично, пептиды, которые могут обеспечивать усиленное действие при введении с вышеописанными пептидами на основе последовательностей SEQ ID No. 1-5, представляют собой любые пептиды, являющиеся 5-мером, 6-мером, 7-мером, 8-мером, 9-мером, 10-мером, 11-мером или 12-мером и содержащие любую из последовательностей, выбранных из вариантов a, b и с в таблице 1.
Таким образом, пептиды изобретения индуцируют толерантность при пероральном введении к белкам коровьего, овечьего, буйволиного или козьего молока у млекопитающих.
Получение и характеризация пептидов
В соответствии с одним вариантом осуществления изобретения выделенные пептиды можно получать синтетическим путем в соответствии со стандартными способами, известными специалистам в данной области. Альтернативно, в соответствии с другим вариантом осуществления изобретения их можно концентрировать, экстрагировать и/или отделять от природных источников, таких как молоко (например, коровье молоко) или молочные фракции, которые предпочтительно были модифицированы, обработаны с целью, например, получения или концентрирования пептидов. Молочные гидролизаты, в которых белки молока гидролизованы с помощью ферментов или других средств, можно получать известными в данной области способами. Способы экстракции, разделения и идентификации пептидных фракций, содержащих пептиды изобретения, из молочных гидролизатов также известны специалистам в данной области. Пептиды изобретения можно получать этими способами.
Например, пептиды изобретения можно получать с применением способа, описанного в публикации US 5039532 А. Способ ферментативного гидролиза включает двухэтапную реакцию гидролиза с промежуточным этапом термической денатурации, чтобы гарантировать, что конечный гидролизат по существу не содержит интактных аллергенных белков. Например, в этих способах можно применять трипсин и химотрипсин, которые могут представлять собой препараты, полученные путем экстракции из свиной поджелудочной железы или полученные с помощью технологии рекомбинантных ДНК в бактериях.
Например, ферментативный гидролиз можно осуществлять с применением любого исходного материала молочной сыворотки, содержащего белки молочной сыворотки. Этим исходным материалом может быть молочная сыворотка, получаемая при производстве сыра, в частности сладкая молочная сыворотка, например, образуемая в результате коагуляции казеина реннином, кислая молочная сыворотка, образуемая в результате коагуляции казеина кислотой или окисляющими ферментами, или даже смешанная молочная сыворотка, образуемая в результате коагуляции кислотой и реннином. Этим исходным материалом может быть молочная сыворотка, деминерализованная посредством ионного обмена и/или электродиализа. Эта молочная сыворотка может представлять собой концентрат белков молочной сыворотки, в большей или меньшей степени освобожденный от полученной лактозы, например, посредством ультрафильтрации с необязательным последующим диализом. Исходным материалом может быть даже комбинация вышеупомянутых исходных материалов и лактозы. Он может быть в виде истинного или коллоидного водного раствора или в виде порошка. В последнем случае порошок растворяют в предпочтительно деминерализованной воде с образованием водного раствора.
Исходный материал подвергают ферментативному гидролизу известным способом, с применением смешанных или очищенных протеолитических ферментов, активных в основном и нейтральном диапазонах, например трипсина, химотрипсина или панкреатина. Предварительный гидролиз можно осуществлять в течение относительно короткого времени, предпочтительно 5-35 минут, например 10 минут, с применением небольшого количества фермента, например 10% от общего количества, применяемого для гидролиза. Это позволяет экономить количества применяемого фермента. В этом случае гидролиз является частичным. Этот этап гидролиза можно осуществлять в реакторе или, альтернативно, в трубе.
В случаях, когда подлежащий гидролизу субстрат имеет склонность к коагуляции во время термообработки, к субстрату можно добавлять хелатирующий агент, такой как цитрат кальция или магния, например, как указано в патенте США №4,748,034. Гидролизат подвергают термообработке при температуре 80-100°C в течение 3-10 минут при значении pH от 6 до 8. Время и температура термообработки, разумеется, взаимосвязаны: более низкий предел температуры соответствует более высокому пределу времени и наоборот. Доказано, что в промышленных теплообменниках для денатурирования небольших белков достаточно температуры приблизительно 90°C и времени пребывания в реакторе порядка 5 минут. Действительно, обнаружено, что денатурирование этих белков делает их доступными для дальнейшего ферментативного разложения. Целесообразно отметить, что термообработка инактивирует фермент.
Затем гидролизат охлаждают до температуры 40-60°C и предпочтительно до температуры приблизительно 55°C, которая является оптимальной для гидролитической активности. Значение pH предпочтительно доводят до приблизительно 7,5 путем добавления водного раствора основания. Условия второго этапа гидролиза могут быть различными. Например, его можно осуществлять сериями с перерывами в емкостном реакторе с термостатическим регулированием. После добавления протеолитического фермента, выбранного из трипсина, химотрипсина, панкреатина или смеси трипсина и химотрипсина в водном растворе, гидролиз осуществляют в течение 60-180 минут.
В иных случаях второй этап гидролиза может происходить непрерывно в течение 1-60 минут и предпочтительно в течение 2-20 минут в трубе, составляющей турбулентный реактор. В этом варианте труба, в зависимости от ее длины, обеспечивает требуемое время реакции в соответствии с пропускаемым количеством подлежащего гидролизу продукта. Соответственно, фермент необходимо непрерывно закачивать на входе трубы для выдерживания. Полученное в результате состояние высокой турбулентности вызывает быстрый и интенсивный контакт между ферментом и субстратом. Независимо от используемого режима (серийного или непрерывного), выбранного для второго этапа гидролиза, продукт гидролиза подвергается термообработке, в результате которой происходит инактивация фермента. Эта термообработка включает в себя предварительный нагрев гидролизата до температуры 75°C или выше и его выдерживание при этой температуре (предпочтительно при 75-85°C) в течение около 5 минут для стимуляции аутолиза фермента; после этой обработки преимущественно следует стерилизация, предпочтительно при сверхвысоких температурах, например при 125-135°C, в течение 2-3 минут посредством нагнетания пара или в теплообменнике. Затем гидролизат можно высушивать, например посредством распылительной сушки или сублимационной сушки в зависимости от назначения, или даже подвергать последующей обработке. В последнем случае фермент можно инактивировать в процессе последующей обработки.
Идентификация и характеризация пептидов
В серии экспериментов, подробно описанных в примере 1, авторы настоящего изобретения идентифицировали пептидные последовательности BLG, отвечающие за индукцию толерантности при пероральном введении по отношению к молочным белкам, в частности BLG. На первом этапе, применяя анализ на основе клеток, частично гидролизованную детскую смесь NAN НА™ (иначе известную как ВЕВЕ НА™) от компании  инкубировали совместно с клетками человека, экспрессирующими рецептор главного комплекса гистосовместимости (ГКГС) класса II, HLA-DR. На первом этапе индукции толерантности при пероральном введении рецептор HLA презентирует пептидные последовательности Т-клеткам, тем самым индуцируя толерантность. Таким образом, развитие толерантности в значительной мере зависит от распознавания пептидной последовательности ГКГС.
инкубировали совместно с клетками человека, экспрессирующими рецептор главного комплекса гистосовместимости (ГКГС) класса II, HLA-DR. На первом этапе индукции толерантности при пероральном введении рецептор HLA презентирует пептидные последовательности Т-клеткам, тем самым индуцируя толерантность. Таким образом, развитие толерантности в значительной мере зависит от распознавания пептидной последовательности ГКГС.
Пептидсвязывающие участки ГКГС распознают пептидные последовательности или совокупность пептидов, состоящих из, в среднем, десяти аминокислот, минимум - пяти. В действительности эти пентапептиды могут быть включены в более длинные пептидные последовательности (или даже белки), поскольку они будут перевариваться в желудочно-кишечном тракте, что приведет к меньшему размеру этих пептидов, составляющему 5-18 аминокислот.Это частично объясняет, почему глубоко гидролизованные продукты, состоящие из свободных аминокислот, дипептидов, трипептидов и тетрапептидов, не индуцируют толерантность при пероральном введении.
Таким образом, в настоящем изобретении клетки человека, экспрессирующие HLA-DR, культивировали в присутствии смеси NAN-HA™ (которая прошла проверку на нетоксичность по отношению к клеткам); пептиды, связывающиеся с рецептором HLA, выделяли с помощью иммунопреципитации, а затем идентифицировали с помощью масс-спектрометрии и секвенирования аминокислот.
Вновь идентифицированные пептиды представляют собой пептиды BLG и перечислены в таблице 1.

Пептиды a, IDALNENK, b, VLDTDY, и с, EVDDEALEK, также идентифицировали этим способом. Эти пептиды были ранее идентифицированы в публикации WO 20042863 как индукторы толерантности при пероральном введении. В последнем документе пептиды идентифицировали как часть более длинной пептидной последовательности. Таким образом, в настоящем эксперименте эти известные пептиды выступают в качестве положительного контроля.
Толерогенное свойство пептидов, подтвержденное in vivo
Дополнительно оценивали способность этих пептидных последовательностей к индукции толерантности при пероральном введении in vivo на экспериментальной мышиной модели сенсибилизации к BLG (см. пример 2 и Фиг. 1).
Эту животную модель ранее использовали для демонстрации эффективности нативного BLG при индукции толерантности после введения через зонд [Patient, Ket et al., (2011). Oral tolerance and Treg cells are induced in BALB/c mice after gavage with bovine β-lactoglobulin. Allergy, 66 (10), 1312-1321]. Интересно, что в последней статье было продемонстрировано, что BLG, подвергавшийся гидролизу под действием трипсина, не индуцировал толерантность при пероральном введении.
Мышиную модель применяли для оценки индукции толерантности при пероральном введении в отношении полноразмерного нативного BLG и двух синтетических пептидов BLG, соответствующих последовательностям (84-106) и (25-107) коровьего BLG. Мышам через зонд вводили либо нативный BLG, либо синтетический пептид (84-106) или (25-107) на сутки 1, 2, 3, 8, 9 и 10. Затем их сенсибилизировали посредством интраперитонеального введения нативного BLG на сутки 14. Концентрацию IgE в сыворотке измеряли в период между сутками 30 и 33.
На Фиг. 1 показано, что введение нативного BLG через зонд индуцирует эффективную толерантность, предотвращая дальнейшую индукцию выработки BLG-специфического IgE после сенсибилизации BLG. Пептид (25-107), который содержит последовательности 2, 3, 4, 5 изобретения, так же как и ранее известный пептид а, приводит к снижению концентрации IgE в сыворотке по сравнению с контролем (фосфатно-солевым буфером, ФСБ) (р=0,04). Пептид (84-106), содержащий последовательности 5, a, b и с, демонстрирует тенденцию к пониженной концентрации IgE по сравнению с ФСБ.
Авторы изобретения заключают, что пептиды 1-5, полученные из последовательности (25-107), более эффективно индуцируют толерантность при пероральном введении в данной мышиной модели по сравнению с пептидами (a, b и с), полученными из последовательности (84-106). Эти более длинные пептидные последовательности (25-107) и (84-106) после их введения мышам через зонд естественным путем обрабатываются ферментами и протеазами поджелудочной железы, таким образом приводя к выработке пептидов меньшего размера, включающих последовательности SEQ ID No. 1-5 и последовательности a, b и с.
Эксперимент демонстрирует, что HLA-DR распознает и связывает вновь идентифицированные пептиды 1-5. Затем эти пептиды могут быть презентированы Т-клеткам. Этот способ позволяет индуцировать толерантность при пероральном введении к аллергенным белкам, содержащим эти последовательности, т.е. BLG. Пептид или комбинация пептидов 1-5 в соответствии с настоящим изобретением были выбраны благодаря своей способности индуцировать толерантность при пероральном введении.
В соответствии с вариантом осуществления изобретения пептид или комбинацию пептидов, вводимые для индукции толерантности при пероральном введении, выбирают из последовательностей SEQ ID No. 1-5.
Предполагается, что производимый пептидами толерогенный эффект усиливается при их введении в комбинации с одним или более пептидами, выбранными из известных пептидов a, b и с в таблице 1. Данная комбинация предположительно обеспечивает усиленное действие при индукции толерантности при пероральном введении к BLG по сравнению с действием, производимым как другой группой пептидов а, b, с, так и пептидами 1-5, используемыми отдельно.
Таким образом, в соответствии с одним вариантом осуществления изобретения пептид или комбинацию пептидов, выбранных из SEQ ID No. 1-5, вводят в комбинации с пептидами a, b и с.
Последовательности SEQ ID No. 1-5 были идентифицированы как высоко консервативные (100%-я идентичность последовательности) в BLG в следующих видах: корова, буйвол, домашняя коза, овца и муфлон. Таким образом, считается, что любой из этих источников молока, содержащего эти последовательности, может индуцировать толерантность при пероральном введении к коровьему молоку и наоборот. Таким образом, авторы изобретения утверждают, что идентифицированные ими пептиды могут индуцировать толерантность при пероральном введении к BLG из любого из этих источников. Во многих странах козье и овечье молоко употребляется в качестве альтернативы или дополнения к коровьему молоку. На рынке представлены детские смеси, в которых в качестве источника белка применяется молочная сыворотка из козьего молока. Таким образом, применение результатов настоящего исследования к молоку от видов, отличных от коровы, может представлять интерес.
В соответствии с одним вариантом осуществления изобретения пептид или комбинацию пептидов вводят в количестве, достаточном для индукции толерантности при пероральном введении, предпочтительно полной толерантности при пероральном введении, к коровьему BLG. BLG также может происходить от овцы или козы. Полная толерантность при пероральном введении означает, что после DBPCFC (двойного слепого плацебо-контролируемого пищевого провокационного теста), выполняемого с использованием коровьего молока, в частности коровьего BLG, аллергической реакции не наблюдается.
В соответствии с одним вариантом осуществления изобретения пептиды могут присутствовать в количестве от 0,01% до 5% и предпочтительно от 0,1% до 0,5% от общего количества белков.
В соответствии с одним вариантом осуществления изобретения комбинация пептидов содержит один, или два, или три, или четыре, или более пептидов.
Пептид или комбинацию пептидов можно вводить пероральным путем непосредственно молодому млекопитающему отдельно (например, в чистом виде или разбавленными в воде или материнском молоке) или в композиции, которая представляет собой детскую молочную смесь или пищевую добавку, например обогатитель грудного молока. Также его можно вводить в составе любой молочной основы, применяемой при трофическом питании, немолочных детских смесей, детской каши или йогурта, детского пудинга из сыра, молочного или фруктового напитка, смузи, легкой закуски или печенья, или другого хлебобулочного изделия. Пептид или комбинацию пептидов можно вводить взрослым в виде напитка, продукта питания или пищевой добавки. Также его можно вводить в корм и питье для домашних питомцев, например в любой сухой корм или гранулу, мягкий корм или консервы, или добавку.
Синтетические пептиды и/или концентраты пептидов, полученные искусственными способами, могут составлять часть искусственной детской смеси, искусственной гидролизованной (частично или глубоко) детской смеси или искусственных питательных композиций в целом. Такие композиции могут представлять собой варианты осуществления изобретения.
Такие композиции можно применять в указанных дозах в качестве питательного раствора или лекарственного средства для индукции толерантности при пероральном введении, особенно к белкам молока. Такие композиции можно вводить младенцам или субпопуляции младенцев с проявленными симптомами или склонностью к аллергиям. Такая индукция толерантности при пероральном введении может вызывать облегчение аллергии в среднесрочной перспективе (во время лечения или в течение 1, 6, 12 или 18 месяцев после лечения). Альтернативно или дополнительно, толерантность при пероральном введении может быть индуцирована с положительным эффектом в дальнейшей жизни (например, спустя 24, 36, 48, 72 месяца после лечения), особенно после того, как иммунная система будет сформирована.
Дозировка
В соответствии с одним вариантом осуществления изобретения доза пептида (-ов) находится в диапазоне 0,4-50 мкмоль/кг массы тела/сутки, предпочтительно 0,9-40 мкмоль/кг массы тела/сутки. Например, если пептиды вводят в составе детской смеси, пептиды могут присутствовать в смеси в концентрации 50-150 мкг/г порошка. Типичная дозировка детской смеси для младенца в возрасте пяти месяцев составляет три бутылки в сутки по семь мерных ложек порошка в каждой, а для ребенка в возрасте шести месяцев или старше - две бутылки в сутки по семь мерных ложек в каждой. Дозы основаны на средней массе тела ребенка в возрасте шести месяцев, составляющей около 8 кг, и ребенка в возрасте двенадцати месяцев, составляющей около 9,5 кг.
Период введения
Период введения пептидов изобретения может быть непрерывным или с перерывами. Непрерывное введение является предпочтительным в связи с развитием более продолжительного эффекта. Однако предполагается, что введение с перерывами (например, ежесуточное введение в течение одной недели в месяц или каждую вторую неделю) может оказывать положительное влияние на молодое или взрослое млекопитающее.
В соответствии с одним вариантом осуществления изобретения предполагается, что для молодых млекопитающих, ранее не подвергавшихся воздействию BLG («наивных» испытуемых), однократной дозы пептида или комбинации пептидов изобретения может быть достаточно для индукции толерантности при пероральном введении к BLG. В общем случае рекомендуется более длительная продолжительность, например ежесуточное введение в течение от одной до трех недель.
Для молодых млекопитающих, ранее подвергавшихся воздействию BLG, более длительный период введения является предпочтительным. В целом положительное воздействие ожидается при относительно небольшой продолжительности введения (например, при ежесуточном введении в течение от одной до четырех недель), однако считается, что более длительное введение обеспечивает усиленное воздействие (например, при продолжительности от трех до шести месяцев у людей и при соответствующих периодах у других млекопитающих).
Взрослым, уже имеющим аллергию на BLG, для осуществления «десенсибилизации» может потребоваться период введения, равный по меньшей мере одному месяцу.
Предпочтительно, введение осуществляют посредством ежесуточного приема внутрь (один или два раза в сутки) или еженедельного приема внутрь (четыре, или три, или два, или один раз в неделю).
Введение с другими соединениями
Пептиды можно вводить отдельно (например, в чистом виде или разбавленными в воде или молоке, включая человеческое грудное молоко) или в виде смеси с другими соединениями (такими как пищевые добавки, питательные добавки, лекарственные средства, носители, ароматизаторы, перевариваемые или неперевариваемые ингредиенты).
Пептиды можно вводить, например, младенцам в первые месяцы жизни в составе композиции, которая представляет собой обогатитель грудного молока или другую питательную добавку. Если пептиды предназначены для введения взрослым, их можно вводить в составе продукта питания, напитка или пищевой добавки. Пептиды также можно вводить всем субъектам (как молодым млекопитающим, так и взрослым) в составе фармацевтической композиции.
В соответствии с одним вариантом осуществления изобретения пептиды можно добавлять в базовую композицию, либо они могут содержаться в базовой композиции, которая представляет собой гипоаллергенную композицию, предназначенную для млекопитающих, в частности человека и домашних питомцев. Таким образом, базовая смесь, к которой добавляют пептиды или в которой пептиды могут содержаться, может представлять собой гипоаллергенную (НА) смесь, в которой белки молока частично гидролизованы, либо неаллергенную смесь, в которой белки молока глубоко гидролизованы или заменены свободными аминокислотами, либо заменитель коровьего молока, например, на основе сои. Она может представлять собой, например, детскую смесь, смесь для прикармливаемых детей или питательную композицию для детей с конкретными физиологическими/патологическими состояниями.
В одном варианте осуществления базовая смесь представляет собой мономерную детскую смесь, и базовая смесь не содержит пептидов или белков, а содержит только аминокислоты. В одном варианте осуществления белки базовой смеси частично или полностью происходят из сладкой молочной сыворотки, из которой был удален гликомакропептид казеина (cGMP). В этом отношении делается ссылка на публикацию ЕР 880902, в которой описан способ, позволяющий удалять практически весь гликомакропептид казеина (фракцию с высоким содержанием треонина и низким содержанием триптофана) из молочной сыворотки коровьего молока, тем самым повышая долю альфа-лактальбумина (фракции с очень высоким содержанием триптофана). За счет объединения этой модифицированной фракции сладкой молочной сыворотки с обезжиренным молоком и при добавлении некоторого количества свободного L-гистидина и L-аргинина (чтобы достичь минимального уровня содержания этих аминокислот согласно требованиям директивы ЕС) композиция в соответствии с изобретением имеет профиль аминокислот, значительно приближенный к профилю грудного молока, характеризующийся, в частности, сопоставимыми концентрациями триптофана и треонина, что позволяет адаптировать его белковый состав к белковому составу человека.
Следует понимать, что при введении вместе с вышеописанным оптимизированным профилем белков пептиды могут действовать синергически с оптимизированным белком, обеспечивая индукцию толерантности при пероральном введении наряду с оптимизированной белковой питательной ценностью (которая может существенно усилить действие пептидов за счет удовлетворения потребностей в белках в надлежащем количестве).
Следует понимать, что при введении с мономерными аминокислотами действие пептидов не маскируется или не ингибируется присутствием белков, потенциально вызывающих аллергию.
Пептиды можно вводить, например, в составе детской смеси в концентрации 50-150 мкг/г порошка.
Базовая гипоаллергенная композиция, в которую добавляют пептиды, может содержать в качестве источника азота пептиды или свободные аминокислоты, в частности, из белков молока от коровы, козы или овцы, такие как, например, белки молочной сыворотки, альфа-лактальбумин, β-лактоглобулин, бычий сывороточный альбумин, казеиновая кислота, казеинаты или альфа-, бета-, каппа-казеин. Источник азота может обеспечивать по меньшей мере 7-25% общей энергетической ценности.
Витамины и минеральные вещества представляют собой примеры типичных пищевых добавок. В предпочтительном варианте осуществления композицию вводят вместе с другими соединениями, которые усиливают описанное действие на иммунитет молодого млекопитающего или взрослого, имеющего аллергию. Такие соединения могут представлять собой другие активные соединения, такие как пробиотики и пребиотики, которые оказывают синергическое или отдельное влияние на иммунный ответ младенца и/или потенцируют действие пептидов.
Примерами известных пробиотических соединений являются Bacillus, Bifidobacterum, Lactobacillus Saccharomyce, Streptococcus thermophilus, E. Faecium, E. Coli Nissle. В частности, пробиотики и неразмножающиеся штаммы пробиотиков, такие как род Lactobacillus, Bifidobacterium или их комбинация, например Lactobacillus paracasei, Lactobacillus GG, Lactobacillus rhamnosus, Bifidobacterium longum, Bifidobacterium lactis, Bifidobacterium breve или их комбинация, и применения этих бактерий.
Примерами известных пребиотических соединений являются углеводные соединения, выбранные из группы, состоящей из инулина, фруктоолигосахарида (FOS), короткоцепочечного фруктоолигосахарида (короткоцепочечного FOS), галактоолигосахарида (GOS), ксилоолигосахарида (XOS), ганглиозидов, частично гидролизованной гуаровой камеди (PHGG), аравийской камеди, соевой смолы или их смесей. Могут присутствовать и другие углеводы, такие как второй углевод, действующий синергически с первым углеводом и выбранный из группы, состоящей из ксилоолигосахаридной (XOS) камеди, аравийской камеди, крахмала, частично гидролизованной гуаровой камеди или их смесей. Углевод или углеводы могут присутствовать в суточных дозах композиции в количестве от около 1 г до 20 г, или от 1% до 80%, или от 20% до 60%. Альтернативно, углеводы присутствуют в количестве от 10% до 80% сухой композиции.
В одном варианте осуществления базовая смесь или готовая питательная композиция содержит смесь олигосахаридов в соответствии с публикацией WO 2007/090894 (общий предмет и, в частности, пример 1). В частности, ее можно применять в комбинации с GOS. Базовая смесь может обеспечивать смесь олигосахаридов, содержащую 5-70 мас. % по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, состоящей из GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc; 20-90 мас. % по меньшей мере одного нейтрального олигосахарида, выбранного из группы, состоящей из Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Gaβ1,3Galβ1,4Glc; и 5-50 мас. % по меньшей мере одного сиалилированного олигосахарида, выбранного из группы, состоящей из NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc.
В одном варианте осуществления смесь (базовой смеси или готовой питательной композиции) содержит 10-70 мас. % указанного (-ых) N-ацетилированного (-ых) олигосахарида (-ов), 20-80 мас. % указанного (-ых) нейтрального (-ых) олигосахарида (-ов) и 10-50 мас. % указанного (-ых) сиалилированного (-ых) олигосахарида (-ов). Более предпочтительно, смесь содержит 15-40 мас. % N-ацетилированного (-ых) олигосахарида (-ов), 40-60 мас. % другого (-их) нейтрального (-ых) олигосахарида (-ов) и 15-30 мас. % сиалилированного (-ых) олигосахарида (-ов). Особенно предпочтительно, смесь представляет собой 30 мас. % N-ацетилированного (-ых) олигосахарида (-ов), 50 мас. % нейтрального (-ых) олигосахарида (-ов) и 20 мас. % сиалилированного (-ых) олигосахарида (-ов).
Альтернативно, в целях удобства смесь может содержать 5-20 мас. % указанного (-ых) N-ацетилированного (-ых) олигосахарида (-ов), 60-90 мас. % указанного (-ых) нейтрального (-ых) олигосахарида (-ов) и 5-30 мас. % указанного (-ых) сиалилированного (-ых) олигосахарида (-ов).
Смесь олигосахаридов изобретения можно получать из одного или более видов молока животных. Молоко можно получать от любого млекопитающего, в частности от коров, коз, буйволов, лошадей, слонов, верблюдов или овец.
Альтернативно, смесь олигосахаридов можно получать путем приобретения и смешивания отдельных компонентов. Например, синтетические галактоолигосахариды, такие как Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc и Galβ1,3Galβ1,6Galβ1,4Glc и их смеси, доступны в продаже под торговыми марками Vivinal® и Elix'or®. Другими поставщиками олигосахаридов являются Dextra Laboratories, Sigma-Aldrich Chemie GmbH и Kyowa Hakko Kogyo Co., Ltd. Альтернативно, для производства нейтральных олигосахаридов можно применять специальные гликозилтрансферазы, такие как галактозилтрансферазы.
N-ацетилированные олигосахариды можно получать посредством воздействия глюкозаминидазы и/или галактозаминидазы на N-ацетилглюкозу и/или N-ацетилгалактозу. Равным образом для этой цели можно применять N-ацетилгалактозилтрансферазы и/или N-ацетилгликозилтрансферазы. N-ацетилированные олигосахариды также можно получать посредством технологии ферментации с применением соответствующих ферментов (рекомбинантных или природных) и/или микробиологической ферментации. В последнем случае либо микроорганизмы могут экспрессировать свои природные ферменты и субстраты, либо могут быть созданы микроорганизмы, продуцирующие соответствующие субстраты и ферменты. Можно применять культуры микроорганизмов одного вида или смешанные культуры.
Образование N-ацетилированных олигосахаридов можно инициировать акцепторными субстратами, начиная с любой степени полимеризации (DP), от DP=1 и далее. Другой вариант представляет собой химическое преобразование кетогексоз (например, фруктозы), либо свободных, либо связанных с олигосахаридом (например, лактулозы), в N-ацетилгексозамин или N-ацетилгексозамин-содержащий олигосахарид, как описано в публикации Wrodnigg, Т.М.; Stutz, А.Е. (1999) Angew. Chem. Int. Ed. 38: 827-828.
Сиалилированные олигосахариды 3'сиалиллактоза и 6'сиалиллактоза могут быть выделены из природного источника, такого как молоко животных, методами хроматографии или фильтрации. Альтернативно, они также могут быть получены биотехнологическим путем с применением специфических сиалилтрансфераз, либо посредством технологии ферментации на основе ферментов (рекомбинантных или природных ферментов), либо посредством технологии микробиологической ферментации. В последнем случае либо микроорганизмы могут экспрессировать свои природные ферменты и субстраты, либо могут быть созданы микроорганизмы, продуцирующие соответствующие субстраты и ферменты. Можно применять культуры микроорганизмов одного вида или смешанные культуры. Образование сиалилолигосахаридов может быть инициировано акцепторными субстратами, начиная с любой степени полимеризации (DP), от DP=1 и далее.
В предпочтительном аспекте изобретения описанные выше смеси олигосахаридов включают в продукт питания. В контексте настоящего изобретения подразумевают, что термин «продукт питания» охватывает любое пригодное к потреблению вещество. Следовательно, это может быть продукт, предназначенный для потребления людьми, в частности детская смесь, смесь для прикармливаемых детей, детское питание, такое как детские каши и т.п. В частности, смеси олигосахаридов изобретения можно включать в детские смеси, сухое молоко или смеси зерновых.
Вышеописанные олигосахариды оказывают благоприятное воздействие на улучшение состояний иммунной системы (повышающую или понижающую регуляцию) субъекта таким образом, что он становится более восприимчивым к индукции толерантности при пероральном введении посредством пептидов. Это улучшение может представлять собой прямое действие на иммунную систему или на биохимические пути воспаления или может быть опосредовано кишечными пробиотиками, которые селективно стимулируются олигосахаридами.
В композицию можно включать одну или более незаменимых длинноцепочечных жирных кислот (ДЦ-ПНЖК). Примерами ДЦ-ПНЖК, которые можно добавлять, являются докозагексаеновая кислота (ДГК) и арахидоновая кислота (АРК). ДЦ-ПНЖК можно добавлять в таких концентрациях, которые составляют более 0,01% от жирных кислот, присутствующих в композиции.
При желании в питательную композицию можно включить один или более пищевых эмульгаторов; например эфиры диацетилвинной кислоты и моно- и диглицеридов, лецитин и моно- или диглицериды или их смесь. Аналогично, можно включить подходящие соли и/или стабилизаторы. В композицию можно добавлять ароматизаторы.
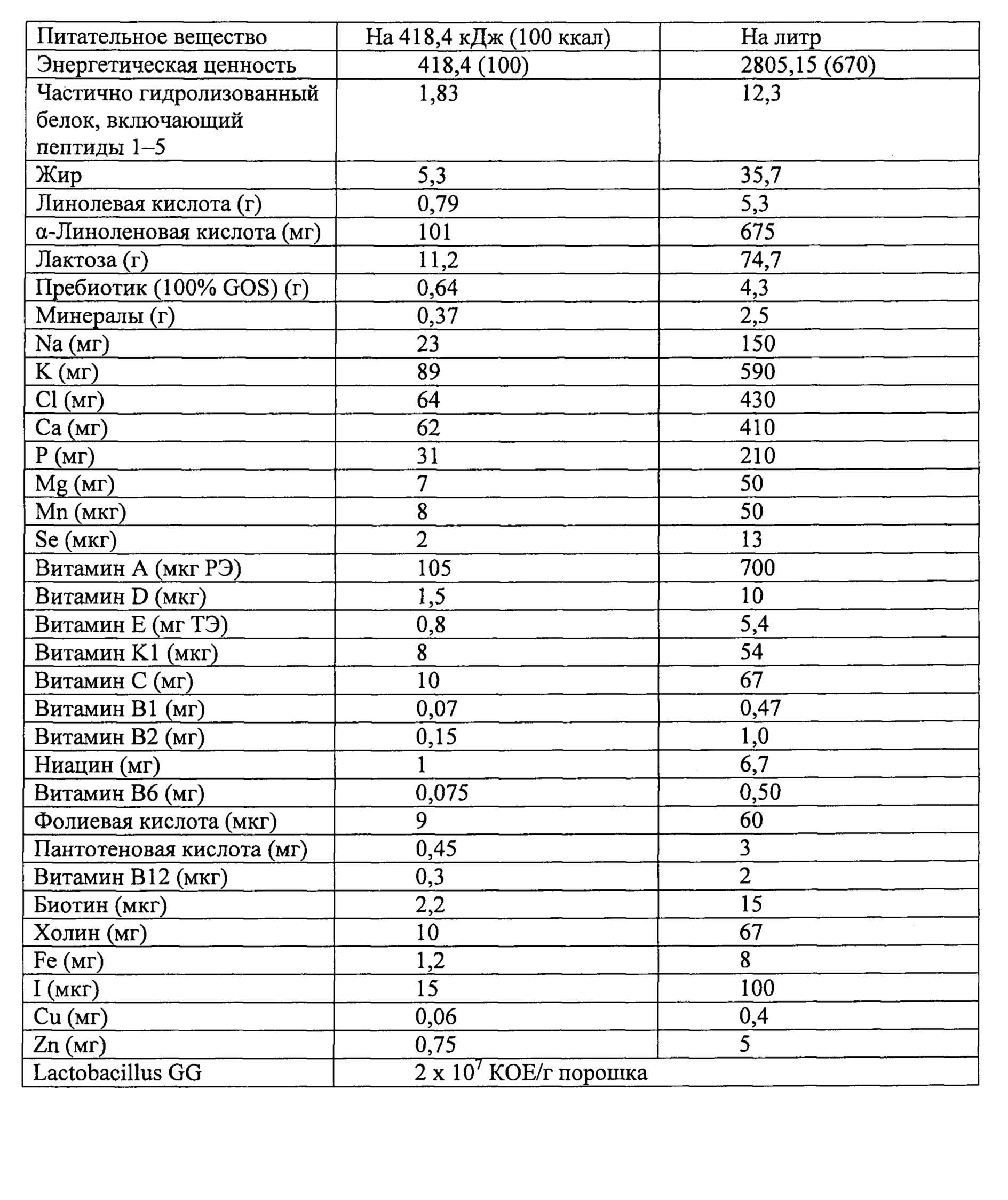
Пептиды могут быть включены в композицию или присутствовать в композиции, которая представляет собой «детскую смесь для недоношенных младенцев» для младенцев, которые родились раньше срока или с низким весом при рождении, «начальную детскую смесь» или «детскую смесь для прикармливаемых детей». Пример такой начальной детской смеси приведен в примере 3.
Пример 1. Выделение и идентификация пептидов, способных к индукции толерантности при пероральном введении к BLG
Клеточная культура
Для оценки экспрессии рецептора ГКГС на двух различных моноцитах человека (U937 и Thp1) клетки окрашивали антителом к HLA-DR, конъюгированным с аллофикоцианином (АРС) (Santa Cruz Biotechnologies, клон L243), в течение 30 минут на льду, дважды промывали охлажденным ФСБ 1X (Sigma) с добавлением 0,5% фетальной телячьей сыворотки (FCS) (Amimed, Bioconcept), затем анализировали на проточном клеточном анализаторе BD Fortessa (BD).
Для оценки токсичности детской смеси ВЕВА-НА на линиях клеток U937 и Thp1 клетки инкубировали с различными концентрациями продукта ВЕВА-НА (в диапазоне от 10 мг до 1 нг), разведенного в полной среде RPMI1640. Клетки инкубировали при концентрации 1×106 клеток/мл в 24-луночном планшете в течение 24 ч при температуре 37°C в присутствии 5% CO2. Клетки центрифугировали и дважды промывали ФСБ 1X с добавлением 0,5% FCS, затем окрашивали с помощью набора для определения апоптоза РЕ Annexin V Apoptosis Detection Kit I (BD Pharmingen). Наконец, клетки анализировали посредством проточной цитометрии на анализаторе BD Fortessa (BD). Результаты показали, что в дозах, применяемых в экспериментах, смесь ВЕВА-НА нетоксична для клеток.
Клетки Thp1 и U937 инкубировали в 20 мл среды RPMI-1640 с L-глутамином (Sigma) с добавлением 10% термоинактивированной FCS (Amimed, Bioconcept) и пенициллина/стрептомицина (Sigma) при концентрации 1×106 клеток/мл в Т-образном флаконе Т175 см2 (Falcon) с 1 мкг/мл и 100 мкл/мл ВЕВА-НА (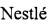 , партия № L02680742AP) соответственно в течение 24 часов при температуре 37°C в присутствии 5% CO2. Клетки центрифугировали и собирали для выполнения иммунопреципитации комплексов ГКГС с пептидами.
, партия № L02680742AP) соответственно в течение 24 часов при температуре 37°C в присутствии 5% CO2. Клетки центрифугировали и собирали для выполнения иммунопреципитации комплексов ГКГС с пептидами.
Белковый лизат и иммунопреципитация
Кратко, для каждого тестируемого условия (для обеих клеточных линий использовали контроль без ВЕВА-НА, образец с ВЕВА-НА) 2×107 клеток ресуспендировали в ледяном солевом трис-буфере (TBS) и промывали три раза. Затем клеточную массу ресуспендировали в буфере для лизиса, содержащем 1%3-[(3-холамидопропил)диметиламмоний]-1-пропансульфонат (CHAPS) и ингибиторы протеиназ. После лизиса надосадочную жидкость собирали и смешивали с гранулами протеин А-сефарозы (PAS) со связанным антителом, которые предварительно получали посредством инкубации 60 мкл гранул PAS с 50 мкг моноклонального антитела ГКГС II, специфического к молекулам HLA-DR (клон L243). Лизат и гранулы со связанным антителом (Ab) инкубировали в течение ночи при температуре 4°C при мягком вращении. После аффинного захвата гранулы центрифугировали и удаляли надосадочную жидкость. Выполняли несколько промывок с применением соответственно: 1×1 мл 1% буфера CHAPS, 1×1 мл 20 мМ трис-буфера/50 мМ NaCl, 1×1 мл 20 мМ трис-буфера с pH 8,0. После промывки к гранулам добавляли 200 мкл 10% раствора уксусной кислоты, мягко перемешивали на вортексе и инкубировали в течение 15 мин при температуре 70°C. Гранулы центрифугировали в течение 5 мин при 14000 g. Этот этап повторяли один раз. Обе надосадочные жидкости соединяли и фильтровали с применением центрифужного фильтра с пороговой молекулярной массой 10 кДа (Amicon Ultra, Millipore). Как ретентат (содержащий в основном антитела к HLA-DR и молекулы HLA-DR), так и фильтрат (содержащий HLA-DR-презентированные пептиды) хранили при температуре 20°C для дальнейшего анализа ЖХ-МС/МС.
Анализ МС
Перед анализом МС пептиды HLA-DR обессоливали с применением обессоливающих колонок- обращенно-фазной колонки С18 (The Nest group, США) или комбинированной колонки OASIS (Waters, США) - в соответствии с руководством изготовителя. После обессоливания пептиды анализировали наножидкостной хроматографией с масс-спектрометрией/масс-спектрометрией (нано-ЖХ-МС/МС), с применением внутрилабораторной колонки Magic С18 (150×0,075 мм) для разделения пептидов (2-35% ацетонитрил/0,1% муравьиная кислота в течение 30 минут), соединенной с прибором Orbitrap XL. Пептиды выбирали для фрагментации, применяя информационно-зависимый сбор данных пяти наиболее интенсивных ионов в каждом полном сканировании. Динамическое исключение было включено, длительность исключения составляла 30 секунд. Фрагментацию выполняли с применением индуцированной столкновениями диссоциации (CID) с энергией столкновения 35%. Наконец, пептиды идентифицировали по базе данных коровьего молока с помощью программы поиска по базе данных Sequest и проверяли данные вручную на основании качества и индекса совпадения спектра.
Пример 2. BLG-специфические гуморальные иммунные ответы у мышей, которым через зонд вводили nBLG или синтетические пептиды, а затем сенсибилизировали их экспериментальным путем
Мыши
Мыши BALB/cJ без специфических патогенов (SPF) (самки в возрасте 3-4 недель, Centre d'Elevage  Janvier, г. Ле Женест-Сент-Иль, Франция) содержались в клетках с фильтром при нормальных условиях ухода без специфических патогенов (обработанная в автоклаве подстилка и стерильная вода) и проходили акклиматизацию в течение двух недель до экспериментов. Их содержали на рационе с исключением животного белка, в котором не был обнаружен BLG по результатам специфичных иммунологических сэндвич-анализов. Все эксперименты на животных выполняли в соответствии с правилами Европейского сообщества по уходу за животными и с разрешения французской ветеринарной службы под номером 91-368. Все эксперименты соответствовали соглашению №2009-DDSV-074 (29 октября 2009 г.) с департаментом по ветеринарному надзору г. Эссона (Франция).
Janvier, г. Ле Женест-Сент-Иль, Франция) содержались в клетках с фильтром при нормальных условиях ухода без специфических патогенов (обработанная в автоклаве подстилка и стерильная вода) и проходили акклиматизацию в течение двух недель до экспериментов. Их содержали на рационе с исключением животного белка, в котором не был обнаружен BLG по результатам специфичных иммунологических сэндвич-анализов. Все эксперименты на животных выполняли в соответствии с правилами Европейского сообщества по уходу за животными и с разрешения французской ветеринарной службы под номером 91-368. Все эксперименты соответствовали соглашению №2009-DDSV-074 (29 октября 2009 г.) с департаментом по ветеринарному надзору г. Эссона (Франция).
Воздействие введения BLG и синтетических пептидов
Группам из 6 или 7 мышей вводили либо 4 мг нативного коровьего BLG, либо эквивалентное количество (т.е. 0,22 мкмоль) выделенных синтетических пептидов BLG. Вводили (n=7/группа) либо 0,6 мг синтетического пептида (84-106), соответствующего номерам последовательности коровьего BLG 84-106 (молекулярная масса (MW) 2731 Да), либо 2 мг синтетического пептида (25-107), соответствующего номерам последовательности коровьего BLG 25-107 (MW 9440 Да). Девять контрольных мышей получали ФСБ. Синтетические пептиды (25-107) и (84-106) разбавляли в ФСБ. Введение выполняли на сутки 1, 2, 3, 8, 9 и 10 при помощи внутрижелудочного зонда с применением иглы для кормления животных (Popper & sons, г. Нью-Йорк). Контрольные мыши получали ФСБ (мыши группы отрицательного контроля, n=16). Впоследствии на сутки 14 всех мышей сенсибилизировали посредством интраперитонеального введения 5 мкг нативного коровьего BLG, адсорбированного на квасцах (Alhydrogel 3%, Superfos, Дания, 1 мг/мышь).
Эффективность сенсибилизации мышей оценивали посредством количественных измерений BLG-специфических антител IgE в индивидуальных образцах сыворотки крови, взятых у мышей из ретроорбитального венозного сплетения под легкой анестезией (изофлуран, Baxter) между сутками 30 и 33. Неспецифическое связывание определяли с применением индивидуальных образцов сыворотки крови от 10 мышей, ранее не подвергавшихся воздействию, и выводили из значений поглощения, измеренных с использованием иммунной сыворотки.
Статистический анализ, выполняемый с применением t-критерия Стьюдента для одной выборки с поправкой Уэлча, показал значимое различие в концентрациях BLG-специфических антител IgE между группой мышей, получавших пептид (25-107), и группой, получавшей ФСБ (р=0,04) (см. Фиг. 1).
Статистический анализ
Все статистические анализы выполняли с применением программы GraphPad Prism версии 4.00 для ОС Windows (GraphPad Software, г. Сан-Диего, штат Калифорния, США). Сначала проверяли нормальность распределения с применением критерия нормальности Шапиро - Уилка, затем анализировали статистическую значимость, используя однофакторный дисперсионный анализ и апостериорный критерий множественного сравнения Тьюки. Если данные не соответствовали нормальному распределению, выполняли непараметрический анализ, применяя критерий Краскела - Уоллиса, а затем критерий множественного сравнения Данна (DMCT). Различия между группами считали значимыми при р<0,05. Сравнение двух конкретных групп выполняли с использованием t-критерия Стьюдента для одной выборки с поправкой Уэлча на логарифмически преобразованных данных, которые позволяют получить сопоставимую дисперсию.
Пример 3
Ниже приведен пример композиции детской смеси для применения в соответствии с настоящим изобретением. Эта композиция приводится только в качестве иллюстрации.