Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО КОМПОЗИТА НА ОСНОВЕ НАНОКРИСТАЛЛИЧЕСКОГО ДИОКСИДА ЦЕРИЯ И КУРКУМИНА
Вид РИД
Изобретение
Изобретение относится к области фармации, а именно к способам получения биологически активных композитов, а именно композитов на основе нанокристаллического диоксида церия и куркумина, которые могут быть использованы в качестве или входить в состав препаратов для раневой терапии, антиоксидантных, противовоспалительных и противоопухолевых препаратов.
Куркумин - биологически активный компонент корневища куркумы {Curcuma Longa L.), растения семейства имбирных [1], липофильный биофлавоноид (diferuloylmethane), обладающий широким спектром антиоксидантного действия. При этом куркумин является не столько классическим антиоксидантом, сколько ингибитором комплекса IκВ-α-киназы и Akt [2-4], который обеспечивает супрессию NF-κВ, а также медиирует процессы пролиферации и ангиогенеза. Куркумин может как непосредственно взаимодействовать с IkB-α-киназой [5], так и выступать в качестве ингибитора сигнальной трасдукции и активатора транскрипции 3 (Signal Transducer and Activator of Transcription 3 - STAT-3), второго фактора ядерной транскрипции, благодаря которому провоспалительные эффекты медиируются цитокином IL-6 [6]. Также показана возможность присоединения молекул куркумина к СОХ-2 и 5-LOX с последующим ингибированием активности последних [7]. Все это показывает эффективность куркумина в качестве супрессора иммуновоспалительного ответа благодаря его взаимодействию с молекулами внутриклеточных каскадов сигнальной трансдукции. Куркумин перспективен также в терапии онкологических заболеваний, поскольку ингибирование фосфорилирования субъединиц IkBa и р65 снижает активность фактора NF-kB в опухолевых клетках [8, 9]. При этом торможение активации NF-κВ в опухолевых клетках сопровождается супрессией антиапоптотических белков [10]. Раковые клетки, как правило, развивают устойчивость к апоптозу за счет сверхпродукции антиапоптогенных белков и снижения уровня апоптогенных белков. Куркумин усиливает апоптоз, индуцированный фактором некроза опухолей (TNF) [11]. Куркумин также ингибирует пролиферацию многих раковых клеток in vitro и оказывает противоопухолевые эффекты in vivo за счет способности осуществлять контроль активности циклинов и циклин-зависимых киназ и усиливать экспрессию ингибиторных белков CDKI [12-14]. В опытах с имплантацией клеток карциномы печени иммунодефицитным мышам куркумин снижал как плотность неокапилляров опухоли, так и уровень фактора VEGF в плазме животных [15].
Несмотря на терапевтический потенциал, использование куркумина для лечения различных заболеваний затруднено из-за его быстрого клиренса и достаточно низкой растворимости в воде [16, 17].
Для увеличения его биодоступности часто используют поверхностно-активные вещества (ПАВ) в качестве солюбилизаторов.
Например, в патенте [18] в качестве такого поверхностно-активного вещества использовали мальтодекстрин. Однако, нами было показано, что использование мальтодекстрина в качестве поверхностно-активного вещества не обеспечивает проникновение куркумина в клетки, поэтому мальтодекстрин не увеличивает биодоступность куркумина.
В патентах [19, 20] авторы для получения солюбилизата куркумина использовали Полисорбат 80, Полисорбат 20 или их смесь, также известно применение оксиэтилированного касторового масла Kalliphor ELP или Cremophor RH 40 [21, 22], где дополнительными стабилизаторами являлись лимонная кислота или триглицериды каприл-капроновой кислоты. В качестве стабилизаторов часто используют водорастворимые полимеры, например, полиэтиленгликоль [23], желатин [24], а также углеводы, например, циклодекстрин [25].
Недостатком таких солюбилизатов является их сравнимая токсичность по отношению к нормальным и малигнизированным клеткам. Многие авторы отмечают небезопасность использования куркумина, в том числе стабилизированного, в медицинских целях, поскольку при определенных условиях он может проявлять цитотоксичность по отношению к нормальным клеткам [26, 27]. Авторы обзора [28] приводят возможные механизмы негативного воздействия куркумина. В первую очередь, оно связано с тем, что куркумин в некоторых концентрациях может стимулировать увеличение уровня активных форм кислорода, повреждающих клетки.
Нанокристаллический диоксид церия (НДЦ) - неорганический антиоксидант [29, 30], который способен выполнять функцию некоторых оксидоредуктаз: каталазы [30] супероксиддисмутазы [31] и оксидазы [32], а также фосфатазы [33] - при этом НДЦ ингибирует деятельность киназ, регулируя активность ядерного фактора NF-κB [34].
Таким образом, нанокристаллический диоксид церия может нивелировать токсичность куркумина по отношению к нормальным клеткам, благодаря инактивации активных форм кислорода, и при этом сохранить его терапевтическое действие относительно раковых клеток. Существуют работы, в которых исследовано синергетическое действие куркумина и нанокристаллического диоксида церия.
Наиболее близкое техническое решение предложенного изобретения изложено в статье [35] (прототип). Растворяли 8 мг (или 16 мг) в 0.5 мл ацетона и добавляли раствор к щелочному коллоидному раствору нанокристаллического диоксида церия с концентрацией 5 или 10 мМ, стабилизированного декстраном. Полученный смешанный коллоидный раствор перемешивали в течение одной ночи и затем центрифугировали в течение 5 мин при 1000 об/мин для удаления несорбировавшегося куркумина. Отобранную надосадочную жидкость хранили в темноте до использования.
Обоснованное сомнение вызывает сохранность куркумина в полученном растворе - в щелочной среде куркумин быстро деградирует. Это подтверждается видом представленных авторами УФ-видимых спектров полученных смешанных коллоидных растворов. На спектрах практически отсутствует полоса поглощения куркумина. Таким образом, к основному недостатку прототипа можно отнести нестабильность куркумина в процессе получения и хранения смешанных коллоидных растворов.
Еще одним недостатком является ограниченный диапазон концентраций куркумина в получаемых композициях, поскольку весь несорбировавшийся на поверхности нанокристаллического диоксида церия куркумин удаляют центрифугированием.
Изобретение направлено на изыскание способа получения биологически активного композита на основе нанокристаллического диоксида церия и куркумина, обладающего пониженной цитотоксичностью и повышенной биодоступностью, что позволит безопасно использовать его в широком диапазоне концентраций в различных медицинских целях, в частности, в составе препаратов для раневой терапии, антиоксидантых, противовоспалительных и противоопухолевых препаратах.
Технический результат достигается тем, что предложен способ получения биологически активного композита на основе нанокристаллического диоксида церия и куркумина, характеризующегося относительно низкой цитотоксичностью и относительно высокой биодоступностью, заключающийся в том, что экстракт куркумина в спирте смешивают в темноте со спиртовым коллоидным раствором нанокристаллического диоксида церия, стабилизированного поливинилпирролидоном, в мольном соотношении куркумин ÷ диоксид церия = от 100÷1 до 1÷100, затем полученный смешанный коллоидный раствор сушат в темноте при 60÷75°C до сухого остатка.
Целесообразно, что в качестве спирта используют этанол, изопропанол, н-пропанол.
Получаемый композит может быть сформован в виде подходящей для перорального или парентерального введения лекарственной формы. Сухой композит легко растворяется в протонных и апротонных полярных средах и при необходимости из него путем растворения снова может быть получен смешанный коллоидный раствор.
Диапазон соотношений куркумин ÷ диоксид церия выбран из тех соображений, что при соотношении, большем, чем 100÷1 нивелируется антиоксидантное действие нанокристаллического диоксида церия, а использование соотношения меньшего, чем 1÷100 нецелесообразно, поскольку нивелируется терапевтическое действие куркумина.
Сушку раствора проводят при температуре 60÷75°C, поскольку при более низких температурах спирт медленно улетучивается, а использование более высоких температур приводит к кипению спирта и разбрызгиванию смешанного коллоидного раствора. Также использование температур свыше 75°C приводит к деструкции куркумина.
Сущность изобретения заключается в том, что использование спиртового коллоидного раствора нанокристаллического диоксида церия, стабилизированного поливинилпирролидоном, предотвращает деградацию куркумина в процессе получения композита. Процесс сушки обеспечивает стабильность композита при последующем хранении и позволяет получать композит с широким диапазоном заданных концентраций куркумина и НДЦ.
Синтез нанокристаллического диоксида церия, стабилизированного поливинилпирролидоном (ПВП), проводили аналогично методике, описанной в [36]. Вместо мальто декстрина использовали поливинилпирролидон.
Влияние синтезированного композита на основе нанокристаллического диоксида церия и куркумина на жизнеспособность клеток изучали, используя 7 видов клеточных линий из музея клеточных культур Института экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, а именно: RIN-m5F (АТСС® CRL-11605™) эпителиальные бета-клетки инсулиномы крысы; А549 (АТСС® CCL-185™) эпителиоподобные клетки карциномы легкого; T98G [T98-G] (АТСС® CRL-1690™) фибробласты мультиформной глиобластомы человека; Vero (АТСС® CCL-81™) нормальные эпителиальные клетки почки мартышки; MDBK (NBL-1) (АТСС® CCL-22™) эпителиальные клетки почки быка; НЕр-2 (АТСС® CCL-23™) эпителиоподобные клетки карциномы гортани; ST (АТСС® CRL-1746™) эпителиоподобные клетки свиных тестикул.
Для формирования монослоя клеток в лунки планшетов (96-луночные платы «Costar», США) вносили по 0.1 мл суспензии, содержащей 5×105 клеток/мл, и инкубировали 24 ч при 37°C в термостате ТС-80 М-2, в атмосфере с влажностью 98%, содержащей 5% СО2. В качестве ростовой среды использовали синтетическую питательную среду 199 («Биотестлаборатория», Украина), содержащую 5-10% эмбриональной сыворотки телят («Sigma», США), 25 мМ HEPES, 10 мМ глютамина, пенициллина и стрептомицина (по 100 ед/мл каждого).
В состав поддерживающей среды входили: среда 199, 2% эмбриональной сыворотки телят, 25 мМ HEPES, 10 мМ глютамина, пенициллин и стрептомицин (по 100 ед/мл каждого). Для промывки монослоя клеток использовали среду 199 без сыворотки. Количество выживших клеток оценивали по интенсивности окраски клеток кристаллическим фиолетовым. Для этого из лунок удаляли надосадочную жидкость, а к клеткам на 15 мин вносили 0.2% раствор красителя в 2% этаноле. Затем краситель удаляли, а окрашенный монослой клеток промывали дистиллированной водой и высушивали. Оптическую плотность окрашенных клеток измеряли на спектрофотометре с вертикальным лучом LabsystemMultiscan (Великобритания) на длине волны 540 нм. Процент окрашенных клеток в опытных лунках определяли по формуле:
(Поп/Пконтр)*100, где
Поп - показатели оптической плотности опытных лунок,
Пконтр - оптическая плотность в интактных, контрольных лунках.
Статистическую обработку проводили с использованием программного комплекса BioStat 2009 Professional 5.8.1. Числовые данные представлены в виде медианы первого и третьего интерквартильного интервала.
Биодоступность синтезированного композита на основе нанокристаллического диоксида церия и куркумина оценивали по степени проникновения в клетку (по интенсивности его люминесценции), используя референтную клеточную линию фибробластов мышей (L929) из музея клеточных культур Института экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины.
Изобретение проиллюстрировано следующими фигурами.
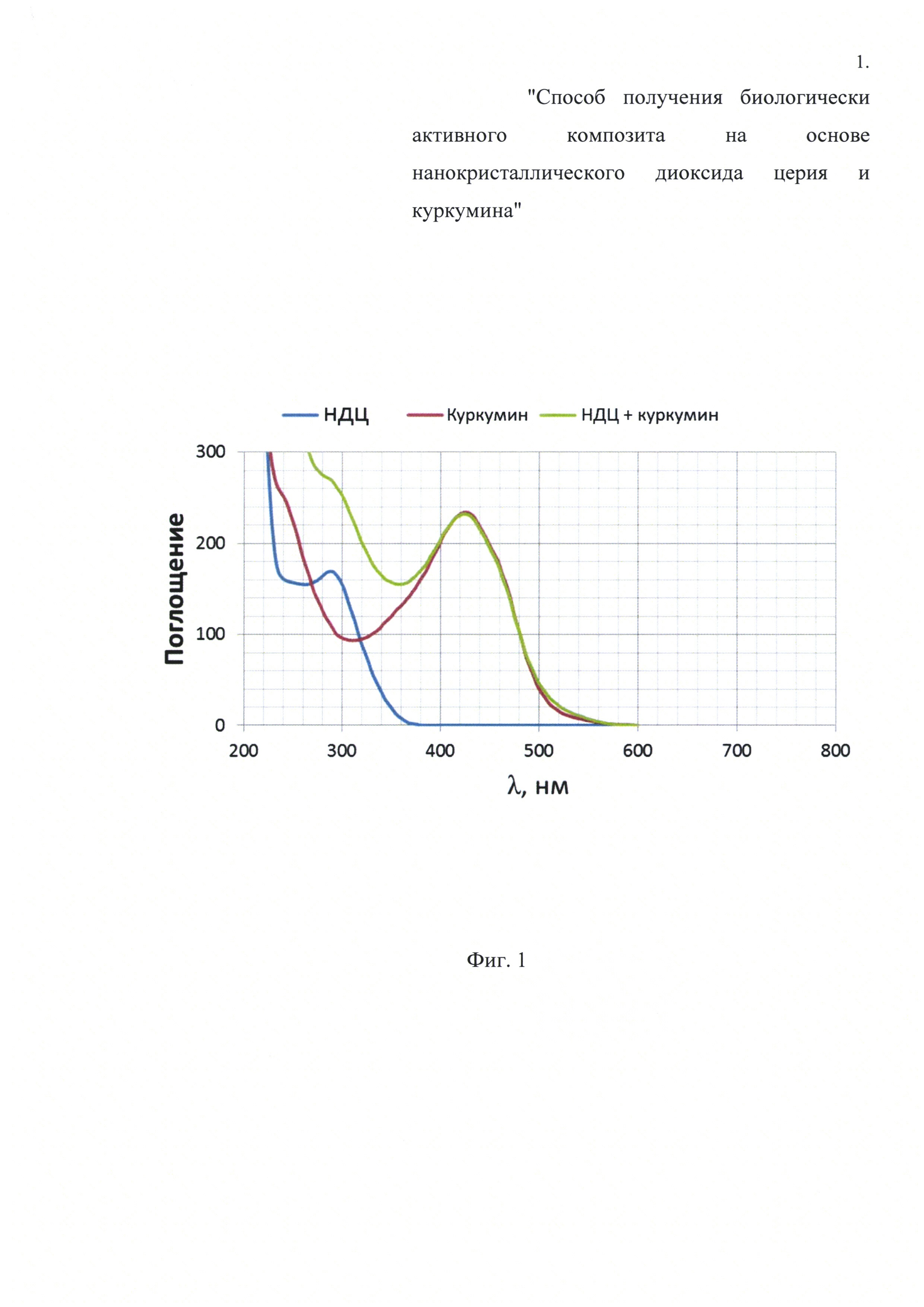
Фиг. 1. УФ-видимые спектры поглощения экстракта куркумина в изопропаноле (красная полоса), изопропанольного коллоидного раствора нанокристаллического диоксида церия, стабилизированного поливинилпирролидоном (синяя полоса), и смешанного коллоидного раствора (зеленая полоса).
Фиг. 2. Результаты просвечивающей электронной микроскопии композита. Видно образование гибридной частицы, состоящей из куркумина и наночастиц диоксида церия, графическая модель представлена на врезке.
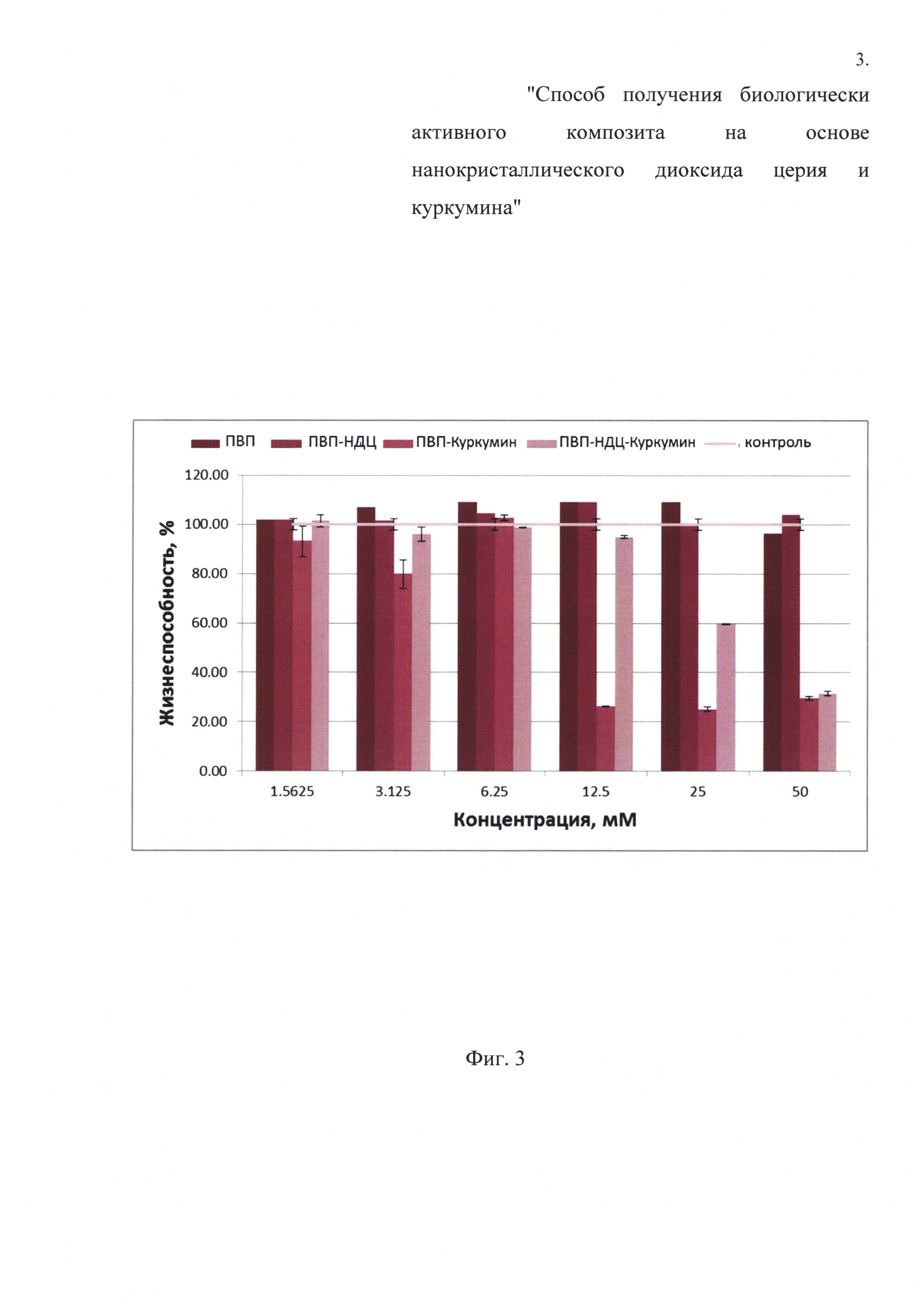
Фиг. 3. Зависимость жизнеспособности клеток MDBK (NBL-1) (АТСС® CCL-22™) от концентрации композита в ростовой среде (также приведены данные контрольных измерений).
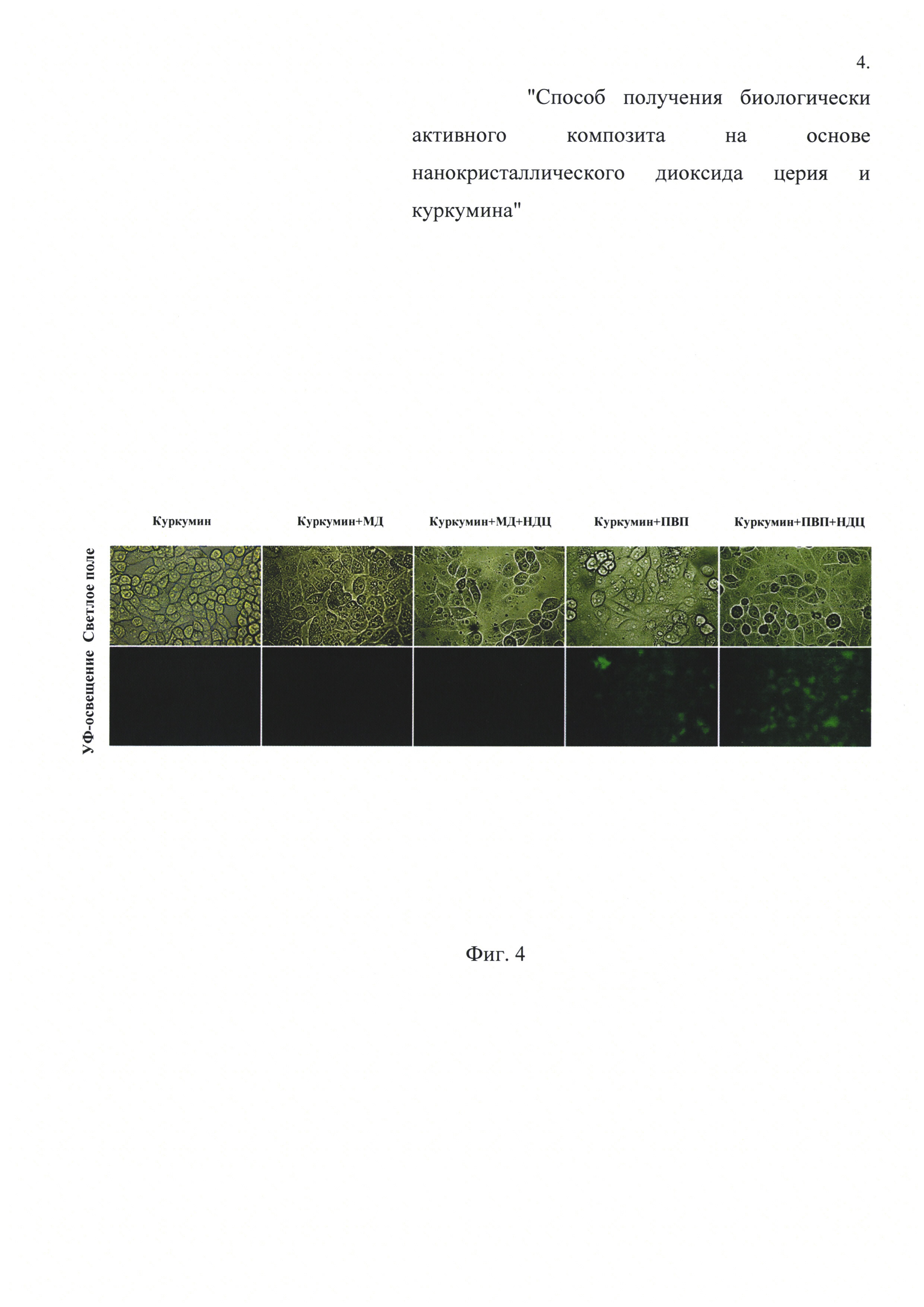
Фиг. 4. Микрофотографии в светлом поле и соответствующие им люминесцентные изображения при УФ-освещении нефиксированных клеток L929, обработанных: куркумином без стабилизатора; куркумином, стабилизированным мальтодекстрином (МД) в отсутствии и в присутствии нанокристаллического диоксида церия; куркумином, стабилизированным ПВП в отсутствии и в присутствии нанокристаллического диоксида церия.
Ниже приведены примеры иллюстрирующие, но не ограничивающие предложенный способ.
Пример. 1.
Экстракт куркумина в изопропаноле смешивали с изопропанольным коллоидным раствором нанокристаллического диоксида церия, стабилизированного поливинилпирролидоном, в мольном соотношении куркумин ÷ диоксид церия =1÷4. Присутствие куркумина в полученном смешанном коллоидном растворе подтверждали с помощью УФ-видимых спектров, что показано на Фиг. 1. Затем полученный смешанный коллоидный раствор сушили при 70°C до сухого остатка. Совместное использование полимера, наночастиц диоксида церия и куркумина позволяет получить именно композит, что подтверждали с помощью просвечивающей электронной микроскопии и проиллюстрировано Фиг. 2. Было показано, что приготовленный композит обладает относительно низкой цитотоксичностью, что проиллюстрировано Фиг. 3. Также полученный композит имеет относительно высокую биодоступность, что показано на Фиг. 4.
Пример. 2.
По примеру 1, отличающийся тем, что экстракт куркумина в изопропаноле смешивали с изопропанольным коллоидным раствором нанокристаллического диоксида церия, стабилизированного поливинилпирролидоном, в мольном соотношении куркумин ÷ диоксид церия =100÷1. Присутствие куркумина в полученном смешанном коллоидном растворе подтверждали с помощью УФ-видимых спектров. Затем полученный смешанный коллоидный раствор сушили при 60°C до сухого остатка. Совместное использование полимера, наночастиц диоксида церия и куркумина позволяет получить именно композит, что подтверждали с помощью просвечивающей электронной микроскопии. Установлено, что приготовленный композит обладает относительно низкой цитотоксичностью и имеет относительно высокую биодоступность.
Пример. 3.
По примеру 1, отличающийся тем, что экстракт куркумина в изопропаноле смешивали с изопропанольным коллоидным раствором нанокристаллического диоксида церия, стабилизированного поливинилпирролидоном, в мольном соотношении куркумин ÷ диоксид церия =1÷100. Присутствие куркумина в полученном смешанном коллоидном растворе подтверждали с помощью УФ-видимых спектров. Затем полученный смешанный коллоидный раствор сушили при 75°C до сухого остатка. Совместное использование полимера, наночастиц диоксида церия и куркумина позволяет получить именно композит, что подтверждали с помощью просвечивающей электронной микроскопии. Установлено, что приготовленный композит обладает относительно низкой цитотоксичностью и имеет относительно высокую биодоступность.
Предложенный способ позволяет получать биологически активный композит на основе нанокристаллического диоксида церия и куркумина, обладающий пониженной цитотоксичностью и повышенной биодоступностью, что позволяет безопасно его использовать для различных биомедицинских приложений.
Литература
1. Chainani-Wu, N. Safety and anti-inflammatory activity of curcumin: a component of tumeric (Curcuma longa). The Journal of Alternative & Complementary Medicine, (2003), 9(1), 161-168.
2. Shishodia S., Amin H.M., Lai R., Aggarwal B.B. Curcumin (diferuloylmethane) inhibits constitutive NF-kappaB activation, induces G1/S arrest, suppresses proliferation, and induces apoptosis in mantle cell lymphoma. // Biochem. Pharmacol., (2005), 70(5): 700-713.
3. Aoki H., Takada Y., Kondo S. Et al. Evidence that curcumin suppresses the growth of malignant gliomas in vitro and in vivo through induction of autophagy: role of Akt and extracellular signal-regulated kinase signaling pathways. // Mol. Pharmacol., (2007) 72(1): 29-39.
4. Kamat A.M., Sethi G., Aggarwal B.B. Curcumin potentiates the apoptotic effects of chemotherapeutic agents and cytokines through down-regulation of nuclear factor-kappaB and nuclear factor-kappaB-regulated gene products in IFN-alpha-sensitive and IFN-alpha-resistant human bladder cancer cells. // Mol. Cancer Ther, (2007), 6(3): 1022-1030.
5. Aggarwal B.B., Shishodia S., Sandur S.K. et al. Inflammation and cancer: how hot is the link? // Biochem. Pharmacol., (2006), 72(11): 1605-1621.
6. Bharti A.C., Donato N., Aggarwal B.B. Curcumin (diferuloylmethane) inhibits constitutive and IL-6-inducible STAT3 phosphorylation in human multiple myeloma cells. // J. Immunol., (2003), 171(7): 3863-3871.
7. Hong J., Bose M., Ju J. et al. Modulation of arachidonic acid metabolism by curcumin and related beta-diketone derivatives: effects on cytosolic phospholipase A(2), cyclooxygenases and 5-lipoxygenase. // Carcinogenesis, (2004), 25(9): 1671-1679.
8. Aggarwal, S., Takada, Y., Singh, S., Myers, J.N., Aggarwal, В.B. Inhibition of growth and survival of human head and neck squamous cell carcinoma cells by curcumin via modulation of nuclear factor-κВ signaling. // International journal of cancer, (2004), 111(5), 679-692.
9. Aggarwal, В.В., Shishodia, S. Suppression of the Nuclear Factor-кВ Activation Pathway by Spice-Derived Phytochemicals: Reasoning for Seasoning. // Annals of the New York Academy of Sciences, (2004), 1030(1), 434-441.
10. Kunnumakkara A.B., Guha S., Krishnan S. etal. Curcumin potentiates antitumor activity of gemcitabine in an orthotopic model of pancreatic cancer through suppression of proliferation, angiogenesis, and inhibition of nuclear factor-kappaB-regulated gene products. // Cancer Res., (2007), 67(8), 3853-3861.
11. Gao X., Deeb D., Jiang H., Liu Y.B., Dulchavsky S.A., Gautam S.C. Curcumin differentially sensitizes malignant glioma cells to TRAIL/Apo2L-mediated apoptosis through activation of procaspases and release of cytochrome с from mitochondria. // J. Exp. Ther. Oncol., (2005), 5, 39-48.
12. Meeran S.M., Katiyar S.K. Cell cycle control as a basis for cancer chemoprevention through dietary agents// Front Biosci., (2008), 13, 2191-2202.
13. Salvioli, S., Sikora, E., Cooper, E.L., Franceschi, C. Curcumin in cell death processes: a challenge for CAM of age-related pathologies. // Evidence-Based Complementary and Alternative Medicine, (2007), 4(2), 181-190.
14. Sa, G., Das, T. Anti cancer effects of curcumin: cycle of life and death. // Cell Division, (2008), 3(1), 14.
15. Yoysungnoen, P., Wirachwong, P., Changtam, C, Suksamrarn, A., Patumraj, S. Anti-cancer and anti-angiogenic effects of curcumin and tetrahydrocurcumin on implanted hepatocellular carcinoma in nude mice. // World journal of gastroenterology: WJG, (2008), 14(13), 2003.
16. Tonnesen, H.H., Solubility, chemical and photochemical stability of curcumin in surfactant solutions. Studies of curcumin and curcuminoids, XXVIII. // Pharmazie, 2002, 57(12): p. 820-4.
17. Pathak, N. and S. Khandelwal, Comparative efficacy of piperine, curcumin and picroliv against Cd immunotoxicity in mice. // Biometals, 2008, 21(6), p. 649-61.
18. Специализированный пищевой продукт. Тутельян Виктор Александрович и др. RU 2611821, Заявка: 2015157126, 30.12.2015
19. Солюбилизат куркумина. БЕНАМ Дариуш. RU 2615815, Заявка: 2015129577, 15.05.2013
20. Curcumin solubilisate. Behnam, Dariush. United States Patent Application 20160128939, Publication Date: 05.12.2016.
21. Pharmaceutical composition containing curcumin. Rose, Uwe-bernd. United States Patent Application 20150342904. Publication Date: 12.03.2015.
22. Pharmaceutical compositions of curcumin. Khamar, Bakulesh Mafatlal. United States Patent Application 20130225689. Publication Date: 08.29.2013.
23. Water Soluble Curcumin-Based Compounds. Safavy, Ahmad. United States Patent Application 20100316631. Publication Date: 12.16.2010.
24. Water-soluble curcumin complex. Schranz, John L. US 4368208, Publication Date: 01.11.1983.
25. Soluble complexes of curcumin. US 8568815. Parkkinen, Jaakko. Publication Date: 10.29.2013.
26. Ahsan H, Hadi SM. Strand scission in DNA induced by curcumin in the presence of Cu(II) // Cancer Lett, (1998), 124, 23-30.
27. Sakano K, Kawanishi S. Metal-mediated DNA damage induced by curcumin in the presence of human cytochrome P450 isozymes // Arch Biochem Biophys, (2002), 405: 223-30.
28. E.  , J.M.
, J.M.  , J. Salvador, A. Robles, M.
, J. Salvador, A. Robles, M.  . The dark side of curcumin // IJC, (2010), 126(7), 1771-1775.
. The dark side of curcumin // IJC, (2010), 126(7), 1771-1775.
29. Ivanov, V.K., Shcherbakov, А.В., & Usatenko, A.V. Structure-sensitive properties and biomedical applications of nanodispersed cerium dioxide // Russian chemical reviews, (2009), 78(9), 855.
30. Pirmohamed, Т., Dowding, J.M., Singh, S., Wasserman, В., Heckert, E., Karakoti, A.S., … & Self, W.T. Nanoceria exhibit redox state-dependent catalase mimetic activity // Chemical communications, (2010), 46(16), 2736-2738.
31. Korsvik, C., Patil, S., Seal, S., & Self, W.T. Superoxide dismutase mimetic properties exhibited by vacancy engineered ceria nanoparticles // Chemical communications, (2007), (10), 1056-1058.
32. Asati, A., Santra, S., Kaittanis, C., Nath, S., & Perez, J.M. Oxidase-Like Activity of Polymer-Coated Cerium Oxide Nanoparticles // Angewandte Chemie International Edition, (2009), 48(13), 2308-2312.
33. Kuchma, M.H., Komanski, С.В., Colon, J., Teblum, A., Masunov, A.E., Alvarado, В., … & Baker, С.H. Phosphate ester hydrolysis of biologically relevant molecules by cerium oxide nanoparticles // Nanomedicine: Nanotechnology, Biology and Medicine, (2010), 6(6), 738-744.
34. Niu, J., Wang, K., & Kolattukudy, P.E. Cerium oxide nanoparticles inhibits oxidative stress and nuclear factor-кВ activation in H9c2 cardiomyocytes exposed to cigarette smoke extract // Journal of Pharmacology and Experimental Therapeutics, (2011), 338(1), 53-61.
35. I. Kalashnikova, J. Mazar, C.J. Neal, A.L. Rosado, S. Das, T.J. Westmoreland and S. Seal. Nanoparticle delivery of curcumin induces cellular hypoxia and ROS-mediated apoptosis via modulation of Bcl-2/Bax in human neuroblastoma // Nanoscale, (2017), 9, 10375-10387.
36. Shcherbakov, А.В., Zholobak, N.M., Ivanov, V.K., Ivanova, O.S., Marchevsky, A.V., Baranchikov, A.E., … & Tretyakov, Y.D. Synthesis and antioxidant activity of biocompatible maltodextrin-stabilized aqueous sols of nanocrystalline ceria // Russian Journal of Inorganic Chemistry, (2012), 57(11), 1411-1418.