Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ ОКТАГИДРОХРОМЕНЫ В КАЧЕСТВЕ СРЕДСТВА ПРОТИВ ВИРУСА ГРИППА
Вид РИД
Изобретение
Изобретение относится к медицине и фармацевтике, а именно, к лекарственным средствам, обладающим антивирусным действием против вируса гриппа.
Грипп является наиболее распространенным инфекционным заболеванием людей, которым ежегодно болеет около 20% населения Земли. Вирус гриппа вызывает повторяющиеся эпидемии с массовыми заболеваниями людей и высокой смертностью, вызванной последующими осложнениями [1]. Наряду с вакцинацией, химиотерапия является важнейшим способом предупреждения и лечения вирусных заболеваний, особенно во время пандемий, когда распространение нового вируса происходит быстрее, чем практическая медицина способна осуществить производство вакцины и вакцинацию эпидемически значимой части населения.
Высокая изменчивость вируса гриппа позволяет ему вырабатывать резистентность к тем немногим известным противогриппозным препаратам, которые применяются в настоящий момент (ингибиторы нейраминидазы и блокаторы М2 канала) [2]. Известно, что при использовании комбинированного состава двух и более препаратов с различным механизмом действия возможно предотвратить развитие резистентных мутантов вируса гриппа [3]. Таким образом, необходимым является поиск препаратов против вируса гриппа новых структурных типов, в том числе, имеющих иные, по сравнению с уже используемыми, мишени и механизмы действия.
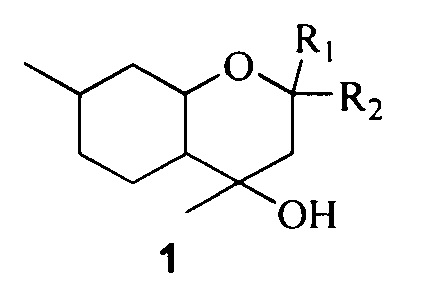
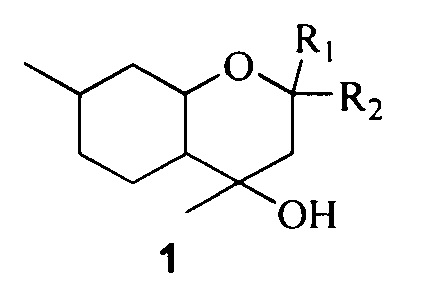
Поставленная задача решается путем использования в качестве противовирусных средств замещенных октагидрохроменов общей формулы 1, включая их пространственные изомеры:
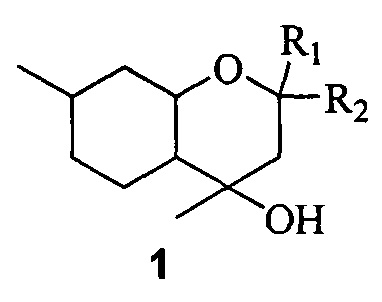
где R1 и R2 являются алкильными группами и могут быть одинаковыми или различаться или являться компонентами карбоцикла.
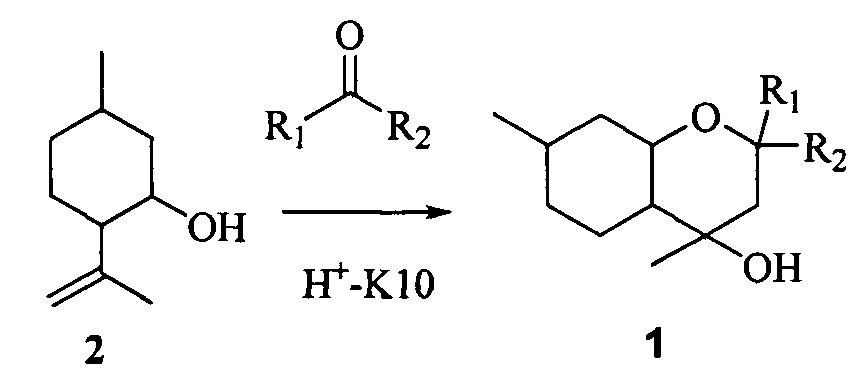
Известно, что соединения типа 1 могут быть получены взаимодействием изопулегола 2 с кетонами в присутствии кислотно-активированной монтмориллонитовой глины K10 (Н+-K10, [4]) с использованием микроволнового облучения [4] или под воздействием иода в ацетоне [5].
Мы показали, что синтез соединений типа 1 может быть осуществлен взаимодействием изопулегола 2 или его пространственных изомеров с кетонами в присутствии монтмориллонитовых глин без применения микроволнового облучения, что упрощает методику проведения реакции.
В качестве тестового вируса для скрининга был выбран вирус гриппа А (штамм A/Puerto Rico/8/34 (H1N1)), который является актуальным на протяжении нескольких сезонов.
На первой стадии биологических экспериментов определяли 50% цитотоксическую дозу (CTD50) каждого препарата в культуре клеток MDCK. Далее оценивали противовирусную активность каждого препарата и определяли 50% эффективную дозу (ЕС50), а также вычисляли химиотерапевтический индекс (SI) - отношение CTD50 к ЕС50. Это соотношение отражает эффективность исследуемого соединения как противовирусного средства. Принято считать, что соединения, SI которых превышает 10, проявляют противовирусную активность. Полученные данные сравнивали с соответствующими показателями римантадина.
Исследования биологической активности соединений 1 показали их высокую эффективность как ингибиторов репродукции вируса гриппа (Таблица 1). Полученные количественные показатели ингибирования подтверждают высокую степень подавления репликации вируса гриппа в культуре клеток MDCK соединениями 1 с высоким индексом селективности, превышающим тот же показатель у препарата сравнения римантадина до 27 раз.

Изобретение иллюстрируется следующими примерами:
Пример 1. Синтез 2,2,4,7-тетраметилоктагидро-2H-хромен-4-ола 1а взаимодействием изопулегола 2 с ацетоном в присутствии монтмориллонита Н+-K10.
К 0.45 г монтмориллонита Н+-K10, прокаленного 1 час при 120°С, прибавили 0.90 г изопулегола 2 и 0.68 г ацетона, перемешивали при комнатной температуре в течение 2.5 часа. Добавили 20 мл этилацетата. Катализатор отфильтровали, фильтрат упарили. Полученную реакционную смесь делили на колонке с 20 г силикагеля (60-200 μ, Macherey-Nagel) (элюент - гексан с градиентом этилацетата от 0 до 100%). Выделили 0.534 г соединения 1а (43%).
Соединение 1а: Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.82-0.91 м (1Н, Н8а), 0.88 д (3Н, J14,9 6.6 Гц, С14Н3), 0.92-1.02 м (2Н, Н7а, Н10а), 1.08 д.д.д (1Н, J6a,7a 12.1, J6a,1a 10.2, J6a,7e 3.2 Гц, Н6а), 1.17 с (3Н, C12H3), 1.18 с (3Н, С11Н3), 1.20 д (3Н, J13,4а 0.8 Гц, С13Н3), 1.35-1.46 м (1Н, H9a), 1.57 ш.д (1H, J4a,4e 13.2 Гц, Н4а), 1.67 д.м (1H, J8e,8a 12.7 Гц, другие J<3.5 Гц, Н8е), 1.69 д (1Н, J4e,4a 13.2 Гц, H4e), 1.82-1.89 м (2Н, Н7е, Н10е), 3.18 д.д.д (1Н, J1a,10a 10.8, J1a,6a 10.2, J1a,10e 4.3 Гц, Н1а). Спектр ЯМР 13С (CDCl3), δ, м.д.: 70.84 д (С1), 71.80 с (С3), 52.89 т (С4), 70.23 с (С5), 51.98 д (С6), 22.82 т (С7), 34.26 т (С8), 31.35 д (С9), 41.82 т (С10), 33.30 к (С11), 23.84 к (С12), 23.75 к (C13), 22.06 к (С14). Найдено [М-СН3] 197.1540 C12H21O2. Вычислено [М-СН3] 197.1536.
Пример 2. Синтез 2,2,4,7-тетраметилоктагидро-2H-хромен-4-ола 1а взаимодействием соединения 2 с ацетоном в присутствии монтмориллонита H+-K10.
К 0.15 г монтмориллонита Н+-K10, прокаленного 1 час при 120°С, прибавили 0.30 г соединения 2 и 0.23 г ацетона, перемешивали при комнатной температуре в течение 2 часов. Добавили по 15 мл этилацетата и ацетона. Катализатор отфильтровали, фильтрат упарили. Полученную реакционную смесь делили на колонке с 17 г силикагеля (60-200 μ, Macherey-Nagel) (элюент - гексан с градиентом этилацетата от 0 до 100%). Выделили 0.204 г соединения 1а (49%).
Пример 3. Синтез 2,2-диэтил-4,7-диметилоктагидро-2H-хромен-4-ола 1b взаимодействием изопулегола 2 с 3-пентаноном в присутствии монтмориллонита Н+-K10.
К 0.30 г монтмориллонита Н+-K10, прокаленного 1 час при 120°С, прибавили 0.30 г изопулегола 2 и 0.34 г 3-пентанона, перемешивали при комнатной температуре в течение 2 часов. Добавили по 15 мл этилацетата и ацетона. Катализатор отфильтровали, фильтрат упарили. Полученную реакционную смесь делили на колонке с 17 г силикагеля (60-200 μ, Macherey-Nagel) (элюент - гексан с градиентом этилацетата от 0 до 100%). Выделили 0.131 г соединения 1b (28%).
Соединение 1b: Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.77 т, 0.80 т (по 3Н, J 7.5 Гц, С12Н3, С14Н3), 0.83-0.92 м (1H, Н8а), 0.89 д (3Н, J16,6 6.6 Гц, С16Н3), 0.93-1.03 м (2Н, H7a, H10a), 1.09 д.д.д (1H, J6a,7a 12.2, J6a,1a 10.1, J6a,7e 3.2 Гц, H6a), 1.22 д (3Н, J15,4а 0.8 Гц, С15Н3), 1.31-1.45 м (3Н), 1.46-1.56 м (1Н), 1.64-1.74 м (1H), (Н9а, 2Н11, 2H13), 1.49 ш.д (1Н, J4a,4е 13.4 Гц, H4a), 1.64-1.70 м (1Н, H8e), 1.72 д (1Н, J4e,4а 13.4 Гц, Н4е), 1.82-1.88 м (2Н, Н7е, Н10е), 3.13 д.д.д (1H, J1a,10a 10.7, J1a,6a 10.2, J1a,10e 4.4 Гц, Н1а). Спектр ЯМР 13С (CDCl3), δ, м.д.: 69.97 д (С1), 75.89 с (С3), 48.39 т (С4), 70.43 с (С5), 52.18 д (С6), 22.86 т (С7), 34.32 т (C8), 31.34 д (С9), 41.87 т (С10), 24.72, 33.03 (2 т, С11, С13), 7.44, 7.69 (2 к, С12, С14), 24.31 к (С15), 22.08 к (С16). Найдено [М-С2Н3] 211.1692 C13H22O2. Вычислено [М-С2Н5] 211.1693.
Пример 4. Синтез 4,7-диметилоктагидроспиро[хромен-2,1'-циклопентан]-4-ола 1с взаимодействием изопулегола 2 с циклопентаноном в присутствии монтмориллонита K10.
К суспензии 1.20 г монтмориллонита K10, прокаленного 3 часа при 105°С, в 10 мл CH2Cl2 прибавили раствор 0.40 г изопулегола 2 в CH2Cl2 и раствор 0.23 г циклопентанона в CH2Cl2. Растворитель отогнали, реакционную смесь выдерживали при комнатной температуре в течение 2 часов. Добавили по 15 мл этилацетата и ацетона. Катализатор отфильтровали, фильтрат упарили. Полученную реакционную смесь делили на колонке с 17 г силикагеля (60-200 μ, Macherey-Nagel) (элюент - гексан с градиентом этилацетата от 0 до 100%). Выделили 0.167 г соединения 1с (27%).
Соединение 1с: Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.82-0.91 м (1H, H8a), 0.89 д (3Н, J16,9 6.6 Гц, С16Н3), 0.92-1.03 М (2Н, H7a, H10a), 1.11 д.д.д (1H, J6a,7а 12.2, J6a,1a 10.1, J6a,7e 3.2 Гц, Н6а), 1.17 д (3Н, J15,4a 0.8 Гц, С15Н3), 1.36-1.45 м (1H, H9a), 1.65 д (1H, J4e,4a 13.0 Гц, H4e), 1.82 д.к (1H, J4a,4e 13.0, J4a,15 0.8 Гц, H4a), 1.79-1.88 м (2Н, Н7е, H10e), 3.09 д.д.д (1Н, J1a,10a 10.7, J1a,6a 10.1, J1a,10e 4.3 Гц, H1a). Сигналы протонов циклопентанового фрагмента проявляются в виде мультиплетов в областях 1.25-1.32 (1Н), 1.44-1.53 (2Н), 1.54-1.63 (1Н), 1.64-1.75 (3Н) и 1.88-1.94 (1Н) м.д.. Спектр ЯМР 13С (CDCl3), δ, м.д.: 71.35 д (С1), 83.10 с (С3), 51.35 т (С4), 70.63 с (С5), 52.21 д (С6), 22.91 т (С7), 34.33 т (С8), 31.44 д (С9), 41.84 т (С10), 33.83, 42.88 (2т, С11, С14), 22.53, 24.96 (2т, С12, С13), 22.99 к (С15), 22.07 к (С16). Найдено М 238.1931 C15H26O2. Вычислено М 238.1927.
Пример 5. Синтез 4,7-диметилоктагидроспиро[хромен-2,1'-циклопентан]-4-ола 1с взаимодействием изопулегола 2 с циклопентаноном в присутствии монтмориллонита Н+-K10.
К суспензии 1.00 г монтмориллонита Н+-K10, прокаленного 1 час при 120°С, в 10 мл CH2Cl2 прибавили раствор 0.70 г изопулегола 2 в CH2Cl2 и раствор 0.35 г циклопентанона в CH2Cl2. Растворитель отогнали, реакционную смесь выдерживали при комнатной температуре в течение 2 часов. Добавили по 15 мл этилацетата и ацетона. Катализатор отфильтровали, фильтрат упарили. Полученную реакционную смесь делили на колонке с 17 г силикагеля (60-200 μ, Macherey-Nagel) (элюент - гексан с градиентом этилацетата от 0 до 100%). Выделили 0.264 г соединения 1с (24%).
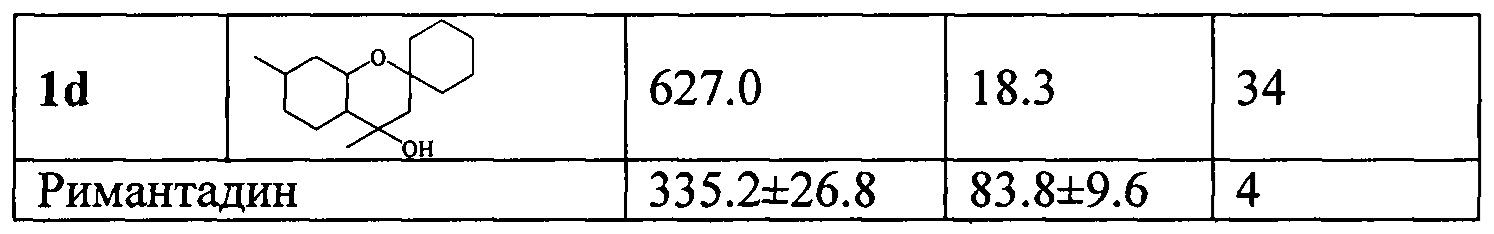
Пример 6. Синтез 4,7-диметилоктагидроспиро[хромен-2,1'-циклогексан]-4-ола 1d взаимодействием изопулегола 2 с циклогексаноном в присутствии монтмориллонита Н+-K10.
К суспензии 1.00 г монтмориллонита Н+-K10, прокаленного 1 час при 120°С, в 7 мл CH2Cl2 прибавили раствор 0.50 г изопулегола 2 в 3 мл CH2Cl2 и раствор 0.38 г циклогексанона в CH2Cl2. Растворитель отогнали, реакционную смесь выдерживали при комнатной температуре в течение 2 часов. Добавили по 10 мл этилацетата и ацетона. Катализатор отфильтровали, фильтрат упарили. Полученную реакционную смесь делили на колонке с 17 г силикагеля (60-200 μ, Macherey-Nagel) (элюент - гексан с градиентом этилацетата от 0 до 100%). Выделили 0.245 г соединения 1d (30%).
Соединение 1d: Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.83-0.92 м (1Н, Н8а), 0.90 д (3Н, J17,9 6.6 Гц, С17Н3), 0.94-1.03 м (1Н, Н7а), 1.01 д.д.д (1Н, J10a,10e=J10a,9a=12.2, J10a,1a 10.7 Гц, Н10а), 1.11 д.д.д (1Н, J6a,7a 12.2, J6a,1a 10.1, J6a,7e 3.2 Гц, H6a), 1.21 ушир.с (3Н, С16Н3), 1.42 ш.д (1Н, J4a,4e 13.3 Гц, H4a), 1.68 д.м (1Н, J8e,8a 13.0 Гц, H8e), 1.82 д (1H, J4e,4a 13.3 Гц, H4e), 1.83-1.91 м (3Н, Н7е, H10e, H11 или H15), 3.15 д.д.д (1Н, J1a,10a 10.7, J1a,6a 10.1, J1a,10e 4.4 Гц, H1a). Сигналы протонов циклогексанового фрагмента и H9a проявляются в областях 1.22-1.53 и 1.58-1.66 м.д.. Спектр ЯМР 13С (CDCl3), δ, м.д.: 69.79 д (С1), 72.63 с (С3), 51.91 т (С4), 70.40 с (С5), 52.50 д (С6), 22.91 т (С7), 34.37 т (С8), 31.40 д (С9), 41.90 т (С10), 31.84, 41.52 (2т, С11, С15), 21.84, 21.86 (2т, С12, С14), 25.88 т (С13), 24.37 к (С16), 22.11 к (С17). Найдено М 252.2083 C16H28O2. Вычислено М 252.2084.
Пример 7. Изучение цитотоксичности соединений 1a-d.
Токсичность продуктов была изучена в отношении клеток MDCK. Клетки MDCK сеяли в 96-луночные планшеты и культивировали при 37°С в среде MEM с добавлением 10% сыворотки крупного рогатого скота в атмосфере 5% CO2 (в газопроточном инкубаторе Sanyo-175) до состояния монослоя. Из исследуемых соединений 1a-d готовили маточный раствор концентрации 3 мг/мл в диметилсульфоксиде, после чего готовили серию трехкратных разведений препаратов в среде MEM от 300 до 3μg/ml. Растворенный препарат вносили в лунки планшетов и инкубировали 2 суток при 37°С. По истечении этого срока клетки промывали 2 раза по 5 минут фосфатно-солевым буфером, и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ). С этой целью в лунки планшетов добавляли по 100 мкл раствора (5 мг/мл) 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) на физиологическом растворе. Клетки инкубировали при 37°С в атмосфере 5% CO2 в течение 2 часов и промывали 5 минут фосфатно-солевым буфером. Осадок растворяли в 100 мкл на лунку ДМСО, после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (Perkin Elmer, Finland) при длине волны 535 нм. По результатам теста для каждого продукта определяли 50% цитотоксическую дозу (CTD50), т.е. концентрацию соединения, вызывающую гибель 50% клеток в культуре. Полученные результаты приведены в таблице.
Пример 8. Изучение противовирусной активности соединений 1a-d.
Определение противовирусной активности препаратов проводили на клетках MDCK в 96-луночных планшетах для клеточных культур. Соединения растворяли в поддерживающей среде для клеток, вносили в лунки панелей с клеточным монослоем и инкубировали в течение 1 часа при 36°С в атмосфере 5% CO2.
Из вируссодержащей жидкости (штамм A/Puerto Rico/8/34 (H1N1)) готовили серию десятикратных разведении от 10-1 до 10-7, добавляли в лунки с препаратами и инкубировали при 36°С в течение 48 часов в атмосфере 5% CO2. По окончании срока инкубации 100 мкл культуральной жидкости смешивали с равным объемом 1% куриных эритроцитов в отдельных планшетах с круглым дном. Учет результатов проводили через 60 минут инкубации при 20°С. За титр вируса принимали величину, обратную десятичному логарифму наибольшего разведения исходного вируса, способного вызвать положительную реакцию гемагглютинации в лунке и выражали в количестве 50% инфекционных доз (ED50). Вирусингибирующее действие исследуемых соединений оценивали по снижению титра вируса в опыте по сравнению с контролем. На основании полученных данных рассчитывали 50% ингибирующую дозу ED50, то есть, концентрацию препарата, снижающую уровень вирусной репродукции вдвое, и химиотерапевтический индекс, или индекс селективности (SI), представляющий собой отношение CTD50 к ED50. Полученные результаты приведены в таблице.
Литература
1. Influenza (Seasonal) Fact Sheet №211, World Health Organization, Geneva, 2014, http://www.who.int/mediacentre/factsheets/fs211/en/.
2. Fiore, A.E.; Fry, A.; Shay, D.; Gubareva, L.; Bresee, J.S.; Uyeki, T.M. Antiviral agents for the treatment and chemoprophylaxis of influenza. Recommendations and Reports, 2011, 60(1), 1-26.
3. S.M. Moghadas, C.S. Bowman, G. Rost, J. Wu, PLoS One, 3(3), e1839 (2008).
4. G. Baishya, Sarmah, N. Hazarika. Environmentally benign synthesis of octahydro-2H-chromen-4-ols via modified montmorillonite K10 catalyzed Prins cyclization reaction. SYNLETT 2013, 24, 1137-1141.
5. Kishore, K.R.; Reddy, K.; Silva, L.F., Jr. Iodine-catalyzed Prins cyclization of aliphatic and aromatic ketones. Brazilian Chemical Society (2013), 24(9), 1414-1419.