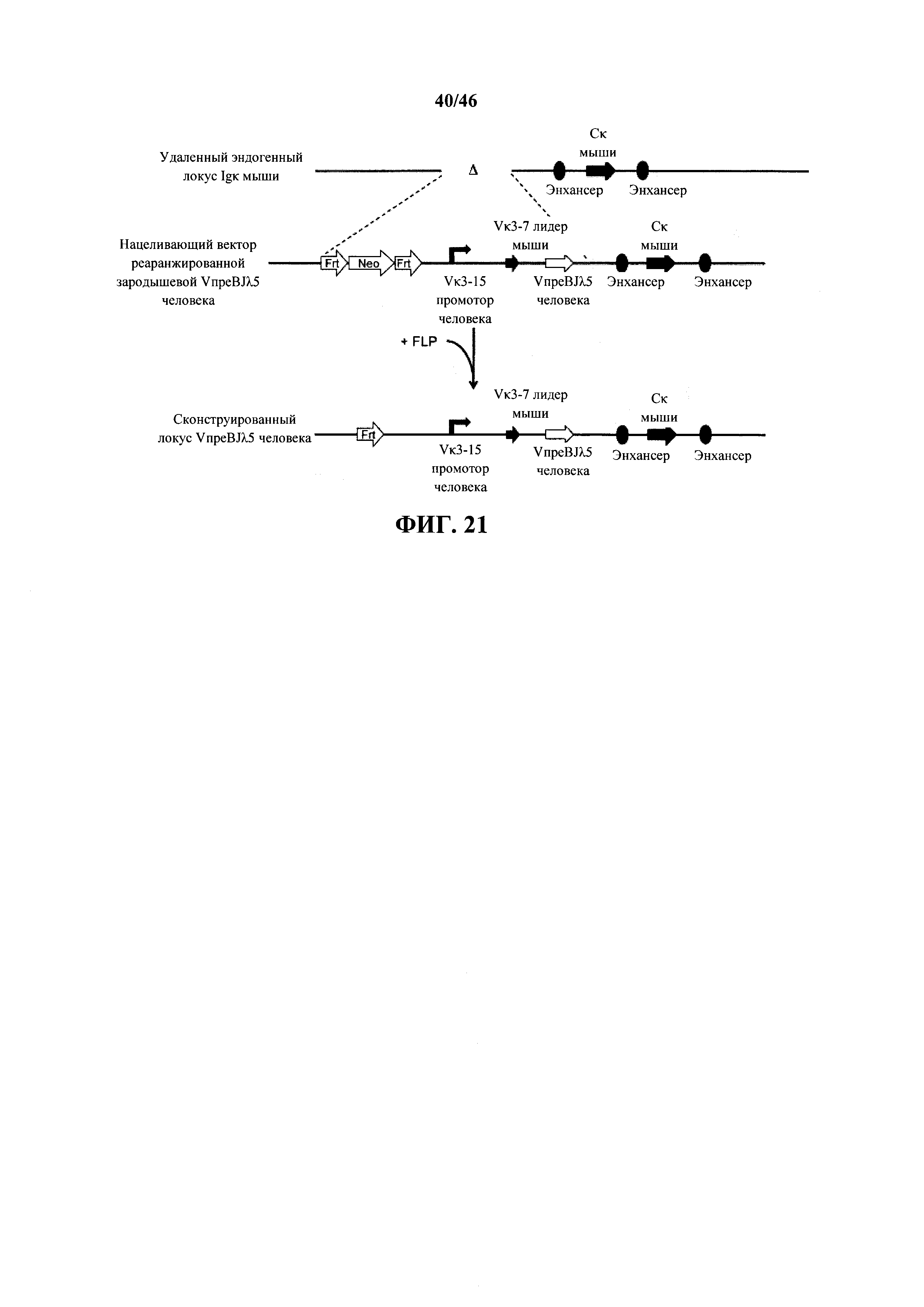
Результат интеллектуальной деятельности: МЫШИ С ГУМАНИЗИРОВАННОЙ УНИВЕРСАЛЬНОЙ ЛЕГКОЙ ЦЕПЬЮ
Вид РИД
Изобретение
Область техники, к которой относится настоящее изобретение
Генетически модифицированные мыши, клетки, эмбрионы, ткани и выделенные нуклеиновые кислоты для получения антител и последовательностей, кодирующих вариабельные домены тяжелой цепи иммуноглобулина человека, включая биспецифические антитела и включая биспецифические антитела, которые содержат универсальные легкие цепи. Композиции и способы включают генетически модифицированных мышей с зародышевыми замещениями на эндогенном вариабельном локусе тяжелой цепи мыши, которые содержат модифицированные локусы легкой цепи, которые экспрессируют легкие цепи, происходящие не более чем из одного или двух различных генных сегментов V легкой цепи, причем мыши дополнительно генетически модифицированы в их зародышевой линии так, чтобы несущие эти модификации самцы мышей являлись фертильными. Предусматриваются генетически модифицированные мыши, которые экспрессируют универсальные легкие цепи и гуманизированные вариабельные домены тяжелой цепи, причем мыши содержат активность ADAM6, который является функциональным у самца мыши.
Предшествующий уровень техники настоящего изобретения
Разработка антител для применения в качестве терапевтических средств для людей имеет длинную и сложную историю. Значительным успехом стала способность создавать по существу полные последовательности антитела человека для применения в разработке эффективных терапевтических средств для людей со сниженным потенциалом в отношении иммуногенности. В настоящее время существуют мыши, модифицированные в их зародышевой линии для создания последовательностей антитела человека, происходящих из переаранжированных генных сегментов (тяжелых и легких) или в виде трансгенов, или в виде замещений на эндогенных локусах иммуноглобулина мыши. Замещение вариабельных последовательностей мыши вариабельными последовательностями человека на эндогенных локусах у мышей, как в случае гуманизированных мышей VELOCIMMUNE®, позволяет иммунной системе мыши функционировать, по существу, нормально. В результате этого, воздействие на таких мышей определенным антигеном создает удивительно разнообразную, богатую популяцию клонально-селективных В-клеток, которые экспрессируют соматически мутированные вариабельные домены человека с высокой аффинностью, которые могут использоваться в создании полностью человеческих антител, направленных против определенного антигена.
Вариабельные домены человека, произведенные у гуманизированных мышей, могут быть использованы для разработки полностью человеческих биспецифических антител, т.е., связывающих белков, которые являются гетеродимерами тяжелых цепей, где идентичности и специфичности связывания вариабельных доменов тяжелой цепи являются различными. Однако решение о выборе легких цепей, которые могут эффективно связываться и экспрессироваться с гетеродимерами тяжелой цепи, не является легким. Разработка вариабельных доменов легкой цепи человека для применения в терапевтических средствах для людей безусловно возможна в гуманизированных мышах, но в этом случае отсутствуют простые решения в отношении выбора того, какие легкие цепи будут эффективно связываться и экспрессироваться с тяжелыми цепями, характеризующимися необходимыми характеристиками связывания, где легкие цепи не являются неблагоприятными в отношении экспрессии или характера связывания обеих тяжелых цепей.
Таким образом, в настоящей области техники сохраняется необходимость в композициях и способах разработки вариабельных областей иммуноглобулина человека для применения в терапевтических средствах для людей, предусматривающих вариабельные области иммуноглобулина человека, образованные из последовательностей нуклеиновых кислот на эндогенных локусах иммуноглобулина мыши.
Краткое раскрытие настоящего изобретения
Описаны мыши, которые экспрессируют вариабельные домены иммуноглобулина человека, являющиеся подходящими для применения в биспецифических связывающих белках, включающих биспецифические антитела, причем мыши содержат гуманизированный эндогенный вариабельный локус тяжелой цепи мыши, причем содержащие гуманизированный локус самцы мышей являются фертильными, и при этом мыши дополнительно содержат гуманизированный эндогенный локус легкой цепи иммуноглобулина, который дает в результате мышь, экспрессирующую репертуар легкой цепи иммуноглобулина, который происходит не более чем из одного или не более чем из двух, Х и/или к генных сегментов V.
Предлагаются подвергнутые генной инженерии мыши, которые выбирают подходящие вариабельные домены тяжелой цепи иммуноглобулина человека созревшей аффинности, происходящие из репертуара переаранжированных сегментов V, D, и J тяжелой цепи человека, причем вариабельные домены тяжелой цепи человека созревшей аффинности связываются и экспрессируются с гуманизированной универсальной легкой цепью. Гуманизированная универсальная легкая цепь экспрессируется из локуса, который содержит либо не более чем один, либо не более чем два сегмента V легкой цепи человека и сегмент J легкой цепи человека, функционально связанный с геном константной области легкой цепи, или не более чем с одной или не более чем с двумя реаранжированными (Vλ/Jλ, Vκ/jκ, Vλ/Jκ или Vλ/Jκ) последовательностями нуклеиновых кислот человека, кодирующими вариабельный домен легкой цепи, функционально связанный с геном константной области легкой цепи. Согласно различным вариантам осуществления универсальный гуманизированный домен легкой цепи образует пару с многочисленными вариабельными доменами тяжелой цепи человека созревшей аффинности, причем многочисленные вариабельные домены тяжелой цепи специфически связывают различные эпитопы или антигены.
Согласно одному аспекту предусматриваются конструкции нуклеиновых кислот, клетки, эмбрионы, мыши и способы получения мышей, которые содержат гуманизированный вариабельный локус тяжелой цепи иммуноглобулина и гуманизированный вариабельный локус легкой цепи иммуноглобулина, причем мышь экспрессирует одну из не более чем двух универсальных легких цепей, и самцы мышей проявляют характерную для мышей дикого типа фертильность.
Согласно одному аспекту предусматривается модифицированная мышь, которая содержит в ее зародышевой линии гуманизированный вариабельный локус тяжелой цепи иммуноглобулина на эндогенном локусе тяжелой цепи мыши и гуманизированный вариабельный локус легкой цепи иммуноглобулина, причем мышь экспрессирует универсальную легкую цепь, и при этом мышь содержит последовательность нуклеиновой кислоты, кодирующую ADAM6 мыши или его ортолог или гомолог или функциональный фрагмент. Согласно различным вариантам осуществления гуманизированный вариабельный локус легкой цепи иммуноглобулина находится на эндогенном локусе легкой цепи мыши.
Согласно одному варианту осуществления гуманизированный вариабельный локус тяжелой цепи иммуноглобулина содержит замещение на эндогенном вариабельном локусе тяжелой цепи мыши всех или, по сути, всех функциональных генных сегментов V, D, и J тяжелой цепи иммуноглобулина мыши одним или несколькими генными сегментами V человека, сегментами D человека и сегментами J человека, причем один или несколько сегментов V, D и J человека функционально связаны и способны к реаранжировке для образования реаранжированного гена V/D/J, который функционально связан с последовательностью константной области тяжелой цепи.
Согласно одному варианту осуществления мышь содержит локус легкой цепи, который конструируют для получения универсальной легкой цепи, причем универсальная легкая цепь представляет собой легкую цепь, которая происходит из локуса легкой цепи, который содержит не более чем один сегмент V легкой цепи и не более чем один сегмент J легкой цепи, или локуса легкой цепи, который содержит единственную реаранжированную последовательность V/J легкой цепи. Согласно одному варианту осуществления мышь содержит локус легкой цепи иммуноглобулина, который содержит единственный сегмент V легкой цепи иммуноглобулина человека, который способен к реаранжировке с генным сегментом J легкой цепи человека (выбранным из одного или множества сегментов J) и кодированию вариабельного домена легкой цепи человека. Согласно другому варианту осуществления мышь содержит не более чем два сегмента V легкой цепи человека на локусе легкой цепи, каждый сегмент V которого способен к реаранжировке с генным сегментом J человека (выбранным из одного или множества сегментов J легкой цепи) и кодированию реаранжированного вариабельного домена легкой цепи человека.
Согласно одному варианту осуществления единственный сегмент V легкой цепи человека функционально связан с сегментом J легкой цепи человека, выбранным из Jκ1, Jκ2, Jκ3, Jκ4, и Jκ5, причем единственный сегмент V легкой цепи человека способен к реаранжировке для образования последовательности, кодирующей ген вариабельной области легкой цепи с любым из одного или нескольких сегментов J легкой цепи человека.
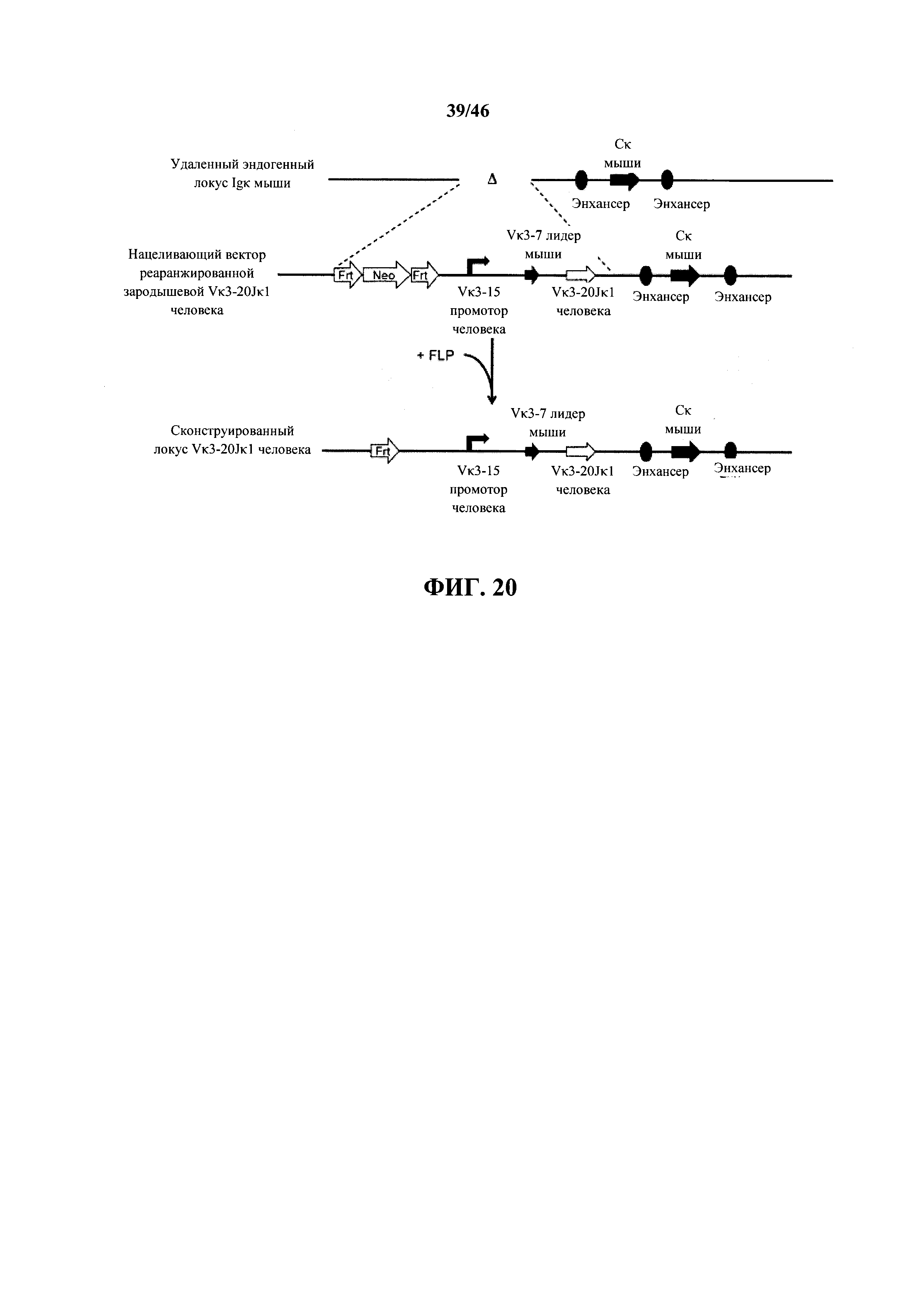
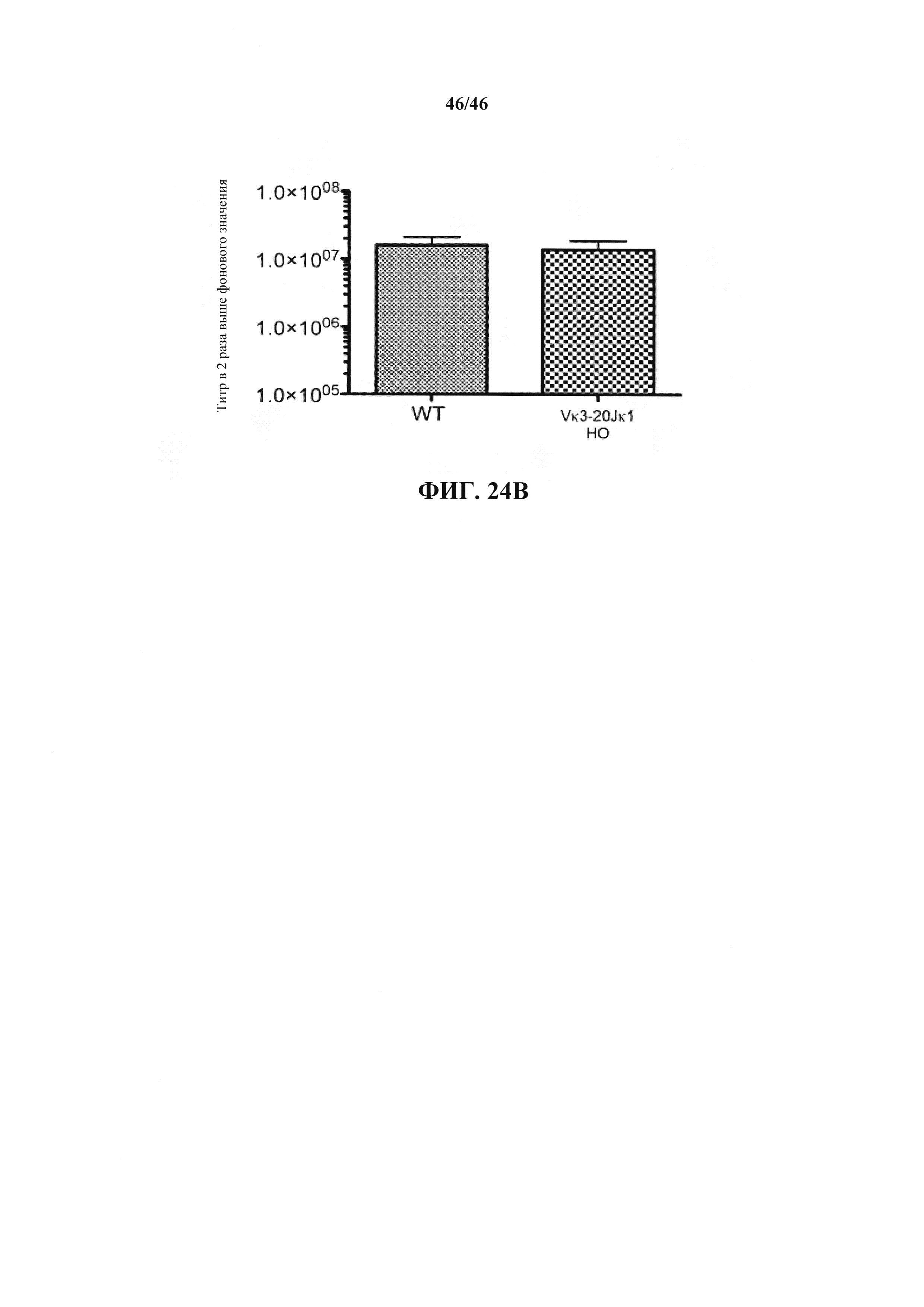
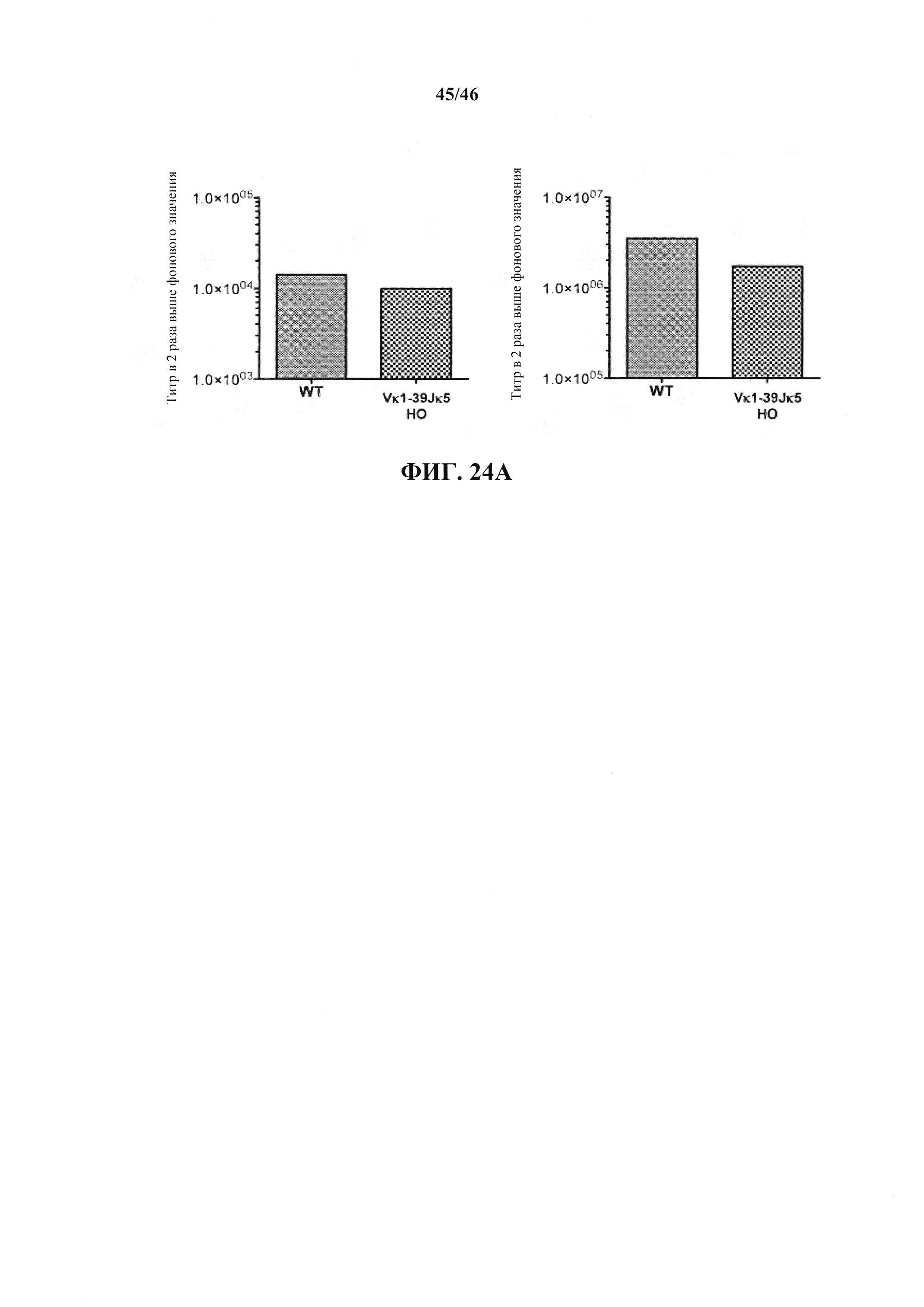
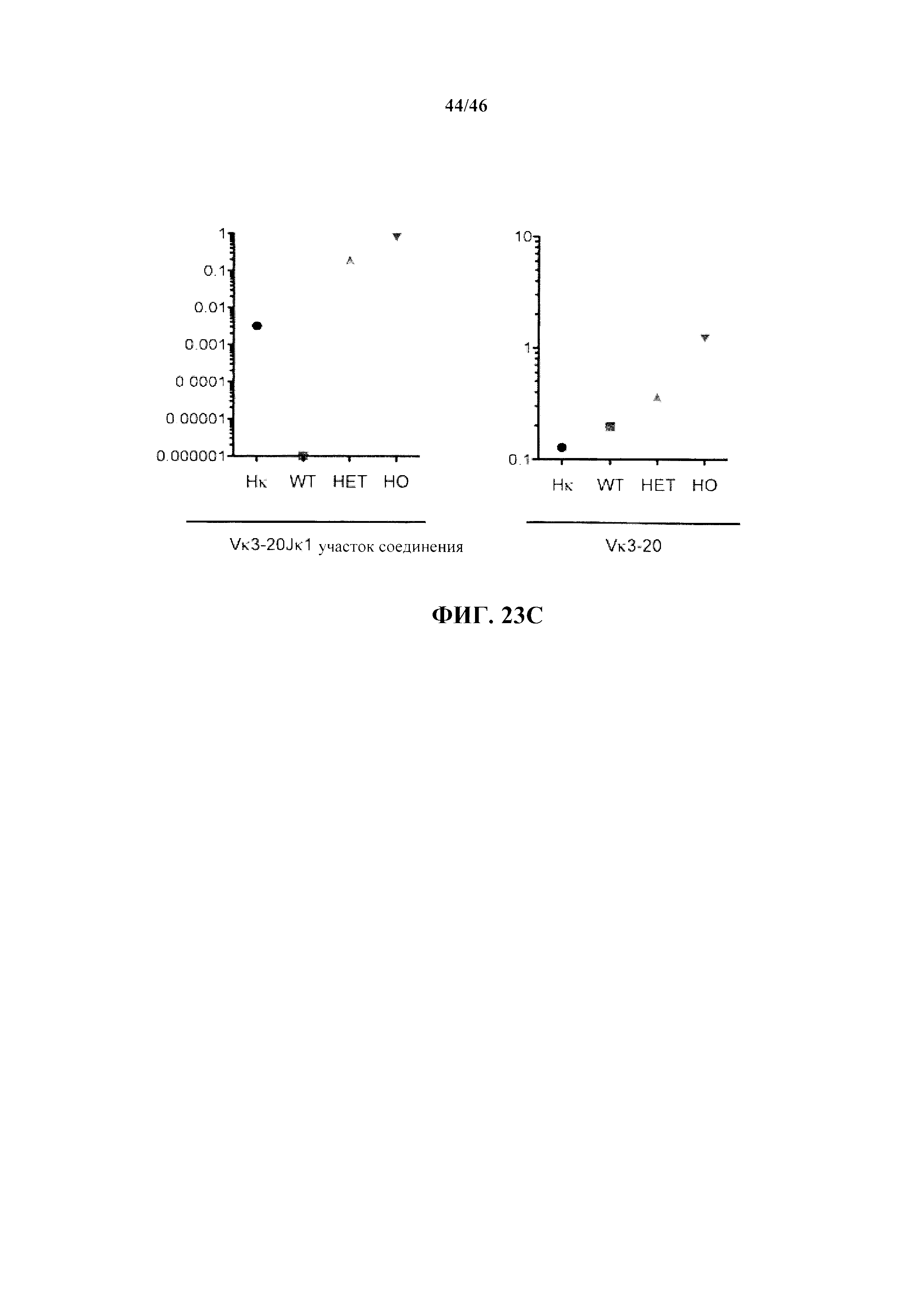
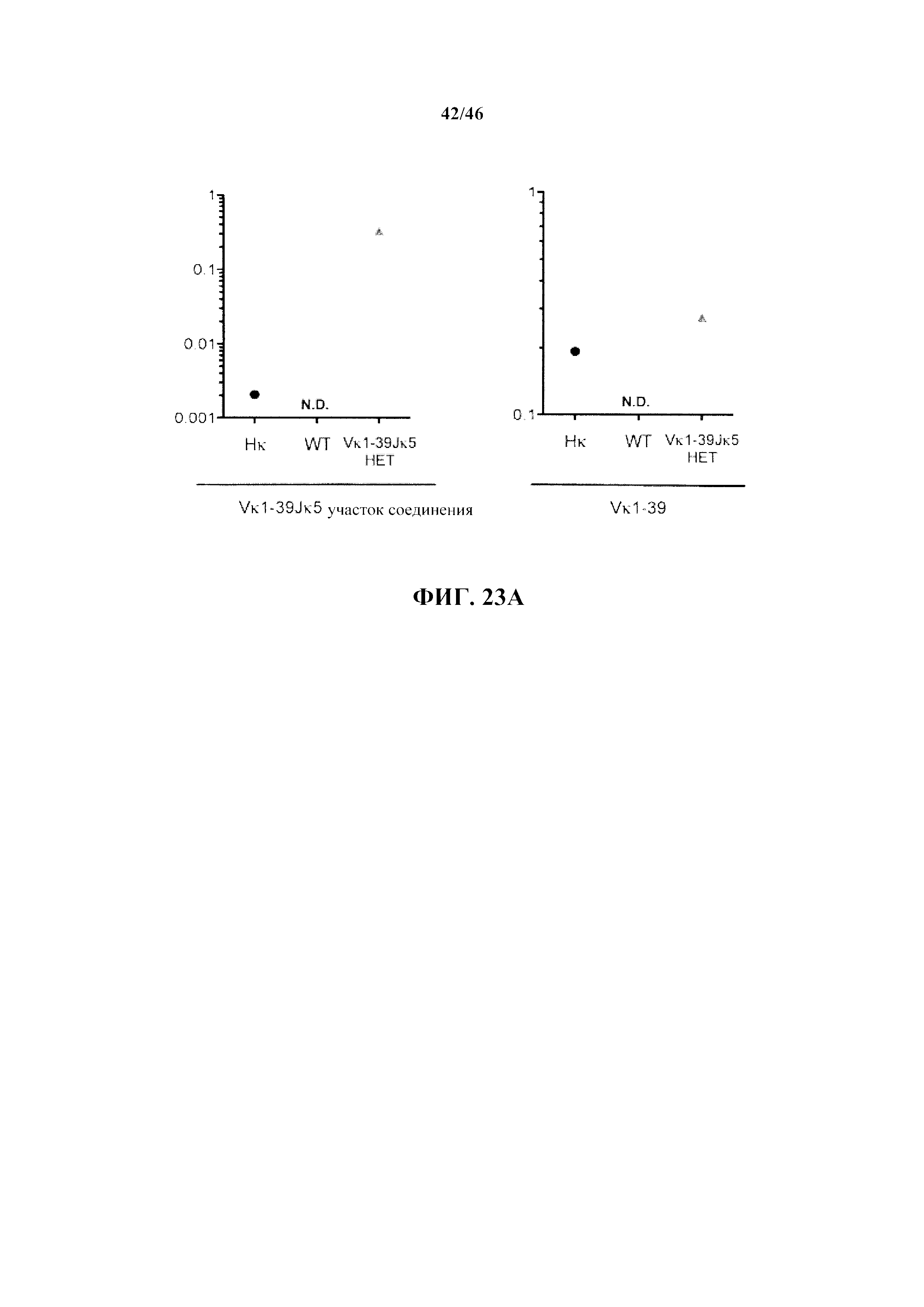
Согласно одному варианту осуществления мышь содержит эндогенный локус легкой цепи, который содержит замещение всех или, по сути, всех генных сегментов V и J мыши не более чем одной или не более чем двумя реаранжированными (V/J) последовательностями нуклеиновых кислот.Согласно одному варианту осуществления не более чем одна или не более чем две реаранжированных (V/J) последовательности нуклеиновых кислот выбраны из Vκ1-39Jκ5, Vκ3-20Jκ1 человека и их комбинации.
Согласно одному варианту осуществления мышь не содержит функциональный эндогенный локус легкой цепи, который способен к экспрессии вариабельного домена легкой цепи мыши. Согласно одному варианту осуществления мышь содержит последовательность нуклеиновой кислоты, кодирующую вариабельный домен универсальной легкой цепи на локусе κ. Согласно одному варианту осуществления мышь содержит последовательность нуклеиновой кислоты, кодирующую вариабельные домен универсальной легкой цепи на локусе λ.
Согласно одному варианту осуществления сегмент V человека (или реаранжированная V/J последовательность) функционально связан с лидерной последовательностью человека или мыши. Согласно одному варианту осуществления лидерная последовательность представляет собой лидерную последовательность мыши. Согласно конкретному варианту осуществления лидерная последовательность мыши представляет собой лидерную последовательность Vκ3-7 мыши.
Согласно одному варианту осуществления сегмент V человека (или реаранжированная V/J последовательность) функционально связан с промоторной последовательностью иммуноглобулина. Согласно одному варианту осуществления промоторная последовательность представляет собой промоторную последовательность человека. Согласно конкретному варианту осуществления промотор иммуноглобулина человека представляет собой промотор Vκ3-15 человека.
Согласно одному варианту осуществления переаранжированные сегменты V и J или реаранжированная (V/J) последовательность функционально связана с геном константной области легкой цепи иммуноглобулина. Согласно конкретному варианту осуществления ген константной области представляет собой Сκ ген мыши.
Согласно одному варианту осуществления переаранжированные сегменты V и J или реаранжированная (V/J) последовательность присутствуют на локусе к легкой цепи, и локус κ легкой цепи содержит κ интронный энхансер мыши, κ 3' энхансер мыши или как интронный энхансер, так и 3' энхансер. Согласно конкретному варианту осуществления к локус представляет собой эндогенный локус κ.
Согласно одному варианту осуществления мышь содержит локус κ, содержащий последовательность, кодирующую вариабельный домен универсальной легкой цепи, и мышь содержит нефункциональный локус лямбда (λ) легкой цепи иммуноглобулина. Согласно конкретному варианту осуществления локус λ легкой цепи содержит делецию одного или нескольких последовательностей локуса, причем одна или несколько делеций делает локус λ легкой цепи неспособным к реаранжировке для образования гена легкой цепи. Согласно другому варианту осуществления все или, по сути, все сегменты V локуса λ. легкой цепи подвергаются делеций. Согласно другому варианту осуществления мышь содержит делецию всего или, по сути, всего эндогенного вариабельного локуса легкой цепи.
Согласно одному варианту осуществления мышь дополнительно содержит в ее зародышевой линии последовательность, выбранную из к интро иного энхансера мыши 5' по отношению к реаранжированной последовательности легкой цепи иммуноглобулина или переаранжированным генным сегментам, к 3' энхансер мыши и их комбинацию.
Согласно одному варианту осуществления последовательность вариабельного домена универсальной легкой цепи мыши содержит одну или несколько соматических гипермутаций; согласно одному варианту осуществления последовательность вариабельного домена содержит многочисленные соматические гипермутации.
Согласно одному варианту осуществления мышь производит универсальную легкую цепь, которая содержит соматически мутированный вариабельный домен человека. Согласно одному варианту осуществления легкая цепь содержит соматически мутированный вариабельный домен человека, происходящий из сегмента V человека, сегмента J человека и Ск гена мыши. Согласно одному варианту осуществления мышь не экспрессирует Х легкую цепь.
Согласно одному варианту осуществления вариабельная последовательность человека представляет собой реаранжированную последовательность Vκ1-391κ5 человека, и мышь экспрессирует обратную химерную легкую цепь, содержащую (i) вариабельный домен, происходящий из Vκ1-39Jκ5 и (ii) CL мыши; причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (i) CH мыши и (ii) соматически мутированный вариабельные домен тяжелой цепи человека. Согласно одному варианту осуществления мышь экспрессирует легкую цепь, которая является соматически мутированной. Согласно одному варианту осуществления CL представляет собой Сκ мыши.
Согласно одному варианту осуществления вариабельная последовательность человека представляет собой реаранжированную последовательность Vκ3-20Jκ1 человека, и мышь экспрессирует обратную химерную легкую цепь, содержащую (i) вариабельный домен, происходящий из Vκ3-20Jκ1, и (ii) CL мыши; причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (i) CH мыши и (И) соматически мутированный вариабельный домен тяжелой цепи человека.
Согласно одному варианту осуществления мышь содержит как реаранжированную последовательность Vκ1-391κ5 человека, так и реаранжированную последовательность Vκ3-20Jκ1 человека, и мышь экспресс ирует обратную химерную легкую цепь, содержащую (i) легкую цепь, содержащую вариабельные домен, происходящий из последовательности Vκ1-39Jκ5 или последовательности Vκ3-201κ1, и (ii) CL мыши; причем легкая цепь связана с обратной химерной тяжелой цепью, содержащей (i) CH мыши и (ii) соматически мутированный вариабельный домен тяжелой цепи человека. Согласно одному варианту осуществления мышь экспрессирует легкую цепь, которая является соматически мутированной. Согласно одному варианту осуществления CL представляет собой Сκ мыши.
Согласно одному варианту осуществления мышь экспрессирует обратное химерное антитело, содержащее легкую цепь, которая содержит Сκ мыши и соматически мутированный вариабельный домен человека, происходящий из реаранжированной последовательности Vκ1-39Jκ5 человека или реаранжированной последовательности Vκ3-20Jκ1 человека, и тяжелую цепь, которая содержит CH мыши и соматически мутированный вариабельный домен тяжелой цепи человека, причем мышь не экспрессирует полностью мышиное антитело и не экспрессирует полностью человеческое антитело. Согласно одному варианту осуществления мышь содержит локус к легкой цепи, который содержит замещение эндогенных генных сегментов мыши к легкой цепи реаранжированной последовательностью Vκ1-39Jκ5 человека или реаранжированной последовательностью Vκ3-201κ1 человека, и содержит замещение всех или, по сути, всех эндогенных генных сегментов V, D и J тяжелой цепи мыши полным или, по сути, полным репертуаром генных сегментов V, D и J тяжелой цепи человека.
Согласно одному аспекту генетически предусмотрена модифицированная мышь, которая экспрессирует единственную к легкую цепь, происходящую не более чем из одной или не более чем из двух реаранжированных последовательностей к легкой цепи, причем мышь при иммунизации антигеном проявляет титр в сыворотке, который сопоставим с таковым у мыши дикого типа, иммунизированной таким же антигеном. Согласно конкретному варианту осуществления мышь экспрессирует единственную последовательность к легкой цепи, причем единственная последовательность к легкой цепи происходит не более чем из одной реаранжированной последовательности к легкой цепи.
Согласно одному варианту осуществления титр в сыворотке характеризуется как общий иммуноглобулин. Согласно конкретному варианту осуществления титр в сыворотке характеризуется как специфический титр IgM. Согласно конкретному варианту осуществления титр в сыворотке характеризуется как специфический титр IgG. Согласно более конкретному варианту осуществления реаранжированная последовательность к легкой цепи выбрана из последовательности Vκ1-39Jκ5 и Vκ3-20Jκ1. Согласно одному варианту осуществления реаранжированная последовательность к легкой цепи представляет собой последовательность Vκ1-39Jκ5. Согласно одному варианту осуществления реаранжированная последовательность к легкой цепи представляет собой последовательность Vκ3-20Jκ1.
Согласно одному аспекту предусматривается генетически модифицированная мышь, которая экспрессирует множество тяжелых цепей иммуноглобулина, связанных с единственной последовательностью легкой цепи. Согласно одному варианту осуществления тяжелая цепь содержит последовательность человека. Согласно различным вариантам осуществления последовательность человека выбрана из вариабельной последовательности, СН1, шарнира, СН2, СН3 и их комбинации. Согласно одному варианту осуществления единственная легкая цепь содержит последовательность человека. Согласно различным вариантам осуществления последовательность человека выбрана из последовательности вариабельной области, последовательности константной области и их комбинации. Согласно одному варианту осуществления мышь содержит недееспособный эндогенный локус иммуноглобулина и экспрессирует тяжелую цепь и/или легкую цепь из трансгена или внехромосомной эписомы. Согласно одному варианту осуществления мышь содержит замещение на эндогенном мышином локусе некоторых или всех эндогенных генных сегментов тяжелой цепи мыши (т.е., V, D, J), и/или некоторых или всех эндогенных последовательностей константной области тяжелой цепи мыши (например, CH1, шарнира, СН2, СН3 или их комбинации), и/или некоторых или всех эндогенных последовательностей легкой цепи мыши (например, V, J, последовательности константной области или их комбинации) одной или несколькими последовательностями иммуноглобулина человека.
Согласно одному варианту осуществления мышь после реаранжировки одного или нескольких генных сегментов V, D и J, или одного или нескольких генных сегментов V и J, мышь содержит в своем геноме по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую ген ADAM6 мыши или его гомолог или ортолог или функциональный фрагмент.Согласно одному варианту осуществления после реаранжировки мышь содержит в своем геноме по меньшей мере две последовательности нуклеиновых кислот, кодирующие ген ADAM6 мыши или его гомолог или ортолог или функциональный фрагмент. Согласно одному варианту осуществления после реаранжировки мышь содержит в своем геноме по меньшей мере одну последовательность нуклеиновой кислоты, кодирующую ген ADAM6 мыши или его гомолог или ортолог или функциональный фрагмент. Согласно одному варианту осуществления мышь содержит ген ADAM6 или его гомолог или ортолог или функциональный фрагмент в В-клетке.
Согласно одному варианту осуществления самцы мышей содержат единственный немодифицированный эндогенный аллель ADAM6 или его ортолог или гомолог или функциональный фрагмент на эндогенном локусе ADAM6.
Согласно одному варианту осуществления самцы мышей содержат последовательность ADAM6 или ее гомолог или ортолог или функциональный фрагмент в положении в геноме мыши, которое приблизительно соответствует положению эндогенного аллеля ADAM6 мыши, например, 3' по отношению к последовательности последнего генного сегмента V и 5' по отношению к первому генному сегменту D.
Согласно одному варианту осуществления самцы мышей содержат последовательность ADAM6 или ее гомолог или ортолог или функциональный фрагмент, фланкированный выше, ниже или выше и ниже (относительно направления транскрипции последовательности ADAM6) последовательности нуклеиновой кислоты, кодирующей генный сегмент вариабельной области иммуноглобулина. Согласно конкретному варианту осуществления генный сегмент вариабельной области иммуноглобулина представляет собой генный сегмент человека. Согласно одному варианту осуществления генный сегмент вариабельной области иммуноглобулина представляет собой генный сегмент человека, и последовательность, кодирующая ADAM6 мыши или его ортолог или гомолог или фрагмент, функциональный у мыши, находится между генными сегментами V человека; согласно одному варианту осуществления мышь содержит два или более генных сегментов V человека, и последовательность находится в положении между последним генным сегментом V и предпоследним генным сегментом V; согласно одному варианту осуществления последовательность находится в положении после последнего генного сегмента V и первого генного сегмента D.
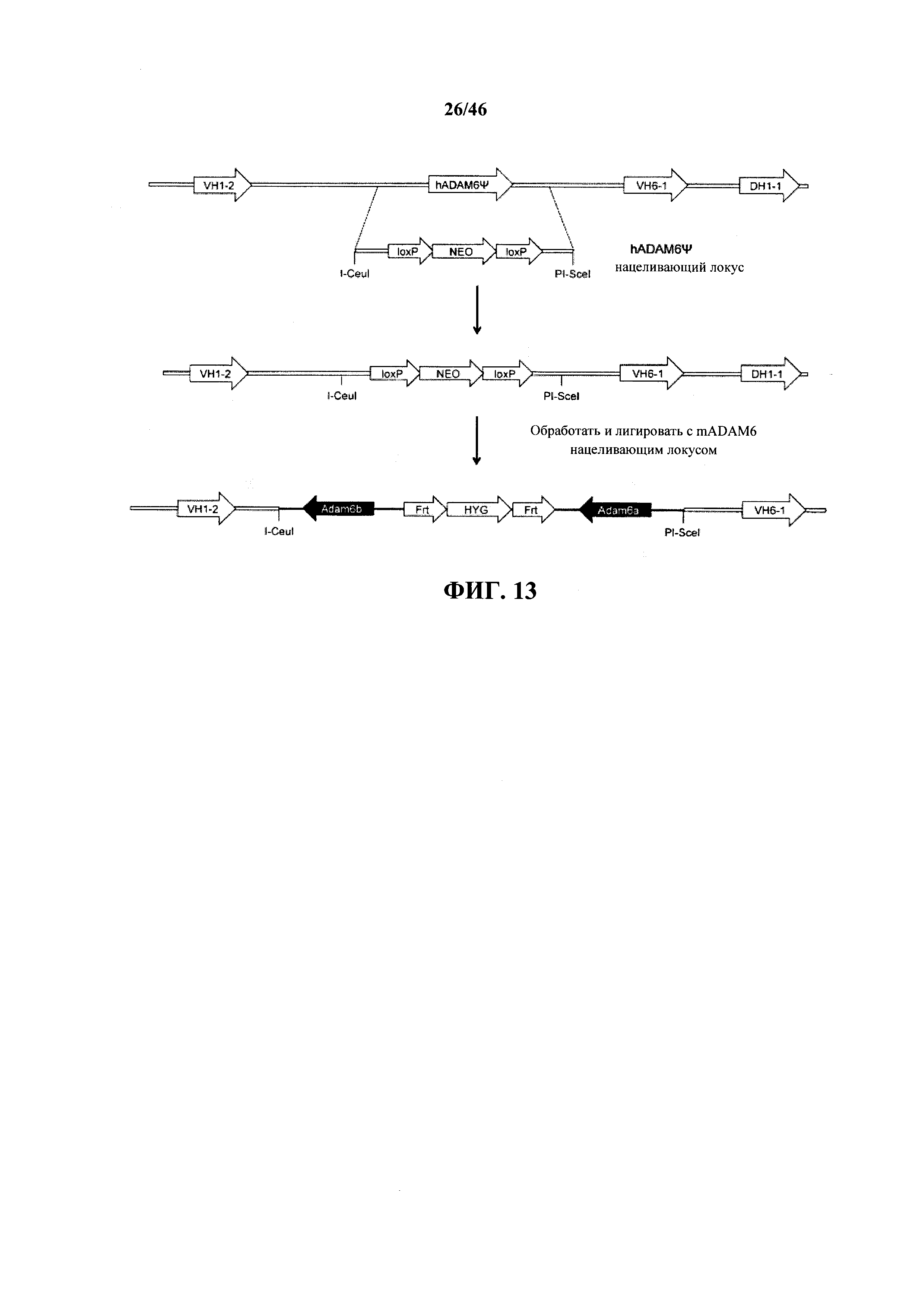
Согласно одному варианту осуществления гуманизированный вариабельный локус тяжелой цепи иммуноглобулина не содержит эндогенный мышиный ген ADAM6. Согласно одному варианту осуществления гуманизированный вариабельный локус тяжелой цепи иммуноглобулина содержит ген ADAM6, который является функциональным у самца мыши. Согласно конкретному варианту осуществления ген ADAM6, являющийся функциональным у самца мыши, представляет собой ген ADAM6 мыши, и ген ADAM6 мыши расположен в пределах или непосредственно прилегает к гуманизированному вариабельному локусу тяжелой цепи иммуноглобулина.
Согласно одному варианту осуществления гуманизированный вариабельный локус тяжелой цепи иммуноглобулина не содержит эндогенный ген ADAM6 мыши, и мышь содержит эктопическую последовательность ADAM6, которая является функциональной у самца мыши. Согласно одному варианту осуществления эктопический ген ADAM6, который является функциональным у самца мыши, представляет собой ген ADAM6 мыши. Согласно одному варианту осуществления ген ADAM6 мыши находится на той же хромосоме, что и гуманизированный вариабельный локус тяжелой цепи иммуноглобулина. Согласно одному варианту осуществления ген ADAM6 мыши находится на другой хромосоме, чем гуманизированный вариабельный локус тяжелой цепи иммуноглобулина. Согласно одному варианту осуществления ген ADAM6 мыши находится на эписоме.
Согласно одному варианту осуществления мышь содержит первый эндогенный аллель тяжелой цепи и второй эндогенный аллель тяжелой цепи, и первый эндогенный аллель тяжелой цепи содержит делецию локуса ADAM6 мыши, и первый эндогенный аллель тяжелой цепи содержит замещение всех или, по сути, всех функциональных сегментов V, D и J мыши одним или несколькими сегментами V, D и J человека. Согласно одному варианту осуществления каждый из первого и второго эндогенных аллелей тяжелой цепи содержат делецию эндогенного локуса ADAM6 мыши, и первый и второй эндогенные аллели тяжелой цепи содержат замещение всех или, по сути, всех функциональных сегментов V, D и J мыши одним или несколькими сегментами V, D и J человека. Согласно одному варианту осуществления первый и/или второй аллель содержит эктопическую последовательность нуклеиновой кислоты, которая кодирует ADAM6 мыши или его ортолог или гомолог или функциональный фрагмент. Согласно одному варианту осуществления эктопическая последовательность нуклеиновой кислоты расположена 3' (по отношению к транскрипционной направленности вариабельного локуса тяжелой цепи) относительно последнего генного сегмента V мыши и расположена 5' (по отношению к транскрипционной направленности последовательности константной области) относительно мышиного (или химерного человеческого/мышиного) гена константной области тяжелой цепи или его фрагмента (например, последовательность нуклеиновой кислоты, кодирующая человеческий и/или мышиный: CH1 и/или шарнир и/или CH2 и/или CH3). Согласно одному варианту осуществления эктопическая последовательность нуклеиновой кислоты расположена ниже (относительно направления транскрипции локуса сегмента V) сегмента V и выше сегмента D. Согласно одному варианту осуществления эктопическая последовательность нуклеиновой кислоты расположена между предпоследним наиболее 3' сегментом V и последним наиболее 3' сегментом V. Согласно конкретному варианту осуществления эктопическая последовательность нуклеиновой кислоты расположена между V сегментом VH1-2 человека и V сегментом VH6-1 человека. Согласно одному варианту осуществления нуклеотидная последовательность между двумя генными сегментами V человека расположена в противоположной ориентации транскрипции по отношению к генным сегментам V человека. Согласно конкретному варианту осуществления нуклеотидная последовательность кодирует, от 5' к 3' относительно направления транскрипции генов ADAM6, и за последовательностью ADAM6a следует последовательность ADAM6b. Согласно конкретному варианту осуществления ген(ы) ADAM6 ориентирован(ы) в противоположной ориентации транскрипции по сравнению с вышележащими и нижележащими фланкирующими сегментами V.
Согласно одному варианту осуществления последовательность нуклеиновой кислоты содержит последовательность, кодирующую ADAM6a мыши или его функциональный фрагмент, и/или последовательность, кодирующую ADAM6b мыши или его функциональный фрагмент, причем ADAM6a и/или ADAM6b или их функциональный(е) фрагмент(ы) функционально связан(ы) с промотором. Согласно одному варианту осуществления промотор представляет собой промотор человека. Согласно одному варианту осуществления промотор представляет собой промотор ADAM6 мыши. Согласно конкретному варианту осуществления промотор ADAM6 содержит последовательность, расположенную между первым кодоном первого гена ADAM6, ближайшего к наиболее 5' генному сегменту DH мыши и сигнальной последовательностью рекомбинации наиболее 5' генного сегмента DH, причем 5' обозначается относительно направления транскрипции генов иммуноглобулина мыши. Согласно одному варианту осуществления промотор представляет собой вирусный промотор. Согласно конкретному варианту осуществления вирусный промотор представляет собой промотор цитомегаловируса (CMV). Согласно одному варианту осуществления промотор представляет собой промотор убиквитина.
Согласно одному варианту осуществления ADAM6a и/или ADAM6b мыши выбраны из ADAM6a SEQ ID NO:1 и/или ADAM6b последовательности SEQ ID NO:2. Согласно одному варианту осуществления промотор ADAM6 мыши представляет собой промотор SEQ ID NO:3. Согласно конкретному варианту осуществления промотор ADAM6 мыши содержит последовательность нуклеиновой кислоты SEQ ID NO:3 непосредственно перед (относительно направления транскрипции ADAM6a) первым кодоном ADAM6a и продолжающуюся до конца SEQ ID NO:3 выше кодирующей области ADAM6. Согласно другому конкретному варианту осуществления промотор ADAM6 представляет собой фрагмент, простирающийся от в пределах приблизительно 5 - приблизительно 20 нуклеотидов выше стартового кодона ADAM6a до приблизительно 0,5 т.п.о., 1 т.п.о., 2 т.п.о. или 3 т.п.о. или более выше стартового кодона ADAM6a.
Согласно одному варианту осуществления последовательность нуклеиновой кислоты содержит SEQ ID NO:3 или ее фрагмент, который, будучи помещен в мышь, которая является нефертильной или которая характеризуется низкой фертильностью вследствие отсутствия ADAM6, улучшает фертильность или восстанавливает фертильность приблизительно до фертильности дикого типа. Согласно одному варианту осуществления SEQ ID NO:3 или ее фрагмент предоставляет самцу мыши способность производить сперматозоид, способный пройти яйцевод самки мыши для того, чтобы оплодотворить яйцеклетку мыши.
Согласно одному варианту осуществления мыши содержат последовательность нуклеиновой кислоты, которая кодирует белок ADAM6 или его ортолог или гомолог или фрагмент, являющийся функциональным у самца мыши. Согласно конкретному варианту осуществления последовательность нуклеиновой кислоты находится в пределах или прилегает к последовательности нуклеиновой кислоты человека, которая содержит один или несколько генных сегментов вариабельной области иммуноглобулина. Согласно одному варианту осуществления один или несколько генных сегментов вариабельной области иммуноглобулина находятся на модифицированном эндогенном вариабельном локусе тяжелой цепи иммуноглобулина мыши. Согласно одному варианту осуществления модификация содержит замещение всех или, по сути, всех функциональных вариабельных генных сегментов тяжелой цепи иммуноглобулина мыши множеством переаранжированных генных сегментов тяжелой цепи человека, которые являются функционально связанными с эндогенным геном константной области мыши. Согласно конкретному варианту осуществления последовательность нуклеиновой кислоты находится между двумя сегментами V человека. Согласно конкретному варианту осуществления последовательность нуклеиновой кислоты находится между сегментом V человека и сегментом D человека. Согласно конкретному варианту осуществления последовательность нуклеиновой кислоты находится между сегментом D человека и сегментом J человека. Согласно конкретному варианту осуществления последовательность нуклеиновой кислоты находится выше расположенного наиболее 5' (относительно направления транскрипции V сегмента) сегмента V человека. Согласно конкретному варианту осуществления последовательность нуклеиновой кислоты находится между сегментом J человека и эндогенной мыши генной последовательностью константной области тяжелой цепи.
Согласно одному варианту осуществления самцы мышей способны к созданию потомства путем спаривания, с частотой, которая является приблизительно такой же, как и у мыши дикого типа. Согласно одному варианту осуществления самцы мышей производят сперматозоиды, которые могут проходить от матки мыши через мышиный яйцевод для оплодотворения яйцеклетки мыши; согласно конкретному варианту осуществления сперматозоиды мышей проходят через яйцевод приблизительно настолько же результативно, как и сперматозоиды мыши дикого типа. Согласно одному варианту осуществления приблизительно 50% или более сперматозоидов, произведенных мышью, проявляют способность поступать в яйцевод и/или проходить его для оплодотворения яйцеклетки мыши.
Согласно одному варианту осуществления у мыши отсутствует функциональный эндогенный локус ADAM6, причем мышь содержит эктопическую нуклеотидную последовательность, которая дополняет потерю функции ADAM6 мыши у самца мыши. Согласно одному варианту осуществления эктопическая нуклеотидная последовательность предоставляет самцу мыши способность производить потомство, которая сопоставима с соответствующим самцом мыши дикого типа, который содержит функциональный эндогенный ген ADAM6. Согласно одному варианту осуществления последовательность предоставляет мыши способность формировать комплекс ADAM2 и/или ADAM3 и/или ADAM6 на поверхности сперматозоида мыши. Согласно одному варианту осуществления последовательность предоставляет сперматозоиду мыши способность проходить от матки мыши через яйцевод мыши к яйцеклетке мыши для оплодотворения яйцеклетки.
Согласно одному варианту осуществления у мыши отсутствует функциональный эндогенный локус ADAM6 и мышь содержит эктопическую нуклеотидную последовательность, кодирующую ADAM6 или его ортолог или гомолог или фрагмент, являющийся функциональным у самца мыши, и при этом самец мыши производит по меньшей мере приблизительно 50%, 60%, 70%, 80% или 90% от числа пометов, которые производит мышь дикого типа мышь того же возраста и разновидности за шестимесячный период времени.
Согласно одному варианту осуществления мышь, не содержащая функциональный эндогенный ген ADAM6 и содержащая эктопическую нуклеотидную последовательность, производит больше по меньшей мере приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 2,5 раза, приблизительно в 3 раза, приблизительно в 4 раза, приблизительно в 6 раз, приблизительно в 7 раз, приблизительно в 8 раз или приблизительно в 10 раз или более потомства при разведении в течение шестимесячного периода времени, чем мышь того же возраста и аналогичной разновидности, у которой отсутствует функциональный эндогенный ген ADAM6 и отсутствует эктопическая нуклеотидная последовательность, которую разводят в течение, по сути, такого же периода времени и, по сути, при таких же условиях.
Согласно одному варианту осуществления мышь, не содержащая функциональный эндогенный ген ADAM6 и содержащая эктопическую нуклеотидную последовательность, производит в среднем по меньшей мере приблизительно в 2 раза, в 3 раза или в 4 раза большее число детенышей на помет за 4- или 6-месячный период разведения, чем мышь, у которой отсутствует функциональный эндогенный ген ADAM6 и у которой отсутствует эктопическая нуклеотидная последовательность, и которую разводят в течение такого же периода времени.
Согласно одному варианту осуществления мышь, не содержащая функциональный эндогенный ген ADAM6 и содержащая эктопическую нуклеотидную последовательность, представляет собой самца мыши, и самец мыши производит сперму, которая будучи извлеченной из яйцеводов приблизительно через 5-6 часов после копуляции, демонстрирует перемещение в яйцеводе, которое является больше по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 30 раз, по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 60 раз, по меньшей мере в 70 раз, по меньшей мере в 80 раз, по меньшей мере в 90 раз, в 100 раз, в 110 раз или в 120 раз или выше, чем сперма мыши, которая не содержит функциональный эндогенный ген ADAM6 и которая не содержит эктопическую нуклеотидную последовательность.
Согласно одному варианту осуществления мышь, не содержащая функциональный эндогенный ген ADAM6 и содержащая эктопическую нуклеотидную последовательность, при копуляции с самкой мыши образует сперму, которая способна к перемещению в матке и попаданию и перемещению в яйцеводе в течение приблизительно 6 часов при результативности, которая приблизительно равна сперме мыши дикого типа.
Согласно одному варианту осуществления мышь, не содержащая функциональный эндогенный ген ADAM6 и содержащая эктопическую нуклеотидную последовательность, производит больше приблизительно в 1,5 раз, приблизительно в 2 раза, приблизительно в 3 раза или приблизительно в 4 раза или более пометов за сопоставимый период времени, чем мышь, у которой отсутствует функциональный ген ADAM6 и эктопическая нуклеотидная последовательность.
Согласно одному аспекту предлагается мышь, которая содержит гуманизированный эндогенный локус вариабельной области тяжелой цепи иммуноглобулина мыши и модификацию локуса легкой цепи иммуноглобулина мыши, причем мышь экспрессирует В-клетку, которая содержит реаранжированную последовательность тяжелой цепи иммуноглобулина человека, функционально связанную с генной последовательностью константной области тяжелой цепи человека или мыши, и В-клетка содержит в своем геноме (например, на хромосоме В-клетки) ген, кодирующий ADAM6 или его ортолог или гомолог или фрагмент, являющийся функциональным у самца мыши (например, ген ADAM6 мыши, например, ADAM6a и/или мышиный ADAM6b мыши), причем вариабельные домены Х или к легких цепей иммуноглобулина мышей происходят не более чем из одного или не более чем из двух генных сегментов V легкой цепи.
Согласно одному варианту осуществления реаранжированная последовательность иммуноглобулина, функционально связанная с генной последовательностью константной области тяжелой цепи, содержит последовательность V, D и/или J тяжелой цепи человека; последовательность V, D и/или J тяжелой цепи мыши; последовательность V и/или J легкой цепи человека или мыши. Согласно одному варианту осуществления генная последовательность константной области тяжелой цепи содержит последовательность тяжелой цепи человека или мыши, выбранную из группы, состоящей из СН1, шарнира, СН2, CH3 и их комбинации.
Согласно одному аспекту предусматривается мышь, подходящая для получения антител, которые характеризуются одинаковой легкой цепью, причем все или, по сути, все антитела, образованные у мыши, экспрессируются с одинаковой легкой цепью, причем легкая цепь содержит вариабельный домен человека, и причем антитела содержат тяжелую цепь, которая содержит вариабельный домен человека.
Согласно одному аспекту предусматривается мышь, которая характеризуется неспособностью мыши производить В-клетку, которая экспрессирует вариабельный домен легкой цепи иммуноглобулина, который происходит из реаранжированной последовательности легкой цепи, которая не является последовательностью Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека.
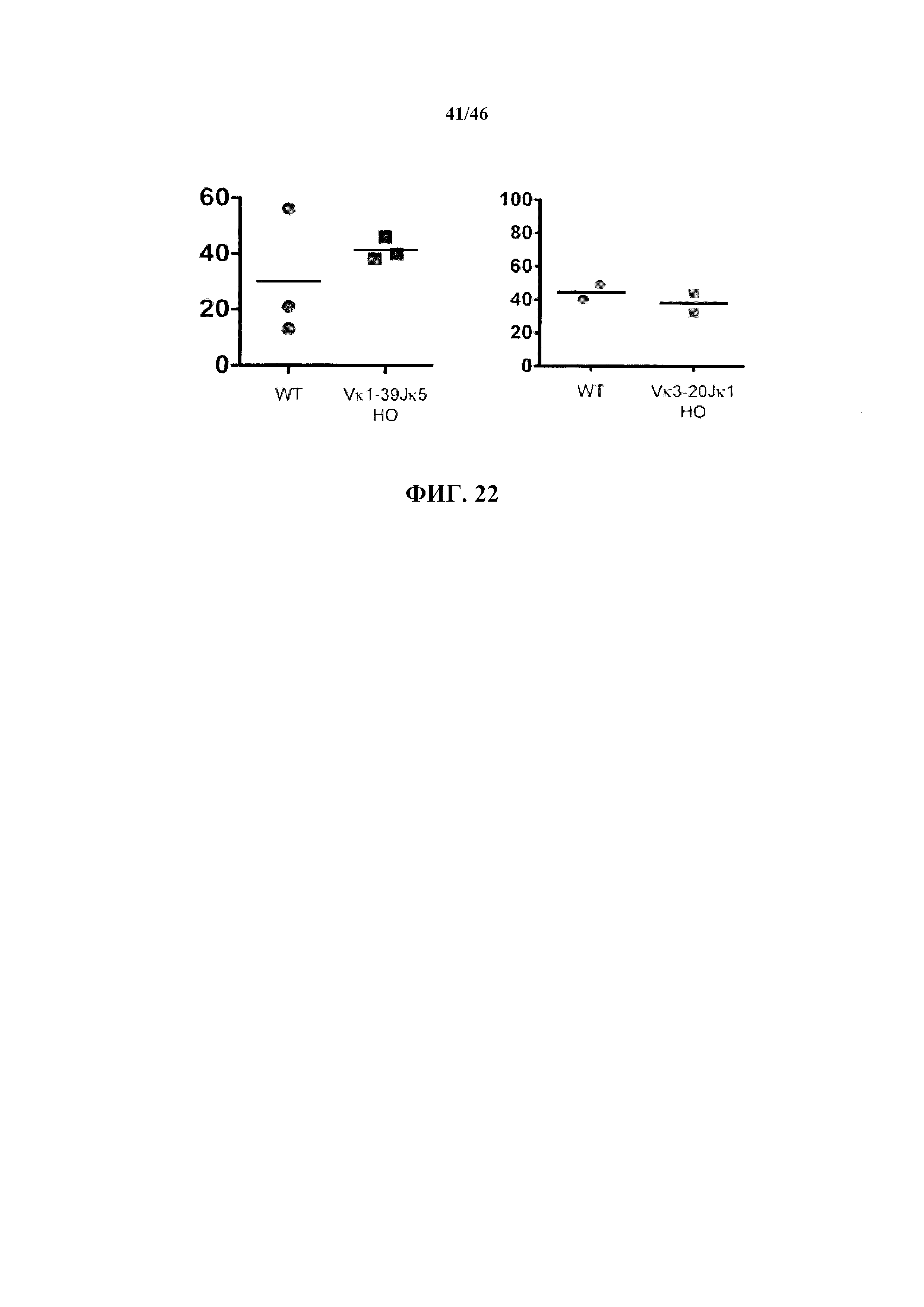
Согласно одному варианту осуществления мышь проявляет отношение κ:λ легких цепей, которое является приблизительно одинаковым относительно такового у мыши, которая содержит сегмент, комплементарный генным сегментам V и J легкой цепи иммуноглобулина дикого типа.
Согласно одному аспекту предусматривается описанная в настоящем документе мышь, которая экспрессирует легкую цепь иммуноглобулина, происходящую из последовательности Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека, причем мышь содержит замещение всех или, по сути, всех эндогенных генных сегментов вариабельной области тяжелой цепи мыши одним или несколькими генными сегментами вариабельной области тяжелой цепи человека, и мышь проявляет отношение (a) CD19+ В-клеток, которые экспрессируют иммуноглобулин, характеризующийся А, легкой цепью, к (b) CD19+ В-клеткам, которые экспрессируют иммуноглобулин, характеризующийся к легкой цепью, составляющее приблизительно 1 к приблизительно 20.
Согласно одному варианту осуществления мышь экспрессирует единственную к легкую цепь, причем единственная к легкая цепь происходит из последовательности Vκ1-39Jκ5 человека, и отношение CD19+ В-клеток, которые экспрессируют иммуноглобулин, характеризующийся λ легкой цепью, к CD19+ В-клеткам, которые экспрессируют иммуноглобулин, характеризующийся к легкой цепью, составляет приблизительно 1 к приблизительно 20; согласно одному варианту осуществления отношение составляет приблизительно 1 по меньшей мере к приблизительно 66; согласно конкретному варианту осуществления отношение составляет приблизительно 1 к 66.
Согласно одному варианту осуществления мышь экспрессирует единственную к легкую цепь, причем единственная к легкая цепь происходит из последовательности Vκ3-20Jκ5 человека, и отношение CD19+ В-клеток, которые экспрессируют иммуноглобулин, характеризующийся λ легкой цепью, к CD19+ В-клеткам, которые экспрессируют иммуноглобулин, характеризующийся к легкой цепью, составляет приблизительно 1 к приблизительно 20; согласно одному варианту осуществления отношение составляет приблизительно 1 к приблизительно 21. Согласно конкретным вариантам осуществления отношение составляет 1 к 20 или 1 к 21.
Согласно одному варианту осуществления процент Igκ+Igλ+ В-клеток у мыши является приблизительно таким же, как и у мыши дикого типа. Согласно конкретному варианту осуществления процент Igκ+Igλ+ В-клеток у мыши составляет приблизительно 2 -приблизительно 6 процентов. Согласно конкретному варианту осуществления процент Igκ+Igλ+ В-клеток у мыши, причем единственная реаранжированная к легкая цепь происходит из последовательности Vκ1-39Jκ5, составляет приблизительно 2 - приблизительно 3; согласно конкретному варианту осуществления приблизительно 2,6. Согласно конкретному варианту осуществления процент Igκ+Igλ+ В-клеток у мыши, причем единственная реаранжированная к легкая цепь происходит из последовательности Vκ3-20Jκ1, составляет приблизительно 4 - приблизительно 8; согласно конкретному варианту осуществления приблизительно 6.
Согласно одному варианту осуществления мышь не содержит модификацию, которая снижает или устраняет способность мыши соматически мутировать любой функциональный локус легкой цепи мыши. Согласно одному варианту осуществления единственный функциональный локус легкой цепи у мыши экспрессирует легкую цепь, которая содержит вариабельный домен человека, происходящий из реаранжированной последовательности, выбранной из Vκ1-39Jκ5 последовательности человека, Vκ3-20Jκ1 последовательности человека и их комбинации.
Согласно одному аспекту генетически предусматривается модифицированная мышь, которая экспрессирует единственную к легкую цепь, происходящую не более чем из одной или не более чем из двух реаранжированных последовательностей к легкой цепи, причем мышь проявляет частоту использования к легкой цепи, которая является выше приблизительно в 100 раз или больше, по меньшей мере приблизительно в 200 раз или больше, по меньшей мере приблизительно в 300 раз или более, по меньшей мере приблизительно в 400 раз или более, по меньшей мере приблизительно в 500 раз или более, по меньшей мере приблизительно в 600 раз или более, по меньшей мере приблизительно в 700 раз или более, по меньшей мере приблизительно в 800 раз или более, по меньшей мере приблизительно в 900 раз или более, по меньшей мере приблизительно в 1000 раз или более, чем частота использования такой же к легкой цепи (т.е., происходящей из того же сегмента V и того же сегмента J, или происходящей из того же реаранжированного сегмента V/J), которая проявляется мышью, несущей полный или, по сути, полный локус к легкой цепи человека. Согласно конкретному варианту осуществления мышь, несущая полный или, по сути, полный локус к легкой цепи человека, не содержит функциональную переаранжированную последовательность к легкой цепи мыши. Согласно конкретному варианту осуществления мышь экспрессирует единственную к легкую цепь не более чем из одной реаранжированной последовательности к легкой цепи. Согласно одному варианту осуществления мышь содержит одну копию реаранжированной последовательности к легкой цепи (например, гетерозигота). Согласно одному варианту осуществления мышь содержит две копии реаранжированной последовательности к легкой цепи (например, гомозигота). Согласно более конкретному варианту осуществления реаранжированная последовательность к легкой цепи выбрана из последовательности Vκ1-39Jκ5 и Vκ3-20Jκ1. Согласно одному варианту осуществления реаранжированная последовательность к легкой цепи представляет собой последовательность Vκ1-39Jκ5. Согласно одному варианту осуществления реаранжированная последовательность к легкой цепи представляет собой последовательность Vκ3-20Jκ1.
Согласно одному аспекту предусматривается генетически модифицированная мышь, которая экспрессирует единственную легкую цепь, происходящую не более чем из одной или не более чем из двух реаранжированных последовательностей к легкой цепи, причем легкая цепь у генетически модифицированной мыши проявляет уровень экспрессии, который по меньшей мере в 10 раз - приблизительно в 1000 раз, в 100 раз - приблизительно в 1000 раз, в 200 раз - приблизительно в 1000 раз, в 300 раз - приблизительно в 1000 раз, в 400 раз - приблизительно в 1000 раз, в 500 раз - приблизительно в 1000 раз, в 600 раз - приблизительно в 1000 раз, в 700 раз - приблизительно в 1000 раз, в 800 раз - приблизительно в 1000 раз или в 900 раз - приблизительно в 1000 раз выше, чем экспрессия такой же реаранжированной легкой цепи, проявляемая мышью, несущей полный или, по сути, полный вариабельный локус к легкой цепи человека. Согласно одному варианту осуществления легкая цепь содержит последовательность человека. Согласно одному варианту осуществления единственная легкая цепь происходит из реаранжированной последовательности к легкой цепи, выбранной из Vκ1-39Jκ5 человека, Vκ3-20Jκ1 человека и их комбинации.
Согласно одному варианту осуществления уровень экспрессии легкой цепи, с целью сравнения экспрессии легкой цепи с экспрессией у мыши, содержащей, по сути, полностью гуманизированный вариабельный локус легкой цепи, характеризуется количественным определением мРНК транскрибированной последовательности легкой цепи (из одной или двух реаранжированных последовательностей) и ее сравнением с транскрибированной последовательностью легкой цепи мыши, несущей полный или, по сути, полный локус легкой цепи.
Согласно одному аспекту предлагается способ получения антитела, включающий экспрессию в клетке (а) первой последовательности нуклеиновой кислоты вариабельного домена тяжелой цепи человека описанной в настоящем документе иммунизированной мыши, слитой с генной последовательностью СН человека; (b) последовательности нуклеиновой кислоты вариабельного домена легкой цепи человека описанной в настоящем документе иммунизированной мыши, слитой с CL генной последовательностью человека; и, (с) хранение клетки при условиях, достаточных для экспрессии полностью человеческого антитела, и выделение антитела. Согласно одному варианту осуществления клетка содержит вторую последовательность нуклеиновой кислоты вариабельного домена тяжелой цепи человека описанной в настоящем документе второй иммунизированной мыши, слитую с генной последовательностью СН человека, причем первая последовательность нуклеиновой кислоты тяжелой цепи кодирует первый вариабельный домен тяжелой цепи, который распознает первый эпитоп, а вторая последовательность нуклеиновой кислоты тяжелой цепи кодирует второй вариабельный домен тяжелой цепи, который распознает второй эпитоп, причем первый эпитоп и второй эпитоп не являются идентичными.
Согласно одному аспекту предлагается способ получения связывающего эпитоп белка, включающий воздействие на описанную в настоящем документе мышь антигеном, который содержит представляющий интерес эпитоп, содержание мыши при условиях, достаточных для того, чтобы мышь создала молекулу иммуноглобулина, которая специфически связывает представляющий интерес эпитоп, и выделение молекулы иммуноглобулина, которая специфически связывает представляющий интерес эпитоп; причем связывающий эпитоп белок содержит тяжелую цепь, которая содержит соматически мутированный вариабельный домен человека и СН мыши, связанный с легкой цепью, содержащей CL мыши и вариабельный домен человека, происходящие из реаранжированной Vκ1-39Jκ5 человека или реаранжированной Vκ3-20Jκ1 человека.
Согласно одному аспекту предлагается способ получения биспецифического связывающего антиген белок, включающий воздействие на первую описанную в настоящем документе мышь первым представляющим интерес антигеном, который содержит первый эпитоп, воздействие на вторую описанную в настоящем документе мышь представляющим интерес вторым антигеном, который содержит второй эпитоп, позволяя и первой, и второй мыши выработать иммунные ответы к представляющим интерес антигенам, определение у первой мыши первой вариабельной области тяжелой цепи человека, которая связывает первый эпитоп первого представляющего интерес антигена, определение у второй мыши второй вариабельной области тяжелой цепи человека, которая связывает второй эпитоп второго представляющего интерес антигена, получение первого полностью человеческого гена тяжелой цепи, который кодирует первую тяжелую цепь, которая связывает первый эпитоп первого представляющего интерес антигена, получение второго полностью человеческого гена тяжелой цепи, который кодирует вторую тяжелую цепь, которая связывает второй эпитоп второго представляющего интерес антигена, экспрессию первой тяжелой цепи и второй тяжелой цепи в клетке, которая экспрессирует единственную полностью человеческую легкую цепь, происходящую из генного сегмента Vκ1-39 человека или Vκ3-20 человека для образования биспецифического связывающего антиген белка, и выделение биспецифического связывающего антиген белка.
Согласно одному варианту осуществления первый антиген и второй антиген не идентичны.
Согласно одному варианту осуществления первый антиген и второй антиген являются идентичными, и первый эпитоп и второй эпитоп не идентичны. Согласно одному варианту осуществления связывание первой вариабельной области тяжелой цепи с первым эпитопом не блокирует связывание второй вариабельной области тяжелой цепи со вторым эпитопом.
Согласно одному варианту осуществления первый антиген выбран из растворимого антигена и антигена клеточной поверхности (например, опухолевого антигена), и второй антиген содержит рецептор клеточной поверхности. Согласно конкретному варианту осуществления рецептор клеточной поверхности представляет собой рецептор иммуноглобулина. Согласно конкретному варианту осуществления рецептор иммуноглобулина представляет собой рецептор Fc. Согласно одному варианту осуществления первый антиген и второй антиген представляют собой одинаковый рецептор клеточной поверхности, и связывание первой тяжелой цепи с первым эпитопом не блокирует связывание второй тяжелой цепи со вторым эпитопом.
Согласно одному варианту осуществления вариабельный домен легкой цепи содержит 2-5 соматических мутаций. Согласно одному варианту осуществления вариабельный домен легкой цепи представляет собой соматически мутированную когнатную легкую цепь, экспрессированную в В-клетке первой или второй иммунизированной мыши или с первым, или со вторым вариабельным доменом тяжелой цепи.
Согласно одному аспекту предлагается клетка, которая экспрессирует связывающий эпитоп белок, причем клетка содержит: (а) нуклеотидную последовательность человека, кодирующую вариабельный домен легкой цепи человека, который происходит из реаранжированной Vκ1-391κ5 человека или реаранжированной Vκ3-20Jκ1 человека, причем последовательность нуклеиновой кислоты человека слита (напрямую или через линкер) с последовательностью нуклеиновой кислоты константного домена легкой цепи иммуноглобулина человека (например, последовательность ДНК к константного домена человека); и, (b) первую последовательность нуклеиновой кислоты вариабельного домена тяжелой цепи человека, кодирующую вариабельный домен тяжелой цепи человека, происходящий из первой нуклеотидной последовательности вариабельного домена тяжелой цепи человека, причем первая нуклеотидная последовательность вариабельного домена тяжелой цепи человека слита (напрямую или через линкер) с последовательностью нуклеиновой кислоты константного домена тяжелой цепи иммуноглобулина человека (например, последовательностью IgG1, IgG2, IgG3, IgG4 или IgE человека); причем связывающий эпитоп белок распознает первый эпитоп. Согласно одному варианту осуществления связывающий эпитоп белок связывает первый эпитоп с константой диссоциации ниже чем 10-6 М, ниже чем 10-8 М, ниже чем 10-9 М, ниже чем 10-10 М, ниже чем 10-11 М или ниже чем 10-12 М. Согласно одному варианту осуществления клетка содержит вторую нуклеотидную последовательность человека, кодирующую второй вариабельный домен тяжелой цепи человека, причем вторая последовательность человека слита (напрямую или через линкер) с последовательностью нуклеиновой кислоты константного домена тяжелой цепи иммуноглобулина человека, и при этом второй вариабельный домен тяжелой цепи человека не распознает специфически первый эпитоп (например, проявляет константу диссоциации, составляющую, например, 10-6 М, 10-5 М, 10-4 М или выше), и причем связывающий эпитоп белок связывает как первый эпитоп, так и второй эпитоп, и при этом каждая из первой и второй тяжелых цепей иммуноглобулина связаны с легкой цепью согласно (а). Согласно одному варианту осуществления второй домен VH связывает второй эпитоп с константой диссоциации, которая составляет ниже чем 10-6 М, ниже чем 10-7 М, ниже чем 10-8 М, ниже чем 10-9 М, ниже чем 10-10 М, ниже чем 10-11 М или ниже чем 10-12 М.
Согласно одному варианту осуществления связывающий эпитоп белок содержит первую тяжелую цепь иммуноглобулина и вторую тяжелую цепь иммуноглобулина, каждая из которых связана с универсальной легкой цепью (например, легкой цепью, происходящей из реаранжированной последовательности вариабельной области легкой цепи человека, выбранной из Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека), причем первая тяжелая цепь иммуноглобулина связывает первый эпитоп с константой диссоциации в диапазоне от наномолярного (например, 1 нМ-100 нМ) до пикомолярного (например, 1 пМ-100 пМ), вторая тяжелая цепь иммуноглобулина связывает второй эпитоп с константой диссоциации в диапазоне от наномолярного до пикомолярного (например, 1 пМ-100 нМ), первый эпитоп и второй эпитоп не идентичны, первая тяжелая цепь иммуноглобулина не связывает второй эпитоп или связывает второй эпитоп с константой диссоциации слабее, чем микромолярный диапазон (например, миллимолярный диапазон), вторая тяжелая цепь иммуноглобулина не связывает первый эпитоп или связывает первый эпитоп с константой диссоциации слабее, чем микромолярный диапазон (например, миллимолярный диапазон), и один или несколько вариабельных доменов (т.е., один или несколько вариабельных доменов легкой цепи, вариабельный домен тяжелой цепи первой тяжелой цепи иммуноглобулина и вариабельные домен тяжелой цепи) второй тяжелой цепи иммуноглобулина является соматически мутированным. Согласно одному варианту осуществления связывание связывающего эпитоп белка с первым эпитопом не блокирует связывание связывающего эпитоп белка со вторым эпитопом.
Согласно одному варианту осуществления первая тяжелая цепь иммуноглобулина содержит детерминанту связывания белка А дикого типа, а вторая тяжелая цепь не содержит детерминанту связывания белка А дикого типа. Согласно одному варианту осуществления первая тяжелая цепь иммуноглобулина связывает белок А при условиях выделения, и вторая тяжелая цепь иммуноглобулина не связывает белок А или связывает белок А по меньшей мере в 10 раз, в сто раз или в тысячу раз слабее, чем первая тяжелая цепь иммуноглобулина связывает белок А при условиях выделения. Согласно конкретному варианту осуществления первая и вторая тяжелые цепи представляют собой изотипы IgG1, причем вторая тяжелая цепь содержит модификацию, выбранную из 95R (EU 435R), 96F (EU 436F) и их комбинации, и при этом у первой тяжелой цепи отсутствует такая модификация.
Согласно аспекту описанная в настоящем документе мышь, эмбрион или клетка содержит локус к легкой цепи, который сохраняет эндогенные регуляторные или контролирующие элементы, например, к интронный энхансер мыши, к 3' энхансер мыши или как интронный энхансер, так и 3' энхансер, причем регуляторные или контролирующие элементы облегчают соматическую мутацию и созревание аффинности экспрессированной последовательности локуса к легкой цепи.
Согласно одному аспекту предлагается клетка мыши, выделенная из описанной в настоящем документе мыши. Согласно одному варианту осуществления клетка представляет собой ES (эмбриональную стволовую) клетку. Согласно одному варианту осуществления клетка представляет собой лимфоцит. Согласно одному варианту осуществления лимфоцит представляет собой В-клетку. Согласно одному варианту осуществления В-клетка экспрессирует химерную тяжелую цепь, содержащую вариабельный домен, происходящий из генного сегмента V человека; и легкую цепь, происходящую из (а) реаранжированной последовательности Vκ1-39/J человека, (b) реаранжированной последовательности Vκ3-20/J человека, или (с) их комбинации; причем вариабельный домен тяжелой цепи слит с константной областью мыши и вариабельный домен легкой цепи слит с константной областью мыши или человека. Согласно одному варианту осуществления клетка мыши содержит по меньшей мере один ген, который кодирует ADAM6 мыши или его ортолог или гомолог или функциональный фрагмент. Согласно одному варианту осуществления клетка представляет собой В-клетку и В-клетка содержит последовательность, кодирующую реаранжированный вариабельный домен тяжелой цепи иммуноглобулина человека, и последовательность, кодирующую вариабельный домен универсальной легкой цепи, причем В-клетка содержит на хромосоме последовательность нуклеиновой кислоты, кодирующую белок ADAM6 или его ортолог или гомолог или фрагмент, который является функциональным у самца мыши; согласно одному варианту осуществления В-клетка мыши содержит два аллеля последовательности нуклеиновой кислоты.
Согласно одному аспекту предусматривается клетка мыши, содержащая первую хромосому, которая содержит гуманизированный локус тяжелой цепи иммуноглобулина, содержащий переаранжированные сегменты V, D и J человека; вторую хромосому, которая содержит гуманизированный локус легкой цепи иммуноглобулина, который кодирует или способен к реаранжировке, чтобы кодировать легкую цепь, причем локус легкой цепи содержит не более чем один сегмент V (или не более чем два сегмента V) и не более чем один сегмент J (или не более чем два сегмента J), функционально связанный с геном константной области легкой цепи, или не более чем одну или не более чем две реаранжированные V/J последовательности легкой цепи, функционально связанную с геном константной области легкой цепи; и третью хромосому, которая содержит последовательность нуклеиновой кислоты, кодирующую ADAM6 мыши или его ортолог или гомолог или фрагмент, который является функциональным у самца мыши. Согласно одному варианту осуществления первая и третья хромосомы являются одинаковыми. Согласно одному варианту осуществления вторая и третья хромосомы являются одинаковыми. Согласно одному варианту осуществления каждая из первой, второй и третьей хромосом являются различными. Согласно одному варианту осуществления последовательность нуклеиновой кислоты, кодирующая ADAM6 мыши или его ортолог или гомолог или функциональный фрагмент присутствует в двух копиях. Согласно одному варианту осуществления клетка представляет собой соматическую клетку. Согласно конкретному варианту осуществления соматическая клетка представляет собой В-клетку. Согласно одному варианту осуществления клетка представляет собой гамету.
Согласно одному аспекту предлагается гибридома, причем гибридома образована с В-клеткой описанной в настоящем документе мыши. Согласно конкретному варианту осуществления В-клетка происходит из описанной в настоящем документе мыши, которая была иммунизирована с помощью антигена, содержащего представляющий интерес эпитоп, и В-клетка экспрессирует связывающий белок, который связывает представляющий интерес эпитоп, при этом связывающий белок характеризуется соматически мутированным вариабельным доменом тяжелой цепи человека и константной областью тяжелой цепи мыши, и содержит вариабельный домен легкой цепи человека, происходящий из реаранжированной Vκ1-39Jκ5 человека или реаранжированной Vκ3-20Jκ1 человека и CL мыши.
Согласно одному аспекту предусматривается клетка, которая содержит полностью человеческий ген тяжелой цепи, содержащий последовательность нуклеиновой кислоты, кодирующую первый вариабельный домен тяжелой цепи описанной в настоящем документе мыши, и полностью человеческий ген легкой цепи, содержащий последовательность нуклеиновой кислоты, кодирующую описанную в настоящем документе последовательность универсальной легкой цепи. Согласно одному варианту осуществления клетка дополнительно содержит последовательность нуклеиновой кислоты, кодирующую второй вариабельный домен тяжелой цепи описанной в настоящем документе мыши, причем первый и второй вариабельные домены тяжелой цепи являются различными. Согласно одному варианту осуществления клетка выбрана из СНО, COS, 293, HeLa и ретинальной клетки, экспрессирующей вирусную последовательность нуклеиновой кислоты (например, клетка PERC.6™).
Согласно одному аспекту предлагается эмбрион мыши, причем эмбрион содержит донорную ES клетку, которая происходит из описанной в настоящем документе мыши.
Согласно одному аспекту предлагается применение эмбриона мыши, который содержит описанную в настоящем документе генетическую модификацию, причем применение предусматривает получение генетически модифицированной описанной в настоящем документе мыши.
Согласно одному аспекту предлагается аминокислотная последовательность вариабельного домена тяжелой цепи человека и вариабельного домена легкой цепи человека антитела, полученная в описанной в настоящем документе мыши.
Согласно одному аспекту предлагается нуклеотидная последовательность вариабельного домена тяжелой цепи человека и нуклеотидная последовательность вариабельного домена легкой цепи человека антитела, полученные в описанной в настоящем документе мыши.
Согласно одному аспекту предлагается антитело или связывающий антиген белок или его связывающий антиген фрагмент (например, Fab, F(ab)2, scFv), полученный в описанной в настоящем документе мыши.
Согласно одному аспекту предлагается мышь, полученная с использованием описанного в настоящем документе нацеливающего вектора, нуклеотидной конструкции или клетки.
Согласно одному аспекту предлагается потомство спаривания первой описанной в настоящем документе мыши со второй мышью, которая представляет собой мышь дикого типа или генетически модифицированную мышь.
Согласно одному аспекту предлагается применение описанной в настоящем документе мыши для получения полностью человеческого антитела или полностью человеческого связывающего антиген белка, содержащего вариабельный домен иммуноглобулина или его функциональный фрагмент.
Согласно одному аспекту предлагается применение описанной в настоящем документе мыши или ткани или клетки для получения полностью человеческого биспецифического антитела.
Согласно одному аспекту предлагается применение последовательности нуклеиновой кислоты, произведенной описанной в настоящем документе мышью, причем применение включает экспрессию последовательности нуклеиновой кислоты в производстве терапевтического средства для людей.
Согласно одному аспекту предлагается применение описанной в настоящем документе мыши для получения иммортализованной клеточной линии.
Согласно одному аспекту предлагается применение описанной в настоящем документе мыши для получения гибридомы или квадромы.
Согласно одному аспекту предлагается применение описанной в настоящем документе мыши для получения последовательности нуклеиновой кислоты, кодирующей вариабельную область иммуноглобулина или ее фрагмент. Согласно одному варианту осуществления последовательность нуклеиновой кислоты применяется для получения человеческого антитела или его связывающего антиген фрагмента. Согласно одному варианту осуществления мышь применяется для получения связывающего антиген белка, выбранного из следующего: антитело, мультиспецифическое антитело (например, биспецифическое антитело), scFv, бис-scFV, диатело, триатело, тетратело, V-NAR, VHH, VL, F(ab), F(ab)2, DVD (т.е., связывающий антиген белок с двойным вариабельным доменом), SVD (т.е., связывающий антиген белок с одним вариабельным доменом) или биспецифический проводник Т-клеток (BiTE).
Согласно одному аспекту предлагается применение описанной в настоящем документе мыши для производства лекарственного средства (например, связывающего антиген белка) или для производства последовательности, кодирующей вариабельную последовательность лекарственного средства (например, связывающего антиген белка) для лечения заболевания или нарушения человека.
Любой из описанных в настоящем документе вариантов осуществления и аспектов может использоваться в сочетании друг с другом, если иное не указано или не очевидно из контекста. Другие варианты осуществления станут очевидными специалистам в настоящей области техники при рассмотрении последующего описания.
Краткое описание графических материалов
На фиг.1А показано общее изображение, без соблюдения масштаба, прямого геномного замещения приблизительно трех миллионов пар оснований (Mb) вариабельного генного локуса тяжелой цепи иммуноглобулина мыши (закрашенные обозначения) приблизительно одним миллионом пар оснований (Mb) вариабельного генного локуса тяжелой цепи иммуноглобулина человека (незакрашенные обозначения).
На фиг.1В показано общее изображение, без соблюдения масштаба, прямого геномного замещения приблизительно трех миллионов пар оснований (Mb) вариабельного генного локуса к легкой цепи иммуноглобулина мыши (закрашенные обозначения) приблизительно 0,5 миллиона пар оснований (Mb) первым, или проксимальным, из двух почти идентичных повторов вариабельного генного локуса к легкой цепи иммуноглобулина человека (незакрашенные обозначения).
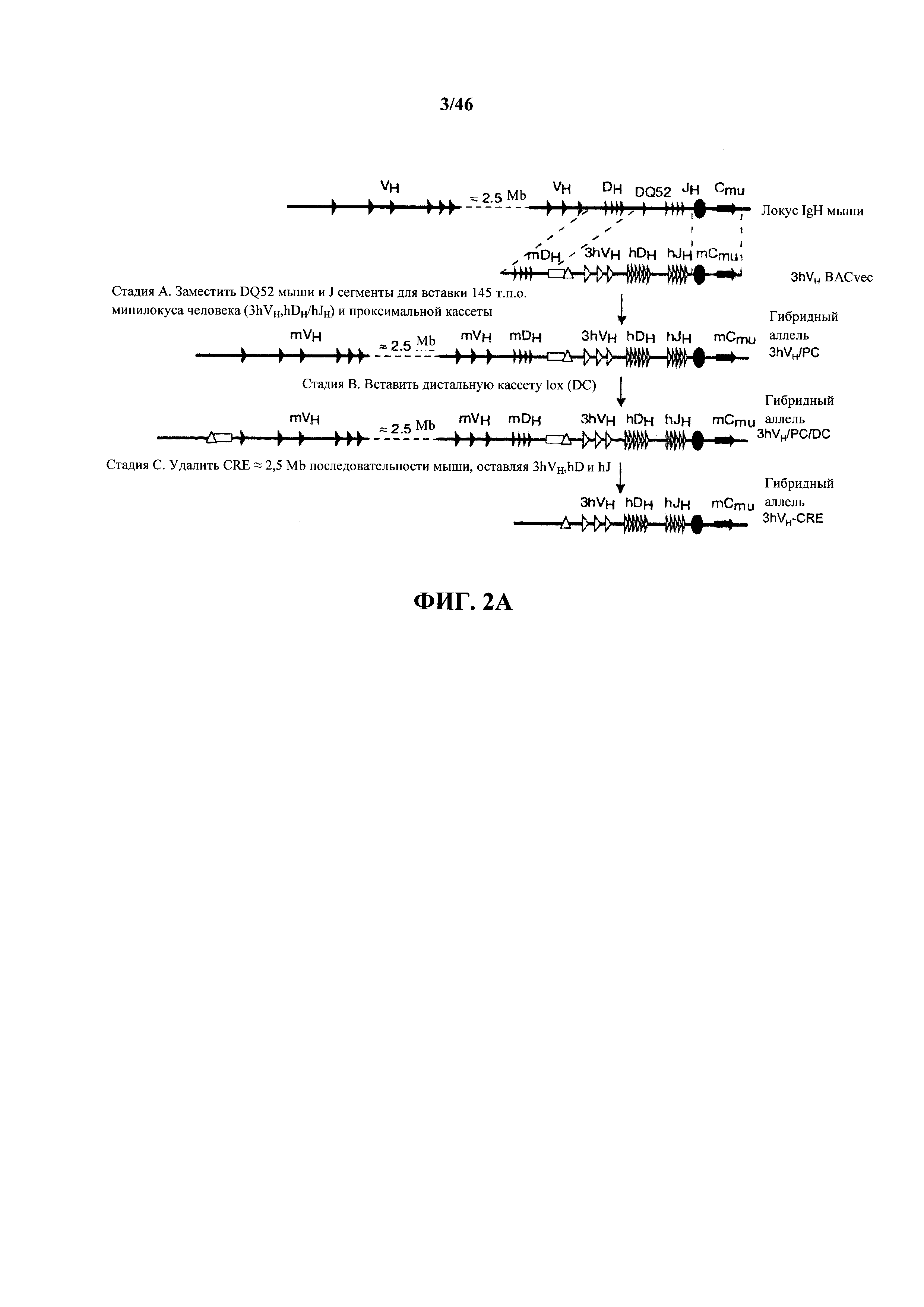
На фиг.2А показано подробное изображение, без соблюдения масштаба, трех начальных стадий (А-С) прямого геномного замещения вариабельного генного локуса тяжелой цепи иммуноглобулина мыши, которое приводит к делеции всех генных сегментов VH, DH и JH мыши и замещению тремя генными сегментами VH человека, всеми генными сегментами DH и JH человека. Нацеливающий вектор для первой вставки генных сегментов тяжелой цепи иммуноглобулина человека показан (3hVH BACvec) с 67 т.п.о. 5' плечом гомологии мыши, кассетой селекции (незакрашенный прямоугольник), сайтом сайт-специфической рекомбинации (незакрашенный треугольник), 145 т.п.о. геномным фрагментом человека и 8 т.п.о. 3' гомологичным плечом мыши. Показаны генные сегменты иммуноглобулина человека (незакрашенные обозначения) и мыши (закрашенные обозначения), дополнительные кассеты селекции (незакрашенные прямоугольники) и сайты сайт-специфической рекомбинации (незакрашенные треугольники), вставленные из последующих нацеливающих векторов.
На фиг.2В показано подробное изображение, без соблюдения масштаба, шести дополнительных стадий (D-I) прямого геномного замещения вариабельного генного локуса тяжелой цепи иммуноглобулина мыши, которое приводит к вставке 77 дополнительных VH генных сегментов человека и удалению последней кассеты селекции. Нацеливающий вектор для вставки дополнительных генных сегментов VH человека (18hVH BACvec) в начальную вставку генных сегментов тяжелой цепи человека (гибридный аллель 3hVH-CRE) показан с 20 т.п.о. 5' плечом гомологии мышь, кассетой селекции (незакрашенный прямоугольник), 196 т.п.о. геномным фрагментом человека и 62 т.п.о. плечом гомологии человека, которое перекрывается с 5' концом начальной вставки генных сегментов тяжелой цепи человека, которая показана с сайтом сайт-специфической рекомбинации (незакрашенный треугольник), расположенном 5' по отношению к генным сегментам человека. Показаны генные сегменты иммуноглобулина человека (незакрашенные обозначения) и мыши (закрашенные обозначения) и дополнительные кассеты селекции (незакрашенные прямоугольники), вставленные с помощью последующих нацеливающих векторов.
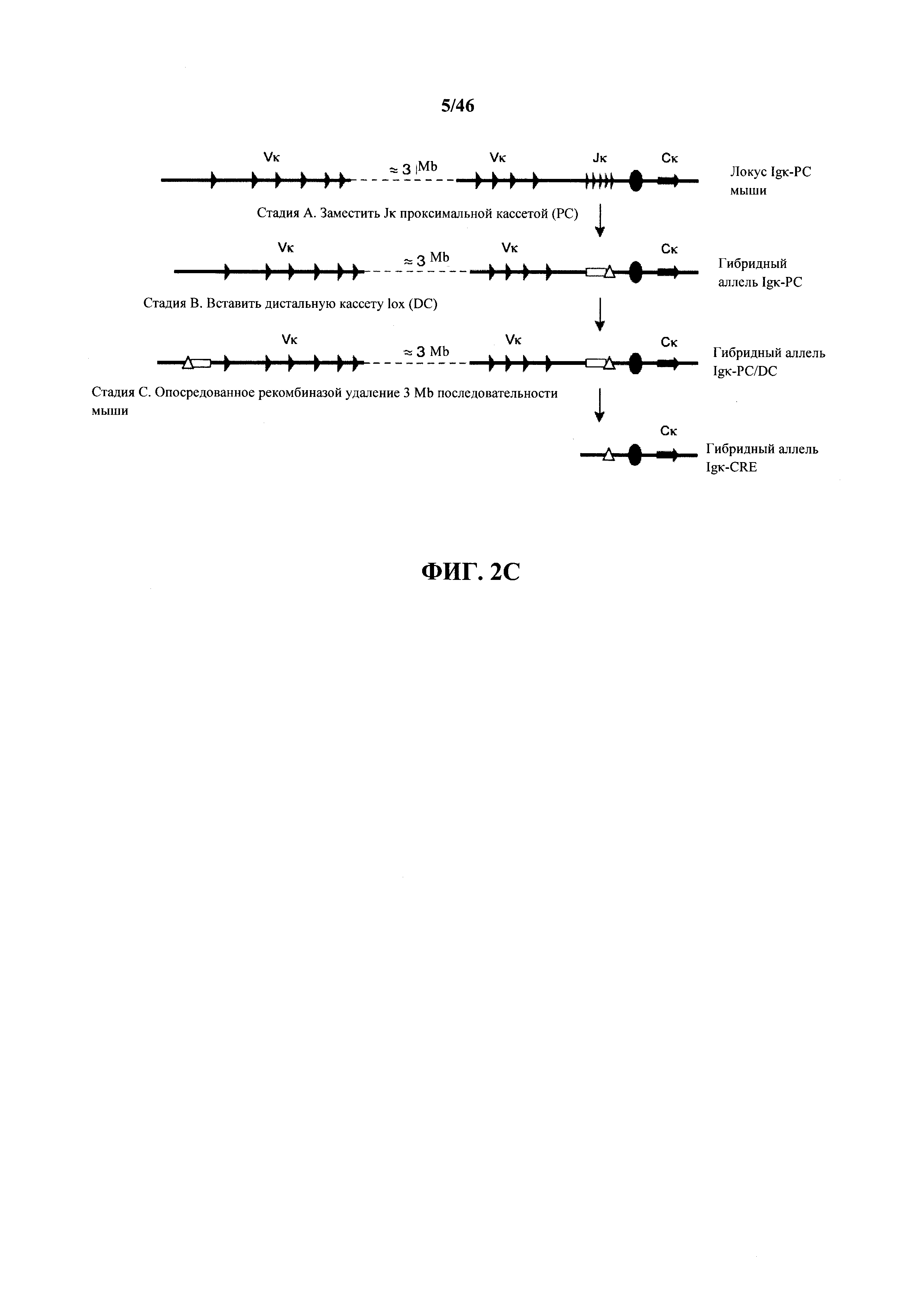
На фиг.2С показано подробное изображение, без соблюдения масштаба, трех начальных стадий (А-С) прямого геномного замещения вариабельного генного локуса к легкой цепи иммуноглобулина мыши, которое приводит к делеции всех генных сегментов Vκ и Jκ мыши (гибридный аллель Igκ-CRE). Показаны кассеты селекции (незакрашенные прямоугольники) и сайты сайт-специфической рекомбинации (незакрашенные треугольники), вставленные из нацеливающих векторов.
На фиг.2D показано подробное изображение, без соблюдения масштаба, 5 дополнительных стадий (D-H) прямого геномного замещения вариабельного генного локуса к легкой цепи иммуноглобулина мыши, которое приводит к вставке всех генных сегментов Vκ и Jκ человека в проксимальный повтор и делеции последней кассеты селекции (гибридный аллель 40hVκdHyg). Показаны генные сегменты иммуноглобулина человека (незакрашенные обозначения) и мыши (закрашенные обозначения) и дополнительные кассеты селекции (незакрашенные прямоугольники), вставленные последующими нацеливающими векторами.
На фиг.3А показано общее изображение положений наборов праймеров/зондов количественной ПЦР (кПЦР) для скрининга ES клеток в отношении вставки генных последовательностей тяжелой цепи человека и потери генных последовательностей тяжелой цепи мыши. Стратегия скрининга в ES клетках и мышах в отношении первой вставки гена тяжелой области человека показана с наборами праймеров/зондов кПЦр для удаленной области (зонды "потери" С и D), вставленной области (зонды "hIgH" G и Н) и фланкирующих областей (зонды "удерживания" А, В, Е и F) на немодифицированной мышиной хромосоме (вверху) и точно направленной хромосоме (внизу).
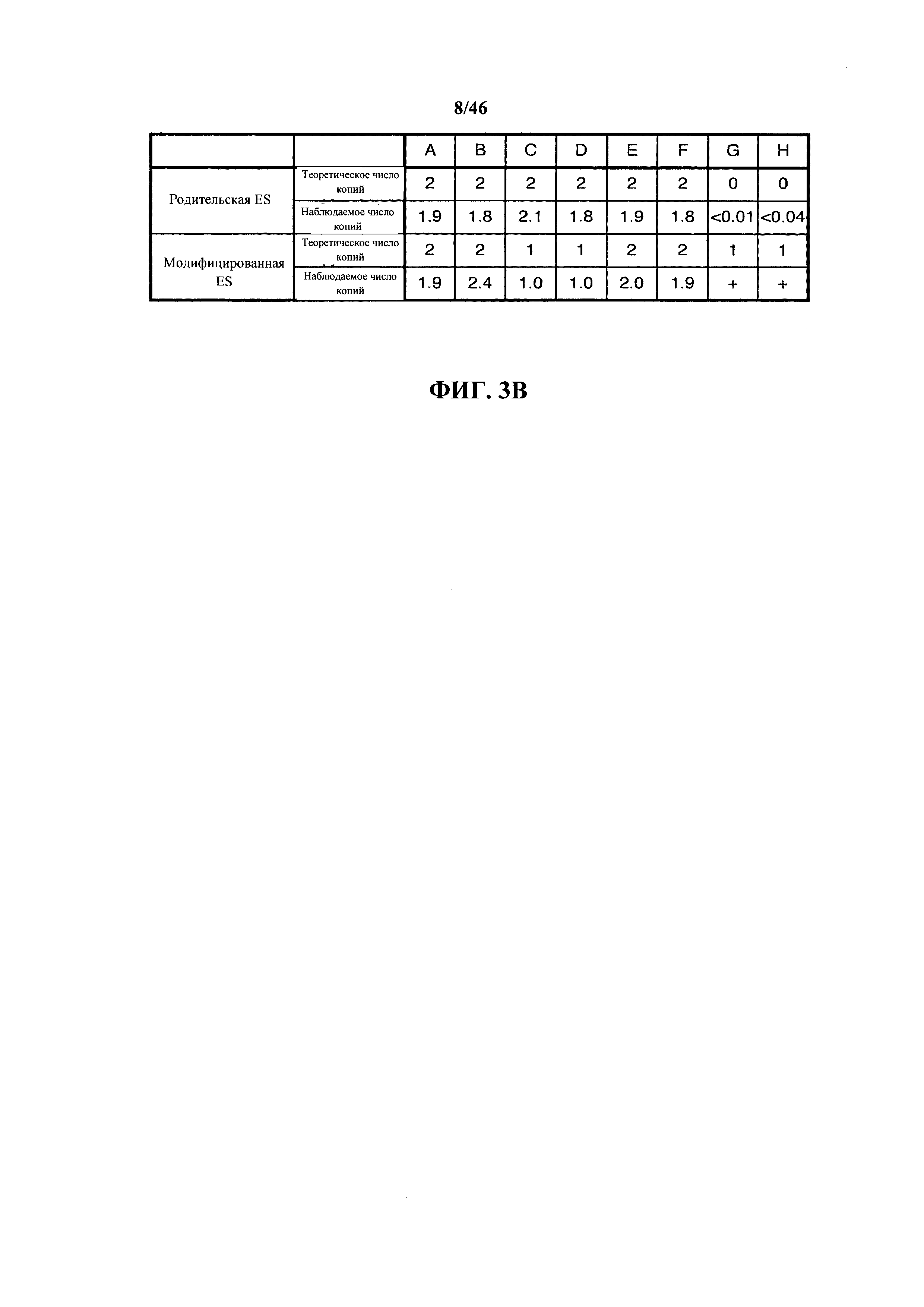
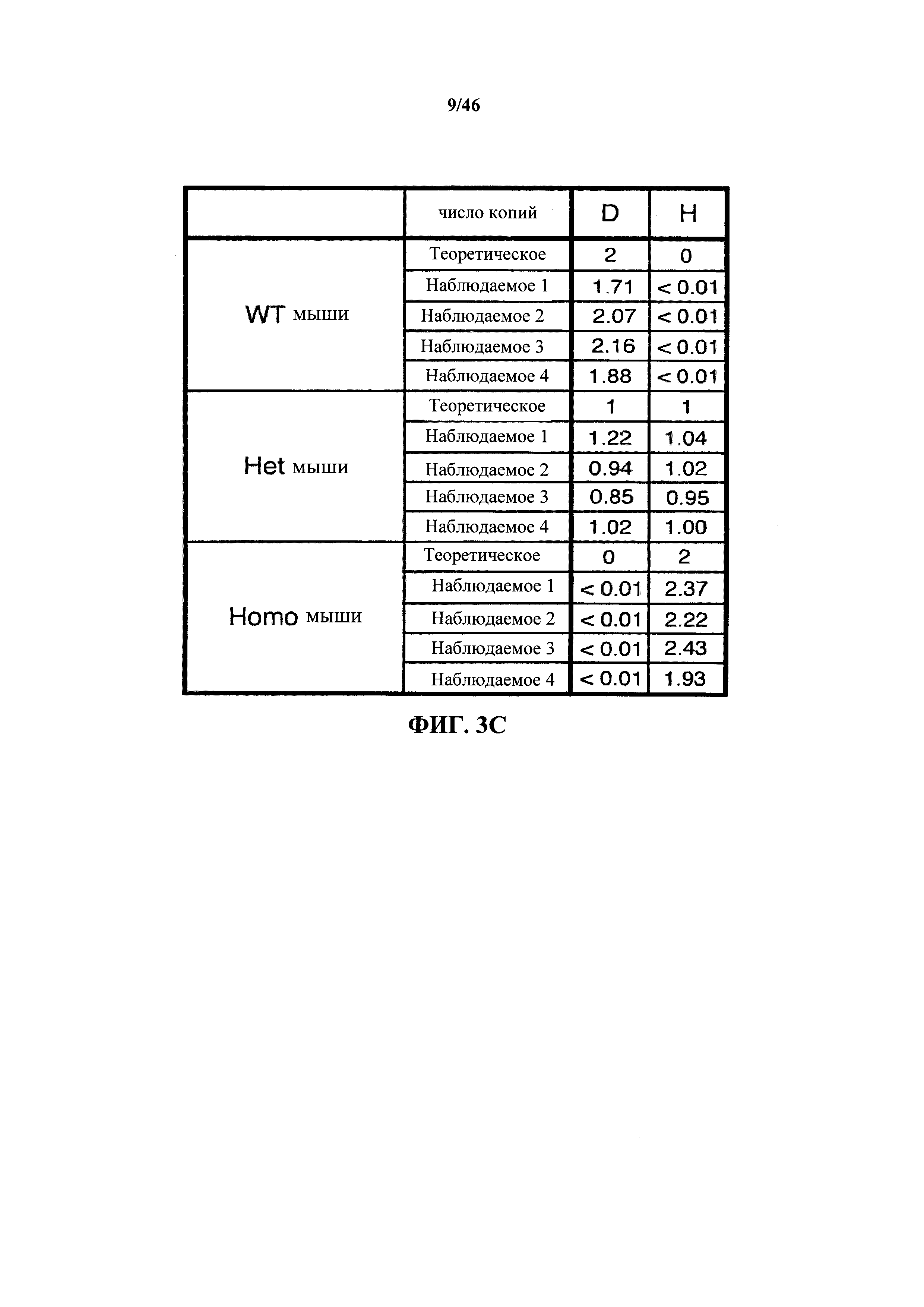
На фиг.3В показан репрезентативный расчет наблюдаемого числа копий зонда в родительских и модифицированных ES клетках для первой вставки генных сегментов тяжелой цепи иммуноглобулина человека. Наблюдаемое число копий зонда для зондов А-F рассчитывали как 2/2ΔΔCt ΔΔCt рассчитывают как ave[ΔCt(образец)-medΔCt(контроль)], где ΔCt представляет собой разницу в Ct между исследуемым и эталонным зондами (между 4 и 6 эталонными зондами в зависимости от анализа). Термин тесΔCt(контроль) представляет собой срединное значение ΔCt многочисленных (>60) ненацеленных образцов ДНК из родительских ES клеток. Каждый клон модифицированных ES клеток анализировали в шести параллельных испытаниях. Для расчета значений числа копий IgH зондов G и Н в родительских ES клетках принимали, что эти зонды характеризуются числом копий, равным 1 в модифицированных ES клетках и максимальный Ct, равный 35, использовали даже если не наблюдалось никакой амплификации.
На фиг.3С показан репрезентативный расчет значений числа копий для четырех мышей каждого генотипа, что рассчитывали аналогичным образом, используя только зонды D и Н. Мыши дикого типа: WT мыши; мыши, гетерозиготные в отношении первой вставки генных сегментов иммуноглобулина человека: НЕТ мыши; мыши, гомозиготные в отношении первой вставки генных сегментов иммуноглобулина человека: Homo мыши.
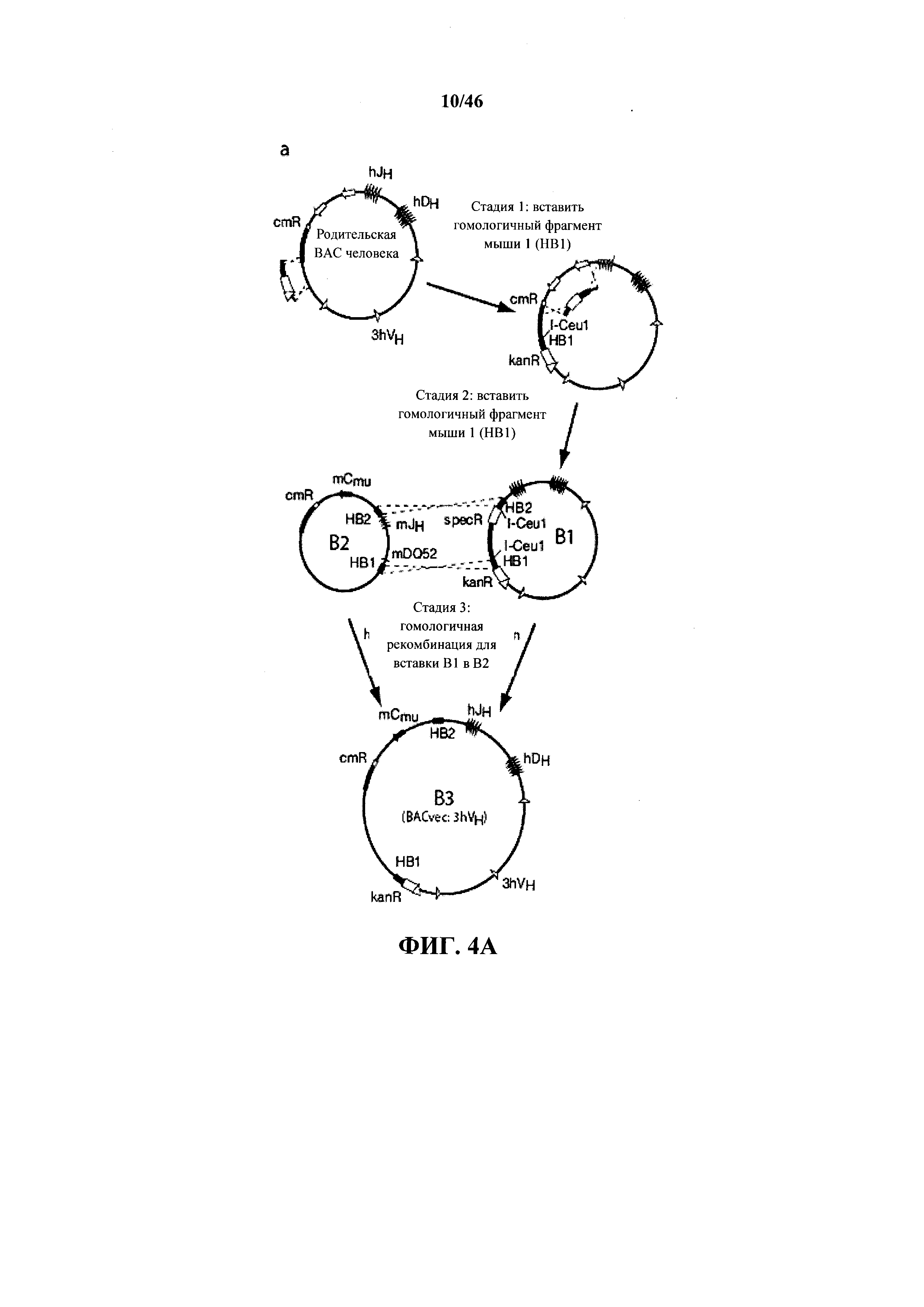
На фиг.4А показано изображение трех стадий, используемых для конструкции 3hVH BACvec с помощью бактериальная гомологичной рекомбинации (BHR). Показаны генные сегменты иммуноглобулина человека (незакрашенные обозначения) и мыши (закрашенные обозначения), кассеты селекции (незакрашенные прямоугольники) и сайты сайт-специфической рекомбинации (незакрашенные треугольники), вставленные из нацеливающих векторов.
На фиг.4В показан гель-электрофорез в пульсирующем поле (PFGE) трех клонов ВАС (B1, B2 и В3) после обработки NotI. Маркеры M1, M2 и М3 представляют собой маркеры низкого диапазона, среднего диапазона и лямбда лэддера PFG, соответственно (New England BioLabs, Ипсвич, Массачусетс).
На фиг.5А показано схематическое изображение, без соблюдения масштаба, последовательных модификаций локуса тяжелой цепи иммуноглобулина мыши с помощью возрастающих количеств генных сегментов тяжелой цепи иммуноглобулин человека. Гомозиготных мышей получали из каждой из трех различных стадий гуманизации тяжелой цепи. Незакрашенные обозначения отображают последовательность человека; закрашенные обозначения отображают последовательность мыши.
На фиг.5В показано схематическое изображение, без соблюдения масштаба, последовательных модификаций локуса к легкой цепи иммуноглобулина мыши с помощью возрастающих количеств генных сегментов D к легкой цепи иммуноглобулина человека. Гомозиготных мышей получали из каждой из трех различных стадий гуманизации D к легкой цепи. Незакрашенные обозначения отображают последовательность человека; закрашенные обозначения отображают последовательность мыши.
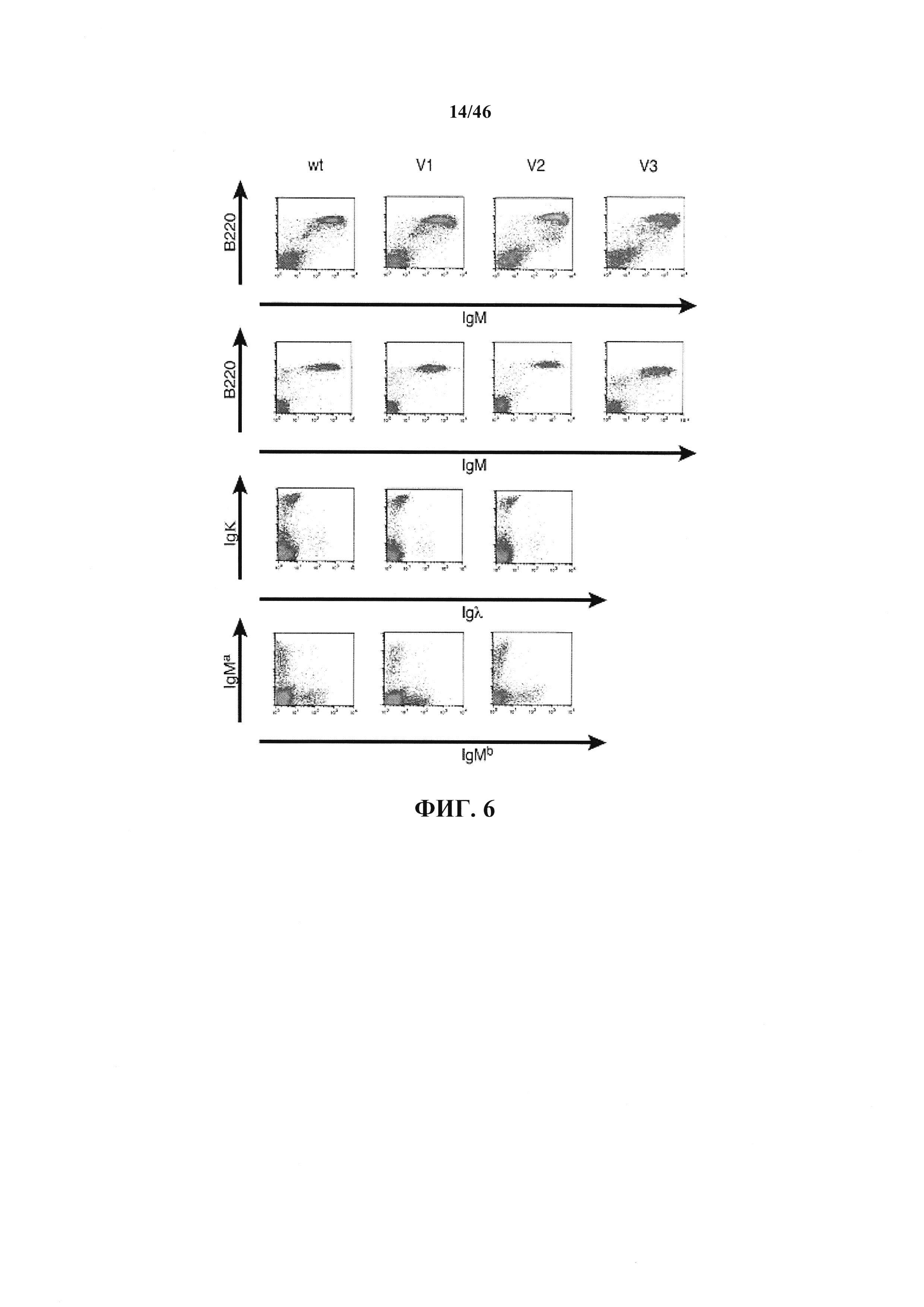
На фиг.6 показан точечные диаграммы FACS популяций В-клеток у мышей дикого типа и гуманизированных мышей VELOCIMMUNE®. Клетки из селезенки (верхний ряд, третий ряд сверху и нижний ряд) или пахового лимфатического узла (второй ряд сверху) мышей дикого типа (wt) или VELOCIMMUNE® 1 (V1), VELOCIMMUNE® 2 (V2) или VELOCIMMUNE® 3 (V3) окрашивали в отношении экспрессирующих поверхностный IgM В-клеток (верхний ряд, и второй ряд сверху), поверхностный иммуноглобулин, содержащий или к или λ легкие цепи (третий ряд сверху) или поверхностный IgM специфических гаплотипов (нижний ряд), и популяции разделяли с помощью FACS.
На фиг.7А показаны репрезентативные последовательности CDR3 тяжелой цепи выбранных произвольно антител VELOCIMMUNE® около участка соединения VH-DH-JH (CDR3), демонстрирующие множественность сегментов J и нуклеотидные вставки. Последовательности CDR3 тяжелой цепи группируются согласно частоте использования генного сегмента DH, зародышевая линия которого приведена над каждой группой жирным шрифтом. Генные сегменты VH для каждой последовательности CDR3 тяжелой цепи указаны в скобках на 5' конце каждой последовательности (например, 3-72 представляет собой VH3-72 человека). Генные сегменты JH для каждой CDR3 тяжелой цепи указаны в скобках на 3' конце каждой последовательности (например, 3 представляет собой JH3 человека). SEQ ID NO для каждой представленной последовательности являются следующими, приведенными сверху вниз: SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:23; SEQ ID NO:24; SEQ ID NO:25; SEQ ID NO:26; SEQ ID NO:27; SEQ ID NO:28; SEQ ID NO:29; SEQ ID NO:30; SEQ ID NO:31; SEQ ID NO:32; SEQ ID NO:33; SEQ ID NO:34; SEQ ID NO:35; SEQ ID NO:36; SEQ ID NO:37; SEQ ID NO:38; SEQ ID NO:39.
На фиг.7В показаны репрезентативные последовательности CDR3 легкой цепи выбранных произвольно антител VELOCIMMUNE® около участка соединения Vκ-Jκ (CDR3), демонстрирующие множественность сегментов J и нуклеотидные вставки. Генные сегменты Vκ для каждой последовательности CDR3 легкой цепи указаны в скобках на 5' конце каждой последовательности (например, 1-6 представляет собой Vκ1-6 человека). Генные сегменты Jκ для каждой CDR3 легкой цепи указаны в скобках на 3' конце каждой последовательности (например, 1 представляет собой Jκ1 человека). SEQ ID NO для каждой представленной последовательности являются следующими, приведенными сверху вниз: SEQ ID NO:40; SEQ ID NO:41; SEQ ID NO:42; SEQ ID NO:43; SEQ ID NO:44; SEQ ID NO:45; SEQ ID NO:46; SEQ ID NO:47; SEQ ID NO:48; SEQ ID NO:49; SEQ ID NO:50; SEQ ID NO:51; 31 SEQ ID NO:52; SEQ ID NO:53; SEQ ID NO:54; SEQ ID NO:55; SEQ ID NO:56; SEQ ID NO:57; SEQ ID NO:58.
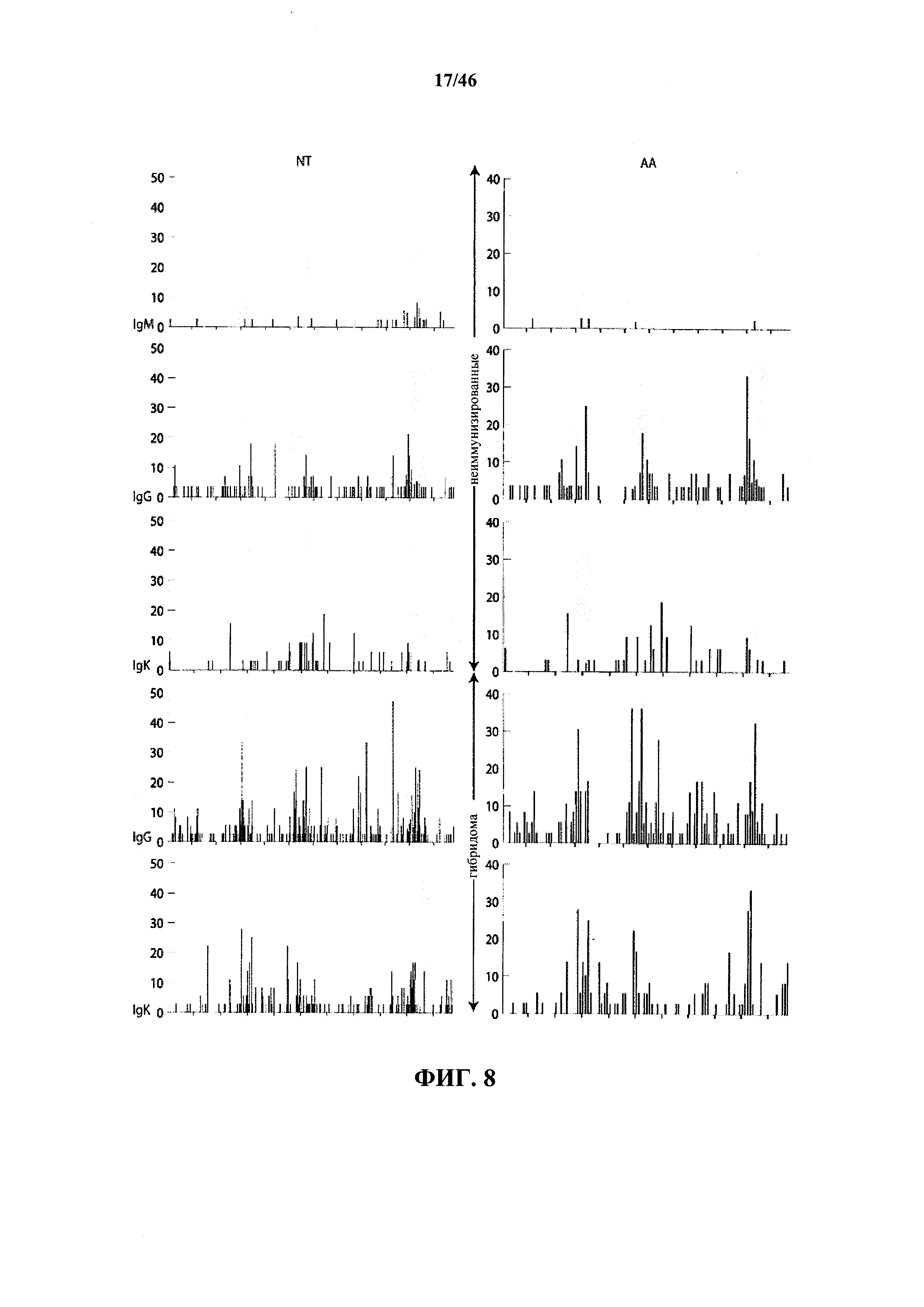
На фиг.8 показаны частоты соматических гипермутаций тяжелых и легких цепей антител VELOCIMMUNE®, подсчитанные (после выравнивания с совпадающими зародышевыми последовательностями) как процент измененных последовательностей на каждом нуклеотидном (NT; левая колонка) или аминокислотном положении (АА; правая колонка) среди наборов из 38 (неиммунизированный IgM), 28 (неиммунизированный IgG), 32 (неиммунизированная IgK из IgG), 36 (иммунизированный IgG) или 36 (иммунизированная IgK из IgG) последовательностей. Заштрихованные столбики указывают на положения CDR.
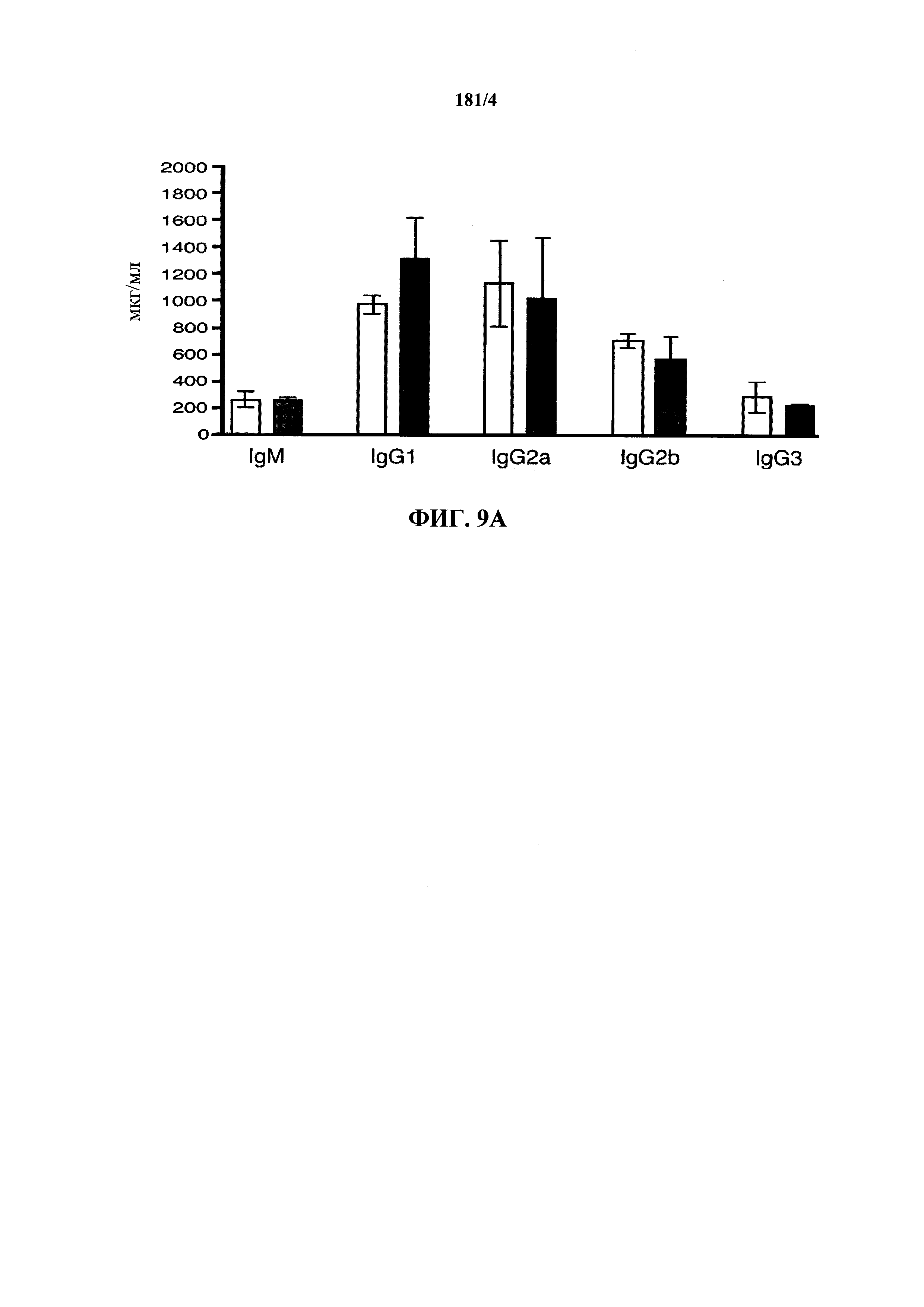
На фиг.9А показаны уровни иммуноглобулина в сыворотке для изотипов IgM и IgG у мышей дикого типа (белые столбики) или VELOCIMMUNE® (окрашенные столбики).
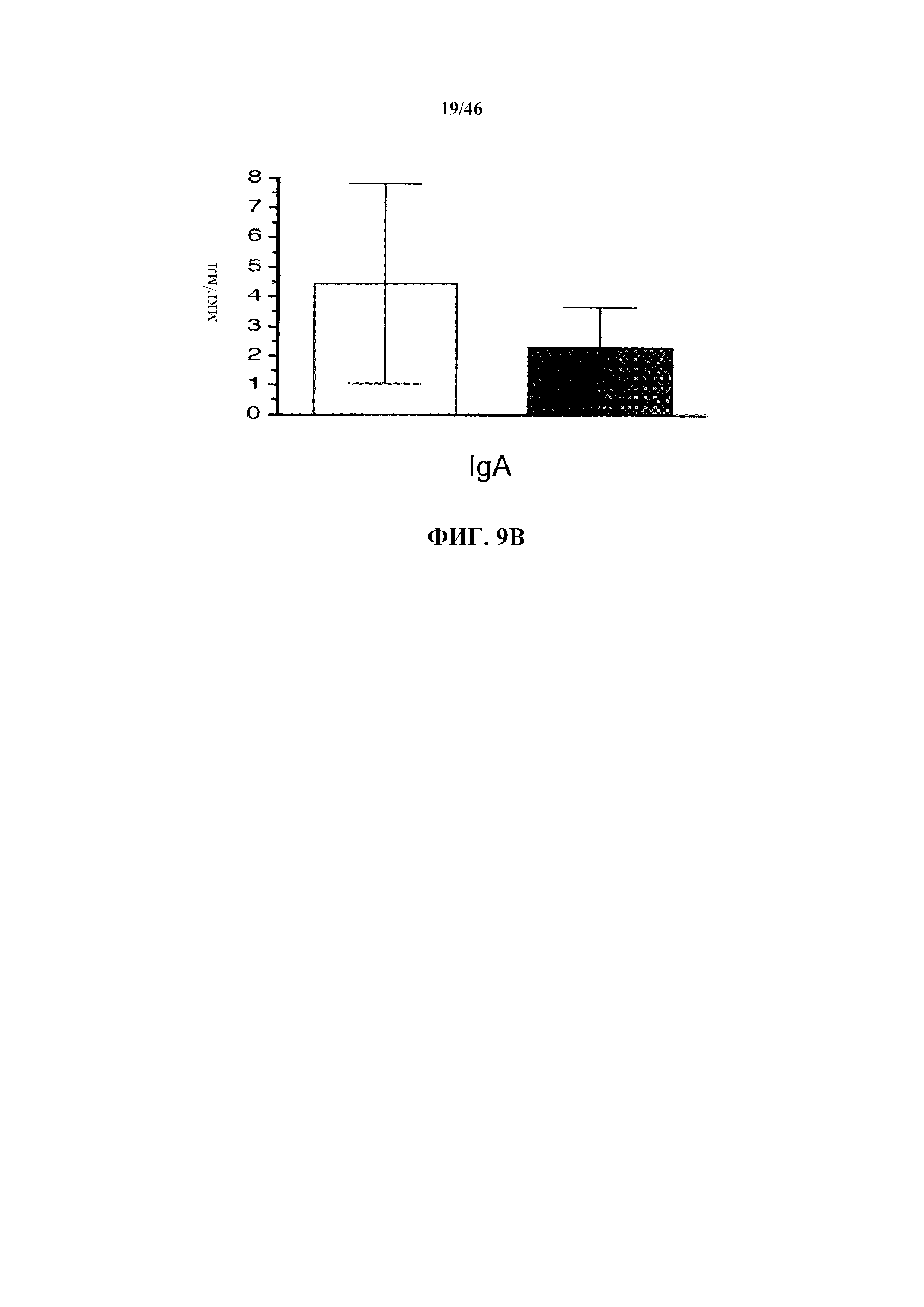
На фиг.9В показаны уровни иммуноглобулина в сыворотке для изотипа IgA у мышей дикого типа (белые столбики) или VELOCIMMUNE® (окрашенные столбики).
На фиг.9С показаны уровни иммуноглобулина в сыворотке для изотипа IgE у мышей дикого типа (белые столбики) или VELOCIMMUNE® (окрашенные столбики).
На фиг.10А показаны титры антиген-специфических IgG к рецептору интерлейкина-6 в сыворотке семи мышей VELOCIMMUNE® (V1) и пяти мышей дикого типа (WT) после двух (кровопускание 1) или трех (кровопускание 2) циклов иммунизации с помощью экто домена рецептора интерлейкина-6.
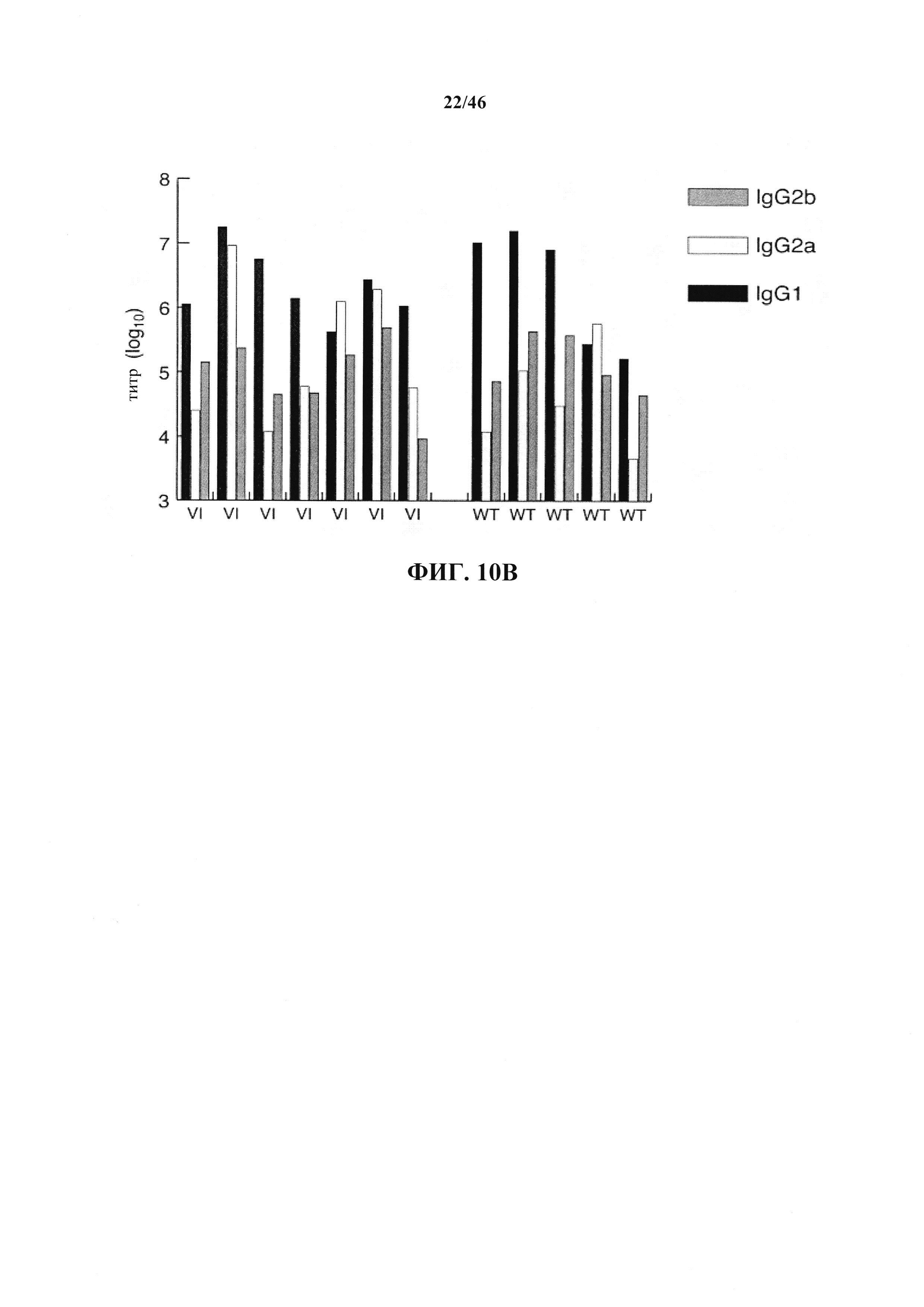
На фиг.10 В показаны титры специфических изотипов IgG, специфических к рецептору интерлейкина-6 от семи мышей VELOCIMMUNE® (VI) и пяти мышей дикого типа (WT).
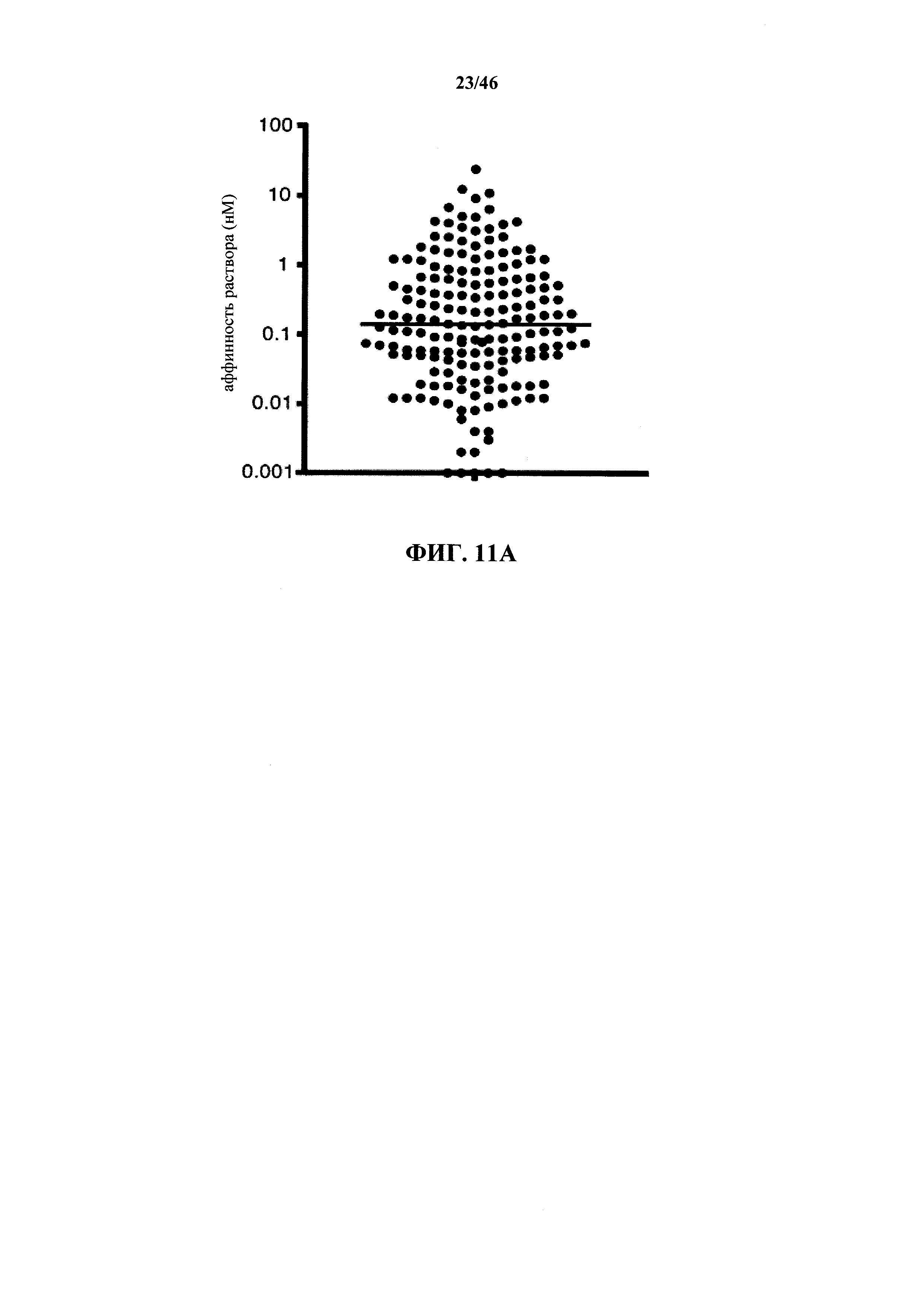
На фиг.11А показано распределение аффинности моноклональных антител к рецептору интерлейкина-6, образованных у мышей VELOCIMMUNE®.
На фиг.11В показано антиген-специфическое блокирование моноклональных антител к рецептору интерлейкина-6, образованных у мышей VELOCIMMUNE® (V1) и мышей дикого типа (WT).
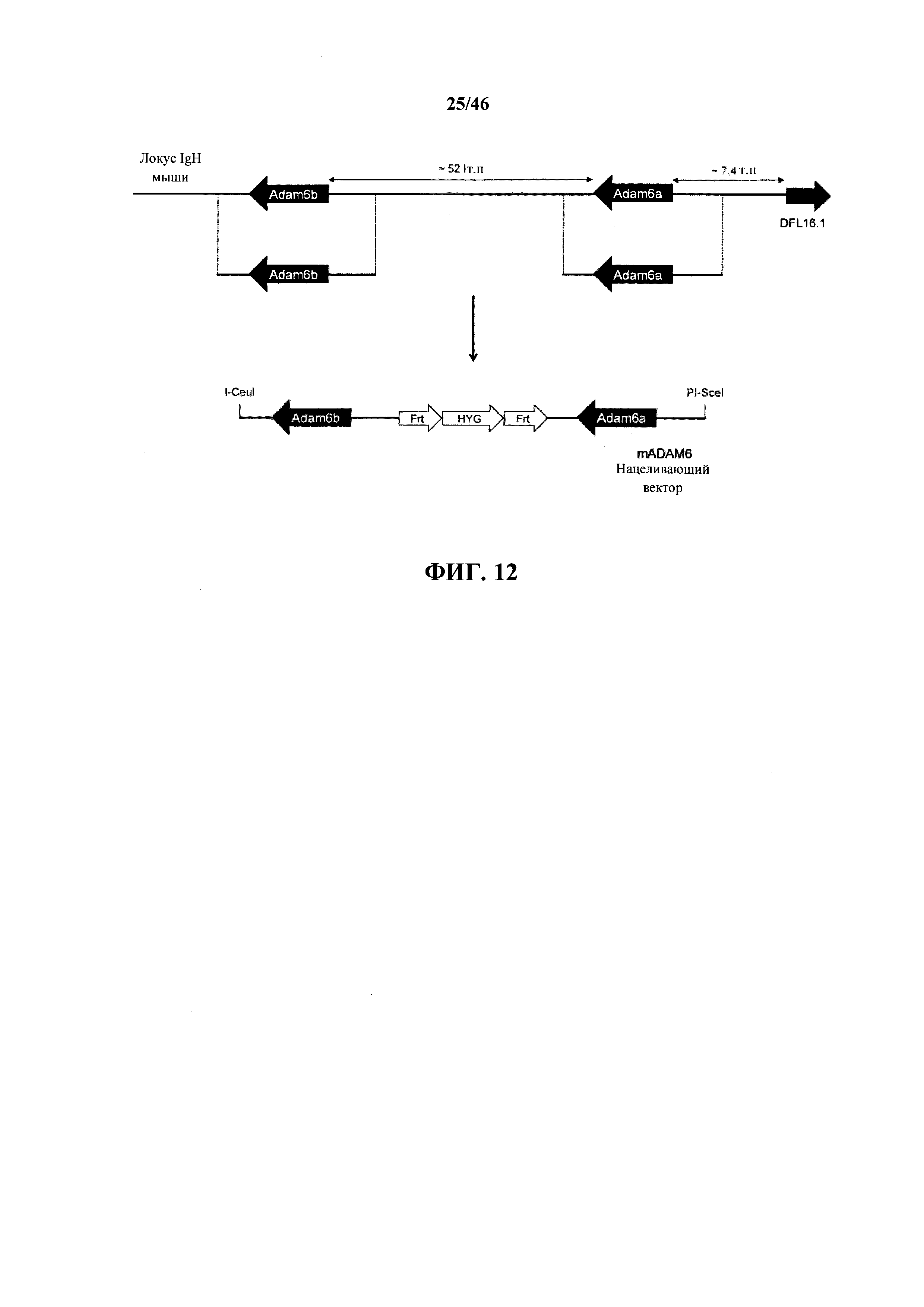
На фиг.12 показано схематическое изображение, без соблюдения масштаба, генов ADAM6a и ADAM6b мыши на локусе тяжелой цепи иммуноглобулина мыши. Нацеливающий вектор (нацеливающий вектор mADAM6), используемый для вставки ADAM6a и ADAM6b мыши в гуманизированный эндогенный локус тяжелой цепи, показан с кассетой селекции (HYG: гигромицин), фланкированной сайтами сайт-специфической рекомбинации (Frt), включающими сконструированные сайты рестрикции на 5' и 3' концах.
На фиг.13 показано схематическое изображение, без соблюдения масштаба, псевдогена ADAM6 человека (hADAM6Ψ), расположенного между вариабельными генными сегментами 1-2 (VH1-2) и 6-1 (VH6-1) тяжелой цепи человека. Нацеливающий вектор для бактериальной гомологичной рекомбинации нацеливающий вектор (hADAM6Ψ) для делеции псевдогена ADAM6 человека и вставки уникальных сайтов рестрикции на локус тяжелой цепи человека показан с кассетой селекции (NEO: неомицин), фланкированной сайтами сайт-специфической рекомбинации (loxP), включающих сконструированные сайты рестрикции на 5' и 3' концах. Показано изображение, без соблюдения масштаба, полученного нацеленного гуманизированного локуса тяжелой цепи, содержащего геномный фрагмент, который кодирует гены ADAM6a и ADAM6b мыши, включая кассету селекции, фланкированную сайтами сайт-специфической рекомбинации.
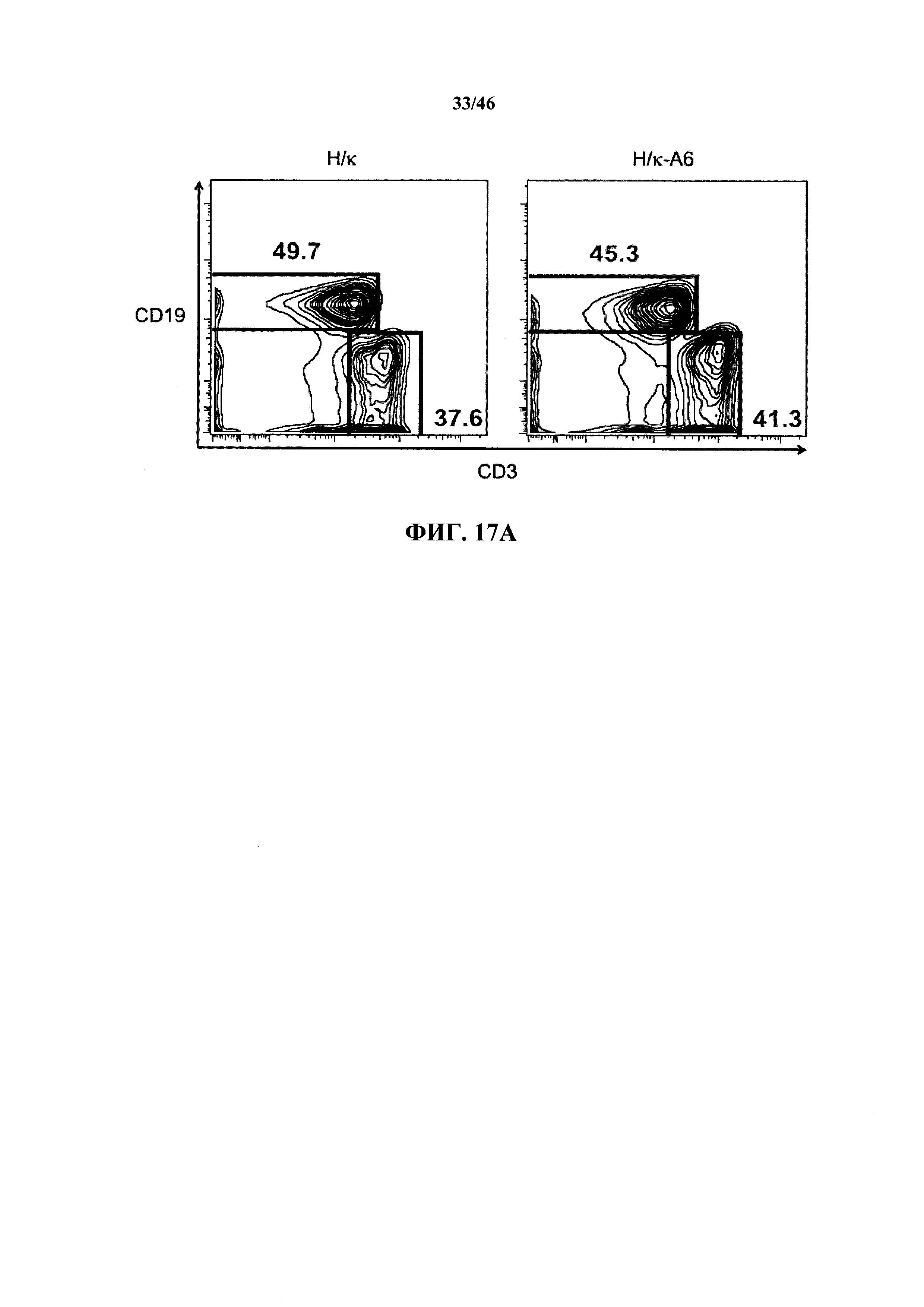
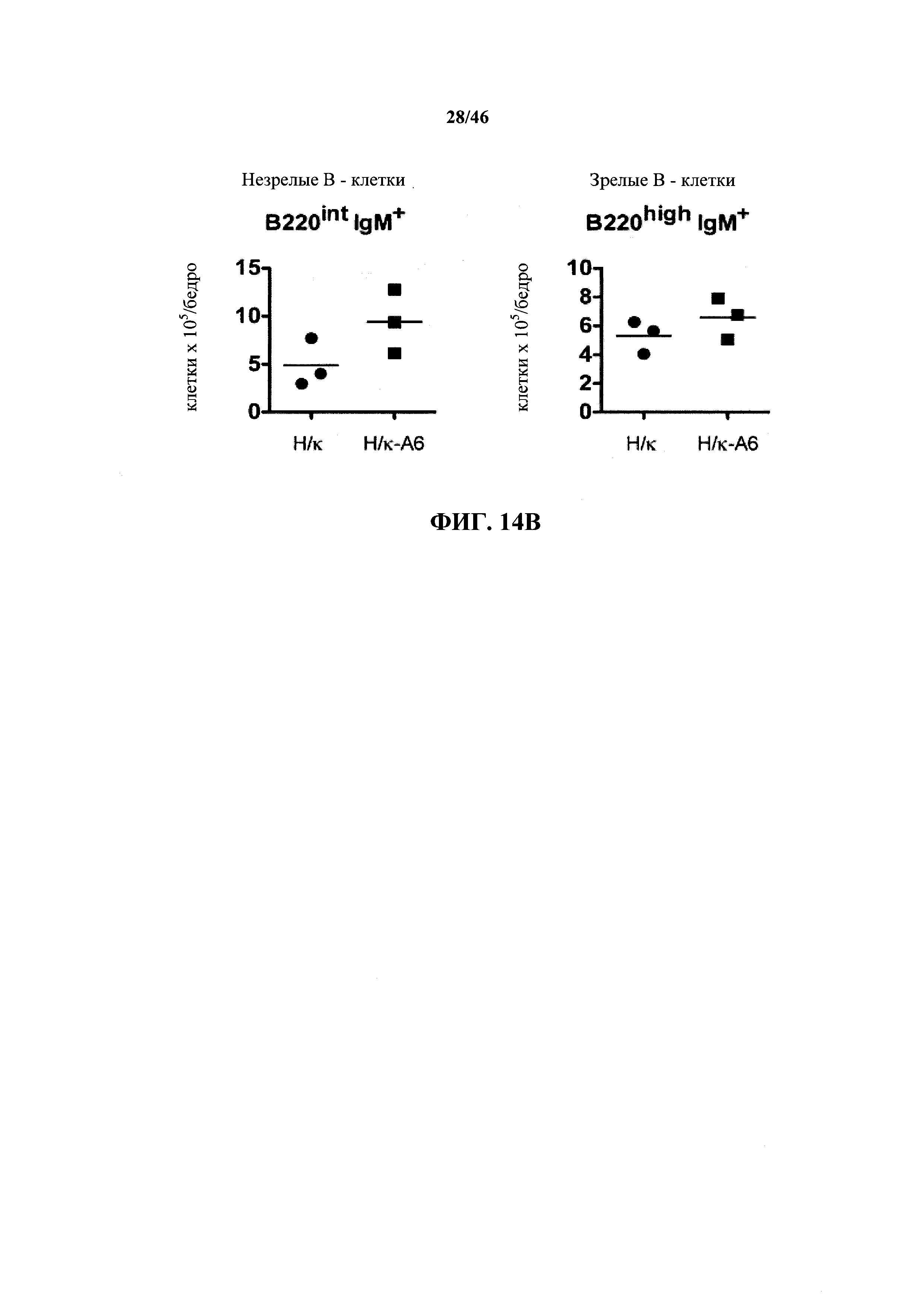
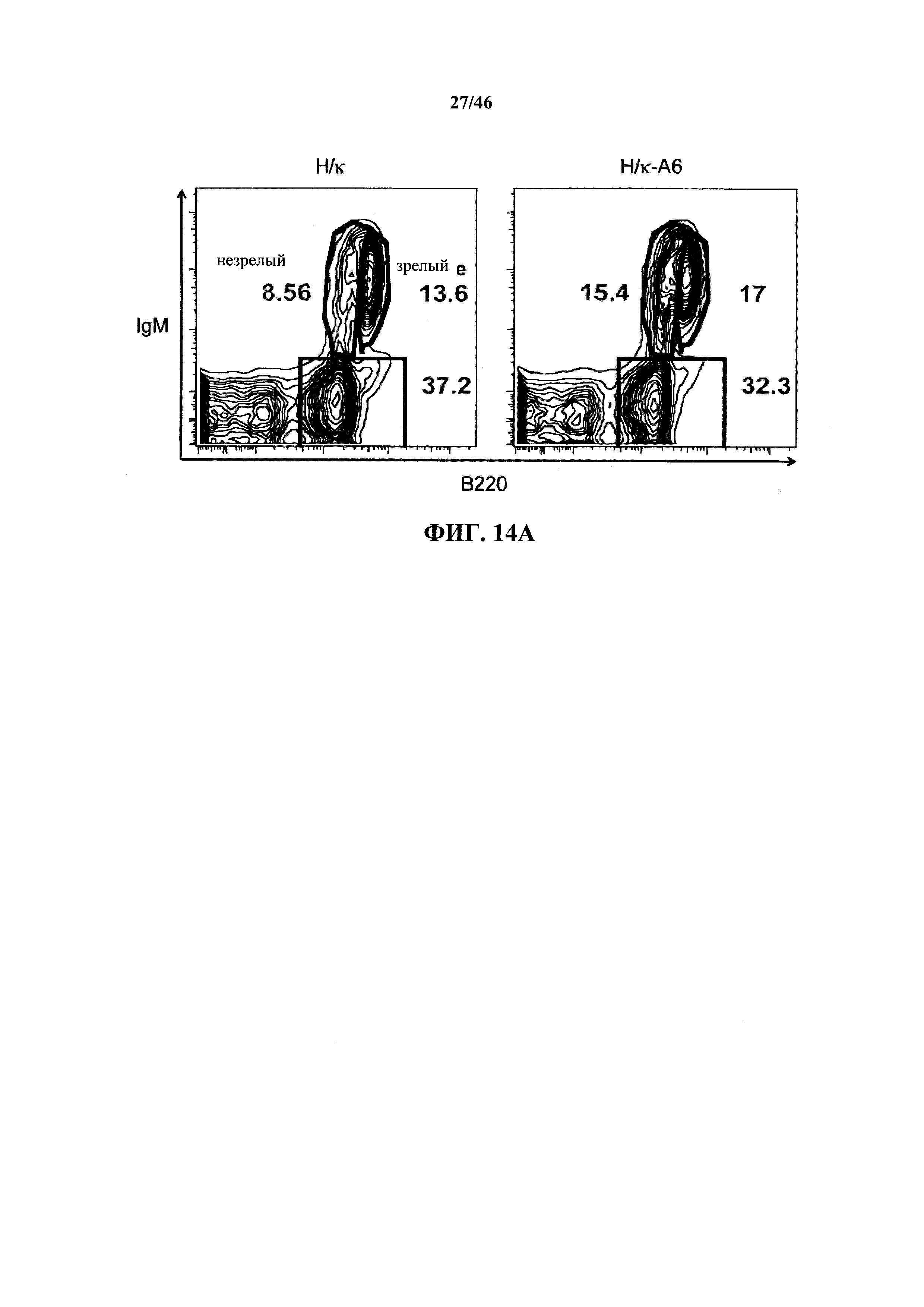
На фиг.14А показаны контурные графики FACS лимфоцитов, дающих сигнал выше порогового значения на синглетах в отношении поверхностной экспрессии IgM и В220 в костном мозге мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека (Н/к) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепей человека, содержащих вставленный геномный фрагмент мыши, содержащий гены ADAM6 мыши (Н/к-А6). Процентное отношение незрелых (B220intIgM+) и зрелых (B220highIgM+) В-клеток указано на каждом контурном графике.
На фиг.14В показано общее количество незрелых (B220intIgM+) и зрелых (B220highIgM+) В-клеток в костном мозге, выделенном из бедренных костей мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека (Н/κ) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, кодирующий гены ADAM6 мыши (Н/κ-А6).
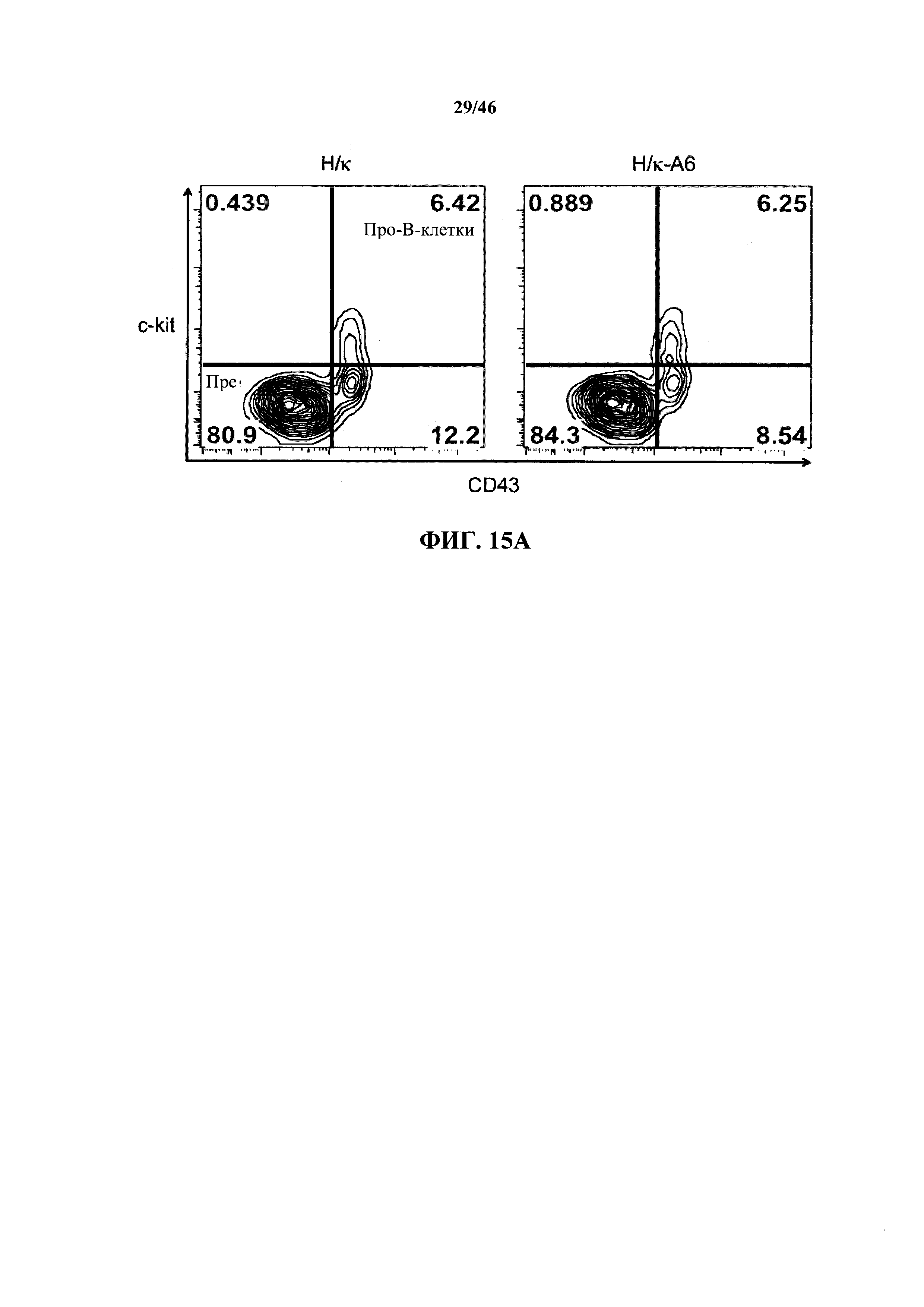
На фиг.15А показаны контурные графики FACS дающих сигнал CD19+ выше порогового значения В-клеток в отношении поверхностной экспрессии c-kit и CD43 в костном мозге мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека (Н/κ), и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, кодирующий гены ADAM6 мыши (Н/κ-А6). Процентное отношение про-В (CD19+CD43+ckit+) и пре-В (CD19+CD43-ckit-) клеток указано в верхнем правом и нижнем левом квадрантах, соответственно, каждого контурного графика.
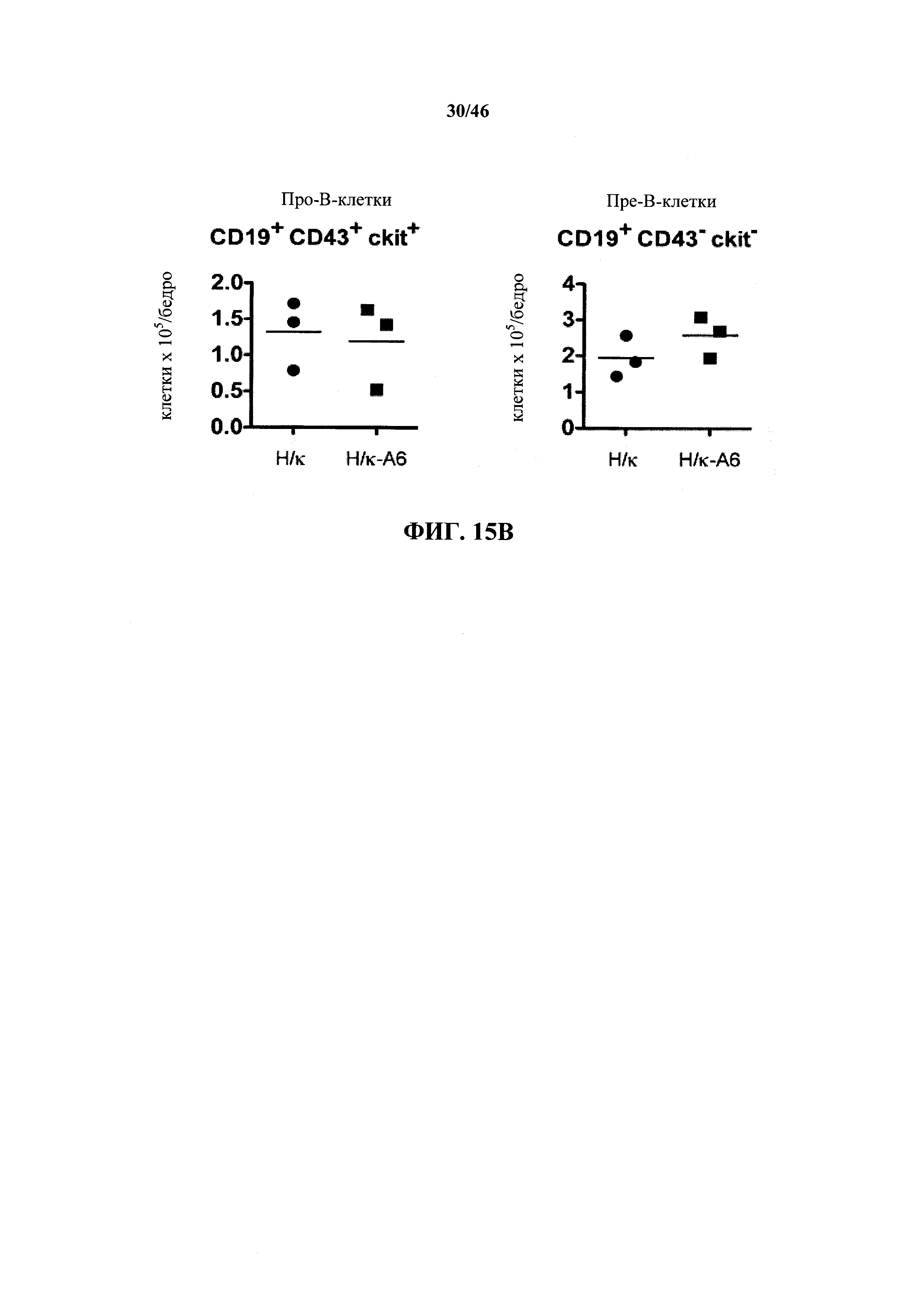
На фиг.15В показано общее количество про-В-клеток (CD19+CD43+ckit+) и пре-В-клеток (CD19+CD43+ckit-) в костном мозге, выделенном из бедренных костей мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и κ легкой цепи человека (Н/κ) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека, содержащих эктопический мыши геномный фрагмент мыши, содержащий гены ADAM6 мыши (Н/κ-А6).
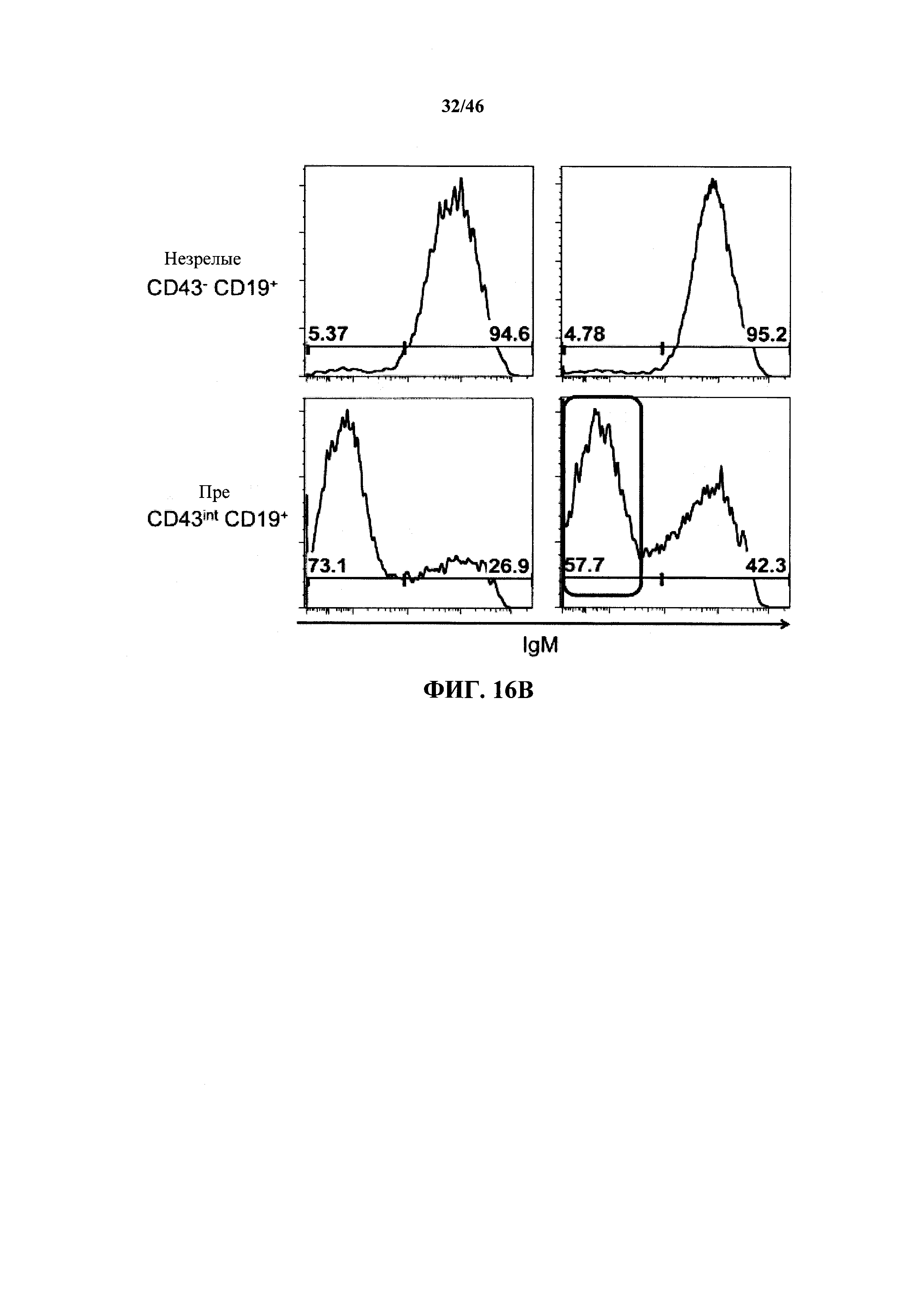
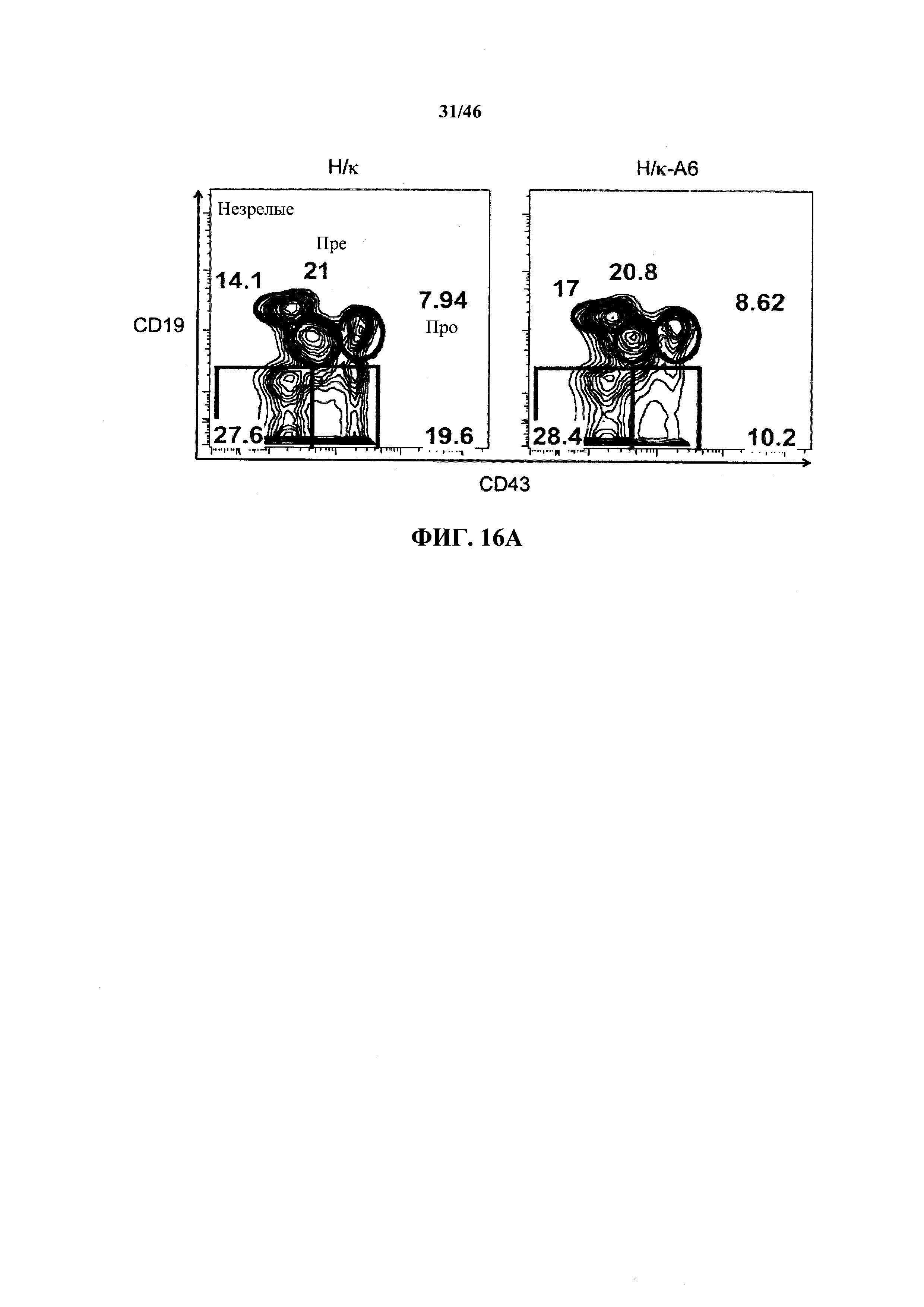
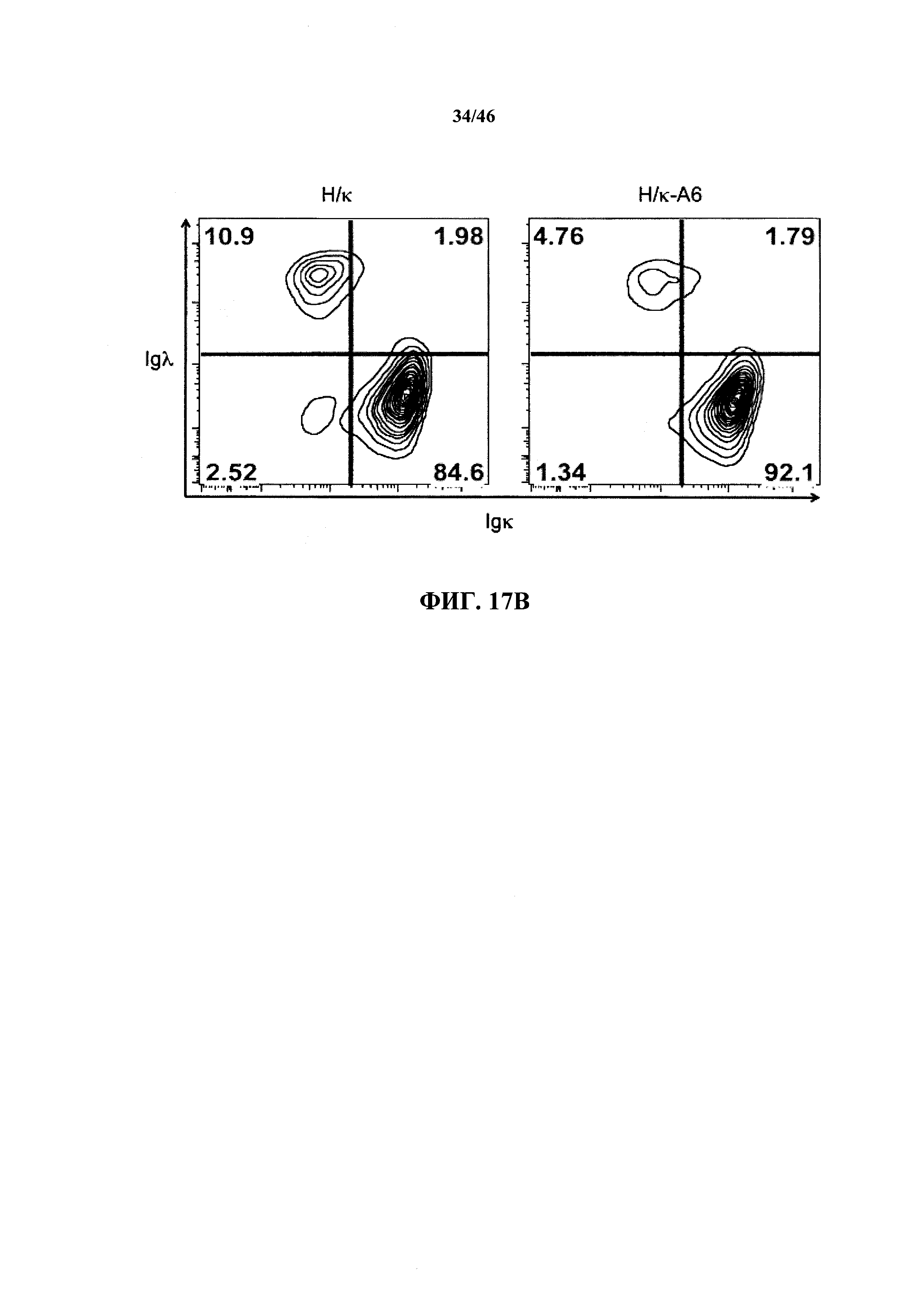
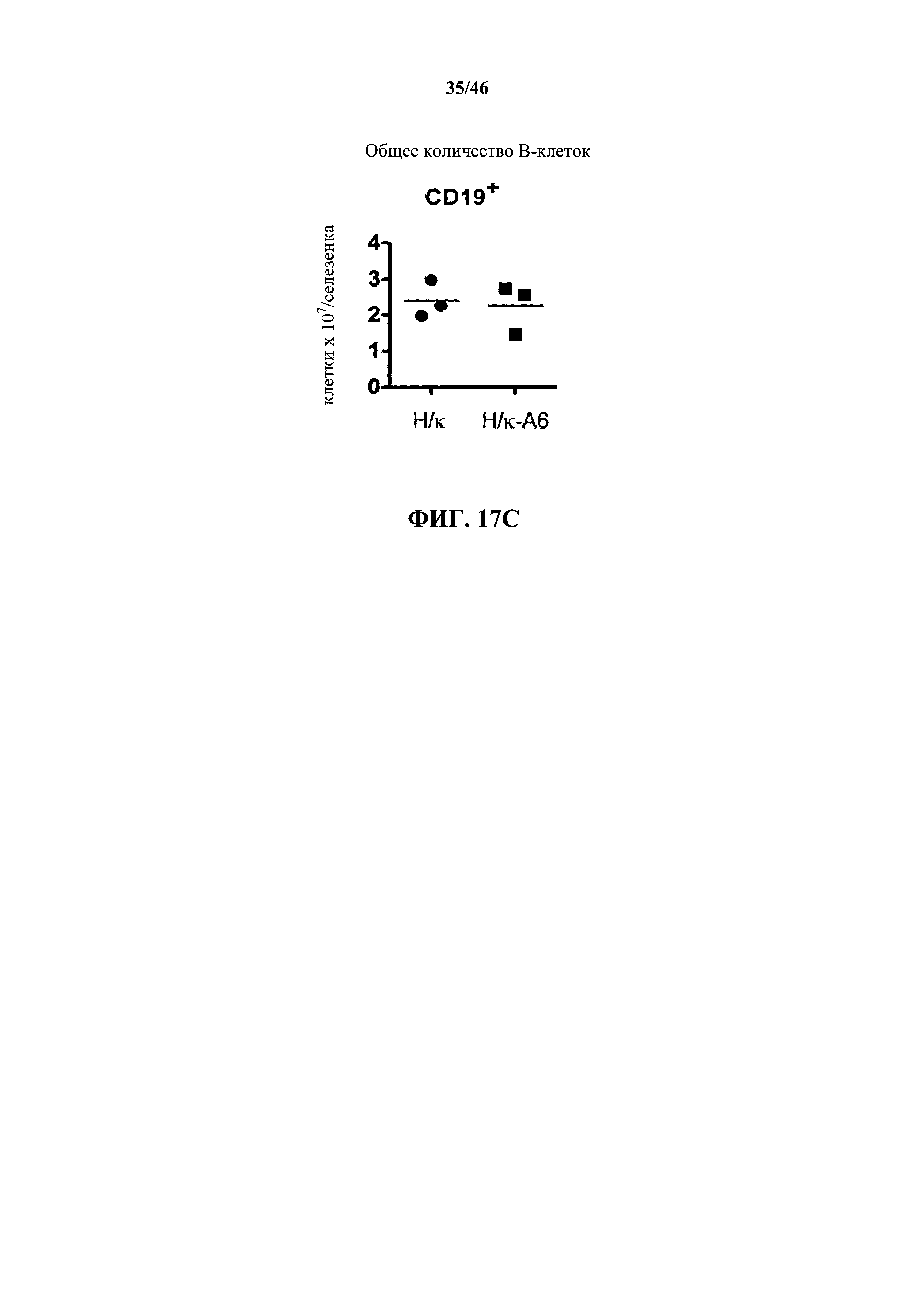
На фиг.16А показаны контурные графики FACS лимфоцитов, выделенных путем гейтирования из пула клеток с одним логическим ограничением в отношении поверхностной экспрессии CD19 и CD43 в костном мозге мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и κ легкой цепи человека (Н/κ) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, кодирующий гены ADAM6 мыши (Н/к-Аб). Процентное отношение незрелых В (CD19+CD43-), пре-В (CD19+CD43int) и про-В (CD19+CD43+) клеток указано на каждом контурном графике.
На фиг.16В показаны гистограммы незрелых В (CDl9+CD43-) и пре-В (CD19+CD43int) клеток в костном мозге мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека (Н/κ) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, кодирующий гены ADAM6 мыши (Н/κ-А6).
На фиг.17А показаны контурные графики FACS лимфоцитов, выделенных путем гейтирования из пула клеток с одним логическим ограничением в отношении поверхностной экспрессии CD19 и CD3 в спленоцитах мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека (Н/κ) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, кодирующий гены ADAM6 мыши (Н/κ-А6). Процентное отношение В (CD19+CD3-) и Т (CD19-CD3+) клеток указано на каждом контурном графике.
На фиг.17В показаны контурные графики FACS выделенных путем гейтирования из пула CD19+ В-клеток с одним логическим ограничением в отношении поверхностной экспрессии Igλ и Igκ легких цепей в селезенке мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека (Н/κ) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, содержащий гены ADAM6 мыши (Н/κ-А6). Процентное отношение Igλ+ (верхний левый квадрант) и Igκ+ (нижний правый квадрант) В-клеток указан на каждом контурном графике.
На фиг.17С показано общее количество CD19+ В-клеток в селезенке мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека (Н/κ) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, содержащий гены ADAM6 мыши (Н/κ-А6).
На фиг.18А показаны контурные графики FACs дающих сигнал CD19+ выше порогового значения В-клеток в отношении поверхностной экспрессии IgD и IgM в селезенке мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека (Н/κ) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, содержащий гены ADAM6 мыши (Н/κ-А6). Процентное отношение зрелых В-клеток (CD19+IgDhighIgMint) указано на каждом контурном графике. Стрелка на правом контурном графике иллюстрирует процесс созревания В-клеток по отношению к поверхностной экспрессии IgM и IgD.
На фиг.18В показано общее количество В-клеток в селезенке мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека (Н/κ) и мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, кодирующий гены ADAM6 мыши (Н/κ-А6) в ходе созревания от CD19+IgMhighIgDlnt до CD19+IgMintIgDhigh.
На фиг.19 показана стратегия выбора цели для замещения эндогенных генных сегментов вариабельной области легкой цепи иммуно глобулина мыши генной областью Vκ1-39Jκ5 человека.
На фиг.20 показана стратегия выбора цели для замещения эндогенных генных сегментов вариабельной области легкой цепи иммуноглобулина мыши генной областью Vκ3-20Jκ1 человека.
На фиг.21 показана стратегия выбора цели для замещения эндогенных генных сегментов вариабельной области легкой цепи иммуноглобулина мыши генной областью Vnpe-B/Jλ5 человека.
На фиг.22 показан процент CD19+ В-клеток (y-ось) из периферической крови мышей дикого типа (WT), мышей, гомозиготных в отношении сконструированной реаранжированной области Vκ1-39Jκ5 легкой цепи человека (Vκ1-39Jκ5 НО) и мышей, гомозиготных в отношении сконструированной реаранжированной области Vκ3-20Jκ1 легкой цепи человека (Vκ3-20Jκ1 НО).
На фиг.23А показана относительная экспрессия мРНК (y-ось) происходящей из Vκ1-39 легкой цепи в анализе количественной ПЦР с использованием зондов, специфических для участка соединения сконструированной реаранжированной области Vκ1-39Jκ5 легкой цепи человека (зонд участка соединения Vκ1-39Jκ5) и генного сегмента Vκ1-39 человека (зонд Vκ1-39) у мыши, гомозиготной в отношении замещения эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (Нκ), мыши дикого типа (WT) и мыши, гетерозиготной в отношении сконструированной реаранжированной области Vκ1-39Jκ5 легкой цепи человека (Vκ1-39Jκ5 НЕТ). Сигналы нормируются по отношению к экспрессии Сκ мыши. N.D.: не обнаружено.
На фиг.23В показана относительная экспрессия мРНК (y-ось) происходящей из Vκ1-39 легкой цепи в анализе количественной ПЦР с использованием зондов, специфических для участка соединения сконструированной реаранжированной области Vκ1-39Jκ5 легкой цепи человека (зонд участка соединения Vκ1-39Jκ5) и генного сегмента Vκ1-39 человека (зонд Vκ1-39) у мыши, гомозиготной в отношении замещения эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (Нκ), мыши дикого типа (WT) и мыши, гомозиготной в отношении сконструированной реаранжированной области Vκ1-39Jκ5 легкой цепи человека (Vκ1-39Jκ5 НО). Сигналы нормируются по отношению к экспрессии Сκ мыши.
На фиг.23С показана относительная экспрессия мРНК (y-ось) происходящей из Vκ3-20 легкой цепи в анализе количественной ПЦР с использованием зондов, специфических для участка соединения сконструированной реаранжированной области Vκ3-20Jκ1 легкой цепи человека (зонд участка соединения Vκ3-20Jκ1) и генного сегмента Vκ3-20 человека (зонд Vκ3-20) у мыши, гомозиготной в отношении замещения эндогенных генных сегментов Vκ и Jκ генными сегментами Vκ и Jκ человека (Нκ), мыши дикого типа (WT) и мыши, гетерозиготной (НЕТ) и гомозиготной (НО) в отношении сконструированной реаранжированной области Vκ3-20Jκ1 легкой цепи человека. Сигналы нормируются по отношению к экспрессии Сκ мыши.
На фиг.24А показан титр IgM (слева) и IgG (справа) у мышей дикого типа (WT; N=2) и мышей, гомозиготных в отношении сконструированной реаранжированной области Vκ1-39Jκ5 легкой цепи человека (Vκ1-39Jκ5 НО; N=2), иммунизированных с помощью β-галактозидазы.
На фиг.24В показан общий титр иммуноглобулинов (IgM, IgG, IgA) у мышей дикого типа (WT; N=5) и мышей, гомозиготных в отношении сконструированной реаранжированной области Vκ3-20Jκ1 легкой цепи человека (Vκ3-20Jκ1 НО; N=5), иммунизированных с помощью β-галактозидазы.
Подробное описание настоящего изобретения
Используемый в настоящем документе термин "антитело" включает молекулы иммуноглобулина, содержащие четыре полипептидных цепи, две тяжелых (Н) цепи и две легких (L) цепи, взаимосвязанных дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область (VH) тяжелой цепи и константную область (СН) тяжелая цепь. Константная область тяжелой цепи содержит три домена, СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область (VL) легкой цепи и константную область (CL) легкой цепи. Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, имеющих название определяющие комплементарность области (CDR), чередующиеся с областями, которые являются более консервативными, имеющими название каркасные области (FR). Каждая VH и VL содержит три CDR и четыре FR, расположенные от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (CDR тяжелой цепи могут иметь сокращение HCDR1, HCDR2 и HCDR3; CDR легкой цепи могут иметь сокращение LCDR1, LCDR2 и LCDR3. Термин антитело с "высокой аффинностью" относится к антителу, которое характеризуется Ко по отношению к его целевому эпитопу, составляющей приблизительно 10"9 М или ниже (например, приблизительно 1×10-9 M, 1×10-10 M, 1×10-11 M или приблизительно 1×10-12 М). Согласно одному варианту осуществления KD измеряют с помощью поверхностного плазменного резонанса, например, BIACORE™; согласно другому варианту осуществления KD измеряют с помощью ELISA.
Фраза "биспецифическое антитело" включает антитело, способное к селективному связыванию двух или более эпитопов. Биспецифические антитела, как правило, содержат две неидентичных тяжелых цепи, причем каждая тяжелая цепь специфически связывает различный эпитоп - или на двух различных молекулах (например, различные эпитопы на двух различных иммуногенах), или на одной молекуле (например, различные эпитопы на одном иммуногене). Если биспецифическое антитело способно к селективному связыванию двух различных эпитопов (первого эпитопа и второго эпитопа), то аффинность первой тяжелой цепи к первому эпитопу будет, как правило, по меньшей мере на один - два или три или четыре или более порядков величин ниже, чем аффинность первой тяжелой цепи ко второму эпитопу, и наоборот. Эпитопы, специфически связанные биспецифическим антителом, могут присутствовать на одинаковой или отличающейся мишени (например, на одинаковом или отличающемся белке). Биспецифические антитела могут быть получены, например, путем комбинации тяжелых цепей, которые распознают различные эпитопы одного иммуногена. Например, последовательности нуклеиновых кислот, кодирующие вариабельные последовательности тяжелой цепи, которые распознают различные эпитопы одного иммуногена, могут быть слиты с последовательностями нуклеиновых кислот, кодирующими одинаковые или различные константные области тяжелой цепи, и такие последовательности могут быть экспрессированы в клетке, которая экспрессирует легкую цепь иммуноглобулина. Типичное биспецифическое антитело содержит две тяжелых цепи, каждая из которой содержит три CDR тяжелой цепи, с последующими (с N-конца до С-конца) СН1 доменом, шарниром, СН2 доменом и СН3 доменом, и легкую цепь иммуноглобулина, которая либо не обеспечивает специфичности связывания с эпитопом, но которая может соединяться с каждой тяжелой цепью, либо может соединяться с каждой тяжелой цепью и которая может связывать один или несколько эпитопов, связанных связывающими эпитоп областями тяжелой цепи, или которая может соединяться с каждой тяжелой цепью и обеспечивает связывание или одной или обеих тяжелых цепей с одним или обоими эпитопами.
Термин "клетка" включает любую клетку, которая является подходящей для экспрессии рекомбинантной последовательности нуклеиновой кислоты. Клетки включают клетки прокариот и эукариот (одноклеточных или многоклеточных), бактериальные клетки (например, штаммы Е. coli, Bacillus spp., Streptomyces spp.и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусом клетки насекомых, Trichoplusia ni и т.д.), клетки не относящихся к человеку животных, клетки человека или такие слияния клеток, как, например, гибридомы или квадромы. Согласно некоторым вариантам осуществления клетка представляет собой клетку человека, мартышки, человекообразной обезьяны, хомяка, крысы или мыши. Согласно некоторым вариантам осуществления клетка является эукариотической и выбрана из следующих клеток: СНО (например, СНО K1, DXB-11 CHO, Veggie-CHO), COS (например, COS-7), ретинальная клетка, Vero, CV1, почечная клетка (например, НЕК293, 293 EBNA, MSR 293, MDCK, HaK, ВНК), HeLa, HepG2, WI38, MRC 5, Colo205, HB 8065, HL-60, (например, ВНК21), Jurkat, Daudi, A431 (эпидермальная), CV-1, U937, 3Т3, клетка L, клетка С 127, SP2/0, NS-0, MMT 060562, клетка Сертоли, клетка BRL ЗА, клетка НТ1080, клетка миеломы, опухолевая клетка и клеточная линия, происходящая из вышеупомянутой клетки. Согласно некоторым вариантам осуществления клетка содержит один или несколько вирусных генов, например, ретинальная клетка, которая экспрессирует вирусный ген (например, клетка PER.C6™).
Фраза "определяющая комплементарность область", или термин "CDR", влючает аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты генов иммуноглобулина организма, которая в норме (т.е., у животного дикого типа) находится между двумя каркасными областями в вариабельной области легкой или тяжелой цепи молекулы иммуноглобулина (например, антитела или Т-клеточного рецептора). CDR может кодироваться, например, зародышевой последовательностью или реаранжированной или нереаранжированной последовательностью, и, например, нативной или зрелой В-клеткой или Т-клеткой. CDR может быть соматически мутирована (например, отличаться от последовательности, кодируемой в зародышевой линии животного), гуманизирована и/или модифицирована с помощью аминокислотных замен, вставок или делеций. В некоторых обстоятельствах (например, для CDR3), CDR могут кодироваться двумя или более последовательностями (например, зародышевыми последовательностями), которые не являются смежными (например, в нереаранжированной последовательности нуклеиновой кислоты), но являются смежными в последовательности нуклеиновой кислоты В-клетки, например, в результате сплайсинга или соединения последовательностей (например, V-D-J рекомбинации для формирования CDR3 тяжелой цепи).
Термин "консервативный" при использовании для описания консервативной аминокислотной замены предусматривает замену аминокислотного остатка другим аминокислотным остатком, содержащим R-группу боковой цепи со сходными химическими свойствами (например, заряд или гидрофобность). Как правило, консервативная аминокислотная замена не будет существенно изменять представляющие интерес функциональные свойства белка, например, способность вариабельной области специфически связывать целевой эпитоп с необходимой аффинностью. Примеры групп аминокислот, которые содержат боковые цепи со сходными химическими свойствами, включают такие алифатические боковые цепи, как глицин, аланин, валин, лейцин и изолейцин; такие алифатическо-гидроксильные боковые цепи, как серин и треонин; такие содержащие амид боковые цепи, как аспарагин и глутамин; такие ароматические боковые цепи, как фенилаланин, тирозин и триптофан; такие основные боковые цепи, как лизин, аргинин и гистидин; такие кислотные боковые цепи, как аспарагиновая кислота и глутаминовая кислота; и, такие серосодержащие боковые цепи, как цистеин и метионин. Группы консервативных замен аминокислот включают, например, валин/лейцин/изолейцин, фенилаланин/тирозин, лизин/аргинин, аланин/валин, глутамат/аспартат и аспарагин/глутамин. Согласно некоторым вариантам осуществления консервативная аминокислотная замена может представлять собой замену любого нативного остатка в белке аланином, как используется, например, сканирующем аланином мутагенезе. Согласно некоторым вариантам осуществления производится консервативная замена, которая характеризуется положительным значением в матрице логарифмического правдоподобия РАМ250, раскрытой в Gonnet et al. (1992) Exhaustive Matching of the Entire Protein Sequence Database, Science 256:1443-45, включенной в настоящий документ посредством ссылки. Согласно некоторым вариантам осуществления замена представляет собой умеренно консервативную замену, причем замена характеризуется неотрицательным значением в матрице логарифмического правдоподобия РАМ250.
Согласно некоторым вариантам осуществления положения остатков в легкой цепи или тяжелой цепи иммуноглобулина отличаются на одну или несколько консервативных аминокислотных замен. Согласно некоторым вариантам осуществления положения остатков в легкой цепи иммуноглобулина или ее функциональном фрагменте (например, фрагменте, который обеспечивает экспрессию и секрецию, например, из В-клетки) не идентичны легкой цепи, чья аминокислотная последовательность представлена в настоящем документе, но отличается на одну или несколько консервативных аминокислотных замен.
Фраза "связывающий эпитоп белок" включает белок, характеризующийся по меньшей мере одной CDR и который способен к селективному распознаванию эпитопу, например, способен к связыванию эпитопа с KD, составляющей приблизительно один микромоль или ниже (например, KD, составляющей приблизительно 1×10-6 М, 1×10-7 М, 1×10-9 М, 1×10-9 М, 1×10-10 М, 1×10-11 М или приблизительно 1×10-12 М). Для терапевтических связывающих эпитоп белков (например, терапевтических антител) зачастую необходима KD, которая находится в наномолярном или пикомолярном диапазоне.
Фраза "функциональный фрагмент" включает фрагменты связывающих эпитоп белков, которые могут экспрессироваться, секретироваться и специфически связывать эпитоп с KD в микромолярном, наномолярном или пикомолярном диапазоне. Специфическое распознавание предусматривает наличие KD, которая находится по меньшей мере в микромолярном диапазоне, наномолярном диапазоне или пикомолярном диапазоне.
Термин "зародышевый" включает ссылку на последовательность нуклеиновой кислоты иммуноглобулина в несоматически мутированной клетке, например, несоматически мутированной В-клетке или пре-В-клетке или гематопоэтической клетке.
Фраза "тяжелая цепь" или "тяжелая цепь иммуноглобулина" включает последовательность константной области тяжелой цепи иммуноглобулина из любого организма. Вариабельные домены тяжелой цепи включают три CDR тяжелой цепи и четыре FR области, если не указано иное. Фрагменты тяжелых цепей включают CDR, CDR и FR и их комбинации. Типичная тяжелая цепь содержит после вариабельного домена (в направлении от N-конца к С-концу) СН1 домен, шарнир, СН2 домен и СН3 домен. Функциональный фрагмент тяжелой цепи содержит фрагмент, который способен к специфическому распознаванию эпитопа (например, распознаванию эпитопа с KD в микромолярном, наномолярном или пикомолярном диапазоне), который способен к экспрессии и секреции из клетки и который содержит по меньшей мере одну CDR.
Термин "идентичность" при использовании в отношении последовательности включает идентичность, которая определяется с помощью ряда различных известных в настоящей области техники алгоритмов, которые могут использоваться для измерения идентичности нуклеотидных и/или аминокислотных последовательностей. Согласно некоторым вариантам осуществления описанные в настоящем документе идентичности определяют с использованием ClustalW версии 1.83 (медленного) выравнивания, использующего штраф за открытие гэпа, составляющий 10,0, штраф за продление гэпа, составляющий 0,1 и с использованием матрицы подобия Gonnet (Mac Vector™ 10.0.2, MacVector Inc., 2008). Длина последовательностей, сравниваемых относительно идентичности последовательностей, будет зависеть от конкретных последовательностей, но в случае константного домена легкой цепи длина должна содержать последовательность достаточной длины для укладки в константный домен легкой цепи, который способен к самоассоциации для формирования канонического константного домена легкой цепи, например, способного к формированию двух складчатых бета-слоев, содержащих бета-тяжи и способного взаимодействовать по меньшей мере с одним СН1 доменом человека или мыши. В случае СН1 домена длина последовательности должна содержать последовательность достаточной длины для укладки в СН1 домен, который способен к формированию двух складчатых бета-слоев, содержащих бета-тяжи и способен взаимодействовать по меньшей мере с одним константным доменом легкой цепи мыши или человека.
Фраза "молекула иммуноглобулина" включает две тяжелых цепи иммуноглобулина и две легких цепи иммуноглобулина. Тяжелые цепи могут быть идентичными или различными, и легкие цепи могут быть идентичными или различными.
Фраза "легкая цепь" включает последовательность легкой цепи иммуноглобулина из любого организма и если не указано иное, предусматривает κ и λ легкие цепи человека и Vnpe-B, а также суррогатные легкие цепи. Вариабельные домены (VL) легкой цепи, как правило, содержат три CDR легкой цепи и четыре каркасные (FR) области, если не указано иное. Как правило, полноразмерная легкая цепь включает от амино-конца к карбокси-концу домен VL, который содержит FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, и константный домен легкой цепи. Легкие цепи включают такие, например, которые не связывают селективно или первый, или второй эпитоп, селективно связанный связывающим эпитоп белком, в котором они имеют место. Легкие цепи также включают те, которые связывают и распознают или содействуют тяжелой цепи в связывании и распознавании одного или нескольких эпитопов, селективно связанных связывающим эпитоп белком, в котором они имеют место.
Универсальные легкие цепи, или общие легкие цепи, относятся к легким цепям, полученным у описанных в настоящем документе мышей, причем мыши строго ограничены в выборе генных сегментов, доступных для образования вариабельного домена легкой цепи. В результате этого такие мыши образуют легкую цепь, происходящую согласно одному варианту осуществления не более чем из одного или двух переаранжированных сегментов V легкой цепи и не более чем из одного или двух переаранжированных сегментов J легкой цепи (например, одного V и одного J, двух V и одного J, одного V и двух J, двух V и двух J). Согласно одному варианту осуществления не более чем одна или две реаранжированные V/J последовательности легкой цепи, например, реаранжированная последовательность Vκ1-39Jκ5 человека или реаранжированная последовательность Vκ3-20Jκ1 человека. Согласно различным вариантам осуществления универсальные легкие цепи предусматривают соматически мутированные варианты (например, с созревшей аффинностью).
Фраза "соматически мутированный" включает ссылку на последовательность нуклеиновой кислоты из В-клетки, которая подверглась переключению класса, причем последовательность нуклеиновой кислоты вариабельной области иммуноглобулина (например, вариабельного домена тяжелой цепи или включающей CDR или FR последовательность тяжелой цепи) в подвергшейся переключению класса В-клетке не идентична последовательности нуклеиновой кислоты в В-клетке перед переключением класса, так что, например, различие в последовательности нуклеиновой кислоты CDR или каркасной области между В-клеткой, которая не подверглась переключению класса и В-клеткой, которая подверглась переключению класса. "Соматически мутированный" предусматривает ссылку на последовательности нуклеиновых кислот из В-клеток созревшей аффинности, которые не являются идентичными соответствующим последовательностям вариабельной области иммуноглобулина в В-клетках с несозревшей аффинностью (т.е., последовательности в геноме гаметоцитов). Фраза "соматически мутированный" также включает ссылку на последовательность нуклеиновой кислоты вариабельной области иммуноглобулина из В-клетки после воздействия на В-клетку представляющего интерес эпитопа, причем последовательность нуклеиновой кислоты отличается от соответствующей последовательности нуклеиновой кислоты перед воздействием на В-клетку представляющего интерес эпитопа. Фраза "соматически мутированный" относится к последовательностям из антител, которые были образованы у животного, например, мыши, содержащей последовательности нуклеиновых кислот вариабельной области иммуноглобулина человека, в ответ на сенсибилизацию иммуногеном, и которые являются результатом процессов отбора, наследственно функционирующих у такого животного.
Термин "переаранжированный" в отношении последовательности нуклеиновой кислоты включает последовательности нуклеиновых кислот, которые существуют в зародышевой линии клетки животного.
Фраза "вариабельный домен" включает аминокислотную последовательность легкой или тяжелой цепи иммуноглобулина (модифицированной при необходимости), которая содержит следующие аминокислотные области, последовательно от N-конца к С-концу (если не указано иное): FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Мыши с гуманизированными локусами иммуноглобулина
Мышь в качестве генетической модели была значительно усовершенствована с помощью трансгенных технологий и технологий генного нокаута, которые предоставили возможность изучить эффекты на направленную избыточную экспрессию или делецию специфических генов. Несмотря на все свои преимущества, мышь все еще демонстрирует генетические затруднения, которые делают ее несовершенной моделью для заболеваний человека и несовершенной платформой для испытаний терапевтических средств для людей или их разработки. Во-первых, несмотря на то, что приблизительно 99% генов человека имеют мышиный гомолог (Waterston, R.H., et. al. (2002). Initial sequencing and comparative analysis of the mouse genome. Nature 420, 520-562.), потенциальные терапевтические средства зачастую не дают перекрестной реакции или дают неадекватную перекрестную реакцию с мышиными ортологами предполагаемых мишеней человека. Для устранения этой проблемы выбранные целевые гены могут быть "гуманизированы", то есть ген мыши может быть устранен и замещен соответствующей ортологичной генной последовательностью человека (например, патенты США №№6586251, 6596541 и 7105348, включенные в настоящий документ посредством ссылки). Изначально, попытки гуманизировать мышиные гены с помощью стратегии "генный нокаут вместе с трансгенной гуманизацией" предусматривали скрещивание мыши, несущей делецию (т.е., нокаут) эндогенного гена, с мышью, несущей интегрированный в произвольном порядке трансген человека (смотрите, например, Bril, W.S., et al. (2006). Tolerance to factor VIII in a transgenic mouse expressing human factor VIII cDNA carrying an Arg(593) to Cys substitution. Thromb Haemost 95, 341-347; Homanics, G.E., et al. (2006). Production and characterization of murine models of classic and intermediate maple syrup urine disease. BMC Med Genet 7, 33; Jamsai, D., et al. (2006). A humanized ВАС transgenic/knockout mouse model for HbE/beta-thalassemia. Genomics 88(3):309-15; Pan, Q., et al. (2006). Different role for mouse and human CD3delta/epsilon heterodimer in preT cell receptor (preTCR) function: human CD3delta/epsilon heterodimer restores the defective preTCR function in CD3gamma- and CD3gammadelta-deficient mice. Mol Immunol 43, 1741-1750). Но эти попытки затруднялись ограничениями в размере; традиционные технологии генного нокаута были недостаточными для прямого замещения больших мышиных генов их большими геномными эквивалентами человека. Простой подход прямого гомологичного замещения, при котором эндогенный мышиный ген напрямую замещается эквивалентным геном человека в том же точном генетическом положении гена меши (т.е., на эндогенном мышином локусе), редко предпринимался вследствие технических сложностей. До настоящего времени попытки прямого замещения предусматривали усложненные и трудные процедуры, таким образом, ограничивая длину генетического материала, с который могли быть произведены манипуляции, и точность, с которой эти манипуляции могли быть произведены.
Экзогенно введенные трансгены иммуноглобулина человека перестраиваются в предшественниках В-клеток у мышей (Alt, F.W., Blackwell, Т.K., and Yancopoulos, G.D. (1985). Immunoglobulin genes in transgenic mice. Trends Genet 1, 231-236). Это открытие использовалось в конструировании мышей с использованием генного нокаута вместе с трансгенным подходом для экспрессии антител человека (Green, L.L. et al. (1994). Antigen-specific human monoclonal antibodies from mice engineered with human Ig heavy and light chain YACs. Nat Genet 7, 13-21; Lonberg, N. (2005). Human antibodies from transgenic animals. Nat Biotechnol 23, 1117-1125; Lonberg, N., et al. (1994). Antigen-specific human antibodies from mice comprising four distinct genetic modifications. Nature 368, 856-859; Jakobovits, A., et al. (2007). From XenoMouse technology to panitumumab, the first fully human antibody product from transgenic mice. Nat Biotechnol 25, 1134-1143). Эндогенные локусы тяжелой цепи и к легкой цепи иммуноглобулина мыши инактивировали у этих мышей путем направленной делеции небольших, но критически важных частей каждого эндогенного локуса с последующим введением генных локусов иммуноглобулина человека в виде описанных выше случайным образом интегрированных больших трансгенов или минихромосом (Tomizuka, K., et al. (2000). Double trans-chromosomic mice: maintenance of two individual human chromosome fragments containing Ig heavy and kappa loci and expression of fully human antibodies. Proc Nati Acad Sci USA 97, 722-727). Такие мыши представляли важное преимущество в генной инженерии; выделенные из них полностью человеческие моноклональные антитела давали в результате перспективные терапевтические средства для лечения различных заболеваний человека (Gibson, T.B., et al. (2006). Randomized phase III trial results of panitumumab, a fully human anti-epidermal growth factor receptor monoclonal antibody, in metastatic colorectal cancer. Clin Colorectal Cancer 6, 29-31; Jakobovits et al., 2007; Kim, Y.H., et al. (2007). Clinical efficacy of zanolimumab (HuMax-CD4): two Phase II studies in refractory cutaneous T-cell lymphoma. Blood 109(11):4655-62; Lonberg, 2005; Maker, A.V., et al. (2005). Tumor regression and autoimmunity in patients treated with cytotoxic Т lymphocyte-associated antigen 4 blockade and interleukin 2: a phase I/II study. Ann Surg Oncol 12, 1005-1016; McClung, M.R., et al. (2006). Denosumab in postmenopausal women with low bone mineral density. N Engl J Med 354, 821-831). Но, как обсуждалось выше, эти мыши проявляют нарушенное развитие В-клеток и иммунологические недостаточности по сравнению с мышами дикого типа. Такие проблемы потенциально ограничивают способность мышей обеспечивать сильный гуморальный ответ и, следовательно, образовывать полностью человеческие антитела к некоторым антигенам. Недостаточности могут быть обусловлены следующим: (1) неэффективная функциональность вследствие введения случайным образом трансгенов иммуноглобулина человека и полученная в результате неправильная экспрессия вследствие отсутствия контролирующих элементов против хода транскрипции и по ее ходу (Garrett, F.E., et al. (2005). Chromatin architecture near a potential 3' end of the Igh locus involves modular regulation of histone modifications during B-Cell development and in vivo occupancy at CTCF sites. Mol Cell Biol 25, 1511-1525; Manis, J.P., et al. (2003). Elucidation of a downstream boundary of the 3' IgH regulatory region. Mol Immunol 39, 753-760; Pawlitzky, I., et al. (2006). Identification of a candidate regulatory element within the 5' flanking region of the mouse Igh locus defined by pro-B cell-specific hypersensitivity associated with binding of PU.1, Pax5, and E2A. J Immunol 176, 6839-6851); (2) неэффективные межвидовые взаимодействия между константными доменами человека и мышиными компонентами В-клеточного рецепторного сигнального комплекса на клеточной поверхности, которые могут ослаблять сигнальные процессы, необходимые для нормального созревания, пролиферации и выживания В-клеток (Hombach, J., et al. (1990). Molecular components of the B-cell antigen receptor complex of the IgM class. Nature 343, 760-762); и (3) неэффективные межвидовые взаимодействия между растворимыми иммуноглобулинами человека и мышиными Fc рецепторами, которые могут снижать аффинную селекцию (Rao, S.P., et al. (2002). Differential expression of the inhibitory IgG Fc receptor FcgammaRIIB on germinal center cells: implications for selection of high-affinity В cells. J Immunol 169, 1859-1868) и концентрации иммуноглобулинов в сыворотке (Brambell, F.W., et al. (1964). A Theoretical Model of Gamma-Globulin Catabolism. Nature 203, 1352-1354; Junghans, R.P., and Anderson, C.L. (1996). The protection receptor for IgG catabolism is the beta2-microglobulin-containing neonatal intestinal transport receptor. Proc Natl Acad Sci USA 93, 5512-5516; Rao et al., 2002; Hjelm, F., et al. (2006). Antibody-mediated regulation of the immune response. Scand J Immunol 64, 177-184; Nimmerjahn, F., and Ravetch, J.V. (2007). Fc-receptors as regulators of immunity. Adv Immunol 96, 179-204). Эти недостаточности можно корректировать с помощью гуманизации in situ только вариабельных областей локусов иммуноглобулина мыши в пределах их естественных положений на эндогенных локусах тяжелой и легкой цепей. Это будет действительно давать в результате мышей, которые образуют обратные химерные антитела (т.е., V человека: С мыши), которые будут способны к нормальным взаимодействиям и селекции в мышином окружении на основании сохранения константных областей мыши. Более того, такие обратные химерные антитела легко реформатируются в полностью человеческие антитела для терапевтических целей.
Описан способ для большого генетического замещения in situ зародышевых вариабельных генов иммуноглобулина мыши зародышевыми вариабельными генами иммуноглобулина человека при сохранении способности мышей образовывать потомство. В частности, описано точное замещение шести миллионов пар оснований вариабельных генных локусов как тяжелой цепи, так и к легкой цепи иммуноглобулина мыши их эквивалентами человека при сохранении константных областей мыши интактными. В результате были образованы мыши, которые содержат точное замещение их полного зародышевого репертуара вариабельной области иммуноглобулина эквивалентными зародышевыми последовательностями вариабельной области иммуноглобулина человека при сохранении константных областей мыши. Вариабельные области человека соединяют с константными областями мыши для образования химерных человеческо-мышиных иммуноглобулиновых локусов, которые перестраиваются и экспрессируются на физиологически приемлемых уровнях. Экспрессированные антитела представляют собой "обратные химеры", т.е. они содержат последовательности вариабельной области человека и последовательности константной области мыши. Эти мыши, характеризующиеся гуманизированными вариабельными областями иммуноглобулина, которые экспрессируют антитела, содержащие вариабельные области человека и константные области мыши, имею название гуманизированные мыши VELCOIMMUNE®.
Гуманизированные мыши VELOCIMMUNE® проявляют полностью функциональную гуморальную иммунную систему, которая по существу неотличима от таковой у мышей дикого типа. Они проявляют нормальные клеточные популяции на всех стадиях развития В-клеток. Они проявляют нормальную морфологию лимфоидных органов. Последовательности антител гуманизированных мышей VELOCIMMUNE® проявляют нормальную реаранжировку вариабельных сегментом и нормальную соматическую гипермутацию. Популяции антител у этих мышей отражает распределения изотипов, которые являются результатом нормального переключения класса (например, нормального цис-переключения изотипа). Иммунизация гуманизированных мышей VELOCIMMUNE® приводит к устойчивым гуморальным ответам, которые образуют большое разнообразие антител, содержащих вариабельные домены иммуноглобулина человека, подходящие в качестве кандидатов терапевтических средств. Эта платформа предоставляет обильный источник последовательностей вариабельной области иммуноглобулина человека созревшей аффинности для получения фармацевтически приемлемых антител и других связывающих антиген белков.
Это представляет собой точное замещение последовательностей вариабельной области иммуноглобулина мыши последовательностями вариабельной области иммуноглобулина человека, которое обеспечивает возможность получения гуманизированных мышей VELOCIMMUNE®. Даже точное замещение эндогенных последовательностей иммуноглобулина мыши на локусах тяжелых и легких цепей эквивалентными последовательностями иммуноглобулина человека с помощью последовательной рекомбинационной инженерии очень больших интервалов последовательностей иммуноглобулина человека может представлять определенные проблемы вследствие дивергентной эволюции локусов иммуноглобулина между мышью и человеком. Например, межгенные последовательности, разбросанные в пределах локусов иммуноглобулина, не идентичны между мышами и людьми и в некоторых обстоятельствах могут не быть функционально эквивалентными. Различия между мышами и людьми в их локусах иммуноглобулина может все еще приводить к аномалиям у гуманизированных мышей, в частности, при гуманизации или манипуляции с определенными частями эндогенных локусов тяжелой цепи иммуноглобулина мыши. Некоторые модификации на локусах тяжелой цепи иммуноглобулина мыши являются вредными. Вредные модификации могут включать, например, потерю способности модифицированных мышей спариваться и производить потомство.
Проводили точное, крупномасштабное замещение in situ шести миллионов пар оснований вариабельных областей локусов тяжелых и легких цепей иммуноглобулина мыши (VH-DH-JH и Vκ-Jκ) соответствующими геномными последовательностями человека, составляющими 1,4 миллиона пар оснований при сохранении фланкирующих последовательностей мыши интактными и функциональными в пределах гибридных локусов, включающих все гены константной цепи мыши и области транскрипционного контроля локуса (фигура 1). В частности, генные последовательности VH, DH, JH, Vκ и Jκ человека вводили посредством поэтапной вставки 13 химерных основанных на ВАС нацеливающих векторов, несущих перекрывающиеся фрагменты зародышевых вариабельных локусов человека, в мышиные ES клетки с использованием технологии генетической инженерии VELOCIGENE® (смотрите, например, патент США №6586251 и Valenzuela, D.M., et al. (2003). High-throughput engineering of the mouse genome coupled with high-resolution expression analysis. Nat Biotechnol 21, 652-659).
Гуманизация генов иммуноглобулина мыши представляет наибольшую генетическую модификацию мышиного генома к настоящему времени. Наряду с тем, что предыдущие попытки с интегрированными случайным образом трансгенами иммуноглобулина человека оказались в некоторой степени успешными (как обсуждалось выше), прямое замещение генов иммуноглобулина мыши их эквивалентами человека значительно увеличивает результативность, с которой полностью человеческие антитела могут быть эффективно образованы у нормальных в других отношениях мышей. Кроме того, такие мыши проявляют значительно увеличенное разнообразие полностью человеческих антител, которые могут быть получены после иммунизации фактически любым антигеном, по сравнению с мышами, несущими недееспособные эндогенные локусы и трансгены полностью человеческих антител. Многочисленные варианты замещенных, гуманизированных локусов проявляют полностью нормальные уровни зрелых и незрелых В-клеток, в отличие от мышей с интегрированными случайным образом трансгенами человека, которые проявляют значительно уменьшенные популяции В-клеток на различных стадиях дифференциации. Наряду с тем, что попытки по увеличению числа генных сегментов человека у гуманизированных трансгенных мышей снизили такие дефекты, расширенные иммуноглобулиновые репертуары не скорректировали в общей сложности снижения в популяциях В-клеток по сравнению с мышами дикого типа.
Несмотря на то что близкая к дикому типу гуморальная иммунная функция, наблюдаемая у мышей с замещенными локусами иммуноглобулина, существуют другие обнаруживаемые при использовании прямого замещения иммуноглобулина сложности, которые не встречаются в некоторых подходах, которые используют интегрированные случайным образом трансгены. Различия в генетическом составе иммуноглобулиновых локусов между мышами и людьми привело к открытию последовательностей, преимущественных для размножения мышей с замещенными иммуноглобулиновыми генными сегментами. В частности, гены ADAM мыши, расположенные в пределах эндогенного локуса иммуноглобулина, оптимально присутствуют у мышей с замещенными иммуноглобулиновыми локусами вследствие их роли в фертильности.
Положение в геноме и функция ADAM6 мыши
Самцы мышей, у которых отсутствует способность экспрессировать какой-либо функциональный белок ADAM6, проявляют тяжелый дефект в способности мышей спариваться и давать потомство. Мыши утрачивают способность экспрессировать функциональный белок ADAM6 посредством замещения всех или, по сути, всех генных сегментов вариабельной области иммуноглобулина мыши генными сегментами вариабельной области человека. Потеря функции ADAM6 происходит, поскольку локус ADAM6 расположен в пределах области эндогенного генного локуса вариабельной области тяжелой цепи иммуноглобулина мыши, проксимального к 3' концу локуса генного сегмента VH, который находится выше генных сегментов DH. Разведение мышей, являющихся гомозиготными в отношении замещения всех или, по сути, всех эндогенных вариабельных генных сегментов тяжелой цепи мыши генными сегментами вариабельной области тяжелой цепи человека, как правило, представляет собой трудоемкий подход для спаривания самцов и самок, каждый из которых являются гомозиготными в отношении замещения, и ожидания продуктивного спаривания. Успешные пометы являются относительно редкими и средний размер помета является очень низким. Вместо этого, самцы, гетерозиготные в отношении замещения, использовались для спаривания с самками, гомозиготными в отношении замещения, для получения потомства, которое является гетерозиготным в отношении замещения, затем выводя из него гомозиготную мышь. Авторы настоящего изобретения показали, что вероятной причиной потери фертильности у самцов мышей является отсутствие у гомозиготных самцов мышей функционального белка ADAM6.
Белок ADAM6 представляет собой представителя семейства ADAM белков, где ADAM представляет собой сокращение англ. A Disintegrin And Metalloprotease (дизинтегрин и металлопротеаза). Семейство белков ADAM является большим и разнообразным, с различными функциями. Некоторые представители семейства ADAM вовлечены в сперматогенез и оплодотворение. Например, ADAM2 кодирует субъединицу белка фертилина, который вовлечен во взаимодействия сперматозоидов и яйцеклетки. ADAM3, или циритестин, оказывается необходимым для связывания сперматозоида с вителлиновым слоем. Отсутствие или ADAM2, или ADAM3 приводит к стерильности. Предположили, что ADAM2, ADAM3 и ADAM6 формируют комплекс на поверхности мышиных сперматозоидов.
Ген ADAM6 человека, в норме встречающийся между VH генными сегментами VH1-2 и VH6-1 человека, по-видимому, является псевдогеном (фигура 12). У мышей существует два гена ADAM6-ADAM6a и ADAM6b - которые встречаются в межгенной области между генными сегментами VH и DH мыши, и у мыши а и b гены ориентированы в транскрипционной ориентации, противоположной ориентации транскрипции окружающих иммуноглобулиновых генных сегментов (фигура 11). У мышей функциональный локус ADAM6 очевидно необходим для нормального оплодотворения. Функциональный локус или последовательность ADAM6, затем относится к локусу или последовательности ADAM6, которая может дополнить или восстановить резко сниженное оплодотворение, демонстрируемое самцами мышей с утраченными или поврежденными эндогенными локусами ADAM6.
Положение межгенной последовательности у мышей, которая кодирует ADAM6a и ADAM6b, делает межгенную последовательность подверженной модификации при модификации эндогенной тяжелой цепи мыши. Когда генные сегменты VH подвергаются делеции или замещаются или когда генные сегменты DH подвергаются делеции или замещаются, существует высокая вероятность того, что полученная мышь будет проявлять тяжелую недостаточность фертильности. Для компенсации этой недостаточности мышь модифицируют, чтобы включить в нее нуклеотидную последовательность, которая кодирует белок, который будет дополнять потерю активности ADAM6 вследствие модификации эндогенного локуса ADAM6 мыши. Согласно различным вариантам осуществления дополняющая нуклеотидная последовательность представляет собой такую, которая кодирует мышиный ADAM6a, мышиный ADAM6b или его гомолог или ортолог или функциональный фрагмент, который восстанавливает недостаточность фертильности.
Нуклеотидная последовательность, которая восстанавливает фертильность, может быть расположена в любом подходящем положении. Она может быть расположена в межгенной области или в любом подходящем положении в геноме (т.е., эктопически). Согласно одному варианту осуществления нуклеотидная последовательность может быть введена в трансген, который случайным образом интегрирован в геном мыши. Согласно одному варианту осуществления последовательность может храниться эписомно, то есть на отдельной нуклеиновой кислоте, а не на хромосоме мыши. Подходящие положения предусматривают положения, которые являются транскрипционно пермиссивными или активными, например, локус ROSA26.
Не предусматривается, что термин "эктопический" включает перемещение или размещение в положении, которое в норме не встречается в природе (например, размещение последовательности нуклеиновой кислоты в положении, которое не является аналогичным положением, в котором последовательность нуклеиновой кислоты встречается у мыши дикого типа). Термин согласно различным вариантам осуществления используется в том смысле, что его объект находится за пределами его нормального, или правильного, положения. Например, фраза "эктопическая нуклеотидная последовательность, кодирующая…" относится к нуклеотидной последовательности, которая находится в положении, в котором она не встречается в норме у мыши. Например, в случае эктопической нуклеотидной последовательности, кодирующей белок ADAM6 мыши (или ее ортолога или гомолога или фрагмента, который обеспечивает такое же или сходное улучшение фертильности у самцов мышей), последовательность может быть расположена в положении в геноме мыши, которое отличается от встречающегося в норме у мыши дикого типа. Функциональный гомолог или ортолог ADAM6 мыши представляет собой последовательность, которая обеспечивает восстановление потери фертильности (например, потери способности самца мыши давать потомство путем спаривания), которая наблюдается у мыши ADAM6a. Функциональные гомологи или ортологи предусматривают белки, которые характеризуются по меньшей мере приблизительно 89% идентичности или более, например, до 99% идентичности, с аминокислотной последовательностью ADAM6a и/или с аминокислотной последовательностью ADAM6b, и которые могут дополнять или восстанавливать способность успешно спариваться у мыши, характеризующейся фенотипом, который содержит делецию или нокаут ADAM6a и/или ADAM6b.
Эктопическое положение может находиться где-либо (например, как в случае случайной вставки трансгена, содержащего последовательность ADAM6 мыши), или может находиться, например, в положении, которое приблизительно соответствует (но не является точно таким же как) его расположение у мыши дикого типа (например, в модифицированном эндогенном локусе иммуноглобулина мыши, но или выше, или ниже в отношении хода транскрипции от его естественного положения, например, в пределах модифицированного локуса иммуноглобулина, но между различными генными сегментами, или в другом положении в V-D межгенной последовательности мыши). Одним примером эктопического размещения является размещение в пределах гуманизированного локуса тяжелой цепи иммуноглобулина. Например, мышь, содержащая замещение одного или нескольких эндогенных генных сегментов VH генными сегментами VH человека, причем замещение удаляет эндогенную последовательность ADAM6, может быть сконструирована так, чтобы содержать последовательность ADAM6 мыши, расположенную в пределах последовательности, которая содержит генные сегменты VH человека. Полученная модификация будет образовывать (эктопическую) последовательность ADAM6 мыши в пределах генной последовательности человека, и (эктопическое) размещение последовательности ADAM6 мыши в пределах генной последовательности человека может приблизительно соответствовать положению псевдогена ADAM6 человека (т.е., между двумя сегментами V) или может приблизительно соответствовать положению последовательности ADAM6 мыши (т.е., в пределах V-D межгенной области).
Согласно различным аспектам могут быть получены мыши, которые содержат делеции или замещения эндогенного локуса вариабельной области тяжелой цепи или его частей, которые содержат эктопическую нуклеотидную последовательность, кодирующую белок, обеспечивающий сходные улучшения фертильности ADAM6 мыши (например, его ортолог или гомолог или фрагмент, который является функциональным у самца мыши). Эктопическая нуклеотидная последовательность может содержать нуклеотидную последовательность, кодирующую белок, который представляет собой гомолог или ортолог ADAM6 (или их фрагмент) другого штамма мышей или другого вида, например, другого вида грызунов, и которая обеспечивает улучшение фертильности, например, увеличенное количество пометов в течение определенного периода времени и/или увеличенное количество детенышей на помет и/или способность сперматозоида самца мыши проходить через яйцевод мыши для оплодотворения яйцеклетки мыши.
Согласно одному варианту осуществления ADAM6 представляет собой гомолог или ортолог, который является по меньшей мере на 89%-99% идентичным белку ADAM6 мыши (например, по меньшей мере на 89%-99% идентичным мышиному ADAM6a или мышиному ADAM6b). Согласно одному варианту осуществления эктопическая нуклеотидная последовательность кодирует один или несколько белков, независимо выбранных из белка, по меньшей мере на 89% идентичного мышиному ADAM6a, белка, по меньшей мере на 89% идентичного мышиному ADAM6b и их комбинации. Согласно одному варианту осуществления гомолог или ортолог представляет собой белок крысы, хомяка, мыши или морской свинки, который является или модифицирован, чтобы быть приблизительно на 89% или более идентичным мышиному ADAM6a и/или мышиному ADAM6b. Согласно одному варианту осуществления гомолог или ортолог является на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичным ADAM6a мыши и/или ADAM6b мыши.
Эктопический ADAM6 у мышей с гуманизированной тяжелой цепью
Мыши, которые производят человеческие антитела, были доступны уже в течение определенного времени. Хотя они представляют собой важный прогресс в разработке человеческих терапевтических антител, эти мыши проявляют ряд значительных нарушений, которые ограничивают их применимость. Например, они проявляют нарушенное развитие В-клеток. Нарушенное развитие может быть обусловлено разнообразными различиями между трансгенными мышами и мышами дикого типа.
Существует вероятность, что человеческие антитела не взаимодействуют оптимально с рецепторами пре-В-клеток или В-клеток мыши на поверхности клеток мыши, которые передают сигнал к созреванию, пролиферации или выживанию в ходе клональной селекции. Полностью человеческие антитела могут не взаимодействовать оптимально с Fc рецепторной системой мыши; мыши экспрессируют Fc рецепторы, которые не проявляют соответствия один к одному с Fc рецепторами человека. В конце концов, различные мыши, которые производят полностью человеческие антитела, не включают все истинные мышиные последовательности, например, нижележащие энхансерные элементы и другие контролирующие элементы локуса, которые могут быть необходимы для развития В-клеток дикого типа.
Мыши, которые производят полностью человеческие антитела, как правило, содержат эндогенные локусы иммуноглобулина, которые являются некоторым образом недееспособными, и человеческие трансгены, которые содержат вариабельные и константные генные сегменты иммуноглобулина, вводят в случайное положение в геноме мыши. При условии, что эндогенный локус является достаточно недееспособным, так чтобы не реаранжировать генные сегменты для образования функционального гена иммуноглобулина, цель получения полностью человеческих антител в такой мыши может быть достигнута, хотя и с нарушенным развитием В-клеток.
Несмотря на принуждение производить полностью человеческие антитела из человеческого трансгенного локуса, образование человеческих антител у мыши является очевидно затрудненным процессом. У некоторых мышей процесс является настолько затрудненным, что приводит к формированию химерных человеческих вариабельных/мышиных константных тяжелых цепей (но не легких цепей) посредством механизма транс-переключения. С помощью этого механизм, транскрипты, которые кодируют полностью человеческие антитела, подвергаются переключению изотипа в трансконфигурации из изотипа человека на изотип мыши. Процесс происходит в транс-конфигурации, поскольку полностью человеческий трансген расположен в отдалении от эндогенного локуса, который сохраняет неповрежденную копию генной константной области тяжелой цепи мыши. Хотя у таких мышей транс-переключение очевидно выражено, явление остается недостаточным для восстановления развития В-клеток, которое остается фактически нарушенным. В любом случае, транс-переключенные антитела, произведенные у таких мышей, сохраняют полностью человеческие легкие цепи, поскольку явление транс-переключения, очевидно, не происходит в отношении легких цепей; транс-переключение, вероятно, основано на переключении последовательностей в используемых эндогенных локусах (хотя и по-другому) в переключении нормального изотипа в цис-конфигурации. Таким образом, даже когда мыши, сконструированные для получения полностью человеческих антител, выбирают механизм транс-переключения для образования антител с константными областями мыши, стратегия остается все еще недостаточной для восстановления нормального развития В-клеток.
Первоочередной задачей в получении основанных на антителах терапевтических средств для людей состоит в получении достаточно большого разнообразия последовательностей вариабельной области иммуноглобулина человека для выявления применимых вариабельных доменов, которые специфически распознают конкретные эпитопы и связывают их с необходимой аффинностью, как правило, но не всегда, с высокой аффинностью. Перед разработкой гуманизированных мышей VELOCIMMUNE®, не существовало ни одного указания на то, что мыши, экспрессирующие вариабельные области человека с константными областями мыши, будут проявлять какие-либо значительные отличия от мышей, которые образуют человеческие антитела из трансгена. Это предположение, тем не менее, было неправильным.
Гуманизированные мыши VELOCIMMUNE®, которые содержат точное замещение вариабельных областей иммуноглобулина мыши вариабельными областями иммуноглобулина человека на эндогенных локусах мыши, проявляют удивительное и существенное сходство с мышами дикого типа по отношению к развитию В-клеток. В удивительном и замечательном развитии гуманизированные мыши VELOCIMMUNE® проявили по существу нормальный ответ дикого типа на иммунизацию, который отличался только в одном существенном аспекте от мышей дикого типа мыши - вариабельные области, образованные в ответ на иммунизацию, являются полностью человеческими.
Гуманизированные мыши VELOCIMMUNE® содержат точное, крупномасштабное замещение зародышевых вариабельных областей тяжелой цепи иммуноглобулина мыши (IgH) и легкой цепи иммуноглобулина (например, к легкой цепи, Igκ) соответствующими вариабельными областями иммуноглобулина человека на эндогенных локусах. В общем, приблизительно шесть миллионов пар оснований мышиных локусов замещают приблизительно 1,4 миллиона пар оснований геномной последовательности человека. Это точное замещение дает в результате мышь с гибридными локусами иммуноглобулина, которая образует тяжелые и легкие цепи, которые содержатся вариабельные области человека и константную область мыши. Точное замещение сегментов VH-DH-JH и Vκ-Jκ мыши оставляет фланкирующие мышиные последовательности интактнымии функциональными на гибридных локусах иммуноглобулина. Гуморальная иммунная система мыши функционирует как система у мыши дикого типа. Развитие В-клеток не затруднено в каком-либо существенном отношении, и у мыши при антигенной сенсибилизации образуется богатое разнообразие вариабельных областей человека.
Гуманизированные мыши VELOCIMMUNE® являются возможными, поскольку иммуноглобулиновые генные сегменты тяжелых и к легких цепей реаранжируются подобным образом у людей и мышей, что не означает, что их локусы являются одинаковыми или даже приблизительно таковы - ясно, что они не такие. Тем не менее, локусы являются достаточно сходными, чтобы гуманизация вариабельного генного локуса тяжелой цепи могла осуществиться путем замещения приблизительно 3 миллионов пар оснований смежной мышиной последовательности, которая содержит все генные сегменты VH, DH и JH, приблизительно 1 миллион оснований смежной геномной последовательности человека, охватывающей, в сущности, эквивалентную последовательность из локуса иммуноглобулина человека.
Согласно некоторым вариантам осуществления дополнительное замещение определенных генных последовательностей константной области мыши генными последовательностями человека (например, замещение последовательности СН1 мыши последовательностью СН1 человека и замещение последовательность CL мыши последовательностью CL человека) дает в результате мышей с гибридными локусами иммуноглобулина, которые образуют антитела, содержащие вариабельные области человека и частично константные области человека, подходящие, например, для образования полностью человеческих фрагментов антител, например, полностью человеческих Fab. Мыши с гибридными локусами иммуноглобулина проявляют нормальную реаранжировку вариабельных генных сегментов, нормальную соматическую гипермутацию и нормальное переключение класса. Эти мыши проявляют гуморальную иммунную систему, которая неотличима от мышей дикого типа, и демонстрируют нормальные клеточные популяции на всех стадиях развития В-клеток и нормальные структуры лимфомных органов - даже когда если у мышей отсутствует полный репертуар вариабельных генных сегментов человека. Иммунизация указанных мышей приводит к устойчивым гуморальным ответам, которые проявляют широкое разнообразие использования вариабельных генных сегментов.
Точное замещение зародышевых генных сегментов вариабельной области мыши обеспечивают получение мышей, которые содержат частично человеческие локусы иммуноглобулина. Поскольку частично человеческие локусы иммуноглобулина нормально реаранжируются, гипермутируют и подвергаются переключению класса, частично человеческие локусы иммуноглобулина образуют у мыши антитела, которые содержат вариабельные области человека. Нуклеотидные последовательности, которые кодируют вариабельные области, могут быть установлены и клонированы, затем слиты (например, в системе in vitro) с любыми предпочтительными последовательностями, например, любым изотипом иммуноглобулина, подходящим для конкретного применения, давая в результате антитело или связывающий антиген белок, происходящий полностью из последовательностей человека.
Крупномасштабную гуманизацию с помощью способов рекомбинационный инженерии использовали для модификации мышиных эмбриональных стволовых (ES) клеток для точного замещения до 3 миллионов пар оснований локуса тяжелой цепи иммуноглобулина мыши, который содержал по существу все генные сегменты VH, DH и JH мыши, эквивалентными генными сегментами человека, составляющими до 1 миллиона пар оснований геномной последовательности человека, содержащей несколько или по существу все генные сегменты VH, DH и JH человека. Составляющий до 0,5 миллиона пар оснований сегмент генома человека, содержащий один из двух повторов, кодирующих по существу все генные сегменты Vκ и Jκ человека использовали для замещения сегмента локуса κ легкой цепи иммуноглобулина мыши размером 3 миллиона пар оснований, содержащего по существу все генные сегменты Vκ и Jκ мыши.
Мыши с такими замещенными иммуноглобулиновыми локусами могут содержать разрыв или делецию эндогенного локуса ADAM6 мыши, который в норме встречается между расположенным наиболее 3' генным сегментом VH и наиболее 5' генным сегментом DH на локусе тяжелой цепи иммуноглобулина мыши. Разрыв в этой области может привести к снижению или подавлению функциональности эндогенного локуса ADAM6 мыши. Если наиболее 3' генные сегменты VH репертуара тяжелой цепи человека используют в замещении, межгенная область, содержащая псевдоген, который, по-видимому, является псевдоген ADAM6 человека, присутствует между этими генными сегментами VH, т.е., между VH1-2 и VH1-6 человека. Тем не менее, самцы мышей, которые содержат эту межгенная последовательность человека, проявляют небольшую фертильность или ее отсутствие.
Описываются мыши, которые содержат описанные выше замещенные локусы, и которые также содержат эктопическую последовательность нуклеиновой кислоты, кодирующую мышиный ADAM6, причем мыши проявляют по существу нормальную фертильность. Согласно одному варианту осуществления эктопическая последовательность нуклеиновой кислоты представляют собой SEQ ID NO:3, расположенную между VH1-2 и VH1-6 человека на модифицированном эндогенном локусе тяжелой цепи мыши. Направление транскрипции генов ADAM6 SEQ ID NO:3 являются противоположным по отношению к направлению транскрипции окружающих генных сегментов VH человека. Хотя примеры в настоящем документе демонстрируют восстановление фертильности путем размещения эктопической последовательности между указанными генными сегментами VH человека, специалистам в настоящей области будет понятно, что размещение эктопической последовательности на любом подходящем транскрипционно пермиссивно локусе в мышином геноме (или даже внехромосомно), как предполагается, приведет к подобному восстановлению фертильности у самца мыши.
Явление дополнения у мыши, у которой отсутствует функциональный локус ADAM6, с помощью эктопической последовательности, которая содержит ген ADAM6 мыши или его ортолог или гомолог или функциональный фрагмент, представляет собой общий способ, который является применимым для восстановления любых мышей с нефункциональными или минимально функциональными эндогенными локусами ADAM6. Таким образом, большое количество мышей, которые содержат разрушающую ADAM6 модификацию локуса тяжелой цепи иммуноглобулина, могут быть восстановлены с помощью композиций и способов по настоящему изобретению. Соответственно, настоящее изобретение предусматривает мышей с широким разнообразием модификаций локусов тяжелой цепи иммуноглобулина, которые нарушают функцию эндогенного ADAM6. Некоторые (не ограничивающие) примеры представлены в настоящем описании. В дополнение к описанным гуманизированным мышам VELOCIMMUNE® относящиеся к ADAM6 композиции и способы могут использоваться в многочисленных применениях, например, при модификации локуса тяжелой цепи разнообразными путями.
Согласно одному аспекту предусматривается мышь, которая содержит эктопическую последовательность ADAM6, которая кодирует функциональный белок ADAM6 (или его ортолог или гомолог или функциональный фрагмент), замещение всех или, по сути, всех VH генных сегментов мыши одним или несколькими VH генными сегментами человека, замещение всех или, по сути, всех генных сегментов DH и генных сегментов JH мыши генными сегментами DH человека и генными сегментами JH человека; причем у мыши отсутствует CH1 и/или шарнирная область. Согласно одному варианту осуществления мышь производит связывающий один вариабельный домен белок, который представляет собой димер иммуноглобулиновых цепей, выбранный из следующего: (a) VH человека-СН1 мыши -СН2 мыши -СН3 мыши; (b) VH человека -шарнир мыши -СН2 мыши -СН3 мыши; и, (с) VH человека -СН2 мыши -СН3 мыши.
Согласно одному аспекту нуклеотидная последовательность, которая восстанавливает фертильность, расположена в пределах последовательности вариабельной области тяжелой цепи иммуноглобулина человека (например, между генными сегментами VH1-2 и VH1-6 человека) у мыши, которая содержит замещение всех или, по сути, всех вариабельных генных сегментов тяжелой цепи иммуноглобулина мыши (mVH, mDH и mJH) одним или несколькими вариабельными генными сегментами тяжелой цепи иммуноглобулина человека (hVH, hDH и hJH), и мышь дополнительно содержит замещение всех или, по сути, всех вариабельных генных сегментов к легкой цепи иммуноглобулина мыши (mVκ, mJκ) одним или несколькими вариабельными генными сегментами к легкой цепи иммуноглобулина человека (hVκ и hJκ). Согласно одному варианту осуществления нуклеотидная последовательность расположена между генным сегментом VH1-2 человека и генным сегментом VH1-6 человека у гуманизированной мыши VELOCIMMUNE® (патенты США №6596541 и 7105348, включенные в настоящий документ посредством ссылки). Согласно одному варианту осуществления модифицированная таким образом гуманизированная мышь VELOCIMMUNE® содержит замещение всеми или, по сути, всеми вариабельными генными сегментами тяжелой цепи иммуноглобулина человека (всеми hVH, hDH и hJH) и всеми или, по сути, всеми вариабельными генными сегментами к легкой цепи иммуноглобулина человека (hVκ и hJκ).
Согласно одному аспекту функциональный локус ADAM6 мыши (или его ортолог или гомолог или функциональный фрагмент) может быть расположен среди генных сегментов VH человека, которые замещают эндогенные генные сегменты VH мыши. Согласно одному варианту осуществления все или, по сути, все генные сегменты VH мыши удаляют и замещают одним или несколькими генными сегментами VH человека, и локус ADAM6 мыши расположен непосредственно прилегающим к 3' концу генных сегментов VH человека, или между двумя генными сегментами VH человека. Согласно конкретному варианту осуществления локус ADAM6 мыши расположен между двумя генными сегментами VH вблизи 3' концов вставленных генных сегментов VH человека. Согласно конкретному варианту осуществления замещение предусматривает VH генные сегменты VH1-2 и VH6-1 человека, и локус ADAM6 мыши расположен ниже генного сегмента VH1-2 и выше генного сегмента Ун6-1. Согласно конкретному варианту осуществления расположение генных сегментов VH человека после этого является следующим (сверху вниз относительно направления транскрипции генных сегментов VH человека): VH1-2 человека - локус ADAM6 мыши - VH6-1 человека. Согласно конкретному варианту осуществления псевдоген ADAM6 между VH1-2 человека и Унб-1 человека замещен локусом ADAM6 мыши. Согласно одному варианту осуществления ориентация одного или нескольких из мышиного ADAM6a и мышиного ADAM6b локуса ADAM6 мыши является противоположной относительно направления транскрипции по сравнению с ориентацией генных сегментов VH человека. Альтернативно, локус ADAM6 мыши может быть расположен в межгенной области между наиболее 3' генным сегментом VH человека и наиболее 5' генным сегментом DH. Это может иметь место независимо от того, является ли наиболее 5' сегмент DH мышиным или человеческим.
Аналогично, мышь, модифицированная с помощью одного или нескольких генных сегментов VL человека (например, сегментов Vκ или Vλ), замещающих все или, по сути, все эндогенные VH генные сегменты мыши, может быть модифицирована так, чтобы или сохранять эндогенный локус ADAM6 мыши, как описано выше, например, путем использования нацеливающего вектора, характеризующегося расположенным ниже плечом гомологии, которое содержит локус ADAM6 мыши или его функциональный фрагмент, или замещать поврежденный локус ADAM6 мыши эктопической последовательностью, расположенной между двумя генными сегментами VL человека или между генными сегментами VL человека и генным сегментом DH (либо человека, либо мыши, например, Vλ+m/hDH), или генным сегментом J (либо человека, либо мыши, например, Vκ+JH). Согласно одному варианту осуществления замещение предусматривает два или более генных сегментов VL человека, и локус ADAM6 мыши или его функциональный фрагмент расположен между двумя наиболее 3' генными сегментами VL. Согласно конкретному варианту осуществления расположение генных сегментов VL человека после этого является следующим (сверху вниз относительно направления транскрипции генных сегментов человека): VL3'-1 человека - локус ADAM6 мыши - VL3' человека. Согласно одному варианту осуществления ориентация одного или нескольких из мышиного ADAM6a и мышиного ADAM6b локуса ADAM6 мыши является противоположной относительно направления транскрипции по сравнению с ориентацией VL генных сегментов человека. Альтернативно, локус ADAM6 мыши может быть расположен в межгенной области между наиболее 3' генным сегментом VL человека и наиболее 5' генным сегментом DH. Это может иметь место независимо от того, является ли наиболее 5' сегмент DH мышиным или человеческим.
Согласно одному аспекту предусматривается мышь с замещением одного или нескольких эндогенных генных сегментов VH мыши, и которая содержит по меньшей мере один эндогенный генный сегмент DH мыши. У такой мыши модификация эндогенных генных сегментов VH мыши может содержать модификацию одного или нескольких из наиболее 3' генных сегментов VH, но не наиболее 5' генный сегмент DH, причем нужно быть внимательным, чтобы модификация одного или нескольких наиболее 3' VH генных сегментов не разрушила эндогенный локус ADAM6 мыши или не сделала его нефункциональным. Например, согласно одному варианту осуществления мышь содержит замещение всех или, по сути, всех эндогенных VH генных сегментов мыши одним или несколькими генными сегментами VH человека, и мышь содержит один или несколько эндогенных генных сегментов DH и функциональный эндогенный локус ADAM6 мыши.
Согласно другому варианту осуществления мышь содержит модификацию эндогенных наиболее 3' генных сегментов VH мыши, и модификацию одного или нескольких эндогенных генных сегментов DH мыши, и модификацию проводят так, чтобы сохранить целостность эндогенного локуса ADAM6 мыши до такой степени, чтобы эндогенный ADAM6 локус оставался функциональным. Согласно одному примеру такую модификацию выполняют в две стадии: (1) замещение наиболее 3' эндогенных генных сегментов VH мыши одним или несколькими генными сегментами VH человека с использованием нацеливающего вектора с вышележащим плечом гомологии и нижележащим плечом гомологии, причем нижележащее плечо гомологии содержит весь или часть функционального локуса ADAM6 мыши; (2) затем замещение и эндогенного генного сегмента DH мыши с помощью нацеливающего вектора, содержащего вышележащее плечо гомологии, которое содержит весь или функциональную часть локуса ADAM6 мыши.
Согласно различным аспектам использование мышей, которые содержат эктопическую последовательность, которая кодирует белок ADAM6 мыши или его ортолог или гомолог или функциональные гомолог, является применимым, если модификации нарушают функцию эндогенного ADAM6 мыши. Вероятность разрушения функции эндогенного ADAM6 мыши является высокой при осуществлении модификаций в отношении локусов иммуноглобулина мыши, в частности, при модификации вариабельных областей тяжелой цепи иммуноглобулина мыши и окружающих последовательностей. Следовательно, такие мыши представляют конкретное преимущество при получении мышей с локусами тяжелой цепи иммуноглобулина, которые подвергнуты делеции полностью или частично, которые являются гуманизированными полностью или частично или замещенными (например, Vκ или Vλ последовательностями) полностью или частично. Способы получения генетических модификаций, описанных для мышей, описанных ниже, известны специалистам в настоящей области техники.
Мыши, содержащие эктопическую последовательность, кодирующую белок ADAM6 мыши или, по сути, идентичный или сходный белок, который обеспечивает улучшения фертильности белка ADAM6 мыши, являются особенно применимыми в связи с модификациями относительно генного локуса вариабельной области тяжелой цепи иммуноглобулина мыши, которые разрушают или подвергают делеции эндогенную последовательность ADAM6 мыши. Несмотря на то что изначально описаны в связи с мышами, которые экспрессируют антитела с вариабельными областями человека и константными областями мыши, такие мыши применимы в отношении любых генетических модификаций, которые нарушают эндогенный ген ADAM6 мыши. Специалистам в настоящей области понятно, что это охватывает широкое разнообразие генетически модифицированных мышей, которые содержат модификации генного локуса вариабельной области тяжелой цепи иммуноглобулина мыши. Они предусматривают, например, мышей с делецией или замещением всех или части генных сегментов тяжелой цепи иммуноглобулина мыши, независимо от других модификаций. Не ограничивающие примеры описаны ниже.
Согласно некоторым аспектам предусматриваются генетически модифицированные мыши, которые содержат эктопический ген ADAM6 мыши, грызуна или другого животного (или ортолог или гомолог или фрагмент), функциональный у мыши, и один или несколько генных сегментов вариабельной и/или константной области иммуноглобулина человека.
Согласно одному аспекту предусматривается мышь, которая содержит эктопическую последовательность ADAM6, которая кодирует функциональный белок ADAM6, замещение всех или, по сути, всех генных сегментов VH мыши одним или несколькими VH генными сегментами человека; замещение всех или, по сути, всех генных сегментов DH мыши одним или несколькими генными сегментами DH человека; и замещение всех или, по сути, всех генных сегментов JH мыши одним или несколькими генными сегментами JH человека.
Согласно одному варианту осуществления мышь дополнительно содержит замещение нуклеотидной последовательности СН1 мыши нуклеотидной последовательностью CH1 человека. Согласно одному варианту осуществления мышь дополнительно содержит замещение шарнирной нуклеотидной последовательности мыши шарнирной нуклеотидной последовательностью человека. Согласно одному варианту осуществления мышь дополнительно содержит замещение вариабельного локуса легкой цепи иммуноглобулина (VL и JL) вариабельным локусом легкой цепи иммуноглобулина человека. Согласно одному варианту осуществления мышь дополнительно содержит замещение нуклеотидной последовательности константной области легкой цепи иммуноглобулина мыши нуклеотидной последовательностью константной области легкой цепи иммуноглобулина человека. Согласно конкретному варианту осуществления VL, JL и CL представляют собой последовательности к легкой цепи иммуноглобулина. Согласно конкретному варианту осуществления мышь содержит последовательность константной области иммуноглобулина CH2 мыши и CH3 мыши, слитую с шарнирной последовательностью человека и последовательностью CH1 человека, так что локусы иммуноглобулина мыши реаранжируются для образования гена, который кодирует связывающий белок, содержащий (а) тяжелую цепь, которая содержит вариабельную область человека, область CH1 человека, шарнирную область человека и область CH2 мыши и область CH3 мыши; и (b) ген, который кодирует легкую цепь иммуноглобулина, которая содержит вариабельный домен человека и константную область человека.
Согласно одному аспекту предусматривается мышь, которая содержит эктопическую последовательность ADAM6, которая кодирует функциональный белок ADAM6, замещение всех или, по сути, всех генных сегментов VH мыши одним или несколькими генными сегментами VL человека, и необязательно замещение всех или, по сути, всех генных сегментов DH и/или генных сегментов JH одним или несколькими генными сегментами DH человека и/или генными сегментами JH человека, или необязательно замещение всех или, по сути, всех генных сегментов DH и генных сегментов JH одним или несколькими генными сегментами JL человека.
Согласно одному варианту осуществления мышь содержит замещение всех или, по сути, всех генных сегментов VH, DH и JH мыши одним или несколькими VL, одним или несколькими DH и одним или несколькими генными сегментами J (например, JΚ или Jλ), причем генные сегменты функционально связаны с эндогенной шарнирной областью мыши, причем мышь образует реаранжированный ген цепи иммуноглобулина, который содержит, от 5' к 3' в направлении транскрипции, VL человека-DH человека или мыши-J человека или мыши-шарнир мыши-CH2 мыши-CH3 мыши. Согласно одному варианту осуществления J область представляет собой JΚ область человека. Согласно одному варианту осуществления J область представляет собой JH область человека. Согласно одному варианту осуществления J область представляет собой Jλ область человека. Согласно одному варианту осуществления VL область человека выбрана из Vλ области человека и Vκ области человека.
Согласно конкретным вариантам осуществления мышь экспрессирует антитело с одним вариабельным доменом, содержащее константную область мыши или человека и вариабельную область, происходящую из Vκ человека, DH человека и Jκ человека; Vκ человека, DH человека и JH человека; Vλ человека, DH человека и Jλ человека; Vλ человека, DH человека и JH человека; Vκ человека, DH человека и Jλ человека; Vλ человека, DH человека и Jκ человека. Согласно конкретному варианту осуществления, последовательности распознавания рекомбинации модифицируют так, чтобы обеспечить осуществление продуктивных реаранжировок между указанными генными сегментами V, D и J или между указанными генными сегментами V и J.
Согласно одному аспекту предусматривается мышь, которая содержит эктопическую последовательность ADAM6, которая кодирует функциональный белок ADAM6 (или его ортолог или гомолог или функциональный фрагмент), замещение всех или, по сути, всех генных сегментов VH мыши одним или несколькими VL генными сегментами человека, замещение всех или, по сути, всех генных сегментов DH и генных сегментов JH мыши генными сегментами JL человека; причем у мыши отсутствует CH1 и/или шарнирная область.
Согласно одному варианту осуществления у мыши отсутствует последовательность, кодирующая домен CH1. Согласно одному варианту осуществления у мыши отсутствует последовательность, кодирующая шарнирную область. Согласно одному варианту осуществления у мыши отсутствует последовательность, кодирующая домен CH1 и шарнирную область.
Согласно конкретному варианту осуществления мышь экспрессирует связывающий белок, который содержит вариабельный домен легкой цепи (λ или κ) иммуноглобулина человека, слитый с доменом CH2 мыши, который прикреплен к домену CH3 мыши.
Согласно одному аспекту предусматривается мышь, которая содержит эктопическую последовательность ADAM6, которая кодирует функциональный белок ADAM6 (или его ортолог или гомолог или функциональный фрагмент), замещение всех или, по сути, всех генных сегментов VH мыши одним или несколькими генными сегментами VL человека, замещение всех или, по сути, всех генных сегментов DH и JH мыши генными сегментами JL человека.
Согласно одному варианту осуществления мышь содержит делецию генной последовательности константной области тяжелой цепи иммуноглобулина, кодирующей область СН1, шарнирную область, СН1 и шарнирную область или область СН1 и шарнирную область и область СН2.
Согласно одному варианту осуществления мышь образует связывающий один вариабельный домен белок, содержащий гомодимер, выбранный из следующего: (а) VL человека - СН1 мыши - СН2 мыши - СН3 мыши; (b) VL человека - шарнир мыши - СН2 мыши - СН3 мыши; (с) VL человека - СН2 мыши - СН3 мыши.
Согласно одному аспекту предусматривается мышь с недееспособным эндогенным локусом тяжелой цепи иммуноглобулина, содержащая недееспособный или удаленный эндогенный локус ADAM6 мыши, причем мышь содержит последовательность нуклеиновой кислоты, которая экспрессирует химерное антитело человека или мыши или человеческое/мышиное или другое химерное антитело. Согласно одному варианту осуществления последовательность нуклеиновой кислоты присутствует на интегрированном трансгене, который интегрирован случайным образом в геном мыши. Согласно одному варианту осуществления последовательность нуклеиновой кислоты находится на эписоме (например, хромосоме), не встречающейся у мыши дикого типа.
Общая, или универсальная легкая цепь
Предыдущие попытки получить применимые мультиспецифические связывающие эпитоп белки, например, биспецифические антитела, были затруднены различными проблемами, которые зачастую характеризовались общей парадигмой: in vitro селекция или манипуляция с последовательностями для рационального конструирования или для конструирования методом проб и ошибок подходящего формата для образования пары гетеродимерного биспецифического иммуноглобулина человека. К сожалению, большинство, если не все из in vitro инженерных подходов обеспечивают преимущественно узкоспециализированные решения проблем, которые являются подходящими, если вообще ими являются, для отдельных молекул. С другой стороны, in vivo способы для использования сложных организмов для отбора соответствующих пар, которые способны привести к получению терапевтических средств для людей, не были реализованы.
Как правило, нативные мышиные последовательности зачастую не представляют собой хороший источник терапевтических последовательностей человека. По меньшей мере по этой причине, создание вариабельных областей тяжелой цепи иммуноглобулина мыши, которые образуют пары с общей легкой цепью человека, находит ограниченную практическую применимость. Больше попыток конструирования in vitro будет затрачено в методе проб и ошибок в попытке гуманизировать вариабельные последовательности тяжелой цепи мыши, при этом надеясь сохранить специфичность и аффинность эпитопа при поддержании способности соединяться с общей легкой цепью человека, с неопределенным результатом. В конце такого процесса конечный продукт может сохранять некоторую специфичность и аффинность, и связываться с общей легкой цепью, но в конечном счете иммуногенность у человека, вероятно, будет сохранять значительную степень опасности.
Следовательно, подходящая мышь для получения терапевтических средств для людей будет содержать соответствующим образом большой репертуар генных сегментов вариабельной области тяжелой цепи человека вместо эндогенных генных сегментов вариабельной области тяжелой цепи мыши. Генные сегменты вариабельной области тяжелой цепи человека должны быть способны реаранжироваться и рекомбинироваться с эндогенным константным доменом тяжелой цепи мыши для образования обратной химерной тяжелой цепи (т.е., тяжелой цепи, содержащей вариабельный домен человека и константную область мыши). Тяжелая цепь должна быть способна к переключению класса и соматической гипермутации так, чтобы подходящим образом большой репертуар вариабельных доменов тяжелой цепи был доступен для мыши для выбора одного, который может связываться с ограниченным репертуаром вариабельные области легкой цепи человека.
Мышь, которая выбирает общую легкую цепь для множества тяжелых цепей, характеризуется практической применимостью. Согласно различным вариантам осуществления антитела, которые экспрессируются у мыши, которая может экспрессировать только общую легкую цепь, будут содержать тяжелые цепи, которые могут связываться и экспрессироваться с идентичной или, по сути, идентичной легкой цепью. Это особенно применимо в получении биспецифических антител. Например, такая мышь может быть иммунизирована первым иммуногеном для образования В-клетки, которая экспрессирует антитело, которое специфически связывает первый эпитоп. Мышь (или мышь, аналогичная генетически) может быть иммунизирована вторым иммуногеном для образования В-клетки, которая экспрессирует антитело, которое специфически связывает второй эпитоп. Вариабельные тяжелые области могут быть клонированы из В-клеток и экспрессированы с одинаковой константной областью тяжелой цепи и одинаковой легкой цепью, и экспрессированы в клетке для образования биспецифического антитела, причем компонент легкой цепи биспецифического антитела был выбран мышью для связывания и экспрессии с компонентном легкой цепи.
Авторы настоящего изобретения сконструировали мышь для образования легких цепей иммуноглобулина, которые будут подходящим образом создавать пары с достаточно разнообразным семейством тяжелых цепей, включающим тяжелые цепи, чьи вариабельные области отклоняются от зародышевых последовательностей, например, вариабельные области созревшей аффинности или соматически мутированные вариабельные области. Согласно различным вариантам осуществления мышь разработана для спаривания вариабельных доменов легкой цепи человека с вариабельными доменами тяжелой цепи человека, которые содержат соматические мутации, таким образом, обеспечивая путь к получению связывающих белков с высокой аффинностью, подходящих для применения в качестве терапевтических средств для людей.
Генетически сконструированная мышь посредством длительного и сложного процесса селекции антитела в пределах организма, образует биологически приемлемые выборы в спаривании разнообразного набора вариабельных доменов тяжелой цепи человека с ограниченным числом вариантов легкой цепи человека. Для достижения этого мышь конструируют так, чтобы она представляла ограниченное число вариантов вариабельных доменов легкой цепи человека в сочетании с широким разнообразием вариантов вариабельных доменов тяжелой цепи человека. При сенсибилизации антигеном мышь максимально увеличивает число решений в ее репертуаре для развития антитела к антигену, ограниченное преимущественно или исключительно числом или варианты легких цепей в ее репертуаре. Согласно различным вариантам осуществления это включает предоставление мыши возможности достичь подходящих и совместимых соматических мутаций вариабельного домена легкой цепи, которые будут при этом совместимыми с относительно широким разнообразием вариабельных доменов тяжелой цепи человека, предусматривая, в частности, соматически мутированные вариабельные домены тяжелой цепи человека.
Для достижения ограниченного репертуара вариантов легкой цепи мышь конструируют для приведения в нефункциональное или, по сути, нефункциональное состояние ее способности образовывать, или реаранжировать, нативный вариабельный домен легкая цепь мыши. Этого можно достичь, например, путем удаления генных сегментов вариабельной области легкой цепи мыши. Эндогенный локус мыши может затем быть модифицирован с помощью экзогенного подходящего предпочтительного генного сегмента вариабельной области легкой цепи человека, функционально связанного с эндогенным константным доменом легкой цепи мыши, таким способом, чтобы экзогенные генные сегменты вариабельной области человека могли комбинироваться с эндогенным геном константной области легкой цепи мыши и формировать реаранжированный ген обратной химерной легкой цепи (вариабельная область человека, константная область мыши). Согласно различным вариантам осуществления вариабельная область легкой цепи способна быть соматически мутированной. Согласно различным вариантам осуществления для максимизации способности вариабельной области легкой цепи к достижению соматических мутаций подходящий(е) энхансер(ы) у мыши сохраняют. Например, в модификации локуса к легкой цепи мыши для замещения эндогенных генных сегментов к легкой цепи мыши генными сегментами κ легкой цепи человека к интронный энхансер мыши и κ 3' энхансер мыши являются функционально сохраненными или неразрушенными.
Предлагается генетически сконструированная мышь, которая экспрессирует ограниченный репертуар обратных химерных (вариабельная область человека, константная область мыши) легких цепей, связанных с разнообразием обратных химерных (вариабельная область человека, константная область мыши) тяжелых цепей. Согласно различным вариантам осуществления эндогенные генные сегменты к легкой цепи мыши подвергают делеции и замещают одной (или двумя) реаранжированной областью легкой цепи человека, функционально связанной с эндогенным геном Сκ мыши. Согласно вариантам осуществления для максимизации соматической гипермутации реаранжированной области легкой цепи человека сохраняют к интронный энхансер мыши и к 3' энхансер мыши. Согласно различным вариантам осуществления мышь также содержит нефункциональный локус λ легкой цепи или его делецию или делецию, которая делает локус, неспособным образовывать λ легкую цепь.
Предусматривается генетически сконструированная мышь, которая согласно различным вариантам осуществления содержит локус вариабельной области легкой цепи, не содержащий эндогенные генные сегменты VL и JL легкой цепи мыши и содержащий реаранжированную вариабельную область легкой цепи человека, согласно одному варианту осуществления реаранжированную последовательность VL/JL человека, функционально связанную с константной областью мыши, причем локус способен подвергаться соматической гипермутации, и при этом локус экспрессирует легкую цепь, содержащую последовательность VL/JL человека, связанную с константной областью мыши. Таким образом, согласно различным вариантам осуществления локус содержит κ 3' энхансер мыши, который связан с нормальным уровнем соматической гипермутации, или уровнем дикого типа.
Генетически сконструированная мышь согласно различным вариантам осуществления, будучи иммунизированной представляющим интерес антигеном, образует В-клетки, которые проявляют разнообразие реаранжировок вариабельных областей тяжелой цепи иммуноглобулина человека, которые экспрессируют и функционируют с одной или двумя реаранжированными легкими цепями, предусматривая варианты осуществления, где одна или две легкие цепи содержат вариабельные области легкой цепи человека, которые содержат, например, 1-5 соматических мутаций. Согласно различным вариантам осуществления легкие цепи человека, экспрессированные таким образом, способны к ассоциации и экспрессии с любой вариабельной областью тяжелой цепи иммуноглобулина человека, экспрессированной у мыши.
Связывающие эпитоп белки, которые связывают более чем один эпитоп
Описанные в настоящем документе композиции и способы могут использоваться для образования связывающих белков, которые связывают более чем один эпитоп с высокой аффинностью, например, биспецифических антител. Преимущества настоящего изобретения предусматривают способность выбирать подходящим образом высокую степень связывания тяжелых цепей иммуноглобулина (например, с созревшей аффинностью), каждая из которых будет ассоциироваться с одной легкой цепью.
Синтез и экспрессия биспецифических связывающих белков были проблематичными, частично вследствие ограничений, связанных с установлением подходящей легкой цепи, которая может связываться и экспрессироваться с двумя различными тяжелыми цепями, и частично вследствие проблем с выделением. Описанные в настоящем документе способы и композиции предусматривают генетически модифицированную мышь для выбора, посредством в остальном нормальных процессов, подходящей легкой цепи, которая может связываться и экспрессироваться с более чем одной тяжелой цепью, предусматривая тяжелые цепи, являющиеся соматически мутированными (например, с созревшей аффинностью). Последовательности VL и VH человека из подходящих В-клеток описанных в настоящем документе иммунизированных мышей, которые экспрессируют антитела созревшей аффинности, содержащие обратные химерные тяжелые цепи (т.е., вариабельная область человека и константная область мыши), могут быть установлены и клонированы в вектор экспрессии с подходящей генной последовательностью константной области человека (например, IgG1 человека). Могут быть получены две таких конструкции, причем каждая конструкция кодирует вариабельный домен тяжелой цепи человека, который связывает различный эпитоп. Одна из VL человека (например, Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека), в зародышевой последовательности или из В-клетки, причем последовательность была соматически мутирована, может быть слита внутри рамки считывания с подходящим геном константной области человека (например, геном к константной области человека). Эти три полностью человеческих тяжелых и легких конструкции могут быть помещены в подходящую клетку для экспрессии. Клетка будет экспрессировать два основных вида: гомодимерную тяжелую цепь с идентичной легкой цепью и гетеродимерную тяжелую цепь с идентичной легкой цепью. Для обеспечения легкого разделения этих основных видов одну из тяжелых цепей модифицируют для исключения связывающей белок А детерминанты, получая в результате дифференциальную аффинность гомодимерного связывающего белка от гетеродимерного связывающего белка. Адресованные этому вопросу композиции и способы описаны в USSN 12/832838, поданной 25 июня 2010, имеющей название "Readily Isolated Bispecific Antibodies with Native Immunoglobulin Format", опубликованной в виде US 2010/0331527 A1, включенной в настоящий документ посредством ссылки.
Согласно одному аспекту предусматривается описанный в настоящем документе связывающий эпитоп белок, причем последовательности VL и VH человека происходят из описанных в настоящем документе мышей, которые были иммунизированы антигеном, содержащим представляющий интерес эпитоп.
Согласно одному варианту осуществления предусматривается связывающий эпитоп белок, который содержит первый и второй полипептид, причем первый полипептид содержит, с N-конца к С-концу, связывающую первый эпитоп область, которая селективно связывает первый эпитоп, за которой следует константная область, которая содержит первую область СН3 IgG человека, выбранного из IgG1, IgG2, IgG4 и их комбинации; и второй полипептид содержит, с N-конца к С-концу, связывающую второй эпитоп область, которая селективно связывает второй эпитоп, за которой следует константная область, которая содержит вторую область СН3 человека IgG, выбранного из IgG1, IgG2, IgG4 и их комбинации, причем вторая область СН3 содержит модификацию, которая снижает или устраняет связывание второго домена СН3 с белком А.
Согласно одному варианту осуществления вторая область СН3 содержит модификацию H95R (по нумерации экзонов IMGT; H435R по нумерации EU). Согласно другому варианту осуществления вторая область СН3 дополнительно содержит модификацию Y96F (IMGT; Y436F по EU).
Согласно одному варианту осуществления вторая область СН3 происходит из модифицированного IgG1 человека и дополнительно содержит модификацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L358M, N384S, K392N, V397M и V422I по EU).
Согласно одному варианту осуществления вторая область СН3 происходит из модифицированного IgG2 человека и дополнительно содержит модификацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT; N384S, K392N и V422I по EU).
Согласно одному варианту осуществления вторая область СН3 происходит из модифицированного IgG4 человека и дополнительно содержит модификацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по EU).
Одним способом получения связывающего эпитоп белка, который связывает более чем один эпитоп, является иммунизация первой мыши согласно настоящему изобретению антигеном, который содержит первый представляющий интерес эпитоп, причем мышь содержит эндогенный локус вариабельной области легкой цепи иммуноглобулина, который не содержит эндогенную VL мыши, которая способна к реаранжировка и формированию легкой цепи, причем на эндогенном локусе вариабельной области легкой цепи иммуноглобулина мыши находится единственная реаранжированная область VL человека, функционально связанная с эндогенным геном константной области легкой цепи мыши, и реаранжированная область VL человека выбрана из Vκ1-39Jκ5 человека и Vκ3-20Jκ1 человека, и эндогенные генные сегменты VH мыши были замещены полностью или частично генными сегментами VH человека, так чтобы тяжелые цепи иммуноглобулина, образованные мышью, представляли собой исключительно или, по сути, тяжелые цепи, которые содержат вариабельные домены человека и константные домены мыши. Будучи иммунизированной, такая мышь будет образовывать обратное химерное антитело, содержащее только один из двух вариабельных доменов легкой цепи человека (например, один из Vκ1-39Jκ5 человека или Vκ3-20Jκ1 человека). Как только определяют В-клетку, которая кодирует VH, который связывает представляющий интерес эпитоп, нуклеотидная последовательность VH (и необязательно VL) может быть извлечена (например, с помощью ПЦР) и клонирована в конструкцию экспрессии внутри рамки считывания с подходящим константным доменом иммуноглобулина человека. Этот процесс может быть повторен для определения второго домена VH, который связывает второй эпитоп, и вторая генная последовательность VH может быть извлечена и клонирована в вектор экспрессии внутри рамки считывания со вторым подходящим константным доменом иммуноглобулина. Первый и второй константные домены иммуноглобулина могут принадлежать одному или различному изотипу, и один из константных доменов иммуноглобулина (но не оставшийся) может быть модифицирован, как описано в настоящем документе или в заявке на патент США №2010/0331527 А1, и связывающий эпитоп белок может быть экспрессирован в подходящей клетке и выделен на основании его дифференциальной аффинности к белку А по сравнению с гомодимерным связывающим эпитоп белком, например, как описано в заявке на патент США №2010/0331527 А1.
Согласно одному варианту осуществления предлагается способ получения биспецифического связывающего эпитоп белка, включающий определение первой нуклеотидной последовательности VH (VH1) созревшей аффинности (например, содержащей одну или несколько соматических гипермутаций) человека из описанной в настоящем документе мыши, определение второй нуклеотидная последовательность VH (VH2) созревшей аффинности (например, содержащей одну или несколько соматических гипермутаций) человека из описанной в настоящем документе мышь, клонирование VH1 внутри рамки считывания с тяжелой цепью человека, не содержащей модификацию детерминанты белка А, как описано в заявке на патент США №US 2010/0331527 А1 для образования тяжелой цепи 1 (НС1), клонирование VH2 внутри рамки считывания с тяжелой цепью человека, содержащей детерминанту белка А, как описано в заявке на патент США №2010/0331527 А1, для образования тяжелой цепи 2 (НС2), введение вектора экспрессии, содержащего НС1, и аналогичного или другого вектора экспрессии, содержащего НС2, в клетку, причем клетка также экспрессирует легкую цепь иммуноглобулина человека, которая содержит Vκ1-39 человека/Jκ5 человека или Vκ3-20 человека/Jκ1 человека, слитую с константным доменом легкой цепи человека, позволяя клетке экспрессировать биспецифический связывающий эпитоп белок, содержащий домен VH, кодируемый VH1, и домен VH, кодируемый VH2, и выделение биспецифического связывающего эпитоп белка на основании его дифференциальной способности связывать белок А по сравнению с моноспецифическим гомодимерным связывающим эпитоп белком. Согласно конкретному варианту осуществления НС1 представляет собой IgG1 и НС2 представляет собой IgG1, который содержит модификацию H95R (IMGT; H435R по EU) и дополнительно содержит модификацию Y96F (IMGT; Y436F по EU). Согласно одному варианту осуществления домен VH, кодируемый VH1, домен VH, кодируемый VH2, или оба, являются соматически мутированными.
Гены VH человека, которые экспрессируются с общей VL человека
Разнообразные вариабельные области человека из антител созревшей аффинности, возникших к четырем различным антигенам, экспрессировали либо с их когнатной легкой цепью, либо по меньшей мере с одной из легких цепей человека, выбранной из Vκ1-39Jκ5 человека, Vκ3-20Jκ1 человека или Vпре-BJλ5 человека (смотрите пример 10). Для антител к каждому из антигенов соматически мутированные тяжелые цепи высокой аффинности из различных семейств генов успешно образовывали пары с реаранжированными зародышевыми областями Vκ1-39Jκ5 и Vκ3-20Jκ1 человека и секретировались из клеток, экспрессирующих тяжелые и легкие цепи. Для Vκ1-39Jκ5 и Vκ3-20Jκ1 домены VH, происходящие из следующих семейств генов VH человека, благоприятно экспрессировались: 1-2, 1-8, 1-24, 2-5, 3-7, 3-9, 3-11, 3-13, 3-15, 3-20, 3-23, 3-30, 3-33, 3-48, 4-31, 4-39, 4-59, 5-51 и 6-1. Таким образом, мышь, которую конструировали для экспрессии ограниченного репертуара доменов VL человека из одной или обеих Vκ1-39Jκ5 и Vκ3-20Jκ1, будет образовывать разнообразную популяцию соматически мутированных доменов VH человека из локуса VH, модифицированного для замещения генных сегментов VH мыши генными сегментами VH человека.
Мыши, генетически сконструированные для экспрессии обратных химерных (вариабельная область человека, константная область мыши) тяжелых цепей иммуноглобулина, ассоциированных с единственной реаранжированной легкой цепью (например, Vκ1-39/J или Vκ3-20/J), будучи иммунизированной представляющий интерес антигеном, образовывали В-клетки, которые содержали разнообразие реаранжировок VH человека и экспрессировали разнообразие высокоаффинных антиген-специфических антител с разнообразными свойствами относительно их способности блокировать связывание антигена с его лигандом и относительно их способности связывать варианты антигена (смотрите примеры 14-15).
Таким образом, описанные в настоящем документе мыши и способы применимы в получении и селекции вариабельных доменов тяжелой цепи иммуноглобулина человека, включающих соматически мутированные вариабельные домены тяжелой цепи человека, которые являются результатом разнообразия реаранжировок, которые проявляют широкий спектр аффинностей (предусматривая проявление KD, являющейся приблизительно наномолярной или менее), широкий спектр специфичностей (предусматривая связывание с различными эпитопами одного антигена) и которые связываются и экспрессируются с одинаковой или, по сути, одинаковой вариабельной областью легкой цепи иммуноглобулина человека.
Согласно одному аспекту первая мышь, содержащая гуманизированный локус вариабельной области тяжелой цепи скрещивают со второй мышью, содержащей последовательность нуклеиновой кислоты, кодирующую описанный в настоящем документе локус общей, или универсальной легкой цепи. Согласно одному варианту осуществления первая или вторая мышь содержит эктопическую последовательность нуклеиновой кислоты, кодирующую ADAM6 мыши или его ортолог или гомолог или функциональный фрагмент. Потомство скрещивают для получения мышей, гомозиготных в отношении гуманизированного локуса тяжелой цепи, и гомозиготных в отношении локуса универсальной легкой цепи. Согласно одному варианту осуществления первая мышь или вторая мышь содержит модификацию эндогенного локуса легкой цепи мыши, чтобы сделать эндогенный локус легкой цепи мыши нефункциональным (например, делеция или нокаут, например, λ и/или κ эндогенного локуса). Согласно одному варианту осуществления первая мышь содержит замещение всех или, по сути, всех функциональных эндогенных генных сегментов V, D и J мыши одним или несколькими переаранжированными генными сегментами V, D и J человека (например, всеми или, по сути, всеми функциональными генными сегментами V, D и J человека); и мышь содержит замещение всех или, по сути, всех функциональных генных сегментов V и J легкой цепи не более чем одной или не более чем двумя реаранжированными последовательностями V/J легкой цепи. Согласно одному варианту осуществления первая мышь дополнительно содержит эктопическую последовательность нуклеиновой кислоты, которая кодирует ADAM6 мыши или его ортолог или гомолог или функциональный фрагмент. Согласно одному варианту осуществления эктопическая последовательность нуклеиновой кислоты находится на гуманизированном локусе тяжелой цепи иммуноглобулина.
Согласно одному варианту осуществления мышей, которые содержат эктопическую последовательность и которые являются гомозиготными в отношении универсального локуса легкой цепи и в отношении гуманизированного локуса тяжелой цепи, иммунизируют представляющим интерес антигеном для образования антител, которые содержат множество соматически мутированных вариабельных доменов человека, которые связываются и экспрессируются с универсальной легкой цепью. Согласно одному варианту осуществления последовательности нуклеиновых кислот вариабельного домена тяжелой цепи человека, определенные у мыши, используются в системе экспрессии для получения полностью человеческого антитела, содержащего вариабельный домен тяжелой цепи человека и легкую цепь, содержащую последовательность универсальной легкой цепи мыши.
Следующие примеры представлены для того, чтобы описать специалистам в настоящей области техники получение и применение способов и композиций настоящего изобретения и не предусмотрены для ограничения объема того, что авторы настоящего изобретения рассматривают как их изобретение. Были предприняты попытки соблюдения точности относительно используемых чисел (например, количеств, температуры и т.д.), но необходимо учитывать некоторые экспериментальные погрешности и отклонения. Если не указано иное, части представляют собой части по весу, молекулярный вес представляет собой средний молекулярный вес, температура указана в градусах Цельсия и давление равно или близко атмосферному.
ПРИМЕРЫ
Пример I
Гуманизация генов иммуноглобулина мыши
Бактериальные искусственные хромосомы (ВАС) человека и мыши использовали для конструирования 13 различных основанных на ВАС нацеливающих векторов (BACvec) для гуманизации локусов тяжелой цепи и κ легкой цепи иммуноглобулина мыши. На таблицах 1 и 2 представлены подробные описания стадий, проведенных для конструкции всех BACvec, используемых для гуманизации локусов тяжелой цепи и κ легкой цепи иммуноглобулина мыши, соответственно.
Определение ВАС человека и мыши.
ВАС мыши, которые охватывают 5' и 3' концы локусов тяжелой цепи и к легкой цепи иммуноглобулина, определяли путем гибридизации фильтров, на которые точечно наносили библиотеку ВАС, или путем скрининга с помощью ПЦР пулов ДНК библиотеки ВАС мыши. Фильтры гибридизировали при стандартных условиях с использованием зондов, которые соответствовали представляющим интерес областям. Пулы библиотеки подвергали скринингу путем ПЦР с использованием пар уникальных праймеров, которые фланкируют целевую представляющую интерес область. Дополнительную ПЦР с использованием тех же праймеров проводили для деконволюции данной лунки и выделения соответствующей представляющей интерес ВАС. Как фильтры ВАС, так и пулы библиотеки создавали из ES клеток 129 SvJ мыши (Incyte Genomics/Invitrogen). ВАС человека, которые охватывают все целые локусы тяжелой цепи и к легкой цепи иммуноглобулина определяли или с помощью гибридизации фильтров, на которые точечно наносили библиотеку ВАС (библиотеки Caltech В, С или D и библиотека RPCI-11, Research GeneticsAnvitrogen) посредством скрининга пулов библиотеки ВАС человека (библиотека Caltech, Invitrogen) с помощью основанного на ПЦР способа или с использованием баз данных концевых последовательностей ВАС (библиотека Caltech D, TIGR).
Конструкция BACvec (таблицы 1 и 2).
Бактериальную гомологичную рекомбинацию (BHR) проводили, как описано (Valenzuela et al., 2003; Zhang, Y., et al. (1998). A new logic for DNA engineering using recombination in Escherichia coli. Nat Genet 20, 123-128). В большинстве случаев линейные фрагменты создавали путем лигирования полученных с помощью ПЦР гомологичных фрагментов с клонированными кассетами с последующим выделением с использованием геля продуктов лигирования и электропорации в BHR-компетентные бактерии, содержащие целевую ВАС. После селекции на чашках Петри с соответствующим антибиотиком, правильно рекомбинированные ВАС определяли с помощью ПЦР в обоих новых участках соединения с последующим рестрикционным анализом на гелях в пульсирующем поле (Schwartz, D.C., and Cantor, C.R. (1984) Separation of yeast chromosome-sized DNAs by pulsed field gradient gel electrophoresis. Cell 37, 67-75) и выборочной проверкой с помощью ПЦР с использованием праймеров, распределенных в последовательностях человека.
3hVH BACvec конструировали с использованием трех последовательных стадий BHR для начальной стадии гуманизации локуса тяжелой цепи иммуноглобулина (фиг.4А и таблица 1). На первой стадии (стадия 1) кассету вводили в родительскую ВАС человека выше против хода транскрипции от генного сегмента VH1-3 человека, который содержит область гомологии с локусом тяжелой цепи иммуноглобулина мыши (НВ1), ген, который обеспечивает устойчивость к канамицину у бактерий и устойчивость к G418 у клеток животных (kanR) и сайт сайт-специфической рекомбинации (например, loxP). На второй стадии (стадия 2), вторую кассету вводили сразу ниже по ходу транскрипции от последнего JH сегмента, который содержит вторую область гомологии с локусом тяжелой цепи иммуноглобулина мыши (НВ2) и ген, который обеспечивает устойчивость бактерий к спектиномицину (specR). Эта вторая стадия предусматривала делецию последовательностей локуса тяжелой цепи иммуноглобулина человека ниже по ходу транскрипции от JH6 и ген устойчивости к хлорамфениколу из вектора ВАС (cmR). На третьей стадии (стадия 3) дважды модифицированную ВАС человека (В1) затем линеаризировали с использованием сайтов I-CeuI, которые добавляли в ходе первых двух стадий и интегрировали в ВАС мыши (В2) с помощью BHR через две области гомологии (НВ1 и НВ2). Отборы по чувствительности к лекарственным средствам для первой (cm/kan), второй (spec/kan) и третьей (cm/kan) стадий разрабатывали так, чтобы они были специфическими для необходимых продуктов. Модифицированные клоны ВАС анализировала с помощью гель-электрофореза в пульсирующем поле (PFGE) после обработки рестрикционных ферментов для определения приемлемой конструкции (фиг.4В).
Аналогичным образом 12 дополнительных BACvec сконструировали для гуманизации локусов тяжелой цепи и к легкой цепи. В некоторых случаях лигирование ВАС проводили вместо BHR для сочетания двух больших ВАС посредством введения редких сайтов рестрикции в оба родительских BACvec с помощью BHR наряду с точным размещением селектируемых маркеров. Это обеспечивает выживание необходимого продукта лигирования при селекции с помощью маркерных комбинаций специфических лекарственных средств. Рекомбинантные ВАС, полученные путем лигирования после обработки с помощью редких рестрикционных ферментов, определяли и подвергали скринингу способом, аналогичным для ВАС, полученных с помощью BHR (как описано выше).
|
|
Модификация эмбриональных стволовых (ES) клеток и создание мышей
Нацеленное воздействие на ES клетки (F1H4) проводили с использованием способа генной инженерии VELOCIGENE®, как описано (Valenzuela et al., 2003). Получение мышей из модифицированных ES клеток либо с помощью инъекции бластоцисты (Valenzuela et al., 2003), либо инъекции 8 клеток (Poueymirou et al., 2007) соответствовало описанному. Нацеленные ES клетки и мышей подтверждали с помощью скрининга ДНК из ES клеток или мышей с помощью уникальных наборов зондов и праймеров в основанном на ПЦР анализе (например, фиг.3А, 3В и 3С). Все исследования на мышах проводились под наблюдением и были одобрены Институциональным комитетом по содержанию и использованию животных Regeneron (IACUC).
Анализ кариотипа и флуоресцентная гибридизация in situ (FISH)
Анализ кариотипа проводили с помощью Coriell Cell Repositories (Coriell Institute for Medical Research, Камден, Нью-Джерси). FISH проводили на нацеленных ES клетках, как описано (Valenzuela et al., 2003). Зонды, соответствующие либо ДНК ВАС мыши, либо ДНК ВАС человека, метили с помощью ник-трансляции (Invitrogen) с помощью флуоресцентно меченых dUTP нуклеотидов оранжевого или зеленого спектра (Vysis).
Вариабельный генный локус тяжелой цепи иммуноглобулина
Гуманизацию вариабельной области локуса тяжелой цепи выполняли за девять последовательных стадий путем прямого замещения приблизительно трех миллионов пар оснований (Mb) смежной геномной последовательности мыши, содержащей все генные сегменты VH, DH и JH, приблизительно одной Mb смежной геномной последовательности человека, содержащей эквивалентные генные сегменты человека (фиг.1А и таблица 1) с использованием VELOCIGENE® технология генной инженерии (смотрите, например, патент США №6586251 и Valenzuela et al., 2003).
Интрон между генными сегментами JH и генами константной области (интрон J-C) содержит транскрипционный энхансер (Neuberger, M.S. (1983) Expression and regulation of immunoglobulin heavy chain gene transfected into lymphoid cells. EMBO J 2, 1373-1378), за которым следует область простых повторов, необходимых для рекомбинации в ходе переключения изотипа (Kataoka, Т. et al. (1980) Rearrangement of immunoglobulin gamma 1-chain gene and mechanism for heavy-chain class switch. Proc Natl Acad Sci USA 77, 919-923). Участок соединения между областью VH-DH-JH человека и CH областью мыши (проксимальный участок соединения) выбирали для сохранения интронного энхансера тяжелой цепи мыши и переключения домена для сохранения как эффективной экспрессии, так и переключения класса гуманизированного локуса тяжелой цепи у мыши. Определение точного положения нуклеотидов этого и последующих участков соединения во всех замещениях было возможным путем использования способа генной инженерии VELOCIGENE® (ранее), который использовал бактериальную гомологичную рекомбинацию, управляемую синтезированными олигонуклеотидами. Таким образом, проксимальный участок соединения располагали приблизительно на 200 п.н. ниже по ходу транскрипции от последнего генного сегмента JH и дистальный участок соединения располагали на несколько сотен выше против хода транскрипции от наиболее 5' генного сегмента VH локуса человека и приблизительно на 9 т.п.о. ниже по ходу транскрипции от генного сегмента VH1-86 мыши, также известного как J558.55. Генный сегмент VH1-86 (J558.55) мыши представляет собой наиболее дистальный вариабельный генный сегмент тяжелой цепи, который, как сообщается, представляет собой псевдоген у C57BL/6 мышей, но является потенциально активным, хотя и со слабой последовательностью RSS, в нацеленном 129 аллеле. Дистальный конец локуса тяжелой цепи мыши, как сообщается, может содержать контрольные элементы, которые регулируют экспрессию и/или реаранжировку локуса (Pawlitzky et al., 2006).
Первую вставку последовательности ДНК иммуноглобулина человека в мышь осуществляли с использованием 144 т.п.о. проксимального конца локуса тяжелой цепи человека, содержащего 3VH, все 27 DH и 9 JH генных сегментов человека, вставленных в проксимальный конец локус IgH мыши, с сопутствующей 16,6 т.п.о. делецией геномной последовательности мыши с использованием приблизительно 75 т.п.о. плечей гомологии мыши (стадия А, фиг.2А; таблицы 1 и 3, 3hVH). Эту большую 144 т.п.о. вставку и сопутствующую 16,6 т.п.о. делецию проводили в одной стадии (стадия А), которая происходила с частотой, составляющей 0,2% (таблица 3). Правильно нацеленные ES клетки подсчитывали с помощью анализа потери нативного аллеля (LONA) (Valenzuela et al., 2003) с использованием зондов в пределах удаленной последовательности мыши и фланкирующих ее и в пределах вставленной последовательности человека, и целостность большой вставки человека подтверждали с использованием множественных зондов, охватывающих всю вставку (фиг.3А, 3В и 3С). Поскольку предполагали много циклов последовательного нацеленного воздействия на ES клетки, нацеленные ES клеточные клоны на этой и всех последующих стадиях подвергали кариотипическому анализу (ранее) и только те клоны, которые показывали нормальные кариотипы меньшей мере в 17 из 20 выборок использовали для последующих стадий.
Нацеленные ES клетки из стадии А подвергали повторному нацеленному воздействию с помощью BACvec, который производил 19 т.п.о. делецию на дистальном конце локуса тяжелой цепи (стадия В, фиг.2А). BACvec стадии В содержал ген устойчивости к гигромицину (hyg) в отличие от гена устойчивости к неомицину (neo), содержащегося на BACvec стадии А. Гены устойчивости из двух BACvec разработали так, чтобы при успешном нацеленном воздействии на одну и ту же хромосому, приблизительно три Mb вариабельного генного локуса тяжелой цепи мыши, содержащего все генные сегменты VH мыши, отличные от VH1-86 и все генные сегменты DH, отличные от DQ52, а также два гена устойчивости, фланкировали с помощью сайтов loxP; DQ52 и все генные сегменты JH цепи мыши удаляли на стадии А. ES клеточные клоны, дважды нацеленные на одну и ту же хромосому, определяли, приводя проксимальную кассету 3hVH к гомозиготности в клетках с высоким содержанием G418 (Mortensen, R.M. et al. (1992) Production of homozygous mutant ES cells with a single targeting construct. Mol Cell Biol 12:2391-239) и следуя направлению дистальной кассеты hyg. Сегменты мыши размером до четырех Mb, модифицированные таким образом, чтобы фланкироваться сайтами loxP, успешно удаляли в ES клетках путем временной экспрессии CRE рекомбиназы с высокими показателями результативности (до ≈11%) даже при отсутствии селекции по чувствительности к лекарственным средствам (Zheng, В., et al. (2000). Engineering mouse chromosomes with Cre-loxP: range, efficiency, and somatic applications. Mol Cell Biol 20:648-655). Сходным образом, авторы настоящего изобретения осуществили трех Mb делецию у 8% ES клеточных клонов после временной экспрессии Cre (стадия С, фиг.2А; таблица 3). Делецию оценивали с помощью анализа LONA с использованием зондов на любом конце удаленной последовательности мыши, а также потерю neo и hyg и появление продукта ПЦР в точке делеции, содержащей единственный оставшийся сайт 1охР. Более того, делецию подтверждали путем флуоресцентной гибридизации in situ (данные не показаны).
Остаток вариабельной области тяжелой цепи человека добавляли к аллелю 3hVH в серии из 5 стадий с использованием способа генной инженерии VELOCIGENE® (стадии Е-Н, фиг.2В), причем каждая стадия включала точную вставку до 210 т.п.о. генных последовательностей человека. Для каждой стадии проксимальный конец каждого нового BACvec разрабатывали так, чтобы он перекрывал наиболее дистальные последовательности человека предыдущей стадии и дистальный конец каждого нового BACvec содержал такую же дистальную область гомологии мыши, как использовалась на стадии A. BACvec из стадий D, F и Н содержали кассеты селекции neo, тогда как BACvec из стадий Е и G содержали кассеты селекции hyg, таким образом, селекции чередовали между G418 и гигромицином. Нацеленное воздействие на стадии D анализировали с помощью потери уникального продукта ПЦР в дистальном сайте loxP гибридного аллеля 3hVН. Нацеленное воздействие для стадий Е-I анализировали с помощью потери предыдущей кассеты селекции. На конечной стадии (стадия I, фиг.2В) кассету селекции neo, фланкированную сайтами Frt (McLeod, M. et al. (1986) Identification of the crossover site during FLP-mediated recombination in the Saccharomyces cerevisiae plasmid 2 microns circle. Mol Cell Biol 6, 3357-3367), удаляли с помощью временной экспрессии FLPe (Buchholz, F. et al. (1998) Improved properties of FLP recombinase evolved by cycling mutagenesis. Nat Biotechnol 16, 657-662). Последовательности человека из BACvec для стадий D, Е и G получали из двух родительских ВАС человека каждый, тогда как таковые из стадий F и И были из одних ВАС. Сохранение последовательностей человека подтверждали на каждой стадии с использованием множественных зондов, охватывающих вставленные последовательности человека (как описано выше, например, фиг.3А, 3В и 3С). Только клоны с нормальным кариотипы и зародышевый потенциал переносили далее в каждой стадии. ES клетки из конечной стадии все еще были способны вносить вклад в зародышевую линию после девяти последовательных манипуляций (таблица 3). Мыши, гомозиготные в отношении каждого из аллелей тяжелой цепи были жизнеспособны, казались здоровыми и демонстрировали по существу гуморальную иммунную систему дикого типа (смотрите пример 3).
|
Вариабельный генный локус к легкой цепи иммуноглобулина
Вариабельную область к легкой цепи гуманизировали в ходе восьми последовательных стадий путем прямого замещения приблизительно трех Mb последовательности мыши, содержащей все генные сегменты Vκ и Jκ приблизительно 0,5 Mb последовательности человека, содержащей проксимальные генные сегменты Vκ и Jκ человека способом, сходным с таковым для тяжелой цепи (фиг.1 В; таблицы 2 и 4).
Вариабельная область локуса к легкой цепи человека содержит два почти идентичных 400 т.п.о. повтора, разделенных 800 т.п.о. спейсером (Weichhold, G.M. et al. (1993) The human immunoglobulin kappa locus consists of two copies that are organized in opposite polarity, Genomics 16:503-511). Поскольку повторы являются настолько сходными, почти все разнообразие локусов может быть воспроизведено у мышей путем использования проксимального повтора. Кроме того, сообщалось о естественном аллеле человека локуса к легкой цепи, утратившем дистальный повтор (Schaible, G. et al. (1993) The immunoglobulin kappa locus: polymorphism and haplotypes of Caucasoid and non-Caucasoid individuals, Hum Genet 91:261-267). Приблизительно три Mb генной последовательности вариабельной области к легкой цепи мыши замещали приблизительно 0,5 Mb генной последовательности вариабельной области к легкой цепи человека для эффективного замещения всех генных сегментов Vκ и Jκ мыши проксимальными Vκ человека и всеми генными сегментами Jκ человека (фиг.2С и 2D; таблицы 2 и 4). В отличие от описанного в примере 1 для локуса тяжелой цепи способа целую генную область Vκ мыши, содержащую все генные сегменты Vκ и Jκ, удаляли с помощью трехстадийного способа перед добавлением какой-либо последовательности человека. Вначале, кассету пео вводили на проксимальный конец вариабельной области (стадия А, фиг.2С). Далее, кассету hyg вставляли на дистальный конец к локуса (стадия В, фиг.2С). Сайты loxP снова размещали в пределах каждой кассета селекции так, чтобы обработка Сге вызывала делецию оставшихся 3 Mb области Vκ мыши вместе с обоими генами устойчивости (стадия С, фиг.2С).
Геномный фрагмент человека размером приблизительно 480 т.п.о., содержащий целую вариабельную область κ легкой цепи иммуноглобулина, вставляли в ходе четырех последовательных стадий (фиг.2D; таблицы 2 и 4), причем до 150 т.п.о. последовательности к легкой цепи иммуноглобулина человека вставляли за одну стадию с использованием способов, сходных в таковыми, используемыми для тяжелой цепи (смотрите пример 1). Последний ген устойчивости к гигромицину удаляли с помощью временной экспрессии FLPe. Как и в случае тяжелой цепи, нацеленные ES клеточные клоны оценивали в отношении целостности полной вставки человека, нормального кариотипа и зародышевого потенциала после каждой стадии. Получали мышей, гомозиготных в отношении каждого из аллелей к легкой цепи, и было обнаружено, что они являлись здоровыми и имели нормальный внешний вид.
|
Пример II
Получение полностью гуманизированных мышей с помощью комбинации множественных гуманизированных аллелей иммуноглобулина
В нескольких местах ES клетки, несущие часть вариабельных репертуаров тяжелой цепи или к легкой цепи иммуноглобулина человека, как описано в примере 1, подвергали микроинъекции и полученных мышей скрещивали для получения множественных вариантов гуманизированных мышей VELOCIMMUNE® с возрастающим количеством фракций зародышевых репертуаров иммуноглобулина человека (таблица 5; фиг.5А и 5В). Гуманизированные мыши VELOCIMMUNE® 1 (VI) обладают 18 генными сегментами VH человека и всеми генными сегментами DH и JH человека, комбинированными с 16 человек генными сегментами Vκ и всеми генными сегментами Jκ человека. Гуманизированные мыши VELOCIMMUNE® 2 (V2) и Гуманизированные мыши VELOCIMMUNE® (V3) характеризуются увеличенными вариабельными репертуарами, включая в общем 39 VH и 30 Vκ, и 80 VH и 40 Vκ, соответственно. Поскольку геномные области, кодирующие генные сегменты VH, DH и JH мыши, и генные сегменты Vκ и Jκ, полностью замещали, антитела, производимые любым вариантом гуманизированных мышей VELOCIMMUNE®, содержат вариабельные области человека, связанные с константными областями мыши. Локусы λ легкой цепи мыши остаются интактными во всех вариантах гуманизированных мышей VELOCIMMUNE® и служат в качестве средства сравнения результативности экспрессии различных гуманизированных локусов к легкой цепи VELOCIMMUNE®.
Мышей, дважды гомозиготных в отношении обеих гуманизации тяжелой цепи и к легкой цепи иммуноглобулина, получали из подгруппы описанных в примере 1 аллелей. Все генотипы, наблюдаемые в течение курса скрещивания для получения дважды гомозиготных мышей, возникали приблизительно в менделевских пропорциях. Мужское потомство, гомозиготное в отношении каждого из аллелей тяжелой цепи человека, показало сниженную фертильность. Сниженная фертильность являлась результатом потери активности ADAM6 мыши. Вариабельный генный локус тяжелой цепи мыши содержит два включенных в него функциональных гена ADAM6 (ADAM6a и ADAM6b). В ходе гуманизации вариабельного генного локуса тяжелой цепи мыши вставленная геномная последовательность человека содержала псевдоген ADAM6. ADAM6 мыши может быть необходимым для фертильности, и, таким образом, отсутствие генов ADAM6 мыши в гуманизированных вариабельных генных локусах тяжелой цепи может привести в сниженной фертильности у этих мышей, несмотря на присутствие псевдогена человека. В примерах 7-9 описано точное замещение удаленных генов ADAM6 мыши обратно в гуманизированный вариабельный генный локус тяжелой цепи, и восстановление уровня фертильности дикого типа у мышей с гуманизированным локусом тяжелой цепи иммуноглобулина.
|
Пример III
Популяции лимфоцитов у мышей с гуманизированными генами иммуноглобулина
Популяции зрелых В-клеток у трех различных вариантов мышей VELOCIMMUNE® оценивали с помощью проточной цитометрии.
Кратко, клеточные суспензии из костного мозга, селезенки и тимуса получали с использованием стандартных способов. Клетки ресуспендировали в концентрации 5×105 клеток/мл в буфере для окрашивания для FACS BD Pharmingen, блокировали с помощью антимышиного CD 16/32 (BD Pharmingen), окрашивали с помощью пригодного коктейля антител и фиксировали с помощью BD CYTOFIX™, все согласно инструкциям производителей. Последние клеточные осадки ресуспендировали в 0,5 мл буфера для окрашивания и анализировали с использованием программного обеспечения BD FACSCALIBUR™ и BD CELLQUEST PRO™. Все антитела (BD Pharmingen) получали в массовом разведении/коктейле и добавляли до конечной концентрации 0,5 мг/105 клеток. Коктейли антител для окрашивания костного мозга (A-D) были следующими: А: антимышиный IgMb-FITC, антимышиный IgMa-PE, антимышиный CD45R(B220)-APC; В: антимышиный CD43(S7)-PE, антимышиный CD45R(B220)-APC; С: антимышиный CD24(HSA)-PE; антимышиный CD45R(B220)-APC; D: антимышиный ВР-1-РЕ, антимышиный CD45R(B220)-APC. Коктейли антител для окрашивания селезенки и паховых лимфатических узлов (Е-Н) были следующими: Е: антимышиный IgMb-FITC, антимышиный IgMa-PE, антимышиный CD45R(B220)-APC; F: антимышиная Ig, λ2, λ2, λ3 легкая цепь-FITC, антимышиная Igκ легкая цепь-РЕ, антимышиный CD45R(B220)-APC; G: антимышиный Ly6G/C-FITC, антимышиный CD49b(DX5)-PE, антимышиный CD11b-APC; H: антимышиный CD4(L3T4)-FITC, антимышиный CD45R(B220)-PE, антимышиный CD8a-APC. Результаты показаны на фиг.6.
Лимфоциты, выделенные из селезенки или лимфатического узла гомозиготных гуманизированных мышей VELOCIMMUNE® окрашивали в отношении поверхностной экспрессии маркеров В220 и IgM и анализировали с использованием проточной цитометрии (фиг.6). Размеры популяций B220+IgM+ зрелых В-клеток во всех вариантах исследованных гуманизированных мышей VELOCIMMUNE® были фактически идентичны таковым у мышей дикого типа, независимо от числа генных сегментов VH, которые они содержали. Кроме того, мыши, содержащие гомозиготные гибридные гуманизированные локусы тяжелой цепи иммуноглобулина, даже таковые только с 3 VH генными сегментами, но нормальными локусами κ легкой цепи иммуноглобулина мыши или мыши, содержащие гомозиготные гибридные гуманизированные локусы κ легкой цепи с нормальными локусами тяжелой цепи иммуноглобулина мыши также содержали нормальные количества клеток В220+ IgM+ в их периферических компартментах (не показано). Эти результаты показывают, что химерные локусы с вариабельными генными сегментами человека и константными областями мыши могут полностью заполнить компартмент зрелых В-клеток. Кроме того, число вариабельных генных сегментов на локусах или тяжелой цепи, или к легкой цепи и, таким образом, теоретическое разнообразие репертуара антител, не коррелирует со способностью создавать популяции дикого типа зрелых В-клеток. Напротив, мыши с интегрированными случайным образом полностью человеческими иммуноглобулиновыми трансгенами и инактивированными локусами иммуноглобулина мыши характеризуются сниженными количествами В-клеток в этих компартментах, причем тяжесть дефицита зависит от числа включенных в трансген вариабельных генных сегментов (Green, L.L., and Jakobovits, A. (1998) Regulation of В cell development by variable gene complexity in mice reconstituted with human immunoglobulin yeast artificial chromosomes, J Exp Med 188:483-495). Это показывает, что стратегия "in situ генетической гуманизации" приводит к функциональному результату, фундаментально отличному от интегрированных случайным образом трансгенов, полученных с помощью "генного нокаута вместе с трансгенным подходом".
Исключение аллеля и выбор локуса.
Способность сохранять исключение аллеля исследовали у мышей, гетерозиготных в отношении различные вариантов гуманизированного локуса тяжелой цепи иммуноглобулина.
Гуманизацию локусов иммуноглобулина проводили в ES линии Fl (F1H4 (Valenzuela et al., 2003)), происходящей из гетерозиготных эмбрионов 129S6/SvEvTac и C57BL/6NTac. Зародышевые генные последовательности вариабельной области тяжелой цепи человек подвергают нацеленному воздействию на 129S6 аллель, который несет гаплотип IgMa, тогда как немодифицированный аллель C576BL/6N мыши несет гаплотип IgMb. Эти аллельные формы IgM могут быть дифференцированы с помощью проточной цитометрии с использованием антител, специфических к полиморфизмам, обнаруженным в аллелях IgMa или IgMb. Как показано на фиг.6 (нижний ряд), В-клетки, определенные у мышей, гетерозиготных в отношении каждого варианта гуманизированного локуса тяжелой цепи, экспрессируют только один аллель, или IgMa (гуманизированный аллель), или IgMb (аллель дикого типа). Это показывает, что механизмы, вовлеченные в исключение аллеля, являются интактными у гуманизированных мышей VELOCIMMUNE®. Кроме того, относительное количество В-клеток, положительных в отношении гуманизированного аллеля (IgMa) приблизительно пропорционально числу присутствующих генных сегментов VH. Гуманизированный локус иммуноглобулина экспрессируется приблизительно в 30% В-клеток у гуманизированных гетерозиготных мышей VELOCIMMUNE® 1, которые содержат 18 генных сегментов VH человека, и в 50% В-клеток у гуманизированных гетерозиготных мышей VELOCIMMUNE® 2 и 3 (не показано), с 39 и 80 генными сегментами VH человека, соответственно. В частности, отношение клеток, экспрессирующих гуманизированный аллель мыши, к аллелю дикого типа (0,5 для гуманизированных мышей VELOCIMMUNE® 1 и 0,9 для гуманизированных мышей VELOCIMMUNE® 2) является больше, чем отношение числа вариабельных генных сегментов, содержащихся в гуманизированных локусах, к локусам дикого типа (0,2 для гуманизированных мышей VELOCIMMUNE® 1 и 0,4 для гуманизированных мышей VELOCIMMUNE® 2). Это может показывать, что вероятность выбора аллеля является промежуточной между случайным выбором одной или другой хромосомы и случайным выбором RSS любого конкретного V сегмента. Кроме того, может иметь место фракция В-клеток, но не все, в которой один аллель становится доступным для рекомбинации, завершает процесс и прекращает рекомбинацию до того, как другой аллель становится доступным. Кроме того, даже распределение клеток, которые содержат поверхностный IgM (sIgM), происходящий или из гибридного гуманизированного локуса тяжелой цепи, или локуса тяжелой цепи мыши дикого типа, является доказательством того, что гибридный локус функционирует на нормальном уровне. В отличие от этого, интегрированные случайным образом трансгены иммуноглобулина человека слабо конкурируют с локусами иммуноглобулина мыши дикого типа (Bruggemann, M., et al. (1989) A repertoire of monoclonal antibodies with human heavy chains from transgenic mice. PNAS 86, 6709-6713; Green et al. (1994); Tuaillon, N. et al. (1993) Human immunoglobulin heavy-chain minilocus recombination in transgenic mice: gene-segment use in mu and gamma transcripts, Proc Nati Acad Sci USA 90:3720-3724). Это дополнительно демонстрирует, что произведенные гуманизированными мышами VELOCIMMUNE® иммуноглобулины являются функционально отличными от таковых, произведенных интегрированными случайным образом трансгенами у мышей, полученных с помощью "генного нокаута вместе с трансгенным подходом".
Полиморфизмы областей Ск являются недоступными в 129S6 или C57BL/6N для исследования исключения аллеля гуманизированных локусов к легкой цепи по сравнению с негуманизированными локусами. Тем не менее, все гуманизированные мыши VELOCIMMUNE® обладают локусами λ, легкой цепи мыши дикого типа, следовательно, возможно наблюдать, может ли реаранжировка и экспрессия гуманизированных локусов к легкой цепи предотвратить экспрессию λ легкой цепи мыши. Отношение числа клеток, экспрессирующих гуманизированную κ легкую цепь, к числу клеток, экспрессирующих λ легкую цепь мыши, было относительно неизменным у гуманизированных мышей VELOCIMMUNE® по сравнению с мышами дикого типа, независимо от числа генных сегментов Vκ человека, вставленных на локус κ легкой цепи (фиг.6, третий ряд сверху). Кроме того, не наблюдалось увеличение числа дважды положительных (κ и λ) клеток, указывая на то, что продуктивная рекомбинация в гибридных локусах к легкой цепи приводит к соответствующему подавлению рекомбинации локусов λ легкой цепи мыши. В отличие от этого, мыши, содержащие интегрированные случайным образом трансгены к легкой цепи с инактивированными локусами к легкой цепи мыши - но локусами κ легкой цепи мыши дикого типа - проявляют сильно увеличенные соотношения λ/κ (Jakobovits, 1998), косвенно указывая на то, что введенные трансгены к легкой цепи не функционируют правильным образом у таких мышей. Это дополнительно демонстрирует другой функциональный результат, наблюдаемый в иммуноглобулинах, произведенных гуманизированными мышами VELOCIMMUNE® по сравнению с таковыми, произведенными мышами, полученными с помощью "генного нокаута вместе с трансгенным подходом".
Развитие В-клеток
Поскольку популяции зрелых В-клеток у гуманизированных мышей VELOCIMMUNE® сходны с таковыми у мышей дикого типа (описано выше), возможно, что дефекты в ранней дифференциации В-клеток компенсируются путем распространения популяций зрелых В-клеток. Различные стадии дифференциации В-клеток исследовали путем анализа популяций В-клеток с использованием проточной цитометрии. На таблице 6 представлено отношение фракции клеток в каждой В-клеточной родословной, определенной с помощью FACs, с использованием специфических маркеров клеточной поверхности, у гуманизированных мышей VELOCIMMUNE® по сравнению с однопометными животными дикого типа.
Развитие ранних В-клеток происходит в костном мозге, и различные стадии дифференциации В-клеток характеризуются изменениями в типах и уровнях экспрессии маркеров клеточной поверхности. Эти различия в поверхностной экспрессии коррелируют с молекулярными изменениями, происходящими на локусах иммуноглобулина внутри клетки. Для перехода от про-В к пре-В-клетке необходима успешная реаранжировка и экспрессия функционального белка тяжелой цепи, наряду с тем, что переход от пре-В к стадии зрелых В-клеток регулируюется правильной реаранжировкой и экспрессией κ или λ легкой цепи. Таким образом, неэффективный переход между стадиями В-клеточной дифференциации можно обнаружить с помощью изменений в относительных популяциях В-клеток на данной стадии.
|
Не наблюдалось никаких значительных дефектов в В-клеточной дифференциации у любой из гуманизированных мышей VELOCIMMUNE®. По-видимому, введение генных сегментов тяжелой цепи человека не оказывает воздействия на переход от про-В к пре-В, и введение генных сегментов к легкой цепи человека не оказывает воздействия на переход от пре-В к В-клеткам у гуманизированных мышей VELOCIMMUNE®. Это демонстрирует, что "обратные химерные" молекулы иммуноглобулина, содержащие вариабельные области человека и константные области мыши, функционируют нормально в контексте передачи сигналов В-клетками и корецепторных молекул, приводя к подходящей В-клеточной дифференциации в мышином окружении. В отличие от этого, баланс между различными популяциями в ходе В-клеточной дифференциации нарушается до определенной степени у мышей, которые содержат интегрированный случайным образом трансгены иммуноглобулина и инактивированные эндогенные локусы тяжелой цепи или к легкой цепи (Green and Jakobovits (1998)).
Пример IV
Репертуар вариабельных генов у мышей с гуманизированным иммуноглобулином
Частоту использования вариабельных генных сегментов человека в репертуаре гуманизированных антител гуманизированных мышей VELOCIMMUNE® анализировали с помощью полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР) вариабельных областей человека из множественных источников, включающих спленоциты и клетки гибридомы. Определяли последовательность вариабельной области, частота использования генного сегмента, соматическая гипермутация и множественность сегментов J реаранжированных генных сегментов вариабельной области.
Кратко, общую РНК экстрагировали из 1×107-2×107 спленоцитов или приблизительно 104-105 гибридомных клеток с использованием TRIZOL™ (Invitrogen) или мининабора Qiagen RNEASY™ (Qiagen) и примировали с помощью специфических маркеров константной области мыши с использованием SUPERSCRIPT™ III системы одностадийной ОТ-ПЦР (Invitrogen). Реакции проводили с 2-5 мкл РНК из каждого образца с использованием вышеупомянутых 3' специфических маркеров константной области, спаренных с объединенными лидерными праймерами для каждого семейства вариабельных областей человека как для тяжелой цепи, так и для к легкой цепи, отдельно. Объемы реагентов и праймеров и условия ОТ-ПЦР/ПЦР обеспечивали согласно инструкциям производителя. Последовательности праймеров были основаны на множественных источниках (Wang, X. and Stollar, B.D. (2000) Human immunoglobulin variable region gene analysis by single cell RT-PCR, J Immunol Methods 244:217-225; наборы Ig-праймеров, Novagen). В соответствующих случаях вложенные вторичные ПЦР реакции проводили с объединенными специфическими в отношении семейства каркасными праймерами и таким же мышь 3' специфическим праймером константной области иммуноглобулина, используемым в первичной реакции. Аликвоты (5 мкл) из каждой реакции анализировали с помощью электрофореза в агарозном геле и продукты реакции очищали от агарозы с использованием набора для экстракции из геля MONTAGE™ (Millipore). Очищенные продукты клонировали с использованием ТОРО™ ТА клонирующей системы (Invitrogen) и трансформировали в клетки DH10β E.coli путем электропорации. Отдельные клоны выбирали из каждой реакции трансформации и выращивали в 2 мл бульонных культур Лурия-Бертани с селекцией по чувствительности к антибиотику в течение ночи при 37°С. Плазмидную ДНК очищали от бактериальных культур с помощью основанного на использовании набора подхода (Qiagen).
Частота использования вариабельных генов иммуноглобулина
Плазмидную ДНК клонов как тяжелой цепи, так и к легкой цепи секвенировали или с Т7, или с М13 обратными праймерами на генетическом анализаторе ABI 3100 (Applied Biosystems). Необработанные данные о последовательностях вносили в SEQUENCHER™ (версия 4.5, Gene Codes). Каждую последовательность собирали в контиги и выравнивали с последовательностями иммуноглобулина человека с использованием IMGT V-Quest (Brochet, X. et al. (2008) IMGT/V-QUEST: the highly customized and integrated system for IG and TR standardized V-J and V-D-J sequence analysis. Nucleic Acids Res 36:W503-508) поисковой функции для определения частоты использования сегментов VH, DH, JH и Vκ, Jκ человека. Последовательности сравнивали с зародышевыми последовательностями для анализа соматической гипермутации и рекомбинации участков соединения.
Мышей получали из ES клеток, содержащих начальную модификацию тяжелой цепи (гибридный аллель 3hVH-CRE, нижняя часть фиг.2А) с помощью RAG комплементации (Chen, J. et al. (1993) RAG-2-deficient blastocyst complementation: an assay of gene function in lymphocyte development, Proc Nati Acad Sci USA 90:4528-4532), и кДНК получали из РНК спленоцита. кДНК амплифицировали с использованием наборов праймеров (описанных выше), специфических к предсказанной мРНК химерной тяжелой цепи, которая будет возникать путем V(D)J рекомбинации в пределах вставленных генных сегментов человек и последующего сплайсинга с константными доменами либо IgM, либо IgG мыши. Последовательности, происходящие из этих клонов кДНК (не показаны), демонстрировали, что правильная V(D)J рекомбинация происходила в пределах генных последовательностей вариабельной области человека, что реаранжированные генные сегменты V(D)J человека правильно сплайсировались в рамке считывания с константными доменами мыши и что произошла рекомбинация переключения класса. Проводили дополнительный анализ последовательности продуктов мРНК последующих гибридных локусов иммуноглобулина.
В сходном эксперименте В-клетки из неиммунизированных мышей дикого типа и гуманизированных мышей VELOCIMMUNE® разделяли с помощью проточной цитометрии на основании поверхностной экспрессии В220 и IgM или IgG. Клетки B220+ IgM+ или поверхностный IgG+ (sIgG+) объединяли и получали последовательности VH и Vκ на основании ОТ-ПЦР амплификации и клонирования (описано выше). Регистрировали частоту использования репрезентативных генов в наборе амплифицированных с помощью ОТ-ПЦР кДНК из неиммунизированных гуманизированных мышей VELOCIMMUNE® 1 (таблица 7) и гуманизированных мышей VELOCIMMUNE® 3 (таблица 8) (*дефектная RSS; † отсутствие или псевдоген).
|
|
Как показано в таблицах 7 и 8, используются почти все функциональные генные сегменты VH, DH, JH, Vκ и Jκ человека. Из функциональных вариабельных генных сегментов, описанных, но не обнаруженных у гуманизированных мышей VELOCIMMUNE® в настоящем эксперименте, сообщалось, что некоторые содержат дефектные сигнальные последовательности рекомбинации (RSS) и, таким образом, как предполагают, не будут экспрессироваться (Feeney, A.J. (2000) Factors that influence formation of В cell repertoire. Immunol Res 21:195-202). Анализ некоторых других наборов последовательностей иммуноглобулина из различных гуманизированных мышей VELOCIMMUNE®, выделенных как из нативных, так иммунизированных репертуаров, показал использование этих генных сегментов, хотя и с более низкими показателями частоты (данные не показаны). Сводные данные о частоте использования генов показали, что все функциональные генные сегменты VH, DH, JH, Vκ и Jκ человека, содержащиеся у гуманизированных мышей VELOCIMMUNE®, наблюдались как в нативных, так и в иммунизированных репертуарах (данные не показаны). Хотя генный сегмент VH7-81 человека определили в анализе последовательностей локуса тяжелой цепи человека (Matsuda, F. et ей. (1998) The complete nucleotide sequence of the human immunoglobulin heavy chain variable region locus, J Exp Med 188:2151-2162), он не присутствует у гуманизированных мышей VELOCIMMUNE®, что подтверждается путем повторного секвенирования полного генома гуманизиро ванной мыши VELOCIMMUNE® 3.
Известно, что последовательности тяжелых и легких цепей антител демонстрируют исключительную вариабельность, особенно в коротких полипептидных сегментах в пределах реаранжированного вариабельного домена. Эти области, известные как гипервариабельные области или определяющие комплементарность области (CDR) образуют сайт связывания для антигена в структуре молекулы антитела. Промежуточные полипептидные последовательности называются каркасные области (FR). Существуют три CDR (CDR1, CDR2, CDR3) и 4 FR (FR1, FR2, FR3, FR4) как в тяжелых, так и легких цепях. Одна CDR, CDR3, является уникальной в том, что эта CDR образуется путем рекомбинации как генных сегментов VH, DH И JH, так и Vκ и Jκ и создает значительное количество разнообразия репертуаров до того, как встретиться антиген. Это соединение является неточным вследствие как нуклеотидных делеций посредством экзонуклеазной активности, так и не кодируемых матрицей вставок посредством терминальной дезоксинуклеотидилтрансферазы (TdT) и, таким образом, обеспечивает возможность появления новых последовательностей в результате процесса рекомбинации. Хотя FR могут демонстрировать существенную соматическую мутацию вследствие высокой частоты мутирования вариабельной области целиком, вариабельность, тем не менее, не распределена равномерно по вариабельной области. CDR представляют собой сконцентрированные и локализованные области высокой вариабельности на поверхности молекулы антитела, которые обеспечивают связывание антигена. Последовательности тяжелой цепи и легкой цепи выбранных антител из гуманизированных мышей VELOCIMMUNE® около участка соединения CDR3, демонстрирующего множественность сегментов J, показаны на фиг.7А и 7В, соответственно.
Как показано на фиг.7А, не кодируемые матрицей нуклеотидные вставки (N-вставки) наблюдаются как на соединении VH-DH, так и DH-JH в антителах из гуманизированных мышей VELOCIMMUNE®, указывая на полноценную функцию TdT с сегментами человека. Концы сегментов VH, DH и JH относительно их зародышевых эквивалентов показывают, что также имела место экзонуклеазная активность. В отличие от локуса тяжелой цепи, реаранжировки к легкой цепи человека проявляют немного или отсутствие вставок TdT на CDR3, которая сформирована путем рекомбинации сегментов Vκ и Jκ (фиг.7В). Это предполагают вследствие отсутствия экспрессии TdT у мышей в ходе реаранжировок легкой цепи на переходе от пре-В к В-клетке. Разнообразие, наблюдаемое в CDR3 реаранжированных областей Укчеловека, вводится преимущественно посредством экзонуклеазной активности в ходе события рекомбинации.
Соматическая гипермутация
Дополнительное разнообразие добавляют к вариабельным областям реаранжированных генов иммуноглобулина в ходе реакции в зародышевом центре с помощью процесса, имеющего название соматическая гипермутация. В-клетки, экспрессирующие соматически мутированные вариабельные области, конкурируют с другими В-клетками за доступ к антигену, представленному фоликулярными дендритными клетками. В-клетки с более высокой аффинностью к антигену будут продолжать развиваться и будут подвергаться переключению класса перед выходом на периферию. Таким образом, В-клетки, экспрессирующие переключенные изотипы, как правило, встретились с антигеном и подверглись реакциям в зародышевом центре и будут характеризоваться увеличенными количествами мутаций относительно нативных В-клеток. Более того, предполагают, что последовательности вариабельной области из преимущественно нативных sIgM+ В-клеток будут характеризоваться относительно меньшим количеством мутаций, чем вариабельные последовательности из sIgG+ В-клеток, которые подверглись антигензависимой селекции.
Последовательности из случайных клонов VH или Vκ из sIgM+ или sIgG+ В-клеток из неиммунизированных гуманизированных мышей VELOCIMMUNE® или sIgG+ В-клеток из иммунизированных мышей сравнивали с их зародышевыми вариабельными генными сегментами и комментировали изменения относительно зародышевой последовательности. Полученные нуклеотидные последовательности подвергали трансляции in silico и также комментировали мутации, приводящие к изменениям аминокислот. Данные собирали от всех вариабельных областей и рассчитывали процентное изменение в данном положении (фиг.8).
Как показано на фиг.8, вариабельные области тяжелой цепи человека, происходящие из sIgG+ В-клеток из неиммунизированных гуманизированных мышей VELOCIMMUNE®, проявляют намного больше нуклеотидов относительно sIgM+ В-клеток из тех же пулов спленоцитов, и вариабельные области тяжелой цепи, происходящие из иммунизированных мышей, проявляют даже больше изменений. Число изменений увеличивается в определяющих комплементарность областях (CDR) по отношению к каркасным областям, что указывает на антигензависимую селекцию. Соответствующий аминокислотные последовательности из вариабельных областей тяжелой цепи человека также проявляют значительно большие количества мутаций в IgG по сравнению с IgM и даже больше в иммунизированном IgG. Эти мутации вновь оказываются более частыми в CDR по сравнению с каркасными последовательностями, указывая на то, что антитела были антигензависимыми in vivo. Сходное увеличение числа нуклеотидных и аминокислотных мутаций наблюдают в последовательностях Vκ, происходящих из IgG+ В-клеток из иммунизированных мышей.
Частота использования гена и соматическая гипермутация, наблюдаемые у гуманизированных мышей VELOCIMMUNE®, показывают, что по существу все присутствующие генные сегменты способны к реаранжировке для образования полностью функциональных обратных химерных антител у этих мышей. Более того, полученные от гуманизированных мышей VELOCIMMUNE® антитела участвуют в полной мере в иммунной системе мыши, подвергаясь аффинной селекции и созреванию для создания полностью зрелых человеческих антител, которые могут эффективно нейтрализовать их целевой антиген. Гуманизированные мыши VELOCIMMUNE® способны развивать устойчивые иммунные ответы на многочисленные классы антигенов, что приводит к использованию широкого диапазона человеческих антител, которые характеризуются высокой аффинностью, а также являются подходящими для терапевтического применения (данные не показаны).
Пример V
Анализ лимфоидной структуры и сывороточных изотипов
Макроструктуры селезенки, паховых лимфатических узлов, пейеровых бляшек и тимуса тканевых образцов из мышей дикого типа или гуманизированных мышей VELOCIMMUNE®, окрашенные с помощью Н&Е, исследовали с помощью световой микроскопии. Уровни изотипов иммуноглобулина в сыворотке, собранной от мышей дикого типа и гуманизированных мышей VELOCIMMUNE®, анализировали с использованием технологии LUMINEX™.
Структура лимфоидных органов
Структура и функция лимфоидных тканей частично зависит от правильного развития гематопоэтических клеток. Нарушение развития или функции В-клеток могут проявляться в виде изменения в структуре лимфоидных тканей. При анализе окрашенных тканевых срезов не установили никакого значительного различия во внешнем виде вторичных лимфоидных органов между мышами дикого типа и гуманизированными мышами VELOCIMMUNE® (данные не показаны).
Уровни иммуноглобулина в сыворотке
Уровень экспрессии каждого изотипа является сходным у мышей дикого типа и гуманизированных мышей VELOCIMMUNE® (фиг.9А, 9В и 9С). Это демонстрирует, что гуманизация вариабельных генных сегментов не оказывала какого-либо очевидного неблагоприятного действия на переключение класса или экспрессию и секрецию иммуноглобулина и, следовательно, очевидно сохраняет все эндогенные последовательности мыши, необходимые для этих функций.
Пример VI
Иммунизация и продукция антител у мышей с гуманизированными иммуноглобулинами
Различные варианты гуманизированных мышей VELOCIMMUNE® иммунизировали антигеном для исследования гуморального ответ на сенсибилизацию чужеродным антигеном.
Иммунизация и развитие гибридомы
Гуманизированных мышей VELOCIMMUNE® и мышей дикого типа можно иммунизировать антигеном в форме белка, ДНК, комбинации ДНК и белка или клеток, экспрессирующих антиген. Животным, как правило, проводят повторную иммунизацию каждые три недели, в общем, в течение двух-трех раз. После каждой повторной иммунизации антигеном образцы сыворотки от каждого животного собирают и анализируют в отношении ответов антиген-специфических антител с помощью определения сывороточного титра. Перед слиянием мыши получали конечный дозу предшествующей слиянию повторной иммунизации 5 мкг белка или ДИК, при необходимости, посредством интраперитонеальной и/или внутривенной инъекций. Спленоциты собирают и проводят их слияние с Ag8.653 миеломными клетками в камере электрослияния согласно рекомендуемому производителем протоколу (Cyto Pulse Sciences Inc., Глен-Бурни, Мериленд). Через десять дней культивации гибридомы подвергают скринингу относительно антигенной специфичности с использованием анализа ELISA (Harlow, E. and Lane, D. (1988) Antibodies: A Laboratory Manual. Cold Spring Harbor Press, New York). Альтернативно, антиген-специфические В-клетки выделяют непосредственно из иммунизированных гуманизированных мышей VELOCIMMUNE® и подвергают скринингу с использованием стандартных методик, включая описанные в настоящем документе, для получения человеческих антител, специфических к представляющему интерес антигену.
Определения сывороточного титра
Для мониторинга ответа сыворотки животного на антиген образцы сыворотки собирают через приблизительно 10 дней после каждой повторной иммунизации и титры определяют с использованием антиген-специфического анализа ELISA. Кратко, Nunc MAXISORP™ 96-луночные планшеты покрывают 2 мкг/мл антигена в течение ночи при 4°С и блокируют с помощью бычьего сывороточного альбумина (Sigma, Сент-Луис, Миссури). Обеспечивают связывание образцов сыворотки в серийных 3-кратных разведениях с планшетами в течение одного часа при комнатной температуре. Планшеты затем отмывают с помощью PBS, содержащего 0,05% Tween-20 и связанный IgG определяют с использованием конъюгированного с HRP козьего антимышиного Fc (Jackson Immuno Research Laboratories, Inc., Вест Гров, Пенсильвания) для общего титра IgG, или меченных биотином специфических к изотипу или специфических к легким цепям поликлональных антител (SouthemBiotech Inc.) для специфических к изотипу титров, соответственно. Для меченных биотином антител после отмывки планшета добавляют конъюгированный с HRP стрептавидин (Pierce, Рокфорд, Иллинойс). Все планшеты проявляют с использованием таких колориметрических субстратов, как BD OPTEIA™ (BD Biosciences Pharmingen, Сан-Диего, Калифорния). После остановки реакции с помощью 1 М фосфорной кислоты, регистрируют показатели оптического поглощения при 450 нм и данные анализируют с использованием программного обеспечения PRISM™ от Graph Pad. Разведения, необходимые для получения сигнала, превышающего в два раза фоновый уровень, определяют как титр.
Согласно одному эксперименту гуманизированных мышей VELOC IMMUNE® иммунизировали рецептором интерлейкина-6 человека (hIL-6R). Репрезентативный набор сывороточных титров для мышей VELOCIMMUNE® и мышей дикого типа, иммунизированных hIL-6R, показан на фиг.10А и 10В.
Гуманизированные мыши VELOCIMMUNE® и мыши дикого типа развивали сильные ответы в отношении IL-6R со сходными диапазонами титров (фиг.10А). Некоторые мыши из когорт гуманизированных мышей VELOCIMMUNE® и мышей дикого типа достигали максимального ответа после оной иммунизации антигена. Эти результаты показывают, что сила иммунного ответа и кинетические параметры в отношении этого антигена были сходными у гуманизированных мышей VELOCIMMUNE® и мышей дикого типа. Эти ответы антиген-специфических антител дополнительно анализировали для исследования конкретных изотипов антиген-специфических антител, обнаруженных в сыворотках. Как группы гуманизированных мышей VELOCIMMUNE®, так и группы дикого типа преимущественно развивают ответ IgG1 (фиг.10В), указывая на то, что переключение класса в ходе гуморального ответа является сходным у мышей каждого типа.
Определение аффинности связывания антитела с антигеном в растворе
Основанный на ELISA анализ конкуренции в растворе, как правило, разрабатывают для определения аффинность связывания антитела с антигеном.
Кратко, антитела в кондиционированной среде предварительно смешивают с серийными разведениями антигенного белка в диапазоне от 0-10 мг/мл. Растворы смеси антитела и антигена затем инкубируют в течение двух-четырех часов при комнатной температуре для достижения равновесных состояний связывания. Количества свободного антитела в смесях затем измеряют с использованием количественного сэндвич-анализа ELISA. 96-луночные планшеты MAXISORB™ (VWR, Вест-Честер, Пенсильвания) покрывают 1 мкг/мл антигенного белка в растворе PBS в течение ночи при 4°С с последующим BSA неспецифическим блокированием. Растворы смеси антител с антигенами затем переносят на эти планшеты с последующей часовой инкубацией. Планшеты затем отмывают буфером отмывки и связанные с планшетом антитела обнаруживают с помощью реагента конъюгированного с HRP козьего антимышиного IgG поликлонального антитела (Jackson Immuno Research Lab) и проявляли с использованием таких колориметрических субстратов, как BD OPTEIA™ (BD Biosciences Pharmingen, Сан-Диего, Калифорния). После остановки реакции с помощью 1 М фосфорной кислоты, регистрируют показатели оптического поглощения при 450 нм и данные анализируют с использованием программного обеспечения PRISM™ от Graph Pad. Зависимость сигналов от концентраций антигена в растворе анализируют с помощью анализа согласия в отношении 4 параметров и выражали как IC50, концентрация антигена, необходимая для достижения 50% снижения сигнала от образцов антител без присутствия антигена в растворе.
Согласно одному эксперименту гуманизированных мышей VELOCIMMUNE® иммунизировали с помощью ML-6R (как описано выше). На фиг.11А и 11В показан репрезентативный набор измерений аффинности для антител к hIL6R из гуманизированных мышей VELOCIMMUNE® и мышей дикого типа.
После получения иммунизированными мышами третьей повторной иммунизации антигеном сывороточные титры определяют с помощью ELISA. Спленоциты выделяют из выбранных когорт мышей дикого типа и гуманизированных мышей VELOCIMMUNE® и проводили слияние с Ag8.653 миеломными клетками для образования гибридом и выращивали при условиях селекции (как описано выше). Обнаружили, что из 671 образованных анти-IL-6R гибридом 236 экспрессируют антиген-специфические антитела. Среды, собранные из положительных в отношении антигена лунок, использовали для определения аффинности антител в отношении связывания с антигеном с использованием анализа конкуренции в растворе ELISA. Антитела, полученные из гуманизированных мышей VELOCIMMUNE®, проявляют широкий диапазон аффинности в связывании с антигеном в растворе (фиг.11А). Более того, обнаружили, что 49 из 236 анти-IL-6R гибридом препятствуют связыванию IL-6 с рецептором в биологическом анализе in vitro (данные не показаны). Более того, эти 49 анти-IL-6R блокирующие антитела проявляли диапазон высоких аффинностей в растворе, сходный с таковым у блокирующих антител, полученных в параллельной иммунизации мышей дикого типа (фиг.11В).
Пример VII
Конструкция нацеливающего вектора ADAM6 мыши
Нацеливающий вектор для вставки генов ADAM6a и ADAM6b мыши в гуманизированный локус тяжелой цепи конструировали с использованием технология генной инженерии VELOCIGENE® (ранее) для модификации бактериальной искусственной хромосомы (ВАС) 929d24, полученной от Dr. Fred Alt (Гарвардский университет). ДНК 929d24 ВАС конструировали так, чтобы она содержала геномные фрагменты, содержащие гены ADAM6a и ADAM6b мыши и кассету гигромицина для направленной делеции псевдогена ADAM6 человека (hADAM6Ψ), расположенного между генными сегментами VH1-2 и VH6-1 человека гуманизированного локуса тяжелой цепи (фиг.12).
Во-первых, геномный фрагмент, содержащий ген ADAM6b мыши, ~800 п.н. последовательности против хода транскрипции (5') и ~4800 п.н. последовательности по ходу транскрипции (3'), субклонировали из клона 929d24 ВАС. Второй геномный фрагмент, содержащий ген ADAM6a мыши, ~300 п.н. последовательности против хода транскрипции (5') и ~3400 п.н. последовательности по ходу транскрипции (3'), отдельно субклонировали из клона 929d24 ВАС. Два геномных фрагмента, содержащие гены ADAM6b и ADAM6a мыши, лигировали с кассетой гигромицина, фланкированной Frt сайтами рекомбинации для создания нацеливающего вектора (нацеливающий вектор ADAM6 мыши, фигура 20; SEQ ID NO:3). Различные сайты рестрикционных ферментов конструировали на 5' конце нацеливающего вектора после гена ADAM6b мыши и на 3' конце после гена ADAM6a мыши (фиг.12, снизу) для лигирования в гуманизированный локус тяжелой цепи.
Отдельную модификацию проводили в отношении ВАС-клона, содержащего замещение локуса тяжелой цепи мыши локусом тяжелой цепи человек, содержащим псевдоген ADAM6 человек, расположенный между генными сегментами VH1-2 и VH6-1 человека гуманизированного локуса для последующего лигирования нацеливающего вектора ADAM6 мыши (фиг.13).
Кратко, кассету неомицина, фланкированную сайтами рекомбинации loxP, конструировали так, чтобы она содержала плечи гомологии, содержащие геномную последовательность человека в положениях 3' от генного сегмента VH1-2 человека (5' по отношению к hADAM6Ψ) и 5' от генного сегмента VH6-1 человека (3' по отношению к hADAM6Ψ; смотрите среднюю часть фиг.13). Расположение сайта вставки этой нацеливающей конструкции находилось приблизительно 1,3 т.п.о. 5' и ~350 п.н. 3' от псевдогена ADAM6 человек. Нацеливающая конструкция также содержала такие же сайты рестрикции, как нацеливающий вектор ADAM6 мыши для обеспечения последующего ВАС-лигирования между модифицированными ВАС-клоном, содержащим делецию псевдогена ADAM6 человека и нацеливающего вектора ADAM6 мыши.
После обработки ВАС-ДНК, полученной из обеих конструкций, геномные фрагменты лигировали вместе для конструирования сконструированного ВАС-клона, содержащего гуманизированный локус тяжелой цепи, содержащий эктопически расположенную геномную последовательность, содержащую нуклеотидные последовательности ADAM6a и ADAM6b мыши. Конечная нацеливающая конструкция для 108 делеции гена ADAM6 человека в пределах гуманизированного локуса тяжелой цепи и вставки последовательностей ADAM6a и ADAM6b мыши в ES клетки, содержащие, в направлении 5'-3', 5' геномный фрагмент, содержащий ~13 т.п.о. геномной последовательности человека 3' от генного сегмента VH1-2 человек, ~800 п.н. геномной последовательности мыши ниже по ходу транскрипции от гена ADAM6b мыши, ген ADAM6b мыши, ~4800 п.н. геномной последовательности выше против хода транскрипции от гена ADAM6b мыши, 5' сайт Frt, кассету гигромицина, сайт 3' Frt, ~300 п.н. геномной последовательности мыши ниже по ходу транскрипции от гена ADAM6a мыши, ген ADAM6a мыши, ~3400 п.н. геномной последовательности мыши выше против хода транскрипции от гена ADAM6a мыши и 3' геномный фрагмент, содержащий ~30 т.п.о. геномной последовательности человека 5' от генного сегмента VH6-1 человека (нижняя часть фиг.13).
Сконструированный ВАС-клон (описанный выше) использовали для электропорации ES клеток мыши, которые содержали гуманизированный локус тяжелой цепи для создания модифицированных ES клеток, содержащих геномную последовательность мыши, расположенную эктопически, которая содержит последовательности ADAM6a и ADAM6b мыши в пределах гуманизированного локуса тяжелой цепи. Положительные ES клетки, содержащие эктопический геномный фрагмент мыши в пределах гуманизированного локуса тяжелой цепи определяли с помощью анализа количественной ПЦР с использованием зондов TAQMAN™ (Lie, Y.S. and Petropoulos, C.J. (1998) Advances in quantitative PCR technology: 5'nuclease assays. Curr Opin Biotechnol 9(1):43-48). Вышележащие и нижележащие области за пределами модифицированной части гуманизированного локуса тяжелой цепи подтверждали с помощью ПЦР с использованием праймеров и зондов, расположенных в пределах модифицированной области для подтверждения присутствия эктопической геномной последовательности мыши в пределах гуманизированного локуса тяжелой цепи, а также кассеты гигромицина. Нуклеотидная последовательность в вышележащей точке вставки включала следующее, что показывает геномную последовательность тяжелой цепи человека, расположенная выше против хода транскрипции от точки вставки, и сайт рестрикционный I-Ceu I (содержащийся в скобках ниже), смежно соединенные с геномной последовательностью мыши, присутствующей в точке вставки: (CCAGCTTCAT TAGTAATCGT TCATCTGTGG TAAAAAGGCA GGATTTGAAG CGATGGAAGA TGGGAGTACG GGGCGTTGGA AGACAAAGTG CCACACAGCG CAGCCTTCGT CTAGACCCCC GGGCTAACTA TAACGGTCCT AAGGTAGCGA G) GGGATGACAG ATTCTCTGTT CAGTGCACTC AGGGTCTGCC TCCACGAGAA TCACCATGCC CTTTCTCAAG ACTGTGTTCT GTGCAGTGCC CTGTCAGTGG (SEQ ID NO:4). Нуклеотидная последовательность в нижележащей точке вставки на 3' конце нацеленной области включала следующее, что показывает геномную последовательность мыши и сайт рестрикции PI-See I (содержащийся в скобка ниже), смежно соединенные с геномной последовательностью тяжелой цепи человека ниже по ходу транскрипции от точки вставки: (AGGGGTCGAG GGGGAATTTT ACAAAGAACA AAGAAGCGGG CATCTGCTGA CATGAGGGCC GAAGTCAGGC TCCAGGCAGC GGGAGCTCCA CCGCGGTGGC GCCATTTCAT ТАССТСТТТС TCCGCACCCG ACATAGATAAAGCTT) ATCCCCCACC AAGCAAATCC CCCTACCTGG GGCCGAGCTT CCCGTATGTG GGAAAATGAA TCCCTGAGGT CGATTGCTGC ATGCAATGAA ATTCAACTAG (SEQ ID NO:5).
Описанные выше нацеленные ES клетки использовали в качестве донорных ES клеток и вводили в эмбрион мыши на стадии 8 клеток с помощью способа генной инженерии мыши VELOCIMOUSE® (смотрите, например, патенты США №№76598442, 7576259, 7294754). Мышей, несущих гуманизированный локус тяжелой цепи, содержащий эктопическую геномную последовательность мыши, содержащую последовательности ADAM6a и ADAM6b мыши, определяли путем генотипирования с использованием модификации анализа аллелей (Valenzuela et al., 2003), в котором обнаруживали присутствие генов ADAM6a и ADAM6b мыши в гуманизированном локусе тяжелой цепи.
Мышей, несущих гуманизированный локус тяжелой цепи, который содержит гены ADAM6a и ADAM6b мыши, скрещивали с FLPe делеторным штаммом мышей (смотрите, например, Rodrfguez, C.I. et al. (2000) High-efficiency deleter mice show that FLPe is an alternative to Cre-loxP. Nature Genetics 25:139-140) для удаления любой кассеты гигромицина FRTed, введенной с помощью нацеливающего вектора, которые е удаляют, например, на стадии ES клетки или в эмбрионе. Необязательно, кассету гигромицина оставляют у мышей.
Детенышей генотипируют и детеныша, гетерозиготного в отношении гуманизированного локуса тяжелой цепи, содержащего эктопический геномный фрагмент мыши, который содержит последовательности ADAM6a и ADAM6b мышь, выбирают для определения характеристик экспрессии и фертильности гена ADAM6 мыши.
Пример VIII
Определение характеристик сохранивших ADAM6 мышей
Проточная цитометрия
Трех мышей в возрасте 25 недель, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и к легкой цепи человека (Н/κ), и трех мышей в возрасте 18-20 недель, гомозиготных в отношении тяжелой цепи человека и к легкой цепи человека, содержащих эктопический геномный фрагмент мыши, кодирующий гены ADAM6a и ADAM6b мыши в обоих аллелях локуса тяжелой цепи человека (Н/κ-А6), умерщвляли для определения и анализа клеточных популяций лимфоцитов с помощью FACs на BD LSR II системе (BD Bioscience). Лимфоциты выделяли путем гейтирования в отношении специфических клеточных родословных и анализировали в отношении прохождения через различные стадии развития В-клеток. Собранные от животных ткани предусматривали кровь, селезенку и костный мозг. Кровь собирали в BD microtainer пробирки с EDTA (BD Biosciences). Костный мозг собирали из бедренных костей с помощью промывки полной средой RPMI, дополненной фетальной телячьей сывороткой, пируватом натрия, HEPES, 2-меркаптоэтанолом, заменимыми аминокислотами и гентамицином. Эритроциты из препаратов крови, селезенки и костного мозга лизировали с помощью лизирующего буфера на основе хлорида аммония (например, лизирующий буфер АСК) с последующей отмывкой полной средой RPMI.
Для окрашивания клеточных популяций 1×106 клеток из различных источников ткани инкубировали с антимышиным CD16/CD32 (2,4G2, BD Biosciences) на люду в течение 10 минут с последующим мечением одним или комбинацией следующих коктейлей антител в течение 30 мин на льду.
Костный мозг: антимышиный FITC-CD43 (1В11, BioLegend), PE-ckit (2B8, BioLegend), PeCy7-IgM (II/41, eBioscience), PerCP-Cy5,5-IgD (11-26c,2a, BioLegend), APC-eFluor780-B220 (RA3-6B2, eBioscience), A700-CD19 (1D3, BD Biosciences).
Периферическая кровь и селезенка: антимышиный FITC-κ (187.1, BD Biosciences), PE-λ (RML-42, BioLegend), PeCy7-IgM (II/41, eBioscience), PerCP-Cy5.5-IgD (11.26c.2a, BioLegend), APC-CD3 (145-2C11, BD), A700-CD19 (1D3, BD), APC-eFluor780-B220 (RA3-6B2, eBioscience). После инкубация с мечеными антителами клетки отмывали и фиксировали в 2% формальдегиде. Сбор данных проводили на проточном цитометре LSRII и анализировали с помощью FlowJo. Результаты от репрезентативной Н/κ и Н/κ-А6 мыши показаны на фигурах 14-18.
Результаты показывают, что В-клетки Н/κ-А6 мышей проходят через стадии развития В-клеток аналогично Н/κ мышам в костном мозге и периферических компартментах, и показывают нормальные паттерны созревания, как только они поступают на периферию. Н/κ-А6 мыши демонстрировали увеличенную CD43intCD19+ клеточную популяцию по сравнению с Н/κ мышами (фиг.16В). Это может указывать на ускоренную экспрессию IgM из гуманизированного локуса тяжелой цепи, содержащего эктопический геномный фрагмент мыши, содержащий последовательности ADAM6a и ADAM6b мыши у Н/κ-А6 мышей. На периферии В - и Т-клеточные популяции Н/κ-А6 мышей оказываются нормальными и сходными с Н/κ мышами.
Морфология семенников и определение характеристик сперматозоидов
Для определения того, является ли стерильность у мышей, характеризующихся гуманизированными вариабельными локусами тяжелой цепи иммуноглобулина вследствие нарушений семенников и/или продукции сперматозоидов, исследовали морфологию яичек и содержание сперматозоидов в придатке семенника.
Кратко, семенники от двух групп из пяти мышей на группу (группа 1: мыши, гомозиготные в отношении вариабельных генных локусов тяжелой и к легкой цепи человека, mADAM6-/-; группа 2: мыши, гетерозиготная в отношении вариабельных генных локусов тяжелой цепи человека и гомозиготные в отношении вариабельных генных локусов D к легкой цепи, mADAM6+/-) вырезали с интакгным придатком семенника и взвешивали. Образцы затем фиксировали, погружали в парафин, делали срезы и окрашивали с помощью гематоксилинового и эозинового (НЕ) красителя. Срезы семенника (2 семенника от каждой мыши, общим количеством 20) исследовали в отношении нарушений в морфологии и данных о продукции сперматозоидов, тогда как срезы придатка семенника исследовали в отношении присутствия сперматозоидов.
Согласно настоящему эксперименту не наблюдали различий в весе или морфологии семенников между mADAM6-/- мышами и mADAM6+/- мышами. Сперму наблюдали во всех генотипах, как в семенниках, так и в придатке семенника. Эти результаты доказывают, что отсутствие генов ADAM6a и ADAM6b мыши не приводит к обнаруживаемым изменениям в морфологии семенника, и что сперматозоиды производятся у мышей в присутствии и при отсутствии этих двух генов. Нарушения в фертильности самцов ADAM6-/- мышей, следовательно, вероятно, не обусловлены низкой продукцией сперматозоидов.
Подвижность и миграция сперматозоидов
Мыши, у которых отсутствуют другие представители семейства генов ADAM являются стерильными вследствие нарушений в подвижности и миграции сперматозоидов. Миграцию сперматозоидов определяют как способность спермы проходить от матки в яйцевод, и в норме необходима для оплодотворения у мышей. Для определения того, влияет ли делеция мышиных ADAM6a и ADAM6b на этот процесс, миграцию сперматозоидов оценивали у mADAM6-/- мышей. Также исследовали подвижность сперматозоидов.
Кратко, сперму получали из семенников (1) мышей, гетерозиготных в отношении вариабельных генных локусов тяжелой цепи человек и гомозиготных в отношении вариабельных генных локусов к легкой цепи человека (ADAM6+/-); (2) мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и гомозиготных в отношении вариабельных генных локусов к легкой цепи человека (ABAM6-/-); (3) мышей, гомозиготных в отношении вариабельных генных локусов тяжелой цепи человека и гомозиготных в отношении к легкой цепи дикого типа (ADAM6-/-mκ); и, (4) C57BL/6 мышей дикого типа (WT). Не наблюдали никаких значительных аномалий в количество сперматозоидов или общую подвижность сперматозоидов путем осмотра. Для всех мышей наблюдали дисперсию кумулюса, указывая на то, что каждый образец спермы был способен проникать в клетки кумулюса и связываться с виттелиновым слоем in vitro. Эти результаты показывают, что ADAM6-/- мыши характеризуются спермой, которая способна к проникновению в кумулюс и связыванию с виттелиновым слоем.
Оплодотворение яйцеклеток мыши in vitro (IVF) проводили с использованием спермы от мышей, как описано выше. Несколько меньшее число нерасщепленных эмбрионов присутствовало для ADAM6-/- на следующих день после IVF, а также сниженное количество сперматозоидов, связанных с яйцеклетками. Эти результаты показывают, что сперма от ADAM6-/- мышей, при взаимодействии с яйцеклеткой, способна к проникновению в кумулюс и связыванию с виттелиновым слоем.
Согласно другому эксперименту способность спермы от ADAM6-/- мышей мигрировать из матки и через яйцевод определяли в анализе миграции сперматозоидов.
Кратко, первую группу из пяти подвергнутых суперовуляции самок мышей спаривали с пятью ADAM6-/- самцами. Вторую группу из пяти подвергнутых суперовуляции самок мышей спаривали с пятью ADAM6+/- самцами. Семейные пары подвергали наблюдению в отношении копуляции, и через пять-шесть часов после копуляции матку и прикрепленный яйцевод из всех самок удаляли и промывали для анализа. Промывочные растворы проверяли в отношении яйцеклеток для подтверждения овуляции и подсчета количества сперматозоидов. Миграцию сперматозоидов оценивали двумя различными путями. Согласно первому способу оба яйцевода удаляли из матки, промывали солевым раствором и любые обнаруженные сперматозоиды подсчитывали. Присутствие яйцеклеток также отмечали как доказательство овуляции. Согласно второму способу яйцеводы оставляли прикрепленными к матке и обе ткани фиксировали, погружали в парафин, делали срезы и окрашивали (как описано выше). Срезы исследовали в отношении присутствия сперматозоидов, как в матке, так и в обоих яйцеводах.
Для пяти самок, спаренных с пятью ADAM6-/- самцами, очень небольшое количество спермы обнаружили в промывочном растворе из яйцевода. Промывочные растворы из яйцеводов пяти самок, спаренных с пятью ADAM6+/- самцами, демонстрировали содержание сперматозоидов, приблизительно в 25-30 раз выше (среднее, n=10 яйцеводов), чем присутствующее в промывочных растворах из яйцеводов пяти самок, спаренных с пятью ADAM6-/- самцами.
Получали гистологические срезы матки и яйцевода. Срезы исследовали в отношении присутствия сперматозоидов в матке и яйцеводе (colliculus tubarius). Осмотр гистологических срезов яйцевода и матки выявил, что для самок мышей, спаренных с ADAM6-/- мышами, сперму обнаружили в матке, но не в яйцеводе. Более того, срезы от самок, спаренных с ADAM6-/- мышами выявили, что сперму не обнаружили в маточно-трубном сочленении (UTJ). В срезах от самок, спаренных с ADAM6+/- мышами сперму обнаружили в UTJ и в яйцеводе.
Эти результаты показывают, что мыши, не содержащие гены ADAM6a и ADAM6b, производят сперму, которая проявляет in vivo нарушение миграции. Во всех случаях сперму обнаружили в матке, что указывает на то, что копуляция и высвобождение спермы, вероятно, происходит в норме, но небольшое количество сперматозоидов или их отсутствие наблюдали в яйцеводах после копуляции, что измеряли или с помощью определения количества сперматозоидов, или с помощью гистологического наблюдения. Эти результаты показывают, что мыши с отсутствием генов ADAM6a и ADAM6b производят сперматозоиды, которые проявляют неспособность мигрировать из матки в яйцевод. Это нарушение, вероятно, приводит к стерильности, поскольку сперматозоиды не способны пересечь маточно-трубное сочленение в яйцеводе, где оплодотворяются яйцеклетки. Взятые вместе, все эти результаты сходятся к подтверждению гипотезы о том, что гены ADAM6 мыши способствуют в направлении сперматозоидов в нормальной подвижностью мигрировать из матки, через маточно-трубное сочленение и яйцевод и, таким образом, достигать яйцеклетки для осуществления события оплодотворения. Механизм, которым ADAM6 достигает этого, может быть прямым путем действия белков ADAM6 или посредством координированной экспрессии с другими белками, например, другими белками ADAM, в сперматозоиде, как описано ниже.
Экспрессия семейства генов ADAM
Известно, что комплекс белков ADAM присутствует в виде комплекса на поверхности созревающих сперматозоидов. Мыши, не содержащие других представителей семейства генов ADAM, теряют этот комплекс, как только сперматозоиды созревают, и проявляют снижение множественных белков ADAM в зрелых сперматозоидах. Для определения того, влияет ли отсутствие генов ADAM6a и ADAM6b на другие белки ADAM сходным образом, вестерн-блоты белковых экстрактов из семенника (незрелые сперматозоиды) и придатка семенника (созревающие сперматозоиды) анализировали для определения уровней экспрессии других представителей семейства генов ADAM.
Согласно настоящему эксперименту анализировали белковые экстракты от четырех ADAM6-/- и четырех ADAM6+/- мышей. Результаты показали, что экспрессия ADAM2 и ADAM3 не подверглась воздействию в экстрактах семенников. Тем не менее, как ADAM2, так и ADAM3 были сильно снижены в экстрактах придатка семенника. Это демонстрирует, что отсутствие ADAM6a и ADAM6b в сперматозоидах ADAM6-/- мышей может напрямую воздействовать на экспрессию и, возможно, функцию других белков ADAM, когда сперматозоиды созревают (например, ADAM2 и ADAM3). Это указывает на то, что ADAM6a и ADAM6b являются частью белкового комплекса ADAM на поверхности сперматозоидов, который может быть критически важным для правильной миграции сперматозоидов.
Пример IX
Частота использования вариабельных генов тяжелой цепи человека у мышей с сохраненным ADAM6
Частоту использования выбранных вариабельных генов тяжелой цепи человека определяли у мышей, гомозиготных в отношении вариабельных генных локусов тяжелой и к легкой цепи человека, либо не содержащих гены ADAM6a и ADAM6b мыши (mADAMb-/-), либо содержащих эктопический геномный фрагмент, кодирующий гены ADAM6a и ADAM6b мыши (ADAM6+/+; смотрите пример 1) с помощью анализа количественной ПЦР с использованием зондов TAQMAN™ (как описано выше).
Кратко, очищали CD19+ В-клетки из селезенок mADAM6-/- и ADAM6+/+ мышей с использованием мышиных CD19 Microbeads (Miltenyi Biotec) и общую РНК очищали с использованием мининабора RNEASY™ (Qiagen). Геномную РНК удаляли с использованием обработки не содержащей РНазу ДНКазой на колонке (Qiagen). Приблизительно 200 нг мРНК обратно транскрибировали в кДНК с использованием набора First Stand cDNA Synthesis (Invitrogen) и затем амплифицировали с использованием универсального мастер-микса для ПЦР TAQMAN™ (Applied Biosystems) с использованием системы обнаружения последовательности ABI 7900 (Applied Biosystems). Относительную экспрессию каждого гена нормировали к к константной области мыши (mCκ). На таблице 9 представлены комбинации сенсовых/антисенсовых/TAQMAN™ MGB зондов, используемых в настоящем эксперименте.
|
Согласно настоящему эксперименту экспрессию всех четырех генов VH человека наблюдали в анализируемых образцах. Более того, уровни экспрессии были сопоставимыми между mADAM6-/- и ADAM6+/+ мышами. Эти результаты показывают, что все гены VH человека, которые являлись как дистальными по отношению к сайту модификации (VH3-23 и VH1-69), так и проксимальными по отношению к сайту модификации (VH1-2 и VH6-1), были способны рекомбинироваться для образования функционально экспрессируемой тяжелой цепи человека. Эти результаты показывают, что эктопический геномный фрагмент, содержащий последовательности ADAM6a и ADAM6b мыши, вставленные в геномную последовательность тяжелой цепи человека, не оказывают влияния на V(D)J рекомбинацию генных сегментов тяжелой цепи человека в пределах локуса, и эти мыши способны к рекомбинации генных сегментов тяжелой цепи человека нормальным способом для получения функциональных иммуноглобулиновых белков тяжелой цепи.
Пример Х
Определение вариабельных областей тяжелой цепи человеке, которые ассоциируются с выбранными вариабельными областями легкой цепи человека
Конструировали in vitro систему экспрессии для определения того, может ли единственная реаранжированная зародышевая легкая цепь человека совместно экспрессироваться с тяжелыми цепями человека из антиген-специфических антител человека.
Способы получения антител человека у генетически модифицированных мышей являются известными (смотрите, например, патент США №6596541, Regeneron Pharmaceutical s, гуманизированная мышь VELOCIMMUNE®). Технология гуманизированной мыши VELOCIMMUNE® предусматривает создание генетически модифицированной мыши, характеризующейся геномом, содержащим вариабельные области тяжелой и легкой цепи человека, функционально связанные с эндогенными локусами константной области мыши так, чтобы мышь производила антитело, содержащее вариабельную область человека и константную область мыши в ответ на стимуляцию антигеном. ДНК, кодирующая вариабельные области тяжелых и легких цепей антител, производимых гуманизированной мышью VELOCIMMUNE®, являются полностью человеческими. Вначале, выделяют химерные антитела с высокой аффинностью, характеризующиеся вариабельной областью человека и константной областью мыши. Как описано ниже, определяют характеристики антител и отбирают по необходимым характеристикам, включающим аффинность, селективность, эпитоп и т.д. Константные области мыши замещают необходимой константной областью человека для получения полностью человеческого антитела, содержащего не-IgM изотип, например, IgG1, IgG2, IgG3 или IgG4 дикого типа или модифицированный IgG1, IgG2, IgG3 или IgG4. Наряду с тем, что выбранная константная область может варьировать в соответствии с конкретным применением, характеристики высокоаффинного связывания с антигеном и целевой специфичности находятся в вариабельной области.
Гуманизированную мышь VELOCIMMUNE® иммунизировали с помощью фактора роста, который стимулирует ангиогенез (антиген С), и антиген-специфические человеческие антитела выделяли и секвенировали в отношении частоты использования V генов с использованием стандартных методик, принятых в настоящей области техники. Выбранные антитела клонировали в отношении константных областей тяжелой и легкой цепи человека и 69 тяжелых цепей выбирали для спаривания с одной из следующих трех легких цепей человека: (1) когнатная к легкая цепь, связанная с к константной областью человек, (2) реаранжированная зародышевая Vκ1-39Jκ5 человека, связанная с к константной областью человека или (3) реаранжированная зародышевая Vκ3-20Jκ1 человека, связанная с к константной областью человека. Каждую пару тяжелой цепи с легкой цепью котрансфицировали в СНО-K1 клетки с использованием стандартных методик. Присутствие антитела в супернатанте обнаруживали с помощью античеловеческого IgG в анализе ELISA. Титр антител (нг/мл) определяли для каждой пары тяжелой цепи с легкой цепью и титры с различными реаранжированными зародышевыми легкими цепями сравнивали с титрами, полученными с молекулой родительского антитела (т.е., тяжелая цепь, спаренная с когнатной легкой цепью) и рассчитывали процент нативного титра (таблица 10). VH: вариабельный ген тяжелой цепи. ND: не обнаружена экспрессия при текущих экспериментальных условиях.
|
Согласно сходному эксперименту гуманизированных мышей VELOCIMMUNE® иммунизировали с помощью нескольких различных антигенов и выбранные тяжелые цепи антиген-специфических антител человека исследовали в отношении их способности спариваться с различными реаранжированными зародышевыми легкими цепями человека (как описано выше). Используемые в настоящем эксперименте антигены включали фермент, вовлеченный в гомеостаз холестерола (антиген А), гормон сыворотки, вовлеченный в регуляцию гомеостаза глюкозы (антиген В), фактор роста, который стимулирует ангиогенез (антиген С) и рецептор клеточной поверхности (антиген D). Антиген-специфические антитела выделяли из мышей каждой группы иммунизации и вариабельные области тяжелой цепи и легкой цепи клонировали и секвенировали. Из последовательности тяжелых и легких цепей определяли частоту использования V генов и выбранные тяжелые цепи спаривали или с их когнатной легкой цепью, или с реаранжированной зародышевой областью Vκ1-39Jκ5 человека. Каждую пару тяжелой цепи с легкой цепью котрансфицировали в СНО-K1 клетки и присутствие антитела в супернатанте обнаруживали с помощью античеловеческого IgG в анализе EL1SA. Титр антител (мкг/мл) определяли для каждого спаривания тяжелой цепи с легкой цепью и титры с различными реаранжированными зародышевыми легкими цепями человека сравнивали с титрами, полученными с молекулой родительского антитела (т.е., тяжелая цепь, спаренная с когнатной легкой цепью) и рассчитывали процент нативного титра (таблица 11). VH: вариабельный ген тяжелой цепи. Vκ: вариабельный ген к легкой цепи. ND: не обнаружена экспрессия при текущих экспериментальных условиях.
|
Полученные из этих экспериментов результаты показывают, что соматически мутированные, высокоаффинные тяжелые цепи из различных семейств генов способны спариваться с реаранжированными зародышевыми областями Vκ1-39Jκ5 и Vκ3-20Jκ1 человека и секретироваться из клетки в виде нормальной молекулы антитела. Как показано в таблице 10, титр антител увеличивался приблизительно для 61% (42 из 69) тяжелых цепей при спаривании с реаранжированной легкой цепью Vκ1-39Jκ5 человека и приблизительно для 29% (20 из 69) тяжелых цепей при спаривании с реаранжированной легкой цепью Vκ3-20Jκ1 человека по сравнению с когнатной легкой цепью родительского антитела. Приблизительно для 20% (14 из 69) тяжелых цепей обе реаранжированные зародышевые легкие цепи человека обеспечивали увеличение экспрессии по сравнению с когнатной легкой цепью родительского антитела. Как показано в таблице 11, реаранжированная зародышевая область Vκ1-39Jκ5 человека обеспечивала увеличение экспрессии нескольких тяжелых цепей, специфических для диапазона различных классов антигенов по сравнению с когнатной легкой цепью для родительских антител. Титр антител увеличивался более чем в два раза приблизительно для 35% (15/43) тяжелых цепей по сравнению с когнатной легкой цепью родительских антител. Для двух тяжелых цепей (315 и 316) увеличение было больше чем десятикратным по сравнению с родительским антителом. Во всех тяжелых цепях, которые показали увеличение экспрессии относительно когнатной легкой цепи родительского антитела, тяжелые цепи третьего семейства (УнЗ) были представлены в избытке по сравнению с другими генными семействами вариабельной области тяжелой цепи. Это демонстрирует благоприятное взаимодействие тяжелых цепей УнЗ человека в спаривании с реаранжированными зародышевыми легкими цепями Vκ1-39Jκ5 и Vκ3-20Jκ1 человека.
Пример XI
Получение реаранжированного зародышевого локуса легкой цепи человека
Различные нацеливающие векторы реаранжированной зародышевой легкой цепи человека получали с использованием технологии генной инженерии VELOCIGENE® (смотрите, например, патент США №6586251 и Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21(6):652-659) для модификации мышиных геномных клонов на основе бактериальной искусственной хромосоме (ВАС) 302g12 и 254m04 (Invitrogen). С использованием этих двух ВАС - клонов геномные конструкции конструировали так, чтобы они содержали единственную реаранжированную зародышевую область легкой цепи человека и вставляли в эндогенный локус к легкой цепи, который предварительно модифицировали для удаления эндогенных к вариабельных и соединяющих генных сегментов.
Конструкция нацеливающих векторов реаранжированной зародышевой легкой цепи человека
Три различные реаранжированные зародышевые области легкой цепи человека получали с использованием стандартных молекулярно-биологических методик, принятых в настоящей области техники. Вариабельные генные сегменты человека, используемые для конструкции этих трех областей, включали реаранжированную последовательность Vκ1-39Jκ5 человека, реаранжированную последовательность Vκ3-20Jκ1 человека и реаранжированную последовательность Vпре-BJλ5 человека.
Сегмент ДНК, содержащий экзон 1 (кодирующий лидерный пептид) и интрон 1 гена Vκ3-7 мыши, получали с помощью синтеза ДНК de novo (Integrated DNA Technologies). Предусматривали часть 5' нетранслируемой области около встречающегося в природе сайта рестрикционного фермента BlpI. Экзоны генов Vκ1-39 и Vκ3-20 человека амплифицировали с помощью ПЦР из геномных ВАС - библиотек человека. Прямые праймеры содержали 5'-удлинение, содержащее акцепторный сайт сплайсинга интрона 1 гена Vκ3-7 мыши. Обратный праймер, используемый для ПЦР последовательности Vκ1-39 человека, содержал удлинение, кодирующее Jκ5 человека, тогда как обратный праймер, используемый для ПЦР последовательности Vκ3-20 человека, содержал удлинение, кодирующее Jκ1 человека. Последовательность Vпре-BJX5 человека получали с помощью синтеза ДНК de novo (Integrated DNA Technologies). Часть интрона JΚ-CΚ человека, содержащая донорный сайт сплайсинга, амплифицировали с помощью ПЦР из плазмиды pBS-296-HA18-PISceI. Прямой праймер ПЦР содержал удлинение, кодирующее часть любой из последовательностей Jκ5, Jκ1 или Jλ5 человека. Обратный праймер содержал сайт PI-Scel, который ранее сконструировали в интрон.
Vκ3-7 экзон 1/интрон 1 мыши, экзоны вариабельной легкой цепи человека и фрагменты JΚ-CΚ интрона человека сшивали вместе с помощью ПЦР перекрывающегося удлинения, обрабатывали с помощью BlpI и PI-SceI и лигировали в плазмиду pBS-296-HA18-PISceI, которая содержала промотор из вариабельного генного сегмента Vκ3-15 человека. Фланкированную 1ох кассету гигромицина в плазмиде pBS-296-HA18-PISceI замещали FRTed кассетой гигромицина, фланкированной сайтами NotI и AscI. Фрагмент NotI/PI-SceI этой плазмиды лигировали в модифицированную ВАС 254m04 мыши, которая содержала часть интрона JΚ-CΚ мыши, экзон Ск мыши и приблизительно 75 т.п.о. геномной последовательности ниже по ходу транскрипции от к локуса мыши, которые обеспечивали 3' плечо гомологии для гомологичной рекомбинации в ES клетках мыши. Фрагмент NotI/AscI этой ВАС затем лигировали в модифицированную ВАС 302g12 мыши, которая содержала FRTed кассету неомицина и приблизительно 23 т.п.о. геномной последовательности выше против хода транскрипции от эндогенного к локуса для гомологичной рекомбинации в ES клетках мыши.
Нацеливающий вектор реаранжированной зародышевой Vκ1-39Jκ5 человека (фиг.19)
Сайты рестрикционных ферментов вводили на 5' и 3' концы сконструированной вставки легкой цепи для клонирования в нацеливающий вектор: сайт AscI на 5' конец и сайт PI-SceI на 3' конец. В пределах 5' сайта AscI и 3' сайга PI-Scel нацеливающая конструкция в направлении 5'-3' содержала 5' плечо гомологии, содержащее последовательность 5' по отношению к эндогенному локусу к легкой цепи мыши, полученному из ВАС-клона 302g12 мыши, FRTed ген устойчивости к неомицину, геномную последовательность, содержащую промотор Vκ3-15 человека, лидерную последовательность вариабельного генного сегмента Vκ3-7 мыши, последовательность интрона вариабельного генного сегмента Vκ3-7 мыши, открытую рамку считывания реаранжированной зародышевой области Vκ1-39Jκ5 человека, геномную последовательность, содержащую часть интрона Jκ-Cκ человека и 3' плечо гомологии, содержащее последовательность 3' эндогенного генного сегмента Jκ5 мыши, полученного из ВАС-клона 254m04 мыши (фигура 19, средняя часть). Гены и/или последовательности выше против хода транскрипции от эндогенного локуса к легкой цепи мыши и ниже по ходу транскрипции от наиболее 3' генного сегмента Jκ (например, эндогенный 3' энхансер) не были модифицированы нацеливающей конструкцией (смотрите фигуру 19). Последовательность сконструированного локуса Vκ1-39Jκ5 человека показана в SEQ ID NO:59.
Нацеленную вставку реаранжированной зародышевой области Vκ1-39Jκ5 человека в ДНК ВАС подтверждали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров, расположенных на последовательностях в пределах реаранжированной зародышевой области легкой цепи человека. Кратко, последовательность интрона 3' по отношению к лидерной последовательности Vκ3-7 мыши подтверждали с помощью 126 праймеров ULC-m1F (AGGTGAGGGT ACAGATAAGT GTTATGAG; SEQ ID NO:60) и ULC-m1R (TGACAAATGC CCTAATTATA GTGATCA; SEQ ID NO:61). Открытую рамку считывания реаранжированной зародышевой области Vκ1-39Jκ5 человека подтверждали с помощью праймеров 1633-h2F (GGGCAAGTCA GAGCATTAGC A; SEQ ID NO:62) и 1633-h2R (TGCAAACTGG ATGCAGCATA G; SEQ ID NO:63). Кассету неомицина подтверждали с помощью праймеров neoF (ggtggagagg ctattcggc; SEQ ID NO:64) и neoR (gaacacggcg gcatcag; SEQ ID NO:65). Нацеленную ДНК ВАС затем использовали для электропорации ES клеток мыши для создания модифицированных ES клеток для получения химерных мышей, которые экспрессируют реаранжированную зародышевую область Vκ1-39Jκ5 человека.
Положительные ES клеточные клоны подтверждали с помощью Taqman™ скрининга и кариотипирования с использованием зондов, специфических для сконструированной области легкой цепи Vκ1-39Jκ5, вставленной в эндогенный локус. Кратко, зонд neoP (TGGGCACAAC AGACAATCGG CTG; SEQ ID NO:66), который связывается в пределах маркерного гена неомицина, зонд ULC-m1P (CCATTATGAT GCTCCATGCC TCTCTGTTC; SEQ ID NO:67), который связывается в пределах интронной последовательности 3' по отношению к Vκ3-7 лидерной последовательности мыши, и зонд 1633h2P (ATCAGCAGAA ACCAGGGAAA GCCCCT; SEQ ID NO:68), который связывается в пределах открытой рамки считывания реаранжированной зародышевой Vκ1-39Jκ5 человека. Положительные ES клеточные клоны затем использовали для имплантации самкам мышей для получения помета детенышей, экспрессирующих зародышевую область легкой цепи Vκ1-39Jκ5.
Альтернативно, ES клетки, несущие реаранжированную зародышевую область легкой цепи Vκ1-39Jκ5 человека, трансфицировали конструкцией, который экспрессирует FLP для удаления кассеты неомицина FRTed, введенной с помощью нацеливающей конструкции. Необязательно, кассету неомицина удаляют путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, патент США №6774279). Необязательно, кассету неомицина сохраняют у мышей.
Нацеливающий вектор реаранжированной зародышевой Vκ3-20Jκ1 человека (фиг.20)
Аналогичным образом, сконструированные локус легкой цепи, экспрессирующий реаранжированную зародышевую область Vκ3-20Jκ1 человека, получали с использованием нацеливающей конструкции, содержащей, в направлении 5'-3', 5' плечо гомологии, содержащее последовательность 5' по отношению к эндогенному локусу к легкой цепи мыши, полученному из ВАС-клона 302g12 мыши, ген устойчивости к неомицину FRTed, геномную последовательность, включающую промотор Vκ3-15 человека, лидерную последовательность вариабельного генного сегмента Vκ3-7 мыши, последовательность интрона вариабельного генного сегмента Vκ3-7 мыши, открытую рамку считывания реаранжиро ванной зародышевой области Vκ3-20Jκ1 человека, геномную последовательность, содержащую часть интрона Jκ-Cκ человека, и 3' плечо гомологии, содержащее последовательность 3' от эндогенного генного сегмента Jκ5 мыши, полученного из ВАС-клона 254m04 мыши (фигура 20, средняя часть). Последовательность сконструированного локуса Vκ3-20Jκ1 человека показана в SEQ ID NO:69.
Нацеленную вставку реаранжированной зародышевой Vκ3-20Jκ1 области человека в ДНК ВАС подтверждали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров, расположенных на последовательностях в пределах реаранжированной зародышевой области легкой цепи Vκ3-20Jκ1 человека. Кратко, последовательность интрона 3' по отношению к лидерной последовательности Vκ3-7 мыши подтверждали с помощью праймеров ULC-m1F (SEQ ID NO:60) и ULC-mIR (SEQ ID NO:61). Открытую рамку считывания реаранжированной зародышевой области Vκ3-20Jκ1 человека подтверждали с помощью праймеров 1635-h2F (TCCAGGCACC CTGTCTTTG; SEQ ID NO:70) и 1635-h2R (AAGTAGCTGC TGCTAACACT CTGACT; SEQ ID NO:71). Кассету неомицина подтверждали с помощью праймеров neoF (SEQ ID NO:64) и neoR (SEQ ID NO:65). Нацеленную ДНК ВАС затем использовали для электропорации ES клеток мыши для создания модифицированных ES клеток для получения химерных мышей, которые экспрессируют реаранжированную зародышевую легкую цепь Vκ3-20Jκ1 человека.
Положительные ES клеточные клоны подтверждали с помощью Taqman™ скрининга и кариотипирования с использованием зондов, специфических для сконструированной области легкой цепи Vκ3-20Jκ1, вставленной в эндогенный локус к легкой цепи. Кратко, зонд neoP (SEQ ID NO:66), который связывается в пределах маркерного гена неомицина, зонд ULC-m1P (SEQ ID NO:67), который связывается в пределах лидерной последовательности Vκ3-7 мыши, и зонд 1635h2P (AAAGAGCCAC CCTCTCCTGC AGGG; SEQ ID NO:72), который связывается в пределах открытой рамки считывания Vκ3-20Jκ1 человека. Положительные ES клеточные клоны затем использовали для имплантации самкам мышей для получения помета детенышей, экспрессирующих человека зародышевую область легкой цепи Vκ3-201к1.
Альтернативно, ES клетки, несущие зародышевую область легкой цепи Vκ3-201κ1 человека могут трансфицировать конструкцией, которая экспрессирует FLP для удаления кассеты неомицина FRTed, введенной путем нацеливающей конструкции. Необязательно, кассету неомицина могут удалить путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, патент США №6774279). Необязательно, кассету неомицина сохраняют у мышей.
Нацеливающий вектор реаранжированной зародышевой Vпре-BJλ5 человека (фиг.21)
Аналогичным образом, сконструированный локус легкой цепи, экспрессирующий реаранжированную зародышевую область Vпре-BJλ5 человека, получали с использованием нацеливающей конструкции, содержащей, в направлении 5'-3', 5' плечо гомологии, содержащее последовательность 5' по отношению к эндогенному локусу к легкой цепи мыши, полученному из ВАС-клона 302g12 мыши, ген устойчивости к неомицину FRTed, геномную последовательность, содержащую промотор Vκ3-15 человека, лидерную последовательность вариабельного генного сегмента Vκ3-7 мыши, последовательность интрона вариабельного генного сегмента Vκ3-7 мыши, открытую рамку считывания реаранжированной зародышевой области Vпре-BJλ5 человека, геномную последовательность, содержащую часть интрона Jκ-Cκ человека, и 3' плечо гомологии, содержащее последовательность 3' по отношению к эндогенному генному сегменту }к5 мыши, полученному из ВАС-клона 254m04 мыши (фигура 21, средняя часть). Последовательность сконструированной Vпре-BJλ5 локуса человека показана в SEQ ID NO:73.
Нацеленную вставку реаранжированной зародышевой область Vпре-BJλ5 человека в ДНК ВАС подтверждали с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров, расположенный на последовательностях в пределах реаранжированной зародышевой области легкой цепи Vпре-BJλ5 человека. Кратко, последовательность интрона 3' по отношению к лидерной последовательности Vκ3-7 мыши подтверждали с помощью праймеров ULC-m1F (SEQ ID NO:60 и ULC-mIR (SEQ ID NO:61). Открытую рамку считывания реаранжированной зародышевой области Vпре-BJλ5 человека подтверждали с помощью праймеров 1616-hlF (TGTCCTCGGC CCTTGGA; SEQ ID NO:74) и 1616-h1R (CCGATGTCAT GGTCGTTCCT; SEQ ID NO:75). Кассету неомицина подтверждали с помощью праймеров neoF (SEQ ID NO:64) и neoR (SEQ ID NO:65). Нацеленную ДНК ВАС затем использовали для электропорации ES клеток мыши для создания модифицированных ES клеток для получения химерных мышей, которые экспрессируют реаранжированную зародышевую легкую цепь Vпре-BJλ5 человека.
Положительные ES клеточные клоны подтверждают с помощью Taqman™ скрининга и кариотипирования с использованием зондов, специфических для сконструированной области легкой цепи Vпре-BJλ5, вставленной в эндогенный локус к легкой цепи. Кратко, зонд neoP (SEQ ID NO:66), который связывается в пределах маркерного гена неомицина, зонд ULC-m1P (SEQ ID NO:67), который связывается в пределах лидерной последовательности IgVκ3-7 мыши, и зонд 1616h1P (ACAATCCGCC TCACCTGCAC CCT; SEQ ID NO:76), который связывается в пределах открытой рамки считывания Vпре-BJκ5 человека. Положительные ES клеточные клоны затем используют для имплантации самкам мышей для получения помета детенышей, экспрессирующих зародышевую область легкой цепи.
Альтернативно, ES клетки, несущие реаранжированную зародышевую легкой цепи область Vпре-BJλ5 человека трансфицируют конструкцией, которая экспрессирует FLP для удаления кассеты неомицина FRTed, введенной с помощью нацеливающей конструкции. Необязательно, кассету неомицина удаляют путем скрещивания с мышами, которые экспрессируют рекомбиназу FLP (например, патент США №6774279). Необязательно, кассету неомицина сохраняют у мышей.
Пример XII
Получение мышей, экспрессирующих единственную реаранжированную легкую цепь человека
Описанный выше нацеленные ES клетки использовали в качестве донорных ES клеток и вводили в эмбрион мыши на стадии 8 клеток с помощью способа VELOCIMOUSE® (смотрите, например, патент США №7294754 и Poueymirou et al. (2007) FO generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses. Nature Biotech. 25(1):91-99. VELOCIMICE®, несущих независимо сконструированную зародышевую область легкой цепи Vκ1-39Jκ5 человека, область легкой цепи Vκ3-20Jκ1 или область легкой цепи Vпре-BJλ5 определяли путем генотипирования с использованием модификации анализа аллелей (Valenzuela et al., ранее), который обнаруживает присутствие уникальной реаранжированной зародышевой область легкой цепи человека.
Детенышей генотипируют и детеныша, гетерозиготного или гомозиготного в отношении уникальной реаранжированной зародышевой области легкой цепи человека выбирают путем получения характеристик экспрессии реаранжированной зародышевой области легкой цепи человека.
Проточная цитометрия
Экспрессию реаранжированной области легкой цепи человека в репертуаре нормальных антител мышей с общей легкой цепью подтверждали с помощью анализа экспрессии к и Х иммуноглобулина в спленоцитах и периферической крови мышей с общей легкой цепью. Суспензии клеток от собранных селезенок и периферической крови мышей дикого типа (n=5), мышей, гетерозиготных в отношении Vκ1-39Jκ5 общей легкой цепи (n=3), гомозиготных в отношении Vκ1-39Jκ5 общей легкой цепи (n=3), гетерозиготных в отношении Vκ3-20Jκ1 общей легкой цепи (n=2) и гомозиготных в отношении Vκ3-20Jκ1 общей легкой цепи (n=2), получали с использованием стандартных способов и окрашивали с помощью CD19+, IgI+ и Igκ+ с использованием флуоресцентно меченых антител (BD Pharmigen).
Кратко, 1×106 клеток инкубировали с антимышиным CD16/CD32 (клон 2.4G2, BD Pharmigen) на льду в течение 10 минут с последующим мечением следующим коктейлем антител в течение 30 минут на льду: АРС конъюгированный антимышиный CD19 (клон 1D3, BD Pharmigen), PerCP-Cy5.5 конъюгированный антимышиный CD3 (клон 17А2, BioLegend), FITC конъюгированный антимышиный Igκ (клон 187.1, BD Pharmigen), РЕ конъюгированный антимышиный Igλ (клон RML-42, BioLegend). После окрашивания клетки отмывали и фиксировали в 2% формальдегиде. Сбор данных проводили на проточном цитометре LSRII и анализировали с помощью FlowJo™. Гейтирование: общие В-клетки (CD19+CD3-), Igκ+ В-клетки (Igκ+IgI-CD19+CD-), IgI+ В-клетки (Igκ-IgI+CD19+CD3-). Данные, собранные от образцов крови и спленоцитов, показали сходные результаты. В таблице 12 представлено процентное отношение положительных CD19+ В-клеток из периферической крови одной репрезентативной мыши из каждой группы, которые являлись IgI+, Igκ+ или IgI+Igκ+. Процентное отношение CD19+ В-клеток в периферической крови от мышей дикого типа (WT) и мышей, гомозиготных в отношении или Vκ1-39Jκ5, или Vκ3-20Jκ1 общей легкой цепи, показаны на фиг.22.
|
Экспрессия общей легкой цепи
Экспрессию каждой общей легкой цепи (Vκ1-39Jκ5 и Vκ3-20Jκ1) анализировали у гетерозиготных и гомозиготных мышей с использованием анализ количественной ПЦР (например, Taqman™).
Кратко, очищали CD19+ В-клетки из селезенок мышей дикого типа, мышей, гомозиготных в отношении замещения локусов вариабельной области тяжелой цепи и к легкой цепи мыши соответствующими локусами вариабельной области тяжелой цепи и к легкой цепи (Нκ) человека, а также мышей, гомозиготных и гетерозиготных в отношении каждой реаранжированной области легкой цепи человека (Vκ1-39Jκ5 или Vκ3-20Jκ1) с использованием мышь CD19 Microbeads (Miltenyi Biotec) в соответствии с инструкциями производителя. Общую РНК очищали от CD19+ В-клеток с использованием мининабора RNeasy™ (Qiagen) в соответствии с инструкциями производителя и геномную РНК удаляли с использованием обработки не содержащей РНазу ДНКазой на колонке (Qiagen). 200 нг мРНК обратно транскрибировали в кДНК с использованием набора First Stand cDNA Synthesis (Invitrogen) и полученную кДНК амплифицировали с использованием универсального мастер-микса для ПЦР Taqman™ (Applied Biosystems). Все реакции проводили с использованием системы обнаружения последовательности ABI 7900 (Applied Biosystems) с использованием праймеров и Taqman™ MGB зондов, охватывающих (1) участок соединения Vκ-Jκ для обеих общих легких цепей, (2) только ген Vκ (т.е. Vκ1-39 и Vκ3-20), и (3) область Ск мыши. На таблице 13 представлены последовательности праймеров и зондов, используемых для настоящего анализа. Относительную экспрессию нормировали к экспрессии области СкПмыши. Результаты показаны на фиг.23А, 23В и 23С.
|
Антиген-специфические антитела с общей легкой цепью
Мышей с общей легкой цепью, несущих или Vκ1-39Jκ5, или Vκ3-20Jκ1 общую легкую цепь на эндогенном локусе к легкой цепи мыши, иммунизировали с помощью β-галактозидаза и измеряли титр антител.
Кратко, β-галактозидазу (Sigma) эмульгировали в адъюванте TITERMAX™ (Sigma), согласно инструкциям производителя. Мышей дикого типа (n=7), гомозигот в отношении общей легкой цепи Vκ1-39Jκ5 (n=2) и гомозигот в отношении общей легкой цепи Vκ3-201κ1 (n=5) иммунизировали с помощью подкожной инъекций в количестве 100 мкг β-галактозидазы/TITERMAX™. Мышей повторно иммунизировали с помощью подкожной инъекции два раза, с интервалом в 3 недели, в количестве 50 мкг β-галактозидазы/TITERMAX™. После второй повторной иммунизации кровь собирали из находящихся под анестезией мышей с использованием ретроорбитального кровотечения в пробирки для отделения сыворотки (BD Biosciences) согласно инструкциям производителя. Для измерения IgM или IgG антител к β-галактозидазе планшеты для ELISA (Nunc) покрывали 1 мкг/мл β-галактозидазы в течение ночи при 4°С. Избыток антигенов смывали перед блокированием с помощью PBS с 1% BSA в течение одного часа при комнатной температуре. Серийные разведения сыворотки добавляли к планшетам и инкубировали в течение одного часа при комнатной температуре перед отмывкой. Планшеты затем инкубировали с конъюгированным с HRP анти-IgM (Southern Biotech) или анти-IgG (Southern Biotech) в течение одного часа при комнатной температуре. После следующей отмывки планшеты проявляли с помощью субстрата ТМВ (BD Biosciences). Реакции останавливали с помощью 1 н. серной кислоты и считывали OD450 с использованием сканирующего спектрофотометра для прочтения планшетов Victor X5 (Perkin Elmer). Данные анализировали с помощью GRAPHPAD™ Prism и сигнал рассчитывали как разведение сыворотки, которое в два раза выше фонового значения. Результаты показаны на фиг.24А и 24В.
Как показано в настоящем примере, отношение кА, В-клеток как в компартменте селезенки, так и периферических компартментах мышей с общей легкой цепью Vκ1-39Jκ5 и Vκ3-20Jκ1 показало паттерн приблизительно дикого типа (таблица 12 и фиг.22). Мыши с общей легкой цепью Vпре-BJλ5, тем не менее, показали меньшее количество периферических В-клеток, из которых приблизительно 1-2% экспрессируют сконструированную область легкой цепи человека (данные не показаны). Уровни экспрессии реаранжированных областей легкой цепи человека Vκ1-39Jκ5 и Vκ3-20Jκ1 из эндогенного локуса к D легкой цепи повышались по сравнению с эндогенным локусом κ легкой цепи, содержащим полное замещение генных сегментов Vκ и Jκ мыши генными сегментами Vκ и Jκ человека (фиг.23А, 23В и 23С). Уровни экспрессии Vпре-BJλ5 реаранжированной области легкой цепи человека демонстрировали сходную высокую экспрессию из эндогенного локуса к легкой цепи как у гетерозиготных, так и гомозиготных мышей (данные не показаны). Это демонстрирует, что в прямой конкуренции с λ, к мыши или обоими эндогенными локусами легкой цепи, единственная реаранжированная последовательность VL/JL человека может давать в результате более высокие, чем уровень экспрессии дикого типа из эндогенного локуса κ легкой цепи и приводить к нормальному количеству В-клеток селезенки и крови. Более того, присутствие сконструированного локуса к легкой цепи, характеризующегося или последовательностью Vκ1-39Jκ5 человека, или Vκ3-20Jκ1 человека, будет хорошо переноситься мышами и, вероятно, функционировать способом дикого типа путем репрезентации значительной части репертуара легкой цепи в гуморальном компоненте иммунного ответа (фиг.24А и 24В).
Пример XIII
Скрещивание мышей, экспрессирующих единственную реаранжированную зародышевую легкую цепь человека
В настоящем примере описаны некоторые другие штаммы генетически модифицированных мышей, которые могут скрещиваться с какой-либо из описанных в настоящем документе мышей с общей легкой цепью для создания множественных штаммов генетически модифицированных мышей, характеризующихся множественными генетически модифицированными локусами иммуноглобулина.
Нокаут эндогенной Igλ (KO)
Для оптимизации частоты использования сконструированного локуса легкой цепи, мышей, несущих одну из реаранжированных зародышевых областей легкой цепи человека, скрещивают с другой мышью, содержащей делецию в эндогенном локусе X легкой цепи. Таким образом, полученное потомство будет экспрессировать, в качестве своей единственной легкой цепи, реаранжированную зародышевую область легкой цепи человека, как описано в примере 11. Скрещивание проводят с помощью стандартных методик, принятых в настоящей области техники, и, альтернативно, с помощью коммерческого производителя (например, Jackson Laboratory). Штаммы мышей, несущие сконструированный локус легкой цепи и делецию эндогенного локуса λ легкой цепи, подвергают скринингу в отношении присутствия уникальной области легкой цепи и отсутствия эндогенных λ легких цепей мыши.
Гуманизированный эндогенный локус тяжелой цепи.
Мышей, несущих сконструированный зародышевый локус легкой цепи человека, скрещивают с мышами, которые содержат замещение эндогенного вариабельного генного локуса тяжелой цепи мыши вариабельным генным локусом тяжелой цепи человека (смотрите патент США №6596541; гуманизированная мышь VELOCIMMUNE®, Regeneron Pharmaceuticals, Inc.). Гуманизированная мышь VELOCIMMUNE® содержит геном, содержащий вариабельные области тяжелой цепи человека, функционально связанные с эндогенными локусами константной области мыши так, чтобы мышь производила антитела, содержащие вариабельную область тяжелой цепи человека и константную область тяжелой цепи мыши в ответ на антигенную стимуляцию. ДНК, кодирующая вариабельные области тяжелых цепей антител, выделяют и функционально связывают с ДНК, кодирующей константные области тяжелой цепи человека. ДНК затем экспрессируют в клетке, способной к экспрессии полностью человеческой тяжелой цепи антитела.
Получают мышей, несущих замещение эндогенного локуса VH мыши с локусом VH человека и единственную реаранжированную зародышевую область VL человека на эндогенном локусе к легкой цепи. Обратные химерные антитела, содержащие соматически мутированные тяжелые цепи (VH человека и CH мыши) с единственной легкой цепью человека (VL человека и CL мыши) получают при иммунизации с помощью представляющего интерес антигена. Определяют нуклеотидные последовательности VH и VL В-клеток, экспрессирующих антитела и полностью человеческие антитела получают путем слияния нуклеотидных последовательностей VH и VL с нуклеотидными последовательностями CH и CL человека в подходящей системе экспрессии.
Пример XIV
Получение антител из мышей, экспрессирующих тяжелые цепи человека и реаранжированную зародышевую область легкой цепи человека
После скрещивания мышей, которые содержат сконструированную область легкой цепи человека с различными необходимыми штаммами, содержащими модификации и делеции других эндогенных ло кусов Ig (как описано в примере 12), выбранных мышей могут иммунизировать с помощью представляющего интерес антигена.
Как правило, гуманизированную мышь VELOCIMMUNE®, содержащую одну из единственных реаранжированных зародышевых областей легкой цепи человека, подвергают сенсибилизации с помощью антигена, и лимфатические клетки (такие как В-клетки) выделяют из сыворотки животных. Лимфатические клетки подвергают слиянию с миеломной клеточной линией для получения иммортализированных гибридомных клеточных линий, и такие гибридомные клеточные линии подвергают скринингу и селекции для определения гибридомных клеточных линий, которые производят антитела, содержащие вариабельные области тяжелой цепи человека и реаранжированные зародышевые легкие цепи человека, которые являются специфическими по отношению к используемому для иммунизация антигену. ДНК, кодирующую вариабельные области тяжелых цепей и легкой цепи, выделяют и связывают с необходимыми изотипическими константными областями тяжелой цепи и легкой цепи. Вследствие присутствия эндогенных последовательностей мыши и каких-либо дополнительных цис-дейтсвующих элементов, присутствующих в эндогенном локусе, единственная легкая цепь каждого антитела может быть соматически мутирована. Это вносит дополнительное разнообразие в антиген-специфический репертуар, содержащий единственную легкую цепь и разнообразные последовательности тяжелой цепи. Полученные клонированные последовательности антитела впоследствии экспрессируют в такой клетке, как СНО клетка. Альтернативно, ДНК, кодирующие антиген-специфические химерные антитела или вариабельные домены легких и тяжелых цепей, определяют непосредственно из антиген-специфических лимфоцитов.
Вначале, выделяют высокоаффинные химерные антитела, содержащие вариабельную область человека и константную область мыши. Как описано выше, определяют характеристики антител и проводят отбор антител в отношении необходимых характеристик, предусматривающих аффинность, селективность, эпитоп и т.д. Константные области мыши замещают необходимой константной областью человека для получения полностью человеческого антитела, содержащего соматически мутированную тяжелую цепь человека и единственную легкую цепь, происходящую из реаранжированной зародышевой области легкой цепи человека настоящего изобретения. Подходящие константные области человека включают, например, IgG1 или IgG4 дикого типа или модифицированные IgG1 или IgG4.
Отдельные когорты гуманизированных мышей VELOCIMMUNE®, содержащие замещение эндогенный локус тяжелой цепи мыши генными сегментами VH, DH и JH человека и замещение эндогенного локуса к легкой цепи мыши или сконструированной зародышевой областью легкой цепи Vκ1-39Jκ5 человека, или сконструированной зародышевой областью легкой цепи Vκ3-20Jκ1 человека (описанными выше), иммунизировали с помощью белка рецептора клеточной поверхности человека (антиген Е). Антиген Е вводят непосредственно на подушечку стопы задней лапы мышей с помощью шести последовательных инъекций каждые 3-4 дня. 2-3 мкг антигена Е смешивают с 10 мкг CpG олигонуклеотида (№ по кат. tlrl-modn - ODN1826 олигонуклеотид; In Vivogen, Сан-Диего, Калифорния) и 25 мкг Adju-Phos (гелевый адъювант фосфата алюминия, № по кат. Н-71639-250; Brenntag Biosector, Фредерикссунд, Дания) перед инъекцией. В общем шесть инъекций вводят перед последней повторной иммунизацией антигеном, которую вводят за 3-5 дней до умерщвления. Образцы крови после 4-ой и 6-ой инъекции собирали и иммунный ответ антител подвергают мониторингу с помощью стандартного антиген-специфического иммуноанализа.
Когда достигается необходимый иммунный ответ, спленоциты собирают и подвергают слиянию с миеломными клетками мыши для сохранения их жизнеспособности и образования гибридомных клеточных линий. Гибридомные клеточные линии подвергают скринингу и селекции для определения клеточных линий, которые производят специфические для антигена Е антитела с общей легкой цепью. С использованием этой техники получают некоторые специфические для антигена Е антитела с общей легкой цепью (т.е., антитела, обладающие вариабельными доменами тяжелой цепи человека, одинаковым вариабельным доменом легкой цепи человека и константными доменами мыши).
Альтернативно, антитела с общей легкой цепью к антигену Е выделяют непосредственно из антиген-положительных В-клеток без слияния с миеломными клетками, как описано в заявке на патент США №2007/0280945 А1, специально включенной в настоящий документ посредством ссылки в ее полноте. С использованием настоящего способа получала некоторые полностью человеческие антитела с общей легкой цепью к антигену Е (т.е., антитела, обладающие вариабельными доменами тяжелой цепи человека, или сконструированной областью легкой цепи Vκ1-39Jκ5 человека, или сконструированной областью легкой цепи Vκ3-20Jκ1 человека и константными доменами человека).
Биологические свойства иллюстративных антител к антигену Е с общей легкой цепью, полученных согласно способам настоящего примера, подробно описаны ниже.
Пример XV
Частота использования генного сегмента тяжелой цепи в антиген-специфических антителах с общей легкой цепью
Для анализа структуры произведенных человеческих антител к антигену Е с общей легкой цепью нуклеиновые кислоты, кодирующие вариабельные области тяжелой цепи антитела, клонировали и секвенировали. Из последовательностей нуклеиновых кислот и предсказанных аминокислотных последовательностей антител частоту использования генов определяли для вариабельной области тяжелой цепи (HCVR) выбранных антител с общей легкой цепью, полученных из иммунизированных гуманизированных мышей VELOCIMMUNE®, содержащих или сконструированную область легкой цепи Vκ1-39Jκ5 человека, или сконструированную область легкой цепи Vκ3-20Jκ1 человека. Результаты показаны в таблицах 14 и 15, на которых показано, что мыши согласно настоящему изобретению образуют антиген-специфические антитела с общей легкой цепью из разнообразных генных сегментов тяжелой цепи человека, вследствие разнообразия реаранжировок, при использовании или мыши, которая экспрессирует легкую цепь только из легкой цепи, происходящей из Vκ1-39 человека или Vκ3-20 человека. Генные сегменты VH человека из 2, 3, 4 и 5 семейств реаранжировали с разнообразными сегментами человека DH и сегментами человека JH для получения антиген-специфических антител.
|
|
Пример XVI
Определение блокирующей способности антиген-специфических антител с общей легкой цепью с помощью анализа LUMINEX™
Девяносто восемь антител с общей легкой цепью человека, возникших против антигена Е, анализировали в отношении их способности блокировать связывание естественного лиганда антигена Е (лиганда Y) с антигеном Е в исследовании на основе изучения гранул.
Внеклеточный домен (ECD) антигена Е конъюгировали с двумя метками туе эпигопа и 6Х гистидиновой меткой (антиген E-mmH) и связывали через аминогруппу с карбоксилированными микрогранулами в концентрации 20 мкг/мл в буфере MES. Смесь инкубировали в течение двух часов при комнатной температуре с последующей дезактивацией гранул с помощью 1 М Tris pH 8,0 с последующей отмывкой в PBS с 0,05% (объем/объем) Tween-20. Гранулы затем блокировали с помощью PBS (Irvine Scientific, Санта-Ана, Калифорния), содержащего 2% (вес/объем) BSA (Sigma-Aldrich Corp., Сент-Луис, Миссури). В 96-луночном планшете для фильтрации супернатанты, содержащие специфические для антигена Е антитела с общей легкой цепью, разбавляли 1:15 в буфере. Получали отрицательный контроль, содержащий имитацию супернатанта с компонентами сред, аналогичными супернатанту антител. Меченные антигеном Е гранулы добавляли к супернатантам и инкубировали в течение ночи при 4°С. Белок биотинилированного лиганда Y добавляли до конечной концентрации, составляющей 0,06 нМ, и инкубировали в течение двух часов при комнатной температуре. Обнаружение биотинилированного лиганда Y, связанного с меченными комплексом антиген E-myc-myc-6His гранулами, определяли с помощью R-фикоэритрина, конъюгированного с стрептавидином (Moss Inc, Пасадена, Мериленд) с последующим измерением на основанном на проточной цитометрии анализаторе LUMINEX™. Фоновую среднюю интенсивность флуоресценции (MFI) образца без лиганда Y отнимали от всех образцов. Процент блокирования рассчитывали путем деления вычтенного из фонового значения MFI каждого образца на скорректированное значение отрицательного контроля, умножая на 100 и вычитая полученное значение из 100.
Согласно аналогичному эксперименту такие же 98 антител с общей легкой цепью человека, возникших против антигена Е, анализировали в отношении их способности блокировать связывание антигена Е с меченными лигандом Y гранулами.
Кратко, лиганд Y связывали через аминогруппу с карбоксилированными микрогранулами в концентрации 20 мкг/мл с разведением в буфере MES. Смесь инкубировали в течение двух часов при комнатной температуре с последующей дезактивацией гранул с помощью 1М Tris pH 8, затем отмывая в PBS с 0,05% (объем/объем) Tween-20. Гранулы затем блокировали с помощью PBS (Irvine Scientific, Санта-Ана, Калифорния), содержащего 2% (вес/объем) BSA (Sigma-Aldrich Corp., Сент-Луис, Миссури). В 96-луночном планшете для фильтрации супернатанты, содержащие специфические для антигена Е антитела с общей легкой цепью, разбавляли 1:15 в буфере. Получали отрицательный контроль, содержащий имитацию супернатанта с компонентами сред, аналогичными супернатанту антител. Биотинилированный антиген E-mmH добавляли до конечной концентрации, составляющей 0,42 нМ, и инкубировали в течение ночи при 4°С. Меченные лигандом Y гранулы затем добавляли к смеси антитела с антигеном Е и инкубировали в течение двух часов при комнатной температуре. Обнаружение биотинилированного антигена E-mmH, связанного с меченными лигандом Y гранулами, определяли с помощью R-фикоэритрина, конъюгированного с стрептавидином (Moss Inc, Пасадена, Мериленд) с последующим измерением на основанном на проточной цитометрии анализаторе LUMINEX™. Фоновую среднюю интенсивность флуоресценции (MFI) образца без антигена Е отнимали от всех образцов. Процент блокирования рассчитывали путем деления вычтенного из фонового значения MFI каждого образца на скорректированное значение отрицательного контроля, умножая на 100 и вычитая полученное значение из 100.
На таблицах 16 и 17 показано процент блокирования для всех 98 антител к антигену Е с общей легкой цепью, исследованных в обоих анализах LUMINEX™. ND: не определено при текущих экспериментальных условиях.
|
|
В первом описанном выше эксперименте LUMINEX™ 80 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ1-39Jκ5, исследовали в отношении их способности блокировать связывание лиганда Y с меченными антигеном Е гранулами. Из этих 80 антител с общей легкой цепью 68 продемонстрировали блокирование >50%, наряду с тем, что 12 продемонстрировали блокирование <50% (6 при 25-50% блокировании и 6 при блокировании <25%). Для 18 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ3-20Jκ1, 12 продемонстрировали блокирование >50%, наряду с тем, что 6 продемонстрировали блокирование <50% (3 при 25-50% блокировании и 3 при блокировании <25%) связывания лиганда Y с меченными антигеном Е гранулами.
Во втором описанном выше эксперименте LUMINEX™ те же 80 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ1-39Jκ5, исследовали в отношении их способности блокировать связывание антигена Е с меченными лигандом Y гранулами. Их этих 80 антител с общей легкой цепью 36 продемонстрировали блокирование >50%, наряду с тем, что 44 продемонстрировали блокирование <50% (27 при 25-50% блокировании и 17 при блокировании <25%). Для 18 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ3-20Jκ1, 1 продемонстрировало блокирование >50%, наряду с тем, что 17 продемонстрировали блокирование <50% (5 при 25-50% блокировании и 12 при блокировании <25%) связывания антигена Е с меченными лигандом Y гранулами.
Данные таблиц 16 и 17 показывают, что описанные в таблицах 14 и 15 реаранжировки создают специфические для антигена Е антитела с общей легкой цепью, которые блокировали связывание лиганда Y с его когнатным рецептором антигеном Е с переменными степенями эффективности, что находится в соответствии с антителами к антигену Е с общей легкой цепью из таблиц 14 и 15, содержащих антитела со специфичностью к перекрывающимся и неперекрывающимся эпитопам по отношению к антигену Е.
Пример XVII
Определение способности к блокированию антиген-специфических антител с общей легкой цепью с помощью ELISA
Человеческие антитела с общей легкой цепью, возникшие против антигена Е, исследовали в отношении их способности блокировать связывание антигена Е с покрытой лигандом Y поверхностью а анализе ELISA.
Лигандом Y покрывали 96-луночные планшеты в концентрации 2 мкг/мл с разведением в PBS и инкубировали в течение ночи с последующей четырехкратной отмывкой в PBS с 0,05% Tween-20. Планшет затем блокировали с помощью PBS (Irvine Scientific, Санта-Ана, Калифорния), содержащего 0,5% (вес/объем) BSA (Sigma-Aldrich Corp., Сент-Луис, Миссури) в течение одного часа при комнатной температуре. В отдельном планшете супернатанты, содержащие антитела с общей легкой цепью к антигену Е разбавляли 1:10 в буфере. Имитацию супернатанта с такими же компонентами антител использовали в качестве отрицательного контроля. Антиген E-mmH (описанный выше) добавляли до конечной концентрации 0,150 нМ и инкубировали в течение одного часа при комнатной температуре. Смесь антитело/антиген E-mmH затем добавляли к планшету, содержащему лиганд Y, и инкубировали в течение одного часа при комнатной температуре. Обнаружение антигена E-mmH, связанного с лигандом Y, определяли с помощью пероксидазы хрена (HRP), конъюгированной с анти-пента-His антителом (Qiagen, Валенсия, Калифорния) и проявляли с помощью стандартной колориметрической реакции с использованием субстрата тетраметилбензидина (ТМВ) (BD Biosciences, Сан-Хосе, Калифорния), нейтрализованного серной кислотой. Поглощение считывали при OD450 в течение 0,1 сек. Фоновое поглощение образца без антигена Е вычитали из всех образцов. Процент блокирования рассчитывали путем деления вычтенного из фонового значения MFI каждого образца на скорректированное значение отрицательного контроля, умножая на 100 и вычитая полученное значение из 100.
На таблицах 18 и 19 показан процент блокирования для всех 98 антител к антигену Е с общей легкой цепью, исследованных в анализе ELISA. ND: не определено при текущих экспериментальных условиях.
|
|
Как описано в настоящем примере, из 80 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ1-39Jκ5, исследованных в отношении их способности блокировать связывание антигена Е с покрытой лигандом Y поверхностью, 22 продемонстрировали блокирование >50%, наряду с тем, что 58 продемонстрировали блокирование <50% (20 при 25-50% блокировании и 38 при блокировании <25%). Для 18 антител с общей легкой цепью, содержащих сконструированную легкую цепь Vκ3-20Jκ1, одно продемонстрировало блокирование >50%, наряду с тем, что 17 продемонстрировали блокирование <50% (5 при 25-50% блокировании и 12 при блокировании <25%) связывания антигена Е с покрытой лигандом Y поверхностью.
Эти результаты также согласуются с пулом антител с общей легкой цепью, специфических для антигена Е, содержащим антитела со специфичностью к перекрывающимся и неперекрывающимся эпитопам по отношению к антигену Е.
Пример XVIII
Определение аффинность с помощью BIACORE™ для антиген-специфических антител с общей легкой цепью
Равновесные константы диссоциации (KD) для выбранных супернатантов антител определяли с помощью SPR (поверхностного плазменного резонанса) с использованием прибора BIAcore™ T100 (GE Healthcare). Все данные получали с использованием HBS-EP (10 мМ HEPES, 150 мМ NaCl, 0,3 мМ EDTA, 0,05% поверхностно-активного вещества Р20, рН 7,4) в качестве как подвижного буфера, так и буфера для образца, при 25°С. Антитела захватывали из сырых образцов супернатанта на поверхность сенсорного чипа СМ5, предварительно дериватизированную с помощью высокой плотности антител к Fc человека с использованием стандартного химического взаимодействия соединения через аминогруппу. В ходе стадии захвата супернатанты впрыскивали по всей поверхности антител к Fc человека с объемной скоростью потока, составляющей 3 мкл/мин в течение в общем 3 минут. За стадией захвата следовало введение или подвижного буфера, или аналита в концентрации 100 нМ в течение 2 минут при объемной скорости потока, составляющей 35 мкл/мин. Диссоциацию антигена от захваченного антитела отслеживали с течение 6 минут. Захваченное антитело удаляли кратковременным введением 10 мМ глицина, рН 1,5. Все сенсограммы дважды соотносили с эталонными значениями путем вычитания сенсограмм от введений буфера из сенсограмм аналита, тем самым удаляя артефакты, вызванные диссоциацией антитела от поверхности захвата. Данные связывания для каждого антитела согласовывали с 1:1 моделью связывания с переносом масс с использованием программного обеспечения для оценки BIACORE™ Т 100 v2.1. Результаты показаны в таблицах 20 и 21.
|
|
Аффинности связывания антител с общей легкой цепью, содержащих показанные в таблицах 14 и 15 реаранжировки, варьируют, причем почти все проявляют KD в наномолярном диапазоне. Данные аффинности согласуются с антителами с общей легкой цепью, полученными в результате комбинаторной ассоциации описанных в таблицах 14 и 15 реаранжированных вариабельных доменов, являющихся высокоаффинными, клонально-селективными и соматически мутированными. Объединяя в предварительно показанными данными, описанные в таблицах 14 и 15 антитела с общей легкой цепью содержат набор разнообразных, высокоаффинных антител, которые проявляют специфичность в отношении одного или нескольких эпитопов на антигене Е.
Пример XIX
Определение специфичностей связывания антиген-специфических антител с общей легкой цепью с помощью анализа LUMINEX™
Выбранные антитела с общей легкой цепью к антигену Е исследовали в отношении их способности связываться с ECD (внеклеточный домен) антигена Е и вариантов ECD антигена Е, включающих ортолог яванского макака (Mf антиген Е), который отличается от белка человека приблизительно на 10% его аминокислотных остатков; делеционный мутант антигена Е, у которого отсутствуют последние 10 аминокислот с С-конца ECD (антиген Е-ΔСТ); и два мутанта, содержащих аланиновую замену на предполагаемых положениях взаимодействия с лигандом Y (антиген Е-Ala1 и антиген Е-Ala2). Белки антигена Е получали в СНО клетках, и каждый содержал myc-myc-His С-концевую метку.
Для исследований связывания белок ECD антигена Е или вариантный белок (описанный выше) из 1 мл культуральной среды захватывали путем инкубации в течении 2 часов при комнатной температуре с 1×106 микросферическими (Luminex™) гранулами, ковалентно покрытыми моноклональным антителом к myc (MAb 9E10, гибридомная клеточная линия CRL-1729™; АТСС, Манассас, Виргиния). Гранулы затем отмывали с помощью PBS перед применением. Супернатанты, содержащие антитела с общей легкой цепью к антигену Е, разбавляли 1:4 в буфере и добавляли к 96-луночным планшетам для фильтрования. Имитацию супернатанта без антител использовали в качестве отрицательного контроля. Гранулы, содержащие захваченные белки антигена Е, затем добавляли к образцам антител (3000 гранул на лунку) и инкубировали в течение ночи при 4°С. На следующий день гранулы образца отмывали и связанное антитело с общей легкой цепью обнаруживали с помощью конъюгированного с R-фикоэритрином антитела к IgG человека. Интенсивность флуоресценции гранул (приблизительно 100 гранул, подсчитанных для связывания каждого образца антитела с каждым белком антигена Е) измеряли с помощью анализатора на основе проточной цитометрии Luminex™ и регистрировали среднюю интенсивность флуоресценции (MFI) по меньшей мере для 100 подсчитанных гранул на одно взаимодействие гранулы с антителом. Результаты показаны в таблицах 22 и 23.
|
|
Супернатанты антител с общей легкой цепью к антигену Е проявляли высокоспецифическое связывание с гранулами, связанными с ECD антигена Е. Для этих гранул имитация супернатанта отрицательного контроля давала в результате пренебрежимо малый сигнал (<10 MFI) по сравнению с образцом гранул с ECD антигена, тогда как супернатанты, содержащие антитела с общей легкой цепью к антигену Е проявляли сильный сигнал связывания (средняя MFI, составляющая 2627, для 98 супернатанов антител; MFI>500 для 91 из 98 образцов антител).
В качестве измерения способности выбранных антител с общей легкой цепью к антигену Е определять различные эпитопы на ECD антигена Е, определяли относительное связывание антител с вариантами. Все четыре варианта антигена Е захватывали на гранулы к myc LUMINEX™, как описано выше для исследований связывания нативного ECD антигена Е, и определяли отношения относительного связывания (МFIвариант/MFIECD антигена E). Для 98 исследованных супернатантов антител с общей легкой цепью, показанных в таблицах 21 и 22, средние отношения (МFIвариант/MFIECD антигена E) отличалось для каждого варианта, вероятно, отражая различные захваченные количества белков на гранулах (средние отношения, составляющие 0,61, 2,9, 2,0 и 1,0 для антиген Е-ΔСТ, антиген Е-Ala1, антиген Е-Ala2 и Mf Антиген Е, соответственно). Для каждого варианта белка связывание для подгруппы из 98 исследованных антител с общей легкой цепью показало значительно сниженное связывание, указывая на чувствительность к мутации, которая характеризовала изучаемый вариант. Например, 19 из образцов антител с общей легкой цепью связывались с Mf антигеном Е с отношением МFIвариант/MFIECD антигена Е, составляющим <8%. поскольку многие из этой группы содержали антитела с высокой или относительно высокой аффинностью (5 с KD<5 нМ, 15 с KD<50 нМ), возможно, что более низкий сигнал для этой группы является результатом чувствительности к различиям в последовательности (эпитопе) между нативным ECD антигена Е и изучаемым вариантом, а не результатом более низких аффинностей.
Эти данные показывают, что описанные в таблицах 14 и 15 антитела с общей легкой цепью представляют разнообразную группу специфических для антигена-Е антител с общей легкой цепью, которые специфически распознают более чем один эпитоп на антигене Е.