Результат интеллектуальной деятельности: СПОСОБ ГЕНОДИАГНОСТИКИ МУТАНТНОГО АЛЛЕЛЯ, ВЫЗЫВАЮЩЕГО КОРОТКИЙ ПОЗВОНОЧНИК ИЛИ БРАХИСПИНУ У КРУПНОГО РОГАТОГО СКОТА, И ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
Вид РИД
Изобретение
Изобретение относится к области молекулярной генетики и может быть использовано в ветеринарии и зоотехнии для диагностики мутации, вызывающей наследственную болезнь: короткий позвоночник или брахиспина (Bovine Brachyspina Syndrome, BYS) у крупного рогатого скота. Синтезированный Набор последовательности праймеров и аллельспецифических зондов позволяет идентифицировать BYS мутацию в гене FANCI 21 хромосомы с помощью ПЦР в режиме реального времени (ПЦР-РВ). Мутация связана с делецией, т.е. с потерей 25-27 экзонов из 37 в участке гена FANCI размером 3,3 т.п.н. голштинской породы крупного рогатого скота. Врожденное заболевание, не связано с полом, наследуется по аутосомно-рецессивному типу. В медицинской литературе данное заболевание получило название анемии Фанкони (FANCI). Болезнь названа именем швейцарского педиатра Гвидо Фанкони, который первым ее обнаружил.
В настоящее время у крупного рогатого скота описано около 60 из 400 известных наследственных заболеваний, которые выявляются на уровне ДНК (ICAR Guidelines, 2011; Марзанова С.Н. и др., 2015). Они вызывают серьезные морфологические и функциональные отклонения, негативно влияют на здоровье и продуктивность животного. Поэтому важной задачей ветеринарных врачей и зоотехников является своевременная диагностика и искоренение источника, вызывающая данную болезнь. Знание молекулярной структуры, определение гетерозиготного животного-носителя, является основой для эффективной борьбы с наследственным заболеванием.
Быстрота и точность диагностики брахиспина значительно повысилась благодаря установлению генетической природы данной молекулярной болезни (Agerholm et al., 2006; 2007; 2010; Thomsen В. et al., 2006; Testoni S. et al., 2008; Buck B.C. et al., 2010; VanRaden P.M., et al., 2011; Charlier C. et al., 2012).
В ряде европейских стран (Agerholm J.S. et al., 2006; Testoni S. et al., 2008; Buck B.C. et al., 2010) мутация была прослежена до элитного американского голштинского быка Свит Хавен Традишин (Sweet Haven Tradition) (HOUSAM 1682485). Хотя, в канадском случае, предполагается более отдаленный предок (Agerholm J.S. et al., 2006). Потомки Свит Хавен Традишин были широко использованы в селекционных программах молочного скота многих стран мира и BY мутантный аллель распространился по всему миру.
Синдром брахиспина (Bovine Brachyspina Syndrome, BYS) является генетическим дефектом у голштинской породы крупного рогатого скота, что приводит либо к ранним срокам прерывания беременности. Аборт, наиболее распространенный признак, либо отел мертворожденными телятами, что является более редким случаем, когда особь является гомозиготной по рецессивному летальному аллелю. Впервые дефект был установлен в Дании в 2006 году (Agerholm J.S. et al., 2006). Позднее, аналогичные случаи были зарегистрированы в Нидерландах (Agerholm J.S., Peperkamp К., 2007), Италии (Testoni S. et al., 2008), Германии (Buck B.C. et al., 2010), Канаде (Agerholm J.S. et al., 2010), Китае (Lingzhao Fang et al., 2013) и др. Мертворожденные телята характеризовались сильным снижением веса тела, несмотря на нормальный или слегка продолжительный период беременности, заметным укорочением позвоночника, длинными и тонкими конечностями, наличием нижнего прикуса - брахигнатизм (brachygnathism), явным нарушением в развитии внутренних органов, например, дисплазией почек и половых желез. Вместе с тем, дефект может быть причиной в отношении некоторых нарушений течения беременности, за счет частых случаев абортов и длительных интервалов между отелами (Charlier С. et al., 2012). Большая часть случаев абортов, естественно сопровождается гибелью плода в течение эмбрионального или в ранний период развития плода. В данном случае по признакам брахиспина может быть схож с другой наследственной болезнью - комплексом аномалий позвоночника (CVM) (Thomsen В. et al., 2006), вызывая снижение плодовитости стада и непредсказуемых экономических потерь для хозяев животных.
Ранее проведенными исследованиями установлен ген, вызывающий BYS в позициях, охватывающих делецией 3,3 т.п.н. в гене FANCI 21 хромосомы крупного рогатого скота и диагностируется, как однонуклеотидный полиморфизм (single nucleotide polymorphism, SNP). В 2010 году группой ученых из разных европейских стран создан международный патент WO/2010/012690 для диагностики брахиспины (Georges М., Coppieters W., Charlier С., Agerholm J.S., Fredholm М. 2010. A genetic test for Brachyspina and fertility in cattle. Patent application WO/2010/012690).
В 2012 году, методом секвенирования была успешно идентифицирована причина мутации, вызывающая брахиспину (Bovine Brachyspina Syndrome, BYS). Им оказался участок гена FANCI ДНК размером 3,3 kb, подвергаемый делеции, т.е. потере 25-27 экзонов из 37 у голштинского крупного рогатого скота, ответственного за синдром или анемию Фанкони. Делеция приводила не только к удалению части ДНК, но и замещению одних аминокислот на другие в синтезируемых белках. Обычная частота встречаемости носителей составляет меньше 1/100,000, однако его встречаемость у голштинской породы составляет 7,4% и выше. Такое резкое расхождение данных между двумя цифрами возможно связано с гибелью гомозиготных телят на ранней стадии беременности (Charlier С. et al., 2012).
В Российской Федерации и за рубежом аналогов данной разработке нет. В настоящее время выдающихся производителей и ремонтный молодняк племенных предприятий Российской Федерации по разработанной методике проверяют на носительство мутантного аллеля BY. Результаты в обязательном порядке, наряду с группами крови, каппа-казеином, CVM и BLAD регулярно публикуют в индивидуальных карточках племенных быков.
Из уровня техники известен генетический тест для идентификации носителей рецессивного аллеля брахиспины у крупного рогатого скота. Данный тест позволяет определить, является ли бык носителем BY путем анализа его геномной ДНК или РНК. Метод может быть использован для выполнения селекции с помощью маркеров или геномного набора с целью повышения рождаемости (Патент на изобретение WO/2010/012690 опубл. 04.02.2010).
Данное изобретение принято в качестве ближайшего аналога. Отличительной особенностью заявленного изобретения от выявленного аналога является возможность определения BY по методике ПЦР в реальном времени (ПЦР-РВ), с помощью праймеров и аллельспецифических зондов. Точка мутации BY та же, что и в указанном аналоге, однако подход детекции принципиально иной.
В заявленном изобретении осуществляется идентификация полиморфизма в локусе FANCI с помощью ПЦР-РВ и использованием TaqMan зондов. Время исследования данного полиморфизма занимает не более 2-х часов.
Предлагаемый к патентованию способ и тест-система для его осуществления в сравнении со всеми изученными аналогами имеет следующие преимущества: специфическая структура праймеров и зондов, возможность проведения полимеразной цепной реакции в режиме реального времени (ПЦР-РВ), что обеспечивает быстроту проведения диагностики и получение результата за 2 часа.
Техническим результатом заявленного изобретения является возможность диагностики брахиспины или короткого позвоночника (Bovine Brachyspina Syndrome) у крупного рогатого скота методом ПЦР в реальном времени, сокращение времени выполнения полимеразной цепной реакции в реальном времени (ПЦР-РВ) (через 2 часа получен результат); не трудоемкость; возможность выполнять повторности; проводить контроль правильности исследования.
Заявленный технический результат достигается благодаря тому, что проводят выделение ДНК из биологического материала, постановку полимеразной цепной реакции в режиме реального времени с использованием реакционной смеси с BY, процесс циклирования, при котором денатурация, отжиг праймеров и синтез новой цепи ДНК происходит при температуре 64°С (при первом циклировании в 10 повторов, при втором циклировании в 30 повторов). Затем проводят оценку результатов реакции: BY не обнаружен при положительном значении по каналу Green и отрицательном значении по каналу Yellow, BY обнаружен при положительном значении по каналам Green и Yellow.
Тест-система для диагностики мутантного аллеля, вызывающего короткий позвоночник или брахиспину у крупного рогатого скота включает ПЦР-смесь для постановки реакции на выявление BY аллеля, разбавитель, термостабильный фермент Taq-полимеразу, положительные для выявления нормальных и мутантных BY аллелей и отрицательный контроли.
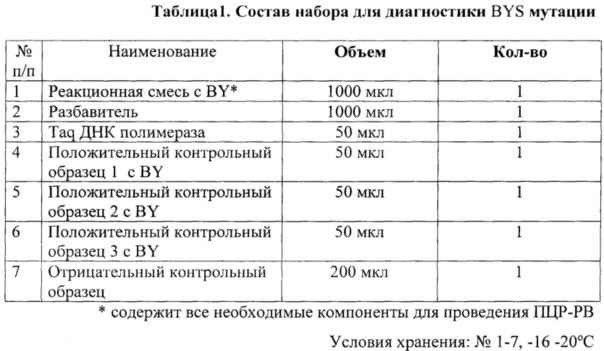
Для осуществления генодиагностики BY аллеля у крупного рогатого скота с помощью ПЦР в реальном времени (ПЦР-РВ) использовали праймеры и аллельспецифические зонды, имеющие следующие последовательности:
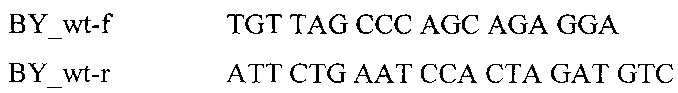

В настоящем изобретении представлен набор праймеров и зондов для диагностики мутантного BY аллеля у черно-пестрого генеалогического корня, куда относятся такие известные породы, как голштинская, черно-пестрая, холмогорская, ярославская, тагильская, кроме того красно-пестрая порода, а также синтетические популяции с примесью голштинской крови.
Заявлен оптимальный состав реакционной смеси для проведения полимеразной цепной реакции в режиме реального времени, приведено сочетание праймеров, необходимое и достаточное соотношение компонентов реакционной смеси и определен режим постановки ПЦР, что является важным при проведении ПЦР-анализа. Система рассчитана на проведение 100 реакций объемом 25 мкл (20 мкл + 5 мкл исследуемого образца).
Подбор праймеров и аллельспецифических зондов проводили при помощи пакета прикладных программ «Oligo 6.0» на основании анализа нуклеотидных последовательностей локуса FANCI ДНК, опубликованных в базе NSBI.
Пример проведения полимеразной цепной реакции с использованием заявленного набора.
Источником для проведения диагностики служит предварительно выделенная ДНК из образцов биологического материала (цельной крови, спермы, эмбрионов, молока, шерстки или кожи).
Реакционная смесь для ПЦР-анализа имеет следующий состав: 50 мМ KCl, 50 мМ TRIS-HCl, 250 нМ dNTP, 2,5 мМ MgCl2, 2,5 ед. ДНК-полимеразы, праймеры в концентрации 200 нМ, флуоресцентные зонды - в концентрации 100 нМ, имеющие определенные последовательности:

Подготовку к проведению реакции осуществляли следующим образом.
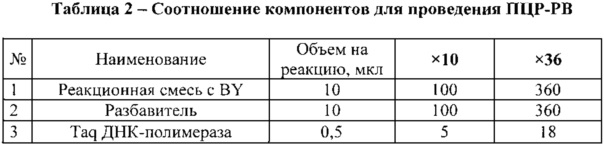
Необходимый объем компонентов рассчитывали исходя из количества исследуемых образцов плюс 4 (три положительных контрольных образца и один отрицательный контрольный образец). Набор компонентов для реакции представлен в таблице №1.
Компоненты разморозили, перемешали и центрифугировали. Приготовили смесь компонентов, добавляя их в порядке, указанном в таблице 2, перемешали и центрифугировали.
Профиль реакции:
1. Удержание температуры 94°С - 3 мин, один повтор.
2. Циклирование 1
94°С - 20 с
61°С - 20 с
64°С - 30 с
Цикл повторить 10 раз.
3. Циклирование 2 (с детекцией)
94°С - 20 с
61°С - 20 с
64°С - 30 с - детекция по каналам: Green, Yellow
Цикл повторить 30 раз. В процессе циклирования денатурация, отжиг праймеров и синтез новой цепи ДНК происходит при температуре 64°С. При первом циклировании провели 10 повторов - детекции нет, так как данные не репрезентативны. При втором циклировании провели повторов 30 - в результате получили стабильные данные, которые являются окончательными в плане диагностики.
Создание шаблона ПЦР-РВ, а также анализ результатов исследования проводили при помощи программного обеспечения «Rotor-Gene 6000 1.8» к прибору Rotor Gene Q (Corbett Research, Австралия).
Результатом анализа является определение мутантного аллеля, вызывающей брахиспину (BYS) у крупного рогатого скота.
В заявленном изобретении использована технология аллельспецифических TaqMan зондов. В данном случае флуоресцентным зондом является олигонуклеотид, комплементарный продукту ПЦР.
Зонд метят флуорофором и гасителем флуоресценции, при этом возможно использование как концевого, так и внутреннего мечения олигонуклеотида. При отсутствии мишени, т.е. последовательности, комплементарной зонду, флуорофор и гаситель сближаются, в результате подавляется флуоресценция зонда. Процесс тушения основан на механизме флуоресцентно-резонансного переноса энергии. При наличии комплементарного зонду фрагмента ДНК, зонд гибридизуется с ампликоном, что ведет к его расщеплению в процессе синтеза за счет 5'-экзонуклеазной активности Taq-полимеразы. Интенсивность сигнала возрастает на соответствующем флуорофору канале флуоресценции с каждым циклом ПЦР, пропорционально накоплению ампликонов.
Аллельспецифические зонды эффективны при детекции BYS мутации в исследуемом фрагменте генома. Для локуса с мутацией подбирают пару зондов, так чтобы один из них специфически гибридизовался при температуре проведения синтеза цепей с аллелем нормального (дикого) типа, а второй зонд - с аллелем мутантного типа.
Эти зонды метят разными флуорофорами, а результаты реакций с ними регистрируют на двух различных каналах детекции прибора для ПЦР-РВ. Для определения ВТ и BY аллелей используют 2 канала - Green и Yellow. Нормальный ВТ аллель дает рост сигнала по каналу Green, детектируемый флуорофором FAM, а мутантный аллель BY - по каналу Yellow, детектируемый флуорофором R6G.
Результаты интерпретируются на основании наличия или отсутствия пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией.
Переход порога, это характеристика количества копий ДНК отдельного гена. При оптимальном количестве копий ДНК, кривая располагается между двумя пороговыми значениями 10 и 15 циклами амплификации.
При перемещении кривой влево по оси абсцисс, это говорит о высокой концентрации ДНК, если вправо, о ее недостатке в реакции.
Все образцы, графики флуоресценции которых пересекают линию порога, будут считаться положительными по определенному каналу, т.е. содержащими соответствующий каналу флуоресценции аллель.
Получаемая картина результатов реакций с использованием указанных зондов на контрольных образцах приведена ниже при определении мутантного BY аллеля.
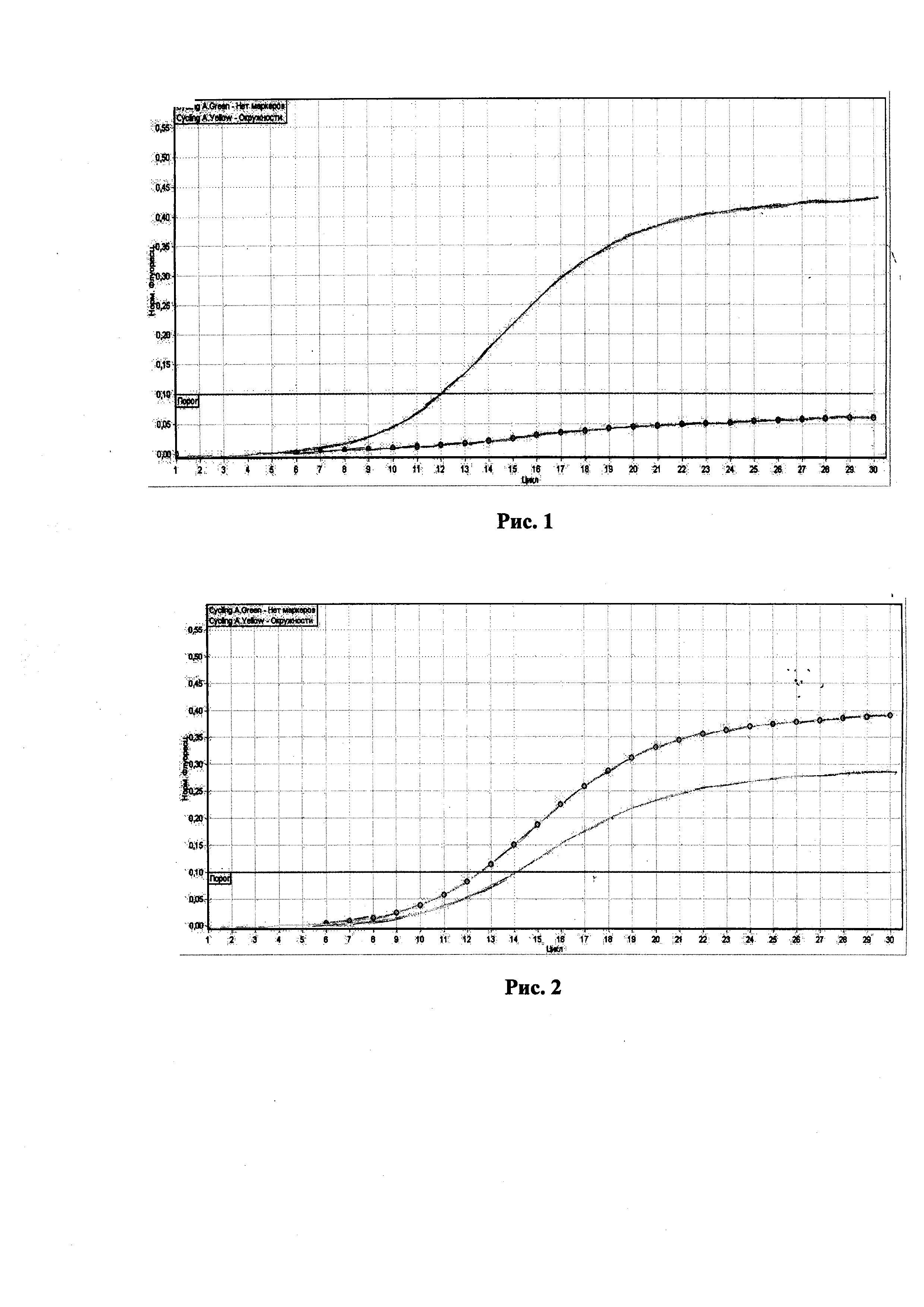
На рис. 1 результаты исследований гомозиготного дикого типа или здорового животного или неносителя, флуоресценция представлена двумя линиями.
Кривая без маркеров располагается между 10 и 15 циклами над красной пороговой линией. Вторая кривая с окружностями ниже пороговой линии. Данная ситуация характерна для здорового исследуемого животного.
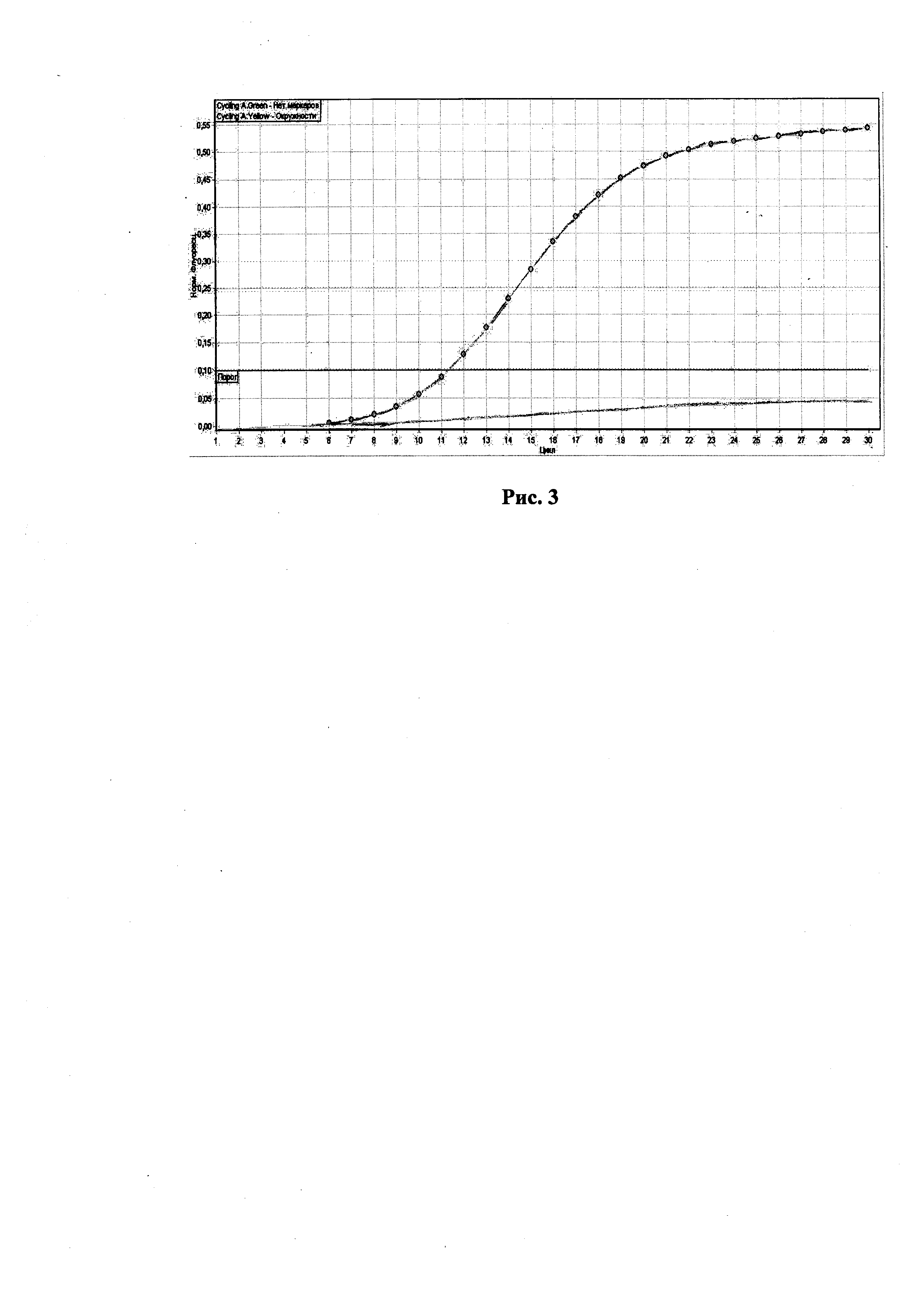
На рис. 2, представлены результаты исследования гетерозиготного животного или носителя мутантного BY аллеля. Как видно на рис. 2, обе кривые флуоресценции, пересекают установленную на соответствующем уровне пороговую линию в обозначенном районе, между 10 и 15 циклами ПЦР-РВ.
В то же время следует отметить, что кривая с окружностями располагается выше кривой без маркеров. Данная картина характерна для гетерозиготного животного или носителя мутации.
При разработке данного способа, не было возможным получение больных телят опытным путем в хозяйственных условиях. В этой связи, впервые удалось смоделировать синтетические рецессивные генотипы больных телят по гену FANCI, в лабораторных условиях, на основе знания структур мутантного BY аллеля.
На рис. 3 представлен модельный образец животного, гомозиготного по мутантному BY аллелю. Как видно на рис. 3, модельный образец отражает ситуацию характерную для больного теленка. В данном случае кривая с окружностями располагается выше порога, кривая флуоресценции без окружностей, характерная для здорового животного, оказывается под пороговой линией.
Прогноз получаемого потомства в зависимости от присутствия или отсутствия мутантного BY аллеля. Наличие BY аллеля является ярким примером носительства мутации с одной стороны, а с другой проявления однонуклеотидного полиморфизма или SNP (single nucleotide polymorphism) в ДНК у крупного рогатого скота.
Основными преимуществами заявляемого изобретения являются:
1. Возможность аттестации элитных животных черно-пестрого генеалогического корня и красно-пестрой породы по BYS мутации при помощи созданного Набора представленных последовательностей праймеров и зондов позволит направленно формировать аллелофонд быков-производителей, быковоспроизводящих групп коров, ремонтный молодняк, а также накапливать племенной материал (банк семени и эмбрионов) от здоровых животных.
2. Наличие генетического паспорта на BYS мутацию элитных животных позволит эффективно вести селекционно-племенную работу в племенных стадах черно-пестрого генеалогического корня и красно-пестрой породы.
3. При завозе племенного материала в Российскую Федерацию из-за рубежа обязательно наличие генетического паспорта.
4. С целью купирования наследственной болезни закупленные животные после карантина должны пройти повторное тестирование на наличие мутантного BY аллеля.
Литература
1. Марзанова С.Н., Нагорный В.А., Девришов Д.А., Алексеев Я.И., Коновалова Н.В., Тохов М.Х., Ескин Г.В., Турбина И.С., Лукашина А.А., Марзанов Н.С. Эффект основателя и геногеография CV- и BL-мутаций у черно-пестрого скота // Доклады РАСХН. 2015. №6. С. 44-47.
2. Agerholm J.S., DeLay J., Hicks В., Fredholm M. First confirmed case of the bovine brachyspina syndrome in Canada // Can. Vet. J. 2010. Vol. 51. P. 1349-1350.
3. Agerholm J.S., McEvoy F., Arnbjerg J. Brachyspina syndrome in a Holstein calf // J. Vet. Diagn. Invest. 2006. Vol. 18. P. 418-422.
4. Agerholm J.S., Peperkamp K. Familian occurrence of Danish and Dutch cases of the bovine brachyspina syndrome // BMC Vet. Res. 2007. Vol. 3. P. 8.
5. Buck B.C., Ulrich R.,  ., Kuiper H., Baumgartner W., Distl O. Missbildungen an der Wirbelsaule mit multiplen Organanomalien bei einem Kalb der Rasse Deutsche Holsteins [Vertebral and multiple organ malformations in a black and white German Holstein calf]. Berl Munch Tierarztl Wochenschr. 2010. Vol. 123. P. 251-255. In German. Abstract in English.
., Kuiper H., Baumgartner W., Distl O. Missbildungen an der Wirbelsaule mit multiplen Organanomalien bei einem Kalb der Rasse Deutsche Holsteins [Vertebral and multiple organ malformations in a black and white German Holstein calf]. Berl Munch Tierarztl Wochenschr. 2010. Vol. 123. P. 251-255. In German. Abstract in English.
6. Charlier C., Agerholm J.S., Coppieters W., Karlskov-Mortensen P., Li W., de Jong G., Fasquelle C., Karim L., Cirera S., Cambisano N., Ahariz N., Mullaart E., Georges M., Fredholm M. A deletion in bovine FANCI gene compromises fertility by causing fetal death and brachyspina // PLoS One. 2012. Vol. 7 (8): e43085.
7. Lingzhao Fang, Yanhua Li, Yi Zhang, Dongxiao Sun, Lin Liu, Yuan Zhang, Shengli Zhang. Identification of brachyspina syndrome carriers in Chinese Holstein cattle // Journal of Veterinary Diagnostic Investigation. 2013. Vol. 25. N4. P. 4508-4510.
8. Testoni S., Diana A., Olzi E., Gentile A. Brachyspina syndrome in two Holstein calves // Vet. J. 2008. Vol. 177. P. 144-146.
9. Thomsen В., Horn P., Panitz F., Bendixen E., Petersen A.H., Holm L.E., Nielsen V.H.. Agerholm J.S., Arnbjerg J., Bendixen C.A missense mutation in the bovine SLC35A3 gene, encoding a UDP-N-acetylgucosamine transporter, causes complex vertebral malformation//Genome Res. 2006. Vol. 16. P. 97-105.
10. VanRaden P.M., Olson K.M., Null D.J., Hutchison J.L. Harmful recessive effects on fertility detected by absence of homozygous haplotypes // J. Dairy Sci. 2011. Vol. 94. P. 6153-6161.
11. Каталог быков-производителей ОАО «Головной центр по воспроизводству сельскохозяйственных животных» / под ред. Ескина Г.В. Быково. - 2010. - 36 с.
Способ для диагностики мутантного аллеля, вызывающего короткий позвоночник или брахиспину у крупного рогатого скота, включающий выделение ДНК из биологического материала, постановку полимеразной цепной реакции в режиме реального времени с использованием реакционной смеси с BY, процесс циклирования, при котором денатурация, отжиг праймеров и синтез новой цепи ДНК происходит при температуре 64°С, при первом циклировании в 10 повторов, при втором циклировании в 30 повторов, затем проводят оценку результатов реакции: BY не обнаружен при положительном значении по каналу Green и отрицательном значении по каналу Yellow, BY обнаружен при положительном значении по каналам Green и Yellow.