Способ получения производных N-алкил- и N,N-диалкилизоцитозина
Вид РИД
Изобретение
Настоящее изобретение относится в химии гетероциклических соединений, конкретно к способу получения новых функциональных производных изоцитозина, содержащих один или два углеводородных заместителя при экзоциклическом атоме азота, являющихся биоизостерическими аналогами ненуклеозидных ингибиторов обратной транскриптазы ВИЧ-1 [Synthesis and Biological Properties of Novel 2-Aminopyrimidin-4(3H)-ones Highly Potent against HIV-1 Mutant Strains / Mai A., Artico M., Rotili D., Tarantino D., Clotet-Codina I.,  Ragno R., Simeoni S., Sbardella G., Nawrozkij M.B., Samuele A., Maga G.,
Ragno R., Simeoni S., Sbardella G., Nawrozkij M.B., Samuele A., Maga G.,  // J. Med. Chem. - 2007. - Vol. 50. - P. 5412-5424].
// J. Med. Chem. - 2007. - Vol. 50. - P. 5412-5424].
Известен способ получения производных N2-алкил- и N2,N2-диалкилизоцитозина с использованием реакции циклоконденсации производных N1-моно- и N1,N1-дизамещенных гуанидинов, полученных из их солей in situ, с соответствующими 3-оксоэфирами в присутствии алкоксидов щелочных металлов [Non-Nucleoside HIV-1 Reverse-Transcriptase Inhibitors. Part 10. Synthesis and Anti-Hiv Activity of 5-Alkyl-6-(1-Naphthylmethyl)pyrimidin-4(3H)-Ones With a Mono- Or Disubstituted 2-Amino Function as Novel 'Dihydro-Alkoxy-Benzyl-Oxopyrimidine' (DABO) Analogues / Wang Y., Chen F.E., Balzarini J., De Clercq E., Pannecouque C. // Chem Biodivers. - 2008. - 5. - P. 168-176; Solid phase synthesis of 2,6-disubstituted-4(3H)-pyrimidinones targeting HIV-1 reverse transcriptase / Nizi E., Corelli F., Manetti F., Messina F., Maga G. // Tetrahedron Lett. - 1998. - Vol. 39. - Is. 20 - P. 3307-3310].
Способ имеет ряд недостатков. Во-первых, при проведении реакции используется пожароопасный и чувствительный к воздействию атмосферной влаги и углекислоты раствор алкоксида щелочного металла. Во-вторых, многие исходные соли замещенных гуанидинов труднодоступны в чистом виде. В-третьих, проведение этой реакции с использованием солей N -монозамещенных гуанидинов приводит к образованию трудноразделяемых смесей региоизомерных продуктов [Solid phase synthesis of 2,6-disubstituted-4(3H)-pyrimidinones targeting HIV-1 reverse transcriptase / Nizi E., Corelli F., Manetti F., Messina F., Maga G. // Tetrahedron Lett. - 1998. - Vol. 39. - Is. 20 - P. 3307-3310].
Известен способ получения производных N2-алкил- и N2,N2-диалкилизоцитозина путем аминолиза соответствующих 2-(алкилсульфанил)пиримидин-4(3H)-онов [Взаимодействие 6-бензил-5-метил-2-(метилсульфанил)-пиримидин-4(3Н)-она с жирноароматическими аминами / Новаков И.А., Орлинсон Б.С, A. Mai, М. Artico, D. Rotili, Навроцкий М.Б // ЖОрХ. - 2009. - Т. 45. - С. 786-789].
Основным недостатком этого способа является выделение в ходе реакции меркаптанов, что требует усиленных мер по очистке и улавливанию отработанных газов. Кроме этого, в ряде случаев продукты реакции, полученные этим способом, имеют невысокую степень чистоты и требуют дополнительной очистки с использованием хроматографических методов.
Известен способ получения производных N2-алкил- и N2,N2-диалкилизоцитозина по реакции аминолиза соответствующих 2-(нитроамино)пиримидин-4(3H)-онов [Diarylpyrimidine-dihydrobenzyloxopyrimidine hybrids: New, wide-spectrum anti-HIV-1 agents active at (Sub)-nanomolar level / D. Rotili, D. Tarantino, M. Artico, M.B. Nawrozkij, E. Gonzalez-Ortega, B. Clotet, A. Samuele, J.A. Este, G. Maga, A. Mai // J. Med. Chem. - 2011. - Vol. - 54. - P. 3091-3096].
Эта реакция, однако, может протекать неоднозначно и, в случае вторичных аминов, приводить к продуктам, отличным от целевых [Исследование синтеза 3-оксоэфиров и функциональных производных пиримидин-4(3H)-она на основе 1-(2,6-дигалогенфенил)циклопропан-1-карбоновых кислот / И.А. Новаков, А.С.Яблоков, М.Б. Навроцкий, А.С. Мкртчян, А.А. Вернигора, А.С. Бабушкин, В.В. Качала, Е.А. Ручко // ЖОХ. - 2017. - Т. 87. - Вып. 2. - С. 247-254].
Известен способ получения производных N2-алкил- и N2,N2-диалкилизоцитозина, основанный на взаимодействии соответствующих производных 2-метоксипиримидин-4(3H)-онов с натриевыми солями первичных аминов в кипящем декалине или тетралине [6-Alky 1- and 5,6-Dialkyl-2-methoxy-4(3H)-pyrimidinones in the Transformations of Pyrimidines. Conversion into 2-Substituted Amino- and 4-Chloro-Pyrimidine-Derivatives / Botta M., De Angelis F., Finizia G., Gambacorta A., Nicoletti R. // Synth. Commun. - 2006. - Vol. - 15. - P. 27-34].
Этот способ подразумевает предварительное получение in situ соответствующих натриевых солей аминов, что предполагает высокую пожаро- и взрывоопасность в связи с использованием металлического натрия или его гидрида, выделением водорода и применением горючих и легковоспламеняющихся амидов. Кроме этого, реакция реализуется в очень жестких условиях, что приводит к образованию побочных продуктов. Целевые продукты, как правило, получаются с умеренным выходом, а их очистка является сложной и трудоемкой. Способ описан лишь для первичных аминов.
Наиболее близким является способ получения производных изоцитозина при взаимодействии соответствующего 2-нитроамино-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она циклопентиламином в среде бутанола [Исследование синтеза 3-оксоэфиров и функциональных производных пиримидин-4(3H)-она на основе 1-(2,6-дигалогенфенил)циклопропан-1-карбоновых кислот / И.А. Новаков, А.С. Яблоков, М.Б. Навроцкий, А.С. Мкртчян, А.А. Вернигора, А.С. Бабушкин, В.В. Качала, Е.А. Ручко // ЖОХ. - 2017. - Т. 87. - Вып. 2. - С. 247-254].
Недостатком способа является трудоемкость выделения продукта реакции в чистом виде и связанное с этим снижение его выхода.
Задачей предлагаемого технического решения является разработка нового технологического способа получения различных производных N2-алкил- и N2,N2-диалкилизоцитозина в одну стадию, с использованием доступных реагентов, приводящего к целевым продуктам с высокой чистотой и хорошим выходом.
Техническим результатом является повышение выхода целевых соединений, наряду с упрощением процесса их получения и выделения в чистом виде.
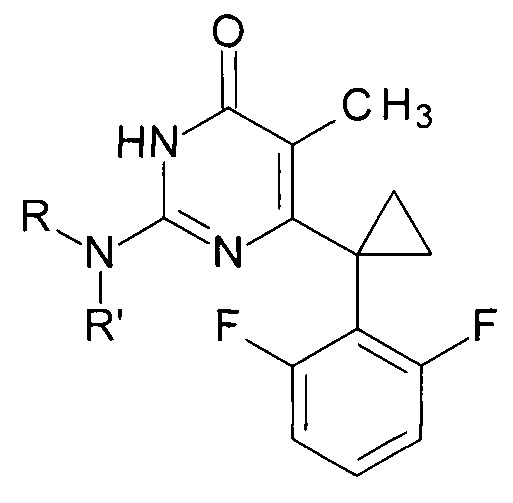
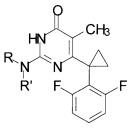
Технический результат достигается в способе получения производных изоцитозина общей формулы:
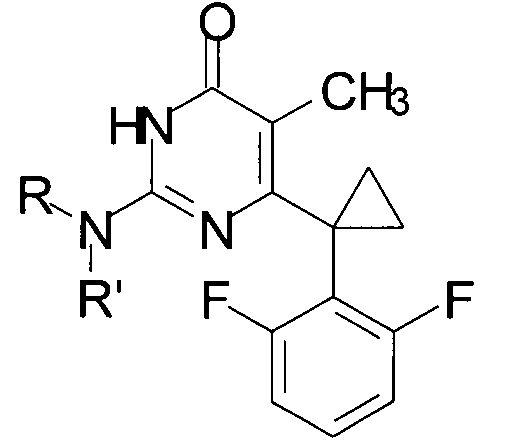
где R=Н, R'=с-С5Н9, 4-СН3ОС6Н4СН2, С6Н5(СН2)3, 1-AdCH2; R+R'=(СН2)5, (СН2СН2)2O,
путем кипячения производного 2-замещенного 6-алкил-5-метилпиримидин-4(3H)-она с соответствующим амином в среде 1-бутанола в качестве растворителя, при этом в качестве производного 2-замещенного 6-алкил-5-метилпиримидин-4(3H)-она используют 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3Н)-он или 2-метокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он, в качестве амина используют амин, выбранный из ряда циклопентиламин, 4-метоксибензиламин, 3-фенилпропан-1-амин, (адамантан-1-ил)метанамин, пиперидин или морфолин, взятых в мольных отношениях пиримидинон : амин = 1:5-19,3, а реакцию ведут при объемном соотношении 1-бутанола к амину равном 10:3-5.
Сущностью предлагаемого способа является реакция соответствующего 2-алкокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она с амином, приводящая к обмену алкокси-группы в положении 2 пиримидинового гетероцикла на остаток исходного амина, с образованием целевого вещества.
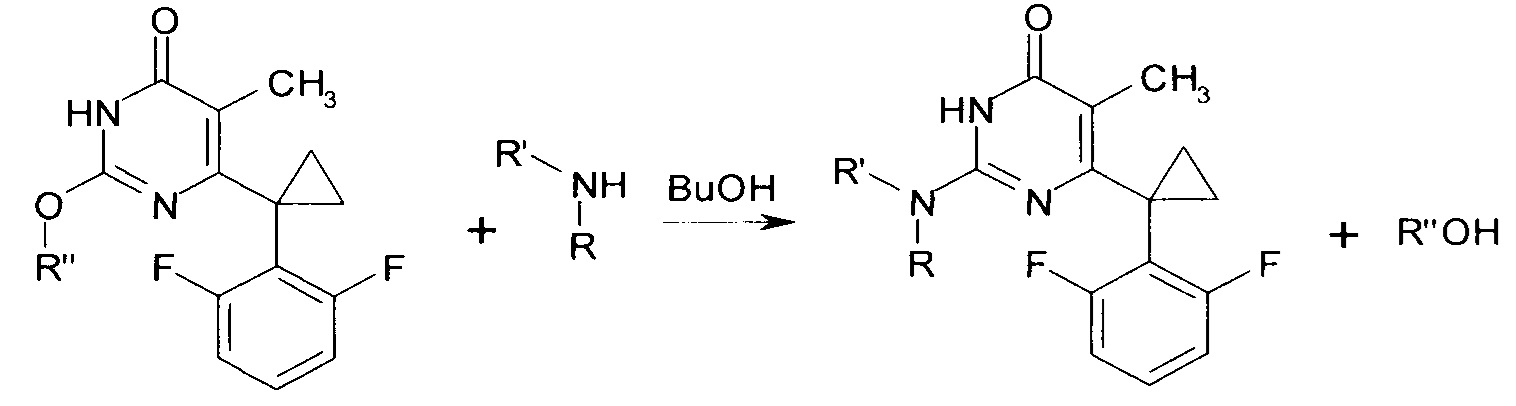
где R=Н, R'=с-С5Н9, 4-СН3ОС6Н4СН2, С6Н5(СН2)3, 1-AdCH2, R+R'=(СН2)5, (СН2СН2)2O, R''=СН3, С4Н9.
Исходный 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он получают в соответствии с известным методом [Исследование синтеза 3-оксоэфиров и функциональных производных пиримидин-4(3H)-она на основе 1-(2,6-дигалогенфенил)циклопропан-1-карбоновых кислот / И.А. Новаков, А.С. Яблоков, М.Б. Навроцкий, А.С. Мкртчян, А.А. Вернигора, А.С. Бабушкин, В.В. Качала, Е.А. Ручко // ЖОХ. - 2017. - Т. 87. - Вып. 2. - С. 247-254]. 6-[1-(2,6-Дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-он получен путем циклоконденсации этилового эфира 3-[1-(2,6-дифторфенил)циклоиропил]-2-метил-3-оксопропановой кислоты [Синтез и противовирусные свойства новых производных 2-(алкилсульфанил)-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она / И.А. Новаков, А.С. Яблоков, М.Б. Навроцкий, И.А. Кириллов, А.А. Вернигора, А.С. Бабушкин, В.В. Качала, Д. Шольц // ЖОрХ - 2016. - Т. 52. - №8. - С. 1195-1200] с сульфатом О-метилизомочевины в присутствии водно-спиртовой суспензии гидроксида кальция, в соответствии с методом, описанным ранее в литературе [6-Alkyl and 5,6-dialkyl-2-methoxy-4(3H)- pyrimidinones in the transformations of pyrimidines-2. Synthesis and conversion into alkyluracils and 2-alkoxy-4(3H)-pyrimidinones / M. Botta, M. Cawalieri, D. Ceci, F. De Angelis, G. Finizia, R. Nicoletti // Tetrahedron. - 1984. - Vol. 40, - Is.e 17. - P. 3313-3320].
В предлагаемом способе повышение выхода и чистоты целевых продуктов реакции достигается за счет гомофазного проведения процесса в относительно мягких условиях.
Необходимость применения избытка амина обусловливается тем, что последний выступает в качестве реагента и сорастворителя при проведении реакции, а кроме этого, снижение избытка амина приводит к существенному замедлению процесса. Применение 1-бутанола, как растворителя обусловлено необходимостью повышения диэлектрической проницаемости среды. При этом 1-бутанол, отогнанный по окончании реакции вместе с избытком амина, может быть использован после осушки и перегонки для проведения аналогичных синтезов.
Преимуществом предлагаемого способа является возможность получения широкого ряда производных N2-алкил- и N2,N2-диалкилизоцитозина, многие из которых представляют интерес как перспективные противовирусные средства [Synthesis and Biological Properties of Novel 2-Aminopyrimidin-4(3H)-ones Highly Potent against HIV-1 Mutant Strains / Mai A., Artico M., Rotili D., Tarantino D., Clotet-Codina I., 
 Ragno R., Simeoni S., Sbardella G., Nawrozkij M.B., Samuele A., Maga G.,
Ragno R., Simeoni S., Sbardella G., Nawrozkij M.B., Samuele A., Maga G.,  // J. Med. Chem. - 2007. - Vol. 50. - P. 5412-5424], в одну стадию в мягких условиях, приводя к желаемым продуктам с хорошим выходом, с использованием доступных и регенерируемых реагентов и растворителей, отсутствии необходимости в применении взрыво- и пожароопасных гидридов и амидов щелочных металлов, препаративной простоте синтеза и легкости выделения целевых продуктов реакции в чистом виде.
// J. Med. Chem. - 2007. - Vol. 50. - P. 5412-5424], в одну стадию в мягких условиях, приводя к желаемым продуктам с хорошим выходом, с использованием доступных и регенерируемых реагентов и растворителей, отсутствии необходимости в применении взрыво- и пожароопасных гидридов и амидов щелочных металлов, препаративной простоте синтеза и легкости выделения целевых продуктов реакции в чистом виде.
Предлагаемый способ осуществляется следующий образом.
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 2-алкокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он, безводный 1-бутанол и соответствующий амин. Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 1М водной соляной кислотой, водой, насыщенный водным раствором NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают продукт с содержанием основного вещества свыше 98% согласно данным ВЭЖХ-анализа (неподвижная фаза Reprosil С18 AQ (Dr. Maisch Gmbh) 150 мм ×4.6 мм, 3 мкм, подвижная фаза H2O/CH3CN/H3PO4=200/200/1 (об.), скорость потока элюента 0.8 мл/мин, длина волны детектора λ 220 нм, температура термостата колонки 30°С).
Изобретение иллюстрируется следующими примерами:
Пример 1. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(циклопентиламино)пиримидин-4(3H)-она из 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-она.
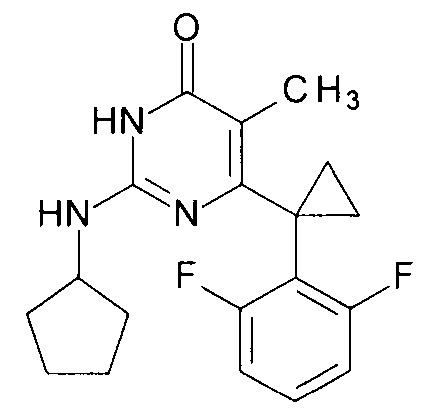
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и циклопентиламин (4 мл, 3.45 г, 0.04 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(циклопентиламино)пиримидин-4(3H)-он с т.пл. 202-204°С (CH3CN), что соответствует данным литературы [ЖОХ. - 2017. - Т. 87. - Вып. 2. - С. 247-254]. Выход - 1.03 г (87%).
Пример 2. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(циклопентиламино)пиримидин-4(3H)-она из 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она.
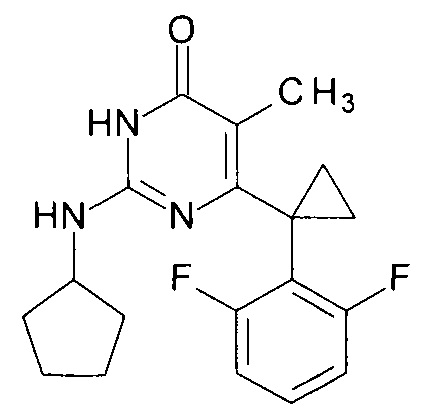
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и циклопентиламин (4 мл, 3.45 г, 0.04 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 6-[1-(2,6- дифторфенил)циклопропил]-5-метил-2-(циклопентиламино)пиримидин-4(3H)-он с т.пл. 202-204°С (CH3CN), что соответствует данным литературы [ЖОХ. - 2017. - Т. 87. - Вып. 2. - С. 247-254]. Выход - 0.90 г (87%).
Пример 3. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-2-[(4-метоксибензил)амино]-5-метилпиримидин-4(3H)-она из 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-она.
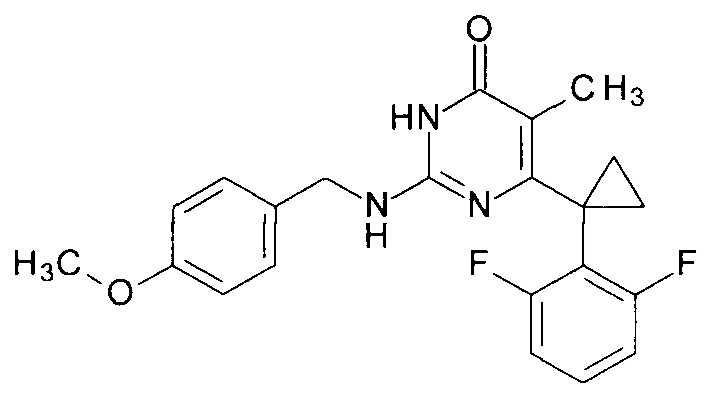
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и (4-метоксифенил)метанамин (3 мл, 3.15 г, 0.023 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 6-[1-(2,6-дифторфенил)циклопропил]-2-[(4-метоксифенил)метиламино]-5-метилпиримидин-4(3H)-он. tR=3.078 мин. Найдено, %: С 66.10; H 4.99; N 10.64. C22H21F2N3O2. Вычислено, %: С 66.49; Н 5.33; N 10.57. Rf=0.35 [EtOAc-С6Н14 (3:1)] (Polygram Sil G/UV254). Выход - 1.22 г (90%).
Пример 4. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-2-[(4-метоксибензил)амино]-5-метилпиримидин-4(3H)-она из 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она.
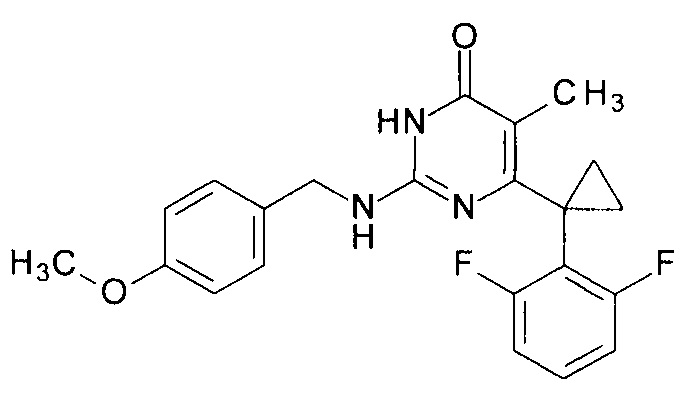
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и (4-метоксифенил)метанамин (3 мл, 3.15 г, 0.023 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 6-[1-(2,6-дифторфенил)циклопропил]-2-[(4-метоксифенил)метиламино]-5-метилпиримидин-4(3H)-он. tR=3.078 мин. Найдено, %: С 66.10; Н 4.99; N 10.64. C22H21F2N3O2. Вычислено, %: С 66.49; Н 5.33; N 10.57. Rf=0.35 [EtOAc - С6Н14 (3:1)] (Polygram Sil G/ UV254). Выход - 0.98 г (82%).
Пример 5. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-[(3-фенилпропил-1)амино]пиримидин-4(3H)-она из 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-она.
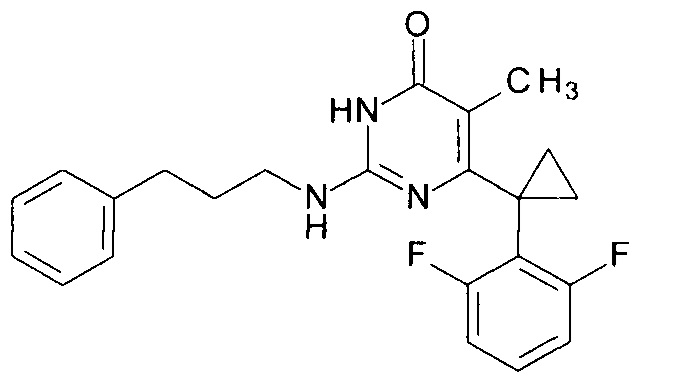
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и 3-фенилпропан-1-амин (3 мл, 4.572 г, 0.034 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-[(3-фенилпропил-1)амино]пиримидин-4(3H)-он. tR=3.41 мин. Найдено, %: С 70.00; Н 6.01; N 10.60. C23H23F2N3O. Вычислено, %: С 69.86; Н 5.86; N 10.63. Спектр ЯМР 1Н (300 МГц, ДМСО-d6), δ, м.д.: 1.35 м (2Н, 2СН2ах, с-Pr); 1.56 м (2Н, 2CH2eq, с-Pr); 1.80-1.85 м (5Н, С2Н2, СН3); 2.64 м (2Н, СН2); 3.29 м (2Н, СН2); 7.04-7.24 м (7Н, С6Н5, С3,5Н (2,6-F2C6H3)); 7.35-7.37 м (1Н, С4Н (2,6-F2C6H3)); 9.51 уш. с. (1Н, N2H); 11.77 уш. с. (1Н, N3H). Т. пл. 199.5-200.5°С с разл. (С6Н14-EtOAc). Rf=0.38 [EtOAc-С6Н14 (4:1)] (Polygram Sil G/UV254). Выход - 1.19 г (88%).
Пример 6. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-[(3-фенилпропил-1)амино]пиримидин-4(3H)-она из 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она.
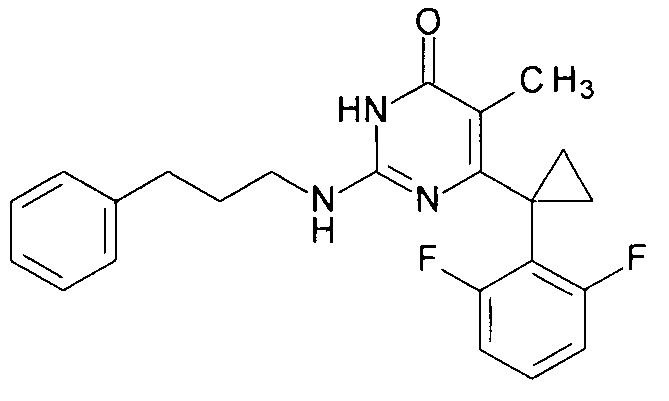
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и (3-фенилпропан-1-ил)амин (3 мл, 4.572 г, 0.034 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-[(3-фенилпропил-1)амино]пиримидин-4(3H)-он. Т. пл. 199.5-200.5°С с разл. (С6Н14-EtOAc). Выход - 0.94 г (79%).
Пример 7. Синтез 2-{[(адамантан-1-ил)метил]амино}-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она из 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-она.
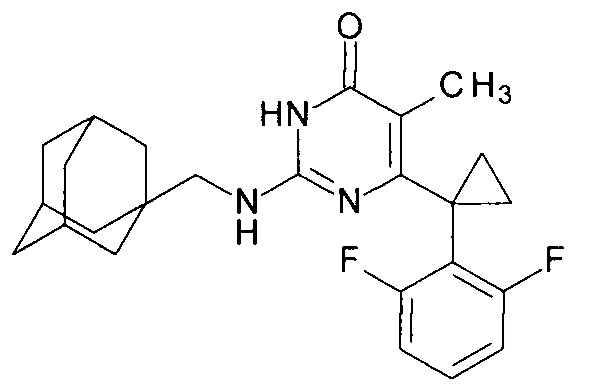
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и (адамантан-1-ил)метанамин (3 мл, 2.8 г, 0.017 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 2-{[(адамантан-1-ил)метил]амино}-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он. tR=5.95 мин. Найдено, %: С 70.71; Н 7.00; N 10.01. C25H29F2N3O. Вычислено, %: С 70.57; Н 6.87; N 9.88. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.09 м (2Н, 2СН2ах, с-Pr); 1.38 м (6Н, 3СН2, С2,8,9 (Ad)); 1.50-1.55 м (9Н, 3СН2, СН3, С4,6,10 (Ad)); 1.87 м (3Н, 3СН, С3,5,7 (Ad)); 2.95 м (2Н, CH2NH); 6.04 уш. с. (1Н, N2H); 6.95 м (2Н, С3,5Н (2,6-F2C6H3)); 7.27 м (1Н, С4Н (2,6-F2C6H3)); 10.36 уш. с. (1Н, N3H). Т. разл.>282.5°С (С2Н5ОН). Rf=0.41 [EtOAc-С6Н14 (4:1)] (Polygram Sil G/UV254). Выход - 1.37 г (94%).
Пример 8. Синтез 2-{[(адамантан-1-ил)метил]амино}-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она из 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она.
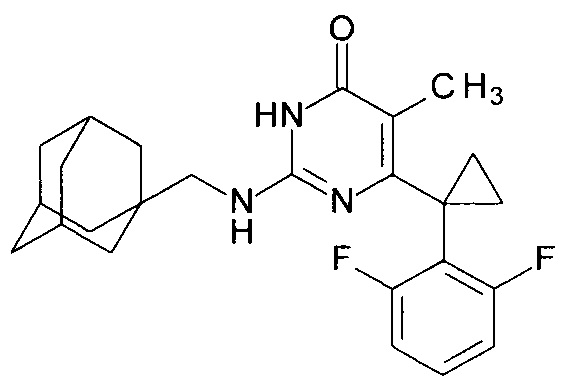
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и (адамантан-1-ил)метанамин (3 мл, 2.8 г, 0.017 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 2-{[(адамантан-1-ил)метил]амино}-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он. Т. разл.>282.5°С (С2Н5ОН). Выход - 1.15 г (90%).
Пример 9. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(морфолин-4-ил)пиримидин-4(3H)-она из 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-она.
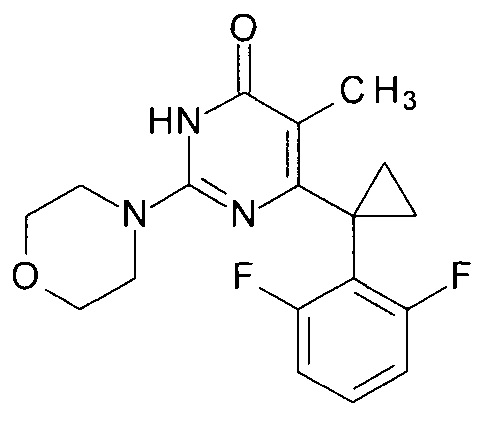
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и морфолин (5 мл, 5.05 г, 0.058 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(морфолин-4-ил)пиримидин-4(3H)-он. tR=3.75 мин. Найдено, %: С 61.98; Н 5.30; N 11.95. C18H19F2N3O2. Вычислено, %: С 62.24; Н 5.51; N 12.10. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.12 м (2Н, 2СН2ах, с-Pr); 1.52 м (2Н, 2CH2eq, с-Pr); 1.61 м (3Н, СН3); 3.46 м (4Н, 2СН2, С3,5 (морфолин)); 3.56 м (2Н, СН2, С2,6 (морфолин)); 6.70 м (2Н, С3,5Н (2,6-F2C6H3)); 7.28 м (1Н, С4Н (2,6-F2C6H3)); 11.15 уш. с. (1Н, N3H). Т. пл. 190-190.5°С (CH3CN). Rf=0.28 [EtOAc-C6H14 (3:1)] (Polygram Sil G/UV254). Выход - 1.12 г (94%).
Пример 10. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(морфолин-4-ил)пиримидин-4(3H)-она из 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она.
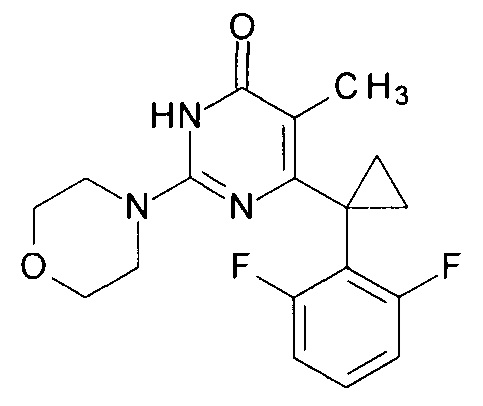
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и морфолин (5 мл, 5.05 г, 0.058 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(морфолин-4-ил)пиримидин-4(3H)-он. Т. пл. 190-190.5°С (CH3CN). Выход - 0.96 г (92%).
Пример 11. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(пиперидин-1-ил)пиримидин-4(3H)-она из 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-она.
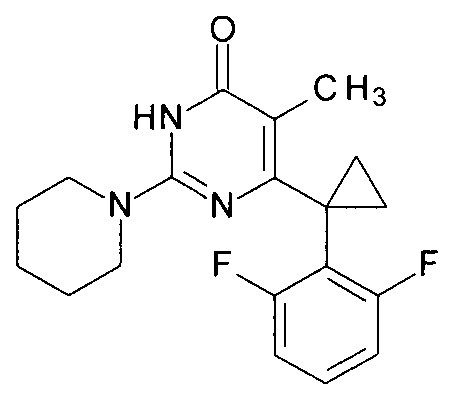
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-метоксипиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и пиперидин (5 мл, 4.31 г, 0.051 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ. Фильтрат упаривают в вакууме, в остатке получают 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(пиперидин-1-ил)пиримидин-4(3H)-он. tR=3.65 мин. Найдено, %: С 65.81; Н 5.98; N 11.70. C19H21F2N3O. Вычислено, %: С 66.07; Н 6.13; N 12.17. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.11 м (2Н, 2СН2ах, с-Pr); 1.43-1.51 м (8Н, 3СН2 (С3,4,5 (пиперидин), 2CH2eq (с-Pr)); 1.59 м (3Н, СН3); 3.47 м (4Н, 2СН2, С2,6 (пиперидин)); 6.94-6.99 м (2Н, С3,5Н (2,6-F2C6H3)); 7.26-7.31 м (1Н, С4Н (2,6-F2C6H3)); 11.00 с (1H, N3H). Т. пл. 164.5-165.5°С (С6Н14). Rf=0.48 [EtOAc-С6Н14 (3:1)] (Polygram Sil G/ UV254). Выход - 0.99 г (84%).
Пример 12. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(пиперидин-1-ил)пиримидин-4(3H)-она из 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она.
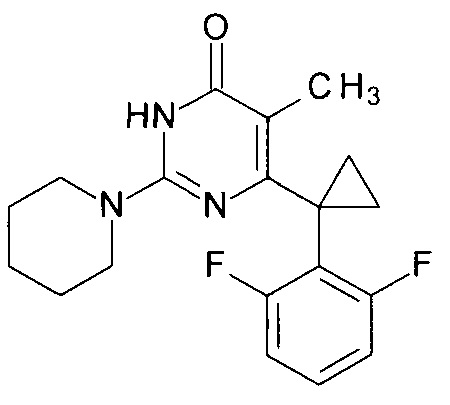
В круглодонную колбу, снабженную магнитной мешалкой и обратным холодильником, закрытым щелочной трубкой, помещают исходный 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-он (1 г, 0.003 моль), безводный 1-бутанол (10 мл) и пиперидин (5 мл, 4.31 г, 0.051 моль). Полученную смесь доводят до кипения при перемешивании и кипятят образовавшийся раствор до тех пор, пока ВЭЖХ-анализ взятой аликвоты не покажет практически полной конверсии исходного производного пиримидина. После этого, растворитель отгоняют в вакууме, а к остатку добавляют последовательно 3 порции ксилола по 50 мл, каждую из которых также отгоняют при пониженном давлении. Оставшийся в кубе технический продукт реакции растворяют в этилацетате, промывают полученный раствор 25 мл 1М водной соляной кислоты, 2×25 мл воды, 2×20 мл насыщенного водного раствора NaCl и сушат безводным MgSO4. Осушитель отделяют фильтрованием через слой силикагеля для ТСХ.