Результат интеллектуальной деятельности: Липидное производное сарколизина в составе фосфолипидных наночастиц
Вид РИД
Изобретение
В мире ежегодно фиксируется 12 миллионов новых случаев онкологических заболеваний (международная некоммерческая организация «Всемирный фонд исследований рака»). По данным ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН за последние 10 лет число онкологических больных в России увеличилось в полтора раза.
Наряду с хирургическими и лучевыми методами лечения широко применяется химиотерапия злокачественных опухолей, которая получила научное обоснование в 40-х гг. XX в. В ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН были синтезированы первый отечественный препарат сарколизин и его пептидное производное - цифелин. Но терапевтический эффект сарколизина сопряжен с рядом побочных действий.
Сохранение и продление жизни многих онкологических больных прямо зависит от применения инновационных лекарственных форм (ЛФ). Одно из наиболее интересных и быстро развивающихся направлений современных исследований в области медицины и фармации - применение в качестве транспортеров для доставки лекарственных веществ (ЛВ) к патологически измененным клеткам различных наночастиц, в частности липидной природы.
В отличие от регулярной, упорядоченной васкуляризации нормальных тканей сосуды опухолей представляют собой аномальные, деформированные капилляры с проницаемыми стенками и замедленным кровотоком. Так, благодаря эффекту повышенной проницаемости капилляров и удерживания ЛВ в тканях организма с нарушенным лимфатическим дренажом, липосомы накапливаются в опухоли, способствуя повышению терапевтического эффекта лекарственных препаратов.
В связи с вышеизложенным актуальной является разработка новых ЛФ известных противоопухолевых лекарственных веществ на основе известных противоопухолевых препаратов.
Гемобластозы - опухолевые (неопластические) заболевания кроветворной и лимфатической ткани - входят в пятерку самых распространенных злокачественных опухолей. Из них наибольшее внимание уделяется миеломной болезни. Это заболевание, называемое также множественной миеломой (multiple myelome) [1].
Для лечения множественной миеломной болезни используются различные схемы химиотерапии, в том числе с применением новых препаратов. Однако, как правило, неотъемлемым ее компонентом является сарколизин или его стерический L-изомер (энантиомер) мелфалан. Это лекарственное средство было первым, внедренным в 60-е годы прошлого века препаратом для специфической терапии миеломы, но до сих пор широко используется как в монотерапии, так и в комбинации с другими лекарственными препаратами (например, с преднизолоном).
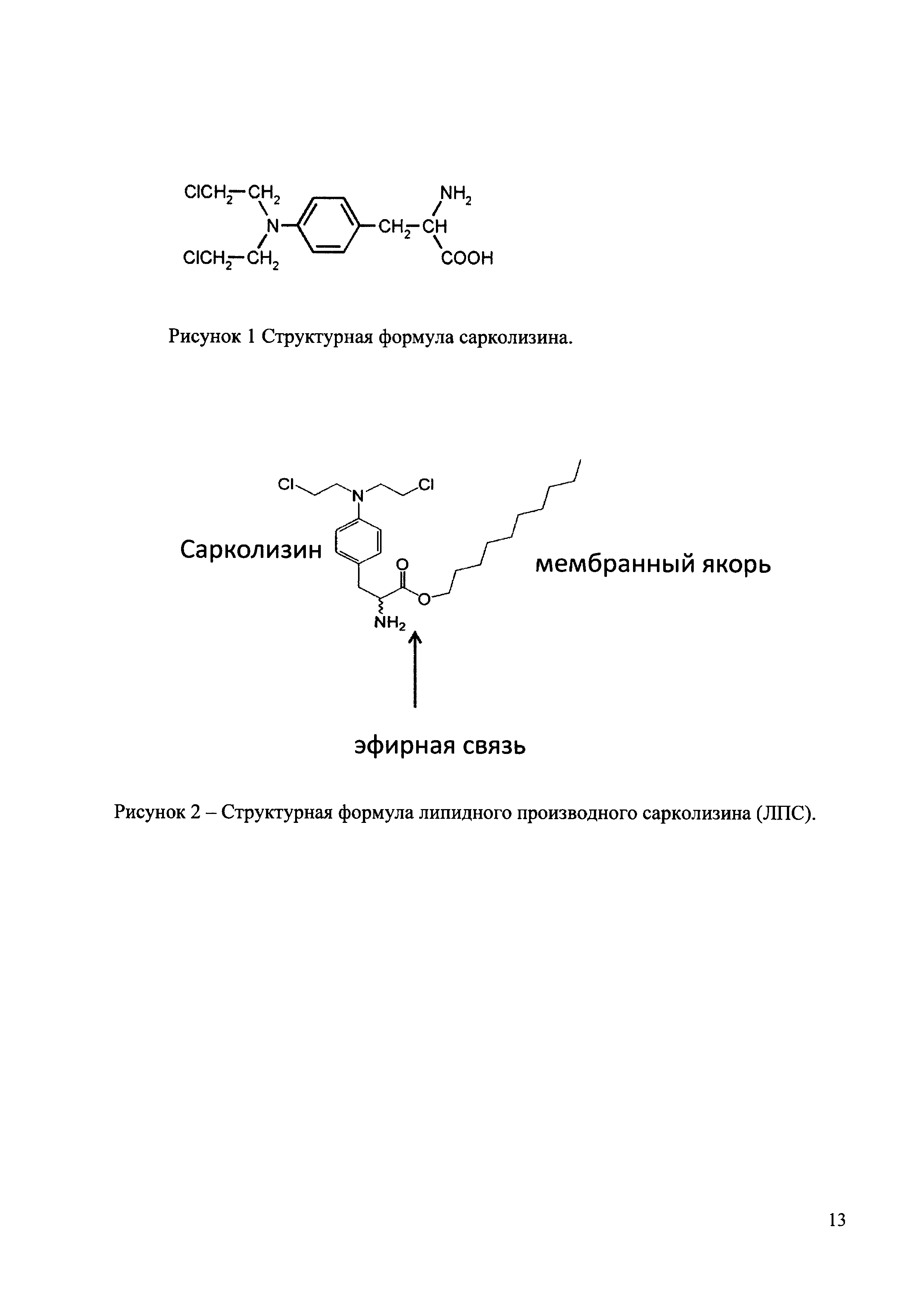
Сарколизин (мелфалан) относится к алкилирующим соединениям группы хлорэтиламинов и представляет собой производное фенилаланина и ди(2-хлорэтил)амина (рис. 1). Его синтез был осуществлен в Великобритании [2], затем в России [3].
За счет того, что сарколизин обладает алкилирующими свойствами, он способен приводить к нарушению стабильности ДНК [4]. Так как аминокислоты обладают более высокой способностью проникать в опухолевые клетки, чем в нормальные, наличие фенилаланинового остатка в сарколизине создает условия для его избирательного накопления в ткани опухоли [3]. Сарколизин и продукты его биотрансформации включаются в метаболизм опухолевых клеток как структурные аналоги нормальных метаболитов фенилаланина. В опухолевой клетке сарколизин и его метаболиты активно влияют на процессы, связанные с нуклеиновыми кислотами. Механизм действия сарколизина связан либо с его прямым воздействием на ДНК за счет присоединения алкильной группы к гуаниновым основаниям с последующим нарушением процессов ее репликации, либо опосредованно через образование дефектных форм ДНК и РНК, останавливает белковый синтез, нарушает работу ферментных систем [4].
Помимо миеломной болезни и других онкологических заболеваний крови сарколизин используется при лечении ряда других опухолей - в офтальмологии при лечении ретинобластомы [5], как компонент в терапии метастазов печени [6] и легких, опухоли яичка, при лимфоэпителиальной опухоли, лимфоме Ходжкина [7].
Среди побочных эффектов сарколизина отмечают гематотоксичность, гепатотоксичность, аллопецию, аллергические реакции [7], а также кардиотоксичность [8]. Основным токсическим проявлением препарата является угнетение костномозгового кроветворения, миелопоэза, которое обеспечивает образование всех форменных элементов крови, кроме лимфоцитов, - гранулоцитов, тромбоцитов, эритроцитов. На фоне терапии сарколизином у пациентов могут развиваться лейкопения, тромбоцитопения и анемия. Нарушения выявляются и со стороны защитных реакций организма, его иммунологических механизмов: уменьшается содержание лимфоцитов, обнаруживаются морфологические изменения макрофагов. Показано, что сарколизин угнетает индуктивную фазу первичного иммунного ответа [9]. Существенным недостатком его является также его выраженная гемолитическая активность.
Несмотря на успешное применение в клинике, использование сарколизина ограничено высокой токсичностью, низкой стабильностью при хранении (чувствительность к температуре, свету и влаге), низкой растворимостью, а также гидролитической нестабильностью в организме. В водной среде он постепенно гидролизуется, с замещением остатков Cl на гидроксильные группы, что приводит к снижению алкилирующих свойств. К недостатком сарколизина относят также его быстрый почечный клиренс. В связи с этим предпринимаются поиски новых схем лечения (комбинированная терапия) и лекарственных форм для преодоления этих недостатков.
Разработанная новая лекарственная композиция липидного производного сарколизина в составе фосфолипидных наночастиц, являющаяся предметом настоящего изобретения, характеризуется менее выраженными проявлениями нежелательных побочных явлений препарата.
Состав лекарственной композиции:
|
Новая лекарственная форма сарколизина представляет собой композицию, в которой синтезированное пролекарство - липидное производное сарколизина (ЛПС) - включено в фосфолипидные наночастицы.
Получение «пролекарства» сарколизина путем присоединения к его молекуле дополнительного «защитного» фрагмента изменяет в нужную сторону его свойства: гидролитическую стабильность в организме, растворимость и стабильность при хранении.
При этом фрагмент отделяется при поступлении в опухолевую клетку, высвобождая лекарство и возвращая его к исходному активному состоянию. Помимо этого, включение в наночастицы не самого сарколизина, а предварительно полученного его пролекарства повышает способность препарата включаться в наночастицы (например, в липосомы).
Молекула синтезированного ЛПС состоит из биологически активной части - сарколизина и углеводородного «хвоста» (на рисунке - мембранный якорь), который обеспечивает включение ЛПС в фосфолипидную матрицу. На рис. 2 представлена структурная формула ЛПС.
Приведенный ниже пример демонстрирует способ получения липидного производного сарколизина.
Пример 1. Получение липидного производного сарколизина.
В двугорлую круглодонную колбу объемом 100 мл, оснащенную форштоссом, обратным шариковым холодильником, магнитной мешалкой и водяной баней, помещали 4 г (13,1 ммоль) мелфалана и 100 мл (524 ммоль) деканола (чда, предварительно высушенного над молекулярными ситами 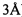 ). Смесь трижды вакуумировали под вакуумом масляного насоса (~0,3 мбар) и колбу заполняли сухим аргоном. Затем реакционную смесь при интенсивном перемешивании охлаждали с помощью ледяной бани до ~0°С и добавляли 4 мл (55,1 ммоль) хлористого тионила (SOCl2). Полученную суспензию перемешивали при охлаждении в течение 15 минут, после чего температуру бани постепенно поднимали до 75°С; перемешивание продолжали в течение 3-х часов, до полного растворения осадка. Протекание реакции контролировали с помощью ТСХ (пластинки Kieselgel 60 F254, Merck) в системе метанол : дихлорметан - 10:90 (Rf продукта ~ 0,7; исходного вещества ~ 0,05). После окончания реакции реакционную смесь охлаждали и заливали холодным гексаном (1 л, ~ -20°С). Полученную суспензию выдерживали сутки при -20°С и декантировали. Полученный осадок отфильтровывали, промывали холодным гексаном (10×200 мл) и высушивали в эксикаторе над P2O5.
). Смесь трижды вакуумировали под вакуумом масляного насоса (~0,3 мбар) и колбу заполняли сухим аргоном. Затем реакционную смесь при интенсивном перемешивании охлаждали с помощью ледяной бани до ~0°С и добавляли 4 мл (55,1 ммоль) хлористого тионила (SOCl2). Полученную суспензию перемешивали при охлаждении в течение 15 минут, после чего температуру бани постепенно поднимали до 75°С; перемешивание продолжали в течение 3-х часов, до полного растворения осадка. Протекание реакции контролировали с помощью ТСХ (пластинки Kieselgel 60 F254, Merck) в системе метанол : дихлорметан - 10:90 (Rf продукта ~ 0,7; исходного вещества ~ 0,05). После окончания реакции реакционную смесь охлаждали и заливали холодным гексаном (1 л, ~ -20°С). Полученную суспензию выдерживали сутки при -20°С и декантировали. Полученный осадок отфильтровывали, промывали холодным гексаном (10×200 мл) и высушивали в эксикаторе над P2O5.
Получали 3,2 г (55%, 7,2 ммоль) белого кристаллического вещества.
Пример 2. Включение липидного производного сарколизина в фосфолипидные наночастицы.
Для включения липидного производного сарколизина в фосфолипидные наночастицы был выбран метод гомогенизации под высоким давлением с помощью микрофлюидайзера М110ЕН30K (Microfluidics, США). В целях оптимизации процесса было проведено изучение влияния основных технологических параметров - давления, температуры, количества циклов гомогенизации - на физические свойства получаемых эмульсий.
В растворе 100 г мальтозы (280 ммоль) в 80 мл воды диспергировали 3 г (3,9 ммоль) фосфолипида Lipoid S100, затем добавляли 0,3 г (0,67 ммоль) конъюгата сарколизина и деканола. Доводили водой объем до 120 мл и перемешивали. Полученную грубую эмульсию нагревали на водяной бане до температуры 45°С и подвергали гомогенизации на микрофлюидайзере под давлением 1000 атм; количество циклов гомогенизации 5, т.е. количество полных прохождений всего объема через систему камер микрофлюидайзера для получения тонкой эмульсии. Эффективность процесса гомогенизации оценивали по величине светопропускания при длине волны 660 нм и среднему диаметру частиц получаемых эмульсий. Оптимальными считали такие условия, при которых полученная эмульсия характеризовалась высоким светопропусканием (не менее 60%) и наименьшим размером частиц при минимальных энергозатратах.
Также было подобрано оптимальное соотношение компонентов лекарственной композиции на основе липидного производного сарколизина, включенного в фосфолипидные наночастицы.
Ранее экспериментальные исследования показали, что только 10% (вес.) растительных фосфолипидов образуют фосфолипидные наночастицы с включенной в них лекарственной субстанцией.
Были проведены эксперименты с различным весовым соотношением липидного производного сарколизина (ЛПС) и растительных фосфолипидов (таблица 1).
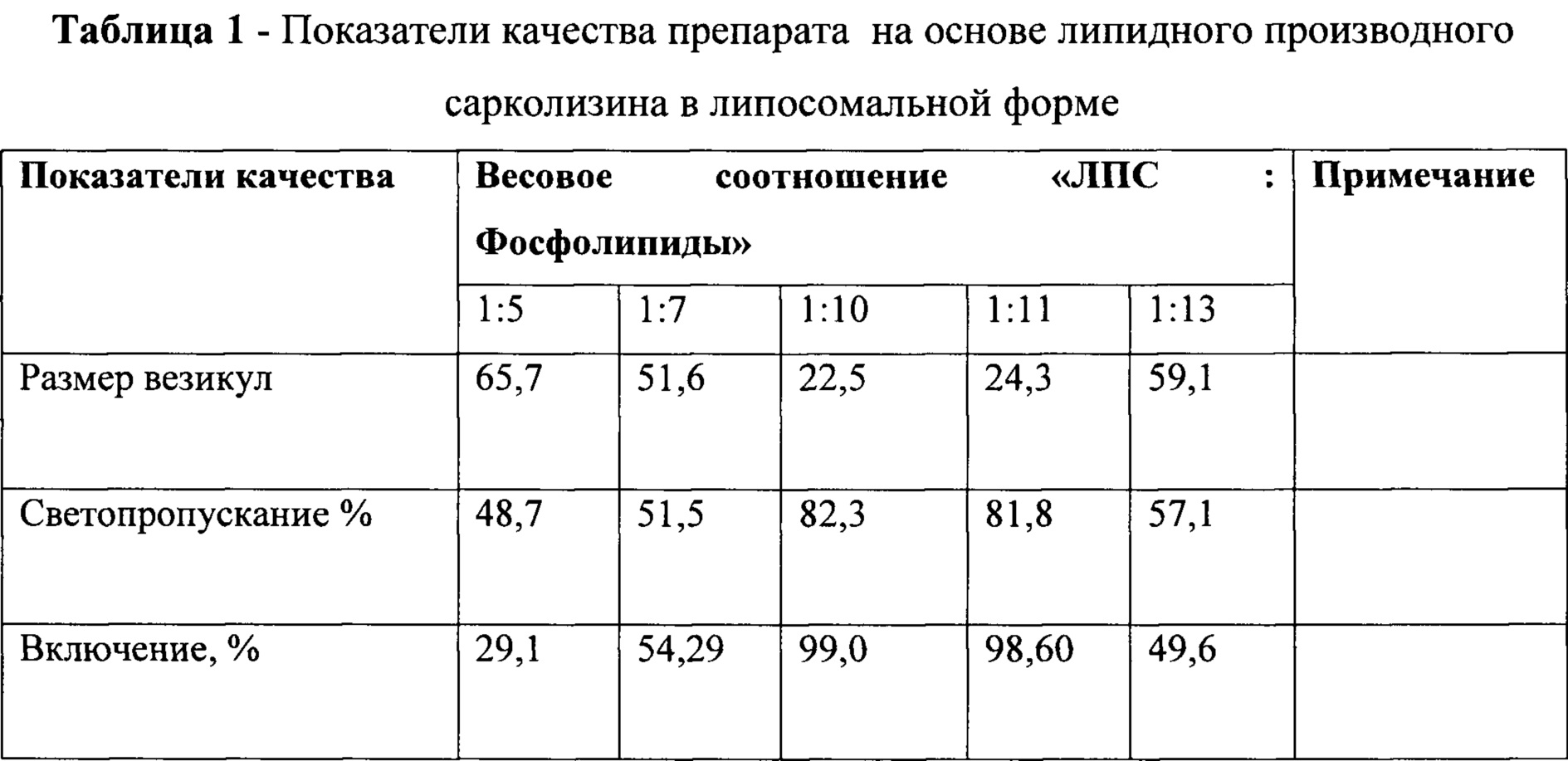
Полученные экспериментальные данные показали, что оптимальным соотношением липидного производного сарколизина и фосфолипидов является соотношение 1:10 и 1:11.
В дальнейшем для стабилизации свежеприготовленной наноэмульсии производного сарколизина был использован криопротектор. В качестве криопротектора была выбрана мальтоза. Проведенные исследования по выбору концентрации криопротектора представлены в таблице 2.

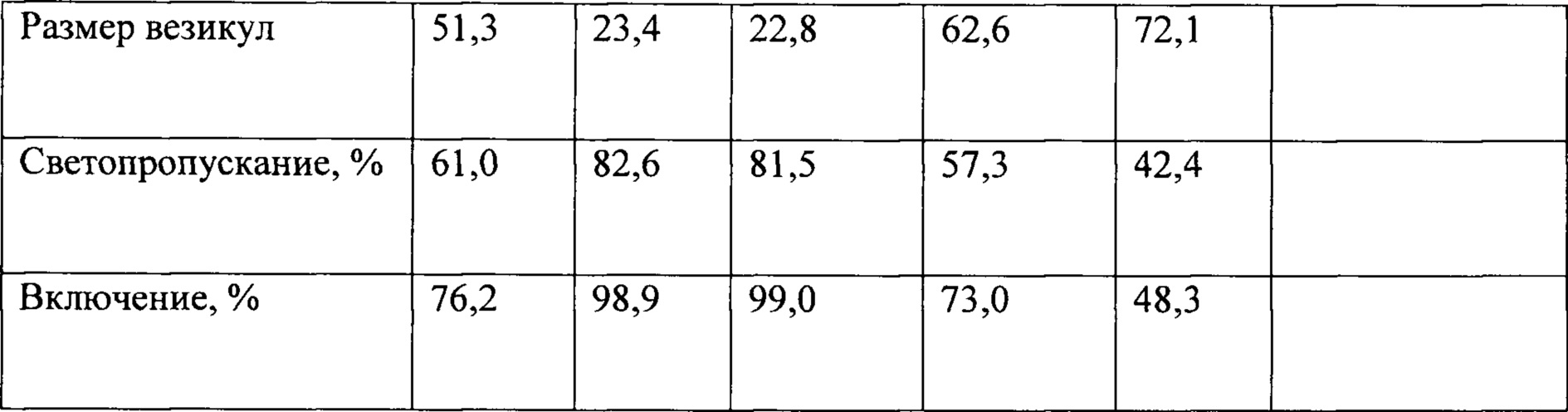
При весовом соотношении суммарный липид : мальтоза = 1:3 и 1:4 были получены оптимальные данные по размеру везикул, светопропусканию и проценту включения липидного производного сарколизина в фосфолипидные наночастицы.
Изучение физико-химических свойств композиции в сухом виде подтвердило ее высокую стабильность при хранении в течение 5-ти лет при комнатной температуре в защищенном от света месте и хорошую растворимость в воде. Гидролиза в водной среде и замещения остатка CI на гидроксильную группу в течение 2-х суток не наблюдалось.
Для проверки агрегационной устойчивости эмульсию ЛС хранили при комнатной температуре в течение 2-х суток и через каждые 12 ч определяли распределение частиц по размерам и светопропускание. Эмульсию ФС разливали по 10 мл во флаконы на 25 мл и закрывали их резиновыми пробками. Для анализа отбирали по 3 флакона.
В таблице 3 приведены средние значения диаметра частиц, индекса полидисперсности и светопропускания по результатам измерения в трех образцах за различные промежутки времени с момента начала их хранения
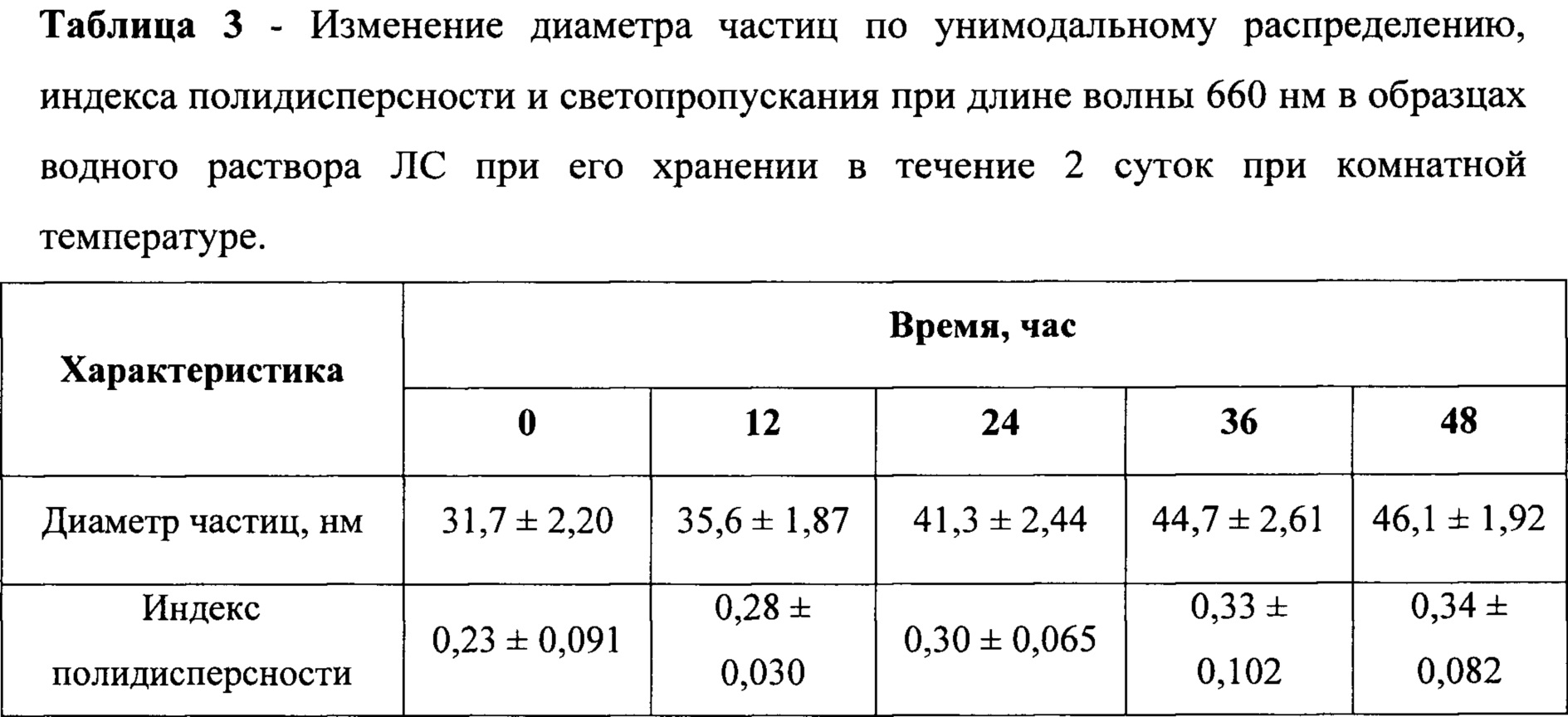
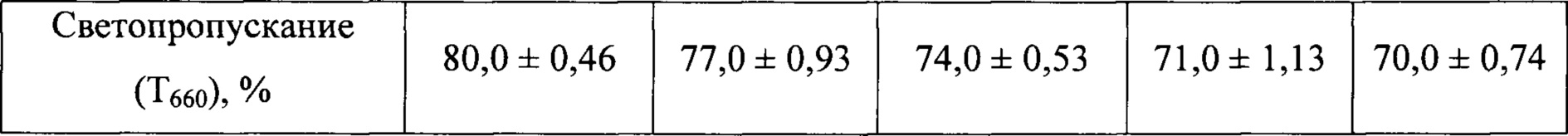
Данные таблицы 3 показывают, что динамика значений среднего диаметра частиц, индекса полидисперсности и светопропускания за весь исследуемый период не выходит за допустимые пределы, обозначенные в нормативно-технической документации. Средний диаметр частиц не превышает 50 нм. Индекс полидисперсности увеличивается незначительно, что свидетельствует о низкой скорости процессов агрегации. Светопропускание остается на приемлемом уровне (выше 60%). Таким образом, ЛС сохраняет агрегационную устойчивость в водном растворе как минимум в течение 2-х суток.
Дальнейшие исследования также показали, что эфирная связь в пролекарстве ЛПС, введенном в плазму как в свободном виде, так и в составе фосфолипидных наночастиц не гидролизуется. Об этом свидетельствует тот факт, что независимо от времени инкубации в образцах не детектируется сарколизин. В тоже время при добавлении ЛПС и Сарколизина НФ в кровь в инкубационной среде обнаруживается сарколизин с параллельным снижением содержания ЛПС. Таким образом, отсутствие гидролиза ЛПС в плазме свидетельствует о том, что гидролиз эфирной связи, объединяющей биологически активную часть молекулы ЛПС и «мембранный якорь», происходит не в плазме, а клетках форменных элементов крови. Таким образом, биологически активным компонентом является собственно сарколизин. Следовательно, механизм действия Сакролизина НФ обусловлен входящим в его состав сарколизином.
В условиях эксперимента на клетках мышиной лимфомы L5178Y показано, исследуемый препарат Сарколизин НФ вызывает повреждения ДНК для всех исследованных концентраций Сарколизина НФ (по сарколизину). При этом Сарколизин-НФ в условиях 1-й 3-часовой экспозиции индуцирует образование Fpg-специфичных сайтов (предположительно N7-гуанина) в ДНК клеток костного мозга мышей in vitro, которое обнаруживается с помощью модифицированной FLARE версии метода ДНК-комет.
Результаты изучения острой токсичности препарата Сарколизин НФ, лиофилизат для приготовления раствора для внутривенного введения на животных выявили наличие видового различия в чувствительности к препарату, но отсутствие различий по полу в проявлениях токсического действия. Средние значения ЛД50 препарата Сарколизин НФ, лиофилизат для приготовления раствора для внутривенного введения для мышей (22,25 мг/кг) и крыс (12,9 мг/кг) превышали разовую терапевтическую для человека дозу при внутривенном введении (0,7 мг/кг) более чем в 32 раза и 18,5 раз, соответственно, что позволило отнести препарат к III классу умеренно токсичных лекарственных веществ.
Значение ЛД50 препарата Сарколизин НФ, лиофилизат для приготовления раствора для внутривенного введения для кроликов (5,5 мг/кг) превышали разовую терапевтическую для человека дозу при внутривенном введении (0,7 мг/кг) почти в 8 раз.
Результаты исследования на кроликах при однократном введении максимальной субтоксической дозы 4,5 мг/кг (в 2 раза больше ТД для кроликов и почти в 7 раз превышающей максимальную терапевтическую дозу для человека) показали, что препарат Сарколизин НФ, лиофилизат для приготовления раствора для внутривенного введения («ИБМХ», Россия) не вызывает гибели животных. Токсическое действие проявлялось так же, как и у мышей - в снижении массы тела. В крови снижалось количество лейкоцитов, в сыворотке крови снижалось содержание белка и альбумина.
Результаты исследования хронической токсичности препарата Сарколизин НФ, лиофилизат для приготовления раствора для внутривенного введения на белых аутбредных крысах и кроликах показали, что многократное внутривенное введение в терапевтической дозе 0,7 мг/кг не вызывало значительных нарушений функционального состояния основных органов и систем организма.
Не было выявлено местного раздражающего действия при многократном внутривенном введении препарата Сарколизин НФ, лиофилизат для приготовления раствора для внутривенного введения («ИБМХ», Россия).
При многократном применении препарата в превышающих терапевтическую дозах в 2,2 и 3,5 раза (1/5ЛД50) отмечались признаки токсического действия.
ЛИТЕРАТУРА
1. А.А. Яковлев А.А., М.В. Яковлева. Клинические особенности периферической нейропатии при парапротеинемическом гемобластозе. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014, №10, с. 5-8.
2. F. Bergel F., J.A. Stock. Cytotoxic alpha amino acids and endopeptidase Br. Emp. Cancer Comp Annu. 1953, vol. 31, p. 6-21.
3. Л.Ф. Ларионов, A.C. Хохлов, E.H. Шкодинская и др. О противоопухолевой активности n-ди(2-хлорэтил)аминофенил-аланина(сарколизина). Бюл. эксп. биол. мед. 1955, №1, с. 48-52.
4. С. Gourzones-Dmitriev, A. Kassambara, S. Sahota, et al. DNA repair pathways in human multiple myeloma: role in oncogenesis and potential targets for treatment. Cell Cycle. 2013, vol. 12(17), p. 2760-2773.
5. Intravitreal injection of melphalan for intraocular retinoblastoma. S. Suzuki, Y. Aihara, M. Fujiwara et al. Jpn J Ophthalmol. 2015, vol. 59(3), p. 164-172.
6. T.J. Vogl, S. Zangos, J.E. Scholtz et al. Chemosaturation with percutaneous hepatic perfusions of melphalan for hepatic metastases: experience from two European centers. Rofo. - 2014, vol. 186(10), p. 937-944.
7. В.П. Краснов, M.А. Королева, E.Л. Водовозова. Опыт и перспективы создания наноразмерных систем доставки сарколизина и мелфалана. Успехи химии. 2013. №82(8), с. 783-814.
8. P. Menna, Е. Salvatorelli, G. Minotti. Cardiotoxicity of antitumor drugs. Chem. Res. Toxicol. 2008, vol. 21(5), p. 978-989.
9. A.L. Garfall, D.T. Vogl, B.M. Weiss, E.A. Stadtmauer Cellular immunotherapy for plasma cell myeloma. Bone Marrow Transplant. 2013, vol. 48(11), p. 1377-1386.