Результат интеллектуальной деятельности: ЭКСПРЕССИОННЫЕ ВЕКТОРЫ ДЛЯ УЛУЧШЕННОЙ СЕКРЕЦИИ БЕЛКА
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, в частности микробного синтеза белков. В особенности изобретение касается экспрессионных векторов для синтеза белков, а также предлагает клетки-хозяева, которые содержат такие экспрессионные векторы. Далее, изобретение касается способа и применения таких экспрессионных векторов и клеток-хозяев для получения белков.
Для синтеза белков можно применять клетки-хозяева, в особенности микроорганизмы, которые экспрессируют гены белков, представляющих интерес. Ген белка, представляющего интерес (трансген), как правило, вводят в клетку-хозяин таким образом, чтобы в ней происходила его экспрессия. Нередко он находится на так называемом экспрессионном векторе вместе с одной или несколькими промоторными последовательностями (промоторами), что дает возможность экспрессии генов.
Для биотехнологичекого производства в промышленных масштабах нужные клетки-хозяева культивируют в ферментерах (биохимических реакторах), которые оборудованы соответственно показателям метаболизма клеток. Во время культивации клетки-хозяева метаболизируют предложенный субстрат и образуют желательный продукт, который по окончании ферментации обычно отделяют от производящих организмов и выделяют путем очистки из кашицы (массы) ферментера и/или из среды ферментации и/или повышают его концентрацию в них.
В принципе желательно получать максимально возможный выход продукта при ферментации. При этом выход продукта зависит от многих факторов, например, помимо собственно желательного продукта клетки-хозяева обычно вырабатывают множество других веществ, которые, как правило, не представляют никакого интереса. Кроме того, экспрессия трансгена и, следовательно, выход продукта существенно зависит от применяемой системы экспрессии. Например, в международной заявке на патент WO 91/02792 раскрыта улучшенная ферментативная продукция щелочной протеазы из Bacillus lentus в оптимизированном штамме Bacillus licheniformis под контролем генно-регуляторных последовательностей из Bacillus licheniformis, в особенности промотора Bacillus licheniformis.
Для промышленного производства белков, например, гидролитических ферментов, предпочтительно применяют такие клетки-хозяева, которые в состоянии выделять в супернатант культуры большие количества белка, что делает лишним трудоемкое вскрытие клеток, которое необходимо при внутриклеточной продукции. Для этого целесообразно применять такие клетки-хозяева, например, виды Bacillus, которые можно культивировать на недорогих питательных средах с эффективной ферментацией при высокой плотности клеток, и которые в состоянии выделять в супернатант культуры несколько грамм целевого белка на литр. Экспрессию подлежащего выделению белка обычно осуществляют экспрессионные векторы, которые введены в клетку-хозяин и кодируют подлежащий выделению белок. В состав выделенного белка обычно входит сигнальный пептид (сигнальная последовательность), вызывающая его экспорт из клетки-хозяина. Сигнальный пептид обычно представляет собой часть транслированной (прошедшей трансляцию) в клетке-хозяине полипептидной цепи, но после трансляции его можно отщепить от белка еще внутри клетки-хозяина или вне ее.
Именно в связи с этой внеклеточной продукцией гетерологических белков имеется, однако, множество узких мест и, соответственно, высокая потребность в оптимизации процессов секреции. Один из этих факторов, тормозящих производственный процесс - это выбор сигнального пептида, позволяющего продуктивно экспортировать целевой белок из клетки-хозяина. В принципе, сигнальные пептиды можно вновь комбинировать с белками, в особенности ферментами. Например, в публикации Brockmeier et al. (J. Mol. Biol. 362, S. 393-402 (2006)) описана стратегия скрининга библиотеки сигнальных пептидов на примере кутиназы. Однако, не каждый сигнальный пептид вызывает также достаточный экспорт белка в условиях ферментации, в особенности промышленной ферментации либо же широкомасштабной технической ферментации.
Поэтому задача изобретения состоит в том, чтобы улучшить секрецию белка из клетки-хозяина и в силу этого повысить выход белка-продукта при ферментации.
Объектом изобретения является экспрессионный вектор, содержащий
a) промоторную последовательность и
b) последовательность нуклеиновой кислоты, кодирующую белок, причем белок включает в себя сигнальный пептид и еще одну аминокислотную последовательность, а сигнальный пептид включает в себя аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности, приведенной как SEQ ID NO. 2, или по меньшей мере на 80% идентична аминокислотной последовательности, приведенной как SEQ ID NO. 4, по меньшей мере на 80% идентична аминокислотной последовательности, приведенной как SEQ ID NO. 6, или же сигнальный пептид включает в себя аминокислотную последовательность, которая структурно гомологична по меньшей мере одной из этих последовательностей.
Неожиданно было обнаружено, что благодаря экспрессионному вектору, который кодирует белок с таким сигнальным пептидом, получают улучшенную секрецию белка из клетки-хозяина, содержащей экспрессионный вектор и экспрессирует последовательность нуклеиновой кислоты b). В силу этого в предпочтительных вариантах осуществления изобретения возможно повысить выход белка-продукта в ферментации.
Экспрессионный вектор - это последовательность нуклеиновой кислоты, которая обеспечивает возможность экспрессии белка в клетке-хозяине, в особенности микроорганизме. Он включает в себя генетическую информацию, то есть, ту последовательность нуклеиновой кислоты (ген) b), которая кодирует белок.
Экспрессия последовательности нуклеиновых кислот - это перевод ее (превращение ее) в кодируемый этой последовательностью генный продукт (кодируемые генные продукты), то есть в полипептид (белок) либо же в несколько полипептидов (белков). В настоящей заявке термины «полипептид» и «белок» используют как синонимы. В смысле настоящего изобретения, следовательно, экспрессия означает биосинтез рибонуклеиновой кислоты (РНК) и белков из генетической информации. Как правило, экспрессия включает в себя транскрипцию, то есть синтез информационной («матричной») рибонуклеиновой кислоты (мРНК) на основании последовательности гена, состоящего из ДНК (дезоксирибонуклеиновой кислоты), и ее трансляцию в соответствующую полипептидную цепь, которую при необходимости еще можно модифицировать после трансляции. Следовательно, экспрессия белка обозначает биосинтез его из генетической информации, которую согласно изобретению предоставляют на экспрессионном векторе.
Векторы - это генетические элементы, состоящие из нуклеиновых кислот, предпочтительно дезоксирибонуклеиновой кислоты (ДНК), и они известны специалисту в области биотехнологии. При использовании в особенности в бактериях они представляют собой плазмиды, то есть кольцевидные генетические элементы. К векторам могут принадлежать, например, таковые, являющиеся производными бактериальных плазмид, вирусов или бактериофагов, или же преимущественно синтетические векторы, или плазмиды с элементами различного происхождения. Векторы с состоянии за много поколений утвердиться в качестве стабильных элементов с другими генетическими элементами, присутствующими в каждом случае, в клетках-хозяевах, в которые они были введены предпочтительно путем трансформации. При этом в смысле изобретения неважно, утверждаются ли они вне хромосом как самостоятельные единицы или же интегрируются в хромосому либо хромосомную ДНК. Выбор одной из многочисленных систем зависит от конкретного случая. Решающую роль могут играть, например, достижимое количество копий, доступные системы селекции, в их числе в первую очередь резистентность к антибиотикам, или же пригодность клеток-хозяев, получивших способность поглощать векторы, к культивации.
Также может существовать возможность регулировать экспрессионные векторы путем изменения условий в культуре, как, например, плотности клеток или добавления определенных соединений. Пример такого соединения - это производное галактозы изопропил-β-D-гиогалактопиранозид (ИПТГ), который используют в качестве активатора бактериального лактозного оперона (lac-оперона).
Далее в состав экспрессионного вектора входит по меньшей мере одна последовательность нуклеиновой кислоты, предпочтительно ДНК, с функцией управления последовательностью нуклеиновой кислоты b), кодирующей белок (так называемая генно-регуляторная последовательность). При этом генно-регуляторная последовательность - это каждая последовательность нуклеиновой кислоты, присутствие которой в данной конкретной клетке-хозяине влияет на частоту транскрипций последовательности нуклеиновых кислот b), которая кодирует белок, предпочтительно повышает ее. При этом целесообразно, чтобы это была промоторная последовательность, поскольку такая последовательность имеет существенное значение для экспрессии последовательности нуклеиновых кислот b). Экспрессионный вектор согласно изобретению может, однако, включать в себя и другие генно-регуляторные последовательности, например, одну или несколько последовательностей-энхансеров. В рамках настоящего изобретения экспрессионный вектор, следовательно, включает в себя по меньшей мере одну функциональную единицу из последовательности нуклеиновых кислот b) и промотора (экспрессионную кассету). Она может, но не обязательно, присутствовать в виде физического объекта. Промотор вызывает экспрессию последовательности нуклеиновых кислот b) в клетке-хозяине. В рамках настоящего изобретения экспрессионный вектор также может ограничиваться чистой экспрессионной кассетой из промотора и подлежащей экспрессии последовательности нуклеиновых кислот b), причем эта экспрессионная кассета может быть внехромосомной или же быть интегрирована в хромосому. Такие варианты экспрессионных векторов согласно изобретению в каждом случае представляют собой отдельную форму исполнения изобретения.
Следовательно, существенное значение для экспрессионного вектора согласно изобретению имеет наличие по меньшей мере одного промотора. В соответствии с этим под промотором подразумевают последовательность ДНК, которая дает возможность регулируемой экспрессии гена. Естественно, промоторная последовательность является составной частью гена и часто находится на его 5'-конце и, следовательно, до участка, кодирующего РНК. Предпочтительно, чтобы промоторная последовательность в экспрессионном векторе согласно изобретению находилась в 5'-направлении от кодирующей белок последовательности нуклеиновых кислот b). Важнейшее свойство промотора - это специфическое взаимодействие по меньшей мере с одним связывающим ДНК белком или полипептидом, который опосредует старт транскрипции гена ДНК-полимеразой и называется фактором транскрипции. Нередко в старте транскрипции ДНК-полимеразой участвуют несколько факторов транскрипции и/или другие белки. Следовательно, предпочтительно, чтобы промотор представлял собой последовательность ДНК с промоторной активностью, то есть последовательность ДНК, к которой по меньшей мере временно присоединяется по меньшей мере один фактор транскрипции для инициации транскрипции некоторого гена. Силу промотора можно измерить по частоте транскрипций экспрессированного гена, то есть по числу молекул РНК, в особенности молекул мРНК, созданных в единицу времени.
Предпочтительно, чтобы промоторная последовательность (а) и последовательность нуклеиновой кислоты (b) располагались на экспрессионном векторе друг за другом. Еще более предпочтительно, чтобы промоторная последовательность (а) располагалась на молекуле нуклеиновой кислоты перед последовательностью нуклеиновой кислоты (b) (в ориентации 5'→3'). Равным же образом предпочтительно, чтобы между обеими последовательностями нуклеиновых кислот (а) и (b) отсутствовали последовательности нуклеиновых кислот, которые бы снижали частоту транскрипции последовательности нуклеиновых кислот (b), кодирующей белок. Все вышеприведенные данные относятся к той нити ДНК, которая содержит последовательность нуклеиновой кислоты (b), кодирующую белок (кодирующую нить), а не к соответствующей кодогенной нити ДНК. Следовательно, с точки зрения последовательности нуклеиновых кислот (b), кодирующей белок, промоторная последовательность (а) предпочтительно находится на этой нити ДНК выше «по течению», то есть в 5'-направлении.
Последовательность нуклеиновой кислоты b) кодирует подлежащий выделению белок. Речь при этом идет о том белке, который необходимо синтезировать с помощью экспрессионного вектора согласно изобретению (целевом белке).
Белок, кодируемый последовательностью нуклеиновой кислоты b), включает в себя сигнальный пептид с аминокислотной последовательностью, которая по меньшей мере на 80% идентична аминокислотной последовательности, приведенной как SEQ ID NO. 2, или по меньшей мере на 80% идентична аминокислотной последовательности, приведенной как SEQ ID NO. 4, по меньшей мере на 80% идентична аминокислотной последовательности, приведенной как SEQ ID NO. 6. Было установлено, что такие сигнальные пептиды вызывают продуктивную секрецию содержащего их белка, в особенности рекомбинантного белка. С нарастающей степенью предпочтения сигнальный пептид включает в себя аминокислотную последовательность, которая идентична аминокислотной последовательности, приведенной как SEQ ID NO. 2, по меньшей мере на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а крайне предпочтительно на 100%, или идентична аминокислотной последовательности, приведенной как SEQ ID NO. 4, на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а крайне предпочтительно на 100%, или идентична аминокислотной последовательности, приведенной как SEQ ID NO. 6, на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% а крайне предпочтительно на 100%. Особо предпочтительно, чтобы сигнальный пептид включал в себя аминокислотную последовательность, которая идентична аминокислотной последовательности, приведенной как SEQ ID NO. 2, по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а крайне предпочтительно на 100%, или идентична аминокислотной последовательности, приведенной как SEQ ID NO. 4, на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а крайне предпочтительно на 100%, или идентична аминокислотной последовательности, приведенной как SEQ ID NO. 6, на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% а крайне предпочтительно на 100%.
В каждом случае крайне предпочтительны на 100% идентичные последовательности, так что соответствующим образом предпочтительный экспрессионный вектор отличается тем, что кодированный последовательностью нуклеиновой кислоты сигнальный пептид b) обладает аминокислотной последовательностью в соответствии с SEQ ID NO. 2, SEQ ID NO. 4 или SEQ ID NO. 6. Особо предпочтительные последовательности нуклеиновых кислот, кодирующие такие пептиды, приведены как SEQ ID NO. 1, SEQ ID NO. 3 и SEQ ID NO. 5.
Кроме того, вместо поименованных сигнальных пептидов, дающих возможность секретировать белок, можно применять последовательности, структурно гомологичные этим последовательностям. Под структурно гомологичной последовательностью подразумевают аминокислотную последовательность, в которой порядок аминокислот характеризуется той же пространственной складчатостью, что и сигнальный пептид с последовательностью аминокислот согласно SEQ ID NO. 2, SEQ ID NO. 4 или SEQ ID NO. 6. Пространственная складчатость обеспечивает, что клетка-хозяин распознает ее [(последовательность)] как секреторную сигнальную последовательность, и, следовательно, белок, содержащий структурно-гомологичную сигнальную последовательность, выходит из клетки-хозяина. Предпочтительно, чтобы имело место взаимодействие с применяемой в клетке-хозяине системой транслокации. Поэтому предпочтительно, чтобы структурно-гомологичная аминокисотная последовательность непосредственно или опосредованно связывалась по меньшей мере с одним компонентом системы транслокации клетки-хозяина. Под непосредственным связыванием подразумевают прямое взаимодействие, под опосредованным же связыванием подразумевают, что взаимодействие может осуществляться через один или несколько других компонентов, в частности, белков или других молекул, которые играют роль адаптера и, соответственно, исполняют функцию мостика между структурно-гомологичной аминокислотной последовательностью и компонентом системы транслокации клетки-хозяина.
Идентификацию последовательностей нуклеиновых кислот или аминокислотных последовательностей осуществляют путем сравнения последовательностей. Такое сравнение выполняют, приводя в соответствие друг другу сходные участки нуклеотидных или аминокислотных последовательностей. Это сравнение последовательностей осуществляют предпочтительно на основании утвердившегося на нынешнем техническом уровне и обычно используемого алгоритма BLAST (ср., например, с публикациями Altschul, S.F., Gish, W., Miller, W., Myers, E.W. & Lipman, D.J. (1990) "Basic local alignment search tool." J. Mol. Biol. 215: 403-410 и Altschul, Stephan F., Thomas L. Madden, Alejandro A. Schaffer, Jinghui Zhang, Hheng Zhang, Webb Miller, and David J. Lipman (1997): "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs"; Nucleic Acids Res., 25, S. 3389-3402), и принципиальная суть его состоит в том, что сходные участки чередования нуклеотидов или аминокислот в последовательности нуклеиновых кислот или аминокислотной последовательности приводят в соответствие друг другу. Таблица соответствия этих позиций называется «выравниванием». Еще один алгоритм, доступный на нынешнем техническом уровне, - это алгоритм FASTA. Сравнение последовательностей (выравнивания), в особенности множественные сравнения последовательностей, обычно создают с помощью компьютерных программ. Часто используют, например, серию программных продуктов Clustal (ср., например, Chenna et al. (2003): Multiple sequence alignment with the Clustal series of programs. Nucleic Acid Research 31, 3497-3500), T-Coffee (ср., например, Notredame et al. (2000): T-Coffee: A novel method for multiple sequence alignments. J. Mol. Biol. 302, 205-217) или программы, основанные на этих программах или алгоритмах. В рамках настоящего изобретения сравнения последовательностей и выравнивание предпочтительно проводят с помощью компьютерной программы Vector NTI® Suite 10.3 (Invitrogen Corporation, 1600 Faraday Avenue, Carlsbad, Калифорния, США) с предварительно заданными параметрами (по умолчанию).
Такое сравнение позволяет сделать высказывание о сходстве прошедших сравнение последовательностей друг с другом. Его обычно выражают в процентах идентичности, то есть в виде доли идентичных нуклеотидов или аминокислот в тех же самых положениях либо же в положениях, соответствующих друг другу при выравнивании. Более широко трактуемый термин «гомология» в случае аминокислотных последовательностей включает в рассмотрение консервированные замены аминокислот, то есть аминокислоты со сходными свойствами, поскольку в пределах белка они по большей части несут сходные функции или же обладают сходной активностью. Поэтому сходство прошедших сравнение последовательностей можно выражать в проценте гомологии или в проценте сходства. Данные об идентичности и/или гомологичности можно получать о целых полипептидах или генах или только об отдельных участках. Поэтому гомологичные или идентичные участки различных последовательностей нуклеиновых кислот или аминокислотных последовательностей определяют по соответствиям в последовательностях. Функции их часто одинаковы или сходны. Они должны быть невелики и включать в себя лишь немногие нуклеотиды или аминокислоты. Такие небольшие участки часто исполняют важнейшие для всей активности белка функции. Поэтому может быть целесообразно применять соответствия последовательностей только к отдельным, при необходимости малым участкам. В настоящей заявке, однако, если не указано иное, данные об идентичности либо же гомологии относятся в каждом случае к общей длине последовательности нуклеиновых кислот или аминокислотной последовательности, приведенной в каждом случае.
Кроме того, белок, кодированный последовательностью нуклеиновой кислоты b), включает в себя еще одну аминокислотную последовательность. Эта аминокислотная последовательность, следовательно, представляет собой собственно аминокислотную последовательность белка без сигнального пептида. Предпочтительно, чтобы это была аминокислотная последовательность зрелого белка. Под зрелым белком подразумевают его готовую форму, прошедшую процессинг, поскольку возможно, что соответствующий ген кодирует незрелую форму, которая после трансляции еще проходит процессинг до зрелой формы. Незрелые формы белка могут, например, включать в себя сигнальные пептиды и/или пропептиды, или элонгации (удлинения) на N-конце и/или С-конце, которые в зрелой форме более не наличествуют. Например, незрелые формы протеаз, в особенности субтилаз, а среди них в первую очередь субтилизин включают в себя сигнальный пептид, а также пропептид, которые в зрелой (созревшей) форме протеазы более не присутствует. В качестве альтернативы другая аминокислотная последовательность может представлять собой аминокислотную последовательность незрелого белка, которая включает в себя пропептид. Такой вариант возможет, в частности, для протеаз, в особенности субтилаз, а среди них в первую очередь для субтилизина. В особо предпочтительных вариантах другая аминокислотная последовательность не включает в себя никаких дополнительных сигнальных пептидов. В таких вариантах согласно изобретению секрецию белка из клетки-хозяина, следовательно, вызывает только сигнальный пептид согласно изобретению.
Особо предпочтительно, чтобы в состав другой аминокислотной последовательности белка входила аминокислотная последовательность фермента, в особенности протеазы, амилазы, целлюлазы, гемицеллюлазы, маннаназы, танназы, ксиланазы, ксантаназы, ксилоглюканазы, β-глюкозидазы, какого-либо расщепляющего пектин фермента, каррагиназы, пергидролазы, оксидазы, оксидоредуктазы или липазы, в особенности фермента в соответствии с указанным ниже. Крайне предпочтительно, чтобы в состав другой аминокислотной последовательности белка входила аминокислотная последовательность протеазы, а среди них - субтилизина.
Например, с помощью экспрессионного вектора согласно изобретению можно выгодным образом синтезировать один из поименованных ниже ферментов.
Среди протеаз предпочтителен субтилизин. Примеры его - это субтилизин BPN' и Карлсберг, протеаза РВ92, субтилизины 147 и 309, щелочная протеаза из Bacillus lentus, субтилизин DY и ферменты термитаза, протеиназа К и протеазы TW3 и TW7, которые следует отнести к субтилазам, но не к субтилизинам в строгом смысле. Субтилизин Карлсберг в доработанной форме под торговым наименованием Alcalase® предлагается на рынке фирмой Novozymes A/S, Bagsvaerd, Дания. Субтилизины 147 и 309 под торговыми наименованиями Esperase® или Savinase®, соответственно, распространяет фирма Novozymes. От протеазы из Bacillus lentus DSM 5483 происходят варианты протеазы, продаваемые под обозначением BLAP®. Прочие предпочтительные протеазы - это, например, ферменты, продаваемые под обозначением PUR. Также прочие протеазы - это ферменты, продаваемые под торговыми наименованиями Durazym®, Relase®, Everlase®, Nafizym®, Natalase®, Kannase® и Ovozyme® фирмой Novozymes, продаваемые под торговыми наименованиями Purafect®, Purafect® OxP, Purafect® Prime, Excellase® и Properase® фирмой Genencor, продаваемый под торговым наименованием Protosol® фирмой Advanced Biochemicals Ltd., Thane, Индия, продаваемый под торговым наименованием Wuxi® фирмой Wuxi Snyder Bioproducts Ltd., Китай, таковой, продаваемый под торговым наименованием Proleather® и Protease Р® фирмой Amano Pharmaceuticals Ltd., Нагоя, Япония, и продаваемый под обозначением Proteinase К-16 фирмой Као Corp., Токио, Япония. Также предпочтительны еще и протеазы из Bacillus gibsonii и Bacillus pumilus, которые раскрыты в международных заявках на патент WO 2008/086916 и WO 2007/131656.
Примеры амилаз - это α-амилазы из Bacillus licheniformis, из Bacillus amyloliquefaciens или из Bacillus stearothermophilus, а также, в частности, их усовершенствованные варианты, улучшенные для применения в стиральных и моющих средствах. Фермент из Bacillus licheniformis распространяется предприятием Novozymes под наименованием Termamyl® и предприятием Danisco/Genencor под названием Purastar®ST. Продукты усовершенствования этой α-амилазы представлены на рынке предприятием Novozymes под торговыми наименованиями Duramyl® и Termamyl®ultra, предприятием Danisco/Genencor под наименованием Purastar®OxAm и предприятием Daiwa Seiko Inc., Токио, Япония, как Keistase®. α-Амилазу Bacillus amyloliquefaciens предприятие Novozymes распространяет под наименованием BAN®, а производные варианты α-амилазы Bacillus stearothermophilus - также предприятие Novozymes под названиями BSG® и Novamyl® Также следует назвать α-амилазу из Bacillus sp. A 7-7 (DSM 12368) и циклодекстрин-глюканотрансферазу (ЦГТазу) из Bacillus agaradherens (DSM 9948). Равным же образом можно применять продукты слияния всех поименованных молекул. Сверх того годятся к применению продаваемые предприятием Novozymes под торговым наименованием Fungamyl® усовершенствованные варианты α-амилазы из Aspergillus niger и A. oryzae. Прочие целесообразные торговые продукты - это, например, амилаза Powerase® производства предприятия Danisco/Genencor и амилазы Amylase-LT®, Stainzyme® и Stainzyme plus®, последние от предприятия Novozymes.
Согласно изобретению можно также синтезировать варианты этих ферментов, получаемых точечной мутацией. Прочие предпочтительные амилазы раскрыты в международных публикациях заявок WO 00/60060, WO 03/002711, WO 03/054177 и WO 07/079938, на каковые публикации настоящим дана ссылка в явном виде, либо же содержание публикации каковых в этом отношении, следовательно, в явном виде включается в настоящую заявку на патент. Амилазы, подлежащие изготовлению согласно изобретению, также предпочтительно представляют собой α-амилазы.
Примеры липаз или кутиназ - это исходно получаемые из Humicola lanuginosa (Thermomyces lanuginosus) либо же усовершенствованные липазы, в особенности таковые с заменой аминокислот D96L. Фирма Novozymes, например, распространяет их под торговым наименованием Lipolase®, Lipolase®Ultra, LipoPrime®, Lipozyme® и Lipex®. Кроме того, например, можно изготавливать кутиназы, которые исходно были выделены из Fusarium solani pisi и Humicola insolens. Фирма Danisco/Genencor может синтезировать, например, липазы либо кутиназы, исходные ферменты для которых были выделены из Pseudomonas mendocina и Fusarium solanii, соответственно. Из других важных торговых продуктов следует упомянуть исходно распространявшиеся фирмой Gist-Brocades (в настоящее время Danisco/Genencor) препараты M1 Lipase® и Lipomax® и ферменты, распространяемые фирмой Meito Sangyo KK, Япония, под наименованиями Lipase MY-30®, Lipase OF® и Lipase PL®, а также продукт Lumafast® производства фирмы Danisco/Genencor.
Примеры целлюлаз (эндоглюканаз, ЭГ) включают в себя последовательности грибковых препаратов целлюлазы, богатых эндоглюканазой (ЭГ), либо же их усовершенствования, которые предлагаются предприятием Novozymes под торговым наименованием Celluzyme®. Также продаваемые предприятием Novozymes продукты Endolase® и Carezyme® основаны на ЭГ в 50 кДа либо же ЭГ в 43 кДа, соответственно, из Humicola insolens DSM 1800. Другие пригодные к изготовлению торговые продукты этого предприятия - это Cellusoft®, Renozyme® и Celluclean®. Также можно изготавливать, например, целлюлазы, которые продает предприятие АВ Enzymes (Финляндия) под торговыми наименованиями Ecostone® и Biotouch®, и которые по меньшей мере отчасти имеют в основе 20 kD-EG из Melanocarpus. Прочие целлюлазы производства предприятия АВ Enzymes - это Econase® и Ecopulp®. Другие пригодные к использованию целлюлазы получают из Bacillus sp. CBS 670.93 и CBS 669.93, причем таковую из Bacillus sp. CBS 670.93 продает предприятие Danisco/Genencor под торговым наименованием Puradax®. Остальные торговые продукты предприятия Danisco/Genencor, которые можно изготавливать, - это "Genencor detergent cellulase L" и IndiAge®Neutra.
Согласно изобретению можно также синтезировать варианты этих ферментов, получаемых точечной мутацией. Особо предпочтительные целлюлазы - это варианты целлюлазы Thielavia terrestris, которые раскрыты в международной публикации заявки WO 98/12307, целлюлазы из Melanocarpus, в особенности Melanocarpus albomyces, которые раскрыты в международной публикации заявки WO 97/14804, целлюлазы типа EGIII из Trichoderma reesei, которые раскрыты в европейской заявке на патент ЕР 1305432, либо же получаемые из них варианты, в особенности те, которые раскрыты в европейских заявках ЕР 1240525 и ЕР 1305432, а также целлюлазы, которые раскрыты в международной публикации заявки WO 1992006165, WO 96/29397 и WO 02/099091. Поэтому в каждом случае на эти публикации настоящим дана ссылка в явном виде, либо же содержание этих публикаций в этом отношении поэтому в явном виде включается в настоящую заявку на патент.
Также можно синтезировать другие ферменты, которые объединяют термином «гемицеллюлазы». К ним относятся, например, маннаназы, ксантанлиазы, ксантаназы, ксилоглюканазы, ксиланазы, пуллуланазы, пектин-расщепляющие ферменты и β-глюканазы. Получаемая из Bacillus subtilis β-глюканаза распространяется под наименованием Cereflo® фирмой Novozymes. Гемицеллюлазы, особо предпочтительные согласно изобретению, представляют собой маннаназы, которые, например, распространяются под торговым наименованием Mannaway® предприятием Novozymes или Purabrite® предприятием Genencor. К пектин-расщепляющим ферментам в рамках настоящего изобретения также относят ферменты под названием, пектиназа, пектатлиаза, пектинэстераза, пектиндеметоксилаза, пектинметоксилаза, мектинметилэстераза, пектаза, пектинметилэстераза, пектиноэстераза, пектинпектилгидролаза, пектиндеполимераза. эндополигалактуроназа, пектолаза, пектингидролаза, пектин-полигалактуроназа, эндо-полигалактуроназа поли-α-1,4-галактуронид гликаногидролаза, эндогалактуроназа, эндо-D-галактуроназа, галактуран 1,4-α-галактуронидаза, экзополигалактуроназа, поли(галактуронат) гидролаза, экзо-D-галактуроназа, экзо-D-галактуроназа, экзополи-D-галактуроназа, экзо-поли-α-галактуронозидаза, экзополигалактуронозидаза или экзополигалактуранозидаза. Примеры подходящих в этом смысле ферментов представлены под наименованиями Gamanase®, Pektinex AR®, X-Pect® или Pectaway® предприятием Novozymes, под наименованиями Rohapect UF®, Rohapect TPL®, Rohapect PTE100®, Rohapect MPE®, Rohapect MA plus HC, Rohapect DA12L®, Rohapect 10L®, Rohapect B1L® предприятием АВ Enzymes и под наименованием Pyrolase® предприятием Diversa Corp., Сан-Диего, Калифорния (США).
Кроме того, можно также синтезировать оксидоредуктазы, например, оксидазы, оксигеназы, каталазы, пероксидазы, как, например, галопероксидазы, хлоропероксидазы, бромопероксидазы, лигнинпероксидазы, глюкозопероксидазы или марганец-пероксидазы, диосксигеназы или лакказы (фенолоксидазы, полифенолоксидазы). В качестве подходящих торговых продуктов следует назвать Denilite® 1 и 2 производства фирмы Novozymes. Прочие ферменты раскрыты в международных заявках на патент WO 98/45398, WO 2005/056782, WO 2004/058961, a также WO 2005/124012.
Еще в одной форме исполнения изобретения другая аминокислотная последовательность в природе не присутствует в полипептидной цепи в микроорганизме вместе с сигнальным пептидом. Следовательно, белок, кодируемый последовательностью нуклеиновой кислоты b), представляет собой рекомбинантный белок. Поэтому выражение «в природе не присутствует» означает, что обе аминокислотные последовательности не являются составными частями собственного белка микроорганизма. Следовательно, экспрессия белка, который включает в себя сигнальный пептид и другую аминокислотную последовательность, в микроорганизме невозможна посредством последовательности нуклеиновых кислот, являющейся частью хромосомной ДНК микроорганизма в форме его дикого типа. Следовательно, такой белок и/или в каждом случае кодирующая его последовательность нуклеиновой кислоты не присутствует в форме дикого типа микроорганизма, и/или ее нельзя выделить из формы дикого типа микроорганизма. Поэтому обе последовательности (сигнальный пептид и другую аминокислотную последовательность) следует в форме дикого типа микроорганизма соотнести с двумя различными полипептидными цепями, если вообще они обе присутствуют либо же могут присутствовать в форме дикого типа микроорганизма. Соответственно, в рамках этого варианта изобретения сигнальный пептид и другую аминокислотную последовательность либо же кодирующие их нуклеиновые кислоты скомбинировали заново с помощью генно-инженерных методов, и эта комбинация сигнального пептида и другой аминокислотной последовательности в природе не существует. В форме дикого типа микроорганизма, следовательно, такого соединения сигнального пептида с другой аминокислотной последовательностью не имеется, причем ни на уровне ДНК, ни на уровне белка. При этом и сигнальный пептид, и другая аминокислотная последовательность, либо же в каждом случае кодирующие их последовательности нуклеиновых кислот могут, однако, быть естественного происхождения, однако их комбинация в природе не существует. Сами по себе сигнальный пептид и другая аминокислотная последовательность могут, однако, иметь происхождением один и тот же микроорганизм или же различные микроорганизмы.
В предпочтительной форме исполнения нуклеиновая кислота согласно изобретению отличается тем, что она не представляет собой натуральную нуклеиновую кислоту. «Не натуральная» означает, что нуклеиновую кислоту согласно изобретению нельзя выделить из встречающегося в природе организма в форме его дикого типа. Поэтому в особенности и применительно к бактериям дикого типа нуклеиновая кислота согласно изобретению не представляет собой собственную нуклеиновую кислоту бактерий.
Предпочтительно, чтобы последовательности (а) и (b) не происходили из одного и того же либо же из одних и тех же организмов, в частности, бактерий, а происходили бы из различных организмов, в особенности бактерий. Различные бактерии - это, например, бактерии, которые принадлежат к различным штаммам, или видам, или родам.
Еще в одной форме исполнения изобретения экспрессионный вектор отличается тем, что в белке, кодируемом последовательностью нуклеиновой кислоты b), сигнальный пептид размещается в направлении N-конца от другой аминокислотной последовательности. Следовательно белок, кодированный последовательностью нуклеиновой кислоты b), обладает следующей структурой: N-конец - сигнальный пептид - (в качестве опции дополнительная аминокислотная последовательность) - другая аминокислотная последовательность - С-конец. Подобная структура подлежащего экспрессии белка оказалась особо целесообразной.
Еще в одной форме исполнения изобретения экспрессионный вектор отличается тем, что кодируемый последовательностью нуклеиновой кислоты b) белок также включает в себя соединительную последовательность, которая расположена между сигнальным пептидом и другой аминокислотной последовательностью белка. Следовательно белок, кодированный последовательностью нуклеиновой кислоты b), обладает следующей структурой: N-конец - сигнальный пептид - соединительная последовательность (также «сцепление» или «спейсер») - другая аминокислотная последовательность - С-конец. Подобная структура подлежащего экспрессии белка также оказалась особо целесообразной. Предпочтительно, чтобы длина соединительной последовательности составляла от 1 до 50 аминокислот, от 2 до 25 аминокислот, от 2 до 15 аминокислот, от 3 до 10 аминокислот, а особо предпочтительно - от 3 до 5 аминокислот. Пример такой особо предпочтительной соединительной последовательности - это ряд аминокислот «аланин, глутаминовая кислота и фенилаланин» (от N-конца к С-концу).
Еще в одной форме исполнения изобретения экспрессионный вектор отличается тем, что другая аминокислотная последовательность белка включает в себя аминокислотную последовательность протеазы, причем аминокислотная последовательность протеазы по меньшей мере на 80% идентична SEQ ID NO. 7. Предпочтительно, чтобы аминокислотная последовательность протеазы была на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а крайне предпочтительно - на 100% идентична SEQ ID NO. 7.
В качестве альтернативы другая аминокислотная последовательность белка включает в себя аминокислотную последовательность протеазы, которая по меньшей мере на 80% идентична последовательности SEQ ID NO. 8. Предпочтительно, чтобы аминокислотная последовательность протеазы на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а крайне предпочтительно - на 100% была идентична SEQ ID NO. 8.
В качестве альтернативы другая аминокислотная последовательность белка включает в себя аминокислотную последовательность протеазы, которая по меньшей мере на 80% идентична SEQ ID NO. 9. Предпочтительно, чтобы аминокислотная последовательность протеазы на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а крайне предпочтительно - на 100% была идентична SEQ ID NO. 9.
В качестве альтернативы другая аминокислотная последовательность белка включает в себя аминокислотную последовательность протеазы, которая по меньшей мере на 80% идентична SEQ ID NO. 10, а аминокислота в положении 99 при подсчете в соответствии с SEQ ID NO. 10 представляет собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D). Предпочтительно, чтобы аминокислотная последовательность протеазы на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а крайне предпочтительно была идентична SEQ ID NO. в положениях от 1 до 98 и от 100 до 269 при подсчете в соответствии с SEQ ID NO. 10.
В качестве альтернативы другая аминокислотная последовательность белка включает в себя аминокислотную последовательность протеазы, которая по меньшей мере на 80% идентична SEQ ID NO. 10, а аминокислота в положении 99 при подсчете в соответствии с SEQ ID NO. 10 представляет собой глутаминовую кислоту (Е) или аспарагиновую кислоту (D), а кроме того при подсчете в соответствии с SEQ ID NO. 10 имеет по меньшей мере одну из следующих аминокислот:
(a) треонин в положении 3 (3Т),
(b) изолейцин в положении 4 (4I),
(c) аланин, треонин или аргинин в положении 61 (61А, 61T или 61R),
(d) аспарагиновую кислоту или глутаминовую кислоту в положении 154 (154D или 154Е),
(e) пролин в положении 188 (188Р),
(f) метионин в положении 193 (193М),
(g) изолейцин в положении 199 (199I),
(h) аспарагиновую кислоту, глутаминовую кислоту или глицин в положении 211 (211D, 211E или 211G),
(i) комбинации аминокислот от (а) до (h).
Предпочтительно, чтобы аминокислотная последовательность протеазы на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, а крайне предпочтительно - на 100% была идентична SEQ ID NO. 10 во всех неизмененных или не предназначенных для изменения положениях. Поэтому крайне предпочтительно, чтобы в состав другой аминокислотной последовательности белка входила аминокислотная последовательность протеазы, которая обладает аминокислотной последовательностью, измененной по сравнению с SEQ ID NO. 10 по меньшей мере в двух положениях, причем первое изменение при подсчете в соответствии с SEQ ID NO. №10 представляет собой глутаминовую кислоту в положении 99, а второе изменение при подсчете в соответствии с SEQ ID NO. 10 выбрано из группы, которую образуют:
(a) треонин в положении 3 (3Т),
(b) изолейцин в положении 4 (4I),
(c) аланин, треонин или аргинин в положении 61 (61А, 61T или 61R),
(d) аспарагиновую кислоту или глутаминовую кислоту в положении 154 (154D или 154Е),
(e) пролин в положении 188 (188Р),
(f) метионин в положении 193 (193М),
(g) изолейцин в положении 199 (199I),
(h) аспарагиновую кислоту, глутаминовую кислоту или глицин в положении 211 (211D, 211E или 211G),
(i) комбинации аминокислот от (а) до (h).
Равным же образом крайне предпочтительно, чтобы в состав другой аминокислотной последовательности белка входила аминокислотная последовательность протеазы, которая обладает аминокислотной последовательностью, измененной по сравнению с SEQ ID NO. 10 по меньшей мере в двух положениях, причем первое изменение при подсчете в соответствии с SEQ ID NO. 10 представляет собой аспарагиновую кислоту в положении 99, а второе изменение при подсчете в соответствии с SEQ ID NO. 10 выбрано из группы, которую образуют:
(a) треонин в положении 3 (3Т),
(b) изолейцин в положении 4 (4I),
(c) аланин, треонин или аргинин в положении 61 (61А, 61T или 61R),
(d) аспарагиновую кислоту или глутаминовую кислоту в положении 154 (154D или 154Е),
(e) пролин в положении 188 (188Р),
(f) метионин в положении 193 (193М),
(g) изолейцин в положении 199 (199I),
(h) аспарагиновую кислоту, глутаминовую кислоту или глицин в положении 211 (211D, 211Е или 211G),
(i) комбинации аминокислот от (а) до (h).
Было обнаружено, что поименованные выше протеазы также можно особо выгодно синтезировать посредством экспрессионных векторов согласно изобретению. Применительно к таким формам исполнения изобретения оказалось, что с помощью таких комбинаций сигнальных пептидов и субтилизинов можно добиться особенно благоприятных показателей выхода продукции в ферментации. В связи с этим приведены аминокислотные последовательности зрелых протеаз, то есть, готовые, прошедшие процессинг продукты. В экспрессионный вектор согласно изобретению могут в связи с этим также быть включены и другие последовательности незрелой протеазы, в частности, например, пропептиды В таком случае «другая аминокислотная последовательность» белка включает в себя аминокислотную последовательность протеазы и пропептида. Следовательно, еще один вариант изобретения отличается тем, что другая аминокислотная последовательность белка включает в себя аминокислотную последовательность протеазы, в особенности протеазы, описанной выше, помимо какого-либо или своего пропептида.
В общем случае справедливо утверждение, что другая аминокислотная последовательность белка не обязательно содержит только аминокислотную последовательность зрелого белка; напротив, эта аминокислотная последовательность может включать в себя также и другие аминокислотные последовательности, например, пропептиды. Это справедливо не только для протеаз. но для всех белков, в частности, и для всех других видов ферментов.
Нуклеиновые кислоты и экспрессионные векторы согласно изобретению можно создавать известными как таковые способами изменения нуклеиновых кислот. Таковые представлены, например, в соответствующих руководствах, как, например, Fritsch, Sambrook и Maniatis, "Molecular cloning: a laboratory manual", Cold Spring Harbour Laboratory Press, New York, 1989, и известны специалисту в области биотехнологии. Примеры таких способов (процессов) - это химический синтез или полимеразная цепная реакция (ПЦР), в качестве опции - в сочетании с другими молекулярно-биологическими и/или химическими либо же биохимическими стандартными методами.
Со всеми поименованными объектами и формами исполнения изобретения связаны в качестве прочих объектов изобретения отличные от человеческих клетки-хозяева, которые содержат векторы согласно изобретению, способы синтеза, в которых применяют соответствующие клетки-хозяева, а также применение соответствующих векторов или клеток-хозяев. Поэтому изложенное выше соответствующим образом касается этих объектов изобретения.
Еще один объект изобретения - это отличная от человеческой клетка-хозяин, которая содержит экспрессионный вектор согласно изобретению. Экспрессионный вектор согласно изобретению предпочтительно вводят в клетку-хозяин посредством трансформации последней. Согласно изобретению это предпочтительно осуществляют посредством того, что вектор согласно изобретению трансформируют в микроорганизм, который затем представляет собой клетку-хозяина согласно изобретению. В качестве альтернативы можно ввести в клетку-хозяин также и отдельные компоненты, то есть части или фрагменты нуклеиновой кислоты, например, компоненты (а) и/или (b) вектора согласно изобретению, таким образом, чтобы получающаяся в результате клетка-хозяин содержала вектор согласно изобретению. Этот способ работы особенно удобен тогда, когда клетка-хозяин уже содержит одну или несколько составных частей вектора согласно изобретению, а затем осуществляют пополнение другими составными частями. Методики трансформации клеток утвердились на нынешнем техническом уровне и хорошо известны специалисту. В качестве клеток-хозяев можно, в принципе, использовать все клетки, то есть прокариотические или эукариотические клетки. Предпочтительны такие клетки-хозяева, с которыми можно работать выгодным с генетической точки зрения образом в том, что касается, например, трансформации вектором и его стабильного обустройства, например, одноклеточные грибы или бактерии. Кроме того, предпочтительные клетки-хозяева отличаются удобством микробиологической и биотехнологической работы с ними. Это касается, например, простоты культивирования, высокой скорости роста, низких требований к ферментационным средам и хороших показателей продукции и секреции чужеродных белков. Ввиду того, что на нынешнем техническом уровне доступны множество различных систем, оптимальные экспрессионные системы для конкретного случая часто приходится определять экспериментально.
Прочие предпочтительные формы исполнения представляют собой такие клетки-хозяева, чью активность можно регулировать благодаря генетическим регуляторным элементам, которые, например, могут быть предоставлены на векторе, но также могут присутствовать в этих клетках с самого начала. Их можно, например, побудить к экспрессии путем контролируемого добавления химических соединений, которые служат активаторами, путем изменения условий культивирования или же по достижении определенной плотности клеток. Это дает возможность экономически выгодного производства белков.
Предпочтительные клетки-хозяева - это прокариотические или бактериальные клетки. Бактерии отличаются коротким периодом смены поколений и низкими требованиями к условиям культивирования. Благодаря этому можно создать недорогие способы. Кроме того, в случае бактерий специалисту доступен обширный опыт в технике ферментации. Для конкретного производства по самым различным, в конкретном случае подлежащим экспериментальному определению причинам, как то: источники питательных веществ, скорость формирования продукции, потребность во времени и т.д., могут годиться грамотрицательные или грамположительные бактерии.
У грамотрицательных бактерий, как, например, Escherichia coli, множество полипептидов выделяются в периплазматическое пространство, то есть в компартмент между двумя мембранами, заключающими в себе клетку. Это может быть выгодно для особых вариантов применения. Кроме того, строение грамотрицательных бактерий может быть таким, что они выделяют экспрессированные полипептиды не только в периплазматическое пространство, но и в окружающую бактерию среду. Грамположительные бактерии, как, например, Bacilli, или актиномицеты, или другие представители Actinomycetales, напротив, не имеют внешней мембраны, так что секретированные белки сразу же выделяются в окружающую бактерии среду, как правило - в питательную среду, из которой экспрессированные полипептиды можно выделить очисткой. Их можно непосредственно изолировать из среды или подвергнуть дальнейшей обработке (процессингу). Кроме того, грамположительные бактерии находятся в родстве или идентичны с большинством организмов, из которых происходят ферменты, важные в техническом отношении, и они по большей части сами вырабатывают сравнимые ферменты, так что они соответствующим образом используют колоны, а аппарат синтеза белка у них естественным образом оснащен соответственно.
Под использованием кодонов подразумевают «перевод» генетического кода в аминокислоты, то есть какая последовательность нуклеотидов (триплет или триплет оснований) кодирует какую аминокислоту, либо же какую функцию, например, начало и конец подлежащего трансляции участка, точки присоединения для различных белков и т.д. Так, каждый организм, в особенности каждый производственный штамм, обладает определенным использованием кодонов. Если для кодонов, находящихся на трансгенной нуклеиновой кислоте, в клетке-хозяине имеется сравнительно малое количество загруженных тРНК, то возможны задержки в биосинтезе белка. Напротив, синонимичные кодоны кодируют одни и те же аминокислоты и в зависимости от хозяина возможна их лучшая трансляция. Таким образом, это возможно необходимое переписывание зависит от выбора экспрессионной системы. Соответствующая настройка может быть необходима, в частности, в случае проб из неизвестных, возможно, непригодных к культивированию организмов.
Настоящее изобретение в принципе применимо ко всем микроорганизмам, в особенности ко всем пригодным к ферментации микроорганизмам, особо предпочтительно к таковым рода Bacillus, и ведет к тому, что благодаря применению таких микроорганизмов в качестве производящих микроорганизмов можно реализовать повышенный выход продукта в ферментации. Такие микроорганизмы представляют собой предпочтительные клетки-хозяева в смысле изобретения.
Поэтому еще в одной форме исполнения изобретения клетка-хозяин отличается тем, что она представляет собой бактерию, предпочтительно выбранную из группы родов Escherichia, Klebsiella, Bacillus, Staphylococcus, Corynebakterium, Arthrobacter, Streptomyces, Stenotrophomonas und Pseudomonas, далее предпочтительно таковую, выбранную из Escherichia coli, Klebsiella planticola, Bacillus licheniformis, Bacillus lentus, Bacillus amyloliquefaciens, Bacillus subtilis, Bacillus alcalophilus, Bacillus globigii, Bacillus gibsonii, Bacillus clausii, Bacillus halodurans, Bacillus pumilus, Staphylococcus carnosus, Corynebacterium glutamicum, Arthrobacter oxidans, Streptomyces lividans, Streptomyces coelicolor и Stenotrophomonas maltophilia. Крайне предпочтительна Bacillus licheniformis.
Клетка-хозяин может, однако, также представлять собой эукариотическую клетку, которая отличается тем, что обладает клеточным ядром. Поэтому еще одним объектом изобретения является клетка-хозяин, которая отличается тем, что обладает клеточным ядром.
В противоположность прокариотическим клеткам эукариотические клетки в состоянии подвергать образовавшийся белок посттрансляционной модификации. Примеры их - это грибы, например, актиномицеты, или дрожжи, например, Saccharomyces или Kluyveromyces. Это может быть особенно целесообразно, например, тогда, когда белки в связи с их синтезом должны подвергнуться специфическим модификациям, возможность которых дают подобные системы. К модификациям, которые осуществляют эукариотические системы, в особенности в контексте синтеза белков, относятся, например, связывание с низкомолекулярными соединениями, как то: мембраносвязывающие фрагменты («мембранные якори») или олигосахариды. Подобная модификация олигосахаридами может быть желательна, например, для снижения аллергенности экспрессированного белка. Может быть также выгодна совместная экспрессия с ферментами, синтезируемыми в таких клетках естественным путем, как, например, целлюлазами. Кроме того, например, термофильные грибковые экспрессионные системы могут быть особо удобны для экспрессии вариантов, устойчивых к температуре.
В рамках изобретения в качестве продуктов, которые образуются во время ферментации, рассматривают белки, кодируемые последовательностью нуклеиновой кислоты (b) в особенности такие, которые описаны выше. При этом предпочтительно, чтобы они представляли собой ферменты, особо предпочтительно протеазы, а крайне предпочтительно - субтилизин.
Кроме того, клетки-хозяева могут быть изменены в том, что касается их требований к условиям культуры, иметь другие или дополнительные селекционные маркеры или экспрессировать другие или дополнительные белки. В частности, речь может идти о таких клетках-хозяевах, которые экспрессируют несколько белков или ферментов. Предпочтительно, чтобы эти клетки выделяли их в среду, окружающую клетки-хозяева.
Клетки-хозяева согласно изобретению культивируют и ферментируют известным как таковой способом, например, в системах с прерывистой или непрерывной работой. В первом случае в подходящую питательную среду вводят клетки-хозяева (прививают), а продукт отбирают из среды по прошествии периода, который следует определить экспериментально. Непрерывные процессы ферментации отличаются достижением динамического равновесия, при котором на протяжении сравнительно долгого времени клетки частично отмирают, но также и нарастают, а в то же время из среды можно отбирать продукт.
Клетки-хозяева согласно изобретению предпочтительно применяют, чтобы синтезировать белки, которые кодируются последовательностью нуклеиновой кислоты (b). Поэтому еще один объект изобретения - это способ получения белка, включающий в себя
a) культивирование клетки-хозяина согласно изобретению;
b) выделение белка из культурной среды или из клетки-хозяина.
Этот объект изобретения предпочтительно включает в себя способы ферментации. Способы ферментации как таковые известны на нынешнем техническом уровне и представляют собой собственно этап промышленного производства, за которым, как правило, следует надлежащая методика очистки синтезированного продукта, например, белка. Все способы ферментации, имеющие в основе соответствующий способ получения белка, представляют собой формы исполнения этого объекта изобретения.
При этом в каждом случае оптимальные условия для процесса синтеза, в особенности оптимальные условия в культуре для используемых клеток-хозяев, необходимо определять экспериментально в соответствии со знаниями специалиста, например, в том, что касается объема ферментации, и/или состава среды, и/или снабжения кислородом, и/или скорости мешалки.
В особенности целесообразно использовать методы ферментации, которые отличаются тем, что тактика ферментации основана на добавлении (подаче). При этом компоненты среды, которые расходуются в силу продолжающейся культивации, добавляют; также это называют стратегией подкормки. Посредством этого можно добиться существенного повышения как плотности клеток, так и клеточной массы либо же сухой массы и/или прежде всего активности представляющего интерес белка, предпочтительно фермента.
Кроме того, ферментацию можно устроить и так, чтобы отделять фильтрацией нежелательные продукты обмена веществ или же путем добавления буфера в каждом случае нейтрализовывать подходящие противоионы.
Синтезированный белок можно извлекать из ферментационной среды. Такой способ ферментации более выгоден, чем изоляция полипептида из клетки-хозяина, то есть дополнительной обработки, выделяющей продукт из клеточной массы (сухой массы). В связи с этим согласно изобретению сигнальные пептиды предоставляют подходящие маркеры секреции.
Все изложенные выше обстоятельства можно скомбинировать в способы для синтез белков. В связи с этим существует множество вариантов того, как комбинировать этапы процессов. Для каждого отдельного конкретного случая следует определять оптимальный способ.
Еще один объект изобретения - это применение экспрессионного вектора согласно изобретению или клетки-хозяина согласно изобретению для синтеза белка.
Все обстоятельства, объекты и формы исполнения, которые уже описаны выше, применимы и к этим объектам изобретения. Поэтом здесь в явном виде дана ссылка на раскрытие в соответствующем месте с указанием, что это раскрытие справедливо также для применений согласно изобретению (применение вектора либо же клетки-хозяина).
Примеры:
Все этапы молекулярно-биологических процедур следуют стандартным методикам, как это описано, например, в руководстве Fritsch, Sambrook и Maniatis "Molecular cloning: a laboratory manual", Cold Spring Harbour Laboratory Press, New York, 1989, или сравнимых специальных работах. Ферменты и наборы применяли в соответствии с данными соответствующих производителей.
Пример 1: Изготовление экспрессионных векторов согласно изобретению
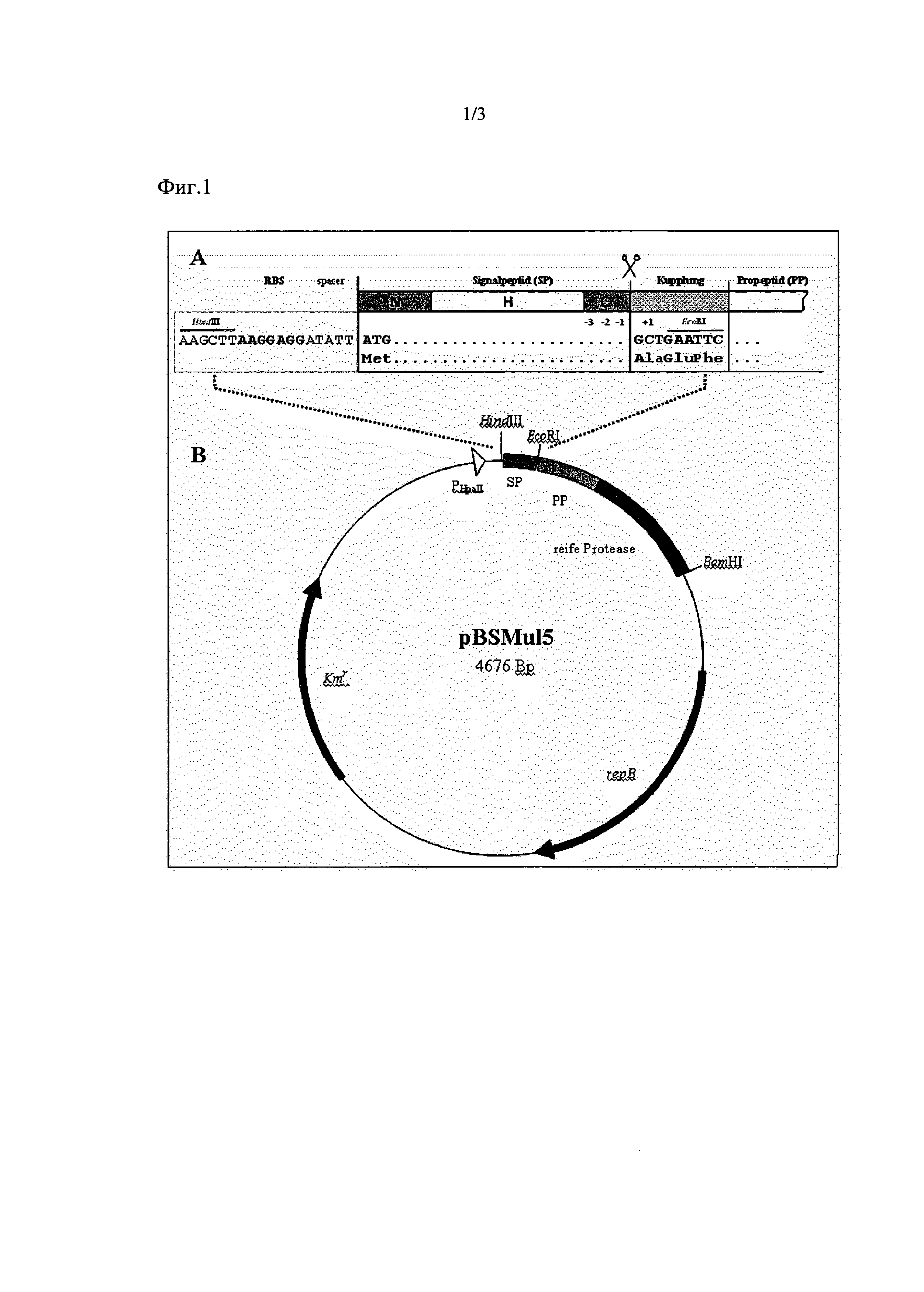
Плазмид pBSMuL3 (Brockmeier et al., 2006) посредством рестрикции SacI и последующей религации укоротили на долю E. coli. Полученный плазмид pBSMuL5 (смотрите Фиг. 1) служил вектором для клонирования протеаз, включая пропептид на сайтах EcoRI и BamHI. Для этого гены протеазы, соответствующие SEQ ID NO. 8, амплифицировали с праймерами согласно SEQ ID NO. 11 и SEQ ID NO. 12, а [гены] щелочной протеазы, соответствующие SEQ ID NO. 9, - с праймерами согласно SEQ ID NO. 13 и SEQ ID NO. 14. Полученные в итоге плазмиды служили векторами для клонирования сигнальных пептидов в сайты HindIII и EcoRI. Фрагмент ДНК контрольного сигнального пептида SubC (В. licheniformis, NCBI ("National Center for Biotechnology Information") № доступа ("Accession Number"): X91260.1) в качестве эталона сравнения (Benchmark) амплифицировали с помощью праймеров согласно SEQ ID NO. 15 и SEQ ID NO. 16 и в каждом случае клонировали в сайты HindIII и EcoRI плазмидов, так что образовались плазмиды с последовательностью нуклеиновой кислоты b), которые кодируют белок с сигнальным пептидом SubC в сочетании с протеазой согласно SEQ ID NO. 8 (плазмид 1) либо же согласно SEQ ID NO. 9 (плазмид 2). В дальнейшем эти плазмиды служили контрольными либо же эталонными (Benchmark). Фрагмент ДНК сигнального пептида, соответствующего SEQ ID NO. 2, амплифицировали с помощью праймеров согласно SEQ ID NO. 19 и SEQ ID NO. 20, Фрагмент ДНК сигнального пептида, соответствующего SEQ ID NO., - с помощью праймеров согласно SEQ ID NO. 17 и SEQ ID NO. 18, Фрагмент ДНК сигнального пептида, соответствующего SEQ ID NO. 6, - с помощью праймеров согласно SEQ ID NO. 21 и SEQ ID NO. 22. В то время как фрагменты ДНК сигнальных пептидов, соответствующих SEQ ID NO. 2 и SEQ ID NO. 4 в каждом случае клонировали в вектор, который кодирует протеазу в соответствии с SEQ ID NO. 8 (плазмиды 3 и 4), фрагмент ДНК сигнального пептида согласно SEQ ID NO. 6 ввели в вектор, который кодирует протеазу, соответствующую SEQ ID NO. 9 (плазмид 5). Ввиду особенностей клонирования при этом между последовательностью ДНК каждого конкретного сигнального пептида и последовательностью ДНК пропептида каждой конкретной протеазы ввели последовательность из 9 нуклеотидов, которая кодирует аминокислотную последовательность AEF (смотрите Фиг. 1). Эта так называемая соединительная последовательность содержит последовательность распознавания рестрикционной эндонуклеазы EcoRI.
Все олигонуклеотиды, применяемые в качестве праймеров, перечислены в нижеследующей таблице 1.
|
Пример 2: Экспрессия белков
Штамм Bacillus licheniformis трансформировали плазмидами 1-5, чтобы получить различные производящие протеазу штаммы. Для инокуляции культур применяли отдельные колонии с агаровых пластин, которые инкубировали на протяжении ночи. Для количественного определения эффективности (производительности) секреции отдельные колонии непосредственно переносили с агаровой пластины на Deepwell-МТР (микротитровальную пластину, 96 ячеек, в каждой 1 мл селективной среды LB). При этом каждую отдельную колонию параллельно переносили по меньшей мере в две ячейки, чтобы путем многократного выращивания данного конкретного клона получить возможность двойного или тройного определения. Для прививки Deepwell-МТР применяли исключительно клоны, которые инкубировали на протяжении ночи при 37°С. После выращивания в течение 20 ч при 37°С во встряхивающем устройстве для микротитровальных пластин (Timix 5, фирма Edmund-Bühler, Хехинген) все клоны реплицировали на LB-агаровых пластинах, а затем провели осаждение клеток центрифугированием (4000 об/мин, 20 мин, 4°С). Все последующие шаги работы с микропипетками проводили с помощью многоканальных пипеток (Eppendorf, Гамбург), причем использовали режим "reverse pipetting", а объемы не были менее 15 мкл. В микротитровальную пластину в каждом случае помещали минимальный объем, а добавляли большие объемы, и на каждом шаге разбавления МТР перемешивали в спектрофтометре "Spektramax 250" (Molecular Devices, Саннивэйл, США) в течение 10 секунд. Для создания соответствующего разведения культуру отбирали многоканальной пипеткой и переносили в микротитровальные пластины (96 ячеек, плоское дно, прозрачные, фирма Greiner Bio-One, Фрикенхаузен).
Затем в культурах или разведениях определяли протеолитическую активность по высвобождению хромофора пара-нитроанилина (pNA) из субстрата сук-L-Ala-L-Ala-L-Pro-L-Phe-пара-нитроанилида (suc-AAPF-pNA). Протеаза расщепляет субстрат и высвобождает pNA. Высвобождение pNA вызывает повышение экстинкции при 410 нм, изменение которой со временем представляет собой меру ферментативной активности (ср. Del Mar et al., Anal. Biochem., 99: 316-320, 1979).
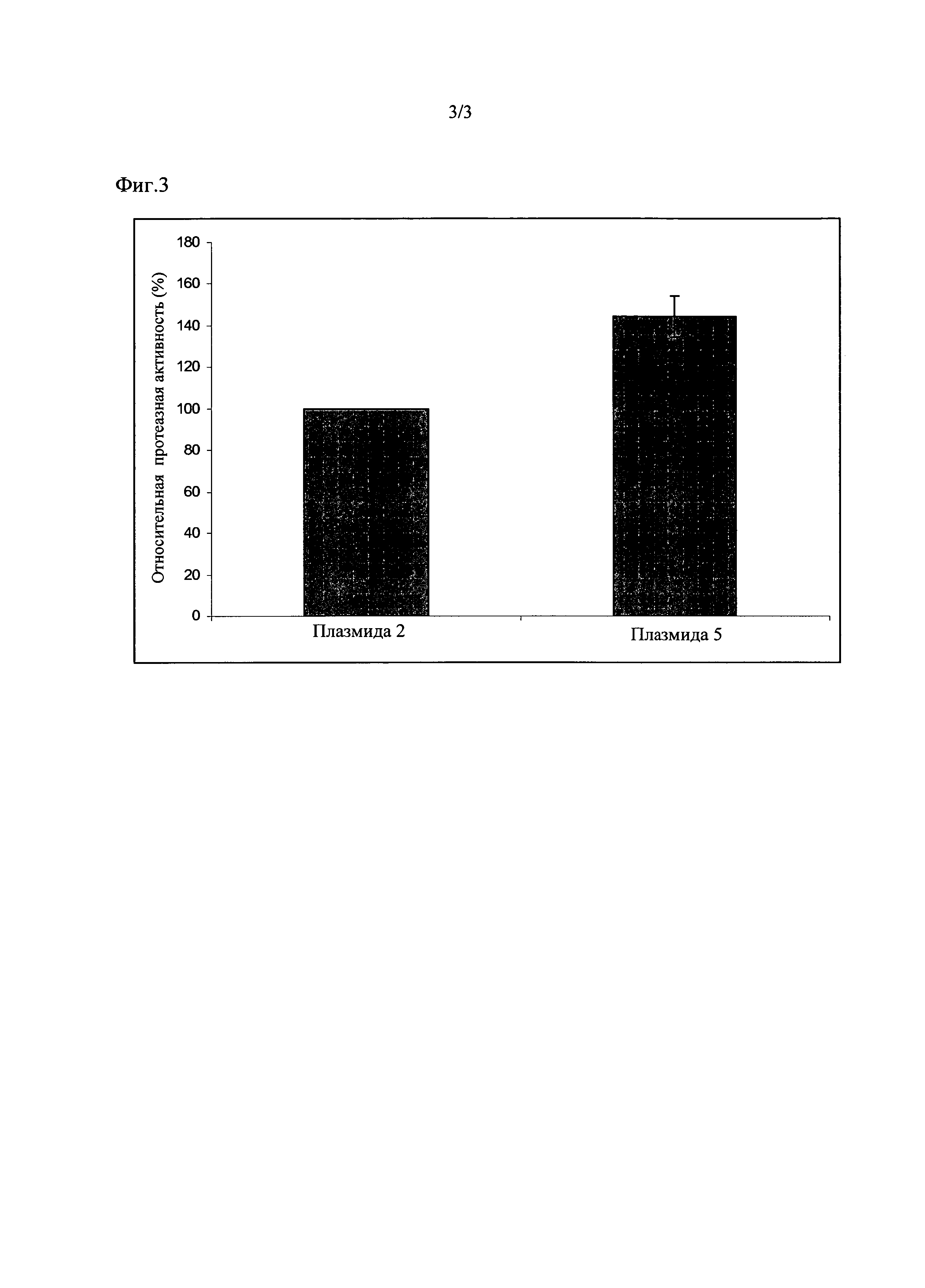
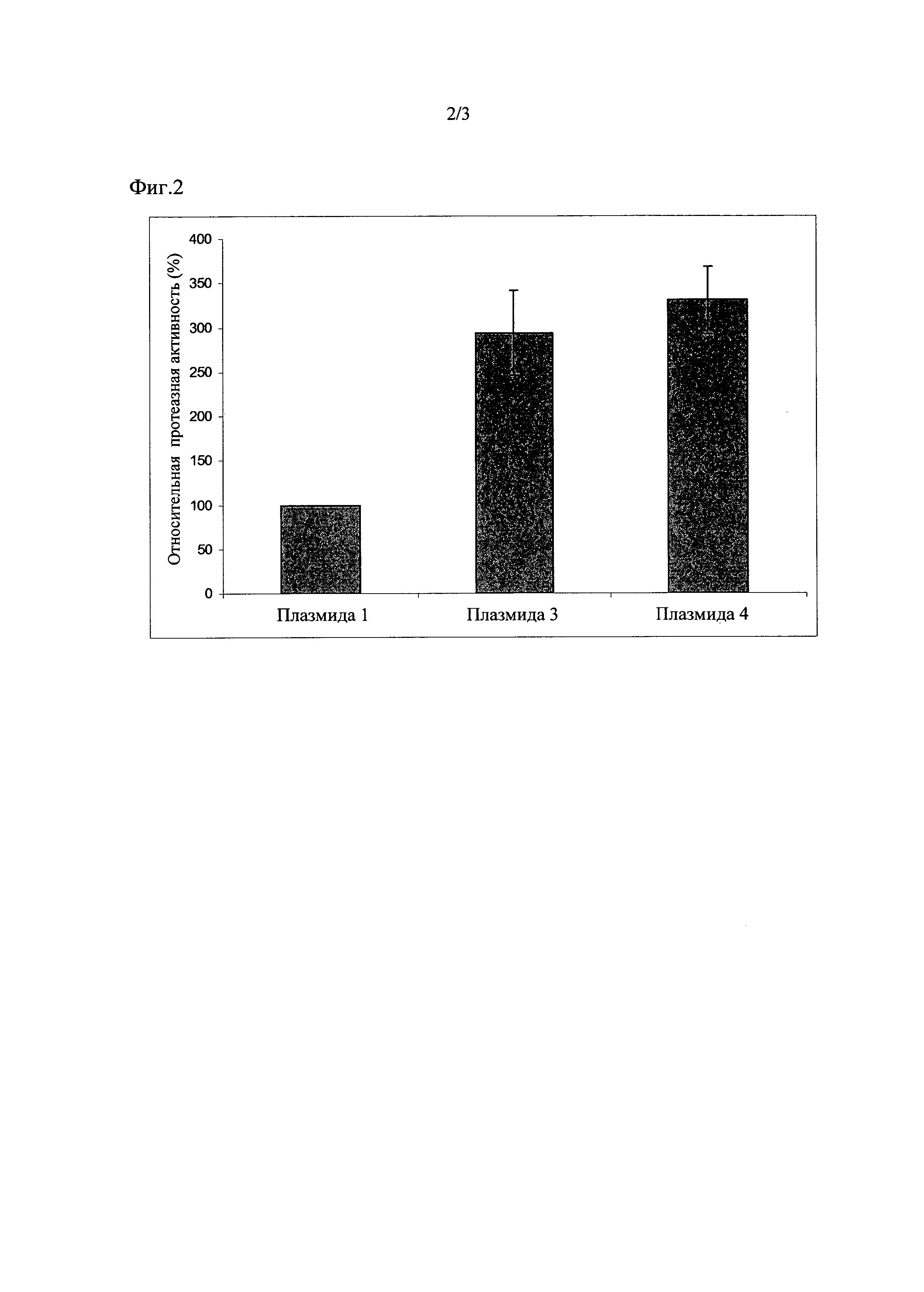
Для определения эффективности секреции различных штаммов при выращивании в каждой МТР также растили внутреннюю контрольную конструкцию - плазмид 1 или плазмид 2. Определенную в супернатанте культуры протеолитическую активность штаммов с контрольной конструкцией приравнивали к 100%.
Штаммы с плазмидами 3 и 4 согласно изобретению проявили протеазную активность, повышенную по сравнению с контролем, который содержал плазмид 1, на 194% +/- 48 либо на 230% +/- 38, соответственно (смотрите Фиг. 2).
Штамм с плазмидом 5 согласно изобретению проявил протеазную активность, повышенную по сравнению с контролем, который содержал плазмид 2, на 44% +/- 10 (смотрите Фиг. 3).
Описание чертежей
|
|