Результат интеллектуальной деятельности: Способ получения производных 5Н-фуро[3,2-c]изохромен-5-она
Вид РИД
Изобретение
Предлагаемое изобретение относится к органической химии, а точнее к способам получения новых гетероциклических соединений ряда изохроменона, которые могут представлять интерес как полупродукты для синтеза биологически активных соединений.
Известен способ получения 5Н-бензофуро[3,2-с]изохромен-5-она II путем циклизации 2-(бензофуран-2-ил)бензойной кислоты под действием 10 мол.% ацетата палладия в присутствии 20 мол.% N-ацетилглицина, иодбензола диацетата и ацетата калия в среде трет-бутанола в соответствии со схемой:
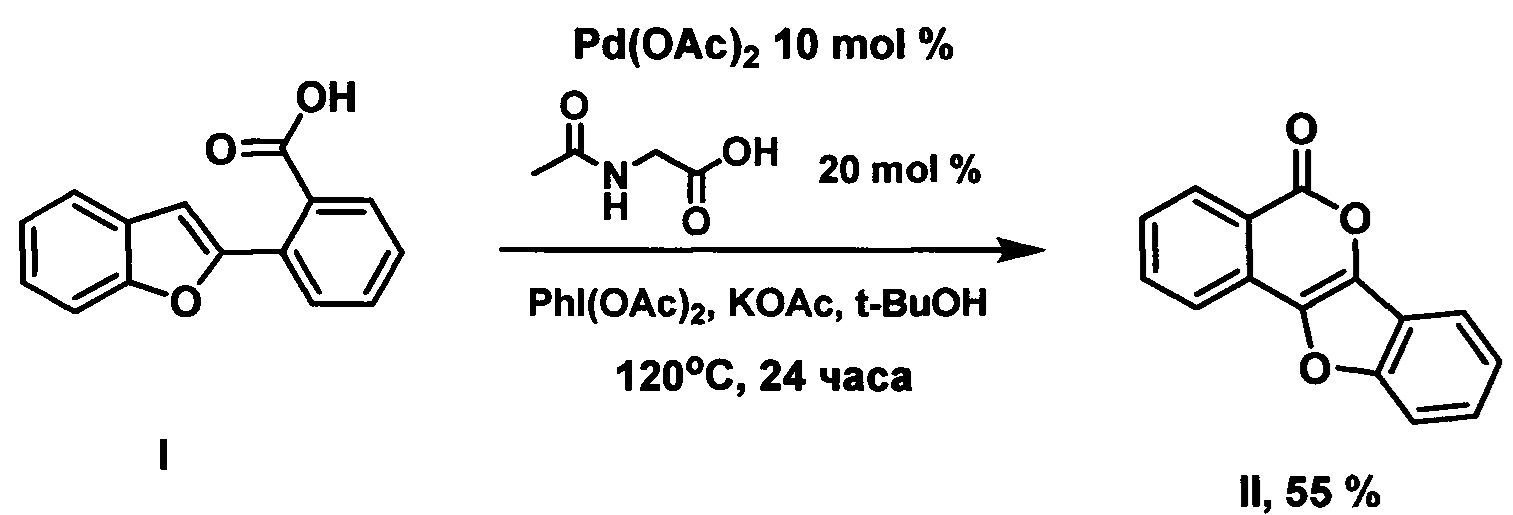
(Патент CN 104370930 C07D 493/04 (2006.01), C07D 495/14 (2006.01), C07D 333/78(2006.01)).
Реакция протекает в достаточно жестких условиях - требуется нагревание при 120°С в течение суток, а учитывая, что температура кипения трет-бутанола 82°С, необходимо использовать оборудование для работы под повышенным давлением. Кроме того, способ реализован на единственном примере.
Наиболее близким к заявляемому является способ получения 5Н-бензофуро[3,2-с]изохромен-5-онов из нингидрина и фенолов, который реализуется в соответствии со схемой:
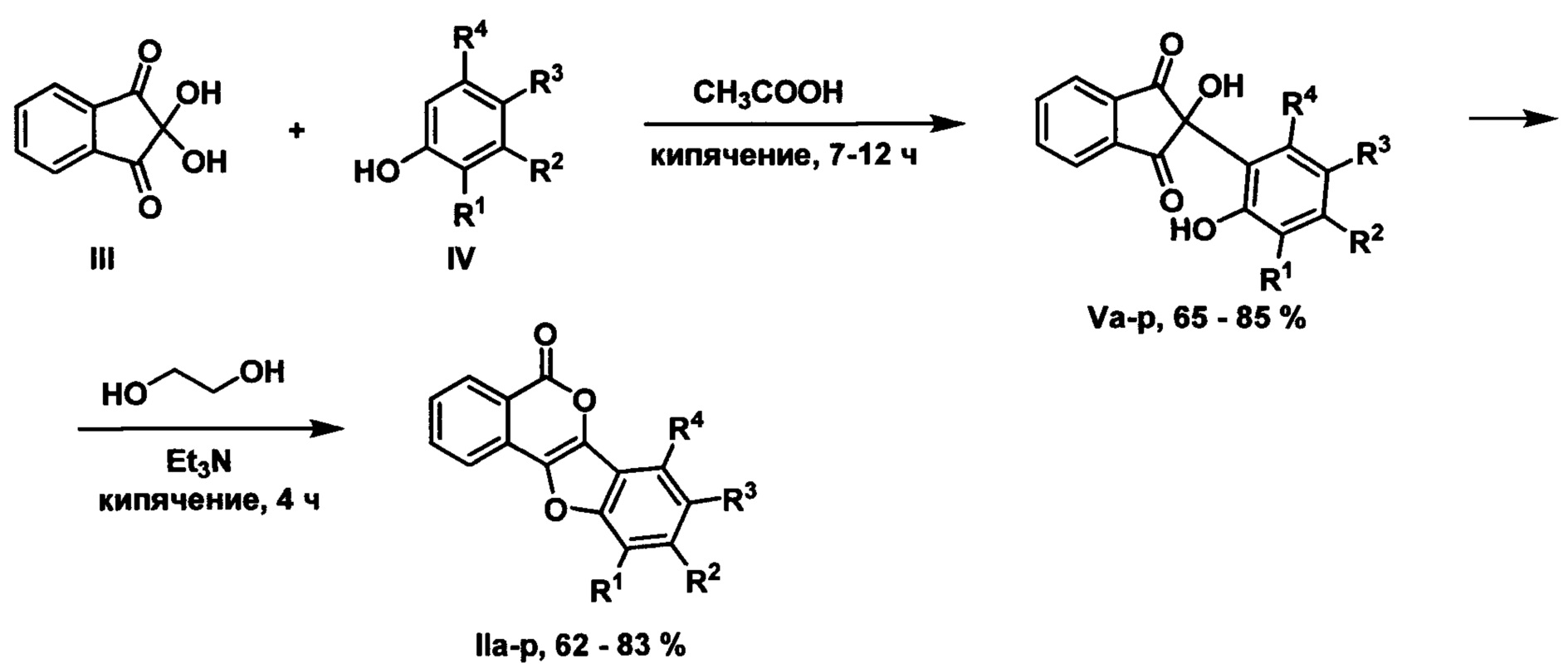
(Suven Das, Roland Frohlich, Animesh Pramanik. A Facile Synthesis of Benzofuroisocoumarins from C-2 Arylated 1.3-Indanediones. Synlett 2006, №2, pp. 207-210).
На первой стадии получают 2-гидрокси-2-(2'-гидроксиарил)-1,3-индандионы кипячением нингидрина III с трехкратным мольным избытком фенола IV в уксусной кислоте, которые далее циклизуют в 5Н-бензофуро[3,2-с]изохромен-5-оны при кипячении в этиленгликоле в присутствии триэтиламина.
Данный способ ограничивается получением соединений, содержащих 5Н-фуро[3,2-с]изохромен-5-оновый фрагмент, в котором фурановое кольцо аннелировано к арильному кольцу.
В то же время интерес могут представлять соединения, в которых фуро[3,2-с]изохромен-5-оновый фрагмент содержит во втором положении фуранового кольца какой-либо заместитель, а в третьем положении водород. Однако данные о способах получения такого типа соединений отсутствуют. Подобного типа соединения встречаются в природе и проявляют ряд практически значимых свойств, например, обладающий гербицидными и инсектицидными свойствами моноцерин VI был выделен из ряда грибков, например Dreschlera monoceras, D. Revenelli, Exserohilum turcicum, Fusarium larvarum.
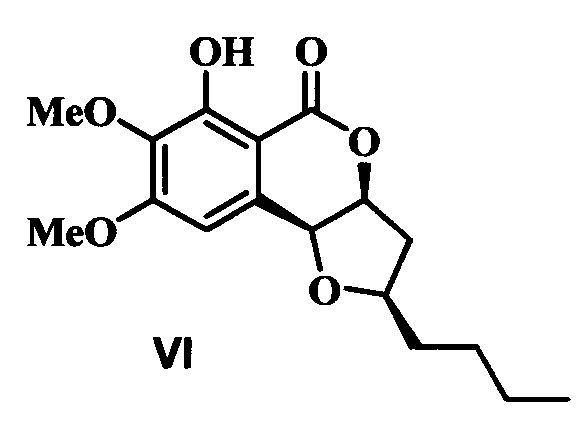
Задача изобретения - разработка эффективного способа получения производных 5Н-фуро[3,2-с]изохромен-5-она, которые могут представлять интерес в качестве аналогов биологически активных веществ.
Техническим результатом является создание простого и эффективного способа получения производных 5Н-фуро[3,2-с]изохромен-5-она с использованием коммерчески доступных соединений, позволяющих варьировать заместитель в положении 2 фуранового кольца.
Технический результат достигается проведением реакции нингидрина с 1-алкинами в присутствии 1 мол.% трифлата скандия при кипячении в среде 1,2-дихлорэтана в соответствии со схемой:
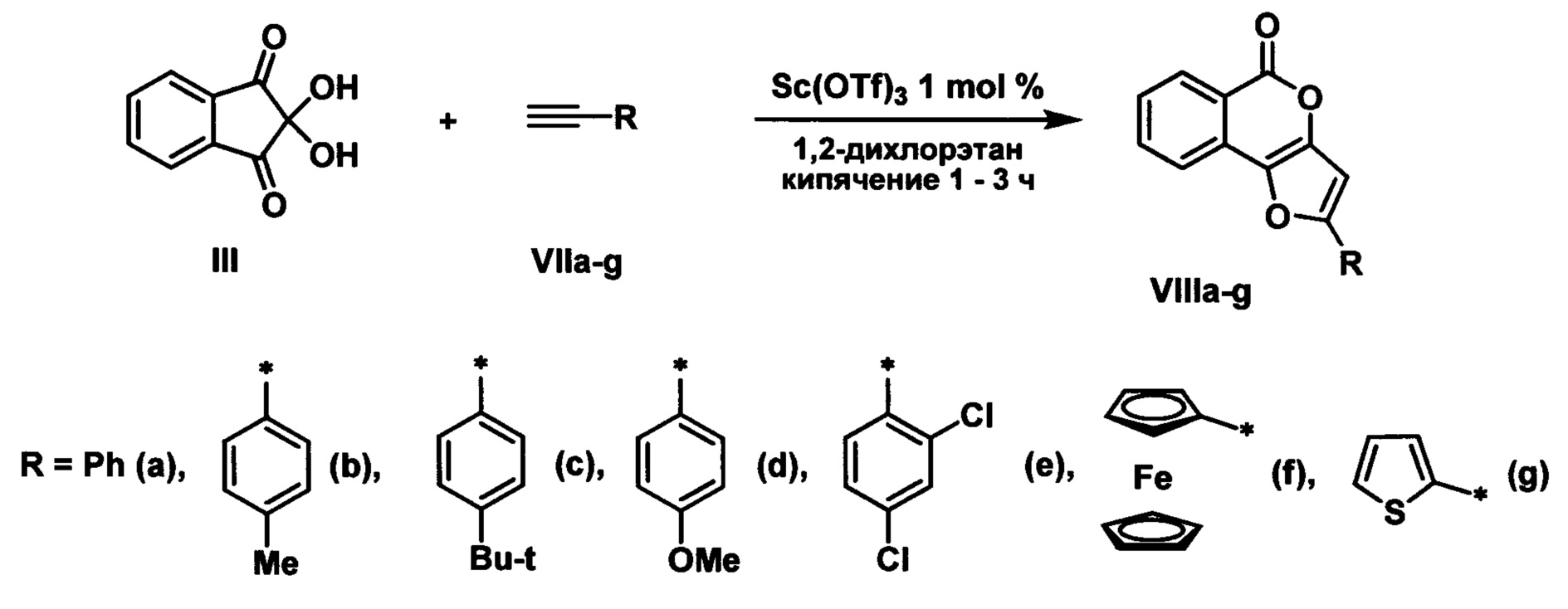
Выбор оптимальных условий получения производных 5Н-фуро[3,2-с]изохромен-5-она с заместителем в положении 2 фуранового кольца проводили на модельной реакции нингидрина с фенилацетиленом, ход которой контролировали тонкослойной хроматографией.
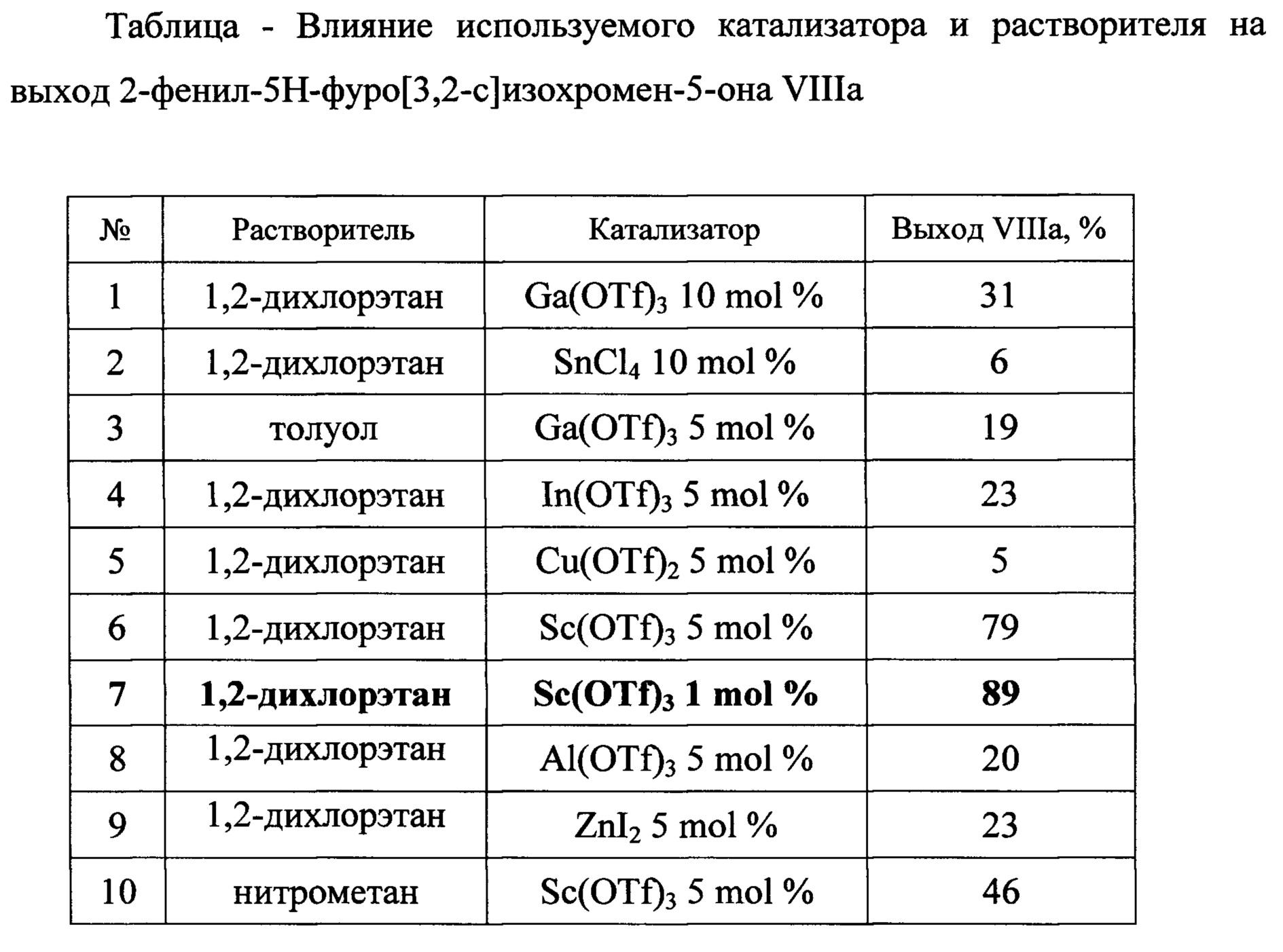
Как видно из данных таблицы, наилучшую активность в качестве катализатора показал трифлат скандия, использованный в количестве 1 мол.% в среде 1,2-дихлорэтана.
Экспериментально было выявлено, что время реакции зависит от природы 1-алкина и составляет от 1 до 3 часов и отражено в примерах конкретного выполнения.
Пример получения 2-фенил-5Н-фуро[3,2-с]изохромен-5-она VIIIa
В круглодонную колбу, снабженную обратным холодильником и магнитным перемешивающим элементом, помещают 75 мл 1,2-дихлорэтана, 3 г (0,0168 моль) нингидрина, 0,083 г (0,000168 моль) трифлата скандия и кипятят 15 минут. Затем прибавляют 1,72 г (0,0168 моль) фенилацетилена и продолжают нагревать при кипении реакционной массы 1 час. После охлаждения реакционной массы до комнатной температуры ее переносят в делительную воронку, содержащую 100 мл 2 М соляной кислоты, и экстрагируют этилацетатом 3 раза по 50 мл. Объединенные экстракты упаривают, остаток перекристаллизовывают из этанола. Выход 89%.
ИК-спектр (KBr), ν/см-1: 3111, 3068, 3034 (Csp2-H), 1730, 1722 (С=O), 1641, 1506 (Csp2-Csp2).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 262 (71, М+), 206 (10), 132 (18), 104 (100).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 6.78 (с., 1Н, СН), 7.31-7.38 (м, 1H, СН), 7.39-7.48 (м, 3Н, СН), 7.71-7.78 (м, 4Н, СН), 8.29 (д, 8 Гц, 1Н, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 97.9 (СН), 117.9 (С), 118.3 (СН), 124.2 (СН), 126.9 (СН), 128.9 (СН), 129.3 (С), 129.6 (С), 131.6 (СН), 133.7 (С), 135.2 (СН), 143.7 (С), 154.7 (С), 161.9 (С).
Пример получения 2-(4-метилфенил)-5Н-фуро[3,2-с]изохромен-5-она VIIIb
В круглодонную колбу, снабженную обратным холодильником и магнитным перемешивающим элементом, помещают 20 мл 1,2-дихлорэтана, 0,3 г (0,00168 моль) нингидрина, 0,008 г (0,0000168 моль) трифлата скандия и кипятят 15 минут. Затем прибавляют 0,195 г (0,00168 моль) 4-этинилтолуола и продолжают нагревать при кипении реакционной массы 1 час. После охлаждения реакционной массы до комнатной температуры ее переносят в делительную воронку, содержащую 50 мл 2 М соляной кислоты, и экстрагируют этилацетатом 3 раза по 20 мл. Объединенные экстракты упаривают, остаток очищают флеш-хроматографией на силикагеле, проводя элюирование хлороформом. Выход 76%.
Желтые кристаллы. Тпл 214-215°С.
ИК-спектр (KBr), ν/см-1: 3138, 3061, 3034 (Csp2-H), 2951, 2916, 2854 (Csp3-H), 1720 (С=O), 1637, 1510 (Csp2-Csp2).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 2.38 (с, 3Н, СН3), 6.72 (с., 1Н, СН), 7.23 (д, 8.1 Гц, 2Н, СН), 7.39-7.43 (м, 1H, СН), 7.63 (д, 8.3 Гц, 2Н, СН), 7.74-7.77 (м, 2Н, СН), 8.28 (д, 8.1 Гц, 1Н, СН).
Спектр ЯМР 13C (CDCl3), δ, м.д.: 21.4 (СН3), 97.2 (СН), 117.8 (С), 118.2 (СН), 124.2 (СН), 126.7 (СН), 126.9 (С), 129.4 (С), 129.6 (С), 131.6 (СН), 133.6 (С), 135.2 (СН), 139.1 (С), 143.9 (С), 155.0 (С), 162.0 (С).
Пример получения 2-(4-трет-бутилфенил)-5Н-фуро[3,2-с]изохромен-5-она VIIIc
В круглодонную колбу, снабженную обратным холодильником и магнитным перемешивающим элементом, помещают 20 мл 1,2-дихлорэтана, 0,3 г (0,00168 моль) нингидрина, 0,008 г (0,0000168 моль) трифлата скандия и кипятят 15 минут. Затем прибавляют 0,266 г (0,00168 моль) 4-трет-бутилфенилацетилена и продолжают нагревать при кипении реакционной массы 1 час. После охлаждения реакционной массы до комнатной температуры ее переносят в делительную воронку, содержащую 50 мл 2 М соляной кислоты, и экстрагируют этилацетатом 3 раза по 20 мл. Объединенные экстракты упаривают, остаток очищают флеш-хроматографией на силикагеле, проводя элюирование хлороформом. Выход 78%.
Желтые кристаллы. Тпл 191-192°С.
ИК-спектр (KBr), ν/см-1: 3111, 3057, 3035 (Csp2-H), 2964, 2953, 2902, 2866 (Csp3-H), 1735 (С=O), 1633, 1508 (Csp2-Csp2).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 1.36 (с, 9Н, СН3), 6.75 (с., 1Н, СН), 7.38-7.44 (м, 1Н, СН), 7.45-7.50 (м, 2Н, СН), 7.68-7.71 (м, 2Н, СН), 7.74-7.79 (м, 2Н, СН), 8.27-8.33 (м, 1Н, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 31.2 (СН3), 34.8 (С), 97.3 (СН), 117.8 (С), 118.3 (СН), 124.1 (СН), 125.9 (СН), 126.7 (СН), 126.9 (С), 129.4 (С), 131.6 (СН), 133.5 (С), 135.2 (СН), 143.9 (С), 152.3 (С), 155.0 (С), 162.0 (С).
Пример получения 2-(4-метоксифенил)-5Н-фуро[3,2-с]изохромен-5-она VIIId
В круглодонную колбу, снабженную обратным холодильником и магнитным перемешивающим элементом, помещают 20 мл 1,2-дихлорэтана, 0,3 г (0,00168 моль) нингидрина, 0,008 г (0,0000168 моль) трифлата скандия и кипятят 15 минут. Затем прибавляют 0,222 г (0,00168 моль) 4-этиниланизола и продолжают нагревать при кипении реакционной массы 1 час. После охлаждения реакционной массы до комнатной температуры ее переносят в делительную воронку, содержащую 50 мл 2 М соляной кислоты, и экстрагируют этилацетатом 3 раза по 20 мл. Объединенные экстракты упаривают, остаток очищают флеш-хроматографией на силикагеле, проводя элюирование хлороформом. Выход 72%.
Желтые кристаллы. Тпл 178°С.
ИК-спектр (KBr), ν/см-1: 3128, 3078, 3051, 3034 (Csp2-H), 2987, 2974, 2945, 2918 (Csp3-H), 1743 (С=O), 1637, 1508 (Csp2-Csp2).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 3.86 (с, 3Н, СН3), 6.65 (с., 1Н, СН), 6.94-6.97 (м, 2Н, СН), 7.38-7.42 (м, 1Н, СН), 7.66-7.71 (м, 2Н, СН), 7.72-7.76 (м, 2Н, СН), 8.25-8.31 (м, 1Н, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 55.4 (СН3), 96.4 (СН), 114.4 (СН), 117.6 (С), 118.1 (СН), 122.5 (С), 125.8 (СН), 126.5 (СН), 129.4 (С), 131.6 (СН), 133.1 (С), 135.2 (СН), 144.0 (С), 154.9 (С), 160.2 (С), 162.0 (С).
Пример получения 2-(2,4-дихлорфенил)-5Н-фуро[3,2-с]изохромен-5-она VIIIe
В круглодонную колбу, снабженную обратным холодильником и магнитным перемешивающим элементом, помещают 20 мл 1,2-дихлорэтана, 0,3 г (0,00168 моль) нингидрина, 0,008 г (0,0000168 моль) трифлата скандия и кипятят 15 минут. Затем прибавляют 0,287 г (0,00168 моль) 2,4-дихлорфенилацетилена и продолжают нагревать при кипении реакционной массы 3 часа. После охлаждения реакционной массы до комнатной температуры ее переносят в делительную воронку, содержащую 50 мл 2 М соляной кислоты, и экстрагируют этилацетатом 3 раза по 20 мл. Объединенные экстракты упаривают, остаток очищают флеш-хроматографией на силикагеле, проводя элюирование хлороформом. Выход 83%.
Желтые кристаллы. Тпл 194-195°С.
ИК-спектр (KBr), ν/см-1: 3145, 3068, 3055, 3032 (Csp2-H), 1732 (C=O), 1637, 1502 (Csp2-Csp2).
Спектр ЯМР 1H (399.78 МГц, CDCl3, δ, м.д.): 7.27 (с., 1Н, СН), 7.33-7.38 (м, 1H, СН), 7.44-7.51 (м, 2Н, СН), 7.74-7.83 (м, 2Н, СН), 7.90 (д, 1Н, СН), 8.28-8.34 (м, 1Н, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 103.7 (СН), 118.6 (СН), 126.6 (С), 127.5 (СН), 127.5 (СН), 128.6 (СН), 128.8 (С), 130.8 (СН), 131.1 (С), 131.7 (СН), 133.8 (С), 134.6 (С), 135.3 (СН), 143.2 (С), 149.7 (С), 161.6 (С).
Пример получения 2-ферроценил-5Н-фуро[3,2-с]изохромен-5-она VIIIf
В круглодонную колбу, снабженную обратным холодильником и магнитным перемешивающим элементом, помещают 20 мл 1,2-дихлорэтана, 0,3 г (0,00168 моль) нингидрина, 0,008 г (0,0000168 моль) трифлата скандия и кипятят 15 минут. Затем прибавляют 0,352 г (0,00168 моль) этинилферроцена и продолжают нагревать при кипении реакционной массы 1 час. После охлаждения реакционной массы до комнатной температуры ее переносят в делительную воронку, содержащую 50 мл 2 М соляной кислоты, и экстрагируют этилацетатом 3 раза по 30 мл. Объединенные экстракты упаривают, остаток очищают флеш-хроматографией на силикагеле, проводя элюирование дихлорметаном. Выход 73%.
Оранжевые кристаллы. Тпл 200-203°С.
ИК-спектр (KBr), ν/см-1: 3142, 3111, 3082, 3068 (Csp2-H), 1724 (С=O), 1635, 1504 (Csp2-Csp2).
Спектр ЯМР 1Н (600.13 МГц, CDCl3, δ, м.д.): 4.23 (уш.с, 5Н, СН), 4.50 (уш.с, 2Н, СН), 4.85 (уш.с, 2Н, СН), 6.33 (с, 1H, СН), 7.37 (уш. с, 1Н, СН), 7.67-7.80 (м, 2Н, СН), 8.29 (уш. с, 1Н, СН).
Спектр ЯМР 13С (150.90 МГц CDCl3), δ, м.д.: 66.2 (СН), 70.3 (С), 70.6 (СН), 117.4 (С), 118.3 (СН), 126.4 (СН), 129.1 (С), 131.5 (СН), 133.2 (С), 135.0 (СН), 143.7 (С), 156.4 (С), 162.1 (С).
Пример получения 2-(2-тиенил)-5Н-фуро[3,2-с]изохромен-5-она VIIIg
В круглодонную колбу, снабженную обратным холодильником и магнитным перемешивающим элементом, помещают 20 мл 1,2-дихлорэтана, 0,3 г (0,00168 моль) нингидрина, 0,008 г (0,0000168 моль) трифлата скандия и кипятят 15 минут. Затем прибавляют 0,182 г (0,00168 моль) 2-этинилтиофена и продолжают нагревать при кипении реакционной массы 1 час. После охлаждения реакционной массы до комнатной температуры ее переносят в делительную воронку, содержащую 50 мл 2 М соляной кислоты, и экстрагируют этилацетатом 3 раза по 20 мл. Объединенные экстракты упаривают, остаток очищают флеш-хроматографией на силикагеле, проводя элюирование хлороформом. Выход 67%.
Желтые кристаллы. Тпл 182-183°С.
ИК-спектр (KBr), ν/см-1: 3126, 3109 (Csp2-H), 1749 (С=О), 1637, 1510 (Csp2-Csp2).
Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 268 (100, М+), 239 (8), 212 (27), 184 (11), 132 (13), 104 (71).
Спектр ЯМР 1Н (399.78 МГц, CDCl3, δ, м.д.): 6.66 (с., 1H, СН), 7.09-7.12 (м, 1Н, СН), 7.33-7.38 (м, 1Н, СН), 7.41-7.46 (м, 2Н, СН), 7.75-7.79 (м, 2Н, СН), 8.28-8.32 (м, 1Н, СН).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 97.7 (СН), 117.9 (С), 118.4 (СН), 124.6 (СН), 126.2 (СН), 126.9 (СН), 128.1 (СН), 129.2 (С), 131.6 (СН), 132.4 (С), 133.3 (С), 135.3 (СН), 143.6 (С), 150.4 (С), 161.8 (С).
Таким образом, взаимодействие нингидрина с 1-алкинами в присутствии 1 мол.% трифлата скандия в среде 1,2-дихлорэтана обеспечивает получение новых целевых производных 5Н-фуро[3,2-с]изохромен-5-она с хорошим выходом, при этом используют коммерчески доступные реагенты, что делает способ промышленно применимым.
![Способ получения производных 5Н-фуро[3,2-c]изохромен-5-она](https://fips.edrid.ru/images/rid/f2/88/a0/8eeb5fdacc3c1922dbff641edad6a8a4.jpg)
![Способ получения производных 5Н-фуро[3,2-c]изохромен-5-она](https://fips.edrid.ru/images/rid/f2/88/a0/02f805b88813fef54a0ab59f1bd64714.jpg)

