Результат интеллектуальной деятельности: НОВЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛИДИН-2,4-ДИОНА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Предметом настоящей заявки являются новые производные имидазолидин-2,4-диона. Данные продукты имеют антипролиферативное действие. Они особенно полезны для лечения патологических состояний и заболеваний, связанных с атипичной клеточной пролиферацией, таких как различные виды рака. Изобретение также относится к фармацевтическим составам, содержащим указанные продукты, и их применению для приготовления лекарственного средства.
УРОВЕНЬ ТЕХНИКИ
В настоящее время рак продолжает оставаться одной из главных причин смертности, несмотря на многочисленные соединения на рынке.
Поэтому необходимо определить более сильнодействующие новые молекулы соединений, обеспечивающие лучшее противоопухолевое действие, в особенности с хорошим ингибирующим действием на пролиферацию колоний опухолевых клеток.
Такие молекулы поэтому особенно полезны для лечения патологических состояний, связанных с атипичной клеточной пролиферацией. Поэтому их можно применять для лечения опухолей или различных видов рака, например, пищевода, желудка, кишечника, прямой кишки, полости рта, глотки, гортани, легких, толстой кишки, груди, шейки матки, эндометрия, яичников, предстательной железы, яичек, мочевого пузыря, почек, печени, поджелудочной железы, костей, соединительных тканей, кожи, таких как меланомы, глаз, мозга и центральной нервной системы, а также рака щитовидной железы, лейкемии, болезни Ходжкина, неходжкинских лимфом, множественной миеломы и других видов рака.
Особый интерес представляет поиск методик лечения для гормонально-зависимых видов рака, для опухолей, экспрессирующих андрогеновые рецепторы, для различных видов рака груди и предстательной железы.
Использование антиандрогенов для рака предстательной железы основано на их свойстве вступать в конкуренцию с природными агонистами андрогенового рецептора. Вместе с тем, эффективность данных антиандрогенов оказывается ограниченной с течением времени, пациенты часто устойчивы к лечению. Разработано несколько предположений относительно данного недостатка, показывающих действие агониста вместо действия антагониста данных молекул (Veldscholte J, Berrevoets CA, Brinkmann AO, Grootegoed JA, Mulder E. Biochemistry 1992 Mar 3; 31(8):2393-9). Например, нилутамид способен стимулировать рост культур раковых клеток предстательной железы у человека. В дополнение к данным экспериментальным критериям, клинические данные также подтверждают данное вредное действие антиандрогенов (Akimoto S.; Antiandrogen withdrawal syndrome Nippon Rinsho. 1998 Aug;56(8):2135-9. Paul R, Breul J. Antiandrogen withdrawal syndrome associated with prostate cancer therapies: incidence и clinical significance Drug Saf. 2000 Nov;23(5):381-90). Устойчивость к антиандрогенным методикам лечения может также возникнуть в результате сверхэкспрессии андрогенового рецептора, который затем становится высокочувствительным к низким уровням андрогенов. Другим путем, которым раковые клетки предстательной железы становятся устойчивыми, является возникновение мутаций андрогенового рецептора, который становится восприимчивым к другим видам стероидов, кроме андрогенов, или удаления части андрогенового рецептора, который затем становится конститутивно активированным.
В публикации WO2010/119194 заявитель определил соединения, показывающие антипролиферативное действие на опухоль предстательной железы, которые не показывают действие агониста при концентрациях, при которых нилутамид ведет себя как агонист. Эта разница в свойствах данных соединений относительно пролиферации по сравнению с нилутамидом подкрепляется их способностью вызывать исчезновение андрогеновых рецепторов в их белковой форме. Нилутамид не оказывает действия на данном уровне рецепторов. Свойства данных молекул позволяют лечить рак предстательной железы лучше, избегая недостаточности действующих антиандрогенов.
Вместе с тем, данные молекулы плохо растворимы в воде, что затрудняет разработку рецептуры для них в качестве эффективного лекарственного средства. К тому же, в фармакокинетических исследованиях на животных, воздействие на плазму не увеличивалось с увеличением дозы, вследствие ограниченной растворимости лекарственных форм.
Поэтому существует необходимость определения соединений, показывающих хорошее антипролиферативное действие для опухоли предстательной железы, без устойчивости к лечению, и рецептуру которых можно легко получить, благодаря лучшей растворимости в воде.
Заявитель определил новые соединения, показывающие антипролиферативное действие для опухоли предстательной железы, без устойчивости к лечению, которые показывают удивительно хорошую растворимость в воде.
Свойства данных новых молекул должны позволить легко разработать рецептуры соединений в фармацевтически приемлемых лекарственных формах при поддержании того же биологического профиля.
Кроме того, соединения настоящего изобретения можно также применять для лечения патологий, связанных с присутствием андрогеновых рецепторов, таких как, например доброкачественная гиперплазия предстательной железы, простатомегалия, угревая сыпь, андрогенная алопеция, гирсутизм и т.п.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
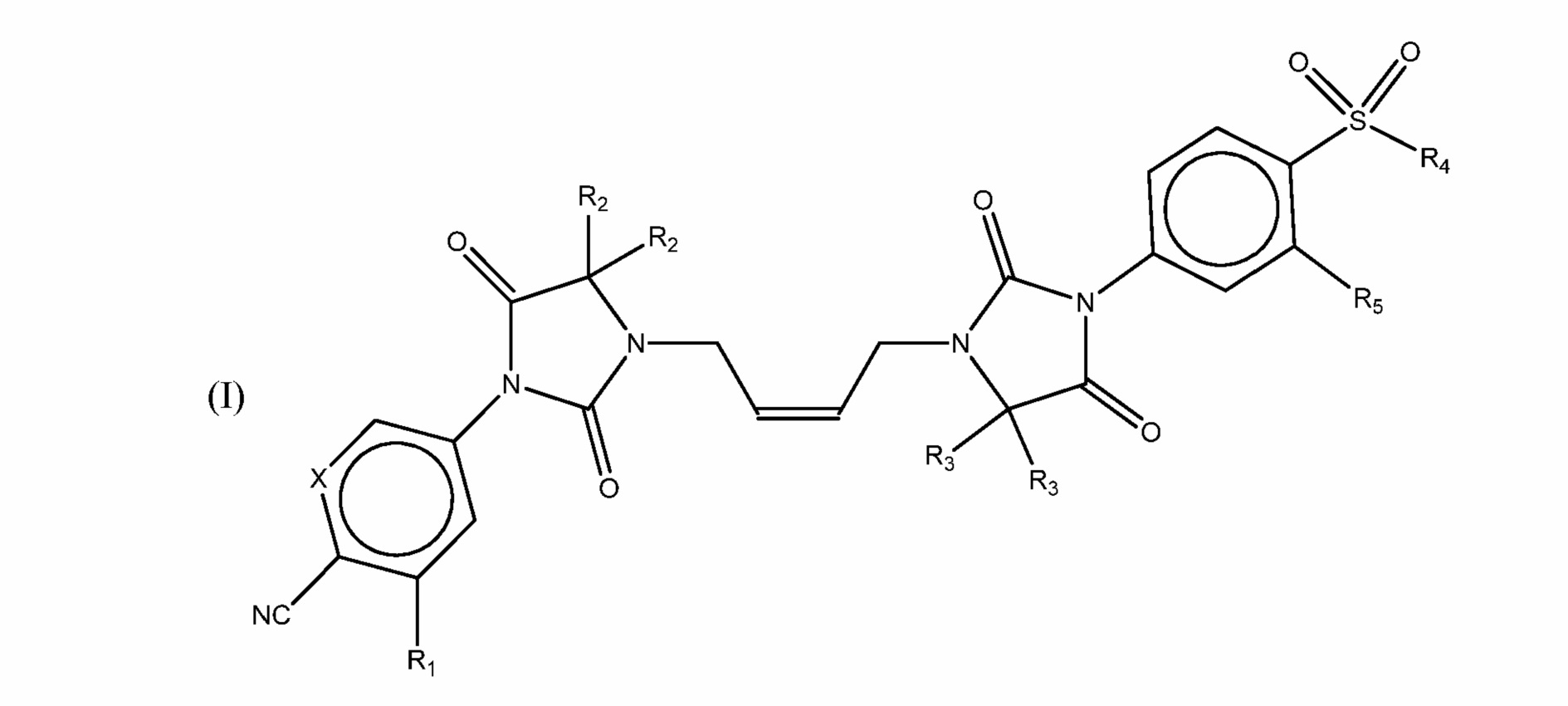
Предметом изобретения, следовательно, являются соединения общей формулы (I)

где:
R1 является -CF3 группой галогенного атома;
R2 является (C1-C6) алкильной группой, или два R2 вместе
образуют (C3-C6) циклоалкильную группу;
X является CH или N;
R3 является атомом водорода или (C1-С6) алкильной группой
или два R3 вместе образуют (C3-C6)циклоалкильную группу;
R4 является (C1-C6) алкильной группой;
R5 является -CF3 группой или атомом галогена;
или их солью.
Предпочтительно, R2 представляет (C1-C6)алкильную группу.
Более предпочтительно, R2 является метильной группой.
Альтернативно, два R2 вместе образуют (C3-C6)циклоалкильную группу.
Предпочтительно, R3 является (C1-C6)алкильной группой.
Более предпочтительно, R3 является метильной группой
Альтернативно, два R3 вместе образуют (C3-C6)циклоалкильную группу.
Предпочтительно, R4 является (C1-C3)алкильной группой.
Более предпочтительно, R4 является метильной группой.
Альтернативно, R4 является этильной группой.
Предпочтительно, R5 является -CF3 группой.
Предпочтительно, R1 является -CF3 группой.
Предпочтительно, соединение формулы I выбрано из
(Z)-4-(3-(4-(5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
(Z)-5-(3-(4-(5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-3-(трифторметил)пиколинонитрила; или
(Z)-4-(4,4-диметил-3-(4-(3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила,
или их фармацевтически приемлемой соли.
Например, соединение формулы I является (Z)-4-(3-(4-(5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрилом или его фармацевтически приемлемой солью.
Другим предметом изобретения является соединение формулы I, согласно приведенному выше определению, как лекарственное средство.
Другим предметом изобретения является фармацевтический состав, содержащий в качестве активного ингредиента, по меньшей мере, одно соединение формулы (I), согласно приведенному выше определению, в комбинации с фармацевтически приемлемым вспомогательным веществом.
Другим предметом изобретения является применение соединения формулы (I), согласно приведенному выше определению, для приготовления лекарственного средства, предназначенного для лечения рака.
Предпочтительно лекарственное средство предназначено для лечения гормонально-зависимого рака.
Более предпочтительно, лекарственное средство предназначено для лечения рака, экспрессирующего андрогеновые рецепторы.
Более предпочтительно, лекарственное средство предназначено для лечения рака груди или рака предстательной железы, предпочтительно рака предстательной железы.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
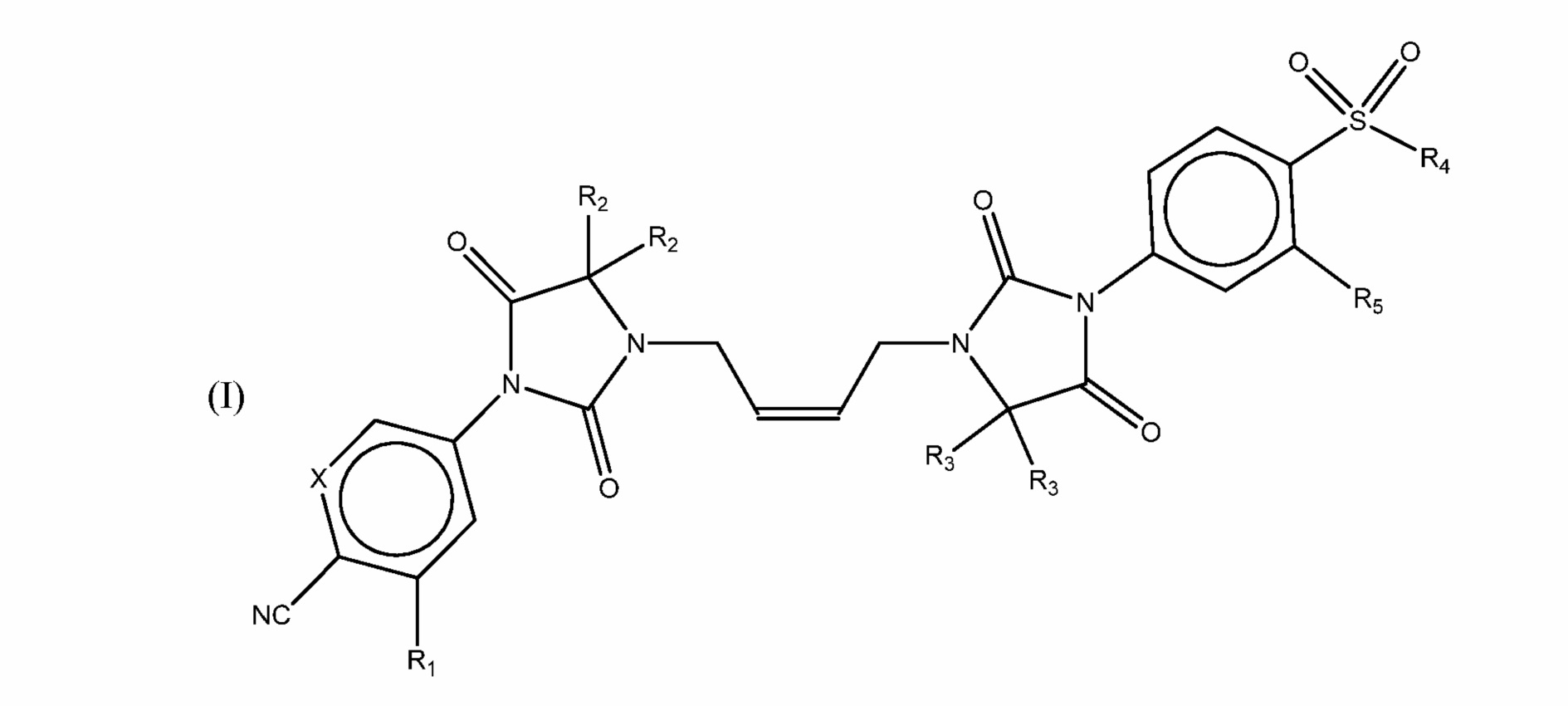
Предметом изобретения являются соединения формулы (I)

где:
R1 является -CF3 группой или атомом галогена;
R2 является (C1-C6) алкильной группой или два R2 вместе образуют (C3-C6)циклоалкильную группу ;
X является CH или N;
R3 является атомом водорода или (C1-C6) алкильной группой или два R3 вместе образуют (C3-C6)циклоалкильную группу;
R4 является (C1-C6) алкильной группой;
R5 является -CF3 группой или атомом галогена;
или их фармацевтически приемлемая соль.
Под фармацевтически приемлемой солью подразумевают конкретные добавочные соли неорганических кислот, такие как гидрохлорид, гидробромид, сульфат, фосфат, дифосфат и нитрат или органических кислот, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, бензолсульфонат, p-толуолсульфонат, памоат и стеарат. Также подразумевают включенные в рамки настоящего изобретения, в случае возможности их использования, соли, образованные из оснований, таких как гидроксид натрия или калия. Для других примеров фармацевтически приемлемых солей, можно привести ссылку на "Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217.
В указанных выше определениях, выражение галоген представляет радикал фтора, хлора, брома или йода, предпочтительно хлора, фтора или брома. Более предпочтительно галоген представляет радикал хлора.
Если не указано иное, термин алкил в значении настоящего изобретения представляет линейный или разветвленный алкильный радикал, включающий от 1 до 6 атомов углерода, такой как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, втор-бутильный и трет-бутильный, пентильный или амильный, изопентильный, неопентильный, гексильный или изогексильный радикалы. Алкильный радикал является (C1-C6)алкильным радикалом, т.е. представляющим алкильный радикал, имеющий от 1 до 6 атомов углерода согласно приведенному выше определению, или предпочтительно (C1-C4)алкильным радикалом, представляющим алкильный радикал, имеющий от 1 до 4 атомов углерода таким, например, как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, втор-бутильный и трет-бутильный радикалы. Наиболее предпочтительно, алкильным радикалом является метильный радикал.
Под циклоалкилом, если не указано иное, подразумевают насыщенный циклический углеродный радикал, включающий от 3 до 6 членов, такой как циклопропил или циклобутил.
ПОДРОБНОЕ ОПИСАНИЕ СПОСОБА ПРИГОТОВЛЕНИЯ
A) Приготовление соединений общей формулы I:
Соединения формулы I могут быть приготовлены, как показано на схеме A, приведенной ниже. Соединения формулы I, в которой R1, R2, R3, R4, R5 и X, как определено выше, могут быть приготовлены N-алкилированием соединения общей формулы III.2, в которой R3, R4 и R5 определены выше соединением общей формулы II.1, в которой R1, R2 и X определены выше. Реакция может быть проведена при температуре между 0 и 80°C, предпочтительно между 15 и 35°C. Например, реакция может быть проведена при комнатной температуре. Реакция может быть проведена в протонном растворителе, таком, например, как ацетонитрил, диметилформамид или тетрагидрофуран. Реакция может быть проведена в присутствии неорганического или органического основания. Подходящим неорганическим основанием может, например, являться K2CO3, Na2CO3, NaH, или KH. Подходящим органическим основанием может, например, являться третичный амин, такой, например, как триэтиламин или N,N-диизопропилэтиламин.

Схема A
B) Приготовление промежуточных соединений общей формулы II.1:
Соединения общей формулы II.1 могут быть приготовлены, как показано на схеме B ниже. Соединения общей формулы II.1, в которой R1, R2 и X как определено выше, могут быть приготовлены N-алкилированием соединения общей формулы III.1, в которой R1, R2 и X, как определено выше, с помощью избыточного (Z)-1,4-дихлоробут-2-ена. Реакция может быть проведена при температуре между 0 и 80°C, предпочтительно между 15 и 35°C. Например, реакция может быть проведена при комнатной температуре. Реакция может быть проведена в протонном растворителе, таком, например, как ацетонитрил, диметилформамид или тетрагидрофуран. Реакция может быть проведена в присутствии неорганического или органического основания. Подходящим неорганическим основанием может, например, являться K2CO3, Na2CO3, NaH, или KH. Подходящим органическим основанием может, например, являться третичный амин, такой, например, как триэтиламин или N,N-диизопропилэтиламин.

Схема B
C) Приготовление промежуточных соединений общей формулы III.1:
C.1) Приготовление соединений общей формулы III.1, где X является CH
Соединения формулы III.1 могут быть приготовлены, как показано на схеме C.1 и описано ниже, согласно пункту i) или ii).
i) Соединения общей формулы III.1, в которой R1 и R3 определены выше, и X является CH, могут быть приготовлены реакцией гидантоина общей формулы V.1, в которой R2 определен выше, и соединением формулы IV.1, в которой R1 определено выше, X является CH и Gf1 является атомом йода или брома. Реакция может быть проведена при температуре между 80 и 150°C в полярном протонном растворителе, например диметилформамиде. Реакция может быть проведена в присутствии производного меди, например оксида меди; или
ii) Соединения общей формулы III.1, в которой R1 и R2 определены выше, и X является CH, могут быть приготовлены реакцией гидантоина общей формулы V.1, в которой R2 определено выше, и соединением общей формулы IV.1, в котором R1 определено выше, X является CH, и Gf1 является атомом фтора. Реакция может быть проведена в протонном растворителе, таком, например, как ацетонитрил, диметилформамид или тетрагидрофуран. Реакция проводится в присутствии неорганического или органического основания. Подходящим неорганическим основанием является, например K2CO3, Na2CO3, NaH, или KH. Подходящим органическим основанием может, например, являться третичный амин, такой, например, как триэтиламин или N,N- диизопропилэтиламин.

Схема C.1
C.2) Приготовление соединений общей формулы III.1, где X является N
Соединения, описанные в общей формуле III.1, могут быть приготовлены, как показано на схеме C.2 ниже. Соединения общей формулы III.1, в которой R1,R2 определены выше, и X является N, могут быть приготовлены обработкой соединения общей формулы III.1.1, в которой R1,R2 определены выше, и X является N, цианидом, таким, например, как Zn(CN)2. Реакция может быть проведена при температуре между 80 и 150°C в полярном протонном растворителе, таком, например, как диметилформамид. Реакция может быть проведена в присутствии комплексного производного палладия, например Pd2(dba)3.

Схема C.2
C.2.a) Приготовление соединений общей формулы III.1.1:
Соединения общей формулы III.1.1 могут быть приготовлены, как показано на схеме C.2.a., приведенной ниже. Соединения общей формулы III.1.1, в которой R1 является CF3, X является N и R2 определено выше, могут быть приготовлены реакцией соединения общей формулы IV.2, в которой R1 является CF3, X является NH и Gf1 является атомом йода или брома, и гидантоина общей формулы V.1, в которой R2 определено выше. Реакция может быть проведена при температуре между 80 и 150°C в полярном протонном растворителе, например диметилформамиде. Реакция может быть проведена в присутствии производного меди, например оксида меди.

Схема C.2.a.
C.3) Приготовление соединений общей формулы III.2:
Соединения общей формулы III.2 могут быть приготовлены, как показано на схеме C.3, приведенной ниже. Соединения общей формулы III.2, в которой R3,R4 и R5 определены выше, могут быть приготовлены реакцией гидантоина общей формулы V.2, в которой R3 определено выше и соединения общей формулы IV.3, в которой R4 и R5 определены выше, и Gf2 является атомом йода или брома. Реакция может быть проведена при температуре между 80 и 150°C в полярном протонном растворителе, таком, например, как диметилформамид. Реакция может быть проведена в присутствии производного меди, такого, как например оксида меди.

Схема C.3
D) Приготовление соединений общей формулы IV.1, IV.2 и IV.3:
D.1) Приготовление соединений общей формулы IV.1:
Серийно производятся и имеются в продаже соединения общей формулы IV.1, в которой X является CH, такие, например, как 4-йодо-2-(трифторметил)бензонитрил.

D.2) Приготовление соединений общей формулы IV.2:
Соединения общей формулы IV.2 могут быть приготовлены, как показано на схеме D.2, приведенной ниже. Соединения общей формулы IV.2, в которой R1 является CF3, X является N, и Gf1 является атомом йода, могут быть приготовлены обработкой соединения общей формулы IV.2.1, в которой R1 является CF3, X является N и Gf1 является атомом йода, хлорирующим веществом, таким, например, как POCl3. Реакция может быть проведена при температуре между 100 и 150°C.

Схема D.2
D.2.1) Приготовление соединений общей формулы IV.2.1:
Соединения общей формулы IV.2.1 могут быть приготовлены, как описано ниже и показано на схеме D.2.1. Соединения общей формулы IV.2.1, в которой R1 является CF3, X является N, и Gf1 является атомом йода, могут быть приготовлены обработкой соединения общей формулы IV.2.1.1, в которой R1 является CF3 и X является N, йодирующим веществом, таким, например, как N-йодосукцинимид. Реакция может быть проведена в полярном протонном растворителе, например диметилформамиде или ацетонитриле. Реакция может быть проведена при температуре между 50 и 100°C.

Схема D.2.1
D.3) Приготовление соединения общей формулы IV.3:
Соединения, описанные в общей формуле IV.3, могут быть приготовлены, как показано на схеме D.3 и описано ниже. Соединения общей формулы IV.3, в которой R4 и R5 определены выше и Gf2 является атомом йода, могут быть приготовлены обработкой соединения общей формулы IV.3.1, в которой R4 и R5 определены выше, и Gf2 является атомом йода, окисляющим веществом, таким, например, как оксон. Реакция может быть проведена при температуре между 50 и 100°C в протонном растворителе, таком, например, как метанол или вода.

Схема D.3
D.3.1) Приготовление соединений общей формулы IV.3.1:
Соединения общей формулы IV.3.1 могут быть приготовлены, как показано на схеме D.3.1 и описано ниже. Соединения общей формулы IV.3.1, в которой R4 и R5 определены выше, и Gf2 является атомом йода, могут быть приготовлены обработкой соединения общей формулы IV.3.1.1, в которой R5 определен выше, Gf2 является атомом йода и Gf3 является уходящей группой, такой, например, как атом фтора, соединением общей формулы VI.1, в которой R4 определен выше. Реакция может быть проведена в полярном протонном растворителе, таком, например, как диметилформамид или ацетонитрил. Реакция может быть проведена при температуре между 20 и 100°C.

Схема D.3.1
E) Приготовление соединения общей формулы V.1 или V.2

Серийно не производящиеся и отсутствующие в продаже гидантоины общей формулы V.1 или V.2, в которой R2 и R3 определены выше, могут быть приготовлены, например, согласно способам, описанным в J. Med. Chem. 1984, 27 (12),1663-8.
Предметом настоящей заявки является также применение соединения формулы (I), согласно настоящему изобретению, для приготовления лекарственного средства предназначенного для лечения пролиферативных заболеваний, предпочтительно рака, более предпочтительно гормонально-зависимого рака или рака, экспрессирующего андрогеновые рецепторы, или рака предстательной железы и рака груди, и наиболее предпочтительно рака предстательной железы.
Фармацевтический состав может иметь твердую форму, например, порошков, гранул, таблеток, желатиновых капсул. Подходящими твердыми вспомогательными веществами могут быть, например, фосфат кальция, стеарат магния, тальк, сахара, лактоза, декстрин, крахмал, желатин, целлюлоза, метилцеллюлоза, натриевая карбоксиметилцеллюлоза, поливинилпирролидон и воск.
Фармацевтические составы, содержащие соединение изобретения, могут также быть представлены в жидкой форме, например, растворов, эмульсий, суспензий или сиропов. Подходящими жидкими вспомогательными веществами могут являться, например, вода, органические растворители, такие как глицерин или гликоли, а также их смеси в изменяющихся пропорциях в воде, добавленной к фармацевтически приемлемым маслам или жирам. Стерильные жидкие составы могут использоваться для внутримышечного, внутрибрюшинного или подкожного введения, и стерильные составы могут также вводиться внутривенно.
Все технические и научные термины, использованные в настоящем тексте известны специалистам в данной области техники. Кроме того, все патенты (или патентные заявки), а также другие библиографические справки, включены посредством ссылки.
Экспериментальная часть
Следуя определениям параметров R1, R2, R3, R4, R5 и X, соединения согласно изобретению могут быть приготовлены различными способами, описанными выше.
ЯМР анализ Примеров 1-3 выполнили на спектрометре Bruker-Avance II с частотой 400 МГц.
Представленные примеры являются иллюстрациями описанных выше способов и не ограничивают объем изобретения.
Терминология, использованная для номенклатуры соединений, приведенных ниже, и примеры являются терминологией Международного союза теоретической и прикладной химии (IUPAC).
Пример 1: (Z)-4-(3-(4-(5,5-диметил-3-(4-(метилсульфонил)-3- (трифторометил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрил
Этап A. 4-(4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрил
К смеси 4-йодо-2-(трифторметил)бензонитрила(51 г, 171,7 ммоль) и Cu2O (24,5 г, 172 ммоль) в диметилформамиде (500 мл) добавили 5,5-диметилимидазолидин-2,4-дион (33 г, 255 ммоль). Смесь нагревали при 150°C в течение 12 часов и охладили до комнатной температуры. Реакционную смесь отфильтровали через прокладку из целита. Фильтрат выпарили под уменьшенным давлением до 50 мл. Остаток вылили в ледяную воду (800 мл) и перемешивали при комнатной температуре в течение 30 минут. К смеси добавили 28% раствор нашатырного спирта (60 мл) и полученную голубую суспензию перемешивали в течение 0,5 часов. Образованный осадок собрали фильтрацией и промыли тетрагидрофураном (50 мл) до получения 4-(4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-трифторметил)бензонитрила в виде белесого твердого вещества (50 г, 98%). Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду:298 [M+H]+.
Этап B. (Z)-4-(3-(4-хлоробут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрил
К смеси 4-(4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила (50 г, 168,4 ммоль) и Cs2CO3 (110 г, 336,7 ммоль) в ацетонитриле (500 мл) при 25°C добавили по каплям раствор (Z)-1,4-дихлоробут-2-ена (104 г, 842 ммоль) в ацетонитриле (200 мл) и подогревали при 75°C в течение 2 часов. Реакционную смесь охладили до комнатной температуры и отфильтровали. Осадок промыли CH3CN (50 мл). Фильтрат выпарили под уменьшенным давлением. Остаток очистили хроматографией на силикагеле, используя EtOAc/петролейный эфир (1:10) как растворители для элюирования до получения (Z)-4-(3-(4-хлоробут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила в виде белого твердого вещества (39 г, 60%). Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 386 [M+H]+.
Этап C. (4-бромо-2-(трифторметил)фенил)(метил)сульфан
Смесь 4-бромо-1-фторо-2-(трифторметил)бензола (5,81 г, 23,9 ммоль) и натрия метантиолата (25% водный раствор, 9,7 мл, 31,1 ммоль) в диметилформамиде(20 мл) перемешивали при 50°C в течение 2 часов. Реакционную смесь охладили до комнатной температуры, добавили воду (120 мл) и полученную смесь экстрагировали этилацетатом (50 мл x 3). Экстракты соединили, промыли солевым раствором (50 мл x 2), высушили над сульфатом магния, отфильтровали, и выпарили под уменьшенным давлением до получения (4-бромо-2-(трифторметил)фенил)(метил)сульфана в виде желтого масла (6,09 г, 94%), которое использовали на следующем этапе без дополнительной очистки.
Этап D. 4-бромо-1-(метилсульфонил)-2-(трифторметил)бензол
Смесь (4-бромо-2-(трифторметил)фенил)(метил)сульфана (5 г, 18,4 ммоль) и оксона (33,7 г, 55,2 ммоль) в MeOH/воде (50 мл/50 мл) перемешивали при 40°C в течение ночи. Реакционную смесь выпарили под уменьшенным давлением, чтобы отделить MeOH. Полученную водную смесь экстрагировали с этилацетатом (40 мл x 3). Экстракты соединили, промыли солевым раствором (50 мл), высушили над сульфатом магния, отфильтровали и выпарили под уменьшенным давлением. Остаток очистили хроматографией на силикагеле, используя петролейный эфир:EtOAc (3:2) в виде растворителей для элюирования до получения 4-бромо-1-(метилсульфонил)-2-(трифторметил)бензола в виде белого твердого вещества (4,35 г, 78%), которое использовали для следующего этапа без дополнительной очистки. Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 303,0 [M+H]+.
Этап E. 5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)имидазолидин-2,4-дион
Смесь 4-бромо-1-(метилсульфонил)-2-(трифторметил)бензола (3,03 г, 10 ммоль), 5,5-диметил имидазолидин-2,4-диона (1,41 г, 11 ммоль) и Cu2O (1,76 г, 12,3 ммоль) в диметилформамиде (8 мл) нагревали при 145°C в течение ночи. Реакционную смесь охладили до комнатной температуры и отфильтровали. Фильтрат вылили в воду (50 мл) и экстрагировали с этилацетатом (25 мл x 3). Экстракты соединили, промыли солевым раствором (50 мл), высушили над сульфатом магния, отфильтровали, и выпарили под уменьшенным давлением до получения 5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)имидазолидин-2,4-диона в виде белесого твердого вещества (2,92 г, 83%), которое использовали для следующего этапа без дополнительной очистки. Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 351,1 [M+H]+.
Этап F. (Z)-4-(3-(4-(5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрил
В атмосфере азота суспензию 5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)имидазолидин-2,4-диона (7,3г, 20,8 ммоль), (Z)-4-(3-(4-хлоробут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила (8г, 20,8 ммоль), K2CO3 (2,9г, 20,8г) и ацетонитрил (80 мл) перемешивали в обратном потоке в течение 10 часов. После охлаждения, реакционную смесь отфильтровали, осадок промыли ацетонитрилом (10 мл) и соединенные фильтраты выпарили под вакуумом. К остатку добавили воду (150 мл) и этилацетат (150 мл). После декантации, отделили органический слой, и водный слой экстрагировали с этилацетатом (2×150 мл). Соединенные органические слои высушили над сульфатом магния и выпарили под уменьшенным давлением. Остаток очистили колоночной хроматографией на силикагеле и элюировали с дихлорометаном/этилацетатом- 95/5 до получения (Z)-4-(3-(4-(5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила в виде белесого твердого вещества (10,6г, 73%).
1H ЯМР (500 МГц, CDC13) δ (ppm) 8,40 (d, J=8,0 Гц, 1H), 8,22 (d, J=1,5 Гц, 1H), 8,15 (d, J=1,5 Гц, 1H), 8,05 (dd, J=9,0 и 1,5 Гц, 1H), 8,00 (dd, J=8,5 и 1,5 МГц, 1H), 7,93 (d, J=8,5 Гц, 1H), 5,63-5,69 (m, 2H), 4,24 (t, J=4,0 Гц, 4H), 3,20 (s, 3H), 1,59 (s, 6H), 1,58 (s, 6H); Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 700,0 [M+H]+.
Пример 2: (Z)-5-(3-(4-(5,5-диметил-3-(4-(метилсульфонил)-3- (трифторометил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-3-(трифторметил)пиколинонитрил
Этап A. 5-йодо-3-(трифторметил)пиридин-2-ол
Смесь 3-(трифторметил)пиридин-2-ола (3,0 г, 18,5 ммоль) и N-йодосукцинимида (4,2 г, 18,5 ммоль) в ацетонитриле(25 мл) и диметилформамиде (25 мл) нагревали при 80°C в течение 2 часов. Далее реакционную смесь охладили до комнатной температуры, добавили воду, и полученную смесь экстрагировали с этилацетатом (70 мл x 2). Экстракты соединили, промыли солевым раствором (120 мл x 3), высушили над сульфатом натрия, отфильтровали, и выпарили под уменьшенным давлением до получения 5-йодо-3-(трифторметил)пиридин-2-ола в виде желтого твердого вещества (4,0 г, 74%). 1H ЯМР (500 МГц, CDCl3) δ (ppm) 13.37 (bs, 1H), 7,98 (d, J=2,0 Гц, 1H), 7,85 (d, J=2,0 Гц, 1H); Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 290 [M+H]+.
Этап B. 2-хлоро-5-йодо-3-(трифторметил)пиридин
Суспензию 5-йодо-3-(трифторметил)пиридин-2-ола (3,0 г, 10,4 ммоль) в POCl3 (8 мл) нагревали при 100°C в течение ночи. После охлаждения до комнатной температуры, смесь вылили в лед (50 г). Полученный водный слой нейтрализовали Na2CО3 и экстрагировали с этилацетатом (70 мл x 2). Экстракты соединили, высушили над сульфатом натрия, отфильтровали, и выпарили под уменьшенным давлением. Остаток очистили хроматографией на силикагеле, используя петролейный эфир:EtOAc (100:1~4:1) в виде растворителей для элюирования до получения 2-хлоро-5-йодо-3-(трифторметил)пиридина в виде белого твердого вещества (2,0 г, 63%). 1H ЯМР (500 МГц, CDCls) δ (ppm) 8,78 (d, J=2,0 Гц, 1H), 8,28 (d, J=2,0 Гц, 1H).
Этап C. 3-(6-хлоро-5-(трифторметил)пиридин-3-ил)-5,5-диметилимидазолидин-2,4-дион
К смеси 2-хлоро-5-йодо-3-(трифторметил)пиридина (1,4 г, 4,5 ммоль) в диметилформамиде (10 мл) добавили 5,5-диметилимидазолидин-2,4-дион (637 мг, 5,0 ммоль) и Cu2О (1,6 г, 11,4 ммоль) и нагревали при 150°C в течение ночи. Реакционную смесь охладили до комнатной температуры и отфильтровали. Фильтрат вылили в воду (70 мл), добавили 28% раствор нашатырного спирта (6 мл), и полученную смесь экстрагировали с этилацетатом (70 мл x 2). Экстракты соединили, промыли солевым раствором (100 мл x 3), высушили над сульфатом натрия, отфильтровали, и выпарили под уменьшенным давлением. Остаток очистили хроматографией на силикагеле, используя петролейный эфир:EtOAc (10:1~1:1) в виде растворителей для элюирования до получения 3-(6-хлоро-5-(трифторметил)пиридин-3-ил)-5,5-диметилимидазолидин-2,4-диона в виде белого твердого вещества (955 мг, 68%). Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 308 [M+H]+.
Этап D. 5-(4,4-диметил-2,5-диоксоимидазолидин-1-ил)-3-(трифторметил)пиколинонитрил
К раствору 3-(6-хлоро-5-(трифторметил)пиридин-3-ил)-5,5-диметилимидазолидин-2,4-диона (950 мг, 3,1 ммоль) в диметилформамиде (15 мл) добавили Zn(CN)2 (434 мг, 3,7 ммоль), Pd2(dba)3 (283 мг, 0,1 ммоль) и dppf (343 мг, 0,62 ммоль). Смесь нагревали в атмосфере N2 при 140°C в течение ночи. Далее реакционную смесь охладили до комнатной температуры, отфильтровали и фильтрат экстрагировали с этилацетатом (70 мл x 2). Экстракты соединили, промыли солевым раствором (100 мл x 3), высушили над сульфатом натрия, отфильтровали, и выпарили под уменьшенным давлением. Остаток очистили хроматографией на силикагеле, используя петролейный эфир:EtOAc (4:1~1:1) в виде растворителей для элюирования до получения 5-(4,4-диметил-2,5-диоксоимидазолидин-1-ил)-3-(трифторметил)пиколинонитрила в виде коричневого твердого вещества (910 мг, 99%). Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 299 [M+H]+.
Этап E. (Z)5-(3-(4-хлоробут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)3-(трифторометил)пиколинонитрил
К смеси 5-(4,4-диметил-2,5-диоксоимидазолидин-1-ил)-3-(трифторметил)пиколино-нитрила (1,1 г, 3,65 ммоль) и Cs2CO3 (2,4 г, 7,3 ммоль) в ацетонитриле (20 мл) при 25°C добавили по каплям раствор (Z)-1,4-дихлоробут-2-ена (2,28 г, 18,3 ммоль) в ацетонитриле (2 мл) и нагревали при 75°C в течение 2 часов. Реакционную смесь охладили до комнатной температуры, отфильтровали, и промыли ацетонитрилом. Фильтрат выпарили под уменьшенным давлением. Остаток очистили хроматографией на силикагеле, используя петролейный эфир:EtOAc (10:1~4:1) в виде растворителей для элюирования до получения (Z)-5-(3-(4-хлоробут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-3-(трифторметил)пиколинонитрила в виде светло-желтого твердого вещества (780 мг, 56%). Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 387 [M+H]+.
Этап F. (Z)-5-(3-(4-(5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-3-(трифторметил)пиколинонитрил
Смесь (Z)-5-(3-(4-хлоробут-2-енил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-3-(трифторметил)пиколинонитрила (190 мг, 0,51 ммоль), K2CO3 (177 мг, 1,28 моль) и 5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)имидазолидин-2,4-диона (150 мг, 0,43 ммоль) в диметилформамиде (5 мл) перемешивали при 60°C в течение 2 часов. Реакционную смесь отфильтровали, и фильтрат выпарили под уменьшенным давлением. Остаток очистили предварительным ВЭЖХ до получения (Z)-5-(3-(4-(5,5-диметил-3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин- 1-ил)бут-2-ен- 1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-3-(трифторметил)пиколинонитрила в виде белого твердого вещества (160 мг, 20%).
1H ЯМР (500 МГц, DMSO-d6) δ (ppm) 9,21 (d, J=2,0 Гц, 1H), 8,64 (d, J=2,0 Гц, 1H), 8,37 (d, J=9,0 Гц, 1H), 8,22 (d, J=1,5 Гц, 1H), 8,10 (d, J=9,0 Гц, 1H), 5,61-5,62 (m, 2H), 4,21-4,23 (m, 4H), 3,34 (s, 3H), 1.52 (s, 6H), 1,51 (s, 6H); Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 701,2 [M+H]+.
Пример 3: (Z)-4-(4,4-диметил-3-(4-(3-(4-(метилсульфонил)-3-(трифторометил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрил
Этап A. 3-(4-(метилсульфонил)3-(трифторометил)фенил)имидазолидин-2,4-дион
Смесь 4-бромо-1-(метилсульфонил)-2-(трифторметил)бензола (1 г, 3,31 ммоль), имидазолидин-2,4-диона (0,50 г, 4,97 ммоль) и Cu2O (0,48 г, 3,36 ммоль) в диметилформамиде (10 мл) нагревали при 150°C в течение 4 часов. Реакционную смесь вылили в ледяную воду (200 мл) и перемешивали при комнатной температуре в течение 30 минут. К смеси добавили 28% раствор нашатырного спирта (5 мл) и перемешивали в течение 1 часа. Реакционную смесь отфильтровали. Полученное сырье промыли водой и тетрагидрофураном до получения 3-(4-(метилсульфонил)-3-(трифторметил)фенил)имидазолидин-2,4-диона в виде белого твердого вещества (350 мг, 33%). Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 323,1 [M+H]+.
Этап B. (Z)-4-(4,4-диметил-3-(4-(3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин-1-ил)бут-2-ен-1-ил)-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрил
Смесь (Z)-4-(3-(4-хлоробут-2-ен-1-ил)-4,4-диметил-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила (420 мг, 1,09 ммоль), 3-(4-(метилсульфонил)-3-(трифторметил)фенил)имидазолидин-2,4-диона (350 мг, 1,09 ммоль) и K2CO3 (560 мг, 4,06 ммоль) в ацетонитриле (5 мл) нагревали при 60°C в течение 1 часа. Реакционную смесь быстро охладили водой и экстрагировали с этилацетатом. Экстракты соединили, промыли солевым раствором, высушили над сульфатом натрия, отфильтровали, и выпарили под уменьшенным давлением. Остаток очистили предварительным ВЭЖХ до получения (Z)-4-(4,4-диметил-3-(4-(3-(4-(метилсульфонил)-3-(трифторметил)фенил)-2,4-диоксоимидазолидин- 1-ил)бут-2-ен-1-ил)-2,5-диоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила в виде белого твердого вещества (62 мг, 9%).
1H ЯМР (500 МГц, DMSO-Je) δ (ppm) 8,38-8,32 (m, 2H), 8,20 (s, 1H), 8,14 (s, 1H), 8,06 (d, J=10,0 Гц, 2H), 6,72-5,66 (m, 2H), 4,22-4,16 (m, 6H), 3,35 (s, 3H), 1,50 (s, 6H); Жидкостная хроматомасс-спектрометрия (ионизация электрораспылением) отношение массы к заряду: 672,1 [M+H]+.
Фармакологичекие исследования соединения согласно изобретению
Измерение антипролиферативной активности:
1. Антипролиферативное действие на LNCaP в полной среде
Антипролиферативное действие соединения настоящего изобретения определяют на LNCaP в полной среде, применяя следующую экспериментальную методику:
LNCaP тип клеток (ATCC, 1740) возникает из карциномы предстательной железы. Эта линия экспрессирует андрогеновый рецептор и является гормонально-зависимой.
Поддержание линии LNCaP выполняется в полной культурной среде: RPMI, 10% фетальной телячьей сыворотки, 2 ммоль глутамина, 100 U/мл пенициллина, 0,1 мг/мл стрептомицина и 0,01 моль N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислоты (HEPES), 1 ммоль натрия пирувата, 40% D-глюкозы.
• Посев в планшеты: LNCaP линию высевают при 20,000 клеток/лунку в 90 мкл полной среды в 96-луночные планшеты, покрытые поли-D-лизином (Biocoat, Costar).
• Обработка клеток: через 24 часа после посева, клетки обрабатывают 10 мкл/лунку соединения разбавленного в культурной среде. Используют следующие концентрации: 1 нмоль/10/30/100/300/1000/3000/10,000 нмоль. Клетки культивируют в течение 144 часов при 37°C, 5% CO2.
• Считывание: После культивирования в течение 6 дней, определяют клеточную пролиферацию способом Cell-Titer-Glow (CTG) Люминисцентного анализа жизнеспособности клеток.
• Результаты: Эксперименты выполняют в двух экземплярах, и лучшие соединения тестируют дважды. Вычисляют значение концентрации, ингибирующее клеточную пролиферацию на 50% (IC50).
|
2. Антипролиферативное действие на DU145 в полной среде
DU145 является клеточной линией рака предстательной железы, не экпрессирующей андрогеновый рецептор. Она используется для оценки избирательной способности соединений для клеток, экпрессирующих андрогеновый рецептор. Ожидается отсутствие действия соединений.
• Клетки DU145 линии (ATCC HTB-81) высеивают при 800 клеток/лунку в 90 мкл полной среды в 96-луночные планшеты, покрытые поли-D-лизином (Biocoat, Costar).
• Обработка клеток: через 24 часа после посева, клетки обрабатывают с 10 мкл/лунку соединения, разбавленного в культурной среде. Используют следующие концентрации: 1 нмоль/10/30/100/300/1000/3000/10,000 нмоль. Клетки культивируют в течение 144 часов при 37°C, 5% CО2.
• Считывание: После культивирования в течение 6 дней, определяют клеточную пролиферацию способом Cell-Titer-Glow (CTG) Люминисцентного анализа жизнеспособности клеток.
• Результаты: Эксперименты выполняют в двух экземплярах, и лучшие соединения тестируют дважды. Вычисляют значение концентрации, ингибирующее клеточную пролиферацию на 50% (IC50).
|
3. Антипролиферативное действие на VCaP в полной среде
- Клетки VCaP линии (ATCC CRL-2876) высеивают при 20000 клеток/лунку в 90 мкл полной среды в 96-луночные планшеты, покрытые поли-D-лизином (Biocoat, Costar).
• Обработка клеток: через 24 часа после посева, клетки обрабатывают с 10 мкл/лунку соединения, разбавленного в культурной среде. Используют следующие концентрации: 1 нмоль/10/30/100/300/1000/3000/10,000 нмоль. Клетки культивируют в течение 144 часов при 37°C, 5% CO2.
• Считывание: После культивирования в течение 9 дней, определяют клеточную пролиферацию способом Cell-Titer-Glow (CTG) Люминисцентного анализа жизнеспособности клеток.
• Результаты: Эксперименты выполняют в двух экземплярах, и лучшие соединения тестируют дважды. Вычисляют значение концентрации, ингибирующее клеточную пролиферацию на 50% (IC50).
|
Измерение белковой экспрессии андрогенового рецептора
Клетки линии LNCaP высеяли в пропорции 2,5 миллионов клеток на 10 см в чашку Петри и выдержали в 8 мл RPMI-1640 в течение 4 дней. После культивирования в течении 4 дней, 4 мл среды удалили из чашки Петри и аккуратно добавили 5 мл свежей среды. 1 мл соединения в 10-кратном разведении в полной среде в концентрациях от 3×10-6 моль до 10-8 моль. Клетки обработали соединением в течение дополнительных 3 дней. Весь клеточный белок экстрагировали, используя набор Nuclear Extract, и произвели количественный анализ, используя Белковый анализ Брэдфорда. Затем определили воздействие соединения на уровни AR в LNCaP клетках, используя набор AR ELISA. Примеры IC50 приведены ниже:
|
Оценка растворимости:
Тестовые соединения приготовили, как базовые растворы при 100 ммоль в DMSO. Базовые растворы разбавили, в двух экземплярах, в 100 ммоль буферном растворе фосфата калия (pH 7,4) до заданной концентрации в 100 мкмоль с конечной концентрацией DMSO в 0,1%. Растворы взбалтывали при 1000 оборотах в минуту в течение 1 часа при комнатной температуре с последующим центрифугированием в течение 10 минут при 1200 оборотах в минуту для осаждения нерастворимых частиц. Супернатанты перенесли в новые пробирки и дополнительно приготовили образцы следующим образом:
• Неразбавленные: 5 мкл супернатанта к 95 мкл ACN, содержащего внутренний стандарт (IS)
• Разбавленные 1:10: 10 мкл супернатанта в 90 мкл K-буфера, перемешали, затем переместили 5 мкл разбавленных 1:10 образцов к 95 мкл ACN, содержащего IS
• Разбавленные 1:100: 10 мкл спернатанта в 990 мкл K-буфера, перемешали, затем переместили 5 мкл разбавленных 1:100 образцов к 95 мкл ACN, содержащего IS
Образцы (неразбавленные, разбавленные 1:10 и разбавленные 1:100) вместе со стандартными проанализировали с помощью LC-MS/MS.
Примеры Растворимости приведены ниже:
|