Результат интеллектуальной деятельности: АНТИТРОМБОТИЧЕСКИЙ ИСКУССТВЕННЫЙ КРОВЕНОСНЫЙ СОСУД
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к искусственному кровеносному сосуду, применяемому для реконструкции, восстановления или замены кровеносного сосуда, который подвергся повреждению и/или т.п.
Уровень техники
Количество пациентов, страдающих от артериосклероза, увеличивается в связи со старением населения и увеличением доли населения с метаболическим синдромом. Артериосклероз представляет собой патологическое изменение стенок артерий. При артериосклерозе гипергликемическое состояние или гиперлипидемическое состояние крови является причиной дегенерации стенки сосуда, в результате которой стенка сосуда становится ослабленной или утолщенной, или происходит кальцификация стенки сосуда, которая делает стенку сосуда твердой и хрупкой. Несмотря на то, что такая дегенерация кровеносных сосудов в организме может наблюдаться в любом месте кровеносных сосудов, периферические кровеносные сосуды подвержены дегенерации особенно заметно.
Лечение такого дегенерировавшего кровеносного сосуда обычно осуществляют с помощью минимально инвазивного, эндоваскулярного способа лечения, такого как баллонная дилатация или установка стента с применением катетера, или путем хирургической операции по замене поврежденного кровеносного сосуда на кровеносный сосуд самого пациента или на искусственный кровеносный сосуд.
Однако в тех случаях, когда используется искусственный кровеносный сосуд, организм воспринимает искусственный кровеносный сосуд как чужеродную субстанцию, и на поверхности искусственного кровеносного сосуда, контактирующей с кровью, протекает реакция свертывания крови с образованием тромба. Кровеносный сосуд в организме содержит интиму (внутреннюю оболочку сосуда), содержащую сосудистые клетки эндотелия на своей поверхности, контактирующей с кровью, и интима играет роль в ингибировании образования тромба. Также в случае вживления искусственного кровеносного сосуда сосудистые клетки эндотелия выстилают поверхность искусственного кровеносного сосуда, контактирующую с кровью, с образованием интимы сосуда. Однако, поскольку искусственный кровеносный сосуд воспринимается организмом как чужеродная субстанция, прежде чем интима покроется эндотелиальными клетками, необходимо средство для предотвращения тромбообразования до тех пор, пока не образуется интима. В частности, на участке, где применяется искусственный кровеносный сосуд малого диаметра, циркуляция крови является низкой, поэтому легко происходит отложение тромбов, и кровеносный сосуд способен закупориваться с большей вероятностью даже в случае небольшого количества тромбов. В настоящее время долгосрочные характеристики искусственных кровеносных сосудов малых диаметров являются неподходящими, и нет таких искусственных кровеносных сосудов, которые пригодны для применения в клинической практике.
Чтобы решить упомянутые проблемы, разработку искусственных кровеносных сосудов обычно осуществляют, сосредотачивая внимание на скорейшем образовании интимы и скорейшем придании антитромбогенности.
Примеры способов промотирования формирования интимы сосуда включают в себя способ, в котором по искусственному кровеносному сосуду переносится фактор роста или стимулятор роста клеток, и способ, в котором применяется искусственный кровеносный сосуд, содержащий в качестве своего структурного материала ткань, вязаную сетку или нетканый материал из волокна, такого как полиэфирное волокно. В частности, известно, что в тех случаях, когда включено ультратонкое волокно толщиной менее 10 мкм, размер ультратонкого волокна или размер промежутка между волокнами является подходящим для клеточного роста или клеточной инфильтрации (патентные документы 1, 2, и 3). Также известно, что при вживлении волокон (патентный документ 4) ультратонкие волокна оказывают влияние на ускорение адгезии тромбоцитов и предотвращение пропотевания (просачивания) плазмы крови сквозь стенку кровеносного сосуда.
При общепринятом способе придания антитромбогенности искусственному кровеносному сосуду, по искусственному кровеносному сосуду переносится гепарин. Поскольку само по себе волокно не обладает способностью к переносу гепарина, в качестве способов изготовления искусственного кровеносного сосуда для переноса достаточного количества гепарина, известен способ, в котором промежутки между волокнами (патентный документ 5) заполняют гелем, состоящим из рассасывающегося полимера или желатина, содержащего гепарин; и способ, в котором гепарин иммобилизован на поверхности волокна с помощью ковалентных связей (патентный документ 6).
Кроме того, поскольку гепарин ионно заряжен отрицательно, известен способ переноса гепарина на поверхность подложки медицинского устройства путем образования ионной связи с положительно заряженным веществом. При размещении такой подложки в жидкости организма или в водном растворе гепарин со временем высвобождается. Поскольку антитромбогенность можно регулировать путем регулирования скорости высвобождения гепарина, были исследованы комбинации с различными положительно заряженными веществами. Известен способ, в котором образуют ионный комплекс с четвертичным аммониевым соединением, и полученный ионный комплекс наносят на поверхность (патентный документ 7); способ, в котором на поверхность наносят полимер, содержащий третичные аминогруппы, причем третичные аминогруппы наносят на группы четвертичного аммония, и гепарин связывается с этим полимером с помощью ионных связей (патентный документ 8); и способ, в котором гепарин ионно связывается с поверхностью подложки, с которой связан полиэтиленимин, который представляет собой поликатион (патентные документы 9 и 10).
Документы известного уровня техники
Патентные документы
Патентный документ 1: JP 1875991 B;
Патентный документ 2: JP 1870688 B;
Патентный документ 3: JP 1338011 B;
Патентный документ 4: JP 4627978 B;
Патентный документ 5: JP 3799626 B;
Патентный документ 6: выложенная заявка на патент Японии № 2009-545333, переведенная согласно PCT;
Патентный документ 7: JP 4273965 B;
Патентный документ 8: JP 3341503 B;
Патентный документ 9: WO 00/13719;
Патентный документ 10: JP 08-336587 A;
Сущность изобретения
Проблемы, подлежащие решению с помощью изобретения
Однако в тех случаях, когда заполнение промежутков между волокнами осуществляется так, как в случае искусственного кровеносного сосуда, описанного в патентном документе 5, клеточная инфильтрация устраняется, вызывая замедление формирования интимы, и, кроме того, тромбоциты прилипают к желатину и т.п., наоборот, ускоряя тромбообразование, которое является проблематичным. В тех случаях, когда гепарин иммобилизован на поверхности волокна с помощью ковалентных связей так, как в случае искусственного кровеносного сосуда, описанного в патентном документе 6, количество гепарина, которое может быть связано с поверхностью, ограничено из-за большой молекулярной массы гепарина, и не достигается долгосрочного эффекта, что является проблематичным.
Что касается способа, описанного в патентном документе 7, при котором образуют ионный комплекс с низкомолекулярным четвертичным аммониевым соединением, растворяют ионный комплекс в органическом растворителе и наносят на поверхность подложки, в этом способе следует выбирать растворитель, который может растворять ионный комплекс и который не растворяет подложку, на которую наносится покрытие, поэтому выбор растворителя ограничен. Кроме того, существует проблема, связанная с тем, что поскольку гидрофильная группа ионного комплекса и органический растворитель не смешиваются друг с другом, коагулируя во время нанесения покрытия, раствор испаряется, приводя к фазовому расслоению, в связи с чем раствор нельзя нанести равномерно, и высвобождение гепарина не может быть регулируемым. Кроме того, поскольку низкомолекулярное четвертичное аммониевое соединение и поверхность подложки не связаны, четвертичное аммониевое соединение само по себе также отслаивается от подложки, что также является причиной того, что высвобождение гепарина не может быть регулируемым. Что касается способа, описанного в патентном документе 8, при котором наносят полимер, содержащий третичные аминогруппы, которые преобразуют в четвертичные аммониевые группы, и связывают гепарин с подложкой с помощью ионных связей, в этом способе требуется толстое покрытие, чтобы переносить необходимое количество гепарина. Следовательно, когда полимер наносится на подложку с необходимой тонкодисперсной структурой, как в настоящем изобретении, тонкодисперсная структура остается внутри (подложки), поэтому совместимость с клетками в большинстве случаев ухудшается. Кроме того, поскольку нет связи с поверхностью подложки, хотя желательно, чтобы полимер прочно прилипал к подложке, следует выбирать растворитель, который вместе с полимером также растворяет подложку, поэтому выбор растворителя ограничен. Растворитель, который растворяет подложку, применяемую в искусственных сосудах, такую как сложный полиэфир и политетрафторэтилен, является редким. Если лечение, описанное в патентном документе 8, осуществлять с применением обычного растворителя, полимер легко отслаивается от подложки, что является проблематичным для обеспечения безопасности в случае применения способа в отношении человека.
Кроме того, что касается способа, описанного в патентных документах 9 и 10, при котором гепарин ионно связывается с поверхностью подложки, с которой связан полиэтиленимин, который представляет собой поликатион, то поскольку первичные - третичные аминогруппы, содержащиеся в полиэтиленимине, являются слабо основными, часть аминогрупп в водном растворе, с которыми гепарин образует ионную связь, не заряжается положительно. В результате ионное взаимодействие с гепарином является слабым, поэтому количество гепарина, которое может быть перенесено, ограничено.
Таким образом, даже в случае применения известных технологий общепринятые искусственные кровеносные сосуды не удовлетворяют требованиям одновременного достижения клеточной аффинности и антитромбогенности, и в частности, в настоящее время вообще нет искусственного кровеносного сосуда малого диаметра, который подходит для длительного применения в клинической практике.
Ввиду вышесказанного цель настоящего изобретения состоит в том, чтобы обеспечить искусственный кровеносный сосуд, который промотирует формирование интимы после его вживления, способен сохранять антитромбогенность во время формирования интимы и сохранять свою проходимость в течение длительного времени.
Для решения описанных выше проблем авторы настоящего изобретения провели интенсивное исследование и в результате установили, что в то время как сохраняется тонкодисперсная структура, состоящая из ультратонкого волокна (волокон), путем связывания полимера, содержащего четвертичную аммониевую группу, с ультратонким волокном (волокнами) и дополнительного ионного связывания гепарина с полимером, содержащим четвертичную аммониевую группу, можно придавать антитромбогенность, то есть может быть реализована как клеточная аффинность, так и антитромбогенность.
Иначе говоря, в настоящем изобретении предлагаются искусственные кровеносные сосуды согласно следующим пп. 1-8.
1. Искусственный кровеносный сосуд, который представляет собой трубчатый материал, содержащий: волокнистый слой, содержащий ультратонкое волокно (волокна), и слой ультратонкого волокна на внутренней поверхности волокнистого слоя, причем слой ультратонкого волокна состоит из ультратонкого волокна (волокон) с диаметром (диаметрами) волокна в диапазоне от не менее 10 нм до не более 3 мкм, в котором полимер, содержащий четвертичную аммониевую группу и алкильные группы, в каждой из которых число атомов углерода равно 10 или менее, ковалентно связан с ультратонким волокном (волокнами); гепарин ионно связан с полимером, содержащим группы четвертичного аммония; и остаточная активность гепарина после промывки физиологическим раствором при 37°C в течение 30 минут, составляет 20 мМЕ/см2 или более.
2. Искусственный кровеносный сосуд по п. 1, в котором количество катионов, связанных с поверхностью волокна (волокон), составляет 1 мкг/см2 или более.
3. Искусственный кровеносный сосуд по п. 1 или 2, водопроницаемость которого при 120 мм рт. ст. находится в диапазоне от не менее 100 мл/см2/мин до менее 4000 мл/см2/мин.
4. Искусственный кровеносный сосуд по любому из пп. 1-3, в котором волокнистый слой состоит из ультратонкого волокна (волокон) и мультифиламентной нити (нитей) с суммарной тониной в диапазоне от 1 до 60 децитекс.
5. Искусственный кровеносный сосуд по п. 4, в котором тонина однониточной пряжи, составляющей мультифиламентную нить, находится в диапазоне от 0,5 до 10,0 децитекс.
6. Искусственный кровеносный сосуд по любому из пп. 1-5 со степенью адгезии тромбоцитов менее 20%.
7. Искусственный кровеносный сосуд по любому из пп. 1-6, в котором трубчатый материал состоит из полиэфирного волокна (волокон).
8. Искусственный кровеносный сосуд по любому из пп. 1-7, в котором внутренний диаметр трубчатого материала составляет не менее 1 мм и менее 10 мм.
Эффект от изобретения
С помощью настоящего изобретения можно получать искусственный кровеносный сосуд, который промотирует формирование интимы после вживления, способен сохранять антитромбогенность во время формирования интимы и способен сохранять свою проходимость в течение длительного времени.
Краткое описание чертежей
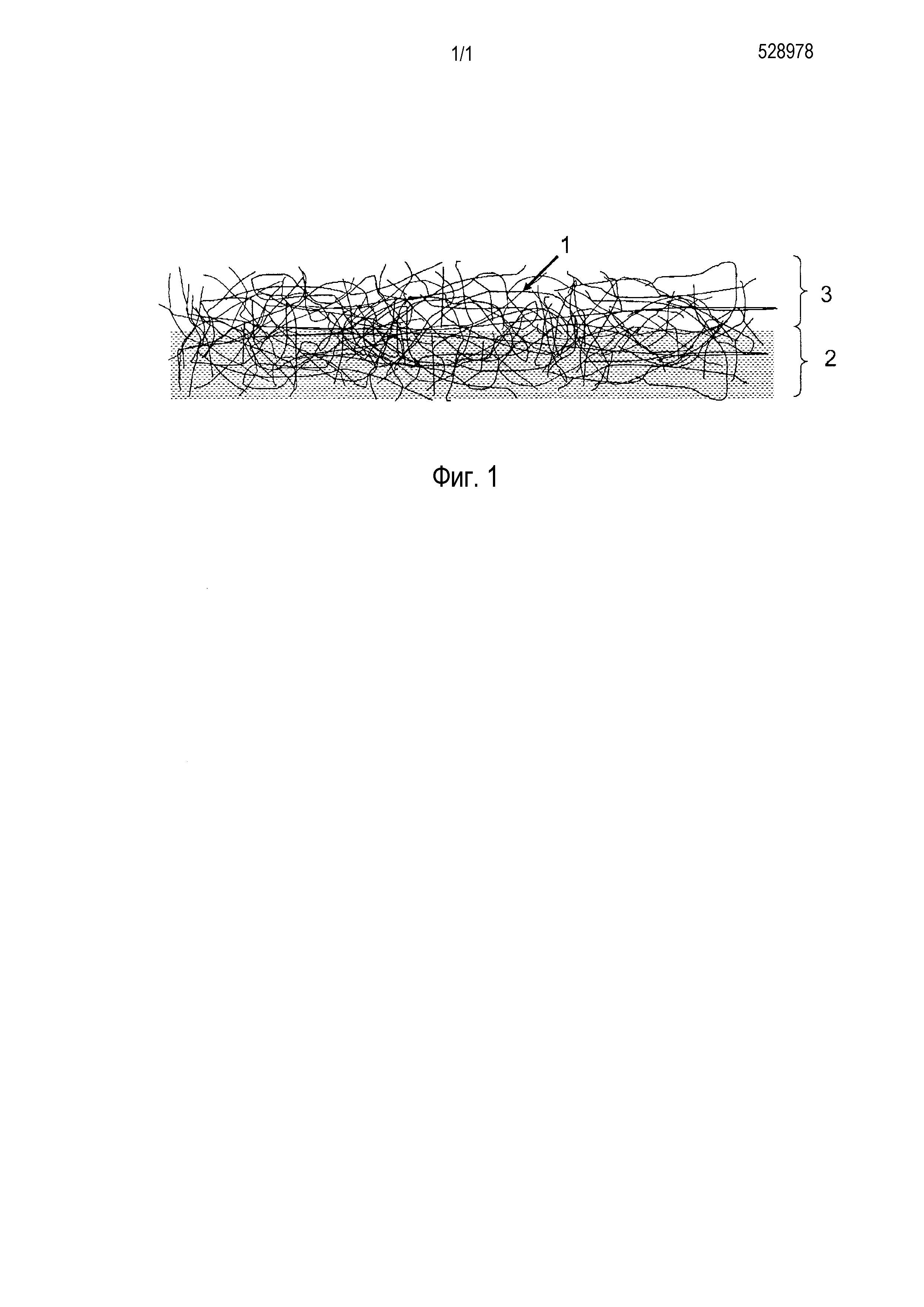
На фиг. 1 приведено схематическое изображение, показывающее волокнистую структуру искусственного кровеносного сосуда согласно настоящему изобретению.
Способ осуществления изобретения
В настоящем изобретении ультратонкое волокно означает волокно с диаметром волокна не менее 10 нм и не более 3 мкм. В тех случаях, когда применяется искусственный кровеносный сосуд, содержащий ультратонкое волокно, число скаффолдов, подходящих для адгезии живых клеток, заметно увеличивается благодаря экстремально малой тонине волокна, и позволяет достичь превосходной клеточной инфильтрации. Благоприятное формирование интимы сосуда происходит на экстремально ранней стадии и пропотевания плазмы крови почти не происходит.
Поскольку придать искусственному кровеносному сосуду прочность, которая позволяет поддерживать давление крови и движение тканей, нельзя только с помощью ультратонких волокон, искусственный кровеносный сосуд согласно настоящему изобретению, как показано на фиг. 1, содержит волокнистую структуру, состоящую из волокнистого слоя 2, в котором ультратонкие волокна 1 распределены в промежутках материала основы, образуемого крупноволокнистой структурой, шовным материалом или т.п., сформированного толстыми волокнами; и слоя ультратонкого волокна 3, состоящего из ультратонких волокон 1, на внутренней поверхности волокнистого слоя 2. Искусственный кровеносный сосуд согласно настоящему изобретению формируют путем изготовления такой волокнистой структуры в трубчатой (пустотелой) форме.
В качестве способа производства для формирования волокнистой структуры, в которой ультратонкие волокна распределены в промежутках материала основы, образуемого крупноволокнистой структурой, шовным материалом или т.п., можно использовать обычный способ производства ультратонких волокон. Многокомпонентное волокно со структурой типа "острова в море" вместе с волокном, которое имеет размер, подходящий для образования прочного материала основы, подвергают плетению, вязке или переработке в плетеный или нетканый материал, и затем структуру типа "море" части многокомпонентного волокна растворяют с применением щелочи или т.п. для осуществления обработки по приданию волокнам ультратонкости. Таким способом предпочтительно получают ультратонкое волокно в материале основы и слой ультратонкого волокна.
В дальнейшем прореженную структуру, которая более желательна для клеток, можно обеспечивать путем переплетения ультратонкого волокна с материалом основы с помощью водоструйного способа, воздушно-соплового способа или т.п. Чтобы обеспечить более эффективное использование клеточной аффинности, образование слоя ультратонкого волокна на поверхности, контактирующей с кровью, дополнительно можно промотировать с помощью способа, при котором, например, поверхность, контактирующую с кровью, обрабатывают напильником для взлохмачивания поверхности.
Волокнистый материал не ограничивается при условии, что он представляет собой полимер, обладающий биосовместимостью. Примеры волокнистого материала включают в себя сложный полиэфир, полиэтилен, политетрафторэтилен, полиуретан, полиамид и нейлон. Среди упомянутых волокнистых материалов предпочтительным является сложный полиэфир, особенно полиэтилентерефталат, поскольку обычно он применяется в клинической практике в качестве материала для искусственных кровеносных сосудов и обладает превосходной прочностью.
Волокно может находиться в любой форме, и примеры такой формы включают в себя однониточную пряжу, мультифиламентную пряжу, монофиламентную пряжу и пряжу из фибриллированной пленки. В качестве такой формы волокна с точки зрения прочности, однородности физических свойств и гибкости превосходной является мультифиламентная пряжа. Пряжа может быть либо некрученой, либо крученой. Пряжа может обладать определенной степенью извитости.
Суммарная тонина волокна предпочтительно составляет от 1 до 60 децитекс (дтекс), более предпочтительно от 1 до 40 децитекс. Нижний предел суммарной тонины волокна более предпочтительно составляет 5 децитекс, наиболее предпочтительно - 10 децитекс. Верхний предел суммарной тонины волокна более предпочтительно составляет 35 децитекс, наиболее предпочтительно - 25 децитекс. Прочность, необходимую для основной структуры искусственного сосуда, можно сохранять в случае суммарной тонины волокна, равной не менее 1 децитекс, и толщину основной структуры искусственного сосуда можно уменьшать в случае суммарной тонины волокна, равной не более 40 децитекс.
Тонина однониточной пряжи предпочтительно составляет от 0,5 до 10 децитекс (дтекс), более предпочтительно от 0,5 до 3,0 децитекс. Нижний предел тонины однониточной пряжи более предпочтительно составляет 1 децитекс, и верхний предел тонины однониточной пряжи более предпочтительно составляет 2 децитекс. В тех случаях, когда тонина однониточной пряжи составляет не менее 3 децитекс, гибкость ухудшается. В тех случаях, когда тонина однониточной пряжи составляет не более 0,5 децитекс, степень гидролиза высокая, и существует проблема ухудшения прочности.
В трубчатом материале, который формирует искусственный кровеносный сосуд, в качестве материала применяют ткань благодаря ее превосходной пространственной стабильности и прочности.
Для увеличения количества иммобилизованного на поверхности волокна полимера, содержащего четвертичную аммониевую группу, в часть ткани можно эффективно вводить ультратонкие мультифиламентные нити с тониной однониточной пряжи. Диаметр волокна однониточной пряжи в таких ультратонких мультифиламентных нитях с тониной однониточной пряжи предпочтительно составляет от 10 нм до 20 мкм, более предпочтительно от 10 нм до 3 мкм, наиболее предпочтительно - от 0,8 до 1,2 мкм.
Размер и количество промежутков между волокнами волокнистого слоя и размер слоя ультратонкого волокна в искусственном кровеносном сосуде можно представить с помощью коэффициента водопроницаемости при давлении 120 мм рт.ст., который для волокнистого слоя с промежутками между волокнами предпочтительно соответствует значению от 100 мл/см2/мин до 4000 мл/см2/мин. Для формирования интимы, содержащей стабильный слой сосудистых клеток эндотелия на поверхности искусственного кровеносного сосуда, контактирующей с кровью, большое значение имеет клеточный слой, который служит подложкой для интимы и в основном содержит сосудистые гладкомышечные клетки и фибробласты. Клетки для такого клеточного слоя вместе с сосудистыми клетками эндотелия, которые мигрируют по поверхности кровеносного сосуда, проходят сквозь промежутки между волокнами и проникают из анастомотической сети внутрь сосуда. Сосудистые клетки эндотелия не только проникают из анастомотической сети, но также инфильтруются с участков внутренней стенки искусственного кровеносного сосуда, где кровеносными капиллярами, которые проникают с наружной стенки искусственного кровеносного сосуда сквозь промежутки между волокнами, формируются отверстия.
В связи с этим водопроницаемость волокнистого слоя с промежутками между волокнами предпочтительно составляет не менее 100 мл/см2/мин., поскольку в таких случаях легко происходит формирование интимы вследствие инфильтрации внутренней поверхности волокнистого слоя клетками и кровеносными капиллярами. В тех случаях, когда водопроницаемость волокнистого слоя с промежутками между волокнами составляет не более 4000 мл/см2/мин., клеточные псевдоподии более легко достигают внутренней поверхности волокнистого слоя и заполняют промежутки, предотвращая при этом пропотевание (просачивание) плазмы крови, что является предпочтительным.
Размер искусственного кровеносного сосуда согласно настоящему изобретению не ограничивается. Искусственный кровеносный сосуд согласно настоящему изобретению наиболее эффективен в качестве тонкого искусственного кровеносного сосуда с внутренним диаметром не менее 1 мм и менее 10 мм.
В настоящем изобретении реализуется как клеточная аффинность, так и антитромбогенность путем образования связей между полимером, содержащим четвертичную аммониевую группу, содержащую три алкильных группы, в каждой из которых число атомов углерода равно 10 или менее, и поверхностью волокон и ультратонких волокон, составляющих материал основы, и дополнительного связывания гепарина с полимером, содержащим четвертичную аммониевую группу, с помощью ионной связи.
Гепарин специально не ограничивается при условии, что он может ингибировать реакцию свертывания крови, и примеры гепарина включают в себя гепарин, обычно широко применяемый в клинической практике, нефракционированный гепарин и низкомолекулярный гепарин, а также гепарин с высоким сродством к антитромбину III.
Поскольку гепарин представляет собой большую молекулу с молекулярной массой от 30000 до 35000 дальтон, он может быть иммобилизован на поверхности только в ограниченном количестве. Несмотря на то, что в клинической практике также применяются низкомолекулярные гепарины, молекулярные массы которых ниже, чем молекулярная масса гепарина, даже такие низкомолекулярные гепарины имеют молекулярные массы вплоть до 4000-6000 дальтон, что приблизительно в 10 раз превышает молекулярные массы синтетических антитромботических веществ. Гепарин может ингибировать активность тромбина только после связывания с антитромбином III и тромбином. Поскольку сайты связывания антитромбина III и тромбина в молекуле встречаются произвольно, очень трудно регулировать иммобилизацию на поверхности, обеспечивая при этом расположение таких сайтов связывания в оптимальных положениях. Такая трудность также является причиной низкой эффективности реакции иммобилизации на поверхности. Следовательно, в настоящем изобретении, полимер, содержащий четвертичную аммониевую группу, связывается с поверхностью волокон, а гепарин ионно связывается с полимером, содержащим четвертичную аммониевую группу.
Более конкретно, выбирают способ, в котором полимер, содержащий аминогруппы, такой как полиэтиленимин, полиаллиламин или полилизин, которые являются поликатионами, иммобилизуют на поверхности и затем аминогруппы преобразуют в четвертичные аммониевые группы; способ, в котором полимеризуемый мономер, содержащий аминогруппу, подвергают графт-полимеризации с поверхностью, и затем аминогруппы преобразуют в четвертичные аммониевые группы; или способ, в котором осуществляют иммобилизацию полимера, содержащего четвертичную аммониевую группу, такого как хлорид полидиаллилдиметиламмония, на поверхности волокон.
Способ иммобилизации полимера, содержащего аминогруппы или четвертичные аммониевые группы, специально не ограничивается, и выбирают способ, отличающийся от способа, при котором раствор полимера наносится на поверхность волокон и затем выпаривается растворитель. Предпочтительно использовать способ, в котором на поверхность волокон вводят реакционноспособные функциональные группы и затем полимер связывают с волокнами с помощью химической реакции; способ, в котором волокна облучают высокоэнергетическим пучком, таким как пучок γ-лучей или пучок электронов, в условиях, когда волокна погружены в водный раствор полимера, содержащего аминогруппы или четвертичные аммониевые группы; или способ, в котором волокна подвергают плазменной обработке и затем обеспечивают контактирование с раствором полимера, содержащим аминогруппы или четвертичные аммониевые группы.
Молекулярная масса и химическая структура применяемого полимера не ограничивается, и предпочтительным является низкомолекулярный полимер с молекулярной массой от 1000 до 50000, или даже полимер с большой молекулярной массой, например, более 50000; и полимер с разветвленной структурой.
В качестве способа преобразования аминогрупп иммобилизованного на поверхности волокон полимера, содержащего аминогруппы, в четвертичные аммониевые группы, наиболее предпочтительным является способ, в котором реакцию осуществляют в растворе, в котором растворено галогеналкильное соединение, такое как алкилбромид.
Если число атомов углерода в алкильных группах, содержащихся в полимере, содержащем четвертичную аммониевую группу, слишком велико, гидрофобность увеличивается, и гепарин не может связываться с катионными группами. Следовательно, число атомов углерода, приходящееся на одну алкильную группу, предпочтительно составляет 10 или менее; и с учетом сродства к гепарину и легкости обработки во время реакции преобразования в четвертичные аммониевые группы, число атомов углерода наиболее предпочтительно составляет от 2 до 6. Нет необходимости, чтобы три алкильные группы, входящие в состав четвертичной аммониевой группы, содержали одинаковое число атомов углерода, поэтому число атомов углерода в алкильных группах может быть разным.
В качестве способа связывания гепарина с волокнами, поверхность которых содержит четвертичные аммониевые группы, наиболее предпочтительным является способ, в котором волокна погружают в водный раствор гепарина. Соответствующим образом можно выбирать температуру водного раствора, время и значение pH.
Антитромбогенность и клеточную аффинность искусственного кровеносного сосуда согласно настоящему изобретению исследовали путем измерения водопроницаемости, остаточной активности гепарина поверхности волокна после промывки, количества катионов на поверхности волокна, степени адгезии тромбоцитов, степени клеточной адгезии и адгезии тромбов.
Водопроницаемость
По схеме случайного отбора выбирают два участка искусственного кровеносного сосуда, и для каждого образца дважды проводят измерения согласно описанному ниже способу с последующим расчетом на основе измеренных значений среднего арифметического значения. Искусственный кровеносный сосуд разрезают вдоль направления оси и готовят образец в виде куска размером 1 см × 1 см. Образец материала размером 1 см × 1 см зажимают между двумя кусками прокладочного материала тороидальной формы диаметром 4 см, на каждом из которых пробито отверстие диаметром 0,5 см, таким образом, чтобы поток жидкости мог проходить только сквозь пробитое отверстие. Полученный образец помещают в гнездо для фильтра, применяемого для циркуляционной фильтрации. Через такой фильтр для циркуляционной фильтрации пропускают воду, отфильтрованную через обратноосмотическую мембрану, при температуре 25°C в течение не менее 2 минут до тех пор, пока отобранный образец не будет содержать достаточное количество воды. В условиях температуры 25°C и избыточного фильтрационного давления 120 мм рт.ст. в течение 30 секунд осуществляют фронтальную (тупиковую) фильтрацию воды, отфильтрованной через обратноосмотическую мембрану, под внешним давлением, измеряя при этом количество воды (мл), которое проходит сквозь участок диаметром 1 см. Проникший через образец объем рассчитывают путем округления измеренного значения до целого числа. Водопроницаемость при давлении 120 мм рт.ст. определяют путем преобразования проникшего через образец объема (мл) в значение, соответствующее объему в единицу времени (мин.) через единицу эффективной площади отобранного образца (см2).
Что касается искусственного сосуда после иммобилизации гепарина, связывающую способность гепарина, связанного с поверхностью волокна, можно измерять согласно способу измерения остаточной активности гепарина на поверхности волокна, описанному ниже. Что касается остаточной активности гепарина на поверхности волокна, более высокое значение соответствует лучшей остаточной активности гепарина, и остаточная активность гепарина предпочтительно составляет 20 мМЕ/см2 или более.
Способ измерения остаточной активности гепарина на поверхности волокна
Искусственный сосуд рассекают в направлении оси и отрезают образец в виде куска размером 1 см × 1 см. Кусок промывают 10 мл физиологического раствора при 37°C в течение 30 минут. Промытый образец подвергают взаимодействию согласно инструкциям, прилагаемым к набору Test team Heparin S (Sekisui Medical Co., Ltd.), и измеряют поглощение при 405 нм с применением считывающего устройства для микропланшетов (Corona Electric Co., Ltd., MTP-300), и рассчитывают активность гепарина согласно инструкциям, прилагаемым к набору реактивов.
Что касается искусственного сосуда после иммобилизации гепарина, количество катионов, связанных с поверхностью волокна, можно измерять согласно описанному ниже способу измерения количества катионов на поверхности волокна. В свою очередь, что касается количества катионов на поверхности волокна, чем больше количество катионов, тем лучше, и количество катионов предпочтительно составляет 1 мкг/см2 или более.
Способ измерения количества катионов на поверхности волокна
Один грамм кольцеобразного образца, полученного при нарезании искусственного кровеносного сосуда на тонкие диски в поперечном направлении, разрезают на 10 небольших кусков, каждый из которых имеет массу 0,1 г, вдоль продольного направления исходного кровеносного сосуда, и при 37°C в течение 24 часов осуществляют экстракцию физиологическим раствором из расчета 10 мл физиологического раствора на 1 г образца. После экстракции образец пропитывают раствором анионного красителя Orange II (молекулярная масса: 350,33, Wako Pure Chemical Industries, Ltd.) в ацетатном буфере (pH 4,0) при 37°C в течение 1 часа, и затем образец промывают тем же самым буфером и водой, соответственно, в течение 10 минут каждым из них. Образец обрабатывают 1 мМ водным раствором гидроксида натрия при 37°C в течение 30 минут, чтобы экстрагировать Orange II, и нейтрализуют экстракт 21 мМ раствором хлористоводородной кислоты. С применением считывающего устройства для микропланшетов (Corona Electric Co., Ltd., MTP-300) измеряют поглощение при 482 нм и 550 нм, и величину поглощения при 550 нм вычитают из величины поглощения при 480 нм. С применением полученной дополнительно калибровочной кривой из разности поглощений определяют связанное количество катиона.
С помощью следующего способа измерения степени адгезии тромбоцитов на поверхности волокна после иммобилизации вещества с антитромбиновой активностью в искусственном кровеносном сосуде можно измерять степень адгезии тромбоцитов на поверхности волокна. Чем ниже степень адгезии тромбоцитов на поверхности волокна, тем лучше. Предпочтительно степень адгезии тромбоцитов на поверхности волокна составляет менее 20%.
Способ измерения степени адгезии тромбоцитов на поверхности волокна
Искусственный кровеносный сосуд разрезают вдоль направления оси и готовят дискообразный образец с диаметром 12 мм путем вырубания с применением пробойника. Отобранный образец помещают в лунку 24-луночного культурального микропланшета (производства компании Sumitomo Bakelite Co., Ltd.) таким образом, чтобы поверхность, контактирующая с кровью, была обращена вверх, и кладут на него металлический груз трубчатой формы с толщиной стенки 3 мм. Добавляют в лунку обогащенную тромбоцитами плазму, полученную дополнительно, таким образом, чтобы число тромбоцитов составляло приблизительно 108 на лунку. Микропланшет оставляют стоять при 37°C в течение 2 часов, затем образец извлекают и промывают ФСБ (-) (Nissui) с последующим разрушением тромбоцитов и измерением активности образовавшейся ЛДГ (лактатдегидрогеназы) согласно протоколу, описанному в отношении набора реактивов для оценки цитотоксичности по активности ЛДГ (Takara Bio Inc.). Исходя из полученной дополнительно калибровочной кривой, определяют число прилипших тромбоцитов. Как показано ниже в уравнении 1, чтобы определить степень адгезии тромбоцитов, определяют отношение числа тромбоцитов после контактирования с отобранным образцом к числу тромбоцитов в обогащенной тромбоцитами плазме перед контактированием.
Степень адгезии тромбоцитов (%) = (число прилипших тромбоцитов после контактирования/число тромбоцитов в обогащенной тромбоцитами плазме) × 100 (уравнение 1)
Адгезивность клеток
Искусственный кровеносный сосуд разрезают вдоль направления оси и готовят дискообразный образец диаметром 12 мм путем вырубания с применением пробойника. Отобранный образец помещают в лунку 24-луночного культурального микропланшета (производства компании Sumitomo Bakelite Co., Ltd.), и кладут на него металлический груз трубчатой формы с толщиной стенки 3 мм. К образцу добавляют обычные эндотелиальные клетки вены пуповины человека (Takara Bio Inc.), суспендированные в среде DMEM, дополненной 10% ФТС (фетальная телячья сыворотка), таким образом, чтобы в лунке содержалось 106 клеток. Микропланшет оставляют стоять при 37°C в течение 12 часов, после чего из него удаляют образец и промывают образец ФСБ (-) (Nissui) с последующим выделением клеток с помощью ферментативной обработки и измерением числа выделенных клеток с применением набора реактивов MTT Assay Kit (производства Funakoshi Corporation). Как показано ниже в уравнении 2, чтобы определить степень клеточной адгезии, определяют отношение число прилипших клеток к числу клеток, нанесенных на образец.
Степень клеточной адгезии (%) = (число прилипших клеток/число нанесенных клеток) × 100 (уравнение 2)
Адгезия тромбов при циркуляции крови
Отрезали кусок искусственного кровеносного сосуда длиной 4 см и соединяли его с трубкой из поливинилхлорида с таким же внутренним диаметром, что и искусственный кровеносный сосуд, и длиной 32 см. В трубку вводили 4,5 мл свежезаготовленной донорской крови, дополненной гепарином с конечной концентрацией 0,5 МЕ/мл, и оба конца незамедлительно заделывали с образованием замкнутого контура. Полученный замкнутый контур фиксировали на рамке, присоединенной к ротору, вращающемуся со скоростью вращения 14 об/мин в сушильном шкафу с терморегулятором влажности, температуру которого предварительно доводили до 37°C, и вращали в течение 120 минут. Затем замкнутый контур вытаскивают, и отрезают трубку из поливинилхлорида, чтобы удалить кровь, с последующим ополаскиванием с применением ФСБ(-) (Nissui). Затем определяли наличие или отсутствие тромбов, образовавшихся в искусственном кровеносном сосуде. Данное испытание осуществляют трижды (N=3). То же самое испытание осуществляют с применением в качестве отрицательного контроля ФСБ(-) вместо свежезаготовленной донорской крови. Измеряют массу искусственного кровеносного сосуда длиной 4 см в сухом состоянии перед испытанием и после удаления крови и ополаскивания; разность между такими измеренными значениями рассматривают в качестве массы тромбов и рассчитывают ее среднее значение и стандартное отклонение. В тех случаях, когда среднее значение, полученное для образца, составляет не менее чем (среднее значение + 3 × стандартное отклонение) для отрицательного контроля, результат оценивают как "+"; и в тех случаях, когда среднее значение, полученное для образца, меньше такого значения, результат оценивают как "-". В тех случаях, когда во время циркуляции крови обнаруживают пропотевание плазмы через искусственный кровеносный сосуд, результат оценивают как "пропотевание" независимо от количества просочившейся плазмы, и испытание прекращают.
ПРИМЕРЫ
Конкретные примеры искусственного кровеносного сосуда согласно настоящему изобретению подробно описаны ниже.
Примеры
Трубчатый материал получали в виде ткани полотняного переплетения с применением полиэтилентерефталатного волокна (55 дтекс-48f) в качестве основы и полимерного матричного волокна (245 дтекс-40 f) в качестве уточной нити. Применяемое для этого полимерное матричное волокно состояло из 20 частей полистирола в качестве компонента типа "моря" и 80 частей полиэтилентерефталата в качестве компонента типа "остров", и число "островов" составляло 36/f. Полученную трубку в достаточной степени обрабатывали водным раствором гидроксида натрия при 80°C и погружали в толуол. Затем материал подвергали ворсованию с применением ворсовальной машины и водоструйному скреплению.
Затем трубчатый материал, полученный после описанных выше обработок, обрабатывали 0,5% водным раствором гидроксида натрия и подвергали окислению 5%-ным раствором перманганата калия. Затем добавляли полиэтиленимин (молекулярная масса 600, Wako Pure Chemical Industries, Ltd.) в присутствии 0,1% 1-(3-диметиламинопропил)-3-этилкарбодиимида для осуществления взаимодействия волокон трубчатого материала с полиэтиленимином. Полиэтиленимин, иммобилизованный на поверхности волокон, подвергали преобразованию с получением четвертичных аммониевых групп в 1% растворе этилбромида, бутилбромида, гексилбромида, октилбромида или децилбромида в метаноле при 50°C. В заключение материал погружали в 0,8% водный раствор гепарин натрия (Wako Pure Chemical Industries, Ltd.) при 70°C, получая при этом антитромботический трубчатый материал, предназначенный для применения в качестве искусственного кровеносного сосуда.
В таблице 1 приведены результаты определения характеристик каждого антитромботического трубчатого материала, полученные при измерении водопроницаемости, остаточной активности гепарина на поверхности волокна после промывки, количества катионов на поверхности волокна, степени адгезии тромбоцитов, степени клеточной адгезии и адгезии тромбов.
В данном описании антитромботический трубчатый материал, к которому с помощью ковалентных связей присоединяли полимер, содержащий четвертичную аммониевую группу, содержащую C2-алкильные группы, обозначали как образец 1; антитромботический трубчатый материал, к которому с помощью ковалентных связей присоединяли полимер, содержащий четвертичную аммониевую группу, содержащую C4-алкильные группы, обозначали как образец 2; антитромботический трубчатый материал, к которому с помощью ковалентных связей присоединяли полимер, содержащий четвертичную аммониевую группу, содержащую C6-алкильные группы, обозначали как образец 3; антитромботический трубчатый материал, к которому с помощью ковалентных связей присоединяли полимер, содержащий четвертичную аммониевую группу, содержащую C8-алкильные группы, обозначали как образец 4; и антитромботический трубчатый материал, к которому с помощью ковалентных связей присоединяли полимер, содержащий четвертичную аммониевую группу, содержащую C10-алкильные группы, обозначали как образец 5.
Пример 2
Трубчатые материалы, приготовленные в примере 1, погружали в водные растворы полиэтиленимина (PEI), полиаллиламина (PAA) и хлорида полидиаллилдиметиламмония (PDDA), соответственно, и облучали γ-лучами при 5 кГр (компания Koga Isotope) в погруженном в раствор состоянии. Полученные материалы промывали раствором Triton-X100 и водой, получая при этом антитромботические трубчатые материалы. Трубчатые материалы, на которых был иммобилизован полиэтиленимин или полиаллиламин, подвергали обработке для преобразования с получением четвертичных аммониевых групп таким же способом, как в примере 1 с применением этилбромида. К трубчатым материалам, на которых был иммобилизован полиэтиленимин с группами, преобразованными в четвертичные аммониевые группы, полиаллиламин с группами, преобразованными в четвертичные аммониевые группы, и хлорид полидиаллилдиметиламмония, соответственно, с помощью ионных связей присоединяли гепарин таким же способом, как в примере 11, получая при этом антитромботические трубчатые материалы.
В данном описании антитромботический трубчатый материал, полученный путем связывания полиэтиленимина при облучении γ-лучами, преобразования до четвертичных аммониевых групп и ионного связывания гепарина, обозначали как образец 6; антитромботический трубчатый материал, полученный путем связывания полиаллиламина при облучении γ-лучами, преобразования до четвертичных аммониевых групп и ионного связывания гепарина, обозначали как образец 7; и антитромботический трубчатый материал, полученный путем связывания полидиаллилдиметиламмония при облучении γ-лучами, преобразования до четвертичных аммониевых групп и ионного связывания гепарина, обозначали как образец 8.
В таблице 1 приведены результаты определения характеристик каждого антитромботического трубчатого материала, полученные при измерении водопроницаемости, остаточной активности гепарина на поверхности волокна после промывки, количества катионов на поверхности волокна, степени адгезии тромбоцитов, степени клеточной адгезии и адгезии тромбов.
Пример для сравнения 1
Описанный в примере 1 трубчатый материал, на котором был иммобилизован полиэтиленимин, связывали с гепарином таким же способом, как в примере 1, и полученный материал обозначали как образец 9. Антитромботический трубчатый материал, полученный путем ковалентного связывания полимера, содержащего четвертичную аммониевую группу, содержащую C12-алкильные группы, полученного путем преобразования полиэтиленимина с помощью додецилбромида с получением четвертичных аммониевых групп, и ионного связывания гепарина таким же способом, как в примере 1, обозначали как образец 10.
Пример для сравнения 2
Описанные в примере 2 трубчатые материалы, на которых были иммобилизованы полиэтиленимин и полиаллиламин, соответственно, ионно связывали с гепарином таким же способом, как в примере 1. В данном описании антитромботический трубчатый материал, полученный путем связывания полиэтиленимина при облучении γ-лучами и ионного связывания гепарина, обозначали как образец 11; и антитромботический трубчатый материал, полученный путем связывания полиаллиламина при облучении γ-лучами и ионного связывания гепарина, обозначали как образец 12.
Пример для сравнения 3
Трубчатый материал получали в виде ткани полотняного переплетения высокой плотности с применением полиэтилентерефталата (55 дтекс-48 f) в качестве основы и полимерного матричного волокна (245 дтекс-40 f) в качестве уточной нити. Полученный трубчатый материал подвергали последовательности операций по примеру 1, и полученный антитромботический трубчатый материал обозначали как образец 13.
Пример для сравнения 4
Трубчатый материал получали с применением полиэтилентерефталата, как в качестве основы, так и в качестве уточной нити. Полученный трубчатый материал подвергали последовательности операций по примеру 1 и полученный антитромботический трубчатый материал обозначали как образец 14.
Пример для сравнения 5
В 2 л диметилформамида растворяли 120 г поливинилхлорида со степенью полимеризации 550 и добавляли 704 г диэтилдитиокарбамата натрия. Полученный раствор оставляли взаимодействовать при 50°C в течение 3 часов, переосаждали из метанола и сушили, получая при этом фотохимически активированный поливинилхлорид (далее для краткости упоминаемый как "DTC-поливинилхлорид"). 80 г полученного DTC-поливинилхлорида растворяли в 1250 мл тетрагидрофурана и добавляли 200 г метакрилата метоксиполиэтиленгликоля (со степенью полимеризации полиэтиленгликольного фрагмента от 20 до 23) и 80 г диметиламиноэтилметакрилата. Полученный раствор облучали с помощью ртутной лампы высокого давления (100 В, Ushio Inc. UM-102) при 30°C в течение 9,5 часов для осуществления фотохимически индуцированной (при помощи УФ-света) полимеризации. 10%-ный раствор полученного полимера в тетрагидрофуране наносили в виде покрытия на трубчатый материал, описанный в примере 1. После сушки материала при пониженном давлении в течение полных суток, добавляли к трубчатому материалу этилбромид и позволяли полученной смеси взаимодействовать при 50°C. После промывки с помощью ионного связывания присоединяли гепарин путем погружения материала в 1%-ный водный раствор гепарина при 60°C. После завершения реакции полученный антитромботический трубчатый материал обозначали как образец 15. Толщина покрытия составляла 20 мкм.
В таблице 1 приведены результаты определения характеристик каждого из антитромботических трубчатых материалов по примерам для сравнения, полученные при измерении водопроницаемости, остаточной активности гепарина на поверхности волокна после промывки, количества катионов на поверхности волокна, степени адгезии тромбоцитов, степени клеточной адгезии и адгезии тромбов.
|
Как видно из таблицы 1, в тех случаях, когда был иммобилизован полимер, содержащий четвертичную аммониевую группу, остаточная активность гепарина на поверхности волокна искусственного кровеносного сосуда была высокой и во время циркуляции крови не наблюдалось тромбообразования. С другой стороны, в тех случаях, когда был иммобилизован полимер, не содержащий четвертичную аммониевую группу, остаточная активность гепарина была низкой и наблюдалось тромбообразование. Что касается образца 14 со слишком высокой водопроницаемостью, в испытании с замкнутым контуром наблюдалось пропотевание (просачивание плазмы крови). В тех случаях, когда был иммобилизован полимер, содержащий четвертичную аммониевую группу, активность гепарина на поверхности была высокой и влияние на подавление тромбообразования было высоким. В тех случаях, когда толщина покрытия была большой, как в случае образца 15, волокнистый материал был перекрыт и клеточная адгезия снижалась.
Промышленная применимость
Настоящее изобретение можно применять для получения искусственного кровеносного сосуда, который можно обеспечивать как антитромбогенностью, так и клеточной аффинностью, который промотирует формирование интимы после вживления и сохраняет антитромбогенность во время формирования интимы и который может сохранять свою проходимость в течение длительного времени.
Описание символов
1 - ультратонкое волокно;
2 - волокнистый слой;
3 - слой ультратонкого волокна.