Результат интеллектуальной деятельности: Энантиомеры 6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, обладающие туберкулостатической активностью
Вид РИД
Изобретение
Настоящее изобретение относится к энантиомерам 6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина. Указанные соединения могут быть использованы в качестве противотуберкулезных агентов, в первую очередь для лечения больных туберкулезом.
Рацематы заявляемых соединений описаны [Европейский патент №183848], они известны как модуляторы кальциевых каналов [Европейский патент №0217142], селективные и малотоксичные противотуберкулезные агенты [патент РФ №2360905]. Энантиомеры 6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, а также их активность в отношении микобактерий туберкулеза не известны и не описаны.
Аналогом заявляемых соединений по строению является противоопухолевый препарат из класса замещенных дигидропиримидинов - 5-фторурацил формулы I, который был использован для лечения экспериментального туберкулеза лабораторных животных [патент РФ №2165761].
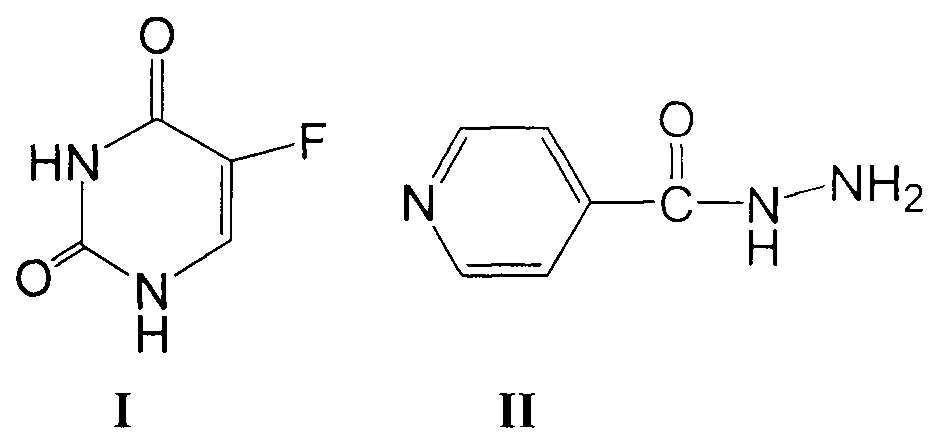
Однако 5-фторурацил токсичен, а его туберкулостатическая активность в опытах in vitro невысока (MIC = 600 мкг/мл) [патент РФ №2153339].
Аналог по назначению, изониазид формулы II, является селективным противотуберкулезным препаратом, однако, недостатками этого препарата являются его высокая токсичность и различные побочные эффекты при применении. Изониазид вызывает аллергию, негативно влияет на функцию желудочно-кишечного тракта, имеет побочное действие на нервную систему [М.Д. Машковский, Лекарственные средства, т. II, Харьков, Торгсин, 1998, с. 332? и Фармакология и токсикология, 1987, 50, (4), с. 87]. Отмечено широкое распространение устойчивых к изониазиду клинических штаммов микобактерий.
Мировая фармацевтическая промышленность уделяет все большее внимание использованию энантиомерночистых лекарственных средств и постепенно осуществляет замену рацематов чистыми энантиомерами во всех областях терапии [Е. Hodgson. A Textbook of modern toxicology (4th edition). Wiley-Interscience, 2004, 557-558; M. Breuer, K. Ditrich, T. Habicher, B. Hauer, M.  , T. Zelinski. «Industrial Methods for the Production of Optically Active Intermediates». Angew. Chem. Int. Ed., 2004, 43, 788-824].
, T. Zelinski. «Industrial Methods for the Production of Optically Active Intermediates». Angew. Chem. Int. Ed., 2004, 43, 788-824].
Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration) поощряет создание хирально чистых лекарственных препаратов и создает серьезные ограничения для использования рацематов [Burke D., Henderson D.J. Br. J. Anaesth., 2002, V. 88. P. 563-576; Gurjar M.J. Indian Med. Assoc., 2007, Vol. 105 (4), P. 177-178]. Подобная тенденция намечается и в России. Это связано с возможными различиями фармакологического действия энантиомеров, входящих в состав рацемата.
Например, для структурных аналогов заявляемых соединений - замещенных 1,4-дигидропиримидинов отмечено, что энантиомеры могут обладать различной или разнонаправленной активностью, один может являться блокатором кальциевых каналов, в то время как другой энантиомер действует в обратном направлении, нивелируя биологическое действие первого [Кубиньи Г. Рос. Хим. Ж., 2006, Т.L, №2, С. 5-17]. Для соединений, обладающих туберкулостатической активностью, также описаны случаи различной активности энантиомеров [R. Chofor, S. Sooriyaarachchi, et al. J. Med. Chem., 2015, 58, 2988-3001].
Развитие лекарственной устойчивости Mycobacterium tuberculosis (МБТ) к известным противотуберкулезным препаратам и значительная токсичность большинства из них диктует необходимость создания новых туберкулостатиков, характеризующихся высокой эффективностью при низкой токсичности. Это возможно при внедрении в медицинскую практику соединений, отличающихся механизмом действия от применяемых в практической медицине противотуберкулезных препаратов. В этом отношении интерес представляют хиральные ингибиторы ферментов МБТ, особенно энантиомерночистые. Последние способны к более специфичному взаимодействию со связывающими сайтами ферментов, которые представляют собой фрагменты оптически активных аминокислот.
Задача - выявление новых энантиомерночистых соединений, обладающих высокой туберкулостатической активностью, особенно в отношении лекарственно устойчивых штаммов микобактерий.
Поставленная задача решается тем, что в качестве противотуберкулезных агентов используют энантиомеры: (+)6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин (III), (-)6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин (IV) и (+)6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин (V), (-)6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин (VI) общей формулы:
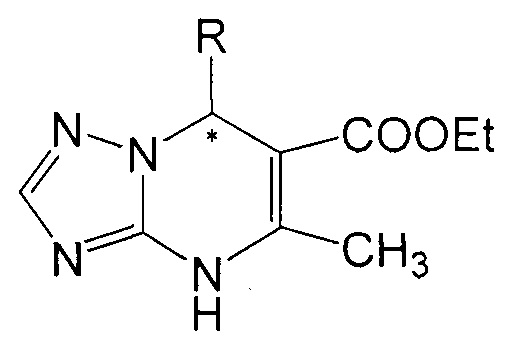
где R = фенил или тиен-2-ил, которые получают путем разделения соответствующих рацематов (±)6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и (±)6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина с использованием препаративной ВЭЖХ (хиральная колонка).
Для получения энантиомеров III-VI используют ВЭЖХ в обращено-фазовом варианте, хроматограф Agilent 1200 фирмы «Agilent Technologies», США, препаративная хиральная колонка Kromasil 5-CelluCoat 150×21.2 мм, подвижная фаза CH3CN:Н2О (3:7), детектирование при длине волны 293 нм, скорость подачи подвижной фазы 1,0 мл/мин, комнатная температура.
При несоблюдении указанных параметров: состава подвижной фазы (концентрации ацетонитрила в воде) и скорости ее подачи, ухудшается разделение соединений III и IV, а также V и VI (уменьшается коэффициент разделения) и/или увеличивается время процесса, что приводит к снижению выхода целевых соединений. Собранные фракции упаривают досуха при температуре не более 40°C, высушивают до постоянного веса. Подлинность и индивидуальность полученных соединений подтверждают данными аналитической ВЭЖХ и спектроскопией 1Н ЯМР.
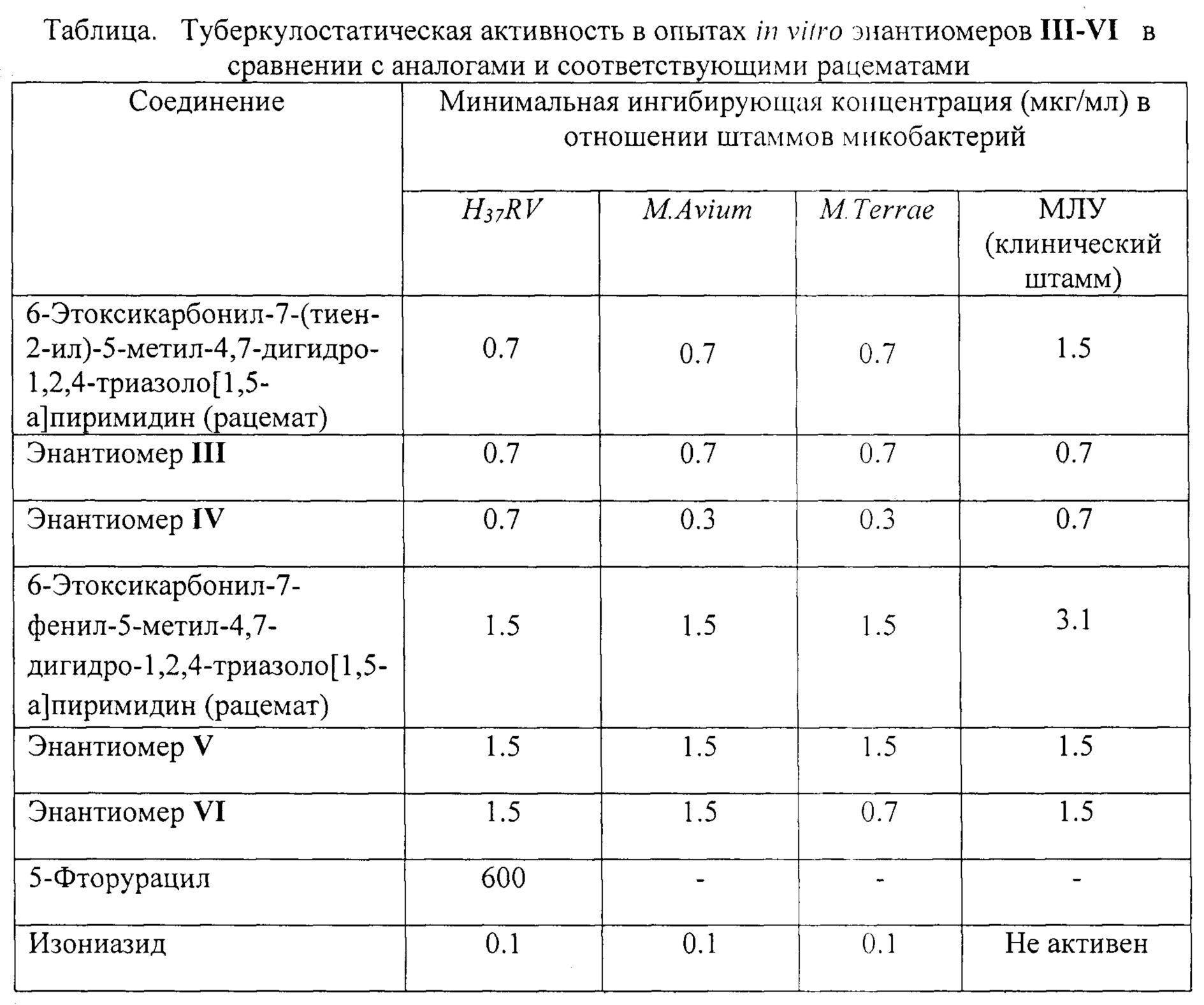
Особенности строения энантиомеров III-VI приводят к повышению туберкулостатической активности указанных соединений. В сравнении с аналогом по строению I энантиомеры III-VI обладают более высокой туберкулостатической активностью в отношении штамма H37RV, в сравнении с аналогом II активны в отношении штамма с множественной лекарственной устойчивостью (МЛУ) (Таблица). Отмечено увеличение туберкулостатической активности в 2-2.3 раза при переходе от рацематов к энантиомерам IV и VI в отношении атипичных штаммов микобактерий M. Avium и/или М. Terrae, а также в отношении штамма с множественной лекарственной устойчивостью (МЛУ).
Разделение рацематов на энантиомеры и оценку их оптической чистоты проводят на хроматографе «Agilent 1200», США; величину оптического вращения для энантиомеров III-VI определяют на приборе «Perkin Elmer 341», США.
Исследование антимикобактериальной активности заявляемых соединений формулы III-VI в опытах in vitro проводят бактериологически методом вертикальной диффузии на плотной питательной среде Ливенштейна-Йенсена или «Новая». В пробирку с засеянным тест-микробом по свободному краю на дно закапывают по 0.3 мл каждого разведения. Пробирки помещают в термостат в вертикальном положении и инкубируют при 37°C, результаты анализируют на 10-12 сутки.
Примеры конкретного выполнения
Пример 1
Получение (+)6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина (III) и (-)6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина (IV) (хиральное ВЭЖХ разделение рацемата 6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина)
40 мг рацемического продукта (соотношение энантиомеров III и IV 1:1) подвергают препаративной ВЭЖХ в следующих условиях: колонка Kromasil 5-CelluCoat, 150×21,2 мм; элюент CH3CN:H2O (3:7); скорость потока 1 мл/мин; детектор УФ, 293 нм; температура комнатная. Собирают фракцию с временем удерживания 11.99±1,0 мин и после упаривания получают 19,0 мг энантиомера IV, [α]D20=-65.42 (с=0,3; ТГФ), (выход 95.0% от его содержания в исходном рацемате); после упаривания фракции с временем удерживания 13.57±1.0 мин получают 18,2 мг энантиомера III, [α]D20=+56.76 (с=0,3; ТГФ), (выход 91,0% от его содержания в исходном рацемате).
Пример 2
Получение (+)6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин (V) и (-)6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин (VI) (Хиральное ВЭЖХ разделение рацемата 6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина)
40 мг рацемического продукта (соотношение энантиомеров V и VI 1:1) подвергают препаративной ВЭЖХ в следующих условиях: колонка Kromasil 5-CelluCoat, 150×21,2 мм; элюент CH3CN:H2O (3:7); скорость потока 1 мл/мин; детектор УФ, 293 нм; температура комнатная. Собирают фракцию с временем удерживания 13.1±1,0 мин и после упаривания получают 18,9 мг энантиомера III, [α]D20=+7.96 (с=0,3; ТГФ), (выход 94.5% от его содержания в исходном рацемате); после упаривания фракции с временем удерживания 14.9±1.0 мин получают 18,3 мг энантиомера IV, [α]D20=-7.05 (с=0,3; ТГФ), (выход 91,5% от его содержания в исходном рацемате).
![Энантиомеры 6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, обладающие туберкулостатической активностью](https://fips.edrid.ru/images/rid/06/9f/ad/8b82afaa3394b8565cc8bd4c74b4028e.jpg)
![Энантиомеры 6-этоксикарбонил-7-(тиен-2-ил)-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина и 6-этоксикарбонил-7-фенил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидина, обладающие туберкулостатической активностью](https://fips.edrid.ru/images/rid/06/9f/ad/e8024b17aa3ccd2ea14346cff3def6ba.jpg)

