Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 2-ТРИФТОРМЕТИЛИЗОНИКОТИНОВОЙ КИСЛОТЫ И ЕЕ ЭФИРОВ
Вид РИД
Изобретение
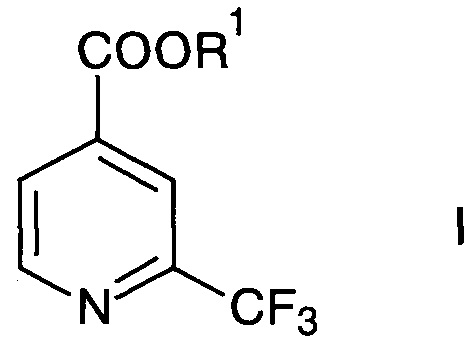
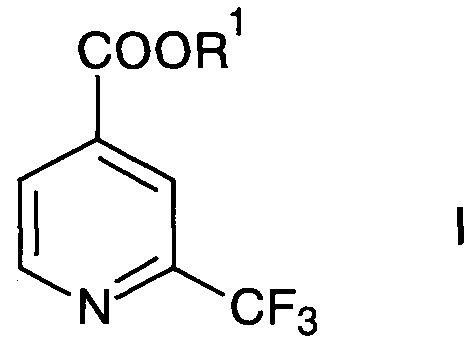
Изобретение относится к новому способу получения 2-трифторметилизоникотиновой кислоты и ее эфиров формулы
где R1 представляет собой водород или C1-6-алкил.
2-Трифторметилизоникотиновая кислота и ее эфиры формулы I являются изменяемыми промежуточными соединениями для получения активных фармацевтических и агрохимических веществ (например, Manfred Schlosser et al., Eur. J. Org. Chem. 2003, 1559-1568).
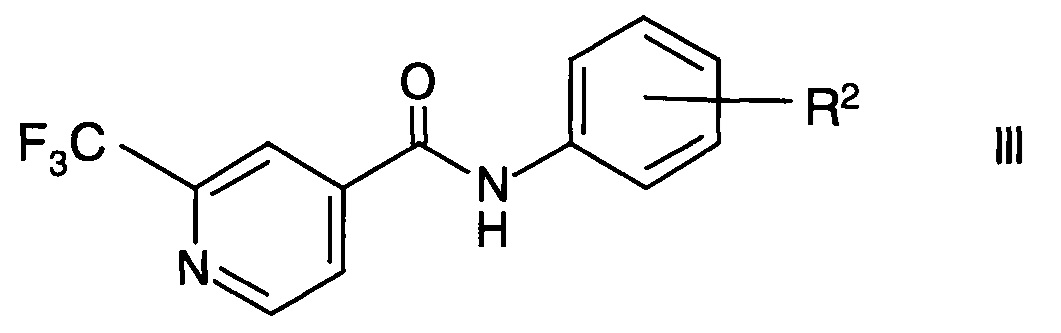
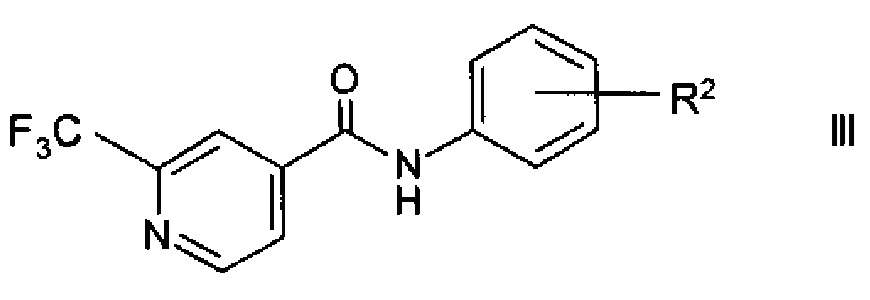
Кроме того, изобретение относится к применению способа по настоящему изобретению в способе получения агонистов рецепторов, ассоциированных со следовыми аминами TAAR1 (от англ. trace amine-associated receptor, TAAR), формулы
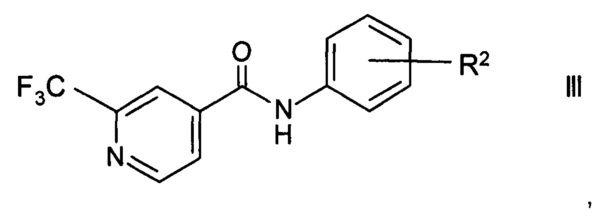
где
R2 представляет собой (СН2)n-(O)o-гетероциклоалкил, возможно замещенный C1-6-алкилом, гидрокси, галогеном или -(СН2)р-арилом;
n представляет собой 0, 1, 2;
о представляет собой 0, 1;
р представляет собой 0, 1, 2;
или их фармацевтически приемлемой соли присоединения кислоты.
Агонисты TAAR формулы III раскрыты в РСТ публ. WO 2012/016879.
Разные синтезы описаны в данной области техники.
Например, Chikara Fukaya et al., Chem. Pharm. Bull. 38(9) 2446-2458 (1990) предлагает сначала метилировать 4-хлор-2-трифторметилпиридин триметилалюминием и затем окислить метильную группу с помощью KMnO4. В результате получают низкий выход, и способ не применим в промышленном масштабе.
Manfred Schlosser et al., Eur. J. Org. Chem. 2003, 1559-1568 описывает получение 2-трифторметил-4-пиридин-карбоновой кислоты с общим выходом 45% из 2-трифтор-пиридина в ходе предварительного депротонирования, последующего иодирования в 3-положении, после чего следует миграция галогена и заключительное карбоксилирование. Этот синтез также не применим в промышленном масштабе.
Manfred Schlosser et al., Eur. J. Org. Chem. 2003, 1569-1575 описывает синтез, который начинается с 2-трифторметилпиридина, который обрабатывают амидным основанием LITMP (Li-2,2,5,5-тетраметилпиперидин) при минус 70°C с последующей обработкой диоксидом углерода. Этот синтез показывает низкую селективность относительно требуемой 2-трифторметилизоникотиновой кислоты, использует дорогое амидное основание, а также труден для обработки в промышленном масштабе.
Следовательно, цель настоящего изобретения состояла в обнаружении способа, с помощью которого преодолеваются недостатки, известные из способов, известных в данной области техники, и который возможно осуществлять в промышленном масштабе.
Обнаружили, что цель может быть достигнута с помощью способа, как изложено ниже.
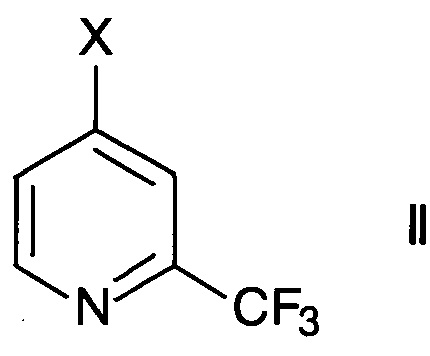
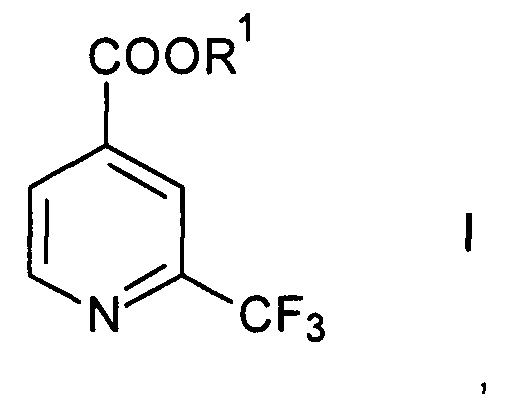
Согласно способу получения 2-трифторметилизоникотиновой кислоты и ее эфиров формулы

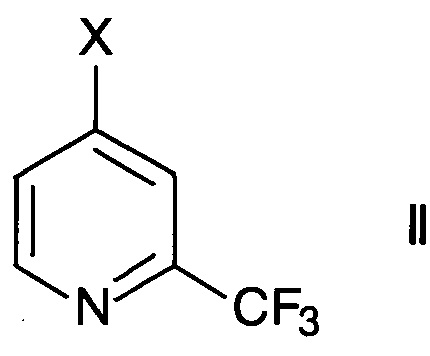
где R1 представляет собой водород или С1-6-алкил, осуществляют превращение производного 2-трифторметилпиридина формулы
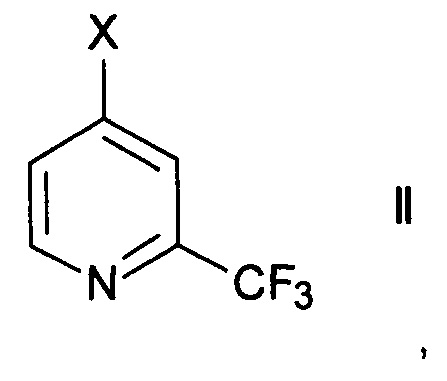
где X представляет собой галоген или -OSO2CY3, где Y представляет собой галоген, в присутствии палладиевого комплексного катализатора.
Следующие определения приводятся для иллюстрации и установления значения и объема разных терминов, используемых для описания изобретения в данном документе.
Термин "C1-6-алкил" относится к разветвленному или неразветвленному одновалентному насыщенному алифатическому углеводородному радикалу от одного до шести атомов углерода, предпочтительно от одного до четырех, более предпочтительно от одного до двух атомов углерода. Кроме того, примерами данного термина являются радикалы, такие как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил или трет-бутил, пентил и их изомеры, и гексил и их изомеры.
Термин "галоген" относится к фтору, хлору, брому или йоду, но особенно к хлору.
Термин "арил" относится к ароматическому углеродному кольцу, такому как фенильное или нафтильное кольцо, предпочтительно фенильному кольцу.
Термин "гетероциклоалкил" относится к неароматическому 5-6 членному моноциклическому кольцу, которое может включать 1, 2 или 3 гетероатома, выбранных из азота, кислорода и/или серы, такому как пиперазинил, пиперидинил, морфолинил, пирролидинил или тиоморфолинил.
Термин "фармацевтически приемлемые соли присоединения кислоты" охватывает соли с неорганическими и органическими кислотами, такими как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п.
Производные 2-трифторметилпиридина формулы II имеются в продаже. Альтернативно, их можно синтезировать согласно методике РСТ межд. публикации WO 2011/161612 или приводимых в данном документе публикаций.
Подходящими производными 2-трифторметилпиридина формулы II являются те, где X представляет собой фтор, хлор, бром, йод или трифторметансульфонил. Особенно используют 4-хлор-2-трифтор-пиридин (X= хлор).
Подходящие палладиевые комплексные катализаторы либо имеются в продаже, либо их можно получить в реакционной смеси, следуя способам, известным квалифицированному специалисту в данной области техники.
Их можно выбрать из бис(бензонитрил)палладия (II) - хлорида (CAS №14220-64-5), трис(дибензилиденацетон)дипалладия (0) (CAS: 51364-51-3), ацетата палладия (II) (CAS №3375-31-3) или хлорида палладия (II) CAS №.7647-10-1 с лигандами, выбранными из 1,1-бис(дифенилфосфино)этана (DPPE), 1,1'-бис(дифенилфосфино)ферроцена (DPPF), бис(дифенилфосфино)метана (DPPM), 1,3-бис(дифенилфосфино)пропана (DPPP), 4,5-бис(дифенилфосфино)-9,9-диметилксантена или из трифенилфосфана.
В одном воплощении согласно превращению осуществляют взаимодействие производного 2-трифторметилпиридина формулы II с монооксидом углерода (СО) в присутствии реагента R1OH, где R1 является таким, как приведено выше.
Особенно выбранными палладиевыми комплексными катализаторами для этого превращения являются хлорид палладия (II) с лигандами 1,1'-бис(дифенилфосфино)ферроцен (dppf) или 1,3-бис(дифенилфосфино)пропан (DPPP), предпочтительно в их имеющейся в продаже форме аддукта 1,1'-бис(дифенилфосфино)ферроцен - палладия (II) дихлорид (CAS №95464-05-4) и (1,3-бис(дифенилфосфино)пропан) - палладия (II) хлорид (CAS №59831-02-6).
Превращение можно осуществить при давлении СО от 5 бар до 100 бар, особенно от 60 бар до 70 бар.
Температура реакции, как правило, выбрана между 50°C и 170°C, особенно между 120°C и 140°C.
Предпочтительно присутствует основание, которое может быть выбрано либо из органического основания, подобного третичному амину, либо из неорганического основания, подобного гидрокарбонату щелочного металла или фосфату щелочного металла. Подходящим представителем органического основания является три-алкиламин, подобный триэтиламину, и подходящими представителями неорганических оснований являются, например, гидрокарбонат натрия или фосфат калия.
Реагент R1OH представляет собой либо воду (R1=Н), давая 2-трифторметилизоникотиновую кислоту, либо C1-6-спирт (R1=C1-6-алкил), давая соответствующие эфиры 2-трифторметилизоникотиновой кислоты.
Особо используют C1-4-спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, втор-бутанол или трет-бутанол, особенно метанол, этанол, или изопропанол, и в особенности метанол.
В случае превращения с водой можно добавить органический растворитель, выбранный из эфиров, подобных диоксану или тетрагидрофурану, или низших спиртов, подобных метанолу, этанолу или изопропанолу. Обнаружено, что особенно подходит тетрагидрофуран.
В случае превращения с C1-6-спиртом за первоначальным превращением с монооксидом углерода может следовать обработка хлороводород-образующим веществом, что способствует завершению образования эфира.
Подходящие хлороводород-образующие вещества можно выбрать из неорганических хлоридов, подобных хлороводороду, или из хлорангидридов органических кислот, таких как тионилхлорид или ацетилхлорид. Обнаружено, что тионилхлорид является наиболее подходящим.
Обработку водород-образующим веществом обычно проводят в условиях нагревания с обратным холодильником реакционной смеси.
В дополнительном воплощении согласно превращению осуществляют взаимодействие производного 2-трифторметилпиридина формулы I с цианидом металла MCN, где М означает ион металла, с образованием нитрила формулы V
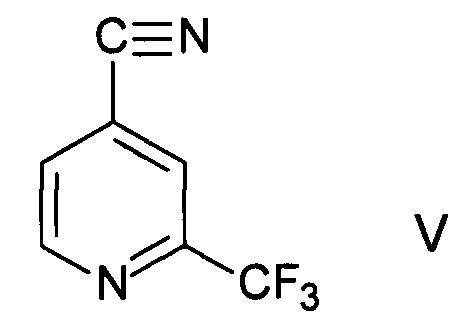
и проводят дополнительный гидролиз или этерификацию с образованием 2-трифторметилизоникотиновой кислоты и ее эфиров формулы I.
Палладиевый комплексный катализатор, выбранный для этого превращения, как правило, представляет собой Pd(PPh3)4(0), аддукт 1,1'-бис(дифенилфосфино)ферроцен - палладия (II) дихлорида дихлорметана (CAS №95464-05-4), Pd(P-трет-Bu3)2, трис(дибензилиденацетон)дипалладий (0) или Pd(трифторуксусная кислота)2 (Pd(ТФК)2) с лигандами 1,1'-бис(дифенилфосфино)ферроцен (dppf) или рац-2-(ди-трет-бутилфосфино)-1,1-бинафтил.
Подходящими цианидами металлов MCN являются цианид цинка или цианид цинка в смеси с цианидом натрия или цианидом калия, но особенно цианид цинка.
Температуру реакции обычно выбирают между 50°C и 120°C.
Реакцию проводят в подходящем органическом растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-этил-2-пирролидон, но предпочтительно в N,N-диметилформамиде.
Нитрил формулы V можно выделить из реакционной смеси, например, в ходе экстракции с подходящим растворителем, таким как трет-метилбутиловый эфир, и выпариванием растворителя. Вакуумная перегонка неочищенного нитрила может давать нитрил высокой чистоты.
Гидролиз нитрила формулы V до 2-трифторметилизоникотиновой кислоты формулы I с R1= водород проводят с подходящим основанием, которое можно выбрать из гидроксида щелочного металла, такого как гидроксид натрия, калия или лития.
Как правило, реакцию проводят в подходящем растворителе, таком как низшие спирты, подобные метанолу, этанолу, 1-пропанолу, 2-пропанолу, в условиях нагревания с обратным холодильником.
Выделение продукта может происходить после подкисления водной соляной кислотой в ходе фильтрации.
Этерификация нитрила формулы V до эфира 2-трифторметилизоникотиновой кислоты формулы I с R1=С1-6-алкил проводят со спиртом R1OH, где R1 представляет собой С1-6-алкил, в присутствии газообразного хлороводорода или хлороводород-образующего вещества.
Особо используют C1-4-спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, втор-бутанол или трет-бутанол, особенно метанол, этанол, или изопропанол, и в особенности метанол.
Подходящие хлороводород-образующие вещества можно выбрать из неорганических хлоридов, подобных хлороводороду, или из хлорангидридов органических кислот, таких как тионилхлорид или ацетилхлорид. Обнаружено, что ацетилхлорид является наиболее подходящим.
Реакцию, как правило, проводят в условиях нагревания с обратным холодильником соответствующего спирта.
Выделение соответствующего эфира может происходить в ходе экстракции с подходящим растворителем, таким как трет-метилбутиловый эфир, из нейтрализованной реакционной смеси и последующим выпариванием органического растворителя.
Предпочтительным является воплощение, включающее превращение производного 2-трифторметилпиридина формулы II с монооксидом углерода (СО) в присутствии реагента R1OH, где R1 является таким, как указано выше.
Как указано выше, изобретение, кроме того, включает применение способа по настоящему изобретению в способе получения агонистов TAAR1 формулы
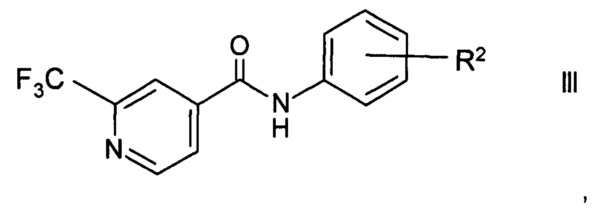
где
R2 представляет собой (СН2)n-(O)o-гетероциклоалкил, возможно замещенный С1-6-алкилом, гидрокси, галогеном или -(СН2)р-арилом;
n представляет собой 0, 1, 2;
о представляет собой 0, 1;
р представляет собой 0, 1, 2;
или их фармацевтически приемлемой соли присоединения кислоты.
Например, соединения формулы III можно получить согласно РСТ публ. WO 2012/016879 в ходе взаимодействия 2-трифторметилизоникотиновой кислоты и ее эфиров формулы I с возможно защищенным ариламином формулы IV
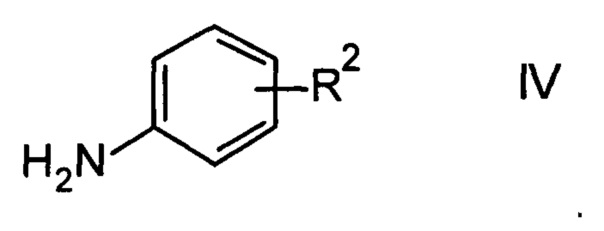
Возможно защищенный в данном случае означает, что гетероатом азота гетероциклоалкильной группировки R2 защищен общепринятой аминозащитной группой, такой как например Boc. В данном случае согласно способу, кроме того, удаляют аминозащитную группу, например, в кислой среде.
Примеры
Аббревиатуры:

Пример 1
Получение 4-хлор-2-трифторметил-пиридина
В 25 мл круглодонной колбе, оборудованной обратным холодильником, магнитной мешалкой и подводом инертного газа, 1,63 г (10,0 ммоль) 4-гидрокси-2-трифторметил-пиридина обрабатывали 4,9 мл циклогексана и 0,077 мл ДМФА, при комнатной температуре добавляли 2,19 мл (25,0 ммоль) оксалилхлорида, смесь нагревали с обратным холодильником в течение 3 часов, охлаждали до комнатной температуры, медленно по каплям (выделение газа) добавляли 18 мл воды, смесь экстрагировали 18 мл МТБЭ, отделенный органический слой промывали 1 М NaHCO3 и отделенный органический слой сушили с безводным Na2SO4, фильтровали и выпаривали при пониженном давлении, неочищенную черную жидкость обрабатывали 12 мл н-гексана, перемешивали в течение 5 минут при к.т., фильтровали и выпаривали при пониженном давлении, чтобы получить 0,9 г 4-хлор-2-трифторметил-пиридина в виде желтой жидкости.
ГХ-ЭИ-МС: М 181+/М 183+.
Пример 2
Получение метилового эфира 2-трифторметил-изоникотиновой кислоты из 4-хлор-2-трифторметилпиридина
Смесь 76,8 г (423 ммоль) 4-хлор-2-трифторметил-пиридина, 7,67 г (7,67 ммоль) аддукта 1,1'-бис(дифенилфосфино)ферроцен - палладия (II) дихлорида дихлорметана и 88,4 мл (635 ммоль) триэтиламина в 792 мл метанола перемешивали при 70 бар СО в течение 18 часов при 130°C. Неочищенную смесь (содержит ~30% кислоты) концентрировали при пониженном давлении до ~20% смеси, медленно обрабатывали 30,9 мл (423 ммоль) тионилхлорида и нагревали с обратным холодильником в течение одного часа. Смесь выпаривали при пониженном давлении, остаток обрабатывали 450 мл воды и 450 мл МТБЭ, и образующуюся суспензию фильтровали. От фильтрата отделяли органический слой и экстрагировали 225 мл 1 М NaHCO3, отделенный органический слой сушили с безводным Na2SO4, фильтровали и выпаривали при пониженном давлении, получая неочищенный метиловый эфир 2-трифторметилизоникотиновой кислоты, который перегоняли при ~20 ммбар/т.кип. 97-99°C, получая 80,7 г метилового эфира 2-трифторметил-изоникотиновой кислоты в виде бесцветной жидкости.
ГХ-ЭИ-МС: М 205+.
Пример 3
Получение этилового эфира 2-трифторметил-изоникотиновой кислоты из 4-хлор-2-трифторметил-пиридина
Смесь 182 мг (1,0 ммоль) 4-хлор-2-трифторметил-пиридина, 18,2 мг (0,022 ммоль) аддукта 1,1'-бис(дифенилфосфино)ферроцен - палладия (II) дихлорида дихлорметана и 0,21 мл (1,50 ммоль) триэтиламина в 3,0 мл этанола перемешивали при 70 бар СО в течение 18 часов при 130°C, неочищенную смесь выпаривали при пониженном давлении, остаток обрабатывали 4,0 мл 0,5 М HCl и 4,0 мл МТБЭ, образующуюся суспензию фильтровали, органический слой отделяли и экстрагировали 2,0 мл 1 М NaHCO3, отделенный органический слой сушили с безводным Na2SO4, фильтровали и выпаривали при пониженном давлении, получая неочищенный этиловый эфир 2-трифторметилизоникотиновой кислоты, который перемешивали с 2,0 мл циклогексана в течение 10 минут при комнатной температуре, слабомутный коричневый раствор фильтровали и фильтрат выпаривали при пониженном давлении, получая 113 мг этилового эфира 2-трифторметил-изоникотиновой кислоты в виде светло-коричневой жидкости.
ГХ-ЭИ-МС: М 219+.
Пример 4
Получение изопропилового эфира 2-трифторметил-изоникотиновой кислоты из 4-хлор-2-трифторметил-пиридина
Смесь 182 мг (1,0 ммоль) 4-хлор-2-трифторметил-пиридина, 18,2 мг (0,022 ммоль) аддукта 1,1'-бис(дифенилфосфино)ферроцен - палладия (II) дихлорида дихлорметана и 0,21 мл (1,5 ммоль) триэтиламина в 3,0 мл 2-пропанола перемешивали при 70 бар СО в течение 18 часов при 130°C, неочищенную смесь выпаривали при пониженном давлении, остаток обрабатывали 4,0 мл 0,5 М HCl и 4,0 мл МТБЭ, образующуюся суспензию фильтровали, органический слой отделяли и экстрагировали 2,0 мл 1 М NaHCO3, отделенный органический слой сушили с безводным Na2SO4, фильтровали и выпаривали при пониженном давлении, получая неочищенный изопропиловый эфир 2-трифторметилизоникотиновой кислоты, который перемешивали с 2,0 мл циклогексана в течение 10 минут при комнатной температуре, слабомутный коричневый раствор фильтровали и фильтрат выпаривали при пониженном давлении, получая 134 мг изопропилового эфира 2-трифторметил-изоникотиновой кислоты в виде светло-коричневой жидкости.
ГХ-ЭИ-МС: М 233+.
Пример 5
Получение 2-трифторметил-пиридин-4-илового эфира трифтор метансульфоновой кислоты
В 25 мл круглодонной колбе, оборудованной магнитной мешалкой и подводом инертного газа, 1,63 г (10,0 ммоль) 2-трифторметил-пиридин-4-ола растворяли в 8,15 мл дихлорметана, добавляли 2,04 мл (12,0 ммоль) N-этилдиизопропиламина и раствор охлаждали до 0-5°C, и по каплям добавляли 1,86 мл (11,0 ммоль) трифторметансульфонового ангидрида, смесь перемешивали при 0-5°C в течение 1 часа, смесь экстрагировали 10 мл 0,5 М HCl, отделенный органический слой сушили с безводным Na2SO4 и выпаривали при пониженном давлении. Остаток очищали через 15 г силикагеля с циклогексаном/МТБЭ, получая 1,58 г 2-трифторметил-пиридин-4-илового эфира трифтор-метансульфоновой кислоты в виде светло-желтого масла.
ГХ-ЭИ-МС: М 295+.
Пример 6
Получение метилового эфира 2-трифторметил-изоникотиновой кислоты из 2-трифторметил-пиридин-4-илового эфира трифтор-метансульфоновой кислоты
Смесь 295 мг (1,0 ммоль) 2-трифторметил-пиридин-4-илового эфира трифтор-метансульфоновой кислоты, 18,1 мг (0,022 ммоль) аддукта 1,1'-бис(дифенилфосфино)ферроцен - палладия (II) дихлорида дихлорметана и 0,21 мл (1,5 ммоль) триэтиламина в 4,0 мл метанола перемешивали при 70 бар СО в течение 18 часов при 130°C, неочищенную смесь (содержит ~30% кислоты) обрабатывали 0,073 мл (1,0 ммоль) тионилхлорида, нагревали с обратным холодильником в течение одного часа, смесь выпаривали при пониженном давлении, остаток обрабатывали 4,0 мл воды и 4,0 мл МТБЭ, образующуюся суспензию фильтровали, отделенный органический слой экстрагировали 4,0 мл 1 М NaHCO3, отделенный органический слой сушили с безводным Na2SO4, фильтровали и выпаривали при пониженном давлении, получая неочищенный метиловый эфир 2-трифторметил-изоникотиновой кислоты, который обрабатывали 2,0 мл циклогексана, смесь фильтровали и выпаривали при пониженном давлении, получая 136 мг метилового эфира 2-трифторметилизоникотиновой кислоты в виде светло-желтой жидкости.
ГХ-ЭИ-МС: М 205+.
Пример 7
Получение метилового эфира 2-трифторметил-изоникотиновой кислоты из 4-бром-2-трифторметил-пиридина гидробромида
Смесь 307 мг (1,0 ммоль) 4-бром-2-трифторметил-пиридина гидробромида, 18,1 мг (0,022 ммоль) аддукта 1,1'-бис(дифенилфосфино)ферроцен - палладия (II) дихлорида дихлорметана и 0,35 мл (2,5 ммоль) триэтиламина в 4,0 мл метанола перемешивали при 70 бар СО в течение 18 часов при 130°C, неочищенную смесь (содержит ~30% кислоты) обрабатывали 0,073 мл (1,0 ммоль) тионилхлорида, нагревали с обратным холодильником в течение одного часа, смесь выпаривали при пониженном давлении, остаток обрабатывали 4,0 мл воды и 4,0 мл МТБЭ, образующуюся суспензию фильтровали, отделенный органический слой экстрагировали 2,0 мл 1 М NaHCO3, отделенный органический слой сушили с безводным Na2SO4, фильтровали и выпаривали при пониженном давлении, получая неочищенный метиловый эфир 2-трифторметил-изоникотиновой кислоты, который перемешивали с 2,0 мл циклогексана в течение 15 минут, фильтровали и выпаривали при пониженном давлении, получая 112 мг метилового эфира 2-трифторметил-изоникотиновой кислоты в виде бесцветной жидкости.
ГХ-ЭИ-МС: М 205+.
Пример 8
Получение метилового эфира 2-трифторметил-изоникотиновой кислоты из 4-йод-2-трифторметил-пиридина
Смесь 165 мг (0,60 ммоль) 4-йод-2-трифторметил-пиридина, 16,5 мг (0,020 ммоль) аддукта 1,1'-бис(дифенилфосфино)ферроцен - палладия (II) дихлорида дихлорметана и 0,126 мл (0,907 ммоль) триэтиламина в 3,0 мл метанола перемешивали при 70 бар СО в течение 18 часов при 130°C, неочищенную смесь обрабатывали 0,044 мл (1,0 ммоль) тионилхлорида и нагревали с обратным холодильником в течение одного часа, выпаривали при пониженном давлении, остаток обрабатывали 2,0 мл воды и 2,0 мл МТБЭ, образующуюся суспензию фильтровали, органический слой отделяли и экстрагировали 2,0 мл 1 М NaHCO3, отделенный органический слой сушили с безводным Na2SO4, фильтровали и выпаривали при пониженном давлении, получая неочищенный метиловый эфир 2-трифторметил-изоникотиновой кислоты, который перемешивали с 2,0 мл циклогексана в течение 10 минут при комнатной температуре, светло-коричневую суспензию фильтровали и фильтрат выпаривали при пониженном давлении, получая 104 мг метилового эфира 2-трифторметил-изоникотиновой кислоты в виде светло-коричневой жидкости.
ГХ-ЭИ-МС: М 205+.
Пример 9
Получение 2-трифторметил-изоникотиновой кислоты из 4-хлор-2-трифторметил-пиридина
Смесь 182 мг (1,0 ммоль) 4-хлор-2-трифторметил-пиридина, 18,0 мг PdCl2(DPPP) и 210 мг гидрокарбоната натрия в 1,5 мл ТГФ и 1,5 мл воды перемешивали при 70 бар СО в течение 20 часов при 120°C, ТГФ удаляли при пониженном давлении, добавляли 0,5 мл 2 М NaOH и суспензию фильтровали. Прозрачный раствор обрабатывали 0,52 мл 25% хлористоводородной кислоты, перемешивали в течение 1 часа при к.т., фильтровали и белые кристаллы сушили при 40°C, получая 146 мг 2-трифторметил-изоникотиновой кислоты.
ГХ-ЭИ-МС: М 191+.
Пример 10
Получение 2-(трифторметил)пиридин-4-карбонитрила из 4-хлор-2-трифторметил-пиридина
Смесь 4,0 г (22,0 ммоль) 4-хлор-2-трифторметил-пиридина в 40,0 мл ДМФА продували аргоном, добавляли 0,98 г (1,76 ммоль) 1,1'-бис(дифенилфосфино)ферроцена (CAS: 12150-46-8), 1,01 г (1,10 ммоль) трис(дибензилиденацетон)дипалладия (0) (CAS: 51364-51-3) и 2,59 г (22,0 ммоль) цианида цинка. Смесь продували аргоном и перемешивали в течение 15 часов при 85-90°C, черную смесь охлаждали до 5-10°C, добавляли 110 мл воды и 110 мл МТБЭ, перемешивали в течение получаса при к.т., затем фильтровали через стекловолоконный фильтр, осадок на фильтре промывали 15 мл МТБЭ, органический слой отделяли от фильтрата и дважды промывали 110 мл воды, отделенный органический слой сушили с безводным Na2SO4, фильтровали и выпаривали при пониженном давлении, получая неочищенных 4,20 г 2-(трифторметил)пиридин-4-карбонитрила, которые содержали дибензилиденацетон в качестве примеси. Неочищенный продукт обрабатывали 8,40 мл МТБЭ, и образующуюся суспензию перемешивали в течение 15 минут при к.т., затем фильтровали и осадок на фильтре промывали 4,0 мл МТБЭ. Коричневый фильтрат выпаривали при пониженном давлении, получая 3,60 г указанного в заголовке продукта в виде коричневого масла, которое перегоняли при 10 мбар/т.кип. 58-60°C, получая 2,75 г 2-(трифторметил)пиридин-4-карбонитрила в виде бесцветной жидкости.
ГХ-ЭИ-МС: М 172+.
Пример 11
Получение 2-трифторметил-изоникотиновой кислоты из 2-(трифторметил)пиридин-4-карбонитрила
Смесь 172 мг (1,0 ммоль) 2-(трифторметил)пиридин-4-карбонитрила в 0,86 мл этанола обрабатывали 0,20 г (5,0 ммоль) гидроксида натрия. Смесь нагревали с обратным холодильником в течение 1,5 часа, охлаждали до к.т. и желтую суспензию охлаждали до к.т., добавляли 3,0 мл воды и 0,65 мл хлористоводородной кислоты. Суспензию охлаждали до 0-5°C в течение 30 минут, фильтровали и промывали 2,0 мл воды. Бежевые кристаллы сушили при 40°C/15 мбар/2 часа, получая 0,15 г 2-трифторметил-изоникотиновой кислоты.
ГХ-ЭИ-МС: М 191+.
Пример 12
Получение метилового эфира 2-трифторметил-изоникотиновой кислоты из 2-(трифторметил)пиридин-4-карбонитрила
Смесь 172 мг (1,0 ммоль) 2-(трифторметил)пиридин-4-карбонитрила в 1,70 мл метанола обрабатывали при охлаждении льдом 0,71 мл ацетилхлорида (образование в реакционной смеси хлороводорода), раствор нагревали с обратным холодильником в течение 4 часов, охлаждали до к.т. и выпаривали при пониженном давлении, остаток обрабатывали 1,0 мл МТБЭ и экстрагировали 1,0 мл 1 М NaHCO3, отделенный органический слой сушили с Na2SO4, фильтровали и выпаривали при пониженном давлении, получая 0,16 г метилового эфира 2-трифторметил-изоникотиновой кислоты.
ГХ-ЭИ-МС: М 205+.