Результат интеллектуальной деятельности: Способ получения 2-алкокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3Н)-она
Вид РИД
Изобретение
Настоящее изобретение относится в химии гетероциклических соединений, конкретно - к способу получения новых функциональных производных пиримидин-4(3H)-она, содержащих алкокси-группу в положении 2 пиримидинового кольца, являющихся биоизостерическими аналогами ненуклеозидных ингибиторов обратной транскриптазы ВИЧ-1 [Синтез и противовирусные свойства новых производных 2-(алкилсульфанил)-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она / И.А. Новаков, А.С. Яблоков, Б.С. Орлинсон, М.Б. Навроцкий, И.А. Кириллов, А.А. Вернигора, А.С. Бабушкин, В.В. Качала, D. Schols // ЖОрХ. - 2016. - 52. - №8. - С. 1195-1200].
Известен способ получения 2-алкоксипиримидин-4(3H)-онов, основанный на реакции циклоконденсации 3-оксоэфиров с О-метилизомочевины бисульфатом, в присутствии гидроксида кальция. Реакция может проводиться как в водной [6-Alkyl and 5,6-dialkyl-2-methoxy-4(3H)-pyrimidinones in the transformations of pyrimidines-2. Synthesis and conversion into alkyluracils and 2-alkoxy-4(3H)-pyrimidinones / M. Botta, M. Cawalieri, D. Ceci, F. De Angelis, G. Finizia, R. Nicoletti // Tetrahedron. - 1984. - Vol. 40, - Is.e 17. - P. 3313-3320], так и водно-спиртовой среде [A versatile route to potential dihydrofolate reductase inhibitors via the hitherto unknown 6-benzyl-2-(O-methyl)uracils: Synthesis of isotrimethoprim / M. Botta, M. Artico, S. Massa, A. Gambacorta // J. Het. Chem. - 1989. - Vol. 26. - Is. 3. - P. 883-884], при комнатной температуре.
Недостатком этого способа является возможность его применения исключительно к получению 2-метоксипроизводных пиримидин-4(3H)-она. Кроме этого, в случае пространственно затрудненных 3-оксоэфиров, реакция сопровождается образованием побочных продуктов, снижением выхода целевого вещества и необходимостью применения методов препаративной хроматографической очистки для выделения целевых продуктов реакции в чистом виде.
Известным является способ, основанный на реакции алкоголиза 2-метоксипиримидин-4(3H)-онов с использованием растворов алкоксидов калия [Synthesis and antiviral activity of new 3,4-dihydro-2-alkoxy-6-benzyl-4-oxopyrimidines (DABOs), specific inhibitors of human immunodeficiency virus type 1 / S. Massa, A. Mai, M. Artico, G. Sbardella, E. Tramontano, A.G. Loi, P. Scano, P. La Colla // Antivir. Chem. Chemother. - 1995. - Vol. 6. - Is. 1. - P. 1-8] и натрия [3,4-Dihydro-2-alkoxy-6-benzyl-4-oxopyrimidines (DABOs): A new class of specific inhibitors of human immunodeficiency virus Type 1 / M. Artico, S. Massa, A. Mai, M.E. Marongiu, G. Piras, E. Tramontano, P. La Colla // Antivir. Chem. Chemother. - 1993. - Vol. 4. - Is. 6. - P. 361-368] в соответствующих абсолютных спиртах.
Данный метод характеризуется целым рядом существенных недостатков. Во-первых, для его реализации используется большой избыток огнеопасных алкоксидов калия или натрия. Во-вторых, за счет известной обратимости реакции, выход целевых продуктов, как правило, невысок, а для их отделения от примесей требуется препаративная хроматографическая очистка.
Наиболее близким является способ получения 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она, который синтезируют из 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)-пиримидин-4(3H)-она, предварительно полученного в результате реакции циклоконденсации нитрогуанидина и соответствующего 3-оксоэфира [Исследование синтеза 3-оксоэфиров и функциональных производных пиримидин-4(3H)-она на основе 1-(2,6-дигалогенфенил)циклопропан-1-карбоновых кислот / И.А. Новаков, А.С. Яблоков, М.Б. Навроцкий, А.С. Мкртчян, А.А. Вернигора, А.С. Бабушкин, В.В. Качала, Е.А. Ручко // ЖОХ. - 2017. - Т. 87. - Вып. 2. - С. 247-254]. 6-[1-(2,6-Дифторфенил)циклопропил]-5-метил-2-(нитроамино)-пиримидин-4(3H)-он кипятят в среде бутанола в присутствии метил(изопропил)амина, упаривают реакционную массу и выделяют продукт реакции с выходом 63% с использованием метода колоночной хроматографии. Для повышения чистоты выделенный продукт дополнительно очищают перекристаллизацией из гексана.
Недостатком способа является трудоемкость выделения продукта реакции в чистом виде и связанное с этим снижение его выхода.
Задачей предлагаемого технического решения является разработка технологичного способа получения различных производных 2-алкоксипиримидин-4(3H)-она с использованием доступных исходных реагентов, приводящего к получению целевых соединений с хорошим выходом и высокой чистотой.
Техническим результатом является повышение выхода целевых соединений, наряду с упрощением процесса их получения и выделения с высокой чистотой.
Технический результат достигается при реализации способа получения 2-алкокси- или 2-(С5-6циклоалкил)окси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она при кипячении 6-[1-(2,6-дифторфенил)циклопропил}-5-метил-2-(нитроамино)пиримидин-4(3H)-она, предварительно полученного путем конденсации нитрогуанидина с этил-3-[1-(2,6-дифторфенил)циклопропил]-2-метил-3-оксопропаноатом с соответствующим спиртом в присутствии амина с последующим упариванием реакционной массы и выделением продукта, при этом в качестве амина используют N-метилпиперидин в избытке по отношению к исходному нитроамину, исходный соответствующий спирт используют в объемном избытке по отношению к N-метилпиперидину, а продукт выделяют последовательным четырехкратным добавлением и отгонкой при пониженном давлении ксилола, причем перед последней отгонкой ксилола раствор подвергают адсорбтивному фильтрованию.
Способ заключается в получении производных 2-алкоксипиримидин-4(3H)-она общей формулы
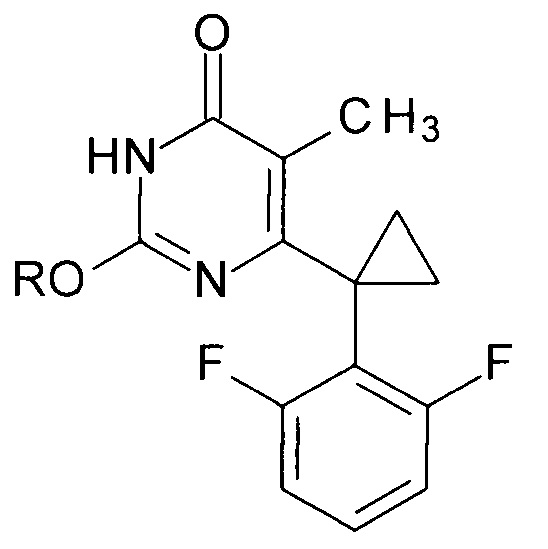
где R=н-С4Н9, н-C5H11, изо-С5Н11, втор-С5Н11, цикло-С5Н9, н-С6Н13, цикло-C6H11, н-С7Н15.
В результате конденсации этил-3-[1-(2,6-дифторфенил)циклопропил]-2-метил-3-оксопропаноата и нитрогуанидина в присутствии этоксида калия образуется 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3Н)-он.
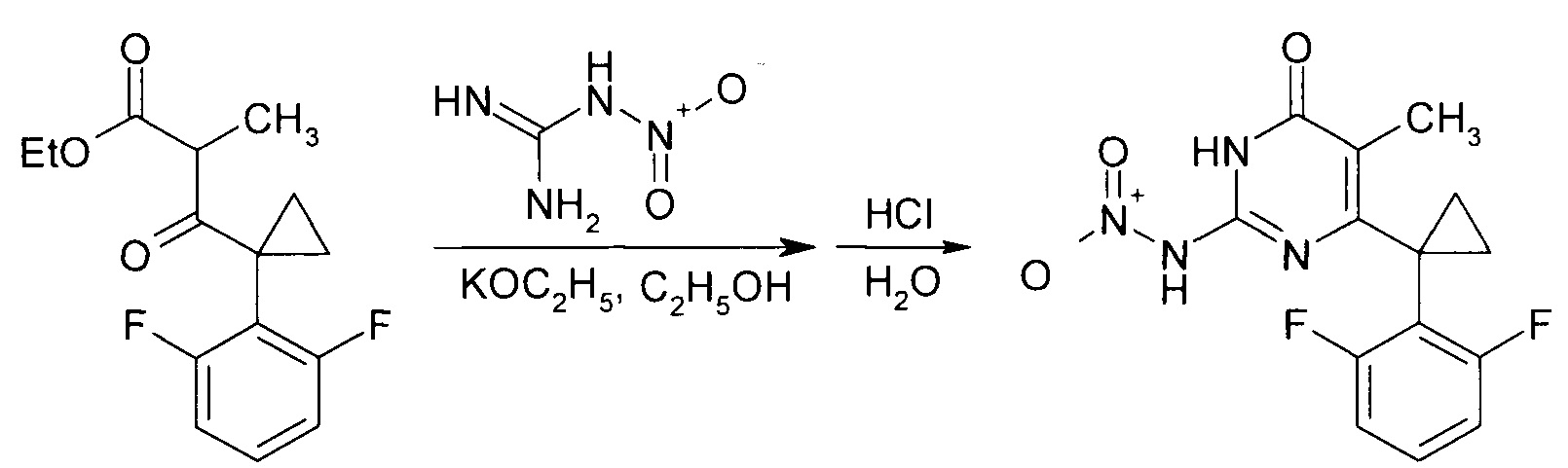
Производные 2-алкоксипиримидин-4(3H)-она получают реакцией 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3H)-она со спиртами в присутствии N-метилпиперидина с последующим упариванием реакционной массы и выделением целевого продукта. Причем реакцию ведут при использовании 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3H)-она и N-метилпиперидина в мольном соотношении 1:11 и объемном соотношении спирта и N-метилпиперидина,равном 5:2.
Сущностью предлагаемого способа является реакция алкоголиза 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3H)-она соответствующим спиртом катализируемая азотистым основанием, роль которого выполняет N-метилпиперидин. В ходе реакции происходит отщепление молекулы нитрамида от молекулы исходного 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3H)-она; образующийся нитрамид в основной среде моментально расщепляется на воду и закись азота.
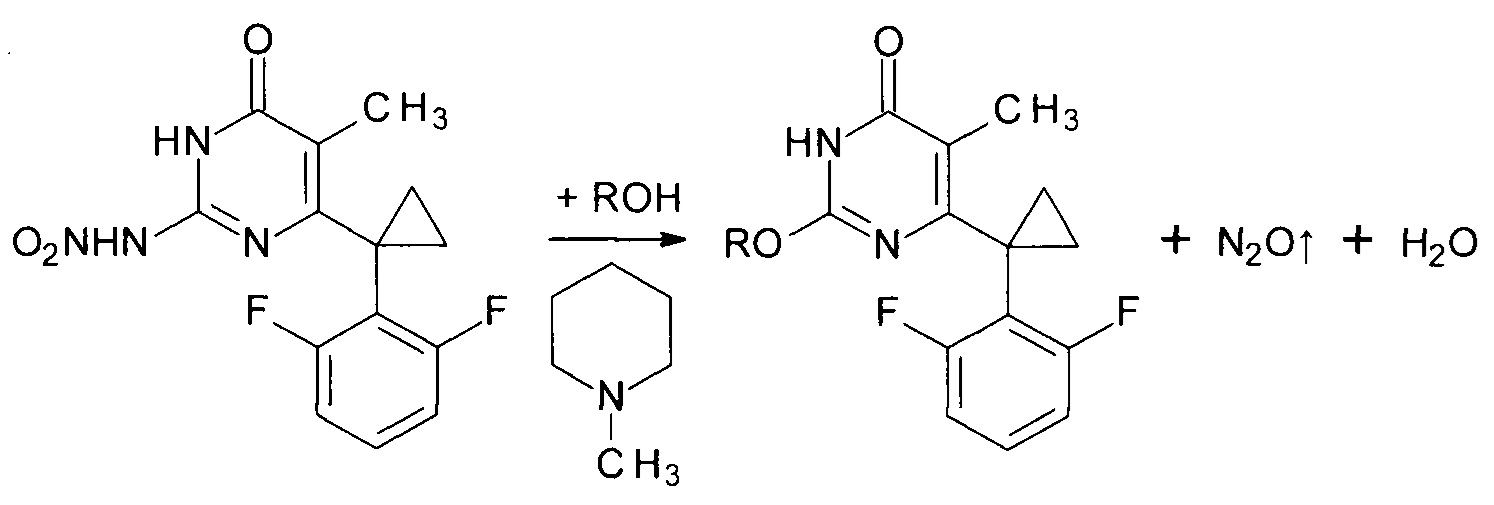
где R=н-С4Н9, н-C5H11, изо-С5Н11, втор-С5Н11, цикло-С5Н9, н-С6Н13, цикло-C6H11, н-С7Н15.
Необходимость применения избытка спирта и N-метилпиперидина обусловлена тем, что первый играет роль как реагента, так и растворителя, а второй - как сорастворителя, так и катализатора реакции. При этом избыток спирта и амина после проведения реакции отгоняется при пониженном давлении и после осушки и перегонки может быть использован для проведения аналогичной реакции.
Преимуществом предлагаемого способа является возможность получения широкого ряда производных 2-алкоксипиримидин-4(3H)-она, многие из которых представляют интерес как перспективные противовирусные средства с хорошим выходом, с использованием доступных и регенерируемых реагентов и катализатора, препаративной простотой синтеза и легкостью выделения целевых продуктов реакции в чистом виде.
Все целевые продукты были получены с чистотой свыше 98% по данным ВЭЖХ-анализа (неподвижная фаза Reprosil С18 AQ 150×4.6 мм, 3 мкм, подвижная фаза H2O/CH3CN/H3PO4=200/200/1 (об.), скорость потока элюента 0.8 мл/мин, λ 220 нм, температура термостата колонки 30°С).
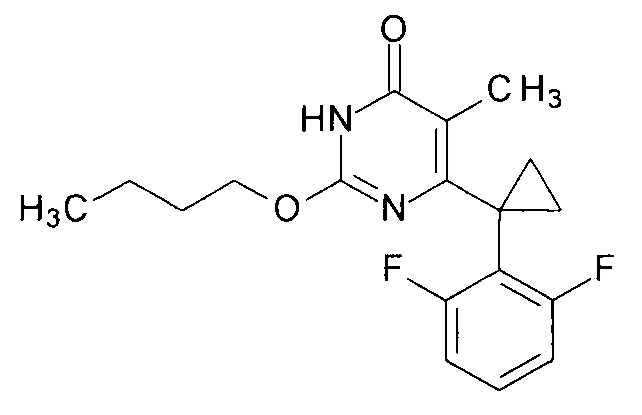
Предлагаемый способ иллюстрируется следующими примерами.Пример 1. Синтез 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она.
К раствору 2.8 г (71.8 мг-атом) калия в 100 мл абсолютного этилового спирта прибавляют 3.64 г (0.035 моль) нитрогуанидина (высушен в эксикаторе над едким кали до постоянной массы) и 8.86 г (0.035 моль) этил-3-[1-(2,6-дифторфенил)циклопропил]-2-метил-3-оксопропаноата.
Полученную смесь кипятят при перемешивании с защитой от влаги и углекислоты воздуха в течение 24 ч. Далее растворитель удаляют, остаток растворяют в 200 мл воды и фильтруют. Фильтрат извлекают метил-трет-бутиловым эфиром (3×75 мл), осветляют активированным углем (около 1 г) и фильтруют. 6-[1-(2,6-Дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3Н)-он высаживают из водного раствора добавлением 12%-ной HCl при перемешивании до рН 2.
В круглодонную колбу, снабженную магнитной мешалкой, внутренним термометром и эффективным обратным холодильником, закрытым щелочной трубкой, помещают 1 г (0.003 моль) 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3H)-она, 8.1 г (10 мл, 0.11 моль) безводного н-бутанола и 4 мл (3.3 г, 0.033 моль) безводного N-метилпиперидина. Полученную смесь нагревают при перемешивании до растворения осадка и перемешивают полученный раствор при температуре кипения до полной конверсии исходного 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3H)-она исходя из данных ВЭЖХ. После этого, растворитель отгоняют при пониженном давлении. К остатку последовательно добавляют и отгоняют при пониженном давлении 3 порции ксилола по 50 мл каждая. Кубовый остаток растворяют в ксилоле, фильтруют через слой адсорбента, например, силикагеля для ТСХ и выпаривают в вакууме досуха. В остатке получают 2-бутокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-пиримидин-4(3H)-он. Выход - 0.92 г (88%).
Тпл. 127-128°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д. (J, Гц): 0.90 т (3Н, СН3СН2СН2СН2, J=7.5 Гц), 1.22 м (2Н, 2СН2 (акс, с-Pr)), 1.36 секст (2Н, СН3СН2СН2СН2, J=7.2 Гц), 1.59 м (2Н, 2СН2 (экв, с-Pr)), 1.65 квинт (2Н, СН3СН2СН2СН2, J1=6.8 Гц, J2=7.2 Гц), 1.71 с (3Н, С5-СН3), 4.28 т (3Н, СН3СН2СН2СН2, J=6.8 Гц), 7.03 м (2Н, С3,5Н), 7.35 м (1Н, С4Н), 12.14 уш.с (1Н, NH). Спектр ЯМР 13С (100.62 МГц, ДМСО-d6), δ, м.д. (J, Гц): 9.58 т (С5-СН3, 6J13C-19F=2.4 Гц), 13.55 с (СН3СН2СН2СН2), 15.29 с (2СН2 (с-Pr)), 18.42 с (СН3СН2СН2СН2), 20.39 с (С (с-Pr)), 30.09 (СН3СН2СН2СН2), 66.42 с (СН3СН2СН2СН2), 111.75 дд (C3,5apoм., J1,13C-19F=19.4 Гц, J2,13C-19F=6.1 Гц), 113.29 с (С5, пиримидин), 118.80 с (С1аром., J13C-19F=17.1 Гц), 129.48 т (С4аром., J13C-19F=10.5 Гц), 153.84 с (С2,6, пиримидин), 160.33 с (С4, пиримидин), 162.05 д (С2,6аром., J1,13С-19F=248.5 Гц, J2,13С-19F=7.8 Гц).
Найдено, %: С 65.00; Н 5.89; N 8.38. C18H20F2N2O2. Вычислено, %: С 64.66; Н 6.03; N8.38.
Пример 2. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(пентилокси)пиримидин-4(3H)-она.
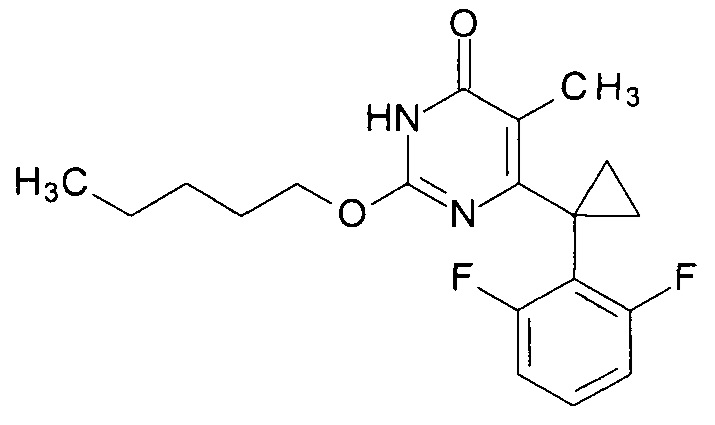
Синтез выполняется аналогично за исключением использования 8.1 г (10 мл, 0.092 моль) 1-пентанола взамен 1-бутанола. Выход - 0.97 г (90%).
Найдено, %: С 65.04; Н 5.98; N 7.92. C19H22F2N2O2. Вычислено, %: С 65.50; Н 6.36; N 8.04.
Пример 3. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-[(3-метилбутил)окси]пиримидин-4(3H)-она.
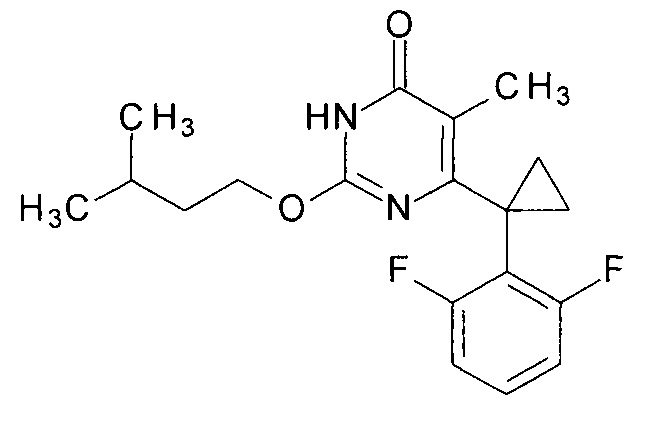
Синтез выполняется аналогично за исключением использования 8.1 г (10 мл, 0.092 моль) 3-метилбутанола взамен 1-бутанола. Выход - 0.95 г (88%).
Найдено, %: С 65.41; Н 6.21; N 8.30. C19H22F2N2O2. Вычислено, %: С 65.50; Н 6.36; N 8.04.
Пример 4. Синтез рацемического 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-[(1-метилбутил)окси]пиримидин-4(3H)-она.
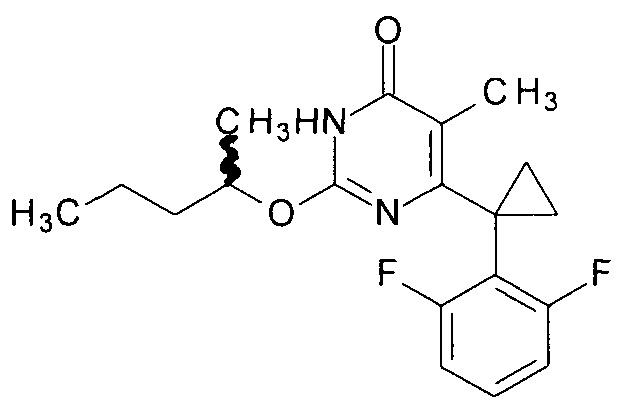
Синтез выполняется аналогично за исключением использования рацемического 8.1 г (10 мл, 0.092 моль) 2-пентанола взамен 1-бутанола. Выход - 0.91 г (84%).
Найдено, %: С 65.32; Н 6.05; N 8.00. C19H22F2N2O2. Вычислено, %: С 65.50; Н 6.36; N8.04.
Пример 5. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(циклопентилокси)пиримидин-4(3H)-она.
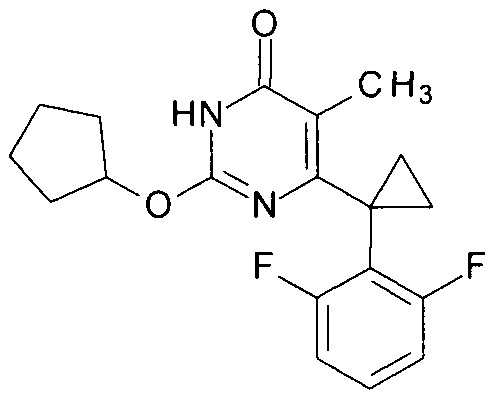
Синтез выполняется аналогично за исключением использования 9.5 г (10 мл, 0.11 моль) циклопентанола взамен 1-бутанола. Выход - 0.94 г (88%). Найдено, %: С 66.01; Н 6.00; N 7.98. C19H20F2N2O2. Вычислено, %: С 65.88; Н 5.82; N 8.09.
Пример 6. Синтез 2-(гексилокси)-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она.
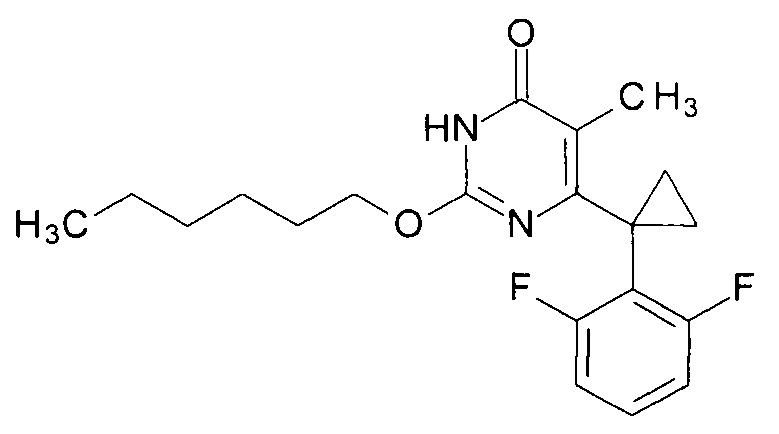
Синтез выполняется аналогично за исключением использования 8.2 г (10 мл, 0.08 моль) 1-гексанола взамен 1-бутанола. Выход - 1.03 г (92%).
Найдено, %: С 65.97; Н 6.81; N 8.00. C20H24F2N2O2. Вычислено, %: С 66.28; Н 6.67; N 7.73.
Пример 7. Синтез 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(циклогексилокси)пиримидин-4(3H)-она.
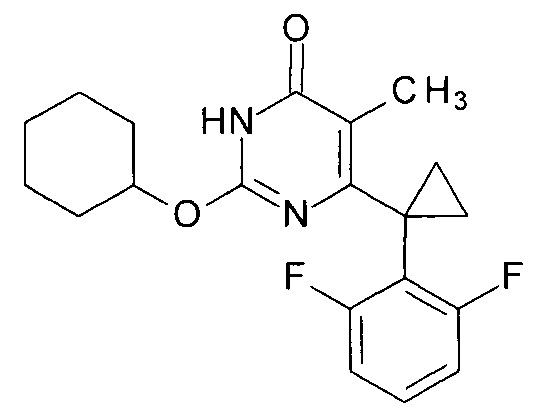
Синтез выполняется аналогично за исключением использования 9.62 г (10 мл, 0.096 моль) циклогексанола взамен 1-бутанола. Выход - 1.05 г (94%).
Найдено, %: С 67.00; Н 5.98; N 8.01. C20H22F2N2O2. Вычислено, %: С 66.65; Н 6.15; N 7.77.
Пример 8. Синтез 2-(гептилокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она
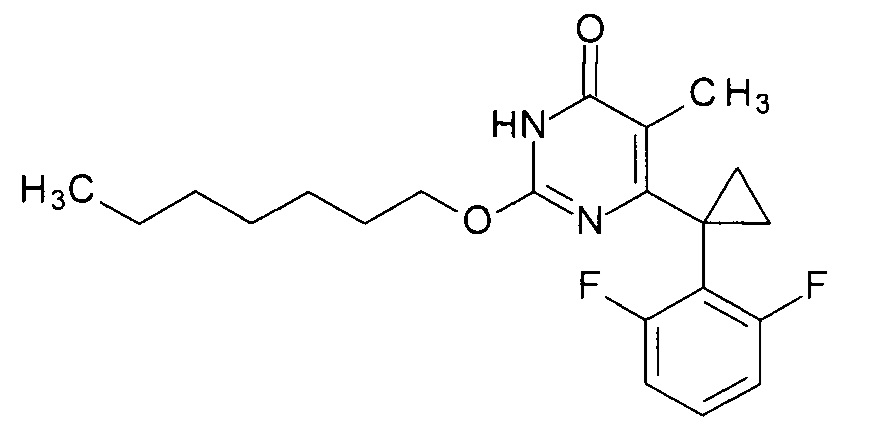
Синтез выполняется аналогично за исключением использования 8.2 г (10 мл, 0.07 моль) 1-гептанола взамен 1-бутанола. Выход - 1.1 г (94%).
Найдено, %: С 67.32; Н 7.00; N 7.56. C21H26F2N2O2. Вычислено, %: С 67.00; Н 6.96; N 7.44. Как следует
из приведенных примеров, предложенный способ получения 2-алкоксипиримидин-4(3H)-онов является технологичным и позволяет получать широкий спектр указанных соединений с высоким выходом и чистотой.
Таким образом, способ получения 2-алкокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она, заключающийся в кипячении предварительно полученного путем конденсации нитрогуанидина с этил-3-[1-(2,6-дифторфенил)циклопропил]-2-метил-3-оксопропаноатом 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3H)-она в спиртовой среде в присутствии N-метилпиперидина с последующим упариванием реакционной массы и выделением продукта последовательным четырехкратным добавлением и отгонкой при пониженном давлении ксилола и адсорбтивным фильтрованием раствора перед последней отгонкой ксилола, является простым, технологичным и обеспечивает высокий выход целевых соединений и их высокую чистоту.
Способ получения 2-алкокси- или 2-(Сциклоалкил)окси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3H)-она при кипячении 6-[1-(2,6-дифторфенил)циклопропил]-5-метил-2-(нитроамино)пиримидин-4(3H)-она, предварительно полученного путем конденсации нитрогуанидина с этил-3-[1-(2,6-дифторфенил)циклопропил]-2-метил-3-оксопропаноатом, с соответствующим спиртом в присутствии амина с последующим упариванием реакционной массы и выделением продукта, отличающийся тем, что в качестве амина используют N-метилпиперидин в избытке по отношению к исходному нитроамину, исходный соответствующий спирт используют в объемном избытке по отношению к N-метилпиперидину, а продукт выделяют последовательным четырехкратным добавлением и отгонкой при пониженном давлении ксилола, причем перед последней отгонкой ксилола раствор подвергают адсорбтивному фильтрованию.
