Результат интеллектуальной деятельности: СПОСОБ СЕЛЕКТИВНОГО ЛАЗЕРНОГО ФОТОТЕРМОЛИЗА РАКОВЫХ КЛЕТОК ПЛАЗМОННО-РЕЗОНАНСНЫМИ НАНОЧАСТИЦАМИ
Вид РИД
Изобретение
Изобретение относится к области биомедицинских технологий, в частности к созданию неинвазивного селективного ИК лазерного фототермолиза раковых клеток в объеме биоткани на основе технологии 3 D пространственного сканирования остросфокусированного оптического пучка при облучении наносекундными лазерными импульсами и селективным разрушением только патологических клеток, к плазматической мембране которых присоединены на основе образования комплекса антиген опухоли-антитело, конъюгированное с плазмонно-резонансными золотыми наночастицами.
Известен способ близкофокусной рентгенотерапии c суммарной очаговой дозой 100-120 Гр и дистанционной гамма терапии при лучевом разрушения злокачественных клеток с суммарной очаговой дозой 30-40 Гр (Ш.Х. Ганцев. Онкология М., Медицинское информационное агентство. 2004, с.190-204.; Stephen J.,Withrow E., MacEwen G. Smal animal clinical oncology- 2001,p.305-308).
Однако данный способ, несмотря на распространенность, обладает существенным недостатком. При разрушении раковых с помощью дистанционной гамма терапии и рентгенотерапии происходит значительное поражение нормальных клеток в пределах облучающего пучка, в том числе и клеток крови.
Известен способ фотодинамического разрушения опухолей, включающий внутривенное введение фотосенсибилизатора и облучение опухоли непрерывным лазерным излучением с длиной волны, совпадающей с полосой поглощения фотосенсибилизатора (Photodynamic therapy/Ed.T.J.Dougherty/ J.Clin.Laser Med Surg. 1996, Vol.14, P.219-348; Патент РФ №2184578. Странадко. Анализ непосредственных результатов ФДТ злокачественных новообразований. Новые достижения лазерной медицины. - М.- СПб., 1993, с. 218). При поглощении фотонов молекулами красителя, молекулы красителя переходят в возбужденное электронное состояние и при столкновении с молекулами кислорода, растворенного в биоткани, переводят его из невозбужденного в возбужденное электронное синглетное состояние, с типичным временем жизни несколько микросекунд. За это время молекулы синглетного кислорода, пройдя характерный путь, соизмеримый с размерами клеток, при взаимодействии с плазматической мембраной клетки повреждают ее и клетка гибнет вследствие некроза. Таким образом, разрушение клеток происходит лишь во время воздействия лазерного излучения в пространственной области облучения лазерным пучком, а степень повреждения зависит от числа фотонов на данной глубине биоткани, клетки которой будут повреждены.
Селективный фотодинамический механизм разрушения раковых клеток основан на более высокой плотности (контрастности) накопления фотосенсибилизатора в опухолевых клетках по сравнению с непатологическими, что связано с большей плотностью кровеносных сосудов в опухоли по сравнению со здоровой биотканью. Однако этот контраст для различных опухолей не превышает двух-трех раз.
Кроме того, фотодинамический способ при разрушении раковых клеток имеет еще ряд недостатков. В частности, коэффициент поглощения оптического излучения биотканью достигает 104-3см-1 в ультрафиолетовой до видимой области, включая зеленую область спектра, т.е. (200нм-550нм), что обусловлено поглощением ДНК, протеинов, жиров (УФ), гемоглобина и меланина (в УФ до зеленой области видимого спектра) и спадает до 102 см-1 в красной области, поэтому глубина проникновения лазерного излучения изменяется от единиц микрон до сотен микрон. Используемые в практике фотосенсибилизаторы: порфирины, хлорины имеют полосы поглощения фотосенсибилизаторов в красной области спектра и используемые лазеры не могут эффективно проникать в биоткань, в этой спектральной области лазерное излучение эффективно может применяться только для поверхностных биотканей.
Наиболее близким к предлагаемому способу является способ селективного разрушения раковых клеток при импульсном лазерном облучении (Pitsillides C.M., Joe E.K., Wei X., Anderson R.R., Lin C.P. Selective cell targeting with light-absorbing microparticles and nanoparticles // Biophys J. 2003. V. 84. P. 4023-4032).
Способ включает введение в кровь внутривенно золотых сферических наночастиц, которые накапливаются в опухоли, вследствие большой концентрации кровеносных сосудов в опухоли, облучение опухоли лазерным пучком с длиной волны, совпадающей с максимумом поглощения наночастиц, при этом наночастицы нагреваются лазерными наносекундными импульсами.
Однако данный способ обладает следующими недостатками:
Золотые наносферы диаметром от единиц до сотен нанометров имеют плазмонный резонанс с максимумом поглощения от 520 нм до 560 нм, совпадающий с максимумами поглощения гемоглобина крови, при этом лазерное излучение будет поглощаться не только наночастицами, но эритроцитами крови, поэтому лазерный фототермолиз может осуществляться только для поверхностных опухолей, так как невозможно доставить лазерное излучение на глубину более сотни микрон в биотканях. Кроме того, для лазерного излучения в этой спектральной области будет происходить поглощение излучения гемоглобином эритроцитов и их разрушение вследствие фототермолиза.
Задачей настоящего изобретения является возможность селективного фототермолиза раковых клеток в объемных опухолях, расположенных не только на поверхности биотканей, но и на глубинах до сантиметра за счет доставки ИК лазерного излучения, которое не только слабо поглощается биотканями, но и селективно будет вызывать некроз только раковых клеток, таргетированных соответствующими антителами с конъюгированными плазмонно-резонансными наночастицами, селективно поглощающими лазерные импульсы энергии и соответственно вызывающими локальный термолиз раковых клеток, при этом нормальные клетки на границе опухоли повреждаться лазерным пучком не будут и в среднем температура облучаемого объема биоткани остается в пределах нескольких градусов (не более 2-3) по сравнению с необлученной.
Технический результат заключается в селективности фототермолиза раковых клеток, расположенных в объеме биоткани при минимальном повреждения нормальных клеток, используя дискретное цифровое 3D пространственное сканирование остросфокусированного лазерного пучка, при облучении патологической биоткани наносекундными лазерными импульсами в ближнем ИК диапазоне и селективно нагревающего только патологические клетки, к плазматической мембране которых, через взаимодействие антиген-антитело, присоединены плазмонно-резонансные наночастицы, селективно поглощающие дозированное лазерное излучение.
Поставленная задача решается тем, что в способе лазерного фототермолиза раковых клеток, включающем введение коллоидного раствора золотых наночастиц в кровь или в опухоль, облучаемую резонансным импульсным лазерным излучением, согласно решению, золотые наночастицы конъюгируют с моноклональными антителами, которые селективно взаимодействуют с соотвествующими антигенами-молекулярными зондами на мембране раковых клеток, а лазерное облучение объема опухоли производят с помощью пространственного дискретного послойного 3D сканирования с помощью остросфокусированного лазерного пучка с минимальным размером фокального пятна, задаваемым средним поперечным размером раковых клеток, при этом пространственное сканирование лазерного пучка осуществляют с такой скоростью, чтобы на каждый дискретный шаг сканирования, равный размеру фокального пятна, приходилось не менее одного лазерного импульса с энергией в диапазоне 1 мкДж - 100 мкДж при длительности каждого импульса в диапазоне 1нс-100 нс соответственно, при скважности не менее 1000 и при средней лазерной мощности не более 1 Вт.
Длину волны лазерного излучения выбирают из области прозрачности биотканей в ИК диапазоне с длинами волн 750 нм-1100 нм, а золотые наночастицы, представляющие собой нанооболочки, наностержни, наноклетки, нанозвезды с плазмонным резонансом, имеют спектральный максимум поглощения, совпадающий с длиной волны излучения лазера, имеющей плазмонный резонанс в этой спектральной области прозрачности, при этом длину волны излучения лазера выбирают в области спектрального максимума поглощения наночастиц, а концентрацию наночастиц выбирают в диапазоне не менее 109 см-3 в зависимости от глубины расположения опухоли.
Изобретение поясняется чертежами:
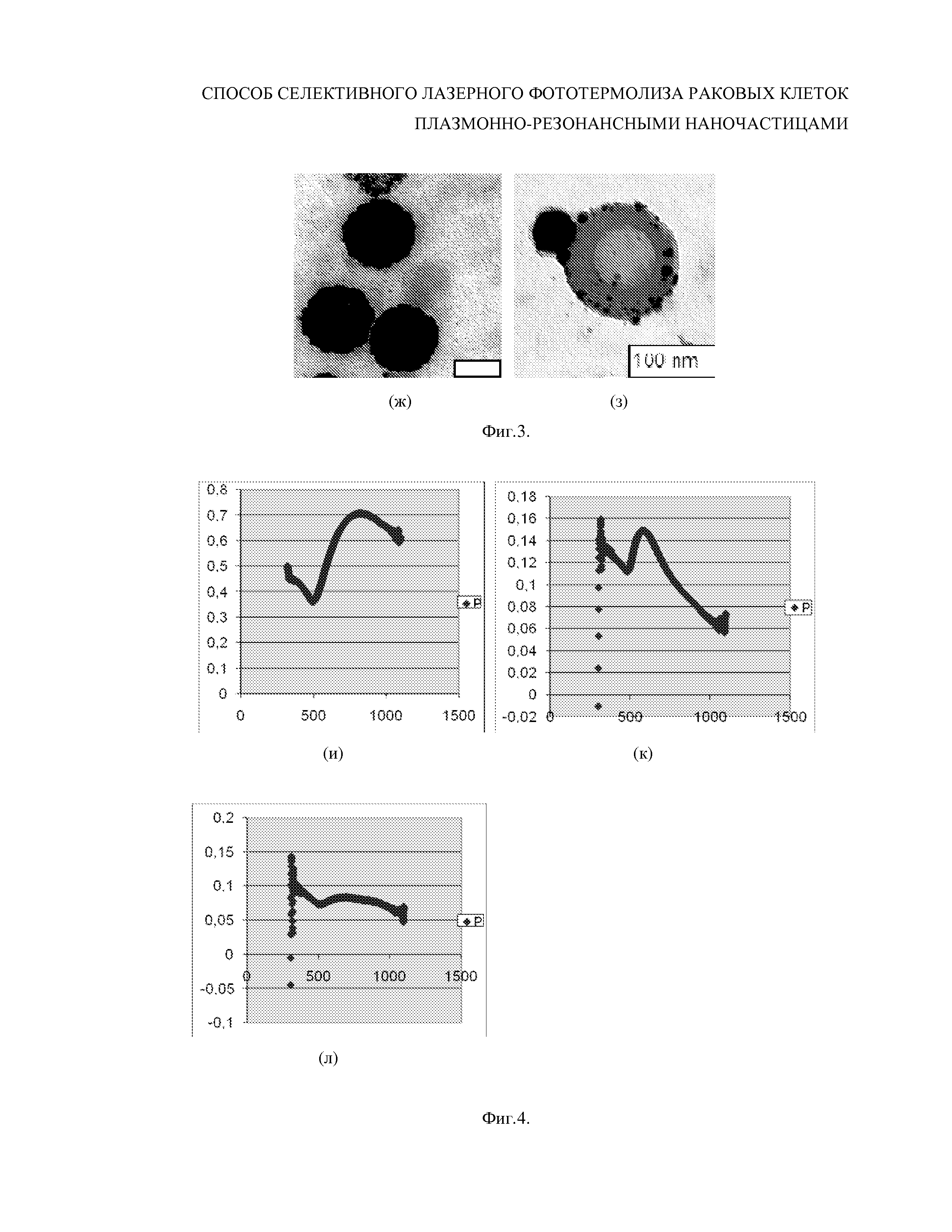
На Фиг.1 - Зависимость коэффициента пропускания (экстинкции равной поглощению и рассеянию света) от длины волны (нм) при изменении геометрических параметров наночастиц: (а) - золотые наносферы, (б) - золотые наностержни с отношение длины к диаметру от 1 до 6; (в) золотые оболочки с толщиной 2 нм с диаметром ядра из двуокиси кремния от 10 до 90 нм.
Фиг.2 - Дефрагментации золотых нанооболочек (Au/SiO2;15/140нм) при воздействии одиночных импульсов YAG:Nd λ=1064 нм лазера с энергией 10 мДж: - коллоидный раствор золотых нанооболочек до облучения г; д - после; е - изменение спектральных характеристик, приводящих к смещению положения плазмонного резонанса из ИК (900 нм) в зеленую область (530 нм).
Фиг.3 - Электронные микрофотографии, показывающие эффект дефрагментации золотых нанооболочек (Au/SiO2;15/140нм) при воздействии одиночных импульсов YAG:Nd λ=1064 нм лазера с энергией 10 мДж: ж - до облучения и з после;
На Фиг.4 - представлены результаты измерения коэффициента пропускания (экстинкции равной поглощению и рассеянию света) в спектральном диапазоне 300 нм -1100 нм коллоидного раствора золотых нанооболочек (Au/SiO2 15/140 нм), покрытых полиэтиленгликолем (ПЭГ) в стеклянной кювете толщиной 2 мм до лазерного воздействия (и) и после 2D пространственного сканирования поверхности наночастиц остросфокусированным лазерным пучком с фокальным диаметром 10 микрон последовательностью лазерных импульсов длительностью 4 нс, частоте следования 20 кГц и энергии в импульсе 1 мДж при 2D сканировании поверхности кюветы 4 на 4 мм сфокусированным лазерным пучком со скоростью сканирования 8 м/с (л) и при 3D пространственном сканирования со скоростью 8 м/c сначала 2D поверхности кюветы 4 на 4 мм сфокусированным лазерным пучком (B скан), с последующим смещением фокального пятна на 10 микрон в глубину для каждого B скана и облучение ста B сканов с суммарной глубиной 1мм (л).
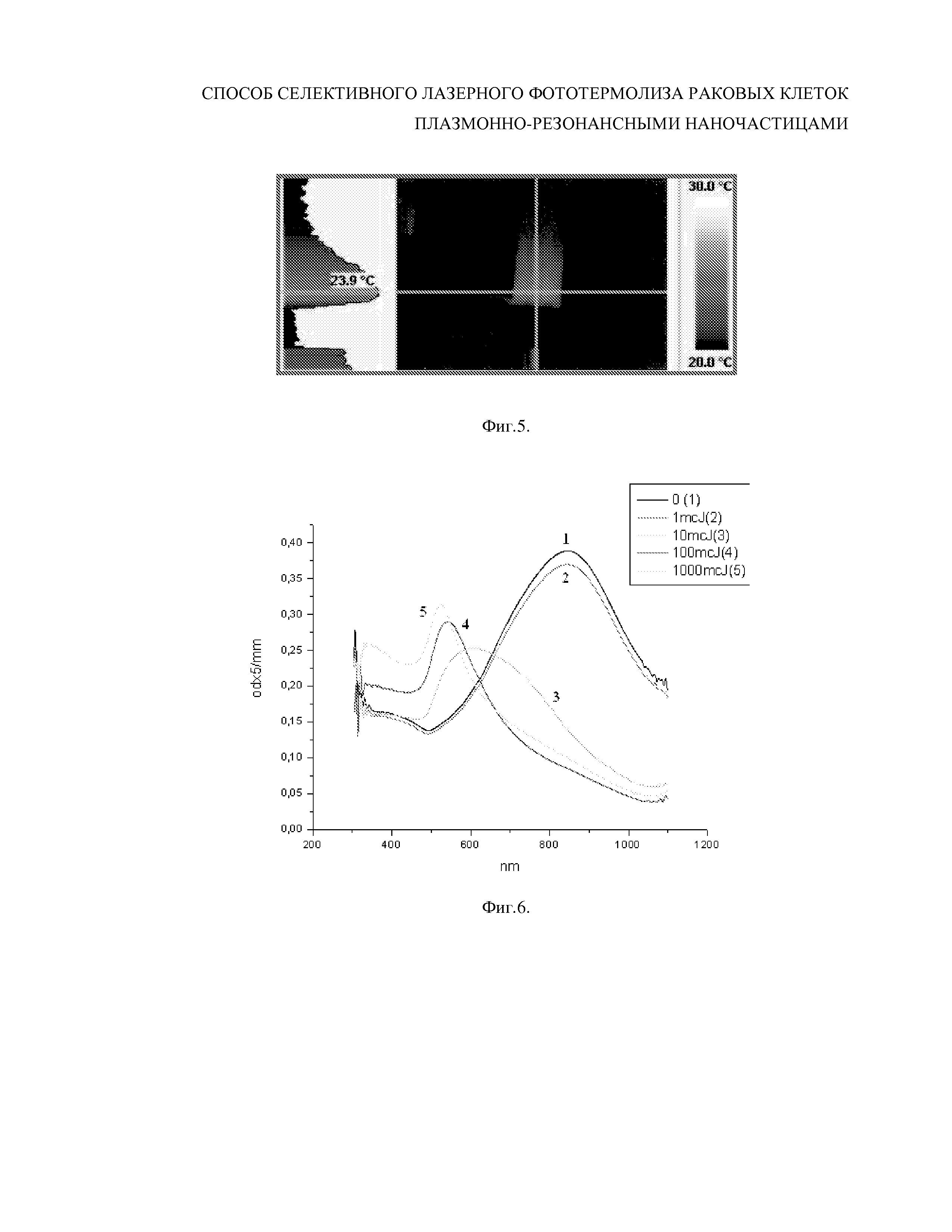
Фиг.5 - Термограммы лазерного нагрева коллоидного раствора золотых плазмонно-резонансных нанооболочек (Au/SiO2 15/140 нм) в воде при торцевом оптическом облучении кюветы типа эппендорф при 3D пространственном сканирования последовательностью лазерных импульсов с длительностью 4 нс частотой повторения 20 кГц , энергии в импульсе 0.5 мДж и средней мощностью 10 Вт с длиной волны 1.06 мкм.
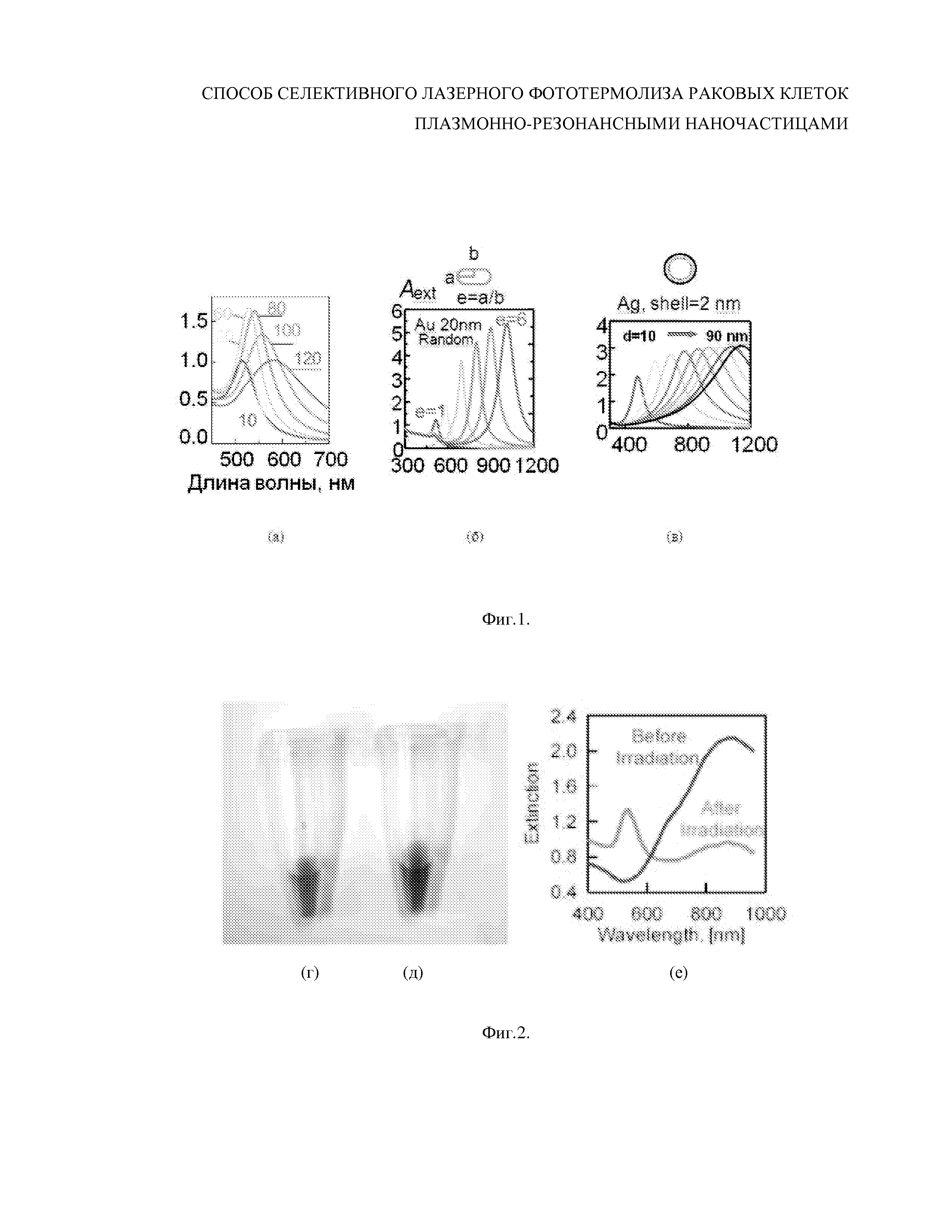
На Фиг.6. Спектральная дефрагментация золотых нанозвезд при 3D облучении остросфокусированным оптическим пучком иттербиевого лазера (1.064 нм) при длительности импульса 4 нс и частоте следования 20 кГц; энергия одиночного импульса 1-0; 2-1 мкДж; 3-10 мкДж; 4-100 мкДж; 5-1000 мкДж; скорость сканирования 400 мм/с, шаг 20мкм.
Фиг.7 - Сравнительные результаты флуоресценции клеток с красителем пропидием йодистым (PI, 6 мкМ) после лазерного 3D облучения (длительность импульса 4 нс, частота следования 20 кГц, энергия в импульсе 1 мкДж) этих раковых клеток печени линии HeLa с золотыми нанозвездами (л) и контрольных (м) без золотых наночастиц.
Фиг.8 - п - базально-клеточный рак кожи собаки, р - после 2-х сеансов лазерного фототермолиза раковых клеток при интерстициальном введении золотых нанооболочек (Au/SiO2;15/140нм) при 3D облучении последовательностью лазерных импульсов длительностью 4 нс и средней мощностью 1 Вт с длиной волны 1.06 мкм волоконного иттербиевого лазера.
Способ осуществляется следующим образом:
Животному или потенциально человеку с известным типом спонтанной раковой опухоли, полученной на основе анализа онкомаркеров, интерстициально внутрь опухоли или в кровь вводится коллоидный физраствор с золотыми плазмонно-резонансными нанооболочками, или наностержнями, или наноклетками, или нанозвездами, конъюгированными с сответствующим типом моноклональных антител, в зависимости от типа раковых клеток, через определенное время (типичная величина не более нескольких часов, если наночастицы вводятся в кровь), соответствующее максимальному накоплению концентрации раковых клеток, присоединивших к своей плазматической мембране, вследствие взаимодействия антиген-антитело наночастицы, производят чрезкожное 3D облучение объема опухоли остросфокусированным лазерным пучком, имеющим размер фокального пятна соизмеримым с типичным размером раковых клеток; при этом поперечный B скан (обычно - поперечное сечение с прямоугольными координатами сканирования X и Y) выбирается в зависимости от поперечного размера опухоли, B скан должен превышать ее размеры, а число таких B сканов по глубине должно превышать предполагаемую глубину опухоли. Облучение опухоли производят лазерным излучением с длиной волны совпадающим с плазмонным резонансом поглощения используемых наночастиц и лежащем в ИК диапазоне с длинами волн 750 нм-1100 нм, соответствующим «окну прозрачности биотканей». Параметры импульсного лазерного облучения и скорости 3D пространственного сканирования выбираются из условия, чтобы на каждое пространственное смещение фокального пятна оптического пучка приходился как минимум один лазерный импульс, а величина смещения соответствовала среднему поперечному размеру раковых клеток и таким образом последовательно облучается каждая раковая клетка в объеме опухоли. При концентрации наночастиц порядка 109 в кубическом сантиметре, среднее расстояние между наночастицами равно 10 микронам, последнее означает, что потенциально каждая раковая клетка может содержать на своей плазматической мембране плазмонно-резонансную наночастицу, которая, в свою очередь, при поглощении энергии лазерного импульса будет локально нагреваться в течение наносекундного промежутка времени и селективно повреждать мембрану раковой клетки, вследствие ее некроза, в то время как у нормальной клетки отсутствует наночастица на мембране и клетка не нагревается под действием лазерного импульса, так как не поглощает лазерное излучение и при этом также не наблюдается нагрева межклеточного пространства. Выбранные параметры длительности лазерных импульсов 1-100 нс и энергии в импульсе 1мкДж- 100 мкДж соответственно, при скважности импульсов не менее 1000, а также скорости пространственного сканирования, связанной с частотой повторения лазерных импульсов не более 100 кГц при средней лазерной мощности не более 1 Вт должны приводить к режиму селективного разрушения раковых клеток в объеме опухоли, а на ее границе нормальные клетки не будут повреждаться.
Нижний предел плотности энергии используемых лазеров определяется температурой нагрева биоткани, содержащей наночастицы, вызывающие некроз клеток опухоли, а верхний предел определяется уровнем плотности лазерной энергии, вызывающей патологические изменения биоткани, в которой не содержатся плазмонно-резонансные наночастицы.
В лаборатории размерных наносенсоров ИБФРМ РАН авторами заявки разработана технология и реально изготавливаются плазмонно-резонансные наночастицы с возможностью управлением спектрального положения плазмонного резонанса золотых нанооболочек, наностержней наноклеток и нанозвезд при изменении геометрических параметров наночастиц, как показано на Фиг. 1 (Н. Г. Хлебцов, В. А. Богатырев, Л. А. Дыкман, Б. Н. Хлебцов. Золотые наноструктуры с плазмонным резонансом для биомедицинских исследований // Российские нанотехнологии. 2007. Т. 2. № 3-4. C. 69-86).
При импульсном нагреве золотых наночастиц длительность лазерного импульса определяет локальность нагрева наночастицей окружающей биоткани. Оценки показывают, что при облучении наносекундными импульсами эффективный радиус нагрева окружающей биоткани составляет не более 1 микрона (Khlebtsov BN, Zharov VP, Melnikov AG, Tuchin VV, Khlebtsov NG. Optical amplification of photothermal therapy with gold nanoparticles and nanoclusters. Nanotechnology 2006; 17, 5267-5179).
Однако обнаруженный авторами эффект дефрагментации плазмонно-резонансных золотых нанооболочек при энергии одиночного лазерного импульса более 2 мДж и длительности 4 нс, вызывающих разрушение нанооболочек или локальное оплавление наностержней, приводит к ограничению на интенсивность лазерного излучения сверху и его минимальную длительность (Garif Akchurin, Boris Khlebtsov, Georgy Akchurin, Valery Tuchin, Vladimir Zharov, Nikolai Khlebtsov. Laser-induced photodestruction of silica/gold nanoshells under single nanosecond pulses. Nanothechnology, 2007, V.18). Эксперименты по дефрагментации золотых нанооболочек (Au/SiO2;15/140нм) при воздействии одиночных импульсов YAG:Nd λ=1064 нм лазера с энергией 2 мДж представлены на Фиг.2,3.
Авторами впервые предлагается технология 3D пространственного сканирования для облучения каждой раковой клетки остро сфокусированным лазерным пучком, вызывающей в ней некроз, но при таком облучении нормальные клетки не пострадают от лазерного воздействия.
Апробирование предлагаемой технологии проводилось при использовании иттербиевого волоконно-оптического лазера с длиной волны 1064 нм со средней лазерной мощностью 1-10 Вт и длительности оптического импульса 4 нс. Скорость пространственного сканирования может достигать 8 м в секунду при размере остросфокусированного пучка 10 мкм и частоте следования лазерных импульсов до 100 кГц.
Использование импульсных наносекундных режимов позволяет эффективно нагревать наночастицы резонансным ИК лазерным излучением, но при пространственном сканировании остросфокусированного лазерного пучка объемная среда остается более холодной, как показано на фиг. 8.
На Фиг.4 представлены сравнительные результаты измерения коэффициента пропускания (экстинкции равной поглощению и рассеянию света) в спектральном диапазоне 300 нм -1100 нм коллоидного раствора золотых нанооболочек (Au/SiO2 15/140 нм), покрытых полиэтиленгликолем (ПЭГ) в стеклянной кювете толщиной 2 мм до импульсного лазерного воздействия (и) и после (к) при 2D сканировании поверхности 4 мм на 4 мм остросфокусированным лазерным пучком. Оптическая плотность коллоидного раствора золотых нанооболочек достигает в максимуме поглощения 3.5, а в области воздействия используемого лазерного излучения на длине волны 1064 нм достигает 3.2. Измерение концентрации наночастиц, проведенное при использовании низко-когерентного оптического томографа позволила оценить концентрацию наночастиц не менее 109 см-3. Нетрудно видеть сильное спектральное изменение положения максимума плазмонного резонанса в области 800-900 нм ближнего ИК диапазона в зеленую область спектра, что соответствует структурному изменению золотых нанооболочек, вследствие сильного лазерного импульсного нагрева (свыше1000 градусов °С). Параметры лазерных импульсов, соответствующих режиму дефрагментации золотых нанооболочек: длительность лазерного импульса 4 нс, энергия в импульсе 1мДж, частота следования 20 кГц, средняя мощность 10 Вт. Однако при таком сканировании дефрагментируют наночастицы на поверхности коллоидного раствора. Результаты при 3D пространственном сканирования остросфокусированного лазерного пучка с фокальным диаметром 10 микрон и со скоростью 8 м/c коллоидного раствора золотых нанооболочек (Au/SiO2 15/140 нм) объемом с поперечными размерами 4 на 4 мм и глубиной 1 мм, вызывающее изменение спектральной зависимости коэффициента пропускания, представлены на Фиг. 4 (л). Дополнительные исследования формы наночастиц с помощью электронного микроскопа после лазерного воздействия позволили установить, что практически каждая наночастица дефрагментировала, но при этом облучаемый объем нагрелся не более чем на 2-3 градуса. Дополнительные исследования спектральной зависимости оптической плотности воды в той же кювете при 3D пространственном сканировании остросфокусированным лазерным пучком, которые показали, что вода нагрелась не более чем на 1 градус Цельсия.
Исследования температурных полей, выполненные с помощью тепловизора и представленные на Фиг. 5, позволили впервые установить, что в режиме 3D пространственного сканирования последовательностью лазерных наносекундных импульсов изменение температуры облучаемой поверхности и объема коллоидного раствора золотых нанооболочек (Au/SiO2 15/140 нм) не превышает 2-3 градуса, что обусловлено быстрым наносекундным остыванием наночастиц.
Экспериментальные результаты по дефрагментации золотых нанозвезд при 3D облучении остросфокусированным оптическим пучком иттербиевого лазера (1.064 нм) при длительности импульса 4 нс и частоте следования 20 кГц и для различных уровней энергии одиночного импульса 1-0; 2-1 мкДж; 3-10 мкДж; 4-100 мкДж; 5-1000 мкДж; скорость сканирования 400 мм/с, шаг 20мкм представлены на Фиг.6. Спектральные зависимости коэффициента экстинкции золотых нанозвезд отражают степень их дефрагментации при воздействии импульсного наносекундного ИК лазерного излучения при разной энергии в каждом оптическом импульсе.
Для определения лазерной оптопорации клеток (управляемой проницаемости мембраны клеток) проводились эксперименты, в ходе которых определяли зависимость степени проницаемости мембраны клеток, инкубированных с наночастицами до и после лазерного облучения в зависимости от морфологии наночастиц и параметров облучения (режим облучения, мощность облучения и т.д.). Клетки линии HeLa выращивали до 80% монослоя в 96-луночном планшете при 37°С в темноте, во влажной атмосфере c содержанием 5% СО2. Получали стоковые растворы золотых наночастиц наностержней, нанозвезд, наносфер, нанооболочек. Добавляли 0,75 или 1,5 мкл стокового раствора на 100 мкл питательной среды. Количество среды в одной лунке – 200 мкл. Клетки перед облучением не отмывали от золотых наночастиц. Клетки облучали наносекундным лазером (1064 нм) при длительности импульса 4 нс, частоте следования 20 кГц, энергией импульса в диапазоне от 1мДж до 1 мкДж. Клетки окрашивали красителем пропидием йодистым (PI, 6 мкМ). При повреждении плазматической мембраны клетки краситель пропидием йодистым проникает внутрь клетки и при возбуждении сине-фиолетовым светом флуоресцирует в красной области. Сравнительные результаты лазерного 3D облучения раковых клеток печени линии HeLa с золотыми нанозвездами и контрольных без наночастиц представлены на Фиг.7 (л) и (м) соответственно. Для лучшей визуализации PI-позитивных клеток использовали флуоресцентный режим с фильтром А4 (Excitation Filter: BP 360/40; Dichromatic Mirror: 400; Suppression Filter: BP 470/40) на флуоресцентном микроскопе. На Фиг. 7 нетрудно видеть прямоугольный уголок из поврежденных флуоресцирующих клеток HeLa и отсутствие флуоресценции из клеток, не содержащих золотые наночастицы, у которых плазматическая мембрана не повреждена лазерным излучением.
Эффективность проведенного по патентуемой методике ИК лазерного фототермолиза на основе технологии плазмонно-резонансных золотых наночастиц при облучении базально-клеточного рака кожи собаки in vivo показали тестовые измерения, представленные на Фиг.8 (п) - до облучения и после (р), через две недели.
Таким образом, параметры лазерного импульсного воздействия определялись экспериментально на клетках линии HeLa и in vivo на спонтанных опухолях животных, при последующем гистологическом анализе, а параметры лазерных импульсов (длительность, частота следования, средняя оптическая мощность) определялась условием, указанным в формуле изобретения.