Результат интеллектуальной деятельности: ШТАММ КЛЕТОК ЯИЧНИКОВ КИТАЙСКОГО ХОМЯЧКА СНО-ЕРО 4А9 - ПРОДУЦЕНТ ВЫСОКОСИАЛИРОВАННОГО ЭРИТРОПОЭТИНА
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, а именно к технологии получения рекомбинантного эритропоэтина.
Эритропоэтин - это гормон гликопротеиновой природы, стимулирующий эритропоэз, т.е. пролиферацию клеток-предшественников эритроидного ряда в костном мозге и созревание эритроцитов. (https://ru.wikipedia.org/wiki/Эритропоэтин). Лекарственные препараты на основе рекомбинантного эритропоэтина с успехом применяются для лечения дефицита эритроцитов, прежде всего, у пациентов с анемиями на фоне хронических заболеваний почек, при которых наблюдается дефицит эндогенной продукции эритропоэтина, а также у больных с онкологическими заболеваниями, у которых анемия связана с побочным действием цитостатической терапии.
В структуре молекулы эритропоэтина присутствует три сайта N-гликозилирования, а также несколько потенциальных сайтов О-гликозилирования. Рекомбинантные эритропоэтины, используемые в качестве лекарственных препаратов, являются обильно гликозилированными и сиалированными белками. Наличие остатков сиаловых кислот в структуре эритропоэтина увеличивает отрицательный заряд молекулы при физиологических значениях рН, что положительно влияет на время циркуляции эритропоэтина in vivo. Наличие соответствующих количеств сиаловых кислот в структуре молекулы эритропоэтина обуславливает определенный диапазон дискретных значений изоэлектрической точки изоформ белка, а определенное соотношение данных изоформ характеризует, в частности, коммерческие препараты эпоэтинов-Рекормон, Эпокрин и других. Указанное соотношение также принципиально важно для определения биоподобия воспроизведенных препаратов рекомбинантного эритропоэтина [Солдатов А.А., и др. Доказательство подобия рекомбинантных эпоэтинов, зарегистрированных на основе принципов "biosimilars" (физико-химические и биологические свойства) // Биопрепараты. 2014. №1 (49). С. 11-22.].
Рекомбинантный эритропоэтин человека получают в настоящее время биотехнологическим способом с использованием клеток млекопитающих, поскольку только клетки млекопитающих могут обеспечить необходимый уровень гликозилирования данного белка. При этом, как правило, используются клетки линии СНО (яичники китайского хомячка). При культивировании штаммов-продуцентов эритропоэтина на основе клеток СНО происходит накопление рекомбинантного белка в культуральной жидкости, при этом характерно присутствие в ней большого разнообразия гликоформ, отличающихся степенью гликозилирования и сиалирования. Очистка эритропоэтина из среды культивирования клеток включает обычно несколько хроматографических стадий, в ходе которых, в частности, удаляются недостаточно сиалированные гликоформы с изоэлектрическими точками, не входящими в целевой диапазон. При этом, в зависимости от особенностей штамма-продуцента и использованной технологии ферментации доля гликоформ, подлежащих удалению при очистке, может превышать 50% [Ahn W.S., et al. Effect of Culture Temperature on Erythropoietin Production and Glycosylation in a Perfusion Culture of Recombinant CHO Cells // Biotechnology and Bioengineering, Vol. 101, No. 6, December 15, 2008, 1234-1243].
В связи с этим актуальной проблемой современной биотехнологии является поиск подходов, позволяющих увеличить гликозилирование и сиалирование эритропоэтина. Подобные подходы обычно основаны либо на подборе питательных добавок, улучшающих профиль гликозилирования [Орлова Н.В., и др. Влияние различных добавок на уровень продукции и степень сиалирования рекомбинантного эритропоэтина человека, секретируемого производственной клеточной линией СНО-ЕРО-2 // Биотехнология. - 2013. - №4. - С. 48-55], либо на использовании специально созданных штаммов-продуцентов с повышенной экспрессией ферментов, ответственных за синтез гликанов [Bork K. et al. Enhanced sialylation of EPO by overexpression of UDP-GlcNAc 2-epimerase/ManAc kinase containing a sialuria mutation in CHO cells // FEBS Letters 581 (2007) 4195-4198; Yeon Tae J. et al., Enhanced Sialylation of Recombinant Erythropoietin in CHO Cells by Human Glycosyltransferase Expression // J. Microbiol. Biotechnol. (2008), 18(12), 1945-1952; Son Y.-D., et al. Enhanced sialylation of recombinant human erythropoietin in Chinese hamster ovary cells by combinatorial engineering of selected genes // Glycobiology vol. 21 no. 8 pp. 1019-1028, 2011; Wang Z., et al. Enhancement of recombinant human EPO production and sialylation in Chinese hamster ovary cells through Bombyx mori 30Kcl9 gene expression // Biotechnol Bioeng. 2011 Jul; 108(7):1634-42].
Наиболее близким по технической сущности к заявляемому изобретению является штамм CHO-gmt4 (JW152) [Goh J.S.Y., et al. Highly sialylated recombinant human erythropoietin production in large-scale perfusion bioreactor utilizing CHO-gmt4 (JW152) with restored GnT I function // Biotechnol. J. 2014, 9, 100-109], позволяющий получать высокосиалированный эритропоэтин. Однако использование данного штамма характеризуется достаточно низкими уровнями выхода целевого белка, что делает его малопригодным для создания промышленной технологии.
Технической задачей, решаемой авторами, было создание штамма-продуцента рекомбинантного эритропоэтина человека, который способен производить высокосиалированный эритропоэтин при культивировании в бессывороточной среде с химически определенным составом с более высоким выходом.
Технический результат был достигнут получением штамма клеток яичников китайского хомячка СНО-ЕРО 4А9 - продуцента высокосиалированного эритропоэтина человека, обеспечивающего за 13 суток культивирования в бессывороточной среде накопление в культуральной среде до 240 мг/л рекомбинантного эритропоэтина со средним содержанием сиаловых килот не менее 10 моль на моль белка.
Данный штамм клеток яичников китайского хомячка СНО-ЕРО 4А9 -продуцент эритропоэтина человека был депонирован в Специализированную коллекцию культур клеток позвоночных Российской коллекции клеточных культур 11.06.2015 под РККК(П) 767 Д.
Родословная штамма: Родительская клеточная линия CHO-S. Трансфекция плазмидами pBVneo/hER и pBVdhfr/hER, отбор стабильного высокопродуктивного клона на среде без гипоксантина/тимидина с 500 мкг/мл G-418 и постепенным увеличением концентрации метотрексата.
Число пассажей к моменту паспортизации и депонирования: 15
Стандартные условия выращивания: Среда CD СНО (Invitrogen) без гипоксантина/тимидина с 8 мМ глутамина, 500 мкг/мл G-418, 25 нМ метотрексата, 37°С, 8% CO2.
Культуральные свойства: Суспензионное культивирование в пробирках, колбах или 6-луночных платах на орбитальном шейкере. Посевная доза 0,3-0,4×106/мл, пересев каждые 3-4 суток. Время удвоения 24-26 часов.
Данные по видовой принадлежности: Cricetulus griseus (ПЦР-анализ с видоспецифичными праймерами).
Продуцирует рекомбинантный эритропоэтин человека (оценка с помощью твердофазного иммуноферментного анализа, вестерн-блота, биологического теста).
Способ криоконсервирования: 45% свежей среды CD СНО, 45% кондиционной среды, 10% DMSO, заморозка до -70°С со скоростью 1°С/мин, далее помещение в жидкий азот, жизнеспособность после размораживания и отмывки от криоконсерванта 90% (с трипановым синим).
Штамм обеспечивает секретирование рекомбинантного эритропоэтина человека в культуральную среду в концентрации не менее 15 пг на клетку в сутки. Стабильность культивирования не менее 25 пассажей.
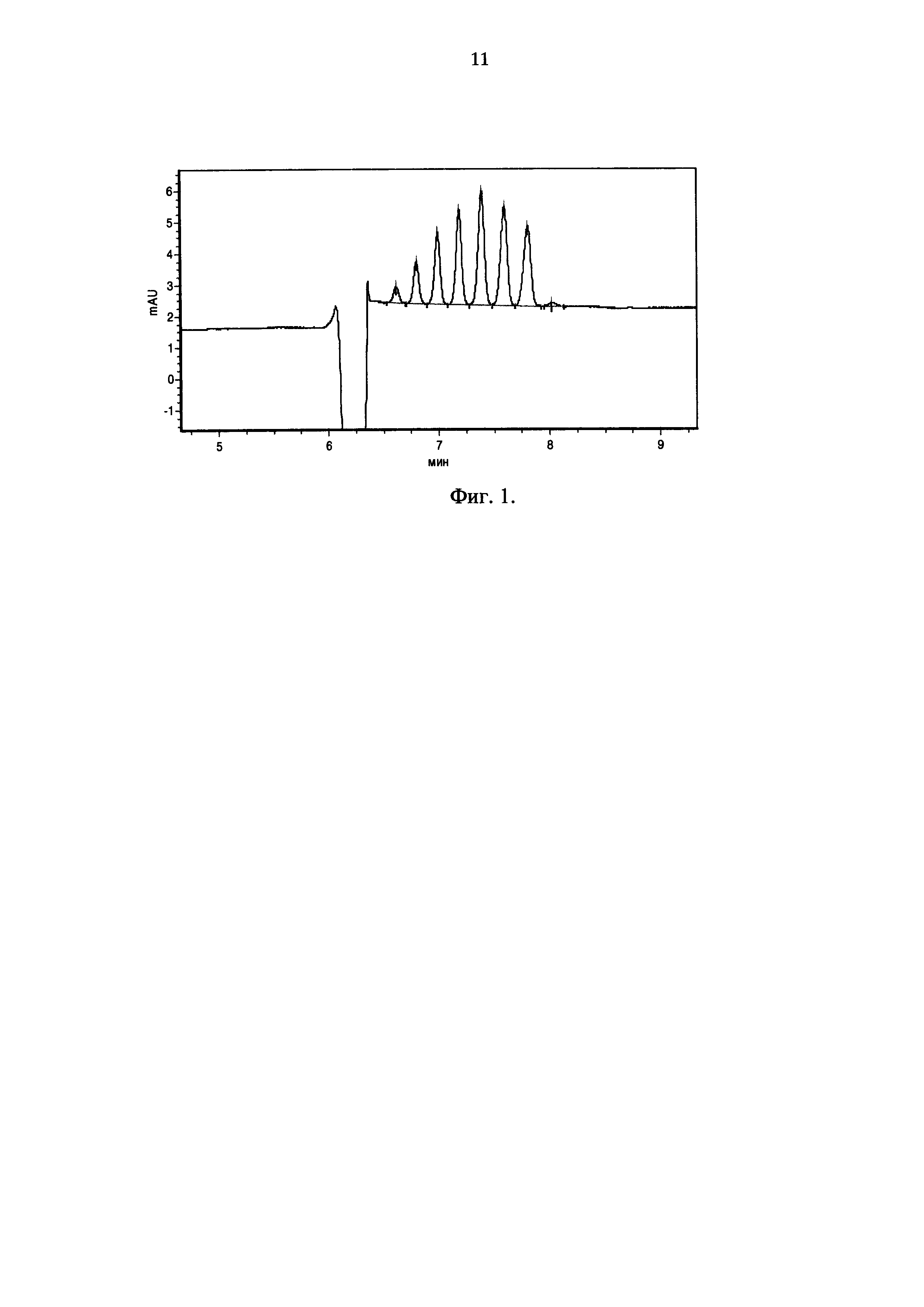
Изобретение иллюстрируется рисунком на фиг. 1, где показана электрофореграмма рекомбинантного эритропоэтина, выделенного из супернатанта штамма-продуцента 4А9 (капиллярный зонный электрофорез). Изобретение поясняется следующими примерами:
Пример 1. Получение штамма-продуцента высокосиалированного эритропоэтина
Дизайн гена, кодирующего человеческий эритропоэтин, был проведен с учетом встречаемости кодонов в геноме Cr.griseus. Нуклеотидная последовательность гена была получена синтетическим путем и рестрикционно клонирована по фланкирующим сайтам в два экспрессионных вектора - pBVneo (содержит ген устойчивости к геницитину) и pBVdhfr (содержит ген дигидрофолатредуктазы). Правильность синтеза гена и сборки полученных плазмид pBVneo/hER и pBVdhfr/hER подтверждали сиквенированием.
Для трансфекции использовали смесь плазмид в соотношении 2 части pBVneo/hER и 1 часть pBVdhfr/hER. В качестве штамма-реципиента использовали клеточную линию CHO-S, дефицитную по дигидрофолатредуктазе, и адаптированную к суспензионному росту в бессывороточной среде. Клетки культивировали в среде CD-CHO Medium (Invitrogen) с добавлением 8 мМ L-глутамина (Gibco) и HT-media supplement (Gibco). Трансфекцию проводили с помощью реагента Lipofectamine 2000 (Life Technologies). Селекцию проводили в среде CD-CHO Medium с глутамином, без гипоксантина/тимидина и с 500 мкг/мл антибиотика G-418 (Gibco).
Через 48 часов после трансфекции клетки переводили на селективную среду, в которой культивировали в течение 22 суток, а затем клонировали методом лимитирующих разведений в 96-луночных платах. Было проанализировано 185 индивидуальных клонов, демонстрировавших стабильный рост в селективной среде. Супернатанты из 96-луночной платы отбирали для первичного скрининга с помощью твердофазного иммуноферментного анализа (ИФА) с использованием набора Human Erythropoietin Platinum ELISA. Всего после первичного скрининга было отобрано для дальнейшей работы 48 клонов, в супернатантах которых уровень эритропоэтина превысил 3 мкг/мл,
Клетки отобранных 48 клонов с максимальной продукцией по результатам первичного скрининга наращивали и высевали по 300 тысяч в 1 мл культуральной среды CD-CHO Medium с 20% питательной добавки СНО CD EfficientFeed С (Life Technologies) в лунке 24-луночной платы и культивировали 10 суток. После определяли концентрацию рЭПО в супернатантах с помощью ИФА, а затем - содержание сиаловых кислот в белках супернатанта с помощью метода, основанного на отщеплении сиаловых кислот от белка сиалидазой с последующей их дериватизацией малононитрилом [10].
В ходе второго скрининга среди десяти клонов с максимальным содержанием эритропоэтина в супернатанте был обнаружен клон 4А9, в супернатанте которого содержался белок со средним содержанием сиаловых кислот более 11 моль в расчете на 1 моль рекомбинантного эритропоэтина (таблица 1). В супернатантах прочих клонов содержание сиаловых кислот не превышало 7 моль на 1 моль эритропоэтина.

Клон 4А9 с высоким уровнем содержания сиаловых кислот в секретируемом белке был подвергнут раунду амплификации при 25 нМ метотрексата для повышения продуктивности. Затем культура штамма-продуцента клона 4А9 была реклонирована и криоконсервирована.
Пример 2. Анализ содержания изоформ в рекомбинантном эритропоэтине, секретируемом штаммом-продуцентом 4А9
Для проведения анализа состава изоформ в рекомбинантном эритропоэтине, секретируемом штаммом-продуцентом 4А9, клетки данного клона культивировали в колбе Эрленмейера в течение 13 суток в среде CD-CHO Medium с 8 мМ глутамина и 25% питательной добавки СНО CD EfficientFeed С, которую добавляли по 5% объема на 3, 5, 7, 9 и 11 сутки. На 13 сутки культивирования концентрация рекомбинантного эритропоэтина в супернатанте составила 240 мг/л, а содержание сиаловых кислот, измеренное, как описано в примере 1-10,9 моль на моль эритропоэтина.
Супернатант осветляли двухступенчатым центрифугированием при 500g и 10000g с последующей фильтрацией через фильтр с диаметром пор 0,22 мкм. Очистка рекомбинантного эритропоэтина проводилась с помощью иммуно-аффинной хроматографии (использовали колонку с иммуносорбентом 6-4A3-сефароза объемом 15 мл). Полученный белок анализировали с помощью капиллярного зонного электрофореза с использованием фонового электролита по Ph. Eur. 1316, непокрытого капилляра общей длиной 50 см с эффективной длиной 40 см диаметром 50 мкм с использованием системы «Капель-105М». Пример электрофореграммы показан на Фиг. 1. При анализе серии электрофореграмм данного образца установлено, что состав изоформ в белке, полученном после единственного этапа хроматографической очистки культуральной жидкости штамма-продуцента 4А9, соответствует требованиям Европейской фармакопеи (таблица 2).
Таким образом, рекомбинантный эритропоэтин, секретируемый штаммом-продуцентом 4А9, выделенный из культуральной жидкости с помощью аффинной хроматографии имеет состав изоформ, соответствующий требованиям Европейской фармакопеи к препаратам эритропоэтина, что подтверждает высокую степень гликозилирования и сиалирования белка.
Для сравнения уровня содержания целевых изоформ в составе рекомбинантного эритропоэтина, секретируемого клоном 4А9, полученный образец белка был подвергнут дополнительной очистке с помощью ионообменной хроматографии, которая используется при производстве фармацевтической субстанции эритропоэтина с целью удаления примесей, таких как белки штамма-продуцента, а также щелочных изоформ рекомбинантного эритропоэтина. Для этого препарат эритропоэтина после аффинной хроматографии наносили на анионообменную матрицу Sepharose Q FF(GE Healthcare) уравновешанную с 10 мМ фосфатным буфером рН 7,3. После сорбции колонку отмывали двумя объемами того же буфера. Для удаления щелочных изоформ сорбент отмывали двумя объемами 20 мМ ацетатного буфера рН4.0. Затем через сорбент вновь пропускали два объема уравновешивающего буфера, после чего очищенный эритропоэтин элюировали 20 мМ фосфатным буфером рН 7,4 содержащим 0,2 М NaCl.
Выход рекомбинантного эритропоэтина определялся как доля белка, полученного после ионообменной хроматографии, от исходного содержания белка (концентрация белка определялась с помощью спектрофотометрии в ультрафиолетовой области). В качестве препарата сравнения использовался эритропоэтин, секретируемый промышленным штаммом-продуцентом СНО-ЭПО/SPM (RU 2125093, 1999). Культуральная жидкость штамма-продуцента СНО-ЭПО/SPM подвергалась такой же процедуре очистки (аффинная хроматография и ионообменная хроматография).
Анализ потерь целевого белка при ионообменной хроматографии показал, что при очистке рекомбинантного белка, синтезированного штаммом-продуцентом 4А9, потери при второй стадии очистки в описанных условиях составляют не более 8%. Аналогичная очистка рекомбинантного эритропоэтина из культуральной жидкости штамма СНО-ЭПО/SPM приводила к потере 26% белка, представленного щелочными изоформами.
Таким образом, штамм-продуцент 4А9 секретирует рекомбинантный эритропоэтин, при выделении которого потери белка, не соответствующего фармакопейным требованиям, являются минимальными, что в совокупности с высокой волюметрической продуктивностью штамма (240 мг/л) демонстрирует его высокую пригодность для промышленного производства рекомбинантного эритропоэтина.
Штамм клеток яичников китайского хомячка СНО-ЕРО 4А9, депонированный в Российской коллекции клеточных культур под номером РККК(П) 767 Д, - продуцент рекомбинантного высокосиалированного эритропоэтина человека.