Результат интеллектуальной деятельности: Подкожный ксенографт клеточной линии беспигментной меланомы кожи человека mel Rac с мутацией NRAS для доклинического изучения противоопухолевых таргетных средств
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к экспериментальной онкологии, и касается создания подкожных ксенографтов беспигментной меланомы кожи человека для доклинического изучения противоопухолевых таргетных средств.
Диссеминированная меланома кожи человека, особенно беспигментная, отличается чрезвычайно низкой чувствительностью к различным видам терапии [Демидов Л.В., Орлова К.В. Индивидуализация лекарственного лечения меланомы кожи // Практическая онкология, 2013, т. 14, №4, с. 239-246].
Важным фактором в исследованиях по созданию таргетных антимеланомных препаратов является повышенная активность митогенактивированных протеинкиназ (МАРК) сигнального пути RAS/RAF/MEK/ERK, сопряженная с наличием мутаций. В 15-20% первичных и метастатических меланом обнаружена мутация гена NRAS, связанная с однонуклеотидной заменой 182A>G, что приводит к замене глутамина на аргинин p. Q61R в кодоне 61, кодирующем малую ГТФазу [Albino A., LeStrange R. Transforming ras genes from human melanoma: a manifestation of tumor heterogeneity? Nature. 1984. - v.308(5954):69-72; Jakob J.A., Bassett R.L. Jr., Ng C.S., Curry J.L., Joseph R.W., Alvarado G.C., et al.: NRAS mutation status is an independent prognostic factor in metastatic melanoma // Cancer. - 2012, v. 118. - №16. - pp. 4014-4023; Colombino M., Capone M., Lissia A., Cossu A., Rubino C., De Giorgi V., Massi D., Fonsatti E., Staibano S., Nappi O., Pagani E., Casula M., Manca A., Sini M., Franco R., Botti G.,  C, Mozzillo N., Ascierto P.A., Palmieri G. BRAF/NRAS mutation frequencies among primary tumors and metastases in patients with melanoma // J. Clin. Oncol. 2012.-Jul 10.-v. 30.-№20.-pp. 2522-2529].
C, Mozzillo N., Ascierto P.A., Palmieri G. BRAF/NRAS mutation frequencies among primary tumors and metastases in patients with melanoma // J. Clin. Oncol. 2012.-Jul 10.-v. 30.-№20.-pp. 2522-2529].
Большинство (80%) мутаций в гене NRAS приводят к образованию аберрантной формы белка, который не может гидролизовать RAS-ГТФ и остается гиперактивным. Эти мутации ассоциированы с онкогенезом на ранних стадиях развития меланомы.
Мутации в экзоне 3 гена NRAS обнаруживаются на более поздних этапах развития болезни и, как предполагают, влияют на процесс метастазирования меланомы. Мутации NRAS нередко выявляются в метастазах меланомы после терапии BRAF-ингибиторами [Zimmer L., Hillen U., Livingstone E., Lacouture M.E., Busam K., Carvajal R.D., et al. Atypical Melanocytic Proliferations and New Primary Melanomas in Patients With Advanced Melanoma Undergoing Selective BRAF Inhibition // J. Clin. One. 2012, - v. 30. - №19. - pp. 2375-2383].
Антимеланомные ингибиторы, нацеленные на мутации NRAS, находятся в стадии доклинической или клинической разработки, отдельные препараты применяются в клинике [Jaiswal B.S., Janakiraman V., Kljavin N.M., Eastham-Anderson J., Cupp J.E., Liang Y., et al.: Combined targeting of BRAF and CRAF or BRAF and PI3K effector pathways is required for efficacy in NRAS mutant tumors // PLoS One 2009, v. 4. - №5. - p.e 5717; Sosman J.A., Kittaneh M., Lolkema M.P., Postow M.A., Schwartz G., Franklin C, et al.: A phase 1b/2 study of LEE011 in combination with binimetinib (MEK162) in patients with NRAS-mutant melanoma: Early encouraging clinical activity // J. Clin. Oncol., 2014, v. 32 (suppl; abstr 9009): 5s. 2014 ASCO Annual Meeting; Posch C, Moslehi H., Feeney L., Green G.A., Ebaee A., Feichtenschlager V., et al.: Combined targeting of MEK and PI3K/mTOR effector pathways is necessary to effectively inhibit NRAS mutant melanoma in vitro and in vivo // Proc. Natl. Acad. Sci. USA, 2013, v. 100. - №10. - pp. 4015-4020; Ascierto P.A., Schadendorf D., Berking C, Agarwala S.S., van Herpen СМ., Queirolo P., et al.: MEK162 for patients with advanced melanoma harbouring NRAS or Val600 BRAF mutations: a non-randomised, open-label phase 2 study // Lancet Oncol. 2013, v. l4. - №3. - pp. 249-256].
При таргетной терапии больных метастатической меланомой с мутацией гена NRAS селективными ингибиторами киназ МЕК1 и МЕК2 - препаратами МЕК 162 и траметинибом (мекинист) получены обнадеживающие результаты [Inman S., Dabrafenib/Trametinib Combination Approved for Advanced Melanoma/ Published Online: Thursday, January 9, 2014. Источник: http://www.onclive.com/web-exclusives/FDA-Approves-First-Ever-Combination-for-Metastatic-Melanoma]. Кроме того, наличие соматической мутации в гене NRAS у больных меланомой кожи коррелирует с эффективностью иммунотерапии высокими дозами интерлейкина IL-2 [Joseph R.W., Sullivan R.J., Harrell R., Stemke-Hale К., Panka D., Manoukian G., et al. Correlation of NRAS mutations with clinical response to high-dose IL-2 in patients with advanced melanoma // J. Immunother. Jan; 2012. - v. 35. - №l. - pp. 66-72].
Для доклинического изучения эффективности новых NRAS-направленных противоопухолевых таргетных средств необходимо создание подкожных ксенографтов in vivo.
Известен подкожный ксенографт клеточной линии меланомы кожи человека mel Cher с мутацией V600E BRAF для доклинического изучения таргетных противоопухолевых средств [Патент РФ №2572569].
Задачей изобретения является создание подкожного ксенографта из клеточной линии беспигментной меланомы кожи человека mel Rac с мутацией NRAS для доклинического изучения противоопухолевых таргетных средств.
Поставленная задача решается тем, что подкожный ксенографт создан из клеточной линии беспигментной меланомы кожи человека mel Rac с наличием мутации гена NRAS, адаптирован к росту со стабильной кинетикой у иммунодефицитных мышей Balb/c nude.
Для доклинического изучения противоопухолевых таргетных средств, направленных на мутацию NRAS, была использована клеточная линия беспигментной меланомы кожи человека mel Rac [Патент РФ №2402612]. Клеточная линия беспигментной меланомы кожи человека mel Rac имеет соответствующие онкологическому профилю стабильные культуральные, морфологические и индивидуальные фенотипические характеристики, представленные дифференцировочными антигенами CD63, HMW, отрицательными MelanA, НМВ45 и Tyrosinase, положительными маркерами на уровне МРНК раково-тестикулярного семейства MAGE, а также молекулами гистосовместимости первого и второго класса. Клеточная линия mel Rac имеет достаточно высокий митотический потенциал, позволяющий получить солидный рост in vivo при соответствующей трансплантационной адаптации.
Технический результат изобретения
Создан подкожный ксенографт клеточной линии беспигментной меланомы кожи человека mel Rac с мутацией NRAS для доклинического изучения противоопухолевых таргетных средств с выявленной мутацией в экзоне 3 гена NRAS, адаптированный к росту у иммунодефицитных мышей Balb/c nude со стабильной кинетикой роста. Изобретение иллюстрируется таблицами 1-4 и фигурами 1-4.
Табл. 1. Выбор оптимальной прививочной дозы клеток меланомы кожи человека mel Rac для получения подкожных ксенографтов у мышей Balb/c nude.
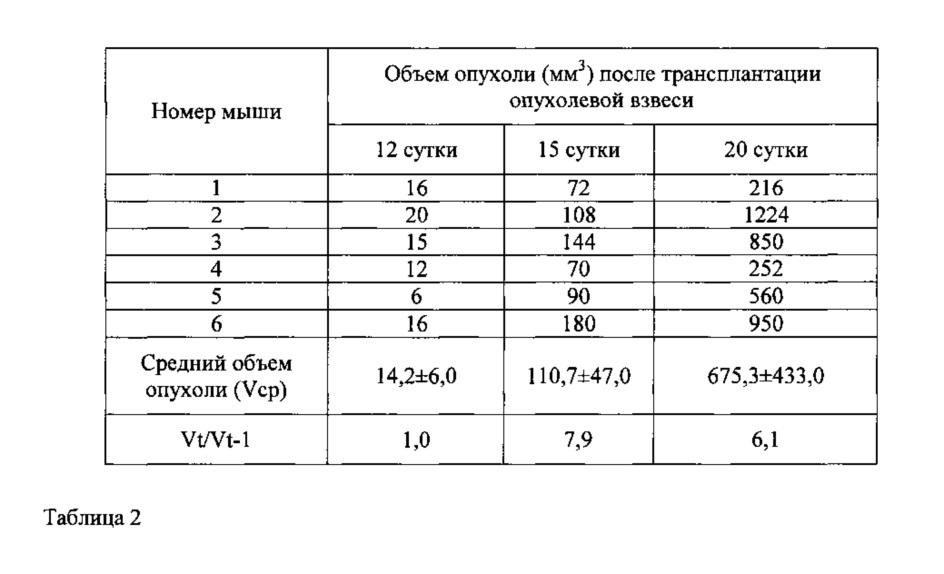
Табл. 2. Динамика роста опухоли после имплантации 1,0×107 клеток меланомы кожи человека mel Rac у мышей Balb/c nude (первый пассаж).
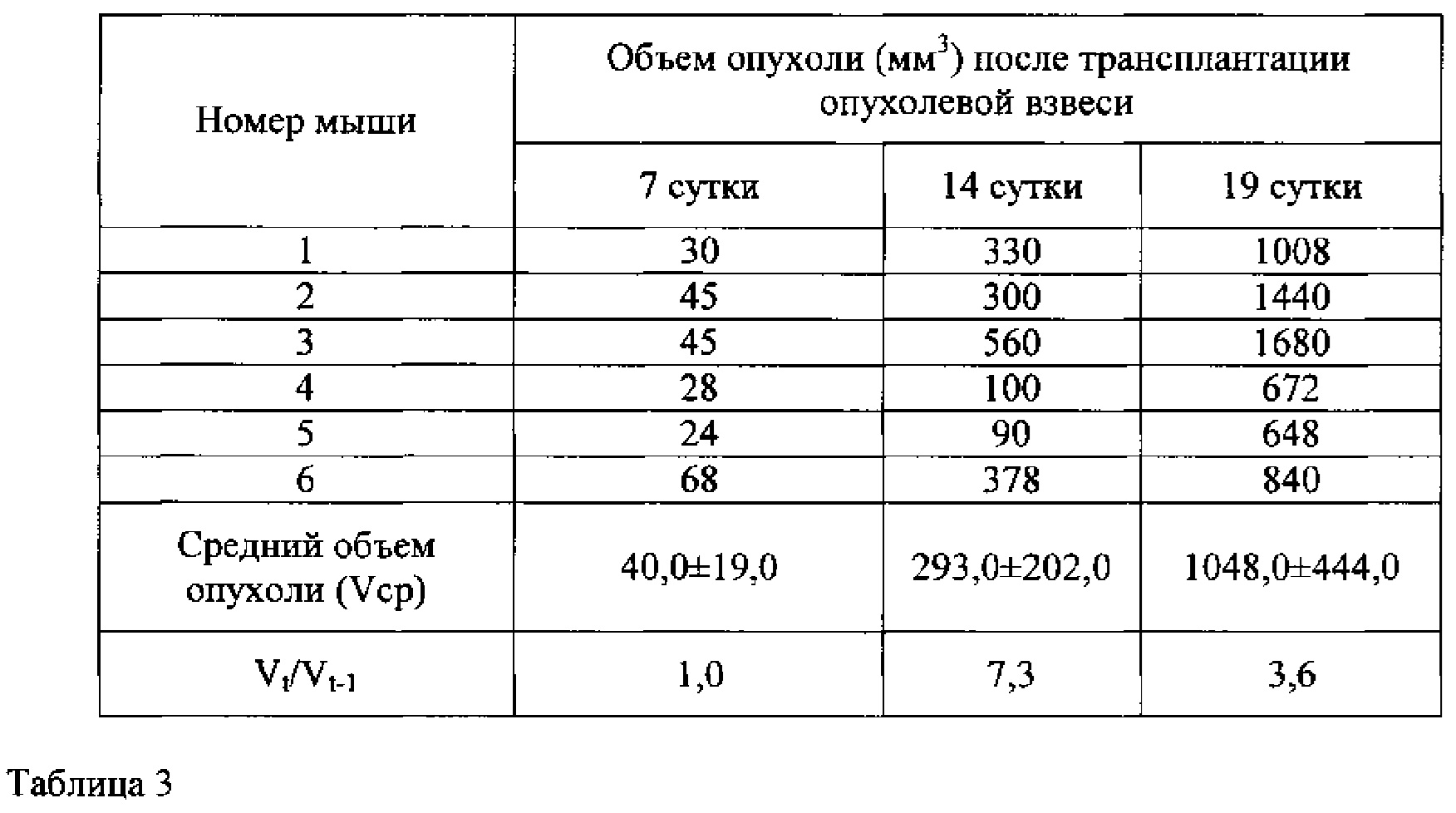
Табл. 3. Средний объем опухоли беспигментной меланомы кожи человека mel Rac у мышей Balb/c nude (четвертый пассаж).
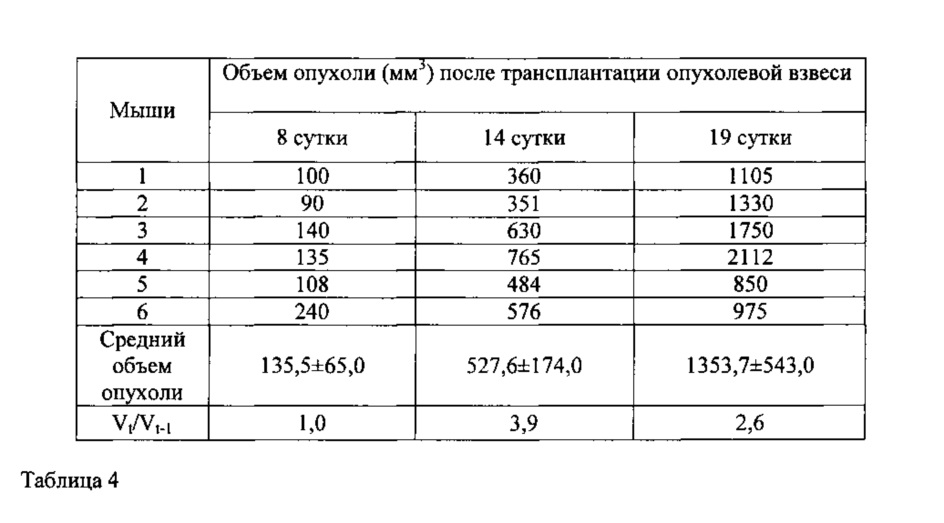
Табл. 4. Средний объем опухоли беспигментной меланомы кожи человека mel Rac у мышей Balb/c nude (девятый пассаж).
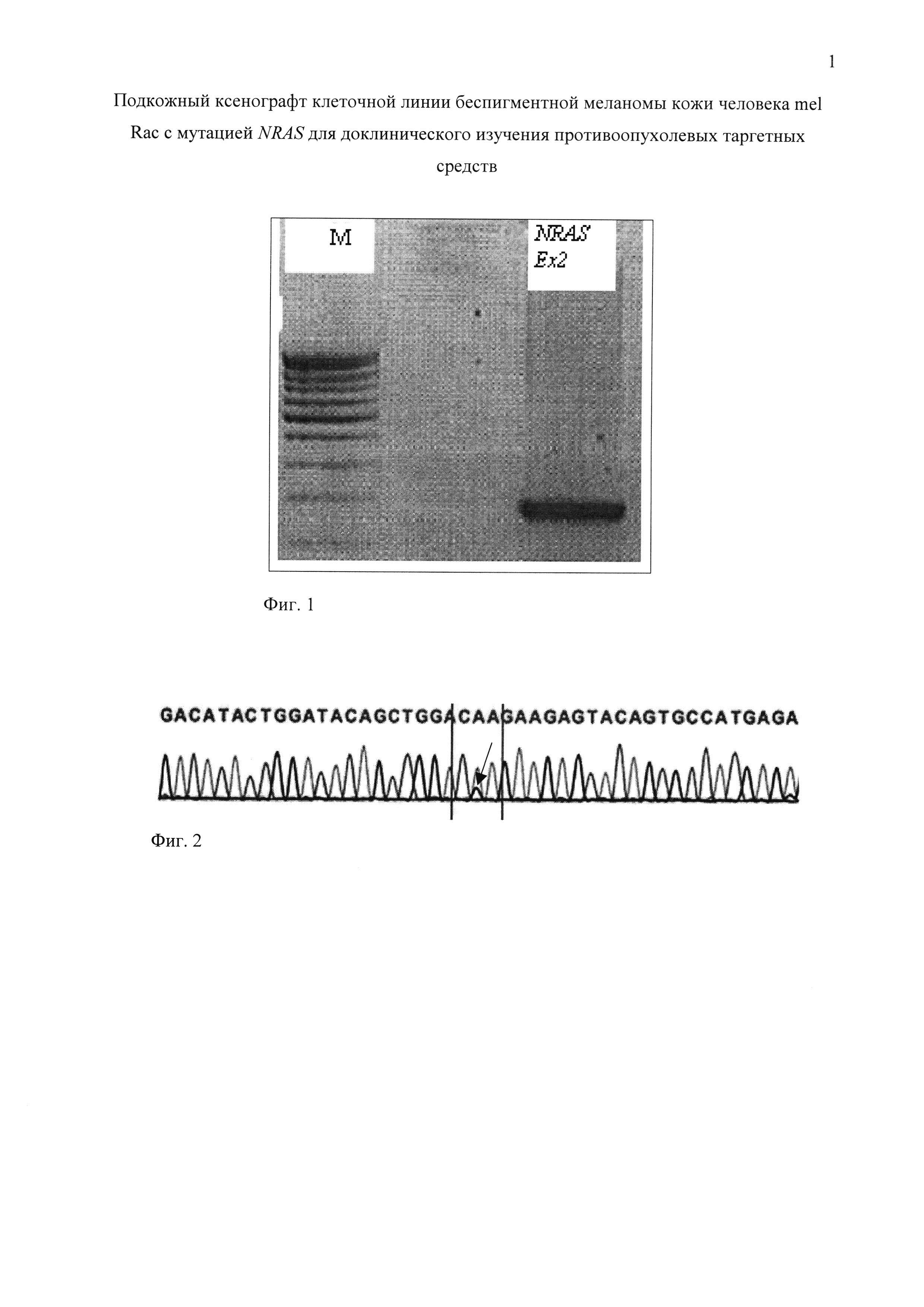
Фиг. 1. Анализ ампликона (ПЦР-продукта), длиной 143 п.н., соответствующего экзону 3 гена NRAS, в агарозном геле; М - маркер молекулярного веса.
Фиг. 2. Анализ секвенированного ампликона. Вертикальными линиями выделен кодон 61 с однонуклеотидной заменой 182A>G, что ведет к замене глутамина на аргинин в молекуле белка - p. Q61R. (пик G черного цвета в позиции 182 показан стрелкой).
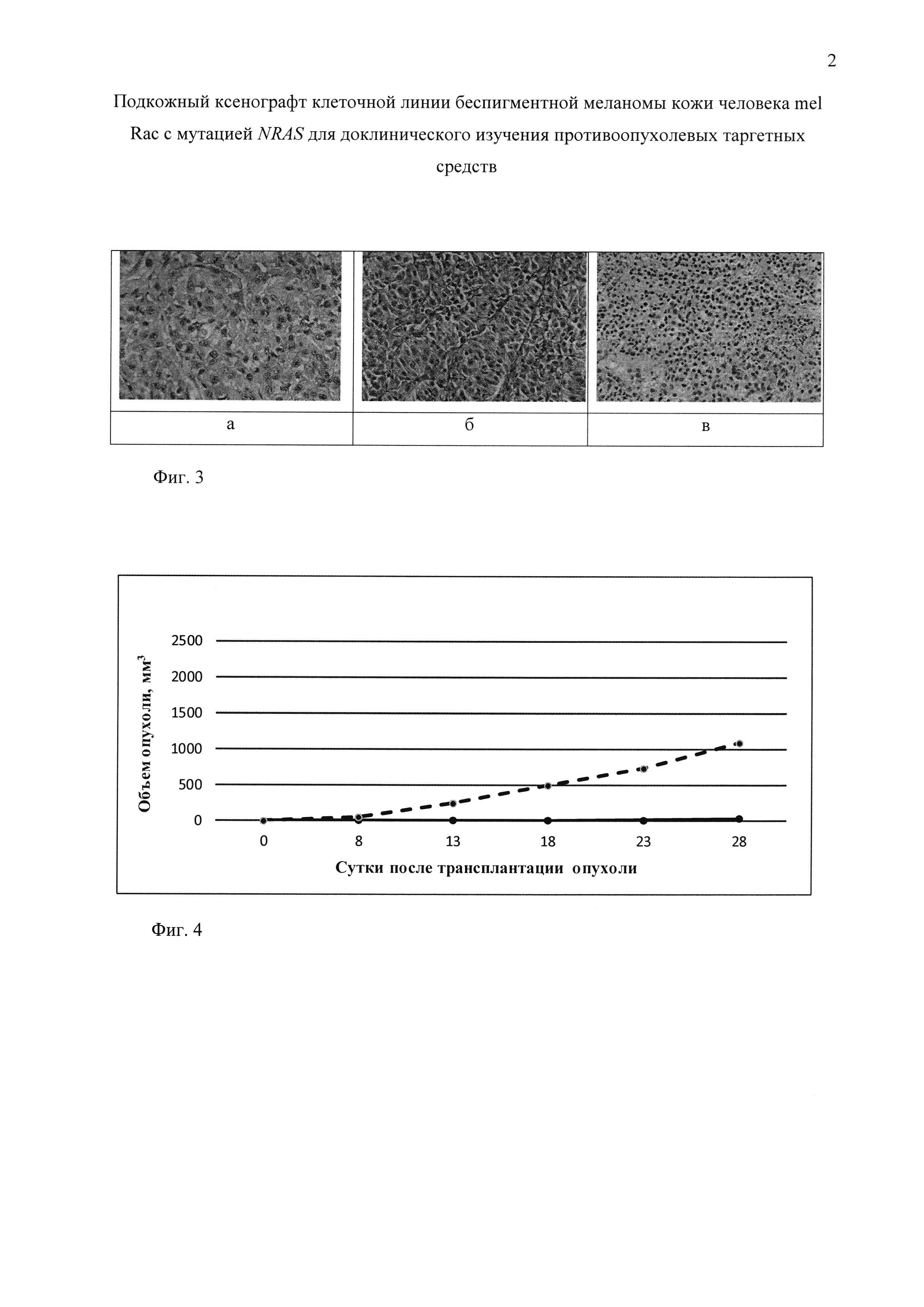
Фиг. 3. Гистологическая картина подкожного ксенографта меланомы кожи человека mel Rac на 19 сутки роста опухоли (девятый пассаж).
Фиг. 4. Противоопухолевая активность траметиниба у мышей с подкожными ксенографтами беспигментной меланомы кожи человека mel Rac с мутацией NRAS.
Подкожный ксенографт беспигментной меланомы кожи человека mel Rac с мутацией NRAS получен следующим образом.
Предварительно в клеточной линии беспигментной меланомы кожи человека mel Rac определяли мутацию NRAS p.Q61R(c.l82A>G).
Для выделения ДНК монослой клеток, растущих в стандартных культуральных флаконах, покрывали слоем Версена (ПанЭко, Москва) в концентрации 3 мл на 25 см2 поверхности клеток и инкубировали 5 мин при t 37°С. После отделения клеток от подложки их собирали в центрифужные пробирки с 1-2 мл среды DMEM, диспергировали и осаждали при 200 g 5-10 мин. Осадок клеток объемом от 100 до 200 мкл переносили в микропробирку объемом 1,5 мл, гомогенизировали в лизирующем буфере из набора «Амплипрайм ДНК-сорб-В» (ООО «НекстБио», Москва), инкубировали в термостате при t 65°С в течение 15 мин, затем в микропробирку с гомогенатом вносили 25 мкл предварительно гомогенизированного сорбента и инкубировали 10 мин при комнатной температуре, осаждали при 13000 g 15 сек и тщательно промывали осадок буфером №1 (300 мкл), затем осаждали при 13000 g 15 сек и трижды повторяли процедуру отмывки буфером №2 (по 500 мкл) с осаждением. Затем осадок высушивали при 165°С в течение 7-10 мин и диспергировали в 50 мкл буфера для разведения, инкубировали при t 65°С 10 мин, осаждали при 13000 g 1 мин. Хранили раствор ДНК в пробирках при t 20°С.
Для поиска соматических мутаций в экзонах 2 и 3 гена NRAS использовали полимеразную цепную реакцию (ПЦР) со специфичными олигонуклеотидными праймерами. Праймеры к экзону 3, в котором была обнаружена мутация NRAS p.Q61R(c.l82A>G) ,следующие:
NR3_F 5’ - AATTGAACTTCCCTCCCTCCCT-3’, отжиг при 68°С.
NR3_R 5’ - TGTCCTCATGTATTGGTCTCTC-3’, отжиг при 64°С.
shNR3_rev-5’ - GTCTCTCATGGCACTGTACTCT-3’, отжиг при 66°Сг.
ПЦР проводили в объеме 25 мкл реакционной смеси по следующей схеме: к 10 нг ДНК добавляли по 1 мМ олигонуклеотидных праймеров, по 200 мкМ каждого дезоксинуклеотидтрифосфата, 3% формамида, 2,5 мкл 10-кратного буфера для ПЦР следующего состава: 500 мМ КС1, 100 мМ трис-HCl рН 8,4; 15 мМ MgCl2, деионизованной воды до 25 мкл.
ПЦР проводили в следующем режиме: начальная денатурация - при t 94°С, 5 1 мин, затем в смесь добавляли HotStart ДНК-полимеразу (1 Ед активности) и выполняли 40 циклов ПЦР: денатурация: t 94°С - 25 сек., отжиг: 165°С - 30 сек., элонгация: t 72°С - 30 сек. и затем при t 72°С в течение 10 мин, хранение при t 4°С.
Второй раунд ПЦР проводили с использованием олигонуклеотидного праймера shNR3_rev в режиме: t 94°С - 1 мин; затем 15 циклов: t 94°С - 30 сек, t 66°С - 30 сек, t 72°С - 30 сек, затем терминация при t 72°С в течение 10 мин.
ПЦР-продукты выявляли в 2%-ном агарозном геле при U=120 B. Полосу, соответствующую последовательности экзона 3 гена NRAS длиной 143 п.н., вырезали из геля и выделяли ДНК с помощью набора Wizard®PCR Preps DNA Purification System, («Promega», США).
Амплифицированную ДНК секвенировали на автоматическом секвенаторе ABI PRISM 3100 («Applied Biosystems», США) по протоколам фирмы-производителя в режиме фрагментного анализа. Для анализа результатов ПЦР-анализа использовали программное обеспечение с помощью компьютерной программы Chromas или GeneMapper.
Мутацию NRAS определяли в клетках опухоли меланомы кожи человека mel Rac девятого пассажа на пике экспоненциальной фазы роста. В результате ПЦР геномной ДНК получен ампликон длиной 143 п.н., соответствующий экзону 3 гена NRAS (фиг. 1). В результате секвенирования этого ПЦР-продукта обнаружена мутация NRAS p.Q61R(c.l82A>G) (фиг. 2).
Адаптацию клеточной линии беспигментной меланомы кожи человека mel Rac к росту у иммунодефицитных мышей Balb/c nude осуществляли многократным пассированием мышам прививочных доз клеток.
Контролем состоявшейся адаптации клеточной линии беспигментной меланомы кожи человека mel Rac к росту in vivo служили следующие трансплантационные характеристики: прививочная доза клеток для 100% получения подкожных ксенографтов, цитологически идентичных клеточной линии беспигментной меланомы кожи человека mel Rac после имплантации у мышей (нулевой пассаж); устойчивая многократная трансплантация до девятого пассажа взвесью опухолевой ткани; устойчивая кинетика роста беспигментной меланомы кожи человека mel Rac у мышей на поздних пассажах; гистологическая верификация меланомы.
Трансплантационные характеристики клеточной линии беспигментной меланомы кожи человека mel Rac с мутацией NRAS получали следующим образом.
Инокулятом для имплантации служила культивированная в атмосфере СО2 клеточная линия беспигментной меланомы кожи человека mel Rac. Отмытые физиологическим раствором от культуральной среды клетки помещали в питательную среду 199 и имплантировали подкожно в дозах 0,1×107; 0,5×107; 1,0×107 клеток на мышь в 0,2 мл питательной среды 199. В исследовании использовали 12 иммунодефицитных мышей Balb/c nude. Контроль прививаемости клеток осуществляли по наличию пальпируемых опухолей у мышей с регистрацией длительности латентного периода до 20 дней и измерением с помощью электронного штангенциркуля. По окончании исследования определили оптимальную прививочную дозу 1,0×107 клеток на мышь, обеспечивающую 100% прививаемость и наиболее короткий латентный период, который составил 11 суток (табл.1).
Подкожные ксенографты меланомы кожи человека mel Rac с мутацией NRAS получали на 6 мышах Balb/c nude. Многократные пассажи выполняли взвесью опухолевой ткани по 50-60 мг на мышь в разведении 1:20 питательной средой 199. Наличие трансплантированных опухолей у мышей в одни и те же сроки при многократном пассировании свидетельствовали о достижении стабильных кинетических характеристик подкожных ксенографтов in vivo.
Кинетику роста подкожных ксенографтов определяли по среднему объему опухолей, начиная от появления всех пальпируемых опухолей с учетом латентной фазы роста. Период увеличения среднего объема опухоли (Vcp=a×b×c) в два и более раз определял длительность экспоненциальной фазы роста, а стабилизация роста опухоли на уровне менее двукратного увеличения - длительность стационарной фазы роста. О кратности роста опухоли судили по соотношению последующего среднего объема к предыдущему (Vt/Vt-1) при 3-кратном измерении опухоли в течение 20 дней.
В табл. 2 показано, что динамика роста опухолей первого пассажа была относительно медленной. Через 20 дней после трансплантации объем опухоли был менее 1,0 см3, а фаза экспоненциального роста практически отсутствовала. В течение этого периода опухоль увеличивалась в 6,1 раза. Средний объем опухоли составил: на 12 сутки 14,2±6,0 мм3, на 15 сутки 110,7±47,0 мм3. Далее к 20 суткам объем опухоли достиг 675,3±433,0 мм3.
В табл.3 показано, что динамика роста опухолей прогрессивно изменялась на четвертом пассаже. Латентная фаза сократилась до 7 дней, средний объем опухоли составил 40,0±19,0 мм3, почти в 3 раза превышающий объем опухоли первого пассажа. На 14 сутки средний объем опухоли составил 293,0±202,0 мм3 при кратности прироста опухоли 7,3. На 14 и 19 сутки стационарного периода кратность прироста опухоли варьировала между 7,3 и 3,6. Средний объем опухоли на 19 сутки достиг 1048,0±444,0 мм3, в 1,6 раза превышая средний объем опухоли первого пассажа.
Устойчивая динамика роста опухоли, достигнутая к 4 пассажу, сохранялась до 9 пассажа с близкими временными характеристиками: латентной фазой до 8 дней (средний объем опухоли на 8 сутки измерения составил 135,5±65,0 мм3), экспоненциальной фазой до 14 дней (средний объем опухоли составил 527,6±174,0 мм3) и стационарной фазой до 19 дня после трансплантации (средний объем опухоли составил 1353,7±543,0 мм3) (табл. 4).
Статистический анализ параметров роста пассажа выполняли с помощью стандартного метода Фишера. Отсутствие значимых различий кривых роста опухоли двух пассажей в полулогарифмической системе координат подтверждало устойчивость кинетических характеристик роста подкожных ксенографтов беспигментной меланомы кожи человека mel Rac у мышей Balb/c nude.
Гистологическую верификацию подкожных ксенографтов меланомы кожи для сравнения клеточного состава с исходной клеточной линией беспигментной меланомы кожи человека mel Rac выполняли в девятом пассаже с устойчивой кинетикой роста с помощью световой микроскопии срезов опухоли, окрашенных гематоксилином и эозином. На фиг. 3. представлена гистологическая картина подкожных ксенографтов меланомы кожи человека mel Rac на 19 сутки роста опухоли (9 пассаж). Опухоль состоит из полиморфных клеток различного размера и формы (округлых, овальных, веретенообразных). Ядра крупные, содержат ядрышки. Цитоплазма опухолевых клеток в большинстве участков темные, в отдельных местах светлые. Пигмент в опухолевых клетках не обнаружен. Опухолевые клетки образуют солидные поля, местами формируют тяжи различного размера, ячейки, альвеолярно-подобные структуры, разделенные тонкими соединительнотканными прослойками на отдельные дольки. В опухоли встречается много митозов, от 5 до 7 митозов в так называемых «горячих точках». Участки некрозов в опухоли единичные, мелкие. В отдельных местах по периферии опухоли располагаются жировая и мышечная ткани, в которые он и прорастает. Опухоль крупная, диаметром 0,8-1,0 см.
Гистологическое исследование позволило установить, что штамм mel Rac является беспигментной меланомой, преимущественно альвеолярно-дольчатого строения с участками солидного типа.
Критерием к применению подкожных ксенографтов беспигментной меланомы кожи человека mel Rac с мутацией NRAS для доклинического изучения противоопухолевых средств считали наличие мутации гена NRAS и высокую чувствительность к траметинибу.
Для оценки чувствительности к ингибитору NRAS траметиниб вводили в желудок 10 мышам в разовой дозе 0,3 мг/кг ежедневно с 4 по 17 сутки после трансплантации опухоли. Контрольная группа (10 мышей) траметиниб не получала. Динамику роста опухоли в обеих группах оценивали на 8, 13, 18, 23 и 28 сутки после введения траметиниба.
На фиг. 4 показано непрерывное прогрессивное увеличение объема опухоли у мышей контрольной группы, в то время как траметиниб практически полностью ингибировал рост опухоли у мышей опытной группы в течение 28 дней (сплошная линия - опытная группа, пунктирная линия - контрольная группа).