Результат интеллектуальной деятельности: ТЕСТ-СИСТЕМА ДЛЯ СКРИНИНГА ХИМИЧЕСКИХ СОЕДИНЕНИЙ НА НАЛИЧИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТИ В ОТНОШЕНИИ PARP-1
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Группа изобретений относится к области медицинской и молекулярной биологии, может быть использована для поиска противоопухолевых препаратов, направленных на PARP-1 с использованием способа, основанного на применении тест-системы из специальных флуоресценто-меченных мононуклеосомных матриц и молекулярной мишени - белка PARP-1 в комплексе с НАД+. При внесении тестируемых соединений и взаимодействии с активированным PARP-1 происходит изменение частотного распределения нуклеосом по величине FRET, что позволяет обнаружить соединения, направленные на PARP-1 и способные ингибировать его активность.
Уровень техники
Одной из перспективных молекулярных мишеней для поиска противоопухолевых средств является поли(ADP-рибозо)полимераза 1 (PARP-1) - второй по распространенности после гистонов ядерный белок (в среднем насчитывается 1-2 млн молекул PARP-1 на клетку). PARP-1 - регуляторный белок и вовлечен во множество клеточных процессов, начиная с репарации ДНК, при ее повреждениях, репликации, рекомбинации, транскрипции, вплоть до регуляции преждевременного старения и гибели клетки. PARP-1 - ключевой белок, выполняющий функцию «сенсора» разрывов ДНК. Получено множество данных об участии PARP-1 в развитии опухолевого процесса: было показано, что экспрессия PARP-1 повышена при меланомах, раке легкого, молочной железы и других опухолевых заболеваниях [М. Peralta-Leal A, O'Valle F, Rodriguez-Vargas JM, Gonzalez-Flores A, Majuelos-Melguizo J,
Peralta-Leal A, O'Valle F, Rodriguez-Vargas JM, Gonzalez-Flores A, Majuelos-Melguizo J,  L, Serrano S, de Herreros AG,
L, Serrano S, de Herreros AG,  JC,
JC,  R, Del Moral RG, de
R, Del Moral RG, de  JM, Oliver FJ. PARP-1 regulates metastatic melanoma through modulation of vimentin-induced malignant transformation. // PLoS Genet. 2013. Vol.9. P. el003531; S. Nowsheen, Cooper T, Stanley JA, Yang ES.. Synthetic lethal interactions between EGFR and PARP inhibition in human triple negative breast cancer cells. // PLoS One. 2012. Vol. 7. P. e46614; A. Galia, Calogero AE, Condorelli R, Fraggetta F, La Corte A, Ridolfo F, Bosco P, Castiglione R, Salemi M. PARP-1 protein expression in glioblastoma multiforme. // Eur J Histochem. 2012. Vol. 56. P. е9; В. Csete, Lengyel Z,
JM, Oliver FJ. PARP-1 regulates metastatic melanoma through modulation of vimentin-induced malignant transformation. // PLoS Genet. 2013. Vol.9. P. el003531; S. Nowsheen, Cooper T, Stanley JA, Yang ES.. Synthetic lethal interactions between EGFR and PARP inhibition in human triple negative breast cancer cells. // PLoS One. 2012. Vol. 7. P. e46614; A. Galia, Calogero AE, Condorelli R, Fraggetta F, La Corte A, Ridolfo F, Bosco P, Castiglione R, Salemi M. PARP-1 protein expression in glioblastoma multiforme. // Eur J Histochem. 2012. Vol. 56. P. е9; В. Csete, Lengyel Z,  Z,
Z,  Z. Mar. Poly(adenosine diphosphate-ribose)polymerase-l expression in cutaneous malignant melanomas as a new molecular marker of aggressive tumor. // Pathol Oncol Res. 2009. Vol. 15. P. 47-53; M. Telli, Ford JM. Novel treatment approaches for triple-negative breast cancer. // Clin Breast Cancer. 2010. Vol.10 Suppl 1. P. E16-22; S.N. Shimizu F.; Tomonaga Т.; Sunaga M.; Noda M.; Ebara M.; Saisho H. Expression of poly(ADP-ribose) polymerase in human hepatocellular carcinoma and analysis of biopsy specimens obtained under sonographic guidance. // Oncol. Rep. 2004. Vol. 12. P. 821-825]. При этом повышенный уровень экспрессии ассоциирован с худшим прогнозом выживаемости, поскольку высокий уровень экспрессии PARP-1 коррелирует с более агрессивным фенотипом злокачественных опухолей [P.Н. Domagala Т.; Lubinski J.; Gugala К.; Domagala W. PARP-1 expression in breast cancer including BRCA1-associated, triple negative and basal-like tumors: Possible implications for PARP-1 inhibitor therapy. // Breast Cancer Res. Treat. 2011. Vol. 127. P. 861-869], кроме того, может коррелировать с устойчивостью опухолей к терапии [Michels J.; Vitale I.; Galluzzi L.; Adam J.; Olaussen K.A.; Kepp O.; Senovilla L.; Talhaoui I.; Guegan J.; Enot D.P. Cisplatin Resistance Associated with PARP Hyperactivation. // Cancer Res. 2013. Vol. 73. P. 2271-2280]. Онкогенез может быть вызван PARP-1-зависимой дисрегуляцией факторов, вовлеченных в клеточный цикл, митоз, а также факторов, регулирующих экспрессию генов, связанных с инициацией и развитием опухолей [С.М. Simbulan-Rosenthal, Ly D.H., Rosenthal D.S., Konopka G., Luo R., Wang Z.Q., Schultz P.G., Smulson M.E. Misregulation of gene expression in primary fibroblasts lacking poly(ADP-ribose) polymerase. // Proc. Natl. Acad. Sci. USA. 2000. Vol. 97. P. 11274-11279].
Z. Mar. Poly(adenosine diphosphate-ribose)polymerase-l expression in cutaneous malignant melanomas as a new molecular marker of aggressive tumor. // Pathol Oncol Res. 2009. Vol. 15. P. 47-53; M. Telli, Ford JM. Novel treatment approaches for triple-negative breast cancer. // Clin Breast Cancer. 2010. Vol.10 Suppl 1. P. E16-22; S.N. Shimizu F.; Tomonaga Т.; Sunaga M.; Noda M.; Ebara M.; Saisho H. Expression of poly(ADP-ribose) polymerase in human hepatocellular carcinoma and analysis of biopsy specimens obtained under sonographic guidance. // Oncol. Rep. 2004. Vol. 12. P. 821-825]. При этом повышенный уровень экспрессии ассоциирован с худшим прогнозом выживаемости, поскольку высокий уровень экспрессии PARP-1 коррелирует с более агрессивным фенотипом злокачественных опухолей [P.Н. Domagala Т.; Lubinski J.; Gugala К.; Domagala W. PARP-1 expression in breast cancer including BRCA1-associated, triple negative and basal-like tumors: Possible implications for PARP-1 inhibitor therapy. // Breast Cancer Res. Treat. 2011. Vol. 127. P. 861-869], кроме того, может коррелировать с устойчивостью опухолей к терапии [Michels J.; Vitale I.; Galluzzi L.; Adam J.; Olaussen K.A.; Kepp O.; Senovilla L.; Talhaoui I.; Guegan J.; Enot D.P. Cisplatin Resistance Associated with PARP Hyperactivation. // Cancer Res. 2013. Vol. 73. P. 2271-2280]. Онкогенез может быть вызван PARP-1-зависимой дисрегуляцией факторов, вовлеченных в клеточный цикл, митоз, а также факторов, регулирующих экспрессию генов, связанных с инициацией и развитием опухолей [С.М. Simbulan-Rosenthal, Ly D.H., Rosenthal D.S., Konopka G., Luo R., Wang Z.Q., Schultz P.G., Smulson M.E. Misregulation of gene expression in primary fibroblasts lacking poly(ADP-ribose) polymerase. // Proc. Natl. Acad. Sci. USA. 2000. Vol. 97. P. 11274-11279].
Ингибиторы PARP-1 рассматриваются в качестве перспективных противоопухолевых агентов, действующих как химио- и радиосенсибилизаторы при традиционной терапии злокачественных образований. В отдельных случаях при опухолях, в которых нарушены определенные пути репарации ДНК, ингибиторы PARP-1 могут использоваться как самостоятельные лекарственные средства. Практически все существующие ингибиторы PARP-1 являются миметиками никотинамида, т.е. ориентированы на связывание с каталитическим доменом PARP-1 НАД+-связывающей области и конкуренцию с НАД+. При проведении расширенных клинических испытаний ингибиторов PARP-1 обнаружена достаточно высокая токсичность таких соединении, поскольку они блокируют множественные ферментативные пути с участием НАД+, происходящие в клетке (известно, НАД+ это кофактор, который взаимодействует со многими ферментами, вовлеченными в ряд клеточных процессов, поэтому конкуренция с НАД+ приводит к высокой токсичности). Кроме того, не решен вопрос о безопасности длительного применения ингибиторов PARP-1 из-за возникающей устойчивости опухолей к монотерапии [Mandery К., Fromm M.F. // Br. J. Pharmacol. 2012. V. 165. Р. 345-362]. Обнаруженный в клинических исследованиях ингибиторов PARP-1 ряд побочных эффектов заставляют менять стратегию разработки новых препаратов. Во-первых, каталитический центр молекулы PARP-1 устроен сложным образом: в нем есть несколько карманов: 1) карман, непосредственно связывающий никотинамидную часть НАД+; 2) карман для связывания аденозиновой части НАД+; 3) карман, связывающий пирофосфатную часть НАД+. Поэтому есть возможность разработки соединений, проникающих не только в никотимамид-связывающий карман, но и другие примыкающие области, что будет создавать основу для разработки селективных к PARP-1 соединений и уменьшать риск интерференции с другими НАД+ зависимыми ферментами. Кроме того, есть возможность искать мишени действия в других доменах PARP-1, поскольку данный белок мультидоменный и, соответственно, активность PARP-1 можно регулировать ингибированием других функциональных доменов, помимо каталитического домена. Например, получать препараты, направленные на ингибирование связывания PARP-1 с ДНК. Такие работы ведутся: [Kirsanov KI, Kotova Е, Makhov Р, Golovine К, Lesovaya ЕА, Kolenko VM, Yakubovskaya MG, Tulin AV.// Oncotarget. 2014 V. 5. P. 428-437]. Или пытаться «выключить PARP-1», воздействуя на его функцию в регуляции транскрипции [Maluchenko N.V., Kotova Е., Chupyrkina А.А., Nikitin D.V., Kirpichnikov M.P., Studitsky V.M. // Mol. biol. Mosc. 2015. V. 49. №1. P. 1-15; Kotova E., Tulin A.V. // Proc. Natl. Acad. Sci. USA. 2010. V. 107. №14. P. 6406-6411].
В качестве основы для поиска новых ингибиторов PARP-1 можно использовать тест-системы на основе мононуклеосом. Известно, что нуклеосомы являются структурообразующими единицами хроматина, которые позволяют компактизовать ДНК путем наматывания на нуклеосомный кор. Структура нуклеосом известна - они состоят из октамера гистонов, который опоясан 147 п. н. ДНК. С использованием мононуклеосом проводят многочисленные исследования особенностей процессов транскрипции, репарации, репликации, поскольку нуклеосомы позволяют воссоздать упаковку ДНК, приближенную к естественной. Применение нуклеосомной системы анализа имеет ряд преимуществ, поскольку: 1) в ней воспроизводятся многие эффекты процесса ДНК-зависимых процессов, наблюдаемые в клетке; 2) система собирается из высокоочищенных компонентов: белков и нуклеиновых кислот, что в значительной степени облегчает интерпретацию данных, 3) возможно проведение модификаций данной системы для проведения биохимического, молекулярно-генетического и флуоресцентного анализа; 4) также система может быть модифицирована (функционализирована) введением различных молекулярных мишеней действия лекарств, например, введением молекул, взаимодействующих в нуклеосомой ДНК или гистонами, в частности - PARP-1. Перспективными технологиями для подобных исследований являются флуоресцентные методы анализа взаимодействий белков с нуклеосомами.
Известен способ обнаружения и измерения присутствия моно-нуклеосом и олиго-нуклеосом и использование таких измерений для обнаружения и диагностики заболеваний [United States Patent Application 20140206015 Method for detecting nucleosomes // Application Number 14/239,782]. Данный способ обнаружения нуклеосом в образце включает взаимодействие тестируемого образца с двумя или более связывающих агентами, которые связываются с различными эпитопами нуклеосом (в качестве агентов используются меченные антитела). При использовании антител, маркированных флурофорами могут быть использованы флюоресцентые методы детекции. Недостаток данного способа заключается в том, что в системе отсутствует молекулярная мишень-PARP-1, а, кроме того, флуоресцентная детекция основана не на SP-FRET взаимодействии (как в предлагаемом способе), а на иммунофлуоресцентном методе анализа, что уменьшает чувствительность метода и не позволяет детектировать взаимодействия единичных молекул.
Известен способ использования нуклеосом в качестве флоуресцентых биосенсоров [United States Patent Application 20090062130 Nucleosome-based biosensors//Application Number 11/687859]. Подобный биосенсор состоит по крайней мере из одной нуклеосомы, состоящей из ДНК-регулирующего транскрипционного элемента, в котором ДНК помечена двумя метками (а гистоновый октамер остается немеченым). В ДНК введена последовательность, взаимодействующая с лигандом ядерных рецепторов. Система предложена для высокопроизводительного скрининга определенных веществ агонистов и антагонистов ядерных рецепторов, что ограничивает использование данного способа в отношении ингибиторов PARP-1.
Известен способ идентификации агентов, которые модулируют активность гистона модифицирующих ферментов, такие как ацетилазы, деацетилаз, метилтрансферазы, деметилазы, киназы и т.д. [United States Patent Application 20080070257 A1 High throughput screening assay for histone modifying enzyme modulators //Application Number 11/854611]. В данном способе используют собранные и иммобилизованные нуклеосомы, тестируют способность агентов модулировать активность гистон-модифицирующих ферментов. Способ идентификации агента, который модулирует пост-трансляционную модификацию гистонов заключается в следующем - осуществляют взаимодействие иммобилизованных собранных нуклеосом и гистон-модифицирующего фермента с тестируемым агентом, и на основе флуоресцентного анализа определяют модулирует ли тестируемое средство активность гистон-модифицирующего фермента. Недостаток данного способа заключается в том, что с помощью такого подхода невозможно обнаружить ингибиторы PARP-1, поскольку они не модифицируют гистоны.
Известен также способ определения связывания и/или функционального взаимодействия, представляющего интерес белка с нуклеосомой [WO 2015104431 А1, Nucleosome substrate assays// Application Number PCT/EP2015/050515]. В одном из вариантов осуществления предложенного способа, представляющий интерес, белок метят FRET акцептором, а нуклеосомный субстрат метят соответствующим FRET донором. В еще одном варианте осуществления композиция веществ дополнительно содержит репортерный белок (это антитело или гистон-связывающий домен), способный распознавать гистон, имеющего посттрансляционную модификацию. Недостаток данного способа, как и в предыдущем случае, заключается в том, что не применим для поиска ингибиторов PARP-1, поскольку PARP-1 не модифицирует гистоны.
Наиболее близким техническим решением (прототипом) является метод, описанный в статье [К.С. Кудряшова, Д.В. Никитин, О.В. Чертков, Н.С. Герасимова, М.Е. Валиева, В.М. Студитский, А.В. Феофанов Разработка флуоресценто-меченых мононуклеосом для изучения механизмов транскрипции методом микросокпии одиночных комплексов //Вестник. Московского Университета. СЕР. 16. Биология. 2015. №4, с. 41-45], в котором мононуклеосомы собирали на (Су3, Су5)-меченой ДНК-матрице с позиционирующей последовательностью с линкерной ДНК, 20 п. о, в ходе диализа против уменьшающейся концентрации NaCl по протоколу, опубликованному ранее [D.A. Gaykalova, Kulaeva OI, Pestov NA, Hsieh FK, Studitsky VM. Experimental analysis of the mechanism of chromatin remodeling by RNA polymerase II. // Methods Enzymol. 2012. Vol.512. P. 293-314; D.A. Gaykalova, Kulaeva O.I., Bondarenko V.A., Studitsky V.M. Preparation and analysis of uniquely positioned mononucleosomes. // Methods Mol. Biol. 2009. Vol.523. P. 109-23]. Нуклеосомную ДНК получали при помощи полимеразной цепной реакции (ПНР) с использованием опубликованных флуоресцентно-меченых ДНК-праймеров. Данные праймеры обеспечивали введение пары FRET меток Су3/Су5 в срединное по отношению к точке входа ДНК в нуклеосому. Недостаток этого способа заключается в том, что флуоресцентные сенсорные метки располагаются в срединном положении, что позволяет детектировать события, касающиеся обширного отворачивания ДНК, доходящего с точки входа до середины нуклеосомы. В таком расположении метки не чувствительны к детекции событий, происходящих на входе/выходе из нуклеосомы и в линкерных участках. Учитывая, что в линкерных областях и на входе/выходе нуклеосомы происходят важные структурные перестройки во время регуляции транскрипции, то размещение флуоресцентных сенсоров в область входа в нуклеосому (проксимальное) позволит детектировать взаимодействие целого ряда белковых регуляторов с нуклеосомой. Кроме того, в описанном в статье способе не предложено введение в нуклеосомную систему таргетных белков, поэтому он не применим для поиска ингибиторов PARP-1.
Раскрытие изобретения
Задачей заявляемой группы изобретений является разработка тест-системы для скрининга химических соединений на наличие ингибирующей активности в отношении PARP-1 на основе SP-FRET-микроскопии (single-particle FRET микроскопии, FRET микроскопии единичных частиц, sp-FRET) на основе использования мононуклеосомной системы и способа ее применения.
Поставленная задача решается тест-системой для скрининга химических соединений на наличие ингибирующей активности в отношении PARP-1 на основе FRET-микроскопии единичных частиц (spFRET), представляющей собой смесь, включающую комплекс мононуклеосомы на нуклеосом-позиционирующей ДНК-матрице, меченной парой флуорофоров, формирующих донор-акцепторные пары для реализации эффекта FRET; белок PARP-1, взятый по меньшей мере в 20-кратном молярном избытке по отношении к мононуклеосоме, и его субстрат - НАД+, взятый по меньшей мере в 2000-кратном молярном избытке по отношению к PARP-1.
Предпочтительно использовать ДНК-матрицу, модифицированную линкером, позволяющим иммобилизовать комплекс на твердой поверхности.
Предпочтительно, когда смесь иммобилизована на твердой поверхности.
Предпочтительно, когда твердая поверхность представляет собой поверхности лунок планшета или зерен сорбента, в виде пробирок, планшетов для микротитрования, шариков, пленок. Наиболее предпочтительно, когда твердые поверхности изготовлены из природных или искусственных полимерных материалов, включая полистирол, поливинилхлорид, полипропилен, целлюлоза, нитроцеллюлоза, нейлон, гели декстрана, полиакриламида, агарозы, стекло, кварц и др. Твердая фаза может быть в виде пробирок, планшетов для микротитрования с пластиковым или стеклянным дном, стеклянных пластинок, шариков, пленок и др.
Предпочтительно, когда пара флуорофоров, формирующих донор-акцепторные пары для реализации эффекта FRET, расположена в проксимальном или дистальном или серединном положении относительно входа ДНК в нуклеосому.
Предпочтительно в качестве пара флуорофоров, формирующих донор-акцепторные пары для реализации эффекта FRET использовать флуорофоры  радиус которых составляет до 10 нм.
радиус которых составляет до 10 нм.
Предпочтительно пары флуорофоров, выбирать из группы Су3/Су5, BFP-YFP, CFP-YFP, GFP-DsRed, GFP-Су3, GFP-mOrange, YFP-RFP, TagBFP-TagGFP2, TagGFP2-TagRFP.
Предпочтительно использовать нуклеосом-позиционирующую ДНК-матрицу дополнительно содержащую гистон H1 натурального или рекомбинантного происхождения, взятый в избытке по отношению к нуклеосомам. Существует также вариант, в котором для сборки нуклеосомных матриц дополнительно используют гистон HI как натурального, так и рекомбинантного происхождения.
Предпочтительно комплекс нуклеосомы на нуклеосом-позиционирующей ДНК-матрице получать с использованием нативных или мутантных коровых гистоновых белков. Можно использовать также вариант, в котором для сборки нуклеосомных матриц используют препараты гистонов различного происхождения или мутантные гистоновые белки (Sin-мутанты и др.).
Существует способ, характеризующийся тем, что перед внесением агентов в систему проводят предварительное математическое моделирование.
Также поставленная задача решается способом скрининга химических соединений на наличие ингибирующей активности в отношении PARP-1 на основе FRET-микроскопии единичных частиц (spFRET), включающим разделение смеси, содержащей комплекс мононуклеосомы на нуклеосом-позиционирующей ДНК-матрице, меченной парой флуорофоров, формирующих донор-акцепторные пары для реализации эффекта FRET; белок PARP-1 и его субстрат -НАД+, на аликвоты, при этом одну из аликвот - без внесения химических соединений, используют в качестве контрольного образца, в другую аликвоту вносят исследуемое химическое соединение, после чего проводят измерение spFRET с получением кривой частотного распределения нуклеосом по величине FRET исследуемого и контрольного образцов, где профиль кривой, характеризующей контрольный образец, имеет два максимума, при этом вывод о наличии у исследуемого соединения ингибирующей активности в отношении PARP-1 делают при выявлении у кривой, характеризующей исследуемое соединение, одного максимума, лежащего в интервале значений между двумя максимумами кривой, характеризующей контрольный образец.
Предпочтительно в третью аликвоту вносят референсное химическое соединение, с последующим измерением частотного распределения нуклеосом по величине FRET и при выявлении у кривой одного максимума, лежащего в интервале значений между двумя максимумами кривой, характеризующей контрольный образец делают вывод о работоспособности полученной тест-системы.
Технический результат предлагаемого изобретения заключается в расширении функциональных возможностей используемой системы путем внесения белка PARP-1 - молекулярной мишени действия лекарственных препаратов (химических соединений) и субстрата, активирующего белок PARP-1 - НАД+. В модифицированную по сравнению с прототипом систему затем будут вноситься различные тестируемые соединения - потенциальные ингибиторы действия PARP-1 и проводиться оценка изменения частотного распределения нуклеосом по величине FRET до и после внесения тестируемого соединения. Для сравнения используется положительный контроль в виде референс образца - олапариба. Изменения в профиле FRET определяют селективность системы по отношению к действию ингибиторов PARP-1. Несомненным преимуществом используемой системы является минимализация компонентов - для детекции используется только флуоресцентно меченная нуклеосома в нековалетном комплексе с активированным PARP-1 и тестируемое соединение. Такая минимальная флуоресцентно меченная система может стать основой для разработки современного метода высокопроизводительного скрининга (high throughput screening, HTS), когда в планшеты (от 96 до 1536 луночного формата) раскапывается система детекции, а роботизированная станция вносит в отдельные лунки соединение из большой серии однотипных молекул и затем проводится реакция и анализ изменений. На основании полученных результатов делается вывод о биологической активности множества разнообразных соединений и выявление среди них соединений-лидеров с наилучшими характеристиками. Высокочувствительные флуоресцирующие метки идеально подходят для подобных широкомасштабных биоаналитических исследований. В последние годы ведущие научные центры и фармацевтические компании всего мира прикладывают значительные усилия к внедрению технологий высокопроизводительного скрининга. Использование высокопроизводительного скрининга позволяет оценивать до 300000 соединений в день, таким образом, для проведения скрининга миллионов веществ потребуется несколько недель.
Краткое описание чертежей
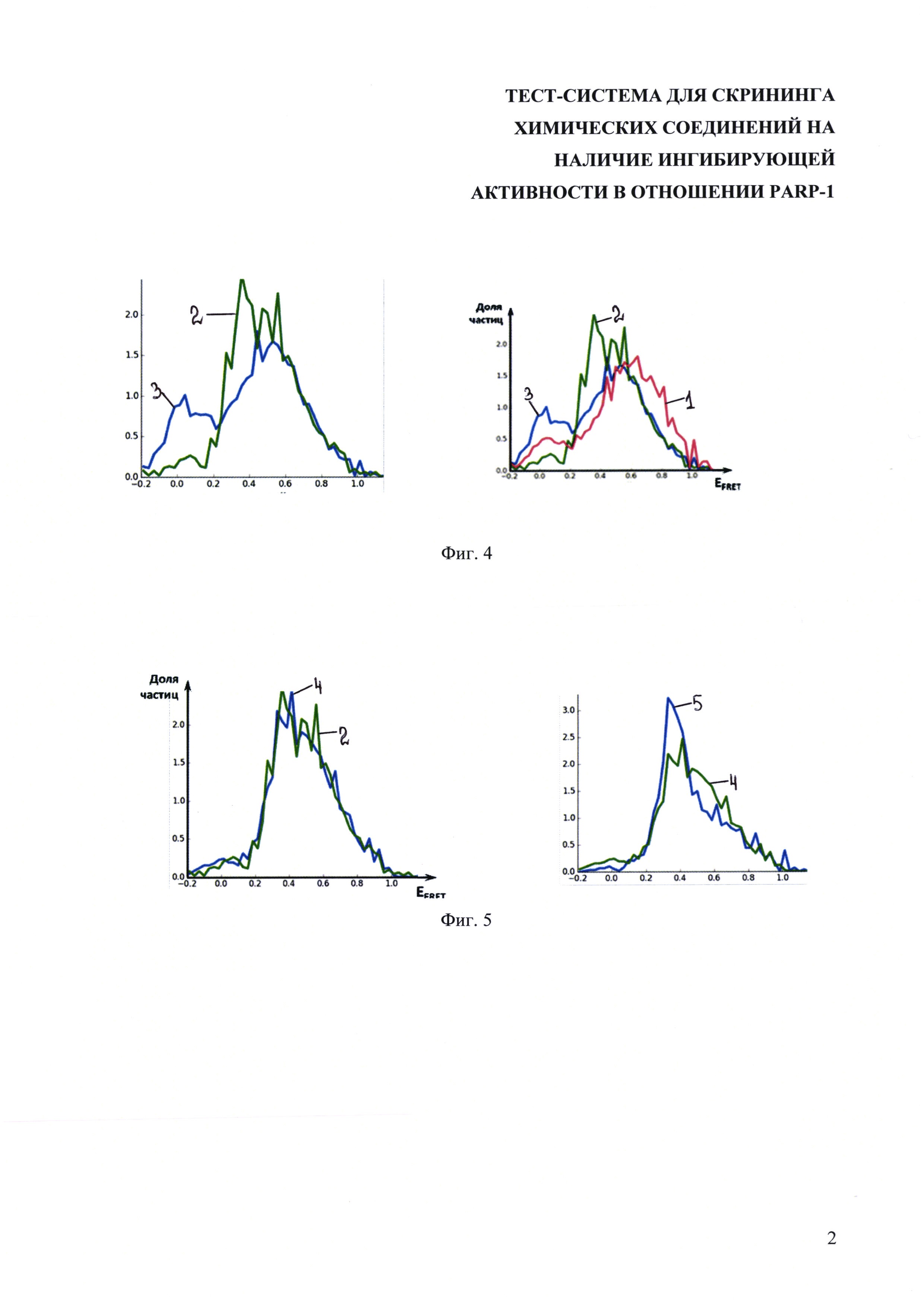
На фиг. 1 показано схематичное изображение модельной нуклеосомы с небольшим 20 п.н. линкерным участком, в цепи нуклеосомной ДНК, в проксимальном положении введены два флуорофора (звездочка А - донор возбуждения Су3, звездочка Б - акцептор возбуждения Су5).
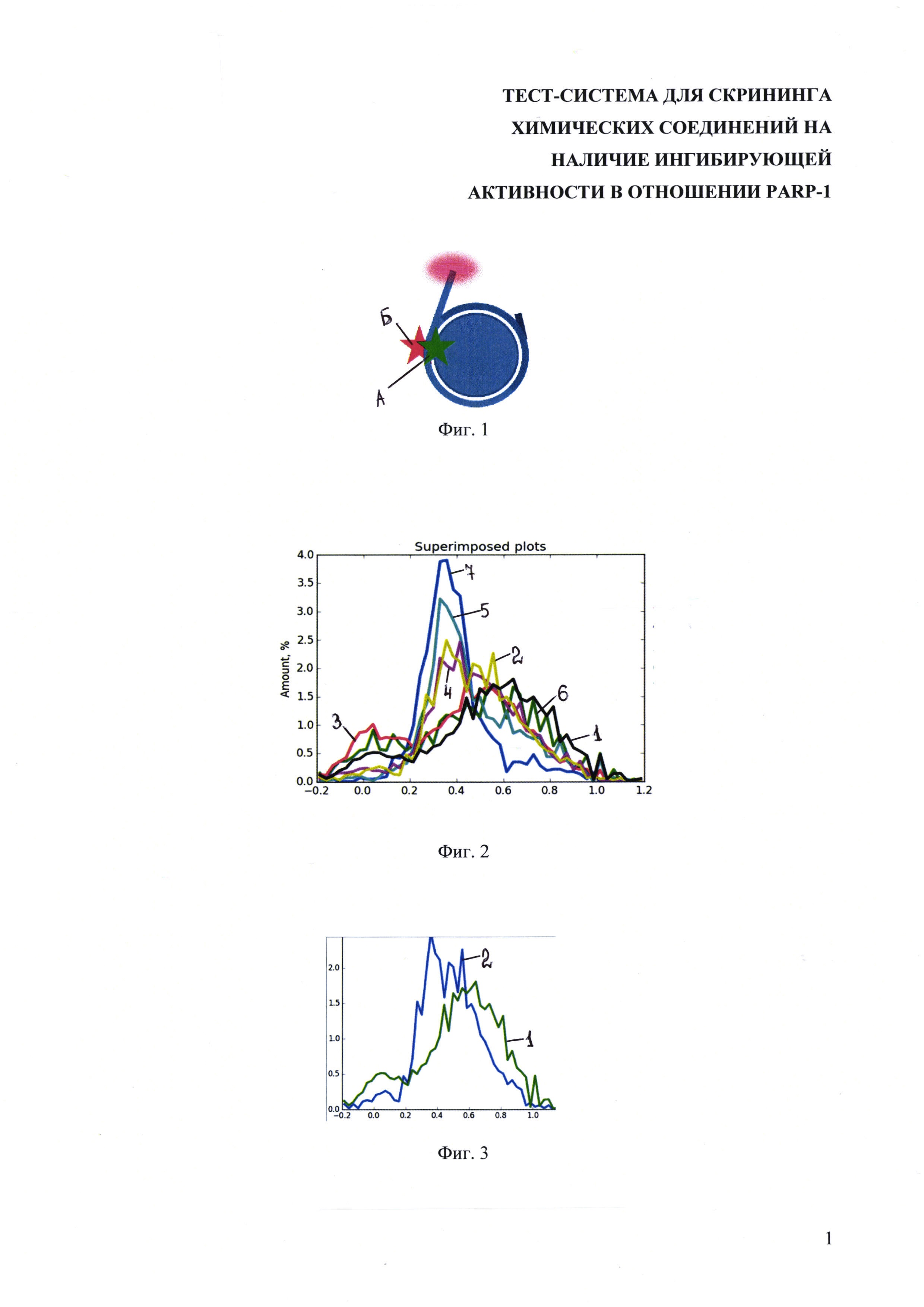
На фиг. 2 показаны результаты измерений 7 образцов методом spFRET, где под цифрой 1 - частотное распределение нуклеосомы (N=8222), 2 - нуклеосома в комплексе с PARP-1 (N=1862), 3 - нуклеосома в комплексе с PARP-1 в присутствии НАД+ (N=11345), 4 - нуклеосома в комплексе с PARP-1 в присутствии олапариба (N=2923), 5 - нуклеосома в комплексе с PARP-1 в присутствии олапариба и НАД+ (N=2088), 6 - нуклеосома в комплексе с PARP-1 в присутствии НАД+ (N=1849), 7 - нуклеосома в комплексе с PARP-1 в присутствии олапариба и НАД+ (N=1615).
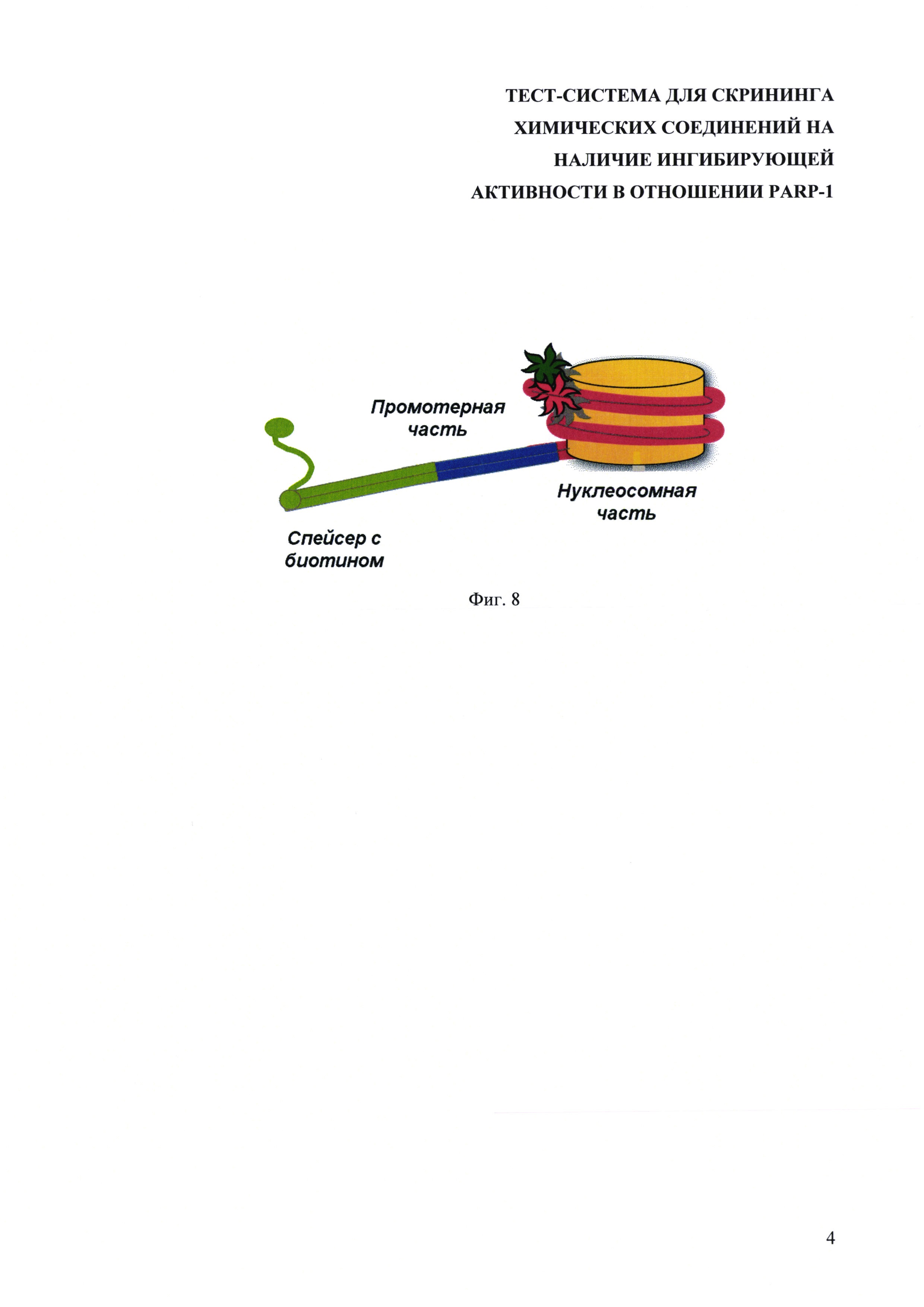
На фиг. 3 показаны частотные распределения по величине FRET нуклеосом (1) и нуклеосом в комплексе с PARP-1 (2), измеренные методом spFRET.
На фиг. 4 представлены частотные распределения по величине FRET нуклеосом в комплексе с PARP-1 в присутствии НАД+, измеренные методом spFRET.
На фиг. 5 представлены частотные распределения по величине FRET нуклеосом в комплексе с PARP-1 в присутствии олапариба (слева), а также олапариба и НАД+ (справа). Измерения выполнены методом spFRET.
На фиг. 6 показано действие тестируемого химического соединения (ингибитора) можно наблюдать в реакции активации PARP-1 при взаимодействии с нуклеосомами, сравнивая пики в частотных распределениях нуклеосом по величине FRET до внесения тестируемого соединения (ингибитора) и после.
На фиг. 7 показана тест-система детекции связывания с ингибитором в модифицированном виде: сначала прединкубация PARP-1 с НАД+, затем внесение тестируемого химического соединения.
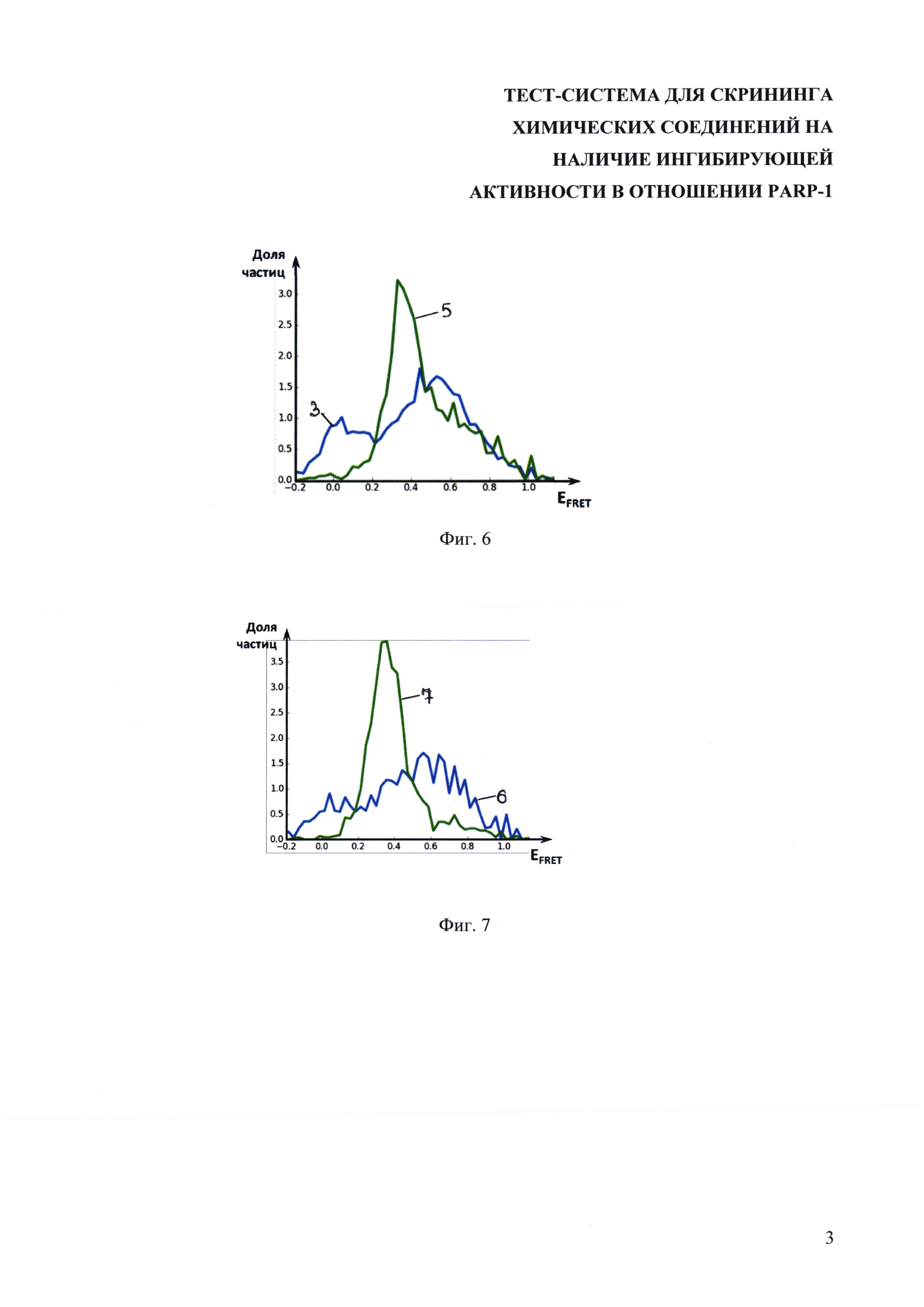
На фиг. 8 представлена схема сборки нуклеосом для иммобилизации на подложке.
Осуществление изобретения
Реализация данного способа может служить основой для получения высокопроизводительной коммерческой системы поиска новых противоопухолевых лекарственных препаратов, направленных на PARP-1. Для оценки конкурентоспособности и патентоспособности результатов авторами заявки был проведен информационный поиск по патентным базам данных и по работам, опубликованным в открытой печати. Анализ результатов поиска показал, что предлагаемый подход не используется в исследовательской и медицинской практике, не описан в открытых источниках и не защищен патентами.
Для реализации способа используют препараты гистонов различного происхождения или мутантные гистоновые белки, например [Hsieh FK, Fisher М,  A, Studitsky VM, Luse DS.//Histone Sin mutations promote nucleosome traversal and histone displacement by RNA polymerase II.//EMBO Rep. 2010 Sep; 11(9):705-10. doi: 10.1038/embor.2010.113].
A, Studitsky VM, Luse DS.//Histone Sin mutations promote nucleosome traversal and histone displacement by RNA polymerase II.//EMBO Rep. 2010 Sep; 11(9):705-10. doi: 10.1038/embor.2010.113].
В качестве линкера для модификации ДНК-матрицы, позволяющего иммобилизовать комплекс на твердой поверхности, используют биотинилированный спейсер (фиг. 8). Для иммобилизации смеси на стекле в состав флуоресцентно меченой ДНК матрицы перед промотером должен быть введен олигонуклеотидный фрагмент (спейсер) с биотином на 3'-конце. На первой стадии иммобилизованные нуклеосомы собираются так же, как и обычные (см. ниже). Затем по сайту TSPRI лигируется следующий линкерный участок, содержащий биотин на 5' конце:

Таким образом, этот участок лигируется непосредственно к собранной нуклеосоме в следующих условиях: Т4 Lig Buff, PEG 4000, BSA, T4 Lig30 u 0.5 мкл, все концентрации в соответствии с рекомендациями производителя, объем 30 мкл, 16°С в течение ночи. При этом комплекс оказывается ковалентно или нековалетно прикреплен к твердой поверхности носителя.
Данную модификацию осуществляют известным специалисту в данной области техники способом, например, Кудряшова К.С., Чертков О.В., Иванов Я.О., Студитский B.М., Феофанов А.В. Экспериментальная установка для изучения одиночных иммобилизованных нуклеосом с помощью флуоресцентной микроскопии полного внутреннего отражения. Вестник Московского университета. Серия 16. Биология. 2016; (2):37-42.
Все используемые реагенты являются коммерчески доступными, все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°С.
Способ использования специальных функциональных нуклеосомных матриц для проведения скрининга для тестирования ингибиторов PARP-1 реализуется следующим образом.
Методика реализации способа
1. Сборка мононуклеосом
Вначале проводят сборку нуклеосом на матричной ДНК согласно опубликованному ранее протоколу [D.A. Gaykalova, Kulaeva OI, Pestov NA, Hsieh FK, Studitsky VM. Experimental analysis of the mechanism of chromatin remodeling by RNA polymerase II. // Methods Enzymol. 2012. Vol. 512. P. 293-314; D.A. Gaykalova, Kulaeva O.I., Bondarenko V.A., Studitsky V.M. Preparation and analysis of uniquely positioned mononucleosomes. // Methods Mol. Biol. 2009. Vol. 523. P. 109-23] с модификациями [M. Valieva, Armeev G.A., Kudryashova Ks.S., Gerasimova N.S., Shaytan A.K., Kulaeva O.I., McCullough L.L, Formosa T, Georgiev P.G., Kirpichnikov M.P., Studitsky V.M., Feofanov A.V. Large-Scale ATP-Independent Nucleosome Unfolding by a Histone Chaperone. // Nature Structure and Molecular Biology. 2016. Vol. Р.]. Кратко: нуклеосомы собирают на целевой флуоресцентно-меченой ДНК и донорном хроматине методом диализа против растворов с понижающейся ионной силой. В ходе диализа получаются коровые (безлинкерные) нуклеосомы, которые хранят в силиконизированных пробирках (Eppendorf) при ±4°С (заморозка не допускается). Качество сборки определяют измерением электрофоретической подвижности (Electrophoretic Mobility Shift Assay, EMSA) в 4% полиакриламидном геле (ПААГ). Собранные нуклеосомы очищали от примесей методом препаративного электрофореза в ПААГ. В ходе сборки формируются нуклеосомы, одна из цепей ДНК которой меченная двумя флуорофорами - Су3 (донор) и Су5 (акцептор) - которые после укладки ДНК на гистоновом октамере оказываются на соседних участках ДНК и взаимодействуют по механизму Ферстеровского резонансного переноса энергии ( Resonance Energy Transfer, FRET) (фиг. 1). Существует вариант, когда используют другие пары флуорофоров, формирующие донор-акцепторные пары для реализации эффекта FRET. Возможно введение меток в различные положения относительно входа ДНК в нуклеосому: проксимальное, срединное, дистальное [Stein IH, S.V.,
Resonance Energy Transfer, FRET) (фиг. 1). Существует вариант, когда используют другие пары флуорофоров, формирующие донор-акцепторные пары для реализации эффекта FRET. Возможно введение меток в различные положения относительно входа ДНК в нуклеосому: проксимальное, срединное, дистальное [Stein IH, S.V.,  Р, Tinnefeld Р, Liedl Т.: Single-molecule FRET ruler based on rigid DNA origami blocks.. / Stein IH, S.V.,
Р, Tinnefeld Р, Liedl Т.: Single-molecule FRET ruler based on rigid DNA origami blocks.. / Stein IH, S.V.,  P, Tinnefeld P, Liedl T. // Journal Single-molecule FRET ruler based on rigid DNA origami blocks. - 2011. - T. 25. - C. 689-695].
P, Tinnefeld P, Liedl T. // Journal Single-molecule FRET ruler based on rigid DNA origami blocks. - 2011. - T. 25. - C. 689-695].
2. Очистка рекомбинатного PARP-1
Гены, кодирующие полноразмерные белки человека PARP-1, отдельные домены PARP-1, а также мутантные формы PARP-1 (полученные нами ранее в сотрудничестве с институтом Fox Chase Cancer Center, США) направленно клонировали в вектор экспрессии рЕТ28 (Novagen/EMD Millipore) по сайтам NdeI/XhoI. РЕТ28 плазмида кодирует N-концевые участки расщепления His-tag/thrombin site/T7-tag и имеющий С-концевой His-tag. Эти векторы используются с лямбда DE3 лизогенными штаммами Е. coli. В этих штаммах экспрессия геномной копии РНК-полимеразы Т7 находится под контролем lac репрессора. Экспрессия рекомбинантного белка индуцируется добавлением IPTG в культуральную среду. В рЕТ векторах Т7-промотор запускает экспрессию рекомбинантного гена. Клонированные клетки рассеивали на подогретые чашки с LB-агаром, содержащим 50 мкг/мл канамицина и 35 мкг/мл хлорамфеникола и инкубировали в течение ночи при 37°С. Одиночные колонии использовали для получения ночной культуры 100 мл LB среды с добавкой 50 мкг/мл канамицина и 35 мкг/мл хлорамфеникола и 1% глюкозы (рЕТ28 вектора экспрессии содержат ген lacI, подавляющий экспрессию Т7 в присутствии глюкозы). Инкубировали при перемешивании в течение ночи при 37°С. Затем 10 мл ночной культуры инокулировали в литр свежей LB среды, содержащей 50 мкг/мл канамицина и 35 мкг/мл хлорамфеникола и инкубировали при перемешивании при 37°С до достижения оптической плотности OD600 от 0,4 до 0,6, соответствующей середине логарифмической фазе роста. Было показано, что для хорошего выхода полноразмерного PARP-1, необходимо получить 6 л культуры. Для доменов PARP-1 меньшего размера достаточно от 2 до 4 л культуры. Добавляли к культуре 100 мМ ZnSO4 до конечной концентрации 0,1 мМ и продолжали инкубировать при перемешивании при 37°С до достижения OD 600 от 0,8 до 1,0. Затем культуру охлаждали на льду в течение 1 ч и инициировали индукцию белка добавлением IPTG до конечной концентрации 0,2 мМ. Культуру инкубировали при 16°С при встряхивании в течение ночи (>16 ч). Клеточный осадок собирали центрифугированием при 4°С (30 мин 2600×g). Удаляли супернатант и осадок ресуспендировали в 25 мл буфера ТСЕР 1 на 1 л культуры. Осадок переносили в охлажденный стальной стакан и перемешивали на льду, при этом медленно добавляли NP-40 до финальной 0,1% концентрации, PMSF до 1 мМ, ингибиторы протеаз: лейпептин (до конечной концентрации 0,5 мкг/мл), пепстатин А (до конечной концентрации 0,7 мкг/мл) antipain (до конечной концентрации 0,5 мкг/мл и апротинин (до конечной концентрации 0,5 мкг/мл). Клетки лизировали на холоде, используя клеточный гомогенизатор «под давлением» EmulsiFlex (Avestin). Затем лизат центрифугировали при при 4°С (2 ч, 40000×g) для удаления клеточного дебриса, при этом PARP-1 белки остаются в супернатанте. Затем полученный супернатант подвергали трехступенчатой очистке на 5-мл никелевую HiTrap Chelating колонку (GE Healthcare) согласно рекомендациям производителя, затем отмывали 15 объемами дистиллированной воды и уравновешивали буфером ТСЕР-2. His-tag PARP-1 белки должны связываться с колонкой. Проскоки собирали. Затем колонку последовательно отмывали: (1) 50 мл промывочного буфера 3 с низкой концентрацией соли, (2) 50 мл промывочного буфера 4 с высокой концентрацией соли, (3) и снова 50 мл промывочного буфера 5 с низкой концентрацией соли. Все отмывки проводили при низком давлении насоса, при скорости потока 3 мл/мин. Образцы, полученные после никелевой колонки, наносили на гепариновую колонку с использованием перистальтического насоса низкого давления, установленного на скорости потока 3 мл/мин. PARP-1 белки должны связываться с колонкой. Проскоки собирали. Элюцию проводили на хроматографической системе низкого давления на скорости 3 мл /мин в три стадии. Элюат собирали по 4 мл и анализировали спектрофотометрически (А280) и электрофоретически. Элюаты концентрировали на Amicon. Очищенные белки PARP-1 хранили при -80°С.
3. Подготовка стоковых растворов для экспериментов spFRET
Для измерений методом spFRET нуклеосомы собранные на (Су3, Су5)-меченой S603 ДНК-матрице, описанным выше способом (см. пункт 1 методики) разбавляют до концентрации 0,3 нг/мкл в ТВ-буфере с добавкой 150 мМ KCl и 0,1% полиэтиленгликоля (380-420 Да). Для экспериментов spFRET 50 нМ раствор PARP в 15% глицерине хранится при -20°С. Раствор НАД берется в концентрации 2 мМ. При проведении эксперимента с автомодифицированным PARP-1 добавляли НАД до конечной концентрации 133 мкМ. Концентрации остальных компонентов были такими же, как и с использованием немодифицированного PARP-1. В приведенном примере использовали стоковый раствор олапариба 10 мМ в ДМСО.
4. Условия проведения экспериментов spFRET
Измерения spFRET выполняли с использованием лазерного сканирующего конфокального микроскопа LSM710- Confocor3 (Zeiss, Германия) с 40-кратным водоиммерсионным объективом C-Apochromat (числовая апертура 1,2) в 8-луночных камерах на покровном стекле Lab-Tek (Thermo Scientific, США). Флуоресценцию возбуждали Ar+-ионным лазером (514,5 нм, 2 мкВт под объективом) и регистрировали с помощью лавинных фотодиодов в диапазонах 530-635 нм (Су3) и 635-800 нм (Су5). Диаметр конфокальной диафрагмы был равен 1 диску Эйри. Для каждого образца зависимости интенсивности флуоресценции от времени измеряли в течение 10 мин с константой интегрирования 5 мс. В анализ включали нуклеосомы с интенсивностью сигнала I3=10÷80 кГц и I5=5÷80 кГц, где I3 и I5 - это интенсивности сигналов Су3 и Су5. I3 и I5 корректировали на величину фона, равную соответственно 1,0 и 0,5 кГц. Интенсивности флуоресценции Су3 и Су5, измеренные для каждой нуклеосомы, пересчитывали в эффективность FRET (Е).
Для анализа действия тестовых соединений на связывание PARP-1 с нуклеосомой методом spFRET брали несколько экспериментальных точек, нормализованных по одному конечному времени - 45 мин инкубации - съемка 15 мин:
1) нуклеосомы (45 мин);
2) нуклеосомы + PARP-1 (45 мин);
3) нуклеосомы + PARP-1 (10 мин); + НАД+ (35 мин);
4) PARP-1 + ингибитор (10 мин); + нуклеосомы (45 мин);
5) PARP-1 + ингибитор (10 мин); + нуклеосомы (10 мин); + НАД+ (35 мин);
6) PARP-1 + НАД+ (35 мин); + нуклеосомы (10 мин);
7) PARP-1 + ингибитор (10 мин); + НАД+ (35 мин); + нуклеосомы (10 мин);
5. Анализ данных. Тестирование spFRET на примере ингибитора PARP-1 олапариба.
Профиль распределения эффективностей spFRET от 7 образцов, перечисленных выше, существенно отличается (фиг. 2). Если все профили spFRET наложить на один график, то интерпретация данных будет сильно затруднена, поэтому следует разобрать графики отдельных кривых spFRET попарно (фиг. 3-7).
5.1. Если выделить кривую распределения spFRET от чистых (необработанных ничем) нуклеосом и нуклеосом в комплексе с PARP-1, то видно изменение характера кривых, что говорит о том, что система чувствительно детектирует образование комплексы PARP-1 с нуклеосомами (фиг. 3). Проксимально-меченные нуклеосомы в положениях +13/+91 имеют характерный профиль распределения частиц с разными эффективностями FRET с двумя пиками. Добавление PARP-1 вызывает уменьшение доли частиц с FRET, близким к нулю, но при этом наблюдается общий сдвиг профиля к более низкой эффективности FRET.
5.2. PARP-1 активируется при связывании с нуклеосомами (фиг. 4). При добавлении субстрата PARP-1 - НАД+ - происходит активация фермента, сопровождаемая изменением профиля распределения частиц с разными эффективностями FRET. Снова наблюдается характерное для свободных нуклеосом распределение частиц с двумя максимумами. Но при активации не происходит полного возвращения профиля (фиг 4 справа).
5.3. Олапариб не влияет на связывание PARP-1 и нуклеосом (фиг. 5).
При добавлении олапариба в концентрации 100 мкМ не наблюдается никаких изменений в связывании PARP-1 с нуклеосомой. При этом активация при добавлении НАД+ не наблюдается: напротив, есть стабилизация комплекса и рост количества частиц со средним значением FRET (фиг. 5 справа).
5.4. В проверенных системах изменение профиля в присутствии ингибитора PARP-1 было заметно в образцах с активированным PARP-1. Если наложить профили без олапариба и с олапарибом в такой системе, видна разница (фиг. 6).
Таким образом, в качестве способа скрининга противоопухолевых препаратов-ингибиторов PARP-1 можно использовать данный вариант. В целом способ оценки будет заключаться в следующем.
1. После сборки мононуклеосом раствор, содержащий мононуклеосомы, разделяют на 3 пробирки: 1 - опытная, 2 - референсный образец, 3 - отрицательный контроль.
2. В каждую из пробирок добавляют одинаковое количество PARP-1 (инкубация 10 мин).
3. В каждую из пробирок добавляют одинаковое количество НАД+ (инкубируют 35 мин).
4. В опытную пробирку (№1) добавляют тестируемое вещество. Возможно, для определения диапазона действия следует использовать раститровку тетсируемого вещества (поэтому опытных пробирок может быть несколько).
5. В пробирку, предназначенную для референс-образца, добавляют олапариб (инкубация 10 мин).
6. В пробирку, предназначенную для отрицательного контроля, добавляют ТВ-буфер (инкубация 10 мин).
7. Производят измерение FRET каждого препарата.
8. Оценка результатов проводится в сравнении с отрицательным контролем. Также дополнительно можно использовать референс-образец (приведен пример с олапарибом). Как видно на фиг. 6 кривая FRET отрицательного контроля (не содержащего ингибитор PARP-1) представлена двумя пиками: первый находится в области нулевого FRET. Второй, более интенсивный в области 50% FRET. При введении активного ингибитора (например, олапариба) характер кривой распределения FRET меняется: имеется только один острый и высокий пик в области 35-38% FRET, при этом исчезает пик с нулевым FRET. Таким образом, если при введении тестируемого вещества будет наблюдаться «двухгорбый» пик с нулевым и 50% FRET, то скорее всего вещество не будет обладать ингибирующей PARP-1 активностью. Если при внесении тестируемого вещества будут наблюдаться изменения в FRET кривой, аналогичные тем, что происходят при внесении олапариба (то есть два максимума исчезают и FRET собирается в один пик (фиг. 7), то, возможно, данное вещество будет обладать ингибирующей PARP-1 активностью и годиться для дальнейшей проверки на клетках.
В качестве отрицательного контроля при проведении экспериментов использовался образец без вносимых соединений, а референсный препарат - олапариб - это ингибитор PARP1, обладающий противоопухолевой активностью, прошедший все стадии клинический испытаний на онкологических пациентах и разрешенный к применению FDA.