Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЛИОФИЛИЗИРОВАННОГО ПРЕПАРАТА АКТИВИРОВАННОГО ПРОТРОМБИНОВОГО КОМПЛЕКСА, ОБЛАДАЮЩЕГО ФАКТОР VIII-ШУНТИРУЮЩЕЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Изобретение относится к области фармацевтической промышленности и биотехнологии и касается способа получения лиофилизированного препарата активированного протромбинового комплекса из плазмы крови, обладающего фактор VIII-шунтирующей активностью.
Гемофилия A - наиболее тяжелый врожденный геморрагический диатез, обусловленный дефицитом или дефектом плазменного белка - фактора VIII. Единственным доступным средством лечения данного заболевания на сегодняшний день остается введение недостающего фактора свертывания крови, очищенного из плазмы или полученного биоинженерным способом.
Одной из наиболее серьезных проблем для больного является развитие ингибиторов. Ингибиторы представляют собой антитела, которые прикрепляются к фактору VIII и нейтрализует его. Антитела, направленные против фактора VIII, могут вырабатываться иммунной системой больного также вследствие заместительной терапии, в результате различных заболеваний или возрастных изменений в организме, во время беременности. Длительность циркуляции ингибиторов составляет от нескольких месяцев до нескольких лет.
Появление ингибиторов отягощает прогноз заболевания, снижается эффективность лечения, кровотечения становятся профузными, сочетанными, рано развиваются тяжелая артропатия и инвалидность. При этом увеличение частоты и количества вводимых препаратов крови больному может приводить не только к резистентности таких больных к этим препаратам, но и к усилению кровоточивости после их введения.
В настоящее время существуют несколько подходов для лечения ингибиторной формы гемофилии A. Одним из способов эффективного восстановления гемостаза является применение лиофилизированных препаратов, обладающих FVIII-шунтирующей активностью. К препаратам данного ряда относятся активированный протромбиновый комплекс (aPCC), получаемый из донорской плазмы человека, и рекомбинантный активированный фактор VII (rFVIIa).
Активированный протромбиновый комплекс - это группа гликопротеинов плазмы крови, включающая факторы ее свертывания - II, IX и X (FII, FIX и FX) в неактивированной форме, а также фактор VII (FVII) преимущественно в активированной форме.
Для характеристики концентратов активированного протромбинового комплекса используют термины «FEIBA-активность» и «специфическая активность» плазматических факторов свертывания II, IIa, VII, IX, X. Количественно данные параметры определяют методом коагулометрии в Международных Единицах (ME).
Одна ME FEIBA-активность соответствует такому количеству препарата, которое в тесте частичного активированного тромбопластинового времени (АЧТВ-тест) уменьшает время свертывания плазмы с высоким уровнем содержания ингибиторов FVIII в два раза.
Одна Международная Единица активности FII, FVII, FIX, FX эквивалентна активности соответствующего фактора, содержащегося в 1 мл нормальной человеческой плазмы. Одна ME активности FIIa эквивалентна такому количеству препарата, которое способно свернуть при температуре +37°C 1 мл нормальной человеческой плазмы за 30 с или 1 мл 0.1% раствора очищенного фибриногена за 15 с.
Активированный протромбиновый комплекс является белковым препаратом, поэтому, как и другие белки, применяемые для лечебных целей, он может быть неустойчивым при хранении. Стабильность - одна из проблем, которая решается при разработке технологии производства препарата. Согласно существующим требованиям восстановленный концентрат должен быть стабилен, по крайней мере, в течение 12 часов.
Другая проблема связана с использованием плазмы - это необходимость защиты реципиентов от вирусов, которые потенциально могут содержаться в крови доноров. Поэтому важными и ответственными в производственном цикле являются стадии химической и/или тепловой вирусной инактивации.
Во второй половине 80-х годов был разработан и внедрен новый метод вирусной инактивации - сольвент/детергентный (S/D метод), который впоследствии взяли на вооружение многие компании. Этот метод является неспецифическим и позволяет инактивировать все вирусы с липидной оболочкой: в частности ВИЧ, вирусы гепатита C и B, а также возможные неизвестные вирусы с липидной оболочкой. Вирусы ВИЧ-инфекции, гепатитов B и C являются наиболее патогенными, поскольку имеют относительно сложное строение и легче преодолевают иммунный барьер. Однако S/D обработка столь действенна, что вирусная нагрузка в 1000000000 частиц на миллилитр устраняется менее чем за 2 минуты. Тем не менее, S/D обработку для многих препаратов выполняют в течение 4-24 часов, что обеспечивает высокий уровень вирусной безопасности. Применяемые детергенты TWEEN-80 или Triton-X-100 в сочетании с гидрофобным растворителем три-n-бутилфосфатом (TnBP) разрушают липопротеиновые оболочки вирусов. Оставшиеся фрагменты нуклеиновых кислот не обладают патогенным действием и удаляются на последующих этапах очистки препарата. Эффективность S/D метода зависит от температуры и времени воздействия. S/D метод также применяется в качестве метода вирусной инактивации при изготовлении рекомбинантных препаратов.
Тепловой способ вирусной инактивации применяется на лиофилизированных препаратах для воздействия на оболочечные вирусы (ВИЧ, гепатиты B и C) и на вирусы, не имеющие оболочек (гепатит A, парвовирус В19). Эффективность данной вирусной инактивации зависит от комбинации нескольких факторов воздействия на вирус: температурного режима, экспозиции установленной температуры, физическое состояние препарата, содержание соли, природы и концентрации стабилизатора. Последний необходим для сохранения качества и гемостатической активности препарата. Тепловой режим варьируется от 60°C до 100°C, экспозиция от 30 минут до 72 часов. В настоящее время многими фирмами применяется так называемый «тепловой шок»: температурный режим 100°C в течение 30 минут.
Помимо S/D метода и тепловой обработки третьим методом инактивации вирусов является нанофильтрация, нацеленная на безоболочечные вирусы. Это весьма действенный метод, хотя он и уступает в эффективности S/D и тепловой обработкам. С другой стороны, патогенность безоболочечных вирусов не так высока, и они преимущественно передаются пероральным и воздушно-капельным путями.
Не редко производители препаратов плазмы комбинируют выше упомянутые способы обеспечения вирусной безопасности.
На сегодняшний день на рынке присутствуют только два препарата aPCC: «FEIBA» («Baxter», Австрия) и «Autoplex Т» («NABI», США). Первый и наиболее широко используемый препарат этого ряда, «FEIBA» получил название по ожидаемому механизму действия - Factor Eight Inhibitor Bypassing Activity (активность в «обход» фактора VIII).
Кроме концентратов активированного протромбинового комплекса также существуют два препарата активированного рекомбинантного фактора VII. Долгое время единственным в мире выпускаемым rFVIIa был препарат «NovoSeven» («Novo Nordisk», Дания). С 2010 года в России появился и стал успешно применяться для лечения больных с ингибиторной формой гемофилии первый отечественный препарат rFVIIa - «Коагил-VII» («ГЕНЕРИУМ», Россия).
Препараты активированного протромбинового комплекса и рекомбинантного активированного фактора VII имеют разные механизм запуска системы гемостаза, при этом каким именно образом это происходит, остается предметом дискуссий.
Концентраты aPCC и rFVIIa высокоэффективны и вирусбезопасны, но, к сожалению, весьма дорогостоящи, также следует учитывать, что российских аналогов aPCC просто не существует.
Известны способы получения активированного протромбинового комплекса, обладающего FVIII-шунтирующей активностью, включающие получение криосупернатанта из цитратной плазмы, активацию протромбинового комплекса в отсутствие свободных ионов кальция и последующее выделение aPCC методом анионообменной хроматографии на DEAE-Sephadex А50 в объеме. Авторы этих патентов осуществляли активацию путем добавления каолина или целита 512 (патент US 4160025, 03.07.1979) и декстрансульфата или непосредственно за счет перемешивания с сорбентом в течение не менее 12 часов (патент US 4395396, 26.07.1983).
Серьезным недостатком этих методов является невозможность контролировать процесс активации и, следовательно, невозможность стандартизации процесса производства. При этом продолжительность и ход активации чрезвычайно важны, так как в процессе активации может образовываться побочный продукт - тромбин. Тромбин повышает риск тромботических осложнений, его присутствие в значительных концентрациях в конечном продукте недопустимо. Также авторами этих патентов не оценивается состояние исходного материала для активации, таким образом, не принимается во внимание уже существующая степень активации каждой партии плазмы или криосупернатанта. Авторы данных патентов предлагают для компенсации вариаций объединять партии готовой продукции с разными количествами единиц FEIBA и тромбина. Это является неудовлетворительным, поскольку повышается риск контаминации, присущий такой процедуре, и не соответствует современным требованиям биофармацевтического производства.
В качестве наиболее близкого аналога (прототипа) является способ получения FVIII-шунтирующей активности, включающий последовательные стадии выделения протромбинового комплекса и его активации действием сверхнизких концентраций ионов кальция (патент US 4364861, 21.12.1982). Такой способ лишен вышеупомянутых недостатков, однако сопряжен с образованием неконтролируемых количеств тромбина, содержание которого в конечном препарате допускается только на крайне низком уровне.
Задачей настоящего изобретения являлась разработка технологии получения препарата, обладающего фактор VIII-шунтирующей активностью, лишенной вышеприведенных недостатков.
Технический результат заявленного изобретения заключается в расширении арсенала технических средств для получения активированного протромбинового комплекса, обладающего FVIII-шунтирующей активностью, с высокой степенью очистки от балластных белков и тромбина.
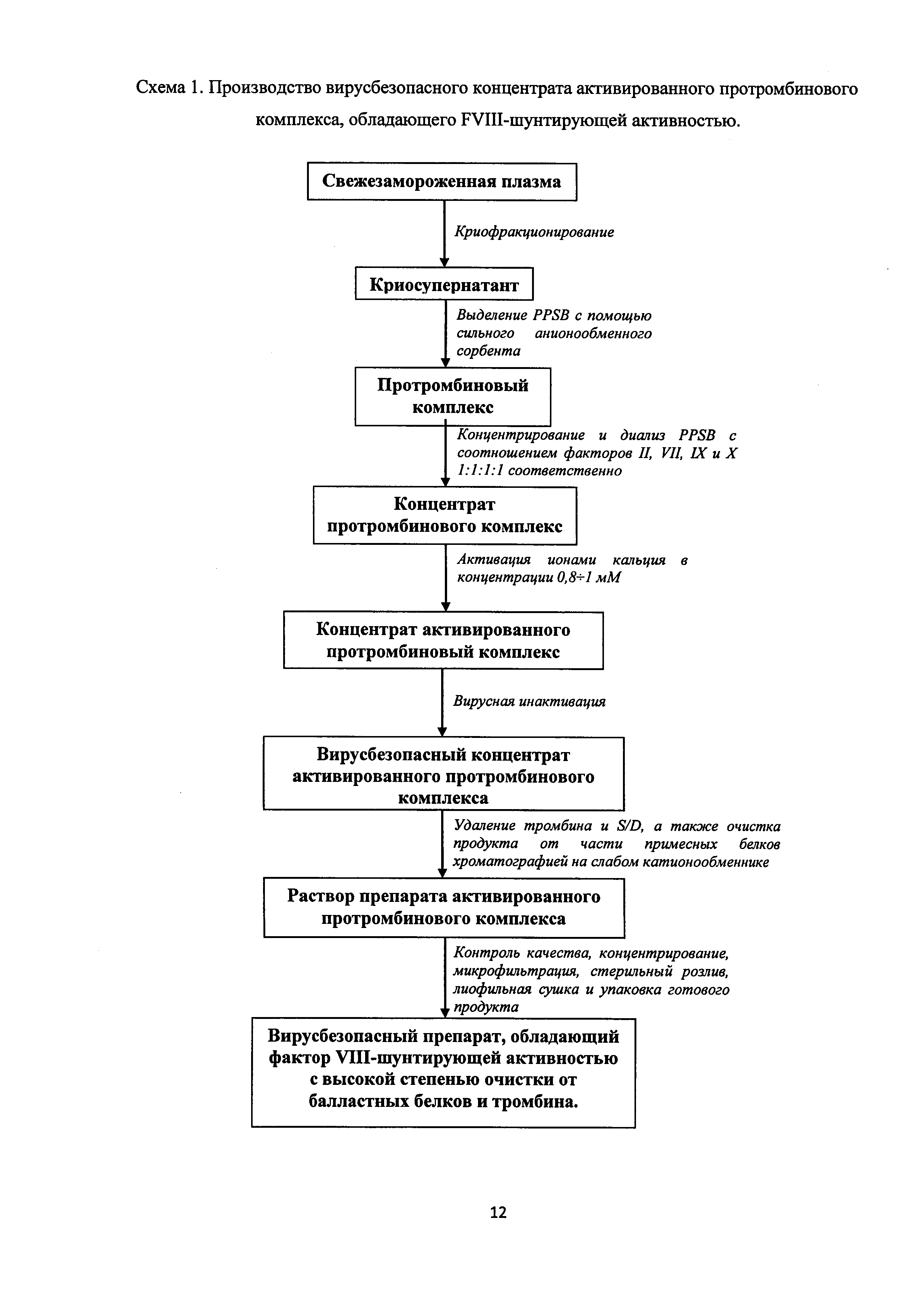
Технический результат достигается тем, что создан способ получения лиофилизированного препарата активированного протромбинового комплекса, обладающего фактор VIII-шунтирующей активностью, включающий криофракционирование свежезамороженной плазмы крови человека, выделение из криосупернатанта протромбинового комплекса методом анионообменной хроматографии, его активацию ионами кальция, вирусную инактивацию и последующие очистку от балластных белков и тромбина, стерильную фильтрацию и лиофильную сушку, при этом выделение из криосупернатанта протромбинового комплекса проводят с помощью сильного анионообменного сорбента, его активацию - ионами кальция с концентрацией 0,8÷1 мМ, а очистку от балластных белков и тромбина - хроматографией на слабом катионообменнике.
Способ осуществляется следующим образом.
Получение препарата активированного протромбинового комплекса, обладающего фактор VIII-шунтирующей активностью, заключается в выделение криосупернатанта (КСН) из свежезамороженной плазмы (СЗП) в процессе первичного криофракционирования по методу J. Newman. Затем из КСН методом анионообменной хроматографии выделяют протромбиновый комплекс (PPSB) с помощью сильного анионообменного сорбента, затем активируют PPSB действием ионов кальция с концентрацией 0,8÷1 мМ. Полученный таким образом aPCC подвергают вирусной инактивации сольвент/детергентным методом. После чего осуществляют очистку aPCC от балластных белков и тромбина, образующегося в процессе активации путем проведения хроматографии на слабом катионообменнике с использованием буферных растворов разной ионной силы. На последнем этапе производства активированный протромбиновый комплекс стерилизуют и переводят в лиофилизированную форму. На схеме 1 представлена последовательность стадий производства активированного протромбинового комплекса согласно данному методу.
Предложенное сочетание и последовательность стадий обработки КСН, условия выделения, активации и очистки в предлагаемом способе позволяют решить трудности, связанные с контролем процесса активации протромбинового комплекса, позволяют обеспечить отсутствие тромбина в конечном препарате, а также вирусную безопасность, стабильность при хранении и удобство применения готовой формы.
Для выделения протромбинового комплекса из КСН могут использоваться различные сильные анионообменные сорбенты, несущие различные положительно заряженные группы (DEAE, ТМАЕ, QAE, ТАМ, АЕ, Q и т.п.), способные сорбировать значительное количество фактора VII, например TOYOPEARL GigaCap Q-650M («TOSOH BIOSCIENCE», Япония), Capto Q, или QAE-Sephadex A50 («GE HealthCare», США).
Для регулирования pH в способе предпочтительно использовать 0.5 М растворы уксусной кислоты или Tris.
В процессе активации в качестве источников ионов кальция можно использовать любые водорастворимые вещества, не нарушающие структуру и функцию белков, не препятствующие активации и нетоксичные для человека (хлорид кальция, ацетат кальция, глицинат кальция, и т.д.) в концентрации 0,8÷1 мМ. рН активируемого образца может варьировать в диапазоне от 7.0 до 8.0. Температура проведения процесса может находиться в диапазоне от 5 до 25°C, время активации может составлять от 4 до 48 ч.
Используемая для активации оптимальная концентрация ионов кальция, pH, температура и время активации связаны с исходной степенью активации протромбинового комплекса, концентрации и соотношения плазменных факторов свертывания крови, количества и относительного состава фосфолипидов, концентрации общего белка, состава буферного раствора.
То есть для активации следует использовать образец PPSB, в котором соотношение FII, FVII, FIX и FX, близкое 1:1:1:1 соответственно, при этом концентрация общего белка составляет порядка 3-5% при pH раствора около 7.60 и проводимости 10-15 мСи/см. В этом случае максимальная генерация FEIBA-активности достигается при концентрации ионов кальция 0,8÷1 мМ, температуре 15°C и инкубации в течение 24 часов.
Для прекращения процесса активации используют хелатирующие агенты, не нарушающие структуру и функцию белков и нетоксичные для человека (Chelex 100 («BioRad Laboratories», США), Amberlite («Dow Chemical Company», США) и т.п.) или вещества, необратимо связывающие ионы кальция в водном растворе (цитрат натрия, фосфат натрия, и т.п). Образовавшиеся в процессе сгустки удаляют центрифугированием или фильтрацией.
Вирусную инактивацию производят путем перемешивания aPCC с 1% Tween 80 и 0.3% TnBP в течение от 4 до 24 часов. В качестве стабилизаторов используют, например, различные сочетания концентраций лизина и глицина.
Удаление S/D, очистку aPCC от тромбина, а также от балластных белков и продуктов деградации проводят колоночной хроматографией на слабом катионообменнике с использованием различных сорбентов, например TOYOPEARL GigaCap Q-650M или Capto Q. При этом буферный раствор, используемый для фракционирования, содержит оптимально Tris, цитрат натрия, хлорид натрия, воду для инъекций, pH 7.55-7.65. Одним из условий фракционирования является изменение концентрации натрия хлорида в сторону увеличения. В приведенной ниже таблице 1 представлены параметры используемых буферов в процессе очистки aPCC.

В полученном растворе aPCC корректируют содержание хлорида натрия, цитрата натрия и pH до уровня, близкого к физиологическому (137 мМ NaCl, 13.5 мМ CitNa3 и pH 7.34), затем раствор концентрируют и стерильно фильтруют оптимально в 3 этапа через мембранные микрофильтры с размерами пор 2-8 мкм, 1.2 мкм и, наконец, 0.65 мкм. После чего концентрат активированного протромбинового комплекса стерильно разливают по флаконам объемом 50 мл и подвергают лиофильной сушке.
Ниже представлены конкретные примеры осуществления изобретения.
Пример 1
Свежезамороженную плазму размораживают при 35°C при непрерывном перемешивании, после того как температура смеси достигает 0-+4°C, криоприципитат отделяют проточным центрифугированием при 4000 об/мин при температуре 0°C. pH полученного криосупернатанта до 7.60 доводят 1.0 М гидроксидом натрия, затем к КСН медленно при перемешивании добавляют сухой сильный анионообменный сорбент QAE-Sephadex А50 («GE HealthCare», США) из расчета 1.5 г/л КСН, суспензию перемешивают в течение 2 часов при комнатной температуре. Сорбент отделяют на колонне и промывают буфером A (80 мМ NaCl, 20 мМ CitNa3, pH 7.60), протромбиновый комплекс элюируют буфером B (500 мМ NaCl, 20 мМ CitNa3, pH 7.60), элюат концентрируют и диализуют против буфера C (100 мМ NaCl, 20 мМ Tris, pH 7.60) до конечной концентрации общего белка 4.0%. Выход PPSB по факторам II, VII, IX и X составлял 91.9%, 78.0%, 92.4% и 94.6% соответственно.
К концентрату протромбинового комплекса при перемешивании добавляют 25 мМ CaCl2 таким образом, чтобы конечная концентрация свободных ионов кальция составляла 0.85 мМ. Раствор инкубируют при непрерывном перемешивании при pH 7.60 и температуре 15°C в течение 24 часов. После этого свободные ионы кальция связывают добавлением при перемешивании трехкратного избытка 1.1 М CitNa3, осадок цитрата кальция, а также образовавшиеся в процессе активации сгустки отделяют центрифугированием при 2000 об/мин в течение 10 мин. Количество сгенерированной FEIBA-активности составило 58.1 МЕ/мл, тромбина 101.3 МЕ/мл.
К полученному таким образом концентрату активированного протромбинового комплекса добавляют сухой лизин до конечной концентрации 10 мМ в сочетание с сухим глицином до конечной концентрации 100 мМ, после растворения аминокислот к aPCC добавляют 11% TWEEN 80 до конечной концентрации 1.0% и TnBP до конечной концентрации 0.3%, вирусную инактивацию проводят при непрерывном перемешивании при комнатной температуре в течение 6 часов. Выход по целевой активности 85-90%.
Очистку aPCC проводят методом колоночной хроматографии на слабом катионообменнике с использованием сорбента TOYOPEARL GigaCap Q-650M, для этого гель уравновешивают буфером A, после чего на него со скоростью 60 см/ч наносят aPCC из расчета 30-35 ME FEIBA-активности/мл геля. Для удаления несвязанных белков сорбент промывают буфером A, затем для очистки от балластных белков и тромбина буфером D (140 мМ NaCl, 20 мМ CitNa3, pH 7.60), десорбцию активированного протромбинового комплекса проводят буфером C, сорбент подвергают регенерации. Выход по FEIBA-активности 83-90%.
К элюату добавляют 11.0 мМ CitNa3, таким образом, чтобы в растворе aPCC конечная концентрация хлорида натрия составила 137 мМ, а цитрата натрия 13.5 мМ, pH до 7.34 корректируют 0.5 М уксусной кислотой. Затем раствор активированного протромбинового комплекса концентрируют так, что бы количество единиц FEIBA-активности составило 25 МЕ/мл, стерилизуют в 3 этапа через мембранные микрофильтры с размерами пор 2-8 мкм, 1.2 мкм и 0.65 мкм, разливают по 20 мл во флаконы объемом 50 мл и замораживают при -50°C и давление 1 бар в течение 7.5 часов, лиофилизацию проводят повышением температуры от -20 до +30°C при давлении 60 мкбар в течение 40.5 ч. Выход по FEIBA-активности на данном этапе составлял 85-90%.
Пример 2
Все этапы способа были проведены также как в примере 1. Отличие заключалось лишь в том, что выделение КСН проводили медленно при перемешивании, добавляя сухой сильный анионообменный сорбент Capto Q, его активацию осуществляли ионами кальция с концентрацией 1 мМ, а очистку aPCC проводили хроматографией на слабом катионообменнике с помощью сорбента Capto Q. Выход по FEIBA-активности на стадии хроматографии составил 83-90%. А после стерильной фильтрации и лиофильной сушки выход FEIBA-активности составил 84-90%.
Для определения FEIBA-активности в кювете коагулометра смешивали по 50 мкл плазмы, содержащей ингибиторы FVIII, соответствующего разведения препарата, обладающего FVIII-шунтирующей активностью, АЧТВ-реагента и после прогрева при 37°C добавляли 35 мМ раствор хлорида кальция. Измеряли время от момента добавления раствора хлорида кальция до момента образования сгустка. FEIBA-активность определяли по калибровочному графику, построенному с использованием ряда последовательных разведений стандарта с известной активностью.
Измерение активности факторов свертывания крови и концентрации общего белка проводили по методикам, многократно описанным в литературе.
Предложенный способ позволяет получить препарат, по своей эффективности не уступающий лучшим зарубежным аналогам, и может быть рекомендован для промышленного использования.
Способ получения лиофилизированного препарата активированного протромбинового комплекса, обладающего фактор VIII-шунтирующей активностью, включающий криофракционирование свежезамороженной плазмы крови человека, выделение из криосупернатанта протромбинового комплекса методом анионообменной хроматографии, его активацию ионами кальция, вирусную инактивацию и последующие очистку от балластных белков и тромбина, стерильную фильтрацию и лиофильную сушку, отличающийся тем, что выделение из криосупернатанта протромбинового комплекса проводят с помощью сильного анионообменного сорбента, его активацию - ионами кальция с концентрацией 0,8÷1 мМ, а очистку от балластных белков и тромбина - хроматографией на слабом катионообменнике.