Результат интеллектуальной деятельности: ПРОГНОЗИРОВАНИЕ ТЕЧЕНИЯ И ИСХОДА КОМЫ И ПОСТКОМАТОЗНЫХ БЕССОЗНАТЕЛЬНЫХ СОСТОЯНИЙ (В ТОМ ЧИСЛЕ ВЕГЕТАТИВНЫХ) С ПОМОЩЬЮ ГЕМОТЕСТОВ
Вид РИД
Изобретение
Область техники
Изобретение относится к экстренной медицине, в частности, к скорой и неотложной медицинской помощи, травматологии, хирургии, реаниматологии и нейрохирургии, а именно, к способам оценки бессознательных и вегетативных состояний, а также прогноза исхода комы в результате поражения структур головного мозга травматического, ишемического или метаболического генеза с помощью гемотестов для определения мозго-специфичных белковых биомаркеров, таких как антитела к каинатным рецепторам.
Уровень техники
Бессознательные состояния могут представлять собой кому и различные варианты посткоматозных расстройств сознания (вегетативное состояние, акинетический/гиперкинетический мутизм) (Александрова Е.В. и др. Выход из затяжного бессознательного состояния вследствие тяжелого диффузного аксонального поражения головного мозга. Неврология, нейропсихиатрия, психосоматика, Выпуск №2/2013, с. 51-58). Причиной комы могут быть структурные (травматические) и неструктурные (метаболические) повреждения. Общие особенности патогенеза всех видов бессознательных состояний заключаются в нарушении функций коры больших полушарий, подкорковых образований и ствола мозга, а также в поражении восходящей ретикулярной формации ствола мозга, активирующей кору больших полушарий.
Тяжелая черепно-мозговая травма (тЧМТ) характеризуется наличием коматозного состояния в остром периоде, которое чаще всего обусловлено дисфункцией ствола головного мозга вследствие его непосредственного травматического повреждения или сопутствующих вторичных (нетравматических) причин, таких как отек, дислокация, внутричерепная гипертензия и др. Выход из комы примерно в 35% случаев сопровождается переходом в другое бессознательное состояние (вегетативный статус, акинетический мутизм), длительность которого влияет на степень дальнейшего восстановления психических функций, трудоспособности, и зависит от наличия и степени повреждения глубинных структур мозга (ствола, базальных ганглиев и таламуса) (Александрова Е.В. и др. Выход из затяжного бессознательного состояния вследствие тяжелого диффузного аксонального поражения головного мозга. Неврология, нейропсихиатрия, психосоматика, Выпуск №2/2013, с. 51-58).
Прогноз исхода комы включает клиническую и биохимическую диагностику. Неврологическая диагностика комы с привлечением компьютерной томографии (КТ) и магнитно-резонансной томографии (MPT) заключается в установлении характера, причины и тяжести угнетения сознания (с использованием Шкалы Комы Глазго (ШКГ)). В силу нестабильности состояния пациента, невозможности транспортировки за пределы отделения реанимации и при наличии противопоказаний (наличие металлических предметов в организме), проведение наиболее информативного метода диагностики - МРТ головного мозга - часто оказывается невозможным. Кроме того, часто обычные МРТ режимы не позволяют оценить функциональные нарушения (кровотока, биохимических процессов) в мозге, что приводит к ложноотрицательной диагностике дисфункции ствола головного мозга. Выявление причины коматозного состояния также включает оценку системных параметров: артериального давления, газов и кислотно-основного равновесия (рН) крови, биохимических (глюкозы и кетонов, лактата и креатина) и электролитных показателей. Однако указанные показатели являются неспецифичными для прогноза исхода комы, т.к. их величины зависят также от скорости периферического кровообращения и тяжести поражения организма.
Выход из комы в остром периоде тЧМТ трудно прогнозировать, используя только традиционные методы. Определение прогноза при коме, кроме сугубо медицинского, имеет важное экономическое значение из-за необходимости перераспределения материальных средств и ограничения интенсивных мероприятий в безнадежных случаях. До сих пор экспресс-оценка специфических параметров состояния мозга в динамике остается нерешенной задачей. В этой связи выявление специфичных биомаркеров мозга, отражающих развитие заболевания и измеряемых в периферической крови в достоверных количествах, является важной задачей мониторинга и прогноза состояния головного мозга при комах.
Сущность изобретения
Сущность данного изобретения заключается в том, что у пациентов в бессознательных состояниях и коме в результате поражения структур мозга повышается концентрация антител к фрагментам специфических нейрорецепторов, а именно каинатных рецепторов, которые можно обнаружить в биологических жидкостях пациента при помощи соответствующих биохимических тестов. На основании определения объективных показателей в биологических жидкостях пациентов возможно своевременное и обоснованное назначение адекватной терапии.
Известно, что ионотропные глутаматные нейрорецепторы подразделяются на три подтипа: NMDA-рецепторы, АМРА и каинатные рецепторы, которые распространены в разных структурах центральной нервной системы для осуществления скоростной передачи сигнала. NMDA рецепторы локализуются на поверхности эндотелия микрососудов в основном в коре головного мозга. АМРА рецепторы локализуются на синаптических терминалях и обнаружены в ряде подкорковых структур головного мозга. Наконец, каинатные рецепторы (КАР), в частности такие подтипы как GluR6 и GluR7, расположены в основном в трактах ствола головного мозга и спинного мозга и вовлечены в регуляцию церебрального венозного кровообращения, а также регулируют основные функции поддержания жизни.
КАР представляют собой рецепторные белки синаптических мембран, участвующие в каскаде нейротоксичности при повреждении мозга с образованием вторичных вазогенных и/или цитотоксических отеков в глубоких структурах головного мозга. Появление пептидных фрагментов КАР в биологических жидкостях, в том числе крови, свидетельствует о структурных разрушениях - патологических изменениях в постсинаптических окончаниях нейронов и поражениях венозного кровообращения ствола мозга. Авторами изобретения был обнаружен повышенный уровень фрагментов КАР, образованных из GluR6 и/или из GluR7, у пациентов, находящихся в бессознательном состоянии. У здоровых лиц образование фрагментов КАР в крови происходит в гораздо меньших количествах, или не происходит совсем. Попадая в кровь, избыточные концентрации фрагментов КАР могут вызывать иммунный ответ, заключающийся в выработке специфических антител, уровень которых будет коррелировать со степенью тяжести и размером повреждения структур головного мозга. В связи с этим, как КАР пептиды, так и антитела к ним, могут служить биомаркерами острых и хронических поражений структур головного мозга.
Задачей настоящего изобретения является объективная оценка состояния головного мозга субъектов в бессознательных состояниях и коме, а также прогнозирование развития состояния больного, которое может заключаться как в восстановлении сознания субъекта (благоприятный исход), так и в переходе в хроническое вегетативное состояние или летальный исход (неблагоприятный исход развития болезни).
Решение указанной задачи заключается в том, что у субъектов в бессознательных состояниях и коме проводят определение в биологических жидкостях уровня антител к КАР для оценки поражения нервной ткани, на основе которого осуществляется прогнозирование выхода из бессознательного состояния. Сущность предлагаемого способа оценки состояния мозга пациента заключается в том, что на основе оценки мозго-специфичных молекулярных биомаркеров у пациента можно быстро и динамично оценить наличие и степень как структурного, так и функционального поражения ствола и подкорковых структур мозга, что невозможно провести только с помощью стандартных методов нейровизуализации (изменения происходят в течение 5-7 дней).
В некоторых вариантах изобретения способ прогнозирования выхода из бессознательного состояния включает в себя: (а) получение биологического образца от указанного субъекта; (б) по меньшей мере, однократный анализ указанного биологического образца для определения уровня антител к одному или нескольким фрагментам каинатных рецепторов GluR6 и/или GluR7; (в) сравнение этого уровня с уровнем соответствующих антител в образцах, взятых у здоровых субъектов; (г) при низком уровне антител в образце субъекта, находящегося в бессознательном состоянии, не превышающем контрольный уровень, зафиксированный в образцах здоровых субъектов, прогнозирование благоприятного выхода из бессознательного состояния; (д) при повышенном уровне антител в образце субъекта, находящегося в бессознательном состоянии, превышающем контрольный уровень, зафиксированный в образцах здоровых субъектов, прогнозирование неблагоприятного исхода развития болезни.
В некоторых вариантах изобретения предпочтительно использовать динамическое измерение уровня высвобождающихся при повреждении мозга и циркулирующих в крови фрагментов КАР рецепторов, которое позволяет оценить наличие, степень повреждения и отслеживать восстановление функции глубинных структур (в частности, течение травматической болезни мозга), и, следовательно, прогнозировать исход при длительных хронических состояниях. В этих случаях у субъекта, находящегося в бессознательном состоянии, осуществляется забор по крайней мере двух, трех или более биологических образцов в интервале от 1 часа до 90 дней после наступления бессознательного состояния. После этого, способ прогнозирования выхода из бессознательного состояния включает в себя: (а) анализ указанных биологических образов для определения уровня антител к одному или нескольким фрагментам каинатных рецепторов GluR6 и/или GluR7; (б) сравнение уровней соответствующих антител, определенных в разных образцах одного субъекта, друг с другом и с уровнем соответствующих антител в образцах, взятых у здоровых субъектов; (в) при понижении уровня указанных антител в образцах субъекта, находящегося в бессознательном состоянии, стечением времени прогнозирование благоприятного выхода из бессознательного состояния; (г) при повышении уровня указанных антител в образце субъекта, находящегося в бессознательном состоянии, с течением времени прогнозирование неблагоприятного исхода развития болезни, при условии, если этот уровень превысил контрольный уровень, зафиксированный в образцах здоровых субъектов. Для улучшения прогнозирования желателен отбор трех или более образцов. Временные интервалы между отборами образцов целесообразно определять, исходя из динамики изменения уровня антител к фрагментам КАР рецепторов, а также к фрагментам других глутаматных рецепторов для оценки общего состояния глутаматергической системы, ответственной за корково-подкорковые функции мозга (например, в соответствии с патентами RU 2435165 и RU 2112243).
В предпочтительных вариантах изобретения субъектом, находящимся в бессознательном состоянии, является пациент, а бессознательное состояние представляет собой кому травматического или метаболического генеза.
В частных вариантах изобретения в качестве биологического образца используют цельную кровь, сыворотку крови, плазму, спинномозговую жидкость, дыхательные пары, пот и/или слюну, полученные от субъекта.
Предпочтительно, в способах по настоящему изобретению выявление и/или количественную оценку антител, специфичных для фрагментов каинатных рецепторов осуществляют с использованием одной или более аналитических систем, например методами иммунологического анализа, таких как твердофазный иммуноферментный анализ (ИФА, ELISA), радиоиммунологический анализ (RAI) или ферментный иммуноанализ (EIA); а также другими аналитическими методами определения белков после взаимодействия со специфическими лигандами (например, масс-спектрометрия, ЯМР-спектроскопия, жидкостная хроматография и др.).
Согласно другому аспекту, настоящее изобретение относится к применению набора для использования в способах или областях применения, описанных выше, где указанный набор включает лиганд, способный связываться с или быть специфически распознанным антителами к фрагментам каинатных рецепторов, а также репортерные средства.
В предпочтительных вариантах изобретения прогнозирование выхода из бессознательного состояния у субъекта также включает в себя дополнительные клинические, лабораторные и/или инструментальные методы обследования. Например, дополнительные методы рекомендуются при появлении цитотоксической эдемы, диффузного аксонального повреждения и/или гематомы, которые подтверждаются методами нейровизуализации с помощью специальных модальностей магнитно-резонансной томографии (Т1, Т2, FLAIR, DWI, SWI и SWAN), а также измерением системных показателей крови.
Технический результат настоящего изобретения заключается в том, что данное изобретение помогает решить проблему объективного прогноза благоприятного или неблагоприятного исхода после поражения структур мозга, приведшего к бессознательному состоянию. Изобретение позволяет оценить наличие и степень как структурного, так и функционального поражения ствола и подкорковых структур мозга. Дополнительно, данное изобретение может позволить оценить время выхода пациента из бессознательного состояния (часы, дни, недели, месяцы) в соответствии со значениями ряда биохимических показателей. Указанный прогноз позволяет повысить точность и объективность оценки состояния структур мозга у лиц в бессознательных состояниях и коме. Такой подход исключает субъективизм, повышает точность в предсказании выхода из бессознательного состояния при поражении структур мозга различного генеза, что позволит проводить наиболее оптимальные лечебные мероприятия с последующим улучшением состояния больного.
Определения и термины
В настоящем описании термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Термин «благоприятный выход из бессознательного состояния» означает восстановление сознания субъекта (пациента), в то время как «неблагоприятный исход развития болезни» означает хроническое вегетативное состояние или летальный исход.
Под «субъектом» следует понимать человека или, менее предпочтительно, другое млекопитающее, наделенное сознанием.
Каинатные рецепторы (КАР) являются одним из подтипов ионотропных глутаматных рецепторов, которые обнаруживаются в структурах центральной нервной системы человека и животных. Существует 5 различных субъединиц каинатных рецепторов (GluR5, GluR6, GluR7, КА1 и КА2), которые образуют гомо- или гетеро-тетрамеры для формирования функционального рецептора. В одном аспекте настоящее изобретение относится к способам определения уровня антител к фрагментам GluR6 и/или GluR7, возникших у субъекта, находящегося в бессознательном состоянии. Субъединица GluR6 может альтернативно называться GluK2 или GRIK2, и определяется с помощью последовательности SEQ ID NO: 1 (см. Рис. 1), или ее вариантами. Субъединица GluR7 может альтернативно называться GluK3 или GRIK3, и определяется с помощью последовательности SEQ ID NO: 2 (см. Рис. 1), или ее вариантами.
Под «клиническими методами обследования» следует понимать обследование с использованием Шкалы Комы Глазго или Питтсбургской шкалы, тогда как «лабораторные методы обследования» заключаются в измерении системных показателей крови, включающие измерение кислотно-основного баланса (рСO2, рН) и биохимические параметры крови (кетоны, лактат, креатин). Под «инструментальными методами обследования» нужно понимать, например, магнитно-резонансную томографию, которая включает Т1 и Т2-взвешенную, FLAIR, DWI, SWI и SWAN модальности.
Под «фрагментами каинатных рецепторов GluR6 и/или GluR7» в данном описании нужно понимать как целые белковые молекулы, определенные с помощью аминокислотных последовательностей SEQ ID NO: 1 и SEQ ID NO: 2, так и различные варианты этих молекул, которые могут включать в себя частичные фрагменты этих молекул, ковалентные модификации фрагментов этих молекул (такие как фосфорилирование, ацетилирование, модификации под действием оксидативного стресса, амидирование, сульфонирование и др.), сшивки частичных фрагментов этих молекул между собой и с другими молекулами (полиглутамил, насыщенные кислоты, мочевина, карбаматы, альдегиды, эфиры, нитроанилиды, аминометилкумарины, полиэтиленгликолии др.), и другие варианты, способные индуцировать образование специфических антител в организме субъекта. Для детекции антител, специфичных к фрагментам каинатных рецепторов GluR6 и/или GluR7, могут быть использованы как целые белковые молекулы этих рецепторов и их фрагменты, так и различные рекомбинантные варианты фрагментов каинатных рецепторов GluR6 и/или GluR7, включающие целые белковые молекулы, частичные фрагменты, сшивки частичных фрагментов, а также конъюгаты этих молекул или их фрагментов с белками или низкомолекулярными соединениями (биотин, авидин, пероксидаза, GABA, АЕА, AVA, Аhх).
Под «контрольным» или «пороговым» уровнем антител к фрагментам каинатных рецепторов следует понимать максимальный уровень соответствующих антител, определенных у здоровых добровольцев. Абсолютное значение этого уровня может варьироваться в зависимости от определенного метода детекции антител и должно быть определено экспериментально для каждого метода.
Краткое описание рисунков
Рис. 1. Аминокислотные последовательности GluR6 (SEQ ID NO: 1) и GluR7 (SEQ ID NO: 2) каинатных рецепторов.
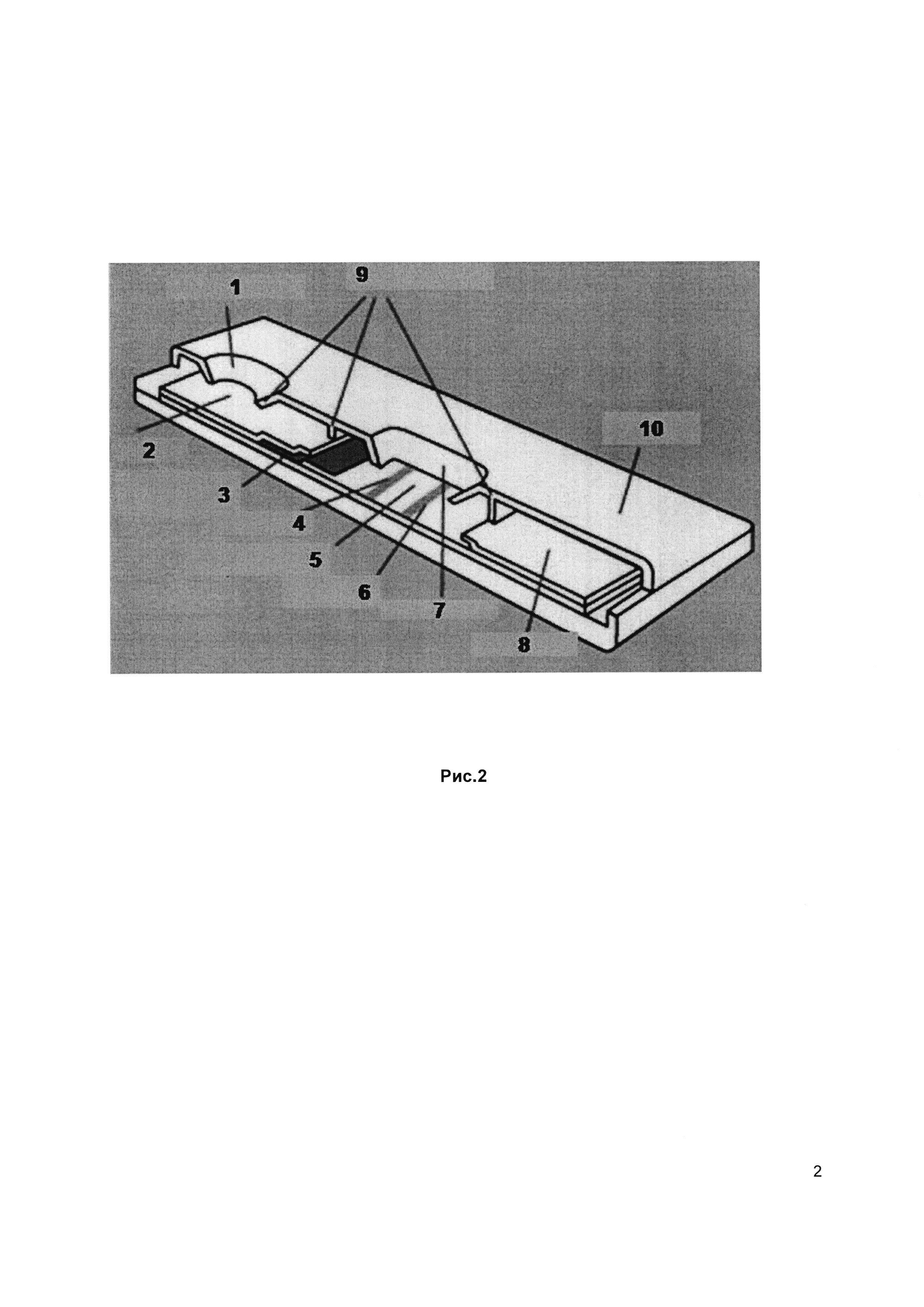
Рис. 2. Тест-карта для проведения полуколичественного определения КАР антител, основанного на методе иммунохроматографического анализа с использованием наночастиц. 1 - окно для нанесения образца биологической жидкости, 2 - двойной фильтр, один из которых содержит наночастицы с детектирующим реагентом (3), 4 - тест-полоса с нанесенным рекомбинантным вариантом GluR6/7 на нитроцеллюлозной мембране (5) с дополнительной контрольной полосой (6), 7 - окно результата, 8 - фильтр, на котором сорбируются излишки реакционных растворов. Тест-карта с прижимной линейкой (9) собрана в корпусе пластиковой кассеты (10).
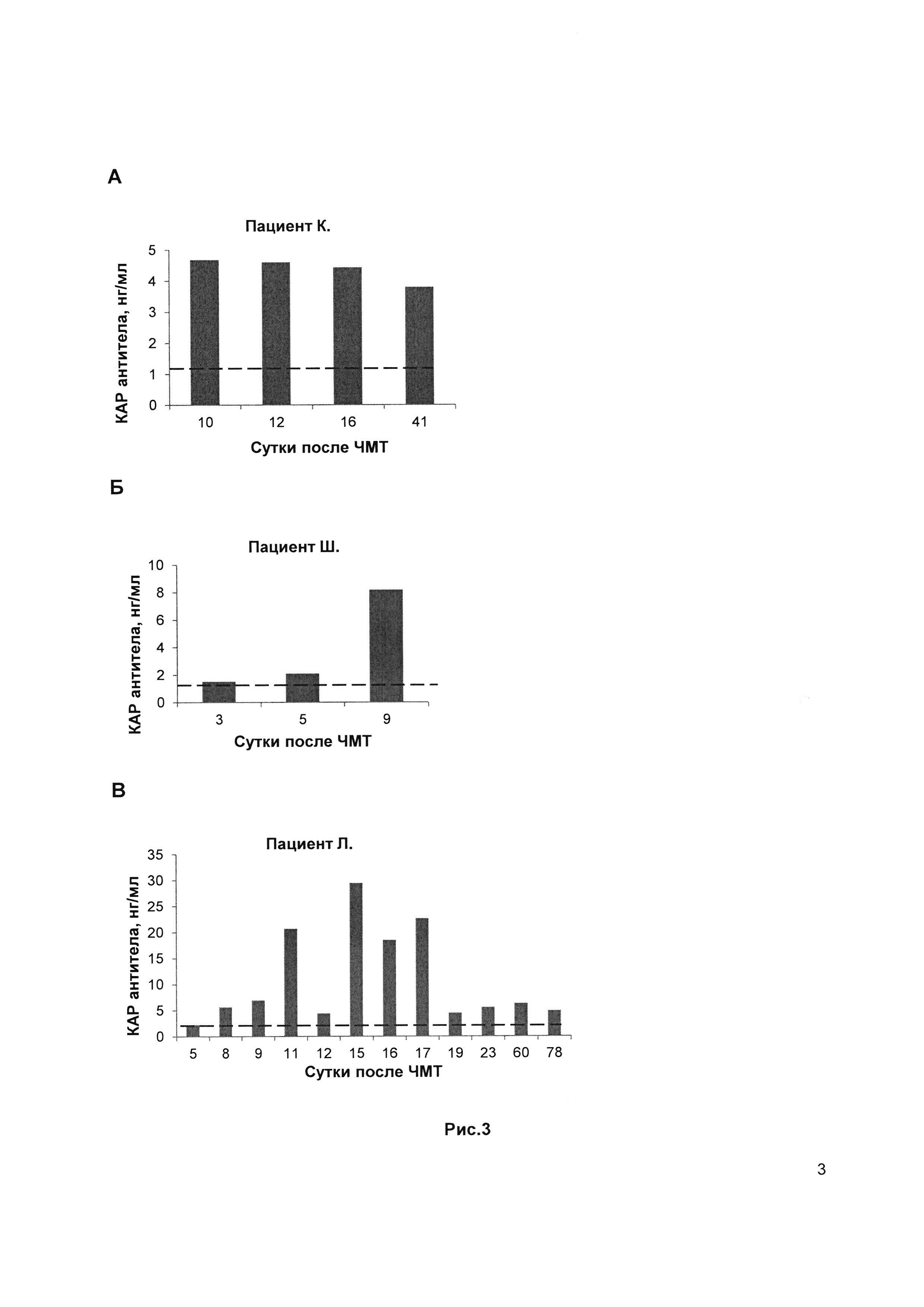
Рис. 3. Результаты динамического измерения КАР антител в сыворотке крови больных после ЧМТ и с разной длительностью комы (см. примеры). Красная линия указывает на пороговые значения КАР антител (1,5 нг/мл), определенных в сыворотке крови здоровых добровольцев.
Подробное раскрытие изобретения
КАР белки специфичны для центральной нервной системы; они участвуют в каскаде нейротоксичности при повреждении мозга с образованием вторичных вазогенных и/или цитотоксических отеков в подкорковых структурах головного мозга. При структурных нарушениях в глубинных отделах мозга происходит образование пептидных фрагментов КАР в биологических жидкостях, в том числе с образованием новых «инородных» аутоантигенов, что в дальнейшем приводит к выработке специфических антител к пептидным фрагментам КАР. При тЧМТ формирование цитотоксического отека и вторичной ишемизации в геморрагических очагах связано со значительным повышением КАР антител и является отсроченным нарушением мозгового кровообращения, которое приводит к ухудшению прогноза исхода комы. При помощи анализа биологических жидкостей лиц, у которых отсутствуют тЧМТ, можно определить пороговые значения уровня специфических антител к определенным пептидным фрагментам КАР. Постоянно повышенные концентрации КАР антител (т.е. выше заранее определенного порогового значения), сопровождающиеся негативными значениями системных показателей крови, позволяет прогнозировать риск неблагоприятного исхода развития болезни. Напротив, при постепенном понижении уровня специфических КАР антител по направлению к пороговым величинам появляется возможность прогнозирования благоприятного исхода (восстановления сознания).
Для определения антител могут быть использованы различные биологические образцы, взятые у пациентов, находящихся в бессознательном состоянии, такие как кровь, сыворотка или плазма крови, спинномозговая жидкость, слюна и др. Антитела предпочтительно определяются методом твердофазного иммуноферментного анализа (ИФА). Последний заключается в реакции анализируемой пробы с антигеном - рекомбинантным вариантом GluR6/7 каинатных рецепторов, иммобилизованным на твердом носителе, с последующей детекцией образовавшегося иммунного комплекса с помощью конъюгата антител против иммуноглобулинов класса G человека с соответствующим ферментом для детекции. Полуколичественное или количественное выявление повышения уровня специфических антител проводится по разности величин (значения оптической плотности, флуоресценции, люминесценции или изменения окраски) анализируемого образца с аналогичным показателем контрольных проб (с определением порогового значения), чтобы определить больных с поражением структур головного мозга, имеющих высокий или низкий потенциал восстановления. Данный способ отличается также тем, что наряду с определением КАР антител проводятся совместно динамические измерения системных показателей крови (лактат, креатин, рСО2, кетоны и рН) для назначения своевременной терапии у пациентов в травматической, метаболической или ишемической коме, у которых сохраняется потенциал к выживанию.
Принцип работы набора реагентов ИФА-КАР антител состоит в количественном или полуколичественном выявлении присутствующих в биологических жидкостях несвязанных в иммунный комплекс КАР антител к пептидным фрагментам каинатных рецепторов мозга человека. Сорбция определенно выбранного рекомбинантного варианта КАР (образованного из субъединиц GluR6 и/или 7) на поверхности твердого носителя позволяет избирательно извлекать КАР антитела из биологических жидкостей пациента (20-100 микролитров крови, сыворотки крови, спинномозговой жидкости, дыхательных паров, слюны). Образовавшийся комплекс антитело-антиген выявляется с помощью меченных ферментом вторых антител против иммуноглобулинов класса G человека. Иммуноферментная реакция измеряется по изменению оптической плотности (также флуоресценции или люминесценции), регистрируемой с помощью портативного аппарата вертикального сканирования оптической плотности (450/630 нм) или с помощью цветной камеры мобильного устройства (телефон, планшет и др.) и программного приложения. Цветная реакция также может быть измерена визуально (полуколичественный вариант) с помощью цветовой шкалы. Изменения концентрации КАР антител, и в том числе их значительное накопление в крови пациентов, служит критерием функционального состояния головного мозга этих пациентов.
Дополнительные методы обследования пациентов основаны на клинических методах, включающих определение тяжести состояния по Шкале Комы Глазго (http://klinrek.ru/calcs/glasgo.htm) и Питтсбургской шкале оценки состояния структур головного мозга (см. http://refdb.ru/look/2364618-p51.html). Лабораторные методы обследования заключаются в измерении системных показателей крови: лактата (норма 0,8-4,0 ммоль/ч*л); рСО2 (норма 32,5-47 мм рт.ст.) и рН (<7.3) - для определения степени газового ацидоза; креатина (норма 76,3-114,5 мкмоль/л в плазме) - для выявления почечной недостаточности; и кетонов (норма <0,6 ммоль/л) - для оценки метаболических нарушений (метаболическая кома); все вышеперечисленные параметры оценивают в совокупности. При поступлении больного также проводят магнитно-резонансную томографию с помощью ряда модальностей, включая Т1 и Т2-взвешенную, FLAIR для оценки поражений структур головного мозга, DWI для определения отека мозга, и SWI/SWAN для выявления мозгового кровоизлияния.
Нижеследующие примеры приведены в целях иллюстрирования способа согласно настоящему изобретению и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Примеры способов определения содержания антител к рекомбинантному варианту GluR6/7 каинатных рецепторов.
Приготовление анализируемых образцов сыворотки крови для количественного ИФА метода: анализируемые образцы сыворотки крови перед определением следует развести в соотношении 1:50; в стеклянные или пластиковые пробирки внести по 20 мкл сыворотки крови, добавить 980 мкл фосфатного буфера и тщательно перемешать содержимое вращательными движениями. Разведенные образцы сыворотки крови можно хранить при температуре +2-8°С не более 7 дней.
Проведение количественного ИФА анализа.
Количественное определение КАР антител в биологических жидкостях пациентов проводят методом иммуноферментного анализа наборами фирмы ООО «ДРД» (Улан-Удэ, РФ). Стандартные растворы, раствор конъюгата, меченного пероксидазой хрена, рабочий буфер и исследуемые пробы готовят согласно инструкции к набору. Все лунки планшета, покрытые рекомбинантным вариантом GluR6/7 каинатных рецепторов, однократно промывают буфером (200 мкл/лунку) с помощью ИФА автоматического промывного устройства для микропланшет. В соответствующие лунки вносят по 100 мкл стандартов или по 100 мкл подготовленных исследуемых проб и инкубируют 30 мин. при +37°С в инкубаторе-шейкере для микропланшет. По окончании инкубации промывают лунки планшета рабочим буфером трижды с помощью ИФА автоматического промывного устройства для микропланшет. Во все лунки вносят по 100 мкл раствора, содержащего коньюгат антител против IgG человека с ферментом (пероксидазой хрена), и инкубируют планшет при постоянном встряхивании на шейкере в течение 30 мин. при +37°С. После окончания инкубации промывают лунки планшета 3 раза рабочим буфером и последний раз дистиллированной водой так, как это указано выше; при каждом промывании лунок планшета необходимо инкубировать планшет на шейкере в течение 2 мин. при +37°С. Добавляют по 100 мкл раствора тетраметилбензидина (ТМБ) и инкубироуют до 10 мин. при комнатной температуре в темном месте. Вносят по 100 мкл стоп-раствора для остановки реакции, при этом голубая/синяя окраска должна измениться на желтую. Осторожно перемешивают до равномерной окраски в каждой лунке и измеряют оптическую плотность на фотометре вертикального сканирования при длине волны 450/630 нм. Используя калибровочную кривую зависимости концентрации антител от оптической плотности, приведенную в инструкции, определяют концентрации КАР антител в исследуемых образцах в нг/мл.
Проведение полуколичественного ИФА анализа.
Полуколичественное определение КАР антител проводится на тест-карте методом иммунохроматографического анализа (lateral flowtest) (Рис. 2) с использованием неразведенного свежеотобранного образца биологической жидкости пациента. Реакция активируется при добавлении одной капли образца (около 20 мкл), антитела из которого реагируют с GluR6/7 пептидом. Образовавшийся комплекс антиген-антитело выявляется с помощью визуализации конъюгатов антител против IgG человека с пероксидазой хрена на тестовой полосе в виде цветной полосы. Интенсивность и скорость проявления полосы соответствует концентрации антител в образце, определяемых по сравнению с окраской полос на референс-карте, прикладываемой к набору. При проявлении только контрольной полосы результат считается отрицательным.
Исследование корреляции уровня антител к фрагментам специфических КАР рецепторов (GluR6/7) и динамики восстановления пациентов, находящихся в бессознательном состоянии.
Пример 1
Пациент К. (женщина, 19 лет) с закрытой тяжелой ЧМТ [4 балла по Шкале комы Глазго (ШКГ)] госпитализирована в НИИ нейрохирургии на 8-й день после падения с высоты в коматозном состоянии из первичного стационара.
Диагноз: Закрытая ЧМТ. Диффузное аксональное повреждение мозга II степени, диффузный отек головного мозга. Заключение о неврологическом статусе при поступлении: кома 2. Стволовое поражение мозга преимущественно метаболического характера.
Больная 11 суток находилась в коме и 8 дней - в вегетативном состоянии, следовательно, длительность бессознательного состояния в целом составила 19 суток. Динамическое измерение антител к каинатным рецепторам в сыворотке крови в течение первых 7 дней (Рис. 3А) показало, что их уровень оставался средне-повышенным (4.7-4.4 нг/мл при пороговом значении 1,5 нг/мл). Стволовая симптоматика была невыраженной и больше соответствовала метаболической дисфункции, а не структурному поражению. По данным МРТ, выполненного в режимах Т1, Т2, FLAIR, SWAN также отсутствовали повреждения ствола и подкорковых структур мозга.
Неврологический статус через 1 мес.после тЧМТ: Ясное сознание (дисмнестический синдром). Преимущественно левосторонний тетрапарез с низким мышечным тонусом. Шкала исходов Глазго (ШИГ) через 6 мес.составила 5 баллов из 5-ти (хорошее восстановление).
К концу 1-го месяца значения антител к КАР (Рис. 3А) показали тенденцию к снижению к пороговым значениям (1,5 нг/мл), свидетельствуя о восстановлении функции ствола, что отмечено и при неврологической оценке.
Таким образом, у пациентки с отсутствием повреждения глубинных структур мозга выявлены средне-высокие значения КАР антител во время коматозного состояния, которые быстро нормализовались наряду с полным регрессом стволовой симптоматики и восстановлением сознания. В целом у пациентки отмечен хороший исход тЧМТ через 6 месяцев.
Пример 2
Пациент Ш. (мужчина, 44 года) с закрытой тяжелой ЧМТ (ШКГ=4) госпитализирован на 2 сутки после кататравмы в коматозном состоянии из первичного стационара. Диагноз: Острая закрытая тЧМТ. Тяжелый ушиб левой лобной доли с формированием внутримозговой гематомы, которая была удалена в день поступления. Отек головного мозга. Заключение о неврологическом статусе при поступлении: кома 2. Стволовая симптоматика с уровня среднего мозга, верхних и нижних отделов моста с двух сторон. По данным МРТ выявлено значительное ишемическое и геморрагическое повреждение ствола головного мозга и подкорковых структур.
Динамическое измерение антител к КАР в сыворотке крови показало, что уровень антител резко возрастал от порогового в первый день до 8,0 нг/мл к 7 дню (Рис. 3Б). На 9 сутки после тЧМТ выявлена отрицательная неврологическая динамика в виде снижения уровня сознания до комы 3 (ШКГ 3 балла), нарастания стволовой симптоматики с уровня среднего мозга, верхних и нижних отделов моста.
На 14-й день на фоне дальнейшего нарастания неврологической симптоматики зафиксирован летальный исход. Оценка по ШИГ составила 1 балл.
Таким образом, у пациента с выраженным структурным повреждением глубинных отделов мозга выявлено значимое нарастание титра антител к КАР, которое сопровождалось усугублением стволовой дислокационной неврологической симптоматики. Исход заболевания - смерть на 14 сутки после травмы.
Пример 3
Пациент Л. (мужчина, 39 лет) с тяжелой ЧМТ госпитализирован на 3 день после ДТП (мотоциклетная травма) в коматозном состоянии (ШКГ=3). Диагноз: Острая сочетанная тЧМТ, ушиб головного мозга тяжелой степени с формированием контузионных очагов 3 типа в обеих лобных и правой височной и теменных долях, стволе головного мозга. Диффузное аксональное повреждение 4 степени. Массивное субарахноидальное кровоизлияние удалено в день госпитализации, проведена пластика костных дефектов лобных областей с 2-х сторон. Заключение о неврологическом статусе при поступлении: кома 3, грубая стволовая симптоматика с уровня среднего мозга, менее выраженная в верхних и нижних отделах моста, продолговатого мозга.
По данным КТ головного мозга выявлены очаги кровоизлияния в фронтальных, медиальных отделах мозга и субарахноидальном пространстве. Динамическое измерение антител к каинатным рецепторам в сыворотке крови показало, что уровень антител оставался на уровне порогового в первые три дня, на 8, а также с 14-17 дни госпитализации (Рис. 3В). Однако эти значения чередовались с особо высокими уровнями КАР антител на 7, 10-12 дни (18-28 нг/мл), указывая на ухудшение процессов в структурах ствола мозга и нестабильность состояния пациента. К концу 2-го месяца госпитализации больной вышел из комы и пребывал более 90 дней в вегетативном состоянии, таким образом длительность бессознательного состояния в целом составила более 120 дней. Выписан из клиники в вегетативном состоянии, ШИГ - 2 балла.
Таким образом, у пациента с выраженным структурным повреждением глубинных отделов мозга, длительной комой и вегетативным состоянием также выявлено выраженное нарастание титра антител к КАР. Исход заболевания хроническое бессознательное состояние.
Пример 4.
Характеристика работы набора реагентов.
Результаты тестирования 143-х образцов крови у 25 пациентов в бессознательном состоянии (посттравматической и метаболической коме), а также 47 контролей показали, что концентрация КАР антител, определенная с помощью количественного ИФА теста, варьировалась в широком диапазоне от <0,6 до 60 нг/мл. Значения КАР антител распределялись следующим образом: 89 из 90 образцов сыворотки крови, включающих контроли и благоприятный исход, показали концентрацию КАР антител ≤1,5нг/мл. Из 53 образцов сыворотки крови у лиц в бессознательном состоянии и с неблагоприятным исходом, в 51 образце были обнаружены КАР антитела в пределах от 1,6 до 60 нг/мл. Определение основных характеристик тестов для диагностики выхода из комы [заболевание/тест позитивный (True Positive)=51, заболевание/тест негативный (False Negative)=2, без заболевания/тест позитивный (False Positive)=1, без заболевания/тест негативный (True Negative)=89] показали предварительные чувствительность 96% и специфичность 98% с уровнем определения позитивного коэффициента достоверности (Positive Likelihood Ratio) 86,6.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.